Агрохимия, 2020, № 1, стр. 9-17
СОРБЦИЯ ГУМИНОВЫХ ВЕЩЕСТВ ЧЕРНООЛЬХОВОГО НИЗИННОГО ТОРФА НА МОНТМОРИЛЛОНИТСОДЕРЖАЩИХ ГЛИНАХ
В. Т. Каримова 1, Е. Д. Дмитриева 1, *, К. В. Сюндюкова 1
1 Тульский государственный университет
300012 Тула, просп. Ленина, 92, Россия
* E-mail: dmitrieva_ed@rambler.ru
Поступила в редакцию 29.07.2017
После доработки 25.03.2019
Принята к публикации 10.10.2019
Аннотация
Выявлена зависимость связывания гуминовых веществ и гиматомелановых кислот с различными формами глинистых минералов на основе монтмориллонита от величины рН среды и начальной концентрации гуминовых веществ. Методом Левенберга–Марквардта, инкорпорированного в систему компьютерной программы Mathcad 15.0, рассчитаны параметры сорбции гуминовых веществ на глинистых минералах и установлено, что максимальная сорбция гуминовых веществ на алюминиевой форме монтмориллонитсодержащей глин при рН 6.5 связана с увеличением его удельной поверхности и адсорбционной емкости, за счет образования слоисто-столбчатой структуры и щелевидных микропор.
ВВЕДЕНИЕ
Гуминовые вещества (ГВ) и глинистые минералы являются важнейшими компонентами почв [1]. Взаимодействие гуминовых веществ почвы с глинистыми минералами является сложным процессом, который зависит от свойств адсорбента – глинистого минерала, свойств адсорбата – гуминового вещества и в значительной степени от условий среды (рН, содержания гуминовых веществ, химического состава почв и др.) [2–5].
Образование комплексных органо-минеральных соединений, состоящих из гуминовых веществ и глинистых минералов, происходит при различных типах взаимодействия гуминовых веществ с компонентами минеральной части почвы [6]. Сорбция гуминовых веществ минеральными соединениями твердой фазы почвы проходит с участием ионного обмена, специфической адсорбции и хемосорбции [4, 5, 7].
Процесс образования гуминовых веществ и их консервации в виде органо-минеральных соединений играет ключевую роль в глобальном цикле углерода и формировании почв [8]. Общепринято считать, что сначала происходит синтез ГВ, а затем их взаимодействие с минеральной частью почв. В результате адсорбционного взаимодействия образуются адсорбционные комплексы, представляющие собой пленки гуминовых веществ на поверхности почвенных минералов [9, 10]. Согласно теории сорбционной консервации, в реакциях органо-минерального взаимодействия участвуют растворенные органические соединения. Таким образом, очевидно, что в природных условиях в реакциях адсорбционного взаимодействия могут участвовать лишь фульвокислоты либо низкомолекулярные фракции гуминовых веществ (гиматомелановые кислоты), тогда как взаимодействию высокомолекулярных компонентов гумуса с почвенными минералами должна препятствовать их низкая растворимость [4, 11, 12].
На активных центрах поверхности минеральной матрицы вначале сорбируются гиматомелановые кислоты (ГМК), а затем на образовавшемся монослое из органических молекул ГМК – высокомолекулярные молекулы гуминовых веществ, при этом возможен процесс вторичной сорбции, при которой происходит дополнительная полимеризация ГВ на поверхности глинистого минерала за счет межмолекулярных взаимодействий, приводящих к увеличению степени покрытия поверхности минерала [13–15]. В результате остается неясным процесс образования высокомолекулярных адсорбционных комплексов, которые являются основной формой нахождения ГВ в минеральных горизонтах почв.
Потому моделирование сорбционных процессов гуминовых веществ на различных формах глинистых минералов является актуальным для понимания процесса гумификации в реальных почвенных системах.
Цель работы – определить сорбцию гуминовых веществ черноольхового низинного торфа на природной и алюминиевой формах монтмориллонитсодержащих глин в зависимости от рН среды.
МЕТОДИКА ИССЛЕДОВАНИЯ
Объектами исследования являлись гуминовые вещества, выделенные по стандартной методике [16–18] из черноольхового низинного торфа, гиматомелановые кислоты, полученные горячей этанольной экстракцией из гуминовых веществ черноольхового низинного торфа (ГВ (ЧНТ)) [18]. Коммерческий образец монтмориллонитсодержащей глины (ММТ) BentoGroupMinerals, изготовленный по ТУ 14-9-364-89, содержит 75–85% монтмориллонита, имеет сорбционную способность 500–700%, набухаемость 15–22 раз и концентрацию обменных катионов 68–93 мг-экв/100 г [19, 20]. Алюминиевая форма монтмориллонитсодержащей глины с содержанием 20 моль Аl3+/кг глины получена по методике, предложенной Kumar et al. [21]. Интерколирование катионов алюминия в структуру монтмориллонита приводит к увеличению заряда, удельной поверхности монтмориллонита и адсорбционной емкости за счет образования слоисто-столбчатой структуры и щелевидных микропор [21].
Концентрацию гуминовых веществ в растворе определяли фотометрическим методом на приборе СФ-104 при длине волны 350 нм, по предварительно построенной градуировочной зависимости D = f(CГВ). Для этого готовили серию растворов с концентрацией ГВ от 10 до 300 мг/л в растворе фонового электролита (0.1 М NaNО3) [4]. Контрольным образцом являлся раствор 0.1 М NaNО3.
Для изучения в модельных системах процесса поглощения гуминовых веществ монтмориллонитсодержащими глинами проводили ряд экспериментов, варьируя последовательно параметры рН среды и концентрации гуминовых веществ в растворе.
Для выявления влияния рН среды на сорбцию гуминовых веществ глинистыми минералами в ряд сосудов с плотно закрывающимися крышками вносили по 0.5 г глинистого минерала, 5 мл раствора ГВ с концентрацией 1 г/л и от 0 до 0.6 мл 0.1 М раствора азотной кислоты. Общий объем доводили до 20 мл раствором фонового электролита (0.1 М NaNО3). Растворы встряхивали в течение 24 ч, после чего центрифугировали в течение 30 мин при 3 тыс. об./мин [4]. Измеряли рН на рН-метре Анион 4154 и концентрацию оставшихся в растворе гуминовых веществ. Рассчитывали долю (%) оставшихся в растворе гуминовых веществ по формуле (1) и строили зависимость количества оставшихся в растворе ГВ от величины рН среды:
где Q – доля ГВ в растворе, %; С – концентрация ГВ оставшихся в растворе, мг/л; С0 – начальная концентрация ГВ, мг/л.Влияние рН среды изучали в области величин 3.0–8.0 ед. рН при фиксированных начальных концентрациях ГВ в растворе 50, 150 и 300 мг/л и содержанием глинистого минерала 10 г/л. Для этого в колбы объемом 20 мл вносили по 0.2 г монтмориллонита, различные объемы ГВ (1, 3 и 6 мл) и доводили рН среды 3.0, 4.0, 5.0, 6.0, 7.0, 8.0 добавлением 0.05 М НNO3 или 0.05 М NaOH и добавлением раствора фонового электролита (0.1 М NaNO3). После чего колбы встряхивали 24 ч и центрифугировали 30 мин при 3 тыс. об./мин [4]. Концентрацию оставшихся гуминовых веществ в растворе определяли фотометрическим методом. Сорбцию ГВ рассчитывали по формуле (2)
где Г – сорбция ГВ, мг/г, С – концентрация ГВ оставшейся в растворе, мг/л, С0 – начальная концентрация ГВ, мг/л, V – объем раствора, л, m – масса монтмориллонита, г.Сорбцию гуминовых веществ на формах монтмориллонитсодержащих глин изучали в режиме изотерм при фиксированных величинах рН 3.5, 6.5 и 9.5 и начальных концентрациях ГВ 10, 50, 100, 150, 200, 250, 300, 350 мг/л. Для этого в колбы добавляли 0.2 г исходного монтмориллонита или алюминиевой формы монтмориллонита (Al-ММТ), различные объемы ГВ (0.25, 1, 2, 3, 4, 5, 6, 7 мл соответственно), добавлением 0.05 М НNО3 или 0.05 М NaOH доводили растворы до нужной величины рН и доводили объем до 20 мл раствором 0.1 М NaNО3. Растворы встряхивали в течение 24 ч, после чего центрифугировали в течение 30 мин при 3 тыс. об./мин [4]. Концентрацию оставшихся гуминовых веществ в растворе определяли фотометрическим методом. Сорбцию гуминовых веществ рассчитывали по формуле (2).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Взаимодействие ГВ с почвенными минералами включает следующие типы взаимодействий: катионный обмен, протонирование, лигандный обмен, связывание посредством воды, катионных мостиков, водородных связей, сил Ван-дер-Ваальса (рис. 1) [4, 5, 10, 11, 22].
Рис. 1.
Взаимодействие гуминовых веществ с глинистыми минералами: 1 – водородные связи; 2 – лигандный обмен: (а) – протонированной гидроксильной группой минерала, (б) – непротонированной гидроксильной группой минерала; 3 – ионная связь; 4 – катионные мостики.
Межмолекулярные силы действуют практически между любыми молекулами, однако образующиеся соединения непрочны. Силы Ван-дер-Ваальса особо важны при высокой ионной силе или низком рН, когда подавлена ионизация кислых групп гуминовых веществ [4, 5, 11].
Огромную роль в образовании комплекса гуминовое вещество–минерал играют водородные связи, возникающие между азот- и кислородсодержащими группами гуминовых веществ и кислородными атомами или гидроксильными группами поверхности монтмориллонита. Так как поверхность глинистых минералов гидратирована, водородная связь с органическим веществом может осуществляться и посредством адсорбированных минералом молекул воды [4, 5, 11, 13, 15].
Притяжение между противоположно заряженными функциональными группами гуминовых веществ и поверхностными группами глинистых минералов осуществляется за счет электростатических сил [4, 5, 11, 13]. Ионная связь возникает в результате катионного обмена между положительно заряженными группами ГВ и обменными катионами минералов. Реакция такого типа имеет значение в кислой среде [4, 5, 10, 11, 22, 23]. Вначале изучали зависимость между долей гуминовых веществ в растворе и величиной рН при начальной концентрации гуминовых веществ 250 мг/л (рис. 2).
Рис. 2.
Доля гуминовых веществ (ЧНТ) в растворе в зависимости от величины рН среды: (а) – гуминовое вещество (ГВ), (б) – гиматомелановые кислоты (ГМК). То же на рис. 3–5.
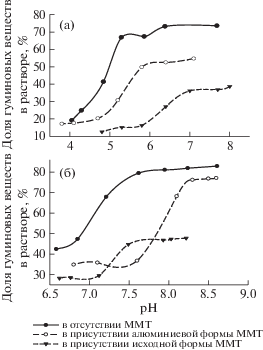
В отсутствии монтмориллонита происходило плавное понижение растворимости ГВ в диапазоне pH от 6.5 до 5.0, ГМК – от 8.5 до 7.5, что связано со структурно-групповым составом макромолекул, а также с их конформационными изменениями, зависящими от рН среды [23]. Последующее снижение pH резко снижало растворимость гуминовых веществ. Повышение концентраций ионов водорода вызывало протонирование карбоксильных групп ГВ и гиматомелановых кислот (ГМК), приводящее к осаждению макромолекул ГВ при рН 4.0 ± 1.0, ГМК – при рН 6.0 ± 0.5. В диапазонах pH 8.0 ± 1.0 до 3.0 ± 1.0 происходят постепенные пространственные и конформационные изменения макромолекул гуминовых веществ “вытянутый стержень–клубок–глобула” [23].
В присутствии исходной и алюминиевой формы монтмориллонита наблюдали уменьшение концентрации ГВ и ГМК в растворе, что связано с их адсорбцией на минерале [4, 5, 15]. Из-за увеличения доли положительного заряда на поверхности монтмориллонита за счет внедрения в его структуру полигидроксокатиона алюминия [21, 24] доля оставшихся в растворе ГВ и ГМК в присутствии алюминиевой формы ММТ была больше по сравнению с исходной формой ММТ (рис. 2б). Сорбция ГМК проходила на формах монтмориллонита в щелочной среде и при минимальном разбросе величин рН. Резкое снижение доли ГМК в растворе в присутствии исходной формы монтмориллонита при рН 7.5 и 8.0 для алюминиевой формы ММТ свидетельствовало об увеличении сорбции гиматомелановых кислот при наличии сорбентов. Причем из-за обогащения ГМК фенольными группами [25] происходил сдвиг рН сорбционного равновесия в щелочную область в системах, содержащих формы монтмориллонита.
Эксперимент показал, сорбция ГВ на глинистых минералах увеличивалась с уменьшением рН. Увеличение сорбции ГВ на исходной форме монтмориллонита наблюдали при рН 6.5, на Аl-ММТ – при рН 5.0, при этом резко снижалась доля ГВ, оставшихся в растворе. Максимальная сорбция ГВ соответствовала их минимальной доле в растворе: при рН 6.0 на исходной форме ММТ и рН 4.5 – на Аl-ММТ (рис. 2а). При низких величинах рН высокая концентрация ионов водорода нейтрализовала отрицательный заряд поверхности обоих веществ, при этом гуминовые вещества и монтмориллонит приближались друг к другу достаточно близко, что приводило к увеличению роли сил Ван-дер-Ваальса и образованию слабых комплексов [4, 5, 25].
Увеличение сорбции ГВ на глинистых минералах с уменьшением величины рН характерно для лигандного обмена [4, 5, 11]. В данном случае, с одной стороны, поверхность глинистого минерала и гуминовые вещества теряли ионы водорода с ростом рН и становились отрицательно заряженными, что вызывало отталкивающие взаимодействия [4, 5, 11, 15]. С другой стороны, из-за того, что и монтмориллонит, и ГВ при низких рН находились в протонированной форме [4, 5], их функциональные карбоксильные и фенольные группы могли взаимодействовать между собой с образованием водородных связей.
В процессе установления равновесия происходило повышение величин рН равновесных растворов, во всех образцах наблюдали смещение в щелочную область. Сорбция гуминовых веществ снижала положительный заряд диффузионного слоя [4, 5].
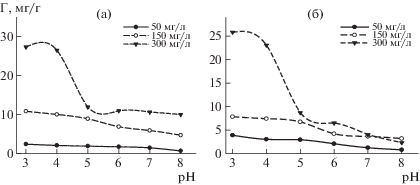
Исследовали влияние начальной концентрации гуминовых веществ на характер зависимости сорбции ГВ и ГМК от величины рН (рис. 3). При концентрации 50 и 150 мг/л происходило плавное поглощение ГВ, что было связано с неполным заполнением сорбционных центров ММТ молекулами гуминовых веществ; увеличение концентрации ГВ в растворе до 300 мг/л выявило S-образный характер изотерм. S-форма изотермы характеризуется малым наклоном кривой в области малых концентраций [4, 5, 11]. С ростом концентрации гуминовых веществ в растворе происходил сдвиг сорбционного равновесия в сторону более низких величин рН [4], так максимальная сорбция ГВ на исходном монтмориллоните отмечена при рН = 4.0. Сорбция ГВ и ГМК на монтмориллоните будет зависеть от структуры гуминовых веществ и формы их существования в растворе. При концентрации 300 мг/л, которая ниже критической концентрации мицеллообразования [26], ГВ в растворе представляют собой как линейные молекулы полимеров, так и псевдомицеллы [23], поэтому молекулы ГВ способны сорбироваться не только на поверхности минерала, но и проникать в поры монтмориллонита [27].
В кислой области происходил катионный обмен между положительно заряженными группами ГВ и обменными катионами ММТ с образованием ионной связи. При pH 5.0 и выше интенсивное поглощение гуминовых веществ монтмориллонитом прекращалось из-за изменения их характера взаимодействия с глинистым минералом, а именно связь осуществлялась за счет электростатических сил или слабых Ван-дер-Ваальсовых взаимодействий.
При низких величинах рН поглощение гуминовых веществ глинистым минералом достигало максимума и составило 26 ± 1%. По мере увеличения рН сорбция гуминовых веществ снижалась, поскольку уменьшалось число протонированных групп как в составе гуминовых веществ, так и в глинистом минерале [4, 5].
Зависимость сорбции гуминовых веществ в режиме изотерм изучали, варьируя концентрацию гуминовых веществ при фиксированных величинах рН 3.5, 6.5 и 9.5 (рис. 4) и рассчитывали параметры изотерм адсорбции Ленгмюра (табл. 1).
Рис. 4.
Изотермы сорбции ГВ и ГМК на различных формах монтмориллонита: (а) – рН 3.5, (б) – рН 6.5, (в) – рН 9.5.

Таблица 1.
Параметры адсорбции Ленгмюра гуминовых веществ и гиматомелановых кислот на формах монтмориллонита (R = 0.96–0.99)
| Изотерма Ленгмюра, Г∞, мг/г | ||||||
|---|---|---|---|---|---|---|
| Гуминовые вещества | Гиматомелановые кислоты | |||||
| pH | 3.5 | 6.5 | 9.5 | 3.5 | 6.5 | 9.5 |
| Исходная форма ММТ | 0.3 ± 0.1 | 9.0 ± 0.2 | 11.8 ± 0.1 | 0.8 ± 0.2 | 0.7 ± 0.1 | 0.4 ± 0.1 |
| Алюминиевая форма ММТ | 60 ± 2 | 97 ± 3 | 58 ± 1 | 54 ± 1 | 71 ± 2 | 58 ± 1 |
Вид кривых изотерм сорбции ГВ на различных формах монтмориллонита представляет собой сложную природу взаимодействия. Изотермы сорбции ГВ на исходной форме монтмориллонита близки к S-типу по Джайлсу. Данный тип изотерм характеризует увеличение адсорбционных мест с ростом концентрации ГВ в растворе. Для алюминиевой формы монтмориллонита характерны изотермы сорбции ГВ, близкие к L-типу, что характеризует высокое сродство поверхности к сорбируемому веществу при его низких концентрациях [4, 5, 11].
Показано, что сорбция ГВ на исходном монтмориллоните значительно увеличивалась при рН 6.5 (об этом трудно говорить при такой форме изотерм). Концентрация оставшихся в растворе ГВ при рН 3.5 и 9.5 была больше, чем концентрация ГВ при рН 6.5 ([СГВ] = 130 мг/л), при этом максимальная сорбция гуминовых веществ на исходной форме монтмориллонита составляла 22 мг/г. Такая же зависимость отмечена для изотерм сорбции ГВ на алюминиевой форме монтмориллонитсодержащей глины. Однако за счет введения в структуру исходной монтмориллонитсодержащей глины катионов алюминия происходило увеличение общей обменной емкости и как следствие увеличение сорбции ГВ на данной форме при рН 6.5 на 10% ([СГВ] = 25 мг/г) (рис. 4б).
Изотермы сорбции ГМК на формах монтмориллонита при рН 3.5 и 9.5 близки к L-типу, при рН 6.5 на исходной форме монтмориллонита – к S-типу изотерм адсорбции Джайлса [4, 5, 11]. Наибольшая величина сорбируемости ГМК на алюминиевой форме монтмориллонита отмечена при рН 6.5 и составляла соответственно 23 мг/г.
Изотерма сорбции ГВ, ГМК на алюминиевой форме монтмориллонита описывается изотермой, близкой к L-типу, что означало высокое сродство поверхности к сорбируемому веществу при его низких концентрациях [4, 5, 11]. По мере увеличения концентрации адсорбата количество свободных мест на поверхности уменьшалось, и изотерма выходила на плато, соответствующее заполнению монослоем адсорбированных молекул. Модифицирование монтмориллонита полигидроксокомплексами алюминия увеличивало удельную поверхность монтмориллонита вследствие образования слоисто-столбчатой структуры с наличием щелевидных микропор, что приводило к увеличению их адсорбционной емкости [4, 5, 25]. При сорбции ГВ на природных и модифицированных формах монтмориллонита происходило проникновение гуминовых веществ или отдельных их частей в межпакетное пространство глинистых минералов, а также была возможна сорбция высокомолекулярных гуминовых веществ на их уже сорбированных низкомолекулярных фракциях.
Данные табл. 1 свидетельствуют, что наибольшей сорбционной способностью по отношению к ГВ и ГМК обладала алюминиевая форма монтмориллонита при рН 6.5, что связано с увеличением межпакетного расстояния при модификации природного ММТ, а также за счет более полного прохождения ионного обмена при уменьшении рН [4, 5, 10, 11, 13, 28].
Полученные результаты являются экспериментальным доказательством того, что процесс сорбции и гумификации в целом в почвенных системах начинается с низкомолекулярных фракций, одной из которых могут быть ГМК [3, 11, 12, 29]. Как было установлено ранее [29], ГМК (ЧНТ) представляют собой монодисперсную фракцию гуминовых веществ с молекулярной массой 42 кДа, тогда как ГВ (ЧНТ) полидисперсны и в своем составе имеют 4 фракции с молекулярными массами от 3 до 56 кДа [30]. ГМК и низкомолекулярные фракции способны сорбироваться как на поверхности минерала, так и на его ребрах, образуя монослой, а также способны проникать в межпакетное пространство глин [28, 29]. Гуминовые вещества, как полидисперсные органические полимеры, не образуют сплошной пленки, а сорбируются только на активных центрах поверхности – центрах адсорбции за счет постадийной адсорбции отдельных собственных фракций, которые, между собой соединяясь водородными и ионными связями, могут образовывать полислой. Из-за значительных размеров ГВ существенное влияние на их связь с минеральными компонентами почв оказывают конформационные изменения при изменении рН среды.
Максимальная адсорбция по Ленгмюру может быть использована для оценки мономолекулярного покрытия твердой поверхности полимером. Однако образование монослоя не обязательно подразумевает насыщение поверхностных гидроксилов [4, 5].
Хотя эмпирические модели часто отлично описывают адсорбцию, они являются просто численными отношениями, используемыми для описания экспериментальных данных. Использование этих моделей для предсказания адсорбции при изменяющихся концентрациях, ионной силе и рН раствора невозможно.
Поэтому рассчитывали параметры сорбции (табл. 2) для представленных изотерм ГВ (рис. 4) по объединенному уравнению (3), приведенному в литературе [4], которое учитывает влияние рН раствора и функциональный состав гуминовых веществ. Методом Левенберга–Марквардта, инкорпорированного в систему компьютерной программы Mathcad 15.0, были построены трехмерные изотермы связывания ГВ c формами монтмориллонитсодержащих глин (рис. 5). Данное программное обеспечение позволяет быстро и точно рассчитать сорбцию гуминовых веществ [4, 5].
где Г – величина сорбции, мг/г; С – равновесная концентрация в растворе, мг/л; χ, β – эмпирические параметры (χ = 0.5, β = 1.0); K – кажущаяся константа сорбции; Г∞ – величина предельной сорбции, мг/г.Таблица 2.
Параметры сорбции гуминовых веществ по объединенному уравнению на формах монтмориллонита (R = 0.97–0.99)
| Изотерма Ленгмюра, Г∞, мг/г | ||||||
|---|---|---|---|---|---|---|
| Гуминовые вещества | Гиматомелановые кислоты | |||||
| pH | 3.5 | 6.5 | 9.5 | 3.5 | 6.5 | 9.5 |
| Исходная форма ММТ | 0.2 ± 0.1 | 0.6 ± 0.1 | 0.4 ± 0.1 | 0.2 ± 0.1 | 0.5 ± 0.2 | 0.4 ± 0.1 |
| Алюминиевая форма ММТ | 0.7 ± 0.2 | 1.9 ± 0.1 | 0.9 ± 0.1 | 0.4 ± 0.1 | 0.7 ± 0.1 | 0.5 ± 0.2 |
Вид 3D-изотерм сорбции ГВ и ГМК на формах монтмориллонита имеет схожий вид и S-образный характер. Знак минус параметра χ обусловлен тем, что сорбция происходила по анионному механизму, то есть возрастала с понижением величины рН [4, 5].
По объединенному уравнению наибольшей сорбционной способностью по отношению к ГВ и ГМК также обладала алюминиевая форма монтмориллонита при рН 6.5. При низких рН высокая концентрация протонов нейтрализовала отрицательный заряд поверхности обоих материалов, что приводило к увеличению сил Ван-дер-Ваальса между гуминовыми веществами и поверхностью минерала [4, 5, 11].
Показатель максимальной сорбции для ГВ был больше, чем для ГМК, что связано с высоким содержанием карбоксильных групп в структуре ГМК. При высоких величинах рН электростатическое отталкивание между соседними ионизированными группами (т.е. карбоксильными группами) было максимальным, что приводило к увеличению кажущегося размера молекул [4], вследствие чего ГМК не могли сорбироваться в межпакетном пространстве модифицированного ММТ. Также большая молекулярная масса и меньший заряд молекулы ГВ приводили к максимальной сорбционной емкости модифицированного монтмориллонита по отношению к гуминовым веществам [4, 5, 29].
ВЫВОДЫ
1. Выявлена зависимость связывания ГВ и ГМК с различными формами глинистых минералов на основе монтмориллонита (ММТ) от рН среды. Доказано, что из-за обогащения ГМК фенольными группами происходил сдвиг рН сорбционного равновесия в щелочную область на исходной и алюминиевой форме монтмориллонита.
2. Получены изотермы сорбции гуминовых веществ и их фракций при фиксированных величинах рН среды: 3.5, 6.5, 9.5 ед. рН, рассчитаны параметры сорбции по уравнению Ленгмюра. Установлено, что сорбция ГВ и ГМК на глинистых минералах увеличивалась с уменьшением рН: наибольшей была сорбированность ГВ при рН 6.5 на алюминиевой форме монтмориллонита, что связано с увеличением межпакетного пространства, причем с увеличением начальной концентрации ГВ увеличивалась их сорбция. Расчет параметров сорбции методом Левенберга–Марквардта, инкорпорированного в систему компьютерной программы Mathcad 15.0, подтвердил влияние модификации глинистого минерала полигидроксокомплексами алюминия: алюминиевая форма монтмориллонита обладала увеличенной удельной поверхностью и адсорбционной емкостью за счет образования слоисто-столбчатой структуры и щелевидных микропор в его составе. Наибольшая была сорбция ГВ на алюминиевой форме монтмориллонита при рН 6.5. Рассчитанные значения сорбируемости соответствовали ручным подсчетам по стандартным уравнениям.
Список литературы
Чуков С.Н. Гуминовые вещества: результаты и перспективы исследования // Тез. докл. III Всерос. конф. “Гуминовые вещества в биосфере” СПб., 2005. С. 159–160.
Мартынова Н.А. Химия почв: органическое вещество почв. 2011. 256 с.
Зубкова Т.А., Карпачевский Л.О. Матричная организация почв. М.: РУСАКИ, 2001. 296 с.
Каюгин А.А. Распределение кадмия в модельных системах, содержащих каолинит и гуминовые кислоты: Дис. … канд. хим. наук, Тюмень, 2009. 151 с.
Заварзина А.Г. Взаимодействие гуминовых кислот различного происхождения с ионами металлов и минеральными компонентами почв: Дис. … канд. биол. наук, М., 2000. 133 с.
Орлов Д.С., Садовникова Л.K., Суханова Н.И. Химия почв М.: Высш. шк., 2005. 558 с.
Карпюк Л.А., Перминова И.В., Пономаренко С.А., Музафаров А.М. Синтез алкоксисилильных производных гуминовых веществ и их иммобилизация на минеральных поверхностях // XVIII Менделеевский съезд по общ. и прикл. химии, М., 2007. С. 2608.
Перминова И.В., Жилин Д.М. Гуминовые вещества в контексте зеленой химии // Зеленая химия в России / Под. ред. Лунина В.В. Сб. научн. ст. М.: Изд-во МГУ, 2004. С. 146–162.
Дину М.И. Влияние функциональных особенностей гумусовых веществ на процессы комплексообразования с ионами металлов (модельные эксперименты и расчеты): Автореф. дис. … канд. хим. наук. М., 2011. 23 с.
Пинский Д.Л. Ионообменные процессы в почвах. Пущино: Ин-т почвоведения и фотосинтеза, 1997. 166 с.
Соколова Т.А., Трофимов С.Я. Сорбционные свойства почв. Адсорбция. Катионный обмен // Тула: Гриф и К, 2009. 174 с.
Каюгин А.А. Закономерности адсорбции низкомолекулярных аналогов гуминовых кислот природным каолинитом // Вестн. Тюмен. Гос. ун-та. Экол. и природопользование. 2015. Т. 1. №. 2. С. 84–91.
Березюк В.Г. Изучение сорбционных свойств природных алюмосиликатов: Дис. … д-ра хим. наук. Екатеринбург, 1993. 265 с.
Данченко Н.Н. Функциональный состав гумусовых кислот: определение и взаимосвязь с реакционной способностью: Дис. … канд. хим. наук. М., 1997. 146 с.
Feng X., Simpson A.J., Simpson M.J. Chemical and mineralogical controls on humic acid sorption to clay mineral surfaces // Org. Geochem. 2005. V. 36. № 11. P. 1553–1566.
Акатова Е.В., Дмитриева Е.Д., Сюндюкова К.В., Леонтьева М.М., Музафаров Е.Н. Детоксицирующая способность гуминовых веществ торфов различного происхождения по отношению к ионам тяжелых металлов // Химия растит. сырья. 2016. №. 1. С. 119–127.
Дмитриева Е.Д., Горячева А.А., Переломов Л.В., Сюндюкова К.В., Леонтьева М.М. Сорбционная способность гуминовых веществ торфов различного происхождения Тульской области по отношению к ионам Pb(II) // Изв. ТулГУ. Естеств. науки. Вып. 4. Тула: Изд-во ТулГУ, 2015. С. 205–219.
Дмитриева Е.Д., Глебов Н.Н., Леонтьева М.М., Сюндюкова К.В. Связывающая способность гуминовых веществ торфов и гиматомелановых кислот по отношению к полиароматическим углеводородам (на примере нафталина) // Вестн. Томск. гос. ун-та. Химия. 2017. №. 7. С. 8–23.
Дмитриева Е.Д., Горячева А.А., Сюндюкова К.В., Музафаров Е.Н. Сорбционная способность природного и модифицированного монтмориллонита по отношению к ионам меди в присутствии органических кислот // Сорбц. и хроматограф. процессы. 2016. Т. 16. № 6. С. 813–820.
Глины формовочные огнеупорные. Метод определения концентрации обменных катионов натрия и калия: ГОСТ 3594.3-93. Введ. 01.01.1995. Минск: Изд-во стандартов, 1993. С. 7.
Kumar P., Jasta R.V., Bhat G.T. Effect of OH/A1 ratio of pillaring solution on the texture and surface acidity of aluminium pillared clays // Indian J. Chem. 1997. V. 36A. P. 667–672.
Murphy E.M., Zachara J.M., Smith S.C., Phillips J.L., Wietsma T.W. Interaction of hydrophobic organic compounds with mineral-bound humic substances // Environ. Sci. Technol. 1994. V. 28. P. 1291–1299.
de Melo B.A.G., Motta F.L., Santana M.H.A. Humic acids: Structural properties and multiple functionalities for novel technological developments // Mater. Sci. Engin.: C. 2016. V. 62. P. 967–974.
Kloster N., Marcelo A. Interaction of humic acids with soil minerals: adsorption and surface aggregation induced by Ca2+ // Environ. Chem. 2015. V. 12. № 6. P. 731–738.
Кормош Е.В. Модифицирование монтмориллонитсодержащих глин для комплексной сорбционной очистки сточных вод: Дис. … д-ра техн. наук. Белгород, 2009. 181 с.
Dmitrieva E., Efimova E., Siundiukova K., Perelomov L. Surface properties of humic acids from peat and sapropel of increasing transformation // Environ. Chem. Letter. 2015. V. 13. № 2. P. 197–202.
Попов А.И. Гуминовые вещества. Свойства, строение, образование. СПб.: Изд-во: СПбГУ, 2004. 248 с.
Дмитриева Е.Д., Леонтьева М.М., Сюндюкова К.В. Влияние рН среды на связывание ионов металлов гуминовыми веществами и гиматомелановыми кислотами торфов // Уч. зап. Казан. гос. ун-та. Сер. Естеств. науки. 2017. № 2. В печати.
Дмитриева Е.Д., Леонтьева М.М., Сюндюкова К.В. Молекулярно-массовое распределение гуминовых веществ и гиматомелановых кислот торфов различного генезиса Тульской области // Химия раст. сырья. 2017. № 4. В печати.
Colombo C., Palumbo G., Ahgelico R., Cho H.G., Francioso O., Ertani A., Hardi S. Spontaneous aggregation of humic acid observed with AFM at different pH // Chemosphere. 2015. V. 138. P. 821–828.
Дополнительные материалы отсутствуют.