Агрохимия, 2020, № 10, стр. 89-96
Выявление фальсифицированной продукции на основе альфа-нафтилтиомочевины
Л. А. Носикова 1, А. Н. Кочетов 1, *, Л. Г. Кузьмина 2
1 МИРЭА–Российский технологический университет
(Институт тонких химических технологий имени М.В. Ломоносова)
119571 Москва, пр Вернадского, 86, Россия
2 Институт общей и неорганической химии имени Н.С. Курнакова РАН
119991 Москва, Ленинский просп., 31, Россия
* E-mail: kochchem@mail.ru
Поступила в редакцию 13.03.2020
После доработки 18.04.2020
Принята к публикации 10.07.2020
Аннотация
Описан случай подмены в составе родентицидного средства острого действия альфа-нафтилтиомочевины на антикоагулянтный родентицид бромадиолон. Использование только лишь тривиальных приманок на ядах антикоагулянтного действия вместо чередования обработок, в том числе и с использованием ядов острого действия, может привести к закреплению резистентности к антикоагулянтам в популяции грызунов. Предложен ВЭЖХ-метод определения титульного производного в изократическом режиме при 280 нм, позволяющий проводить идентификацию в присутствии бромадиолона и некоторых других антикоагулянтов кумаринового ряда. Рассмотрены особенности осуществления пробоподготовки и хроматографического анализа, исключающие потери аналита. В предложенных условиях определение в экстрактах альфа-нафтилтиомочевины на фоне примесных компонентов уверенно осуществляется, начиная с концентрации 1.0 мг/мл без использования метода добавок и дополнительного концентрирования пробы. Произведен рентгенофазовый анализ (РФА) образцов нескольких технических субстанций. Данные РФА сопоставлены со сведениями, полученными при исследовании монокристаллического образца субстанции. Определены кристаллографические данные для монокристаллического образца, при этом выявлены параметры структуры альфа-нафтилтиомочевины: кристаллы моноклинные, пр. гр. С2/с: α = 15.424(2) Å, b = = 7.636(1) Å, c = 17.114(2) Å, β = 91.584(2)°, Z = 8.
ВВЕДЕНИЕ
Использование ядов острого действия, к которым относится альфа-нафтилтиомочевина (НТМ), накладывает специфические требования как на аспекты, связанные с производством, так и на применение данных веществ [1]. Приманки на ядах острого действия дополняют арсенал дератизационных средств и часто служат единственными средствами борьбы с грызунами, устойчивыми к антикоагулянтным субстанциям 4-гидроксикумаринового и индандионового рядов. В настоящее время активно используют тактику чередования использования средств на основе антикоагулянтов и ядов острого действия [2, 3], что является действенным приемом при реализации различных концепций дератизации [4]. Поскольку яды острого действия, помимо общих рекомендаций при отравлениях [5], не имеют специфических антидотов, то к средствам на их основе должно проявляться повышенное внимание как на этапе входного контроля, так и на всех стадиях при производстве, применении и выявлении остаточного содержания. Именно по этим причинам у некоторых недобросовестных участников рынка услуг возникает желание отойти от работы с ядами острого действия, при этом всячески декларируя использование последних. Безусловно, все официально зарегистрированные дезинфекционные средства или средства, разрешенные к применению в сельском хозяйстве, проходят стадию обязательной государственной регистрации, в результате проведения которой устанавливается содержание действующих веществ, однако не редки случаи, когда на территории РФ распространяются средства, вовсе не получившие никаких соответствующих документов и не включенные в общий государственный реестр зарегистрированных средств [6].
Для оценки содержания НТМ (иногда фигурируют альтернативные названия – анту, крысид) в продукции и объектах окружающей среды разработана методическая база, приведенная как в официальных изданиях (МУК 4.1.1348-03 Измерение массовых концентраций 1-нафталенилтиокарбамида (крысида, α-нафтилтиокарбамида) в воздухе рабочей зоны методом высокоэффективной жидкостной хроматографии (дата введения 01.01.2002); Р 4.2.2643-10 Методы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности. М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2010. С. 44–49), так и в доступных источниках. Изначально определение НТМ осуществляли по Кьельдалю [7, с. 226]. Основными методами контроля в настоящее время являются спектрофотометрия [1, 8, 9] и флюориметрия [10, 11], реже используют метод ВЭЖХ [1].
Для определения НТМ в объектах окружающей среды и продукции предложено большое количество методик ВЭЖХ. Высокие стартовые требования, например, при определении НТМ методом ультраВЭЖХ с МС/МС-детектированием (Электронный ресурс https://www.agilent.com/cs/library/applications/si-01510.pdf), и в некоторых других случаях [12, 13] не позволяют рекомендовать данные подходы в качестве базовых при рутинном мониторинге продукции. Вместе с тем при использовании ОФ режимов ВЭЖХ в ряде методических документов были достигнуты весьма скромные характеристики разделения с временами удерживания от 2.5 до 3.5 мин [1, 14], которые кардинально не улучшились при использовании градиентного режима элюирования [15].
Титульную субстанцию производят не только за рубежом, но и на территории нашей страны [16], при этом наверняка использованные при синтезе/очистке технологические приемы будут влиять на содержание целевого компонента и примесных фаз в составе технической субстанции. Одним из примесных компонентов субстанции НТМ является 2-нафтиламин, обладающий канцерогенным действием [17]. Однако при исследовании технических субстанций, например, методом РФА трудно ожидать, что идентификация минорных примесей может послужить достоверным репером при мониторинге сырья, т.к. существует вероятность, что исследуемый образец будет рентгеноаморфен, что помешает осуществить корректный эксперимент, идентифицирующий примесные фазы на фоне интенсивных рефлексов фазы/фаз основного компонента.
Цель работы – установление простых и удобных подходов к входному контролю технической субстанции и отравленных приманок с целью их идентификации и определения содержания на фоне ядов другой группы – антикоагулянтных родентицидов 4-гидроксикумаринового ряда.
МЕТОДИКА ИССЛЕДОВАНИЯ
Для проведения исследования использовали аналитические стандарты родентицидных субстанций: “Дифенакум” 99.2% (Fluka, Англия), “Варфарин” 97.5% (СОП 64-06, НПК “Блок-1”, Россия), “Бродифакум” 97.8% (СОП 68-06, НПК “Блок-1”, Россия), “Бромадиолон” 98.2% (СОП 65-06, НПК “Блок-1”, Россия), “Куматетралил” 99.9% (Bayer AG, Германия), “Флокумафен” 98.0% (Waycome Pharmaceutical Co., Ltd, Kитай). Образец аналитического стандарта НТМ был выделен из фракции монокристаллов, полученных из технического препарата. Монокристаллический образец НТМ был выделен при изотермическом (комнатная температура) испарении раствора субстанции в смеси хлороформа и изопропилового спирта с начальной концентрацией 3 мг/мл. В работе использованы несколько образцов НТМ китайских производителей.
Изопропанол (х.ч., ГОСТ 18300-87), хлороформ (х.ч., ТУ 6-09-06-4263), ацетон (для хроматографии ТУ СОМР 2-044-96), ацетон (ос.ч., 9-5 ОП-2, ТУ 2633-039-44493179-00 с изм.1, 2), хлористый метилен (х.ч., ТУ 2631-019-44493179-98 с изм. 1, 2, 3), уксусная кислота (х.ч., ГОСТ 61-75), вода дистиллированная (ГОСТ 6709-72), ацетонитрил (для ВЭЖХ, “Panreac”, Испания) использовали без предварительной очистки.
В процессе работы готовили премиксы субстанций 4-гидроксикумаринового ряда в хлороформе с концентрациями 5–10 мг/мл. Разбавлением премиксов изопропанолом до концентраций 0.02–0.30 мг/мл удалось получить стабильные рабочие растворы (хранение 3 мес. в холодильнике Т = 2–6°С) для аналитического определения методом ОФ ВЭЖХ с широким охватом полярностей подвижной фазы. Раствор смеси субстанций 4-гидроксикумаринового ряда готовили непосредственно перед использованием.
Проведение ВЭЖХ в сочетании с УФ-детектированием осуществляли на хроматографе “Waters 490” (Waters Ltd., Watford, UK), оснащенном насосом Altex модели 110A, инжектором “Rheodyne” с объемом петли 20 мкл, УФ-детектором модели 490 с переменной длиной волны. Использовали колонку из нержавеющей стали (4.6 × 150 мм), заполненную Reprosil ODS-A, зернение 5 мкм (“Элсико”, Россия). Подвижную фазу предварительно дегазировали при помощи ультразвуковой установки, скорость потока 0.5 мл/мин, соотношение компонентов CH3CN : H2O : СН3СООН = = 70 : 30 : 1. Детектирование осуществляли при 280 нм (температура комнатная). Запись хроматограмм проводили с помощью программы “Мультихром” (Ampersand Ltd. версия 1.52i, Россия).
Рентгенофазовый анализ (РФА) образцов проводили на дифрактометре Bruker D8 Advance (CuKα -излучение) в диапазоне углов 5°–60° 2θ с шагом 0.020 2θ и выдержке не менее 0.3 с/шаг. Дифрактограммы индифицировали с использованием базы данных PDF2 (2012).
Рентгеноструктурное исследование выполнено на дифрактометре CCD SMART-Apex-II при температуре 150 К с использованием MoKα-излучения (λ = 0.71073 Å, графитовый монохроматор). Кристаллы НТМ моноклинные, пр. гр. С2/с, a = = 15.424(2), b = 7.636(1), c = 17.114(2) Å, β = = 91.584(2) Å, V = 2014.9(4) Å3, Z = 8, ρвыч = = 1.347 г/см3, μ(MoKα) = 0.281 мм–1, F(000) = 856. Интенсивности 7326 отражений (из них 2674 независимых, Rint = 0.0141) измерены с использованием ω-сканирования в интервале 4.76° < θ < < 57.98° (–20 ≤ h ≤ 20, –9 ≤ k ≤ 10, –18 ≤ l ≤ 23). Первичная обработка экспериментальных данных проведена по программе SAINT [18, 19].
Структура расшифрована прямым методом и уточнена полноматричным анизотропным МНК по F2 для всех неводородных атомов в программе OLEX-2 [20]. Все водородные атомы помещены в рассчитанные положения и уточнены с использованием модели “наездника”. Окончательная величина фактора расходимости составила R1 = = 0.0321, wR2 = 0.0872 для 2674 отражений с I > > 2σ(I) и 127 параметров уточнения. GOOF = 1.042, Δρmax, Δρmin = 0.41, –0.20 e/Å3. Кристаллографические данные депонированы в Кэмбриджском банке структурных данных под номером 1961215.
В процессе исследования подвергли проверке на содержание родентицидных субстанций готовую зерновую приманку, предназначенную для истребления серых и черных крыс, – препарат “Наповал” (ЗАО “Научно-коммерческая фирма “РЭТ”, Россия) в полимерной упаковке с указанной датой производства 03.03.2017 (ТУ 9392-005-45338156-2006 с изм. № 1-2012).
Экстракцию из зерновой приманки осуществляли как по ранее описанным процедурам [21–23] для определения родентицидов 4-гидроксикумаринового ряда, так и на основании рекомендаций для определения НТМ спектральными [8] и хроматографическими методами [1].
Для установления влияния ультразвуковой обработки на возможные потери целевого компонента при комбинированном воздействии экстрагентов и ультразвука осуществляли параллельное экстрагирование проб с применением и без применения ультразвука. Аликвоты проб экстракта после перемешивания на магнитной мешалке помещали на 0.25 ч в ультразвуковую установку “Кристалл-2,5” (ОАО “ОКТБ Кристалл”, Россия), далее отфильтровывали и хроматографировали.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Проведенное исследование нескольких образцов технических субстанций альфа-нафтилтиомочевины методом рентгенофазового анализа продемонстрировало высокую степень совпадения рефлексов с отражениями для монокристаллического образца НТМ (рис. 1), что могло свидетельствовать о возможности использования метода рентгенофазового анализа для качественной идентификации субстанции (соотнесение миллеровских индексов и основных рефлексов для технической субстанции представлены в табл. 1). При этом ввиду отсутствия стандартных образцов НТМ, метрологически значимых на территории РФ, для приготовления стандартных растворов использовали кристаллическую фазу, идентифицированную с помощью методов РФА и РСА.
Рис. 1.
Рентгенограммы технической субстанции (а) и монокристаллического образца (б) НТМ, полученные методами РФА и РСА соответственно.
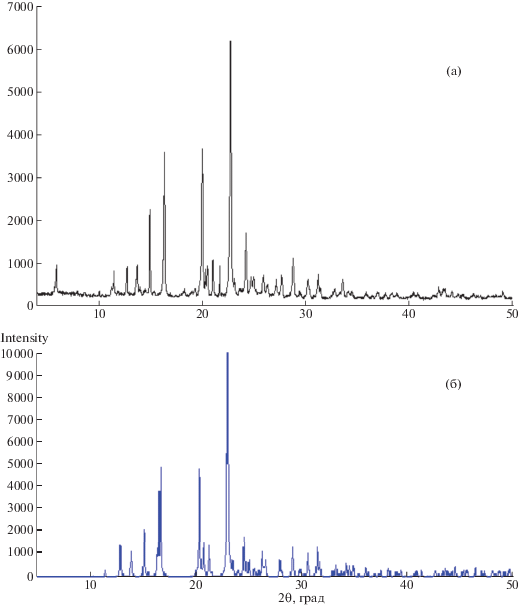
Таблица 1.
Рефлексы на порошковой рентгенограмме технической субстанции НТМ в области 2θ от 10.00 до 25.00° с вероятностью 80% (по данным РФА с отнесением опорных сигналов относительно данных РСА для монокристаллического образца)
| 2θ, град | Интенсивность (I/I0) | Миллеровские индексы (h, k, l) |
|---|---|---|
| 10.258 | 94 | |
| 11.429 | 173 | |
| 11.682 | 774 | 2, 0, 0 |
| 12.924 | 1003 | 1, 1, 0 |
| 13.412 | 33 | |
| 13.948 | 799 | 1, 1, 1 |
| 14.192 | 178 | |
| 15.178 | 2198 | 2, 0, –2 |
| 15.544 | 129 | |
| 16.399 | 553 | 1, 1, –2 |
| 16.596 | 3968 | 1, 1, 2 |
| 17.112 | 50 | |
| 18.500 | 93 | |
| 19.523 | 109 | |
| 20.235 | 3657 | 1, 1, 3 |
| 20.552 | 367 | |
| 20.764 | 879 | 3, 1, 0 |
| 21.289 | 924 | 3, 1, –1 |
| 21.892 | 106 | |
| 22.966 | 5968 | 4, 0, 0 |
| 23.359 | 263 | |
| 23.811 | 97 | |
| 24.456 | 1752 | 1, 1, 4 |
| 24.949 | 370 |
Результаты хроматографического анализа экстрактов из приманки в выбранных условиях проведения определения (изократический режим элюирования) демонстрировали практически полное отсутствие НТМ в исследованных образцах. Детектирование НТМ осуществляли в условиях, унифицированных с ранее предложенными, для определения антикоагулянтных родентицидов [21–25] при длине волны детектирования 280 нм (что фактически соответствовало максимуму поглощения НТМ 285 нм [8]), при этом удалось достичь приемлемой величины удерживания, не уступающей ранее достигнутым показателям [1, 14, 15] без использования градиентных условий элюирования (рис. 2а). Время удерживания НТМ составило 3.8 мин.
Рис. 2.
Хроматограммы (ОФ ВЭЖХ) стандартного раствора НТМ 0.50 мг/мл (а), водно-изопропанольного экстракта средства (б), дихлорэтановый экстракт средства, разбавленный в 2 раза подвижной фазой (в), экстракт зерновой приманки, содержащей 0.005% бромадиолона (г). Колонка 4.6×150 мм Reprosil ODS-A, 5 мкм, система СH3CN : H2O : : СH3COOH (70 : 30 : 1); λ = 280 нм, 0.5 мл/мин изократический режим элюирования.

В результате проведенного исследования не удалось полностью исключить наличие в приманке НТМ (пик 2 на рис. 2б, в), однако содержание последнего не превышало 0.03% (меньше декларируемой величины в 1% более чем в 30 раз). Проведение исследования в режимах, преимущественно использующихся для анализа антикоагулянтных родентицидов, позволило выявить в образце (пики 8, 9 на рис. 2б и 4, 5 на рис. 2в) присутствие другого родентицида – бромадиалона, представителя антикоагулянтов 4-гидроксикумаринового ряда [26] в значительных количествах (0.0027 ± 0.0004%), что было подтверждено введением добавки стандартного раствора к полученному водно-изопропанольному экстракту.
Стандартная хроматограмма для зернового водно-изопропанольного экстракта средства на основе бромадиолона (пробоподготовка идентична ранее использованной нами [21]) демонстрировала близкую картину (пики бромадиолона – 2, 3 на рис. 2г). Замечено, что использование в качестве экстрагентов хлористого метилена и хлороформа было нежелательным, поскольку в этом случае фиксировали значительное искажение аналитического сигнала для субстанций 4-гидроксикумаринового ряда [21], что и было зафиксировано при экстракции хлористым метиленом из фальсифицированного средства (пики 4, 5 на рис. 2в).
В предложенных условиях определению НТМ не мешало возможное присутствие в пробах не только бромадиолона (времена удерживания 12.4 и 13.5 мин), но также и других производных 4-гидроксикумарина, включая геометрические изомерные формы (с временами удерживания): зоокумарин (5.4 мин), куматетраллил (5.8 мин), дифенакум (транс- 21.9 мин, цис- 25.3 мин), флокумафен (транс- 29.5 мин, цис- 35.7 мин), бродифакум (транс- 38.6 мин, цис- 44.2 мин).
Установленное содержание бромадиолона (0.0027 ± 0.0004%) в готовой для применения препаративной форме приманки потенциально может обеспечить приемлемую эффективность композиции, поскольку в настоящее время выпускают значительное количество зерновых приманок с содержанием бромадиолона 0.005 ± 0.001% [1, 2, 22], при этом в лабораторных исследованиях подтверждена эффективность препаратов и с содержанием бромадиолона 0.0025% [27]. Такое содержание антикоагулянтного родентицида в средстве, скорее всего, является целенаправленным, а не случайным производственным сбоем, обусловленным, к примеру, нарушением цикла подготовки оборудования после приготовления зерновых приманок на основе антикоагулянтных родентицидов. Следует констатировать, что исследованное нами средство нельзя отнести к приманкам острого действия в виду того, что содержание НТМ в препарате меньше декларируемого более чем в 30 раз, но, тем не менее, приманка является родентицидным средством.
На стандартном растворе НТМ с концентрацией 0.20 мг/мл (в 5 раз меньше заявленной концентрации в экстракте исследованной приманки НТМ) было проведено дополнительное моделирование экстракционного извлечения в кислых условиях с использованием дополнительной ультразвуковой обработки, которое полностью исключило возможность гидролиза титульного производного при извлечении. Одновременно были проверены различные экстракционные условия, приведенные в официальных документах и статьях, посвященных определению НТМ в родентицидной продукции. Выявили, что различные экстрагенты (ацетон, хлористый метилен и смеси ацетонитрила с водой) не улучшили степень извлечения НТМ из приманки и возможное содержание НТМ в приманке неизменно не превышало 0.03% вместо декларируемого содержания в 1%. Использование ультразвука при экстракционном извлечении также не привело к значительному изменению ранее установленного содержания НТМ.
Исходя из результатов проведенного исследования, не исключен вариант намеренной подмены во многом уникальной приманки (за счет использования яда острого действия) на тривиальную продукцию, выпускаемую большим кругом производителей. Увидит ли конечный потребитель разницу, учитывая обнаруженное высокое содержание бромадиолона – большой вопрос. Однако именно яды острого действия остаются в арсенале родентицидных средств. Несмотря на сложности при производстве и применении ввиду значительной токсичности и отсутствии специфических антидотов, в том числе для снижения популяций грызунов после обработки объектов приманками на основе антикоагулянтных субстанций. Последнее обстоятельство крайне важно, поскольку такое мероприятие (чередование обработок объектов антикоагулянтами и препаратами на ядах острого действия) служит снижению возможности закрепления в популяции резистентности к антикоагулянтам, волна которой докатилась до территории РФ [28, 29], в том числе, и по вине неправильного использования тактики чередования разных групп ядов.
ЗАКЛЮЧЕНИЕ
Проведенное исследование позволило подтвердить относительно высокое качество образцов рассмотренной субстанции альфа-нафтилтиомочевины (НТМ) от разных производителей рентгеновским (РФА) и хроматографическим (ОФ ВЭЖХ) методами, осуществленными относительно полученного в результате дополнительной очистки исходного сырья до выделения кристаллической фракции (идентификация методом РСА), рассмотренной в дальнейшем в качестве аналитического стандарта. Предложен унифицированный хроматографический метод идентификации НТМ на фоне возможного присутствия в пробе родентицидов 4-гидроксикумаринового ряда (зоокумарина, куматетраллила, бромадиолона, бродифакума, дифенакума и флокумафена). НТМ уверенно детектируется на фоне примесных фаз без концентрирования пробы, при осуществлении пробоподготовки по предложенным схемам, начиная с концентрации 1.0 мг/мл (эквивалентно содержанию 0.1% НТМ в приманке, что меньше в 10 раз декларируемого содержания в препаративной форме). Исключены факторы потери НТМ (на модельных растворах) при осуществлении различных вариантов пробоподготовки, включая дополнительное воздействие ультразвука.
Список литературы
Мелков В.К., Румянцева Л.Н., Колков В.Ф., Воронцова В.Л. Рынок родентицидов в России. Кн. 1. Сб. информ., норматив. и метод. мат-лов. М.: Проект, 2003. 328 с.
Назаров В.Ю., Дацкевич А.М., Кабай Л.И. Приготовление отравленных приманок силами дезинфекционных учреждений. Проблемы и пути решения // Дезинфекц. дело. 2011. № 3. С. 26–35.
Рыльников В.А. Управление численностью грызунов путем применения родентицидов (на примере серой крысы, Rattus Norvegicus (Berk)) // Дезинфекц. дело. 2008. № 2. С. 57–60.
Тощигин В.Ю. Современная концепция дератизации в городах и сельских населенных пунктах России (возникновение, развитие, пути реализации) // Дезинфекц. дело. 2009. № 2. С. 60–67.
Рыльников В.А., Тощигин В.Ю., Пыхов С.Г., Отрадинская О.В. К вопросу о применении препарата “Крысид” в современных условиях // Пест-Менеджмент (РЭТ-Инфо). 2000. № 2. С. 32–33.
Махнева Т.В. Барьеры на пути развития дезинфекционного рынка // Дезинфекц. дело. 2016. № 4. С. 51–55.
Спецификация пестицидов. Всемирная организация здравоохранения. Женева–Москва: 1-я типография Медгиза, 1962. 534 с.
Крейнгольд С.У., Шестаков К.А. Определение 1-(1-нафтил)-2-тиомочевины в отравленных приманках // Дезинфекц. дело. 2003. № 1. С. 48–49.
Asghar M., Yaqoob M., Ullah S., Ali S., Munawar N., Nabi A. Development of flow injection spectrophotometric method for 1-napthylthiourea using sodium nitrite and sulphanilic acid diazotization reaction // J. Spectroscop. 2018. Art. ID 3920289, 7 p. https://doi.org/10.1155/2018/3920289
Pulgriän J.A.M., Bermejo L.F.G., Aranda J.A.R. Development of time-resolved chemiluminescence for the determination of antu in river water, wheat, barley, and oat grain samples // J. Agric. Food Chem. 2005. V. 53. P. 6609–6615.
Sanchez F.G., Aguilar G.A. Fluorimetric determination of the rodenticide ANTU in spiked wheat grain // Microchim. Acta. 1993. V. 110. № 4. P. 161–166.
Maizels M., Budde W.L. Exact mass measurements for confirmation of pesticides and herbicides determined by liquid chromatography/time-of-flight mass spectrometry // Analyt. Chem. 2001. V. 73. № 22. P. 5436–5440.
Miles C.J., Moye H. Postcolumn photolysis of pesticides for fluorometric determination by high-performance liquid chromatography // Analyt. Chem. 1988. V. 60. № 3. P. 220–226.
Инструкция по применению родентицидного средства “Крысид-покрытие” [Электр. ресурс] http://www.pesticidy.ru/ps-content/literature/files/Крысид-покрытие_инструкция_1691_instructions.pdf (дата обращения 27.10.2018).
Методические указания по применению и методам контроля качества родентицидного средства “Крысид гель” [Электр. ресурс] http://www.profdez.ru/ins_rodento/rodento_nac/nac_krysid_gel.pdf (дата обращения 27.10.2018).
Махнева Т.В., Чепко В.И., Захарченко А.В. Вклад отечественных производителей средств дезинфекции, дезинсекции и дератизации в развитие дезинфекционного дела в Российской Федерации // Дезинфекц. дело. 2006. № 3. С. 17–22.
Заева Г.Н., Мальцева М.М., Котова Н.А., Березовский О.И. О гигиеническом нормировании крысида (1-нафтилтиомочевины) в воздухе рабочей зоны // Пест-Менеджмент (РЭТ-Инфо). 2002. № 1. С. 24–26.
Sheldrick G.M. Crystal structure refinement with SHELXL // Acta Cryst. 2015. C. 71. P. 3–8.
Bruker (2008). APEX2, SADABS and SAINT. Bruker AXS Inc. Madison, Wiskonsin, USA.
Dolomanov O.V., Bourhis L.J., Gildea R.J, Howard J.A.K., Puschmann H. OLEX2: a complete structure solution, refinement and analysis program // J. Appl. Cryst. 2009. V. 42. P. 339–341.
Носикова Л.А., Кочетов А.Н. Анализ дифенакума в родентицидных композициях, содержащих производные куматетралила // Тонкие хим. технол. 2015. Т. 10. № 6. С. 88–95.
Кочетов А.Н., Шестаков К.А., Шпилевский Г.М., Кузьмина Л.Г. Особенности определения содержания замещенных в третьем положении 4-гидроксикумаринов в дезинфекционных средствах и фармпрепаратах // Хим.-фарм. журн. 2013. Т. 47. № 2. С. 41–50.
Носикова Л.А., Кочетов А.Н. Оценка поставщиков родентицидных субстанций 4-гидроксикумаринового ряда с использованием метода ОФ ВЭЖХ // Пест-Менеджмент. 2015. № 4. С. 42–52.
Носикова Л.А., Кочетов А.Н. Оптимизация определения действующих веществ в инсекто-родентицидных средствах на основе фипронила с производными 4-гидроксикумарина методом ОФ ВЭЖХ // Пест-Менеджмент. 2018. № 4. С. 22–29.
Носикова Л.А., Кочетов А.Н. Определение изомерного состава дифетиалона в родентицидной продукции методом ОФ ВЭЖХ. От оценки поставщиков к мониторингу препаративных форм // Пест-Менеджмент. 2019. № 1. С. 36–43.
Кочетов А.Н., Кузьмина Л.Г. Строение и таутомерные превращения замещенных в третьем положении 4-гидроксикумаринов (обзор) // Хим.-фарм. журн. 2010. Т. 44. № 2. С. 9–14.
Инструкция № 20/07-2018 по применению средства родентицидного “БРОМОРАТ” твердые брикеты [Электр. ресурс] http://www.niid.ru/s/210/files/instrukcii_dezsredstva/Deratizaciya/128156_504.pdf (дата обращения 28.02.2019).
Кочетов А.Н., Кузьмина Л.Г., Шестаков К.А. Пути создания новых антикоагулянтных родентицидов // Дезинфекц. дело. 2009. № 2. С. 68–77.
Рябов С.В. Резистентность грызунов к антикоагулянтам // Дезинфекц. дело. 2018. № 2. С. 46–54.
Дополнительные материалы отсутствуют.


