Агрохимия, 2020, № 10, стр. 72-78
Исследование влияния антибиотиков различных групп на целлюлозолитическую активность дерново-подзолистой почвы методом лабораторного моделирования
Т. А. Трифонова 1, 2, С. М. Чеснокова 1, А. Г. Космачева 1, *
1 Владимирский государственный университет им. А.Г. и Н.Г. Столетовых
600000 Владимир, ул. Горького, 87, Россия
2 Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, стр. 12, Россия
* E-mail: hijadelaluna@mail.ru
Поступила в редакцию 08.10.2019
После доработки 02.03.2020
Принята к публикации 10.07.2020
Аннотация
Исследовали влияние антибиотиков различных групп (бензилпенициллина, окситетрациклина и тилозина) на целлюлозолитическую активность окультуренной легкосуглинистой дерново-подзолистой почвы при индивидуальном и комбинированном воздействии в модельном эксперименте. Целлюлозолитическую активность почвы оценивали по потере массы хлопчатобумажной ткани в загрязненной антибиотиками почве. Установлено, что при индивидуальном воздействии эффекты проявлялись в зависимости от вида антибиотика и его концентрации. Тилозин оказывал явно выраженный эффект ингибирования целлюлозолитической активности, а бензилпенициллин и окситетрациклин стимулировали процесс разложения целлюлозы. При комбинированном воздействии окситетрациклина и тилозина отмечено ингибирование разложения хлопчатобумажного полотна. При комбинированном воздействии бензилпенициллина и тилозина биологические эффекты варьировались в зависимости от их концентрации в почве. При влиянии трехкомпонентной смеси использованных антибиотиков эффекты воздействия проявлялись весьма слабо, т.е. функционирование комплекса целлюлозоразрушающих микроорганизмов в исследованной почве не нарушалось. Определены корреляционные зависимости между концентрацией антибиотиков и эффектами их воздействия.
ВВЕДЕНИЕ
Целлюлозолитическая активность почв является наиболее чувствительным комплексным показателем нарушения деятельности микробиоценоза почв в результате ее загрязнения и в целом отражает экологическую ситуацию, т.к. целлюлоза в почве разрушается представителями разных систематических групп микроорганизмов – от грибов до аэробных и анаэробных бактерий [1–3]. Деятельность целлюлозоразрушающих микроорганизмов обеспечивает сопряжение биологических и геологических круговоротов в почве, уровень плодородия и биохимической активности почвы и зависит как от антропогенных, так и природных факторов [1]. В настоящее время достаточно хорошо изучено влияние на целлюлозолитическую активность почв тяжелых металлов [4], нефти и нефтепродуктов [5], минеральных и органических удобрений и способов обработки почв [6–8].
Тем не менее, слабо изучено влияние антибиотиков, как загрязнителей различных компонентов природной среды. Эти поллютанты во всех странах мира обнаружены в почвах, поверхностных и сточных водах, осадках сточных вод и отнесены к наиболее опасным загрязнителям различных экосистем вследствие их значительного негативного влияния на структуру микробиоценоза и ферментативную активность почвы [9–13], а также распространения в окружающей среде опасных для здоровья человека и животных антибиотикорезистентных патогенных микроорганизмов [14].
Значительная часть медицинских и ветеринарных антибиотиков хорошо растворимы в воде и из организма человека и животных выделяются в окружающую среду с мочой (до 90%) и экскрементами (≈75%) [9].
В почвы антибиотики поступают с навозом крупного рогатого скота, свиней и птицы и осадками сточных вод сооружений биологической очистки, используемых в качестве органического удобрения [9]. В отличие от стран ЕС и США, в России осуществляется только мониторинг содержания антибиотиков в продуктах питания органами Роспотребнадзора. В силу различных причин мониторинг загрязнения антибиотиками почв сельскохозяйственных угодий не проводят. Известно использование в России антибиотиков при исследовании вклада грибов и бактерий в субстрат-индуцированное дыхание почвы, определении структуры микробного сообщества (грибы/бактерии) в почвах разных экосистем и оценке вклада грибного и бактериального компонентов в продуцирование CO2 и N2O дерново-подзолистыми почвами постаграрных биогеоценозов [15–17].
Изучали также влияние различных антибиотиков на структуру микробиоценоза и ферментативную активность чернозема обыкновенного: было показано, что наиболее токсичными для микробиоценоза этих почв являлись антибактериальные антибиотики, менее токсчичными – фунгицидные [18]. Изучено воздействие антибиотиков на активность пероксидазы, каталазы, полифенолоксидазы, дегидрогеназы, инвертазы, фосфотазы [18]. Однако влияние антибиотиков на целлюлозолитическую активность не изучали. Так как значительную часть пахотных земель Владимирской обл. составляют дерново-подзолистые почвы, представляло интерес исследование влияния наиболее широко используемых в медицине и ветеринарии антибиотиков на целлюлозолитическую активность такой почвы. Цель работы – исследование влияния антибиотиков различных групп на целлюлозолитическую активность дерново-подзолистой почвы при их индивидуальном и комбинированном воздействии методом лабораторного моделирования.
МЕТОДИКА ИССЛЕДОВАНИЯ
Объект исследования – дерново-подзолистая легкосуглинистая почва с участка сельскохозяйственного назначения на территории Суздальского р-на Владимирской обл. [19]. Почвенные образцы отбирали из верхнего слоя почвы (0–20 см) в соответствии с ГОСТ 17.4.4.02-84. Агрохимические показатели почвы приведены в табл. 1.
Таблица 1.
Агрохимические показатели исследованной дерново-подзолистой почвы
| Показатель | Величина показателя | Методика исследования |
|---|---|---|
| Кислотность солевой вытяжки, pHKCl, ед. pH | 5.83 ± 0.1 | ГОСТ 26483-85 |
| Кислотность обменная, ммоль/100 г почвы | 0.03 ± 0.01 | ГОСТ 26484-85 |
| Кислотность гидролитическая, ммоль/100 г почвы | 1.53 ± 0.18 | ГОСТ 26212-91 |
| P2O5 подвижный, мг/кг | 178 ± 35.60 | ГОСТ Р 54650-2011 |
| K2O подвижный, мг/кг | 161.0 ± 24.15 | ГОСТ Р 54650-2011 |
| Органическое вещество (гумус), % | 2.38 ± 0.48 | ГОСТ 26213-91 |
| Азот аммонийный, мг/кг | 1.64 ± 0.33 | ГОСТ 26489-85 |
| Азот нитратный, мг/кг | 2.44 ± 0.73 | ГОСТ 26951-86 |
| Содержание глины, % | 27.8 ± 0.03 | ГОСТ 12536-2014 |
Целлюлозолитическую активность почвы определяли в лабораторных условиях модифицированным аппликационным методом Кристенсена [20]. Данный метод основан на выявлении доли (в %) разложившейся целлюлозы. Преимущество лабораторного метода состоит в возможности поддержания заданных оптимальных условий (температуры и влажности) для жизнедеятельности целлюлозолитических микроорганизмов. Опыт проводили в четырехкратной повторности. В качестве источника целлюлозы использовали хлопчатобумажное полотно. Для проведения эксперимента на дно каждой стерильной чашки Петри помещали кусок хлопчатобумажной ткани размером 3 × 4 см, предварительно выдержанный в сушильном шкафу при 105°С в течение 2 ч и взвешенный на аналитических весах с погрешностью 0.0001 г. Далее в каждую чашку Петри добавляли 50 г исследуемой почвы, увлажненной до 60% ПВ и загрязненной антибиотиками в концентрациях, соответствующих 50–700 мг/кг почвы. Антибиотики в образцы почв вводили в виде водных растворов, приготовленных путем разбавления исходного раствора с концентрацией 10 мг/см3. В качестве контроля использовали почву без внесения антибиотиков. Чашки Петри взвешивали, помещали в термостат и инкубировали при температуре 27°С в течении 30 сут. Ежедневно чашки взвешивали и доводили до исходной массы дистиллированной водой. По прошествии 30 сут остатки ткани извлекали из чашек Петри, очищали от почвы, высушивали при 105°C и взвешивали на аналитических весах. Показателем целлюлозолитической активности почвы служит разница в массе ткани (%), разложившейся за время опыта.
Целлюлозолитическая активность исследованной почвы без внесения антибиотиков (контроль) равнялась 47.4 ± 4.2%, что соответствовало средней интенсивности разрушения целлюлозы [20]. Невысокий уровень целлюлозолитической активности исследованной почвы связан с низким содержанием в ней нитратного азота [21].
В работе использовали препараты антибиотиков окситетрациклина и бензилпенициллина в виде порошков для приготовления инъекционного раствора, расфасованные в пенициллиновые склянки в количестве 1 г (1 000 000 ЕД), тилозин – в лекарственной форме раствора для инъекций с концентрацией 200 мг д.в./см3. Исходные растворы антибиотиков с концентрацией 10 мг/см3 готовили путем разбавления препаратов в дистиллированной воде. Исследованные концентрации антибиотиков были выбраны на основании литературных данных об их количествах, обнаруженных в почвах [18], и для рассмотрения эффектов их влияния в случаях экстремального загрязнения почв санитарных защитных зон фармацевтических предприятий и крупных животноводческих комплексов и птицефабрик.
Для статистической обработки результатов исследования использовали программы Microsoft Excel и Statistica 8. В качестве погрешности указаны величины стандартной ошибки эксперимента.
В работе использовали окситетрациклин – бактериостатический антибиотик, подавляет синтез белка на рибосомах. Образуется бактериями рода Streptomyces. Обладает широким антибиотическим спектром в отношении грамположительных и грамотрицательных бактерий. Окситетрациклин применяют в медицинской практике и ветеринарии для лечения ряда бактериальных заболеваний и риккетсиозов, а также в животноводстве для увеличения скорости роста и массы животных и птиц [22, 23]. Этот эффект достигается за счет изменения структуры микрофлоры кишечника и повышения усвояемости растительной пищи животными [23].
Бензилпенициллин относится к группе β-лактамных антибиотиков, образуется мицелиальными грибами рода Penicillium. Эффективен против некоторых грамположительных бактерий, не оказывает действия на грамотрицательные бактерии, грибы и другие группы организмов. Механизм действия основан на ингибировании синтеза пептидогликана – основного компонента клеточной стенки бактерий. Проявляет как бактерицидное, так и бактериостатическое действие. Антибиотик широко применяют в медицине и ветеринарии [22].
Тилозин – антибиотик группы макролидов. Образуется культурой Streptomyces fradiae. Оказывает бактериостатическое действие, подавляя синтез белка, воздействуя на бактериальные рибосомы, применяется в животноводстве, в качестве добавок к кормам животных, а также как консервант в пищевой промышленности для подавления развития плесневых грибков при хранении продуктов [22, 24].
В почвы антибиотики обычно попадают вместе с навозом, осадками сточных вод и стоками с территорий птицефабрик и ферм крупного рогатого скота.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Было установлено, что эффекты индивидуального воздействия антибиотиков на целлюлозолитическую активность исследованной почвы зависели как от их свойств, так и от их концентрации (рис. 1). Биологические эффекты их воздействия на целлюлозоразрушающую микробиоту в разной степени возрастали при увеличении их концентраций.
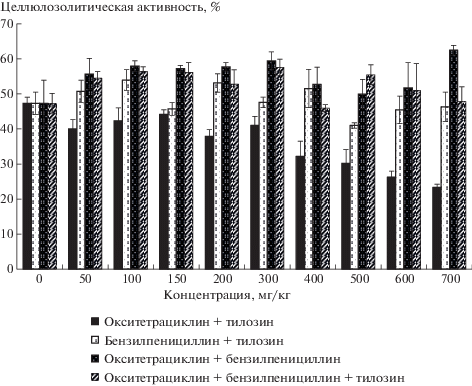
Рис. 1.
Зависимость целлюлозолитической активности почвы от концентрации антибиотиков при индивидуальном воздействии.
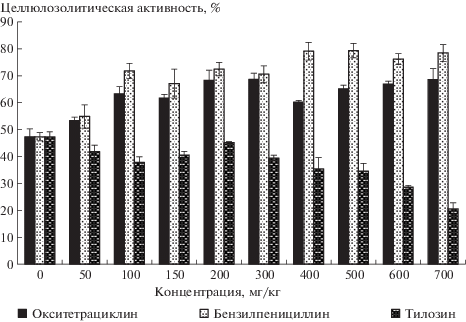
Тилозин во всем диапазоне исследованных концентраций ингибировал процесс разрушения хлопчатобумажного полотна, проявляя слабую острую (EC 10 = 100 мг/кг) и слабую хроническую токсичность (EC 50 = 680 мг/кг). Вероятно, этот эффект был связан с угнетением тилозином комплекса целлюлозолитических ферментов, выделяемых микобиотой – основного участника разложения целлюлозы в дерново-подзолистых почвах и целлюлозоразрушающих прокариотов [2, 3, 16–18, 25, 27].
При индивидуальном воздействии бензилпенициллина и окситетрациклина происходила достаточно заметная стимуляция разрушения хлопчатобумажного полотна в чашках Петри, что, по-видимому, было связано со смещением структуры микробиоценоза почвы в сторону увеличения биомассы грибов из-за снижения количества бактерий [22, 26]. Эти результаты хорошо согласуются с данными, полученными при изучении воздействия сульфамидов и тетрациклина на структуру почвенной микробиоты [26].
При комбинированном воздействии бинарных смесей антибиотиков тилозин подавлял эффекты стимуляции целлюлозолитической активности бензилпенициллином и окситетрациклином (рис. 2). Причем эффект комбинированного воздействия тилозина и окситетрациклина был идентичен эффекту индивидуального воздействия тилозина, т.е. происходило существенное ингибирование активности целлюлозоразрушающих микроорганизмов.
Исходя из этого, можно полагать, что при длительном систематическом поступлении в дерново-подзолистые почвы антибиотиков бензилпенициллина и окситетрациклина, в результате увеличения целлюлозолитической активности микобиоты, может произойти нарушение баланса углерода в почве и снижение ее плодородия.
При комбинированном воздействии окситетрациклина и бензилпенициллина в целом происходила стимуляция целлюлозолитической активности почвы. Однако эти эффекты были меньше, чем при индивидуальном воздействии этих антибиотиков, т.е. наблюдали эффект антагонизма.
Эффекты комбинированного воздействия бензилпенициллина и тилозина варьировались в зависимости от их концентрации. В интервале концентраций 50–100 и 400–700 мг/кг происходила незначительная стимуляция разложения хлопчатобумажного полотна. В интервале концентраций 150–300 мг/кг отмечена суммация положительного (стимуляция) и отрицательного (ингибирование) биологических эффектов.
При комбинированном воздействии смеси 3-х антибиотиков в интервале концентраций 50–300 мг/кг наблюдали незначительную стимуляцию разложения полотна, а в интервале 400–700 мг/кг процесс разложения целлюлозы практически не происходил.
Рассчитаны корреляционные зависимости “доза–эффект” при индивидуальном и комбинированном воздействии бинарных и трехкомпонентных смесей антибиотиков на процесс разложения целлюлозы в модельном эксперименте с указанием доверительных интервалов (табл. 2). Показано, что существует высокая корреляционная зависимость между степенью ингибирования разрушения целлюлозы и концентрацией антибиотиков при воздействии тилозина и комбинированном влиянии смеси тилозина и окситетрациклина. Также отмечена высокая корреляционная зависимость между степенью стимулирования целлюлозолитической активности и концентрацией бензилпенициллина при его индивидуальном воздействии; средняя корреляционная зависимость – между степенью стимулирования разрушения целлюлозы и концентрацией окситетрациклина. Корреляционная зависимость не обнаружена между концентрацией и их биологическими эффектами при комбинированном воздействии бинарных смесей бензилпенициллина и окситетрациклина, бензилпенициллина и тилозина, а также трехкомпонентной смеси антибиотиков.
Таблица 2.
Корреляционные зависимости воздействий антибиотиков на целлюлозолитическую активность почвы
| Вариант | Коэффициент корреляции (r) | Доверительный интервал (p) |
|---|---|---|
| Окситетрациклин | 0.67 | 0.04 |
| Бензилпенициллин | 0.79 | 0.01 |
| Тилозин | –0.90 | 0.00 |
| Окситетрациклин + + тилозин | –0.95 | 0.00 |
| Бензилпенициллин + + тилозин | –0.50 | 0.15 |
| Окситетрациклин + + бензилпенициллин | 0.17 | 0.64 |
| Смесь 3-х антибиотиков | –0.29 | 0.41 |
Исходя из полученных результатов, можно предположить, что наибольшую опасность для исследованной дерново-подзолистой почвы представляет ее загрязнение антибиотиками только какой-либо одной группы, которое может вызвать либо существенное замедление разложения пожнивных остатков, либо, наоборот, значительное ускорение их разложения, но что во всех случаях будет приводить к снижению почвенного плодородия.
ЗАКЛЮЧЕНИЕ
Таким образом, впервые изучены эффекты воздействия антибиотиков различных групп на целлюлозолитическую активность дерново-подзолистой почвы методом лабораторного моделирования при индивидуальном и комбинированном воздействии бинарных и трехкомпонентных смесей. Было установлено, что эффекты влияния антибиотиков на целлюлозолитическую активность легкосуглинистой дерново-подзолистой почвы при индивидуальном воздействии зависели от вида препарата и возрастали с увеличением их концентрации в почве. Тилозин ингибировал процессы разрушения целлюлозы, благодаря широкому бактериостатическому спектру действия как против грамположительных, так и против грамотрицательных организмов. Кроме этого, в связи с содержанием в препарате дополнительных веществ (пропандиола и бензилового спирта), обладающих антисептическими свойствами [28, 29], возможно он способен проявлять и фунгицидное воздействие, вследствие чего подавляется активность микроскопических грибов – основных разрушителей целлюлозы в дерново-подзолистой почве.
Эффекты стимуляции разложения целлюлозы при индивидуальном воздействии наблюдали для антибиотиков с антибактериальным спектром действия (бензилпенициллина и окситетрациклина). Можно предположить, что это было связано со смещением структуры микробиоценоза почвы в сторону увеличения доли микобиоты при снижении количества прокариотических организмов, исходя из аналогичных данных, описанных в литературе [22, 26]. При комбинированном воздействии различных антибиотиков на почвенную биоту разрушение целлюлозы было слабовыраженным.
Обнаружена корреляционная зависимость между степенью ингибирования целлюлозолитической активности и концентрацией при индивидуальном воздействии тилозина (r = 0.90) и комбинированном воздействии тилозина и окситетрациклина (r = 0.95), а также между степенью стимулирования целлюлозолитической активности бензилпенициллином (r = 0.79) и окситетрациклином (r = 0.67).
Присутствие антибиотиков в дерново-подзолистой почве оказывало неоднозначное влияние на процесс разложения клетчатки: они могли как стимулировать, так и ингибировать целлюлозолитическую активность почвенных микроорганизмов.
Список литературы
Полянская Л.М., Звягинцев Д.Г. Содержание и структура микробной биомассы как показатель экологического состояния почв // Почвоведение. 2005. № 6. С. 706–714.
Шипилин Н.Н. Техногенно загрязненные почвы пашни и их биоиндикация: Автореф. дис. … канд. с.-х. наук. Барнаул, 1996. 20 с.
Мишустин Е.Н. Ассоциации почвенных микроорганизмов. М.: Наука, 1975. 169 с.
Громакова Н.В., Минкина Т.М., Манджиева С.С., Чаплыгин В.А., Бауэр Т.В., Сушкова С.Н. Влияние подвижных форм тяжелых металлов на показатели целлюлозоразлагающей и уреазной активности чернозема обыкновенного (модельный эксперимент) // Агрохимия. 2017. № 2. С. 73–81.
Колесников С.И., Казеев К.Ш., Вальков В.Ф., Азнаурьян Д.К., Жаркова М.К. Биодиагностика экологического состояния почв, загрязненных нефтью и нефтепродуктами. Ростов н/Д.: Росиздат, 2007. 192 с.
Щур А.В., Виноградов Д.В., Валько В.П. Целлюлозолитическая активность почв при различных уровнях агротехнического воздействия // Вестн. КрасГАУ. 2015. № 7. С. 45–49.
Климкина Ю.М. Влияние удобрений на урожайность ячменя и целлюлозолитическую активность дерново-подзолистой почвы // Агрохим. вестн. 2015. № 3. С. 34–36.
Зинченко М.К., Бибик Т.С., Стоянова Л.Г. Влияние систем удобрения на жизнедеятельность отдельных физиологических групп микроорганизмов в серой лесной почве Владимирского ополья // Фундамент. исслед-я. 2014. № 12. С. 552–557.
Kaczala F., Blum S.E. The Occurrence of veterinary pharmaceuticals in the environment: A Review // Current Analyt. Chem. 2016. V. 12. P. 169–182.
Chen W., Liu W., Pan N., Jiao W., Wang M. Oxytetracycline on functions and structure of soil microbial community // J. Soil Sci. Plant Nutr. 2013. V. 13. P. 967–975.
Liu W., Pan N., Chen W., Jiao W., Wang M. Effect of veterinary oxytetracycline on functional diversity of soil microbial community // Pant Soil Environ. 2012. V. 58. P. 295–301.
Grenni P., Ancona V., Caracciolo A.B. Ecological effects of antibiotics on natural ecosystems: A review // Microchem. J. 2018. V. 136. P. 25–39.
van de Vijver L., Verwer C., Smolders G., Hospers-Brands M., van Eekeren N. The cycle of veterinary antibiotics in the ecosystem. Louis Bolk Institute, 2016. P. 31.
Всемирная организация здравоохранения. Глобальная стратегия ВОЗ по сдерживанию устойчивости к противомикробным препаратам. Женева: ВОЗ, 2001. 168 с.
Ананьева Н.Д., Сусьян Е.А., Чернова О.В., Чернов И.Ю., Макарова О.Л. Соотношение грибов и бактерий в биомассе разных типов почв, определяемое селективным ингибированием // Микробиология. 2006. Т. 5. № 6. С. 807–813.
Сусьян Е.А., Ананьева Н.Д., Благодатская Е.В. Разделение грибного и бактериального субстрат-индуцированного дыхания с использованием антибиотиков в почвах разных экосистем // Микробиология. 2005. Т. 74. № 3. С. 394–400.
Ананьева Н.Д., Стольникова Е.В., Сусьян Е.А., Ходжаева А.К. Грибная и бактериальная микробная биомасса (селективное ингибирование) и продуцирование CO2 и N2O дерново-подзолистыми почвами постаграрных биогеоценозов // Почвоведение. 2010. № 11. С. 1387–1393.
Акименко Ю.В. Влияние загрязнения антибиотиками на биологические свойства чернозема обыкновенного: Автореф. дис. … канд. биол. наук. Ростов-н/Д., 2015. 24 с.
Герасимова М.И., Красильников П.В. Мировая реферативная база почвенных ресурсов 2014. Международная система почвенной классификации для диагностики почв и создания легенд почвенных карт. Исправл. и допол. верс. 2015. Продовольственная и сельскохозяйственная организация объединенных наций, Московский государственный университет им. М.В. Ломоносова. Рим, 2018. 216 с.
Основные микробиологические и биохимические методы исследования почвы: метод. рекоменд. / Под ред. Возняковской Ю.М. Л.: ВНИИСХМ, 1987. 47 с.
Лазарев А.П., Абрашин Ю.И., Гордеюк Л.Л. Целлюлозолитическая активность обрабатываемого чернозема обыкновенного лесостепной зоны Ишимской равнины // Почвоведение. 1997. № 10. С. 1230–1234.
Егоров Н.С. Основы учения об антибиотиках. М.: Изд-во МГУ, 2004. 528 с.
Хохрин Н.С. Кормление сельскохозяйственных животных. М.: КолосС, 2004. 692 с.
Голубев В.Н., Чичева-Филатова Л.В., Шленская Т.В. Пищевые и биологически активные добавки. М.: Академия, 2003. 208 с.
Титова В.И., Козлов А.В. Методы оценки функционирования микробиоценоза почвы, участвующего в трансформации органического вещества: Научн.-метод. пособ. / Нижегородская СХА. Н. Новгород, 2012. 64 с.
Thiele-Bruhn S., Beck I.C. Effects of sulfonamide and tetracycline antibiotics on soil microbial activity and microbial biomass // Chemosphere. 2005. V. 59. P. 457–465.
Благовещенская Г.Г., Духанина Т.М. Микробные сообщества почв и их функционирование в условиях применения средств химизации // Агрохимия. 2004. № 2. С. 80–88.
Encyclopedia of Toxicology. 2nd Edit. / Eds. Anderson B., de Peyster A., Gad S.C., Hakkinen P.J.B., Kamrin M., Locey B., Mehendale H.M., Pope C., Shugart L., Wexler P. Academic Press, 2005. 2000 p.
Химическая энциклопедия: в 5 т. / Под ред. Зефирова Н.С. М.: БРЭ, 1995. Т. 4. С. 103–104.
Дополнительные материалы отсутствуют.