Агрохимия, 2020, № 3, стр. 37-42
ФИЗИОЛОГИЧЕСКИЕ РЕАКЦИИ РАСТЕНИЙ ТОМАТА НА ПРЕДПОСЕВНУЮ ОБРАБОТКУ СЕМЯН ЭКСТРАКТОМ Fucus vesiculosus
Е. Н. Икконен 1, *, Т. Г. Шибаева 1, М. Г. Юркевич 1
1 Институт биологии КарНЦ РАН, ФИЦ “Карельский научный центр РАН”
185910 Петрозаводск, ул. Пушкинская, 11, Россия
* E-mail: likkonen@gmail.com
Поступила в редакцию 15.07.2019
После доработки 07.10.2019
Принята к публикации 10.12.2019
Аннотация
Исследовали влияние предпосевного замачивания семян томата в экстракте бурых водорослей (Fucus vesiculosus L.) на основные физиологические процессы растений томата (рост, фотосинтез, дыхание, водный обмен). Предпосевная обработка семян томата экстрактом бурых водорослей F. vesiculosus в диапазоне концентраций 0.5–50 г/л не оказала значимого влияния на ростовые процессы растений, интенсивность фотосинтеза, устьичную проводимость и транспирацию растений. Использование экстракта в концентрации 5 г/л способствовало повышению эффективности использования растением световой энергии на фотосинтез и снижению доли дыхательных затрат на этот процесс.
ВВЕДЕНИЕ
Одним из критериев продовольственной безопасности является продовольственная независимость страны и ее регионов, для обеспечения которой требуется стабильный и устойчивый рост сельскохозяйственного производства. В зонах рискованного земледелия, к которым относится практически весь Русский Север, для этого существуют объективные препятствия, что связано с экстремальным и неустойчивым климатом, а также низким естественным плодородием почв. Решение задачи повышения производительности сельского хозяйства особенно в условиях Севера может быть связано, наряду с другими мерами, с поиском новых способов повышения эффективности использования почв на основе экологически индифферентных технологий, в том числе при использовании природных мелиорантов биологического происхождения. В этом отношении большим потенциалом в сельскохозяйственном использовании могут обладать бурые морские водоросли из-за значительного содержания в них стимуляторов роста [1].
Благодаря содержанию в своем составе большого спектра фитогормонов (цитокининов, ауксинов, ауксиноподобных веществ, абсцизовой кислоты), бетаинов, стеролов, полисахаридов (фукоидана), полифенолов, витаминов, аминокислот, антибиотиков, микро- и макроэлементов [2, 3], а также возможности улучшения водно-физических свойств и минерального состава почвы [4] применение морских водорослей в сельскохозяйственной индустрии может способствовать повышению продуктивности растений [5], их устойчивости к действию стрессовых факторов различной природы [1], росту урожайности и повышению послеурожайного качества продукции [6].
Север России обладает большим ресурсным потенциалом бурых морских водорослей, которые представлены в основном ламинариями и видами фукусовых, в том числе фукусом пузырчатым (Fucus vesiculosus L.), который является массовым видом литорали Баренцева, Балтийского и Белого морей. В настоящее время российский промышленный промысел F. vesiculosus осуществляется в основном на побережье Белого моря, однако объемы его добычи постоянно снижаются, что возможно связано с невысоким уровнем его вовлечения в инновационное предпринимательство, особенно в сфере сельскохозяйственного производства. Масштабному применению фукуса в растениеводстве должно предшествовать комплексное изучение аграрной результативности его использования, что невозможно без понимания механизмов влияния фукуса на растения и выявления физиологических причин его стимулирующего действия на сельскохозяйственные культуры.
Использование бурых морских водорослей в виде экстрактов или коммерческих продуктов может положительно отразиться на росте и развитии растений, усилить активность фотосинтетического аппарата [5], что было выявлено, в том числе для фукусовых водорослей, в основном на примере аскофиллума узловатого [1]. Вопрос о влиянии F. vesiculosus на физиологическое состояние сельскохозяйственных культур остается открытым, но гипотетически можно предположить, что данный вид водорослей также способен оказывать определенное положительное влияние на интенсивность и эффективность основных физиологических процессов в растениях.
Цель работы – изучение влияния экстракта фукуса пузырчатого различной концентрации на ростовые показатели, фотосинтез и дыхание растений томата. В растениеводстве экстракты водорослей могут использоваться путем внесения в почву, фолиарной обработки растений или предпосевной обработки семян. В данной работе исследовали прием замачивания семян перед посевом как экономически целесообразный.
МЕТОДИКА ИССЛЕДОВАНИЯ
Семена томата (Solanum lycopersicum L., гибрид Верлиока Плюс F1) в течение 3-х сут замачивали в водных экстрактах водорослей (F. vesiculosus), полученных методом мацерации в концентрации 0, 0.5, 5 и 50 г сухой массы/л, контролем служила дистиллированная вода. Пророщенные семена высаживали в сосуды, заполненные смесью торфяного субстрата (PS–2, “Агроторф”) и песка в соотношении 2 : 1. Растения выращивали в камере искусственного климата (ВКШ-73, Россия) при ежедневном поливе, температуре воздуха 23/20°С (день/ночь), фотосинтетически активной радиации (ФАР) 250 мкмоль/м2/с, фотопериоде 16 ч, влажности воздуха 60–70%. Биометрические (высота растения, длина и количество листьев) и физиологические параметры измеряли на растениях в фазе 6–7 листьев. Суммарное содержание хлорофиллов a и б оценивали с помощью измерителя уровня хлорофилла SPAD 502 Plus (Konica Minolta, Osaka, Япония) в условных единицах SPAD. Газообмен, устьичную проводимость и транспирацию определяли с использованием портативной фотосинтетической системы HCM-1000 (Walz, Германия) при температуре листа 13 и 23°С. Все измерения газообмена начинали не ранее чем через 2 ч после наступления у растений светового периода. Видимый фотосинтез (An) листьев измеряли, начиная с ФАР, равной 1000 мкмоль/м2/с, и далее при 60, 40 и 20 мкмоль/м2/с ФАР. При каждой интенсивности ФАР величину газообмена определяли после полной его стабилизации. По окончании измерений газообмена листа на свету растение выдерживали в течение 30 мин в темноте и определяли скорость газообмена при 0 мкмоль/м2/с ФАР, принимая данную величину за дыхание листьев в темноте (Rd). Видимый квантовый выход фотосинтеза (α) и световой компенсационный пункт (СКП) вычисляли по величинам скорости видимого фотосинтеза при 60, 40 и 20 мкмоль/м2/с ФАР [7]. Митохондриальное дыхание листьев на свету (Rl) определено согласно методу Kok [8] экстраполяцией на ось Y (An) прямой линии, аппроксимирующей величины An при 60, 40 и 20 мкмоль/м2/с ФАР. Точка пересечения аппроксимирующей прямой с осью Y отражала величину газообмена при 0 мкмоль/м2/с ФАР и была принята за Rl [9]. Cкорость истинного фотосинтеза (Ag) рассчитывали как сумму An и Rl. Для определения величины отношения сухой массы листа к его площади (LMA, от англ. leaf mass area) высечки листовых пластинок известной площади (2.6 см2) высушивали при 105°С до постоянного веса.
Измерения фотосинтетических параметров, дыхания и водного обмена проводили на завершивших рост 3−4-м листьях. Температурную чувствительность дыхания выражали посредством величины Q10, показывающей во сколько раз изменяется скорость процесса при изменении температуры на 10°С. На рисунках представлены средние величины 6-ти и более биологических повторностей и их стандартные ошибки. Достоверность различий между средними величинами определяли на основе дисперсионного анализа (LSD-тест) с использованием программного обеспечения Statistica (v. 8.0.550.0, “StatSoft, Inc.”). При P < 0.05 различия средних величин считали как достоверные, при P < 0.1 обсуждали тенденцию к изменению параметра.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Обработка семян экстрактом F. vesiculosus слабо повлияла на ростовые процессы растений томата (табл. 1). Можно отметить только тенденцию к увеличению количества листьев с повышением концентрации экстракта. Содержание хлорофилла и величина отношения сухой массы листа к его площади (LMA) возрастали соответственно на 8 и 12% в результате обработки семян экстрактом в концентрации 0.5 г/л. Повышение показателя LMA косвенно отражает утолщение листа, что вместе с увеличением длины и количества листьев может способствовать росту продуктивности целого растения, т.к. фотосинтетические способности растений во многом определяются величиной LMA [10]. Кроме того, изменение LMA может рассматриваться как один из механизмов структурных преобразований, обеспечивающих рост устойчивости растений к ухудшению условий среды [11].
Таблица 1.
Биометрические показатели и содержание хлорофилла в растениях томата при обработке семян экстрактом F. vesiculosus различной концентрации
| Показатель | Концентрации экстракта, г/л | |||
|---|---|---|---|---|
| 0 | 0.5 | 5 | 50 | |
| Высота растения, см | 17.6 ± 0.4a | 18.2 ± 0.4a | 18.3 ± 0.4a | 17.4 ± 0.3a |
| Количество листьев, шт. | 6.3 ± 0.6a | 6.7 ± 0.4a | 6.8 ± 0.3a | 7.0 ± 0.4a |
| Суммарная длина листьев, см | 38.2 ± 2.2a | 40.3 ± 1.3a | 42.4 ± 1.7a | 42.5 ± 2.2a |
| LMA, мг/см2 | 2.52 ± 0.09b | 2.81 ± 0.09a | 2.83 ± 0.09a | 2.56 ± 0.08b |
| Хл, у.е. | 43.8 ± 1.1b | 44.3 ± 1.8b | 47.3 ± 0.6a | 43.8 ± 1.2b |
Обработка семян экстрактом не влияла на скорость видимого фотосинтеза, устьичную проводимость и транспирацию (результаты не представлены), однако способствовала повышению величины видимого квантового выхода фотосинтеза (α). Данный параметр световой кривой фотосинтеза, показывает количество связанного в процессе фотосинтеза СO2 на один квант падающей на растение световой энергии и отражает эффективность использования растением света на фотосинтез [7]. В результате обработки семян экстрактом F. vesiculosus в концентрации 0.5 и 5 г/л величина α листьев томатов повышалась соответственно на 30 (P = 0.011) и 16% (P = 0.087) при температуре измерения 23°С (рис. 1а). Поскольку величина α отражает эффективность фотосинтеза преимущественно при малой и средней интенсивности света, а рост растений происходит чаще всего при потоке света, не достигающем насыщающих фотосинтез величин, величина видимого квантового выхода может определять скорость первичной продукции растений [12]. Поэтому с определенной долей вероятности можно предположить, что повышение эффективности использования энергии света на фотосинтез у томатов в результате обработки семян экстрактом фукуса может быть одним из механизмов, способствующих росту продуктивности растений. К факторам, определяющим изменение параметра α, часто относят преобразования в пигментном комплексе [7]. Например, было выявлено, что у растений затененных местообитаний формирование более мощного пигментного комплекса сопровождалось повышением величины α [7]. Видимо, выявленное в данной работе увеличение содержания хлорофилла (табл. 1) в результате обработки семян способствовало росту показателя α, т.е. повышению эффективности фотосинтетического использования света. Однако данный рост эффективности проявлялся в большей степени при оптимальных температурных условиях, а при кратковременном понижении температуры он был менее выражен. Также следует отметить, что преобразования пигментного комплекса, такие как, например, определенное в данной работе повышение содержания хлорофилла, могут являться частью процесса повышения устойчивости растений к действию неблагоприятных факторов [13]. Поэтому стимулирующее действие обработки семян экстрактом фукуса может проявиться через оптимизацию физиологических процессов роста и развития растений в стрессовых условиях. Однако данное предположение требует дальнейшего исследования и подтверждения.
Рис. 1.
Видимый квантовый выход фотосинтеза (α) – (а), световой компенсационный пункт (СКП) – (б), дыхание на свету (Rl) – (в), дыхание в темноте (Rd) – (г), величина соотношения Rl к Rd (Rl/Rd) – (д), величина соотношения Rd к истинному фотосинтезу (Rd/Ag) – (ж), величина отношения Rl к истинному фотосинтезу (Rl/Ag) – (з) листьев томата, выращенных из семян, обработанных экстрактом F. vesiculosus в концентрации 0 (1), 0.5 (2), 5 (3) и 50 (4) г/л. В пределах каждого показателя разные буквы указывают на достоверность различий средних величин при уровне значимости Р < 0.05.
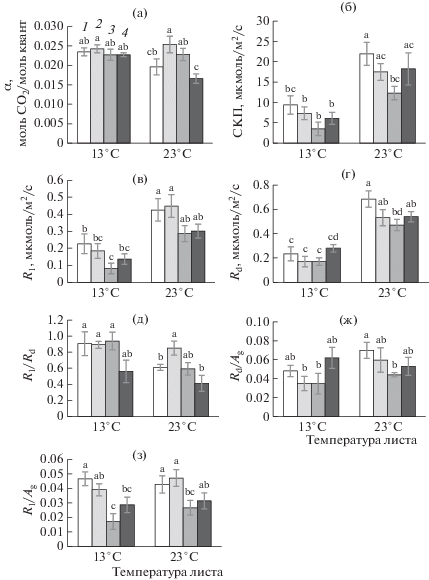
Обработка семян экстрактом в концентрации 5 г/л понижала величину светового компенсационного пункта (СКП) на 43% (P = 0.026) при 23°С (рис. 1б). При температуре измерения 13°С также было выявлено понижение СКП на 60% у растений, выросших из обработанных экстрактом семян, однако данное снижение не было статистически достоверным (Р = 0.300). Снижение СКП, отражающее в определенной мере повышение теневыносливости растений, может быть следствием уменьшения скорости митохондриального дыхания как на свету (Rl), так и в темноте (Rd) (рис. 1в, г). Скорость дыхания на свету, как правило, меньше, чем скорость дыхания в темноте из-за ингибирования процесса светом [14]. Результаты настоящей работы показали, что обработка семян экстрактом F. vesiculosus могла уменьшать степень ингибирования светом дыхания листьев растений, как это было выявлено по повышению величины Rl/Rd (Р = 0.035) при использовании экстракта в концентрации 0.5 г/л при температуре измерения дыхания 23°С (рис. 1д). Однако следует отметить, что при использовании высоко концентрированного экстракта (50 г/л) величина Rl/Rd снижалась независимо от температуры измерения (Р = 0.048 при 13°С и Р = 0.011 при 23°С), что отражало увеличение светового ингибирования дыхания.
Наряду со скоростью, важным показателем процесса дыхания растений является температурный коэффициент Q10, по которому можно судить о зависимости дыхания от изменений температуры. Величина параметра Q10 может меняться в зависимости от воздействующих на растения факторов, отражая определенные преобразования в дыхательном процессе. Ранее было выявлено, что дыхание в темноте в большей степени, чем дыхание на свету, чувствительно к изменению температуры [15], что было подтверждено и результатами настоящей работы (табл. 2). Обработка семян экстрактом F. vesiculosus вызывала увеличение температурной чувствительности Rl, но не Rd.
Таблица 2.
Величина Q10 митохондриального дыхания листьев томатов в темноте (Rd) и на свету (Rl) при предпосевной обработке семян экстрактом F. vesiculosus различной концентрации
| Показатель | Концентрация экстракта, г/л | |||
|---|---|---|---|---|
| 0 | 0.5 | 5 | 50 | |
| Rd | 2.9 | 3.1 | 2.8 | 2.8 |
| Rl | 1.9 | 2.4 | 3.5 | 2.2 |
Соотношение дыхания и фотосинтеза (R/A) является важной характеристикой углеродного баланса растений [16] и показателем сбалансированности у растений основных физиологических процессов − фотосинтеза, дыхания, роста, транспорта ассимилятов и т.п. [17]. Предпосевная обработка семян экстрактом F. vesiculosus способствовала снижению величины отношения дыхания к фотосинтезу у обработанных экстрактом растений, т.е. снижению доли дыхательных затрат от фотосинтеза (рис. 1 ж, з). Например, величина Rd/Ag у растений, обработанных экстрактом с концентрацией 5 г/л была меньше контрольных на 37% (Р = 0.044) при 23°С, а величина Rl/Ag – на 63 и 38% (Р = 0.006 и Р = 0.039) соответственно при 13 и 23°С. Данное снижение доли дыхательных затрат от фотосинтеза как в темноте, так и на свету могло быть вызвано уменьшением энергетических и метаболических запросов растительной клетки. Изменение баланса фотосинтез–дыхание в сторону преобладания поступления ассимилятов как при оптимальных температурных условиях, так и понижении температуры, могло способствовать накоплению растением углеводов и, как следствие, росту продуктивности растений и/или повышению их устойчивости к действию неблагоприятных факторов среды [18].
ВЫВОДЫ
1. Предпосевная обработка семян томата экстрактом бурых водорослей F. vesiculosus не оказывала значимого влияния на ростовые процессы растений, интенсивность фотосинтеза, устьичную проводимость и транспирацию независимо от концентрации экстракта в диапазоне 0.5–50 г/л, но увеличивала содержание в листьях хлорофилла и величину отношения сухой массы листа к его площади при использовании экстракта в концентрации 5 г/л.
2. Снижение скорости дыхания и, как следствие, снижение доли дыхательных затрат от фотосинтеза у растений томата при обработке семян экстрактом F. vesiculosus в концентрации 5 г/л могло способствовать смещению баланса углерода в сторону накопления растениями ассимилятов.
3. Предпосевная обработка семян томата экстрактом F. vesiculosus в концентрации 0.5 г/л снижала степень ингибирования дыхания светом, но высококонцентрированный экстракт (50 г/л) увеличивал данное ингибирование. В результате обработки семян экстрактом F. vesiculosus температурная чувствительность дыхания листьев на свету увеличивалась.
4. В целом результаты выявили стимулирующий эффект влияния предпосевной обработки семян томата экстрактами F. vesiculosus в невысокой концентрации на некоторые физиологические процессы растений.
Список литературы
Khan W., Rayirath U.P., Subramanian S., Jithesh M.N., Rayorath P., Hodges D.M., Critchley A.T., Craigie J.S., Norrie J., Prithiviraj B. Seaweed extract as biostimulants of plant growth and Development // J. Plant Growth Regul. 2009. V. 28. P. 386–399.
Ertani A., Cavani L., Pizzeghello D., Brandellero E., Altissimo A., Ciavatta C., Nardi S. Biostimulant activity of two protein hydrolyzates in the growth and nitrogen metabolism of maize seedlings // J. Plant Nutr. Soil Sci. 2009. V. 172. P. 237–244.
Варзугина М.А., Макарчук Р.Н., Яворский А.С., Николаенко О.А., Куранова Л.К. Фукусовые водоросли Арктического региона – характеристика, направления использования // Изв. высш. учеб. завед. Арктический регион. 2015. № 1. С. 48–53.
Gandhiyappan K., Perumal P. Growth promoting effect of seaweed liquid fertilizer Enteromorpha intestinalis on the sesame crop plant // Seaweed Res. Util. 2001. V. 23. P. 23–25.
Чайкина Е.Л., Герасименко Н.И., Клыков А.Г., Анисимов М.М. Влияние экстрактивных веществ бурой водоросли Laminaria cichorioides Miyabe на рост проростков и продуктивность растений гречихи // Агрохимия. 2015. № 2. С. 94–96.
Panda D., Pramanik K., Nayak B.R. Use of sea weed extracts as plant growth regulators for sustainable agriculture // Inter. J. Bio-resource and Stress Manag. 2012. V. 3. № 3. P. 404–411.
Гармаш Е.В., Головко Т.К. СО2-газообмен и рост Rhaponticum carthamoides в условиях подзоны средней тайги европейского Северо-Востока. 1. Зависимость фотосинтеза и дыхания от внешних факторов // Физиология растений. 1997. Т. 44. № 6. С. 854–863.
Kok B. A critical consideration of the quantum yield of Chlorella-photosynthesis // Enzymologia. 1948. V. 13. P. 1–56.
Ayub G., Zaragoza-Castells J., Griffin K.L., Atkin O.K. Leaf respiration in darkness and in the light under pre-industrial, current and elevated atmospheric CO2 concentrations // Plant Sci. 2014. V. 226. P. 120–130.
Lambers H., Poorter H. Inherent variation in growth rate between higher plants: a search for physiological causes and ecological consequences // Adv. Ecol. Res. 1992. V. 23. P. 187–261.
Poorter H., Niinemets U., Poorter L., Wright I.J., Villar R. Causes and consequences of variation in leaf mass per area (LMA): a meta-analysis // New Phytol. 2009. V. 182. P. 565–588.
Ehleringer J., Björkman O. Quantum yields for CO2 uptake in C3 and C4 plants. Dependence on temperature, CO2 and O2 concentration // Plant Physiol. 1977. V. 59. P. 86–90.
Savitch L.V., Leonardos E.D., Krol M., Jansson S., Grodzinski B., Huner N.P. A., Öquist G. Two different strategies for light utilization in photosynthesis in relation to growth and cold acclimation // Plant Cell Environ. 2002. № 25. P. 761–771.
Гармаш Е.В. Митохондриальное дыхание фотосинтезирующей клетки // Физиология растений. 2016. Т. 63. № 1. С. 17–30.
Atkin O.K., Evans J.R., Ball M.C., Lambers H., Pons T.L. Leaf respiration of snow gum in the light and dark. Interaction between temperature and irradiance // Plant Phys. 2000. V. 122. P. 915–923.
Мурей И.А., Рахманкулова З.Ф. Соотношение фотосинтеза и составляющих дыхания у сахарной свеклы в вегетативную фазу роста растений // Физиология растений. 1990. Т. 37. С. 468–475.
Рахманкулова З.Ф. Физиологические аспекты взаимосвязи фотосинтеза и дыхания // Физиология растений. 2019. Т. 66. № 3. С. 178–188.
Климов С.В. Пути адаптации растений к низким температурам // Усп. совр. биол. 2001. Т. 121. № 1. С. 3–22.
Дополнительные материалы отсутствуют.


