Агрохимия, 2020, № 5, стр. 47-51
ВЛИЯНИЕ АЛЬГИЦИДОВ НА РОСТОВЫЕ ХАРАКТЕРИСТИКИ МИКРОВОДОРОСЛИ Scenedesmus quadricauda (Turpin) Bréb.
А. В. Лиманцев 1, *, М. В. Бидёвкина 1, М. В. Матросенко 1
1 Научно-исследовательский институт дезинфектологии
117246 Москва, Научный проезд, 18, Россия
* E-mail: info@niid.ru
Поступила в редакцию 24.05.2019
После доработки 18.09.2019
Принята к публикации 10.02.2020
Аннотация
Исследовано влияние 2-х альгицидов (бензалкония хлорида и трихлоризоциануровой кислоты) на микроводоросль Scenedesmus quadricauda. Показана высокая эффективность подавления роста микроводоросли в культуре. Выявлены различия токсического действия этих веществ, обсуждаются возможные причины этих различий.
ВВЕДЕНИЕ
Культуру пресноводной хлорококковой микроводоросли Scenedesmus quadricauda (Turp.) Breb. используют в системе природоохранных мероприятий с целью выявления загрязнения (токсичности) водных сред (сточных и природных вод), с ее помощью можно выявлять и уточнять токсичность конкретных веществ и их смесей, например, экстрактов из различных материалов и продуктов, включая радиоактивные [1–9], а также исследовать особенности влияния веществ в сверхмалых (10–9 М/л и ниже) концентрациях [10]. Биотесты на основе изучения реакции Scenedesmus quadricauda применяют для экспериментального установления класса опасности отходов производства [11].
Также эту микроводоросль можно использовать при определении токсических характеристик веществ, предназначенных для целенаправленного уничтожения водорослей, присутствие которых нежелательно. В частности, представляет собой проблему “цветение” воды в открытых и закрытых искусственных водоемах (плавательных бассейнах, аквапарках, аквариумах, фонтанах, декоративных водоемах). Так как размножение клеток является интегральным и адекватным показателем их состояния [12], для определения различных влияний физической или химической природы используют изменения ростовых характеристик культуры водоросли.
Для вре́менного прекращения роста водорослей используют вещества, применяемые в качестве гербицидов в отношении высших растений, имеющие различный механизм действия, в частности, четвертичные аммониевые соединения (ЧАС), а также вещества, содержащие хлор. Для тестирования целевых свойств таких средств нами была применена оценка их влияния на рост культуры Scenedesmus quadricauda. Были проверены 2 средства, предназначенные для предотвращения размножения водорослей в плавательных бассейнах – препараты АAS и MP. В качестве действующего вещества в них использованы соответственно бензалкония хлорид (БХ, алкилдиметил(фенилметил)аммония хлорид, 18%-ный водный раствор) и трихлоризоциануровая кислота (ТХЦК, 95.5% д.в., твердые таблетки).
БХ (мол. м. 340.0 D) представляет собой поверхностно активную четвертичную аммониевую соль, обладающую противомикробной активностью широкого спектра, фунгицидной и фунгистатической, антипротозойной, противовирусной активностью [13]. ПДК БХ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования равна 0.3 г/м3.
ТХЦК (мол. м. 232.4 D) относится к дезинфекционным средствам, активность которых обусловлена образованием в воде хлорноватистой кислоты, в процессе ее распада образуется активная форма кислорода, в результате окисляющего действия которого происходит гибель микробной клетки (в том числе в споровой форме). ТХЦК проявляет также фунгицидную и противовирусную активность. В работе [14] показано, что “пороговые концентрации … ТХЦК … практически совпадают с научно обоснованной величиной ПДК циануровой кислоты в воде водных объектов – 6.0 мг/л”. Можно ожидать, что ПДК ТХЦК будет составлять <1.0 г/м3. Цель работы – исследование альгицидного действия препаратов АAS и MP на культуру Scenedesmus quadricauda.
МЕТОДИКА ИССЛЕДОВАНИЯ
В исследовании применяли альгологически чистую культуру S. quadricauda, выращенную на среде Успенского № 1 [15]. Для культивирования использовали климатостат Р-2 (производство ООО “Омикрон”, Россия). Так как чувствительность S. quadricauda зависит от режима освещения (весна–осень) [1], было использовано стандартное чередование день–ночь по 12 ч (соответствует периоду равноденствия). Освещенность составляла 2.5 кЛк, температура культивирования 20 ± 1°C. Культивирование проводили в пробирках с объемом среды 25 мл. Пробирки прикрывали колпачками из фольги. Равномерность освещения и перемешивание достигали использованием устройств, осуществляющих вращение круглого штатива с пробирками.
Численность клеток определяли методом прямого счета в камере Горяева в 25-ти больших квадратах. Для каждой концентрации препаратов и контроля использовали трехкратную повторность. Каждую повторность подсчитывали в 2-х половинах камеры Горяева.
Для определения альгицидного действия был выбран период наиболее интенсивного размножения клеток (экспоненциальная фаза), поскольку именно в этот период проявляется наибольшая чувствительность культуры к воздействию токсикантов. Альгицидное средство в различных концентрациях добавляли в культуральную среду в фазе экспоненциального роста (недельная культура). Концентрации БХ составляли 0.045, 0.09, 0.45, 0.9, 1.8, 4.5 мг/л (1.3 × 10–7, 2.6 × 10–7, 1.3 × 10–6, 2.6 × 10–6, 5.2 × 10–6, 1.3 × × 10–5 М/л; максимальное разведение 4.5 × 10–8). Испытанные концентрации ТХЦК – 0.095, 0.30, 0.95, 3.0, 9.5, 30.0 мг/л (4.1 × 10–7, 1.3 × 10–6, 4.1 × × 10–6, 1.3 × 10–5, 4.1 × 10–5, 1.3 × 10–4 М/л, максимальное разведение 9.5 × 10–8, использовали ряд Фульда с инкрементом 3.16).
Общую численность клеток выражали в тыс. кл./мл (или в соответствующих десятичных логарифмах). При изучении БХ и ТХЦК начальные концентрации клеток водоросли составили соответственно 34.7 и 20.5 тыс. кл./мл.
Коэффициент ингибирования (Кинг) (в %) вычисляли по формуле:
где N – количество клеток в контроле и опыте. Отрицательные величины коэффициента ингибирования соответствовали активации размножения клеток по отношению к контролю.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Выбранные начальные концентрации клеток входят в диапазон концентраций, рекомендуемых [16]; при дальнейшем увеличении плотности культуры водоросли чувствительность к токсикантам уменьшается, что ранее было показано для меди, хрома, кадмия, цинка, стрептомицина [17, 18].
Исходное состояние культуры определяли темпом размножения клеток водоросли. В контроле начальное время удвоениия (в первые 2-е сут) составляло от 0.8 до 1.3 сут, что указывало на нормальное состояние культуры. Спустя 2 нед скорость размножения уменьшалась, при этом время удвоения составляло от 5 до 9 сут. Численность клеток при этом достигала от 2.4 до 3.7 млн. кл./мл.
Одной из причин замедления скорости размножения клеток S. quadricauda с увеличением их численности является изменение величины рН среды. Например, при рН 7.8 время начального удвоения составило около 1.8 сут, при рН 10.0 – около 9 сут. В контроле рН за 8 сут увеличивался с 7.8 до 10.8 за счет фотосинтеза [19]. Свою роль в ингибировании роста клеток в контроле при продолжительном культивировании могли играть также экзометаболиты.
Культура S. quadricauda состоит из значительной части покоящихся клеток, которые не участвуют в размножении. Доля размножающихся клеток различна в разные фазы развития культуры и при воздействии различных веществ. Именно на них в относительно низких концентрациях оказывают влияние тяжелые металлы [20]. При этом уменьшение численности клеток по отношению к контролю при воздействии токсиканта может происходить не за счет гибели клеток, а вследствие перехода клеток в покоящееся состояние. Дополнительный вклад в уменьшение численности клеток культуры вносит процесс их лизиса.
Полученные результаты указывали на высокую эффективность изученных веществ в плане подавления размножения клеток водоросли (рис. 1). Например, значительное снижение роста водорослей при применении БХ достигалось при его концентрациях между 1.3 × 10–6 и 2.6 × 10–6 М/л и больше. ТХЦК также действовала в микромолярном диапазоне (между 1.3 × 10–6 и 4.1 × 10–6 М/л и больше). То есть максимальная эффективность этих веществ была практически в одном и том же диапазоне концентраций. Однако имелось и важное отличие в их действии на клетки водоросли. Если БХ при высоких концентрациях приводил к полному очищению культуры от клеток, то при максимально высоких испытанных концентрациях ТХЦК оставались жизнеспособные клетки; в присутствии ТХЦК размножение этих клеток не происходило. Численность таких клеток составляла порядка 10–20 тыс./мл и оставалась практически неизменной на протяжении 2-х нед. То есть эффект ТХЦК в значительной степени объясняется альгостатическим действием.
Рис. 1.
Рост культуры водоросли при разных концентрациях БХ (а) и ТХЦК (б). На оси ординат 0 соответствует 1000 кл./мл, единичные клетки или полное их отсутствие условно – логарифму-2.
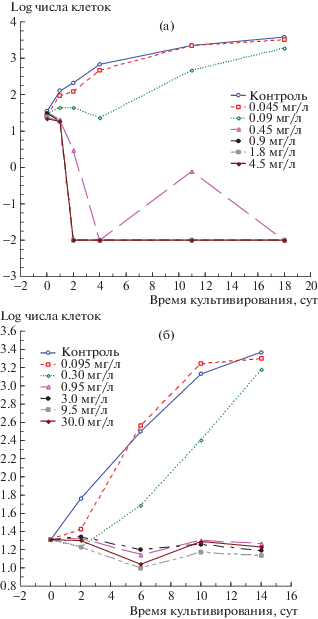
При действии обоих веществ обнаружили явление адаптации клеток к токсикантам. Очень ярко это видно на примере БХ. При концентрации вещества 2.6 × 10–7 М/л было заметно значительное уменьшение скорости роста культуры по сравнению с контролем. Однако между 4-ми и 11‑ми сутками размножение клеток становилось даже более интенсивным по сравнению с контролем. Величины численности клеток на плато в контроле и при воздействии БХ выравнивались. Усиление размножения клеток между 4-ми и 11‑ми сутками наблюдали при более высокой концентрации БХ (1.3 × 10–6 М/л). Однако, в конечном итоге, при такой концентрации токсиканта клетки полностью погибали. В случае ТХЦК также наблюдали процесс адаптации при концентрации 1.3 × 10–6 М/л. При этом вначале происходило торможение роста, хорошо заметное до 2-х суток культивирования, после чего скорость роста становилась практически равной контрольной, а численность клеток спустя 2 нед также достигала уровня контроля. Даже при концентрации ТХЦК 4.1 × 10–7 М/л влияние вещества различалось в разных фазах роста культуры, при этом в течение первых 2-х сут обнаруживалось ингибирование с последующим повышением скорости размножения и достижением контрольной численности клеток в контроле. То есть малые концентрации токсиканта спустя некоторое время вызывали увеличение скорости размножения клеток по сравнению с контролем.
Отмеченные изменения воздействия токсиканта в разных фазах роста культуры были выражены стимуляцией размножения клеток при низких концентрациях и дальнейшем ослаблении размножения при повышении концентрации токсиканта. Такая же закономерность показана для других веществ-поллютантов (например, меди, хрома, серебра; активация роста происходила соответственно при 1.6 × 10–8, 3.4–10.2 × 10–6, 9.2 × 10–10 М/л) [1, 20]. То есть активация размножения клеток может служить показателем токсического действия вещества.
Учет адаптивного влияния низких концентраций токсиканта предполагает использование заведомо токсичных концентраций с целью предотвратить снижение чувствительности популяций микроводорослей к альгициду.
Приведены зависимости ингибирования роста культуры под влиянием БХ и ТХЦК от логарифма концентрации (в тыс. кл./мл) для различных сроков культивирования (рис. 2). Сравнение графиков на рис. 2 указало еще на одно различие влияния БХ и ТХЦК. Например, в случае применения БХ ингибирование роста культуры увеличивалось монотонно по мере возрастания концентрации токсиканта во всем диапазоне времени культивирования, то влияние ТХЦК в начале культивирования практически не зависело от ее концентрации. Это указывало на то, что влияние ТХЦК скорее всего реализуется сложным механизмом, в котором имеется звено, реагирующее по типу “все или ничего” в узком диапазоне концентраций. Причем это звено более чувствительное в сравнении с тем, которое отвечает за “базовую” токсичность. Известно, что ТХЦК содержит в своем составе 3 атома хлора. При растворении ТХЦК в воде хлор отщепляется от молекулы, образуя в воде активный хлор, который оказывает токсическое влияние на водоросль. В то же время при исследованиях на животных не обнаружены значительные различия токсичности между три- и дихлоризоциануровыми кислотами [14]. Возможно, особенность концентрационной зависимости на 2-е сутки культивирования связана не только с отщепляющимся хлором, но и с влиянием собственно молекулы изоциануровой кислоты: известно, что циануровая кислота высокотоксична в отношении ячменя и редиса [21]. Не исключено, что при этом играет роль также динамика освобождения хлора из состава ТХЦК.
Рис. 2.
Зависимость ингибирования роста S. quadricauda от концентрации БХ (а) и ТХЦК (б) при различном времени культивирования водоросли.
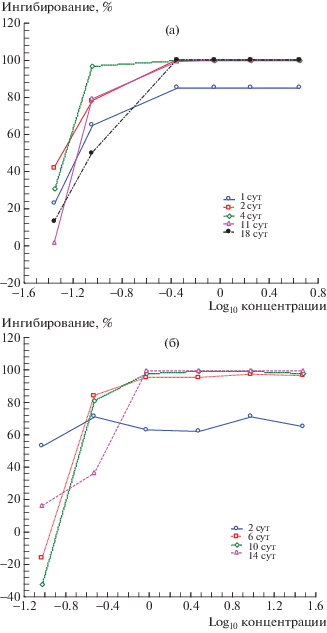
Учитывая, что механизмы действия БХ и ТХЦК различаются, можно ожидать наличие синергичного эффекта при их совместном применении, что можно использовать при создании комплексных альгицидных средств.
Условия культивирования микроводоросли и высших растений близки. При массовом культивированиии микроводоросли Scenedesmus обычно используют те же соли, что и при выращивании высших растений [22]. Это указывает на возможность использования культуры S. quadricauda для тестирования ингибиторов роста (или гербицидов) для высших растений. Данный объект и характеристики его роста можно использовать для экспресс-оценки наличия токсических свойств удобрений, при отборе оптимальных концентраций удобрений и их состава, для контроля эффективности детоксикационных мероприятий, при отборе биостимуляторов и др.
ЗАКЛЮЧЕНИЕ
Таким образом, показано, что, хотя эффективное ингибирование роста культуры микроводоросли Scenedesmus quadricauda испытанными альгицидами достигалось при близких концентрациях, механизм действия этих веществ различался. Например, действие ТХЦК приводило к подавлению размножения клеток. Даже при высоких концентрациях ТХЦК количество клеток водоросли в течение 2-х нед культивирования практически не уменьшалось. В то же время действие БХ приводило не только к прекращению размножения клеток, но и к их полному лизису. Эти особенности следует учитывать при составлении рецептуры альгицидных средств, предназначенных к применению в открытых и закрытых искусственных водоемах.
Список литературы
Джао Ицзюнь. Влияние изменяющихся токсических нагрузок на структурно-функциональные характеристики вродоросли Scenedesmus quadricauda в культуре: Автореф. дис. … канд. биол. наук. М.: МГУ, Биол. фак-т, 1994. 19 с.
Федосеева Е.В., Сапункова Н.Ю., Терехова В.А. Практическая экотоксикология: оценка чувствительности биотест-культур. Уч. пособ. М.: Геос, 2016. 54 с.
Методика определения токсичности вод, водных вытяжек из почв, осадков сточных вод и отходов по изменению уровня флуоресценции хлорофилла и численности клеток водорослей // Федеральный Реестр. ФР.1.39.2007.03223. 2007. 47 с.
Духовная Н.И. Показатели развития фитопланктонных сообществ в водоемах с разным уровнем радиоактивного загрязнения: Автореф. дис. … канд. биол. наук. Урал. научн.-практ. центр радиац. медицины, 2011. 22 с.
Методика определения острой токсичности питьевых, пресных природных и сточных вод, водных вытяжек из почв, осадков сточных вод, отходов по изменению оптической плотности культуры водоросли Сценедесмус (Scenedesmus quadricauda (Turp.) Breb. // ПНД ФТ 14.1:2:4.17-2011. Т 16.1:2:3:3.18-2011. М., 2011. 28 с.
Рябухина Е.В., Фомичева Е.М. Биотестирование и водная токсикология: метод. указания. Ярославль: ЯрГУ, 2012. 53 с.
Оценка токсикологического загрязнения природных вод и донных отложений водных экосистем по коэффициенту регенерации популяции. Рекомендации Р 52.24.695-2007. 20 с.
Ипатова В.И., Дмитриева А.Г., Дрозденко Т.В. Сравнительная токсичность солей и наночастиц серебра для микроводоросли Scenedesmus quadricauda // Токсикол. вестн. 2016. № 2(137). С. 45–51.
Вода. Определение токсичности с использованием зеленых пресноводных одноклеточных водорослей. ГОСТ Р 54496-2011. М., 2011. 58 с.
Маврин Г.В., Смирнова Н.Н., Инюшева А.А., Рощина О.С., Павлова Т.А., Фридланд С.В., Мелко-нян Р.Г. Влияние малых и сверхмалых концентраций соединений Этафосф, Амидофосф и Анифосф на динамику численности тест-объектов Daphnia magna Straus и микроводоросли Scenedesmus quadricauda // Экол. промышл. произ-ва. 2014. № 2(86). С. 39–43.
Об утверждении критериев отнесения опасных отходов к классу опасности для окружающей природной среды. Приказ Министерства природных ресурсов и экологии РФ от 15июня 2001 г., № 511. 8 с.
Прохоцкая В.Ю. Структурно-функциональные характеристики модельной популяции Scenedesmus quadricauda при интоксикации: Автореф. дис. … канд. биол. наук. М.: МГУ, Биол. фак-т, 2000. 24 с.
Яремчук А.А., Хишова О.М., Половко Н.П. Микробиологическое обоснование использования бензалкония хлорида в мягкой лекарственной форме для наружного применения // Вестн. фармации. 2012. № 2(56). С. 39–45.
Печникова И.А. Сравнительная оценка токсичности и опасности сим-триазинов в воде на примере производных циануровой кислоты и меламина: Дис. … канд. мед. наук. М.: НИИ экологии человека и гигиены окружающей среды им. А.Н. Сысина РАМН, 2013. 133 с.
Успенская В.И. Экология и физиология питания пресноводных водорослей: М.: Изд-во МГУ, 1966. 124 с.
Ипатова В.И. Влияние размера популяции тест-объекта Scenedesmus quadricauda (Turpin) Bréb. на результаты биотестирования // Вопр. совр. альгологии. 2017. № 1(13). С. 8.
Franklin N.M., Stauber J.L., Apte S.C., Lim R.P. Effect of initial density on the bioavailability and toxicity of copper in microalgal bioassays // Environ. Toxicol. Chem. 2000. V. 21. P. 742–751.
Vasseur P., Pandard P., Burnel D. Influence of some experimental factors on metal toxicity to Selenastrum capricornutum // Toxic Assess. 1988. V. 3. P. 331–343.
Шавырина О.Б. Токсичность меди для культуры зеленой водоросли Scenedesmus quadricauda при флуктуациях уровня активной реакции среды (pH) // Международ. журн. прикл. и фундамент. исслед-й. 2016. № 4-4. С. 741–743.
Марушкина Е.В. Исследование состояния популяции водоросли Scenedesmus quadricauda в норме и при интоксикации методом микрокультур: Автореф. дис. … канд. биол. наук. М.: МГУ, Биол. фак-т. 2005. 21 с.
The Merck Index. 9th ed. Rahway, New Jersey: Merck & Co., Inc., 1976. 351 p.
Карякин Д.О., Мальцевская Н.В., Новичева М.В., Кулабухов В.Ю. Оптимизация питательной среды для культуры Scenedesmus sp. // Международ. научн.-исслед. журн. 2017. № 8(62). Ч. 2. С. 10–15.
Дополнительные материалы отсутствуют.


