Агрохимия, 2020, № 5, стр. 62-71
ОСОБЕННОСТИ ФОРМИРОВАНИЯ ФИТОСАНИТАРНОЙ СИТУАЦИИ И ЭФФЕКТИВНОСТЬ СРЕДСТВ ЗАЩИТЫ РАСТЕНИЙ ПРОТИВ КОЛОРАДСКОГО ЖУКА И РИЗОКТОНИОЗА В ПОСАДКАХ ЦВЕТНЫХ СОРТОВ КАРТОФЕЛЯ
А. А. Малюга 1, *, Н. С. Чуликова 1, Н. Н. Енина 1
1 Сибирский научно-исследовательский институт земледелия и химизации сельского хозяйства СФНЦА РАН
630501 Новосибирский р-н, Новосибирская обл, р.п. Краснообск, Россия
* E-mail: anna_malyuga@mail.ru
Поступила в редакцию 29.12.2019
После доработки 29.01.2020
Принята к публикации 10.02.2020
Аннотация
Представлены данные об особенностях формирования фитосанитарной ситуации в посадках цветных сортов картофеля (Purple Majesty, Vitelotte и Фиолетовый) в отношении ризоктониоза и колорадского жука в условиях Западной Сибири. Более всего повреждались вредителем растения сорта Vitelotte (33.2–63.9%), менее – сортов Purple Majesty и Фиолетовый (16.0–36.3 и 28.6–55.0% соответственно). Наименьшая численность гриба R. solani в почве отмечена в посадках сорта Фиолетовый (33.3 пропагулы/100 г почвы), у сортов Purple Majesty и Vitelotte данный показатель был равен 40.4–41.5 пропагулы/100 г почвы. Развитие заболевания на растениях сорта Vitelotte было равно 22.3–44.8, сорта Фиолетовый – 27.0–53.0, сорта Purple Majesty – 45.5–47.8%. Распространенность склероциальных форм черной парши на клубнях сорта Purple Majesty составила 44.5, Фиолетовый – 39.0, Vitelotte – 28.9%. Протравливание клубней перед посадкой препаратом селест Топ сократило численность колорадского жука практически до нуля, а опрыскивание посадок препаратом фастак в период вегетации – в 1.5 раза на сортах Purple Majesty и Vitelotte, и в 2.7 раза на сорте Фиолетовый. Протравливание семенных клубней перед посадкой препаратом селест Топ позволило существенно снизить количество выпадов всходов и развитие ризоктониоза на растениях в период вегетации.
ВВЕДЕНИЕ
Вредители и болезни растений, сорные растения наносят огромный экономический ущерб деятельности человека в сельском и лесном хозяйствах. По данным ФАО, потери урожая сельскохозяйственной продукции, несмотря на предпринимаемые человечеством меры по ее защите, достигают 30% [1].
Один из наиболее эффективных, экологически безопасных и экономически выгодных способов стабилизации фитосанитарного состояния посадок картофеля – правильно подобранный сорт, который за счет своих биологических особенностей и антропогенных воздействий полностью реализует свой потенциал в почвенно-климатических условиях региона возделывания. Защита растений является одним из важных резервов в повышении урожайности картофеля и качества полученной продукции. Однако реакция сортов на средства химизации может быть различной, т.к. они по-разному реагируют на вред, наносимый им фитофагами и фитопатогенами [2, 3]. Сорта, обладая неравноценной устойчивостью к воздействию вредящих организмов, специфичностью экологических связей с окружающей средой, требуют индивидуального подхода при выборе каждого агротехнического приема выращивания, в том числе и к системе защитных мероприятий [4, 5].
Стремясь к получению стабильно высоких урожаев картофеля надлежащего качества при снижении затрат на их производство и уменьшении отрицательных действий на окружающую среду, необходимо связать в единое целое преимущества современных сортов, адаптированных агротехнических приемов возделывания, методов биологической и химической борьбы с вредными организмами. Определив основные закономерности этих взаимодействий и их параметры, можно определить роль каждого используемого приема в их изменении, что позволит создать эффективные технологии как с экономической, так и с экологической точки зрения.
Биоэкологические особенности основных организмов, вредящих картофелю в условиях Западной Сибири, таковы, что использование отдельных защитных мероприятий малоэффективно. В этом случае необходим комплексный подход в борьбе c ними, включающий в себя использование сортов, агротехнических мероприятий, и инсектицидов нового поколения. Использование этих базовых элементов позволит оптимизировать фитосанитарную ситуацию при производстве картофеля в условиях региона, в том числе и цветных сортов.
В последнее десятилетие можно наблюдать мощный всплеск новых селекционных направлений. Довольно популярное среди них – работа с сортами картофеля, характеризующимися разноцветной мякотью: фиолетовой, красной, синей, розовой и оранжевой. Самыми первыми представили подобные сорта сотрудники южнокорейского Национального университета Кангвона на Международном конгрессе и отраслевой выставке в 2007 г. Сегодня разноцветный картофель выращивают и селекционируют во многих странах мира [6].
Селекционным материалом для картофеля, содержащего антоцианы, стали подвиды картофеля, в диком виде произрастающие на территории Южной Америки. Клубни этих растений тоже окрашены в разные цвета, но характеризуются мелкими размерами. Удивительную цветовую гамму обусловливает биохимический состав картофеля. В разноцветных клубнях крахмала меньше, чем в белых, зато содержится больше инулина. Основное отличие, впрочем, другое: в цветных клубнях присутствуют каротиноиды, флавоноиды и антоцианы. В клубнях с белой мякотью содержится 50–100 мг каротиноидов/100 г картофеля, с ярко-желтой – до 200 мг. Оранжевые и красные внутри клубни включают больше всего этого вещества – 509–2000 мг. В красных, фиолетовых или синих клубнях в 2 раза больше флавоноидов, чем в желтых или белых.
Клубни с фиолетовой мякотью – богатый источник антоцианов, в частности, их ацилированных производных. У сортов картофеля обнаружены производные антоцианидинов – петунидина, пеларгонидина, пеонидина и мальвидина. В окрашенных клубнях содержание антоцианов сопоставимо с таковым в чернике, ежевике, клюкве и красном винограде – культур, в которых эти соединения синтезируются в наибольшем количестве. При этом флавоноиды в основном накапливаются в картофельной кожуре, богатой веществами, которые представляют фармакологический интерес. Важно, что после кулинарной обработки количество антоцианов либо снижается незначительно, либо не изменяется. То же происходит и при хранении картофеля [7, 8].
Клинические исследования в США показали, что наличие таких растительных пигментов дает возможность при регулярном употреблении в пищу разноцветного картофеля заметно снизить развитие атеросклероза и онкологических заболеваний, улучшить зрение и укрепить стенки кровеносных сосудов. Сок некоторых сортов разноцветного картофеля обладает антибактериальными свойствами. Эти сорта употребляют только сырыми, в качестве лекарства при заболеваниях желудочно-кишечного тракта [9–13].
Было замечено, что цветные сорта картофеля более устойчивы к неблагоприятным погодным условиям. Их чаще выращивают в северных районах США, Канады, в Скандинавии и даже на Аляске. Все они ранние или среднеранние, со сроком сбора урожая от 70 до 100 сут после посадки, что позволяет им созреть в суровых северных условиях [14–16]. Селекция цветных сортов – привилегия не только Кореи, им занимаются и в США, и в России, и в ближнем зарубежье [6, 17, 18].
Несмотря на возрастающую популярность цветных сортообразцов, работ по изучению фитосанитарного состояния в отношении болезней грибной этиологии и вредителей, а также разработке систем рационального применения современных средств защиты растений в посадках подобных сортов в нашей стране и мире практически нет. Например, характеристика цветного сорта Фиолетовый ограничивается информацией о его умеренной устойчивости к ризоктониозу и парше обыкновенной [18]. Окраска кожуры клубня цветных сортов картофеля (розовая, красная, красно-, сине- и темно-фиолетовая), мякоти клубня (красная и фиолетовая, сплошная или очаговая, разной насыщенности), глазков и цветков (красная и синяя, неодинаковой интенсивности), листьев и стеблей (от слабой до очень интенсивной) обусловлена антоцианами. Данные пигменты участвуют в защите фотосинтетического аппарата и цитоплазматической мембраны клетки, нейтрализуют свободные радикалы, предохраняя от их неблагоприятного воздействия, повышают эффективность усвоения фосфора и азота, способствуют усилению осморегулирующей функции, снижают температуру замерзания содержимого клетки, обеспечивают хелатирование и секвестирование ионов тяжелых металлов. Эти свойства в том или ином сочетании позволяют растениям приспособиться к неблагоприятным условиям – избыточному УФ-излучению, засухе, экстремальным температурам, засолению почвы, дефициту фосфора и азота, токсическому действию гербицидов и ионов тяжелых металлов [7]. Также антоцианы обладают антимикробной активностью [19, 20]. Например, показан их существенный вклад в устойчивость картофеля к “черной ножке” – гнили Pectobacterium carotovorum: на срезах клубней с фиолетовой мякотью площадь поражения была в среднем на 28.6% меньше, чем у картофеля с желтой мякотью [21]. В растительных тканях в зоне инфицирования происходило быстрое окисление фенольных соединений, в том числе антоцианов, с последующей лигнификацией, суберинизацией и программируемой гибелью клеток.
Из потребительских качеств картофеля как продовольственной культуры наибольшее значение имеет содержание антоцианов в клубнях и особенно в их мякоти. Известно, что антоцианы, поступающие с растительной пищей, могут предупреждать сердечно-сосудистые заболевания, сахарный диабет II типа, артрит, ожирение, патологии зрения, различные виды рака и нейродегенеративные заболевания, обладают противовоспалительным действием. Молекулярные механизмы, лежащие в основе этих свойств, до конца не ясны [7, 9, 12, 13].
Для Западной Сибири сорта цветного картофеля являются новыми, и характеристика фитосанитарной ситуации в их посадках в литературных источниках отсутствует. В связи с вышесказанным, цель работы – выявить закономерности формирования фитосанитарной ситуации в посадках цветных сортов картофеля и определить биологическую эффективность химических препаратов в отношении колорадского жука и ризоктониоза.
МЕТОДИКА ИССЛЕДОВАНИЯ
Методологической основой работы был системно-альтернативный подход, реализованный в 2-факторном полевом эксперименте [22]. Исследование проведено на полях стационара СибНИИЗиХ СФНЦА РАН Новосибирской обл., почвенно-климатические условия которого типичны для лесостепной зоны Западной Сибири. Основные элементы технологии возделывания картофеля соответствуют общепринятым для данного района [23]. Агротехника картофеля включала зяблевую безотвальную обработку, ранневесенее боронование, культивацию (15–20 см), нарезку гребней. Посадку клубней производили в борозды с последующим закрытием почвой. Уход за посадками включал гербицидные и междурядные обработки, окучивание, обработки в период вегетации против вредителей и болезней. Перед уборкой была проведена десикация ботвы препаратом реглон Супер, ВР (150 г/л, норма расхода 2 л/га). Уборку проводили картофелекопалкой. Опыт закладывали согласно методике проведения полевых исследований [24].
Для изучения особенностей формирования фитосанитарной ситуации в посадках цветных сортов картофеля в отношении колорадского жука и ризоктониоза 1/3 площади посадок была обработана в фазах всходов и созревания инсектицидом на основе альфа-циперметрина (препарат фастак, КЭ, 100 г/л, норма расхода 0.1 л/га), вторая часть посадок была защищена от колорадского жука и ризоктониоза путем протравливания посадочных клубней инсектофунгицидом на основе тиаметоксама, дифеноконазола и флудиоксонила (препарат селест Топ, КС, 262.5 г/л + + 25 г/л + 25 г/л, норма расхода 0.4 л/т) [25]. Третью часть возделываемого картофеля выращивали без защитных мероприятий (контроль). В опыте изучали 3 цветных сорта картофеля: Purple Majesty, Vitelotte и Фиолетовый.
Повторность опыта двухкратная, количество растений в повторности – 20 шт. Густота посадки – 35.7 тыс. растений/га, площадь питания – 0.4 × × 0.7 м.
Эксперимент проводили на фоне естественного заселения посадок колорадским жуком (Leptinotarsa decemlineata Say.) и естественном инфекционном фоне ризоктониоза (Rhizoctonia solani Kühn.).
Наблюдения за фенологией растений и колорадского жука, а также динамикой численности вредителя и степенью поврежденности им растений вели в полевых условиях по общепринятым методикам [26–29]. Учеты проводили еженедельно в течение всего периода вегетации картофеля. Определяли численность имаго, кладок яиц, личинок вредителя, без удаления их с растений. Учет пораженности растений картофеля ризоктониозом проводили через 4, 10 нед после посадки культуры по методике [30]. Уборка картофеля была сплошной, урожайность определяли весовым методом [27].
Статистическая обработка полученных данных проведена с помощью пакета прикладных программ СНЕДЕКОР [31].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Развитие колорадского жука на сортах Purple Majesty, Vitelotte и Фиолетовый было сходно. В условиях региона вредитель развивается на растениях картофеля цветных сортов в 2-х поколениях (2-е – неполное). Первые перезимовавшие имаго на посадках картофеля появлялись во 2-й декаде июня, где они питались до 3-й декады июля. После непродолжительного питания они приступали к откладке яиц в 3-й декаде июня. Яйцекладка продолжалась до 1-й декады августа. Отрождение личинок в среднем отмечено через 7 сут от момента обнаружения первой яйцекладки. Данный процесс начинался с начала 1-й декады июля и заканчивался в 3-й декаде августа (после десикации растений). На окукливание личинки уходили со 2-й декады июля. К 3-й декаде июля заканчивалось развитие 1-го поколения, и начинался выход имаго нового поколения. Имаго 1-го поколения активно питались на растениях картофеля и через несколько суток приступали к спариванию и откладке яиц. Яйцекладка продолжалась с 1-й по 3-ю декаду августа. На момент десикации картофеля на растениях преобладали личинки 3–4-го возраста, имаго 1-го поколения и яйцекладки (табл. 1).
Таблица 1.
Фенокалендарь развития колорадского жука на цветных сортах картофеля (средние за 2017–2019 гг.)
| Месяц | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| май | июнь | июль | август | ||||||
| декада | |||||||||
| 3-я | 1-я | 2-я | 3-я | 1-я | 2-я | 3-я | 1-я | 2-я | 3-я |
| Первое поколение | |||||||||
| (+) | (+) | (+) | |||||||
| + | + | + | + | + | |||||
| * | * | * | * | * | |||||
| – | – | – | – | – | – | ||||
| 0 | 0 | 0 | 0 | 0 | |||||
| + | + | + | + | ||||||
| (+) | |||||||||
| Второе поколение | |||||||||
| * | * | * | |||||||
В посевах всех цветных сортов картофеля зафиксированы 2 пика подъема численности фитофага (имаго и личинок всех возрастов) (рис. 1а). Первый пик был связан с массовым отрождением личинок и в основном зафиксирован в фазе цветения. Второй пик фитофага приходился на время фазы созревания культуры, и он в основном определялся массовым выходом имаго летнего поколения из почвы (несмотря на то, что в посадках в этот момент присутствовали и личинки). Численность первых перезимовавших имаго, появившихся в 3-й декаде июня на сортах Purple Majesty, Vitelotte и Фиолетовый, составила 0.1‒0.3 экз./растение. Максимальное количество личинок на сортах Purple Majesty и Vitelotte отмечено в фазе цветения картофеля (1-я декада июля) – от 4 до 5.3 экз./растение, а на сорте Фиолетовый – в фазе созревания (2-я декада июля) – 6.8 экз./растение.
Рис. 1.
Изменение численности колорадского жука в течение вегетации (имаго и личинки всех возрастов), экз./растение (а) и ее влияние на степень повреждения растений цветных сортов картофеля, % (б) (средние за 2017–2019 гг.).
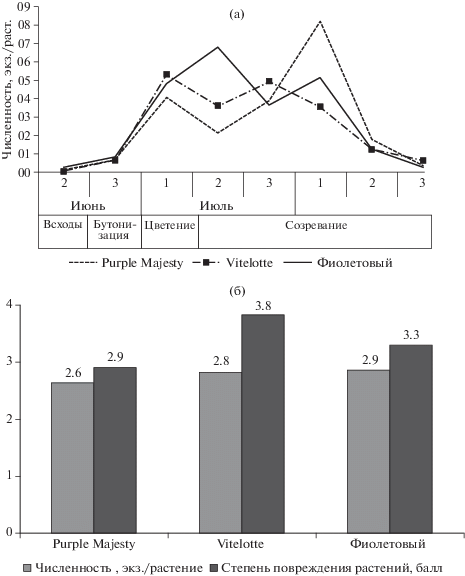
Следующий максимум численности насекомых (имаго и личинок) был зафиксирован в фазе созревания: на сорте Vitelotte (3-я декада июля) – 4.9, на сортах Фиолетовый и Purple Majesty (1-я декада августа) – 5.1 и 8.2 экз./растение соответственно. В среднем за вегетационный период существенной разницы в численности вредителя между цветными сортами не отмечено (рис. 1б).
Степень повреждения растений напрямую зависела от численности колорадского жука на растениях картофеля. Более всего повреждались растения сорта Vitelotte (3.8 балла или 33.2–63.9%). У сортов Purple Majesty и Фиолетовый степень повреждения растений была меньше (2.9 балла или 16.0–36.3% и 3.3 балла или 28.6–55.0% соответственно).
Помимо колорадского жука в Западной Сибири одним из самых вредоносных заболеваний является ризоктониоз или черная парша картофеля. Клубни цветных сортов поражаются в условиях Западной Сибири как несклероциальными, так и склероциальными формами ризоктониоза (табл. 2). На клубнях сортов Purple Majesty и Фиолетовый из первых форм преобладают сетчатый некроз и углубленная пятнистость: соответственно 86.5–89.4 и 10.2–18.3%. На сорте Vitelotte распространенность этих форм существенно меньше – 60.4 и 0.4%. На двух первых сортах также присутствуют трещины и уродливость, вызванные наличием на клубнях гриба R. solani. В то же время сорт Vitelotte данными формами не поражается.
Таблица 2.
Распространенность форм ризоктониоза на клубнях картофеля цветных сортов в лесостепи Западной Сибири (средние за 2017–2019 гг.), %
| Формы ризоктониоза | Сорт | ||
|---|---|---|---|
| Purple Majesty | Vitelotte | Фиолетовый | |
| Несклероциальные формы | |||
| Сетчатый некроз | 86.5 | 60.4 | 89.4 |
| Углубленная пятнистость | 18.3 | 0.4 | 10.2 |
| Трещины | 4.1 | 0 | 4.7 |
| Уродливость | 0.4 | 0 | 1.3 |
| Склероциальные формы | |||
| Всего | 44.5 | 28.9 | 39.0 |
| Склероции на 1/10 поверхности клубня | 36.1 | 23.5 | 35.7 |
| Склероции на 1/4 поверхности клубня | 7.7 | 5.4 | 3.3 |
| Склероции на 1/2 поверхности клубня | 0.7 | 0 | 0 |
Клубни всех 3-х сортов в значительной степени заселяются склероциями. В большей степени этому подвержен сорт Purple Majesty, для которого распространенность склероций на клубнях составляла 44.5%, далее шел сорт Фиолетовый – 39.0 и менее всего склероции встречались на сорте Vitelotte – 28.9%.
Рассматривая динамику численности гриба R. solani в почве, необходимо отметить ее различия в зависимости от сорта (рис. 2а). Например, в почве под посевом сорта Purple Majesty наблюдали 2 пика численности гриба, первый из которых (48.7 пропагул/100 г почвы) был отмечен в период полных всходов, а второй (57.2 пропагулы/100 г почвы) в конце фазы созревания культуры. В то же время у сортов Vitelotte и Фиолетовый был один пик численности (соответственно 59.0 и 49.1 пропагулы/100 г почвы) в конце фазы созревания.
Рис. 2.
Динамика численности R. solani в почве под посевами цветных сортов картофеля (а) и развитие ризоктониоза на растениях этих сортов (б) (средние за 2017–2018 гг.).
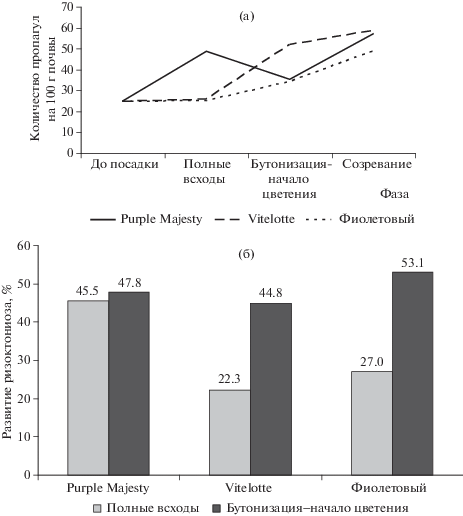
Наименьшая численность гриба R. solani в почве в среднем за период вегетации была отмечена под сортом Фиолетовый, она составила 33.3 пропагулы/100 г почвы. У сортов Purple Majesty и Vitelotte данный показатель соответственно был равен 41.5 и 40.4 пропагулы/100 г почвы.
В первых фазах онтогенеза более всего поражались ризоктониозом растения сорта Purple Majesty, где развитие болезни достигало 45.5%. Два остальных сорта в период всходов были поражены болезнью в значительно меньшей степени: развитие заболевания на растениях сорта Vitelotte составило 22.3, на сорте Фиолетовый – 27.0% (рис. 2б).
Подобные различия в патогенезе возбудителя на растениях картофеля цветных сортов объяснимы различиями в численности возбудителя в почве. Это связано с тем, что в условиях Западной Сибири, в патологическом процессе ризоктониоза наибольшее значение играет почвенная инфекция (доля влияния почвенной популяции возбудителя превышает влияние семенной в 1.5–2.0 раза), поэтому и развитие заболевания на стеблях картофеля в большей степени зависит от численности Rhizoctonia solani в почве.
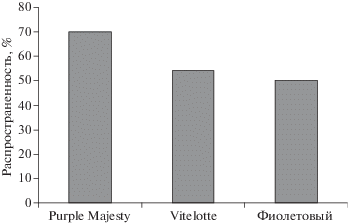
Интенсивность патологического процесса ризоктониоза на растениях цветных сортов картофеля за счет почвенной инфекции в условиях Западной Сибири подтверждена значительным распространением на стеблях “белой ножки” (рис. 3).
Рис. 3.
Распространенность “белой ножки” на растениях цветных сортов картофеля в период вегетации (средние за 2018–2019 гг.), %.
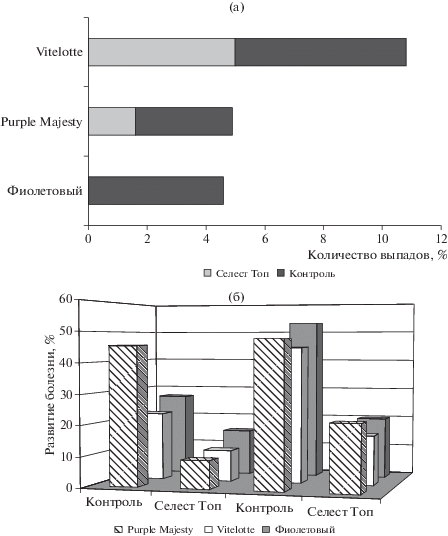
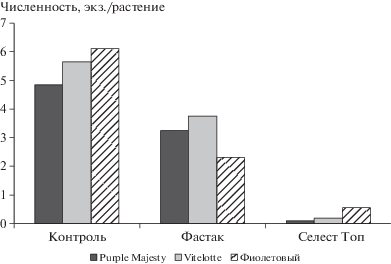
Протравливание клубней перед посадкой препаратом селест Топ или опрыскивание посадок препаратом фастак в период вегетации позволило сократить численность вредителя в первом случае практически до нуля, а во втором – в 1.5 раза на сортах Purple Majesty и Vitelotte, и в 2.7 раза на сорте Фиолетовый (рис. 4).
Рис. 4.
Влияние средств защиты растений на среднюю численность колорадского жука в течение вегетации (средние за 2017–2018 гг.), экз./растение.
Протравливание семенных клубней перед посадкой препаратом селест Топ позволило существенно снизить количество выпадов всходов и развитие ризоктониоза на растениях в период вегетации (рис. 5).
ЗАКЛЮЧЕНИЕ
В посевах всех цветных сортов картофеля зафиксированы 2 пика подъема численности колорадского жука (имаго и личинок всех возрастов), которые отмечены в фазах цветения и созревания культуры. Максимальное количество вредителя было в периоды цветения и созревания картофеля – от 4.0 до 8.2 экз./растение. В среднем за вегетационный период существенной разницы в численности вредителя между цветными сортами не было. Степень повреждения растений напрямую зависела от численности колорадского жука на растениях картофеля. Более всего были повреждены растения сорта Vitelotte (3.8 балла или 33.2–63.9%). У сортов Purple Majesty и Фиолетовый степень повреждения растений была меньшей (2.9 балла или 16.0–36.3% и 3.3 балла или 28.6–55.0% соответственно).
Численность гриба R. solani в почве зависела от сорта картофеля. В почве под посевом сорта Purple Majesty наблюдали 2 пика численности гриба, первый из которых (48.7 пропагул/100 г почвы) был отмечен в период полных всходов, второй (57.2 пропагулы/100 г почвы) – в конце фазы созревания культуры. В то же время в почве под посевами сортов Vitelotte и Фиолетовый был один пик численности гриба (соответственно 59.0 и 49.1 пропагулы/100 г почвы) в конце периода созревания. Наименьшая численность гриба R. solani в почве в среднем за период вегетации была отмечена под сортом Фиолетовый, она составила 33.3 пропагулы/100 г почвы. У сортов Purple Majesty и Vitelotte данный показатель соответственно достиг 41.5 и 40.4 пропагулы/100 г почвы.
Цветные сорта картофеля поражались различными формами ризоктониоза. На клубнях сортов Purple Majesty и Фиолетовый преобладают сетчатый некроз и углубленная пятнистость, соответственно 86.5–89.4 и 10.2–18.3%. На клубнях сорта Vitelotte распространенность этих форм инфекции была существенно меньше – 60.4 и 0.4%. Клубни всех 3-х сортов в значительной степени заселялись склероциями (распространенность на сорте Purple Majesty составила 44.5, Фиолетовый – 39.0, Vitelotte – 28.9%). В первых фазах онтогенеза более всего поражались ризоктониозом растения сорта Purple Majesty, где развитие болезни достигало 45.5%. Развитие заболевания на растениях сорта Vitelotte составило 22.3, Фиолетовый – 27.0%.
Различия в патогенезе возбудителя на растениях картофеля цветных сортов объяснимы различиями в численности возбудителя в почве. Это связано с тем, что в условиях Западной Сибири в патологическом процессе ризоктониоза наибольшее значение играет почвенная инфекция (доля влияния почвенной популяции возбудителя превышает влияние семенной в 1.5–2.0 раза), поэтому и развитие заболевания на стеблях картофеля в большей степени зависит от численности Rhizoctonia solani в почве.
Протравливание клубней перед посадкой препаратом селест Топ или опрыскивание растений препаратом Фастак в период вегетации сократило численность вредителя в первом случае практически до нуля, во втором – в 1.5 раза на сортах Purple Majesty и Vitelotte, и в 2.7 раза – на сорте Фиолетовый. Протравливание семенных клубней перед посадкой препаратом селест Топ позволило существенно снизить количество выпадов всходов и развитие ризоктониоза на растениях в период вегетации.
Список литературы
Долженко В.И. Повысить фитосанитарную безопасность Российской Федерации // Защита и карантин растений. 2011. № 2. С. 4–7.
Власенко Н.Г., Тепляков Б.И., Теплякова О.И. Роль азотных удобрений и фунгицидов в повышении урожайности сортов яровой пшеницы // Докл. РАСХН. 2004. № 4. С. 25–28.
Власенко Н.Г., Тепляков Б.И., Теплякова О.И. Эффективность азотных удобрений и фитосанитарных средств при возделывании яровой пшеницы // Докл. РАСХН. 2007. № 1. С. 26–28.
Захаренко В.А. Проблемы научного обеспечения защиты растений // Проблемы оптимизации фитосанитарного состояния растениеводства: Сб. тр. Всерос. съезда по защите растений. СПб., 1997. С. 25–34.
Жученко А.А. Стратегия адаптивной интенсификации растениеводства // Докл. РАСХН. 1999. № 2. С. 5–11.
Старостина Л. Популярное в селекции: картофель с антоцианом // Аgritimes.ru. 2014 [Электр. ресурс]. 2018. Режим доступа: http://www.agritimes.ru/articles/1536/populyarnoe-v-selekcii-kartofel-s-antocianom/ (Дата доступа 25.10.2018).
Стрыгина К.В., Хлесткина Е.К. Синтез антоцианов у картофеля (Solanum tuberosum L.): генетические маркеры для направленного отбора (обзор) // Сел.-хоз. биол. 2017. Т. 52. С. 37–49.
Jensen G., Flame W. Coloured potatoes (Solanum tuberosum L.) – anthocyanin content and tuber quality // Genet. Res. Crop Ev. 2006. V. 53(7). P. 1321–1331.
Pęksa A., Kita A., Kułakowska K., Aniołowska M., Hamouz K., Nemś A. The quality of protein of coloured fleshed potatoes // Food Chem. 2013. № 141(3). P. 2960–2966.
Rytel E., Tajner-Czopek A., Aniołowska M., Hamouz K. The influence of dehydrated potatoes processing on the glycoalkaloids content in coloured-fleshed potato // Food Chem. 2013. № 141(3). P. 2495–2500.
Rytel E., Tajner-Czopek A., Kita A., Aniołowska M., Kucharska A.Z., Sokół-Łętowska A., Hamouz K. Content of polyphenols in coloured and yellow fleshed potatoes during dices processing // Food Chem. 2014. № 161. P. 224–229.
Lee W., Yeo Y., Oh S., Cho K.S., Park Y.E., Park S.K., Lee S.M., Cho H.S., Park S.Y. Compositional analyses of diverse phytochemicals and polar metabolites from different-colored potato (Solanum tubersum L.) tubers / Food Sci. Biotechnol. 2017. № 26(5). P. 1379–1389.
Oertel A., Matros A., Hartmann A., Arapitsas P., Dehmer K.J., Martens S., Mock H.P. Metabolite profiling of red and blue potatoes revealed cultivar and tissue specific patterns for anthocyanins and other polyphenols // Planta. 2017. № 246(2). P. 281–297.
Lachman J., Hamouz K. Red and purple coloured potatoes as a significant antioxidant source in human nutrition – a review // Plant Soil Environ. 2005. № 51(11). P. 477–482.
Nems A., Peksa A., Kucharska A.Z., Sokół-Łetowska A., Kita A., Drozdz W., Hamouz K. Anthocyanin and antioxidant activity of snacks with coloured potato // Food Chem. 2015. № 172. P. 175–182.
Киру С.Д., Мелешин А.А., Апшев Х.Х. И вкус, и цвет // Растениеводство. 2016. № 1. С. 14–15.
Аникиенко Е. “Арап” из пробирки. Челябинские селекционеры вывели “противораковую” фиолетовую картошку // Южноуральская панорама. 2017. [Электр. ресурс]. Режим доступа: https://up74.ru/articles/obshchestvo/94124/ (Дата доступа 25.10.2018).
Каталог сортов картофеля: ВНИИКХ. 2018 [Электр. ресурс]. Режим доступа: http://www.kartofel.org/cultivars/main_cult/sorta.htm (Дата доступа 25.10.2018).
Cisowska A., Wojnicz D., Hendrich A.B. Anthocyanins as antimicrobial agents of natural plant origin // Nat. Prod. Commun. 2011. V. 6(1). P. 149–156.
Wen H., Kang J., Li D., Wen W., Yang F., Hu H., Liu C. Antifungal activities of anthocyanins from purple sweet potato in the presence of food preservatives // Food Sci. Biotechnol. 2016. V. 25(1). P. 165–171.
Wegener C.B., Jansen G. Soft-rot resistance of coloured potato cultivars (Solanum tuberosum L.): the role of anthocyanins // Potato Res. 2007. V. 50. Is. 1. P. 31–44.
Кирюшин В.И. Методологическая концепция развития земледелия в Сибири: Метод. рекоменд. Новосибирск, 1989. 45 с.
Машьянова Г.К., Гринберг Е.Г., Штайнерт Т.В. Овощные культуры и картофель в Сибири. Новосибирск, 2010. 523 с.
Доспехов Б.А. Методика полевого опыта (с основами статистической обработки результатов исследований): Учеб-к для студ. Высш. сел.-хоз. уч. завед-й по агроном. специальностям. М., 2012. 351 с.
Список пестицидов и агрохимикатов разрешенных к применению на территории Российской Федерации. М., 2017. 944 с.
Методика исследований по культуре картофеля. М.: НИИКХ, 1967. 264 с.
Методические рекомендации по оценке устойчивости картофеля к колорадскому жуку. М., 1987. 31 с.
Методические рекомендации по проведению исследований влияния трансгенных сортов картофеля на жизнедеятельность и микроэволюционные преобразования колорадского жука. СПб.–Пушкин, 2001. 19 с.
Методические рекомендации по индикации и мониторингу процессов адаптации колорадского жука к генетически модифицированным сортам картофеля. СПб., 2005. 48 с.
Frank J., Leach S.S., Webb R.E. Evaluation of potato clone reaction to Rhizoctonia solani // Plant Dis. Reporter. 1976. V. 60. № 11. P. 910–912.
Сорокин О.Д. Прикладная статистика на компьютере. 2-е изд. Новосибирск, 2012. 282 с.
Дополнительные материалы отсутствуют.