Агрохимия, 2021, № 10, стр. 68-73
Оценка защитного действия биофунгицидов и их влияние на рост проростков в начальный период онтогенеза яровой пшеницы
С. В. Бурлакова 1, Н. Г. Власенко 1, *
1 Сибирский федеральный научный центр агробиотехнологий РАН
630501 Новосибирская обл., пгт. Краснообск, Россия
* E-mail: vlas_nata@ngs.ru
Поступила в редакцию 20.03.2021
После доработки 20.04.2021
Принята к публикации 12.07.2021
Аннотация
Результаты сравнительной оценки воздействия обработки семян препаратами Триходермин, Споробактерин на проростки яровой пшеницы сорта Новосибирская 31 показали, что в условиях лабораторного эксперимента эффективность препаратов против семенной инфекции составила 12, 24% соответственно. В полевых условиях препараты подавили развитие корневых гнилей в фазе 4-х листьев на 61.5 и 61.56%, в фазе кущения – на 35.4 и 77.1% соответственно. Показано незначительное увеличение длины проростка (на 4%) при обработке семян Триходермином и достоверный рост корней на 6.6% при применении Споробактерина в лабораторном опыте. В условиях полевого эксперимента обработка семян препаратами Триходермин и Споробактерин повышала полевую всхожесть на 4.8 и 17.1%, длину проростка – на 1.7 и 5.1% относительно контроля. Существенное влияние на увеличение длины корня оказывал препарат Споробактерин – на 7.1% относительно контроля. Низкий уровень варьирования показателей длины проростка и корня (11.0 и 8.4%) при применении Споробактерина был сопряжен с получением высокой прибавки урожая – 0.52 т/га, при более высоком уровне варьирования (14.7 и 9.7%) при обработке семян Триходермином была получена прибавка 0.40 т/га. Эффект воздействия обработок семян биофунгидными препаратами, выявленный в опыте, а именно влияние на величину варьирования размеров органов проростков может быть положен в основу предварительной оценки их действия на урожайность культуры на ранних фазах онтогенеза.
ВВЕДЕНИЕ
Прорастание семян, когда их питательные вещества претерпевают значительные качественные изменения, является одним из критических периодов онтогенеза, оказывающим влияние на все этапы роста и развития растения [1].
Такие показатели оценки посевных свойств семян, как всхожесть, энергия прорастания и др. не могут в полной мере объективно отражать их способность формировать полноценные посевы и высокий урожай сельскохозяйственных культур, поскольку они не дают исчерпывающую информацию, касающуюся морфологической сформированности и физиологической подготовленности зародыша к активному росту [2]. Для полной характеристики урожайных свойств семенных партий необходимо использовать параметры, показывающие степень развитости органов проростков, размер варьирования которых в значительной степени отражает те внутрисортовые модификации, которые сложились при формировании этих семян на материнском растении в конкретных агроэкологических условиях [3] и которые будут влиять на мощность, выравненность полевых всходов и урожайность будущих посевов. В настоящее время установлены связи между различными морфологическими, физическими и физиолого-биохимическими показателями семян и урожайностью их посевов. Для этого использованы методы оценки посевных и урожайных свойств семян, а также изучен процесс формирования органов проростков семян, таких как длина колеоптиля, проростка, корней, поскольку было установлено, что именно эти органы оказывают основное влияние на показатель полевой всхожести, мощности и дружности всходов, а степень их варьирования – на выявление сортов, обладающих более высокой урожайностью [4, 5]. Коэффициенты корреляционной зависимости величины урожайности с параметрами развития органов проростков значительно выше, чем урожайности с параметрами посевных качеств семян [6].
Улучшить посевные качества семян можно предпосевной обработкой семян биологическими препаратами. Одним из преимуществ бактериальных препаратов, например на основе Bacillus subtilis, является то, что, будучи продуцентами фитогормонов, они обладают способностью мобилизовать фосфаты, имеют отличную адаптивность и способны выживать в неблагоприятных условиях [7]. Bacillus spp. выделяют несколько метаболитов, которые запускают рост растений и предотвращают заражение патогенами [8]. На различных сортах пшеницы, ячменя, гороха, кукурузы их применение способствует увеличению всхожести на 5–10%, энергии прорастания – на 6–10%, наземной массы растений – на 11–23%, уменьшению количества деформированных проростков – на 8–12% и положительно сказывается на формировании корневой системы растения, масса которой увеличивается на 14–36% [9], сбор зерна при обработке семян препаратом на основе Bacillus subtilis увеличивался от 0.28 до 0.71 т/га [10]. Грибы рода Trichoderma обладают способностью производить антибиотики, паразитировать на других грибах и конкурировать с вредными микроорганизмами, они оказывают благотворное влияние на рост и развитие растений [11]. Улучшение роста растений может быть реализовано с помощью нескольких механизмов, которые включают микопаразитизм, антибиотическое действие, деградацию токсинов, инактивацию патогенных ферментов, устойчивость к патогенам, повышенное поглощение питательных веществ, улучшение развития корневой системы [12, 13]. Это приводит к более эффективному использованию азота, фосфора, калия и микроэлементов и улучшает рост проростков [14]. Предпосевная обработка семян пшеницы Триходермином обеспечивала рост числа продуктивных стеблей на 3.5%, количества зерен в колосе – на 7.1%, массы 1000 зерен – на 2.3%, сбора зерна повысился на 0.76 т/га относительно контроля (3.48 т/га) [15]. Кроме того, Trichoderma может секретировать ауксины, гиббереллины, цитокинины, абсцизовую кислоту и этилен, которые являются растительными гормонами и отвечают за рост и развитие растений [16].
Цель работы – оценка влияния обработки семян яровой пшеницы биофунгицидами Триходермин и Споробактерин на фитосанитарное состояние семян и посевов яровой пшеницы, ростовые процессы в начале онтогенеза в условиях лабораторного и полевого опытов.
МЕТОДИКА ИССЛЕДОВАНИЯ
В эксперименте использовали естественно зараженные семена яровой мягкой пшеницы сорта Новосибирская 31. Схема опытов включала следующие варианты обработки семян: 1 – контроль без обработки семян, 2 – Триходермин, П (Trichoderma viride, титр >6 млрд спор/г), норма расхода – 15 кг/т семян, 3 – Споробактерин, СП (Bacillus subtilis + Trichoderma viride, штамм 4097), норма расхода – 0.5 кг/т семян.
В лабораторном опыте оценивали воздействие биофунгицидов на энергию прорастания, всхожесть семян пшеницы методом проращивания в растильнях в четырехкратной повторности [17], а также влияние препаратов на развитие болезней семян [18], на биометрические показатели проростков в фазе 2–3-х листьев [19].
Полевой опыт закладывали в 2020 г. в четырехкратной повторности после парового предшественника. Посев осуществляли 14 мая сеялкой СЗС-2,1 c анкерными сошниками с нормой высева 6 млн всхожих зерен/га. Площадь делянки 14.7 м2. В полевом эксперименте учитывали полевую всхожесть пшеницы в фазе 2-го листа, измеряли длину проростков, листьев, стеблей и корней каждого отдельного проростка в фазе 2–3-х листьев, учитывали пораженность растений корневыми гнилями в фазе 4-х листьев и в кущение [19]. Урожайность учитывали прямым комбайнированием, урожай приводили к 100%-ной чистоте и 14%-ной влажности.
Вариационный и дисперсионный анализ экспериментальных данных проводили с помощью прикладной программы Снедекор [21].
Метеоусловия вегетационного периода 2020 г. существенно отличались от среднемноголетних показателей по температурному режиму и количеству выпавших осадков. Май текущего сезона особенно выделялся температурой и режимом увлажнения. Температура воздуха в этом месяце превысила среднемноголетнюю норму на 6.2°С. Количество выпавших осадков превысило норму в 1.5 раза. В июне температура была на уровне среднемноголетней, а количество выпавших осадков в среднем за месяц было меньше нормы в 2.4 раза. В июле температурный режим превысил среднемноголетние показатели на 0.6°С, а осадков выпало в 1.2 раза больше нормы. Август был достаточно теплым: температура воздуха превысила среднемноголетние показатели на 2.8°С. Приход атмосферной влаги в первой декаде месяца был в 1.7 раза меньше нормы, а во второй декаде осадков выпало в 2.2 больше среднемноголетних.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Фитосанитарная диагностика семенного материала выявила 50%-ную пораженность проростков пшеницы контрольного образца грибковыми инфекциями, в том числе: Bipolaris sorokiniana – 4, Alternaria spp. – 30, Penicillium spp. – 16%, и 29%-ную – бактериальной. При обработке семян Триходермином проростки не были поражены гельминтоспориозной и фузариозной инфекцией, степень поражения плесневой и бактериальной микрофлорой была меньше контрольных показателей на 2 и 3% соответственно. Биологическая эффективность против грибковых инфекций составила 12, бактериальной – 10.3%. Препарат Споробактерин оказывал слабое влияние на Alternaria spp., но биологическая эффективность против комплекса грибных инфекций составила 24%, в то время как бактериальную микрофлору этот препарат не подавлял. При этом число здоровых растений в вариантах применения Триходермина и Споробактерина возросло на 10 и 21% относительно контроля.
При выращивании яровой пшеницы сорта Новосибирская 31 после пара степень поражения посевов яровой пшеницы корневой гнилью была невысокой в начальные фазы развития культуры – 1.3% и 4.8% соответственно в фазах 4-х листьев и кущения. Биологическая эффективность предпосевной обработки семян Триходермином и Споробактерином в фазе 4-х листьев составила 61.5%, в фазе кущения эффект от применения Споробактерина оказался выше в 2.2 раза, чем в варианте с Триходермином, и составил 77% (табл. 1).
Таблица 1.
Влияние предпосевной обработки семян биофунгицидами на пораженность растений яровой пшеницы корневой гнилью, %
| Вариант | Первичные корни | Вторичные корни | Эпикотиль | Основание стебля | Среднее развитие болезни | Распростра-ненность | Биологическая эффективность |
|---|---|---|---|---|---|---|---|
| Фаза 4-х листьев | |||||||
| Контроль | 1.5 | 1.0 | 1.0 | 1.6 | 1.3 | 96 | – |
| Триходермин | 1.0 | 0.1 | 0.5 | 0.4 | 0.5 | 98 | 61.5 |
| Споробактерин | 1.5 | 0.1 | 0.3 | 0.2 | 0.5 | 95 | 61.5 |
| Фаза кущения | |||||||
| Контроль | 5.6 | 8.1 | 2.0 | 3.5 | 4.8 | 99 | – |
| Триходермин | 3.6 | 5.8 | 1.4 | 1.7 | 3.1 | 98 | 35.4 |
| Споробактерин | 1.2 | 2.6 | 0.5 | 0.2 | 1.1 | 93 | 77.1 |
В условиях лабораторного опыта в вариантах, где использовали биофунгициды Триходермин и Споробактерин, было 1% непроросших и 2% загнивших семян, в то время как в контроле было 3% загнивших семян. Энергия прорастания семян увеличилась на 3% при их обработке Триходермином и снизилась на 1% в варианте Споробактерин (рис. 1а). На 7-е сут всхожесть при применении Триходермина повысилась еще на 2% относительно контроля, в варианте применения Споробактерина – была на его уровне. В условиях полевого опыта ростостимулирующее действие предпосевной обработки семян Триходермином и Споробактерином проявилось в увеличении полевой всхожести семян на 4.8 и 17.1% соответственно (рис. 1б).
Рис. 1.
Влияние обработок семян яровой пшеницы биофунгицидами: (а) – на энергию прорастания (σ = 4.0) и всхожесть (σ = 4.0). (б) – на полевую всхожесть (σ = 28.4). (в) – на длину проростка (σ = 0.29), листа (σ = 0.29), стебля (σ = 0.66). (г) – на длину корня (σ = 0.78). (д) – на длину проростка (σ = 0.30), листа (σ = 0.4), стебля (σ = 0.16). (е) – на длину корня (σ = 0.24).
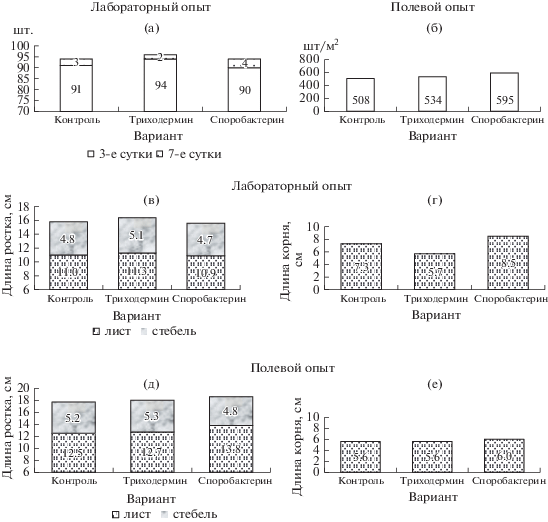
В лабораторных условиях отмечали рост длины листа и проростка в варианте с Триходермином – на 2.7 и 3.8% относительно контроля и ингибирование ростовых процессов в варианте со Споробактерином – на 0.9 и 1.3% (рис. 1в). Обработка семян Триходермином оказала ингибирующее действие на корневую систему, длина корней была на 21.9% меньше, чем в контроле, а Споробактерин, напротив, стимулировал их рост на 16.4% (рис. 1г).
В условиях полевого опыта отмечали усиление активности ростовых процессов в варианте с Триходермином – на 1.6–1.7%, со Споробактерином – на 10.4 и 5.1% соответственно относительно контролей (рис. 1д). По воздействию на рост корней отметили следующее: при применении Триходермина длина корней была на уровне контроля, при использовании Споробактерина рост составил 7.1% (рис. 1ж).
Оценка разности средних по t-критерию Стьюдента показала, что в условиях лабораторного опыта ни одна из обработок семян не оказывала существенного воздействия на проросток, при этом изменчивость признака была сильной – 26.7–29.4% (табл. 2). На формирование корневой системы достоверное влияние оказала обработка семян пшеницы препаратом Споробактерин (tфакт = = 28.57 при tтеор = 1.98), изменчивость признака также была сильной – 32.4%.
Таблица 2.
Влияние препаратов на изменчивость показателей роста растений пшеницы в начале онтогенеза
| Препарат | Статистический показатель | ||||
|---|---|---|---|---|---|
| средняя длина, см/шт. (доверительный интервал, х ± tSх), см | среднее квадратичное отклонение (S), % | коэффициент вариации V, % | относительная ошибка выборки, Sх, % | критерий Стьюдента, tф095 и tтеор. | |
| Лабораторный опыт | |||||
| Длина проростка (n = 100) | |||||
| Контроль | 15.8 ± 3.5 | 4.22 | 26.7 | 2.7 | – |
| Триходермин | 16.4 ± 3.8 | 4.83 | 29.4 | 2.9 | – |
| Споробактерин | 15.6 ± 3.4 | 4.20 | 27.0 | 2.7 | – |
| Длина корней (n = 300) | |||||
| Контроль | 7.3 ± 2.3 | 2.76 | 37.9 | 3.8 | – |
| Триходермин | 5.7 ± 2.1 | 2.52 | 43.9 | 4.4 | – |
| Споробактерин | 8.5 ± 2.3 | 2.74 | 32.4 | 3.2 | 28.6 ≥ 2.0 |
| Полевой опыт | |||||
| Длина проростка (n = 100) | |||||
| Контроль | 17.6 ± 2.0 | 2.53 | 14.4 | 1.4 | – |
| Триходермин | 18.0 ± 2.1 | 2.64 | 14.7 | 1.5 | – |
| Споробактерин | 18.2 ± 1.5 | 5.10 | 11.0 | 1.1 | 3.2 ≥ 2.0 |
| Длина корней (n = 300) | |||||
| Контроль | 5.60 ± 0.40 | 0.48 | 8.5 | 0.9 | – |
| Триходермин | 5.63 ± 0.45 | 0.55 | 9.7 | 1.0 | – |
| Споробактерин | 5.97 ± 0.43 | 0.50 | 8.4 | 0.8 | 29.0 ≥ 2.0 |
В условиях полевого опыта изменчивость показателей длины проростка и корней была меньше – от 11.0 до 14.7% и от 8.4 до 9.7% соответственно. Существенное воздействие на оба показателя отмечали при применении Споробактерина (tфакт = 3.17 и tфакт = 29.02 при tтеор = 1.98). При этом изменчивость показателя длины проростка при использовании Споробактерина снизилась до 11.0%, а длины корней – до 8.4%.
Анализ развития растений пшеницы на начальных этапах онтогенеза позволил выявить некоторые закономерности изменения урожайности в вариантах опыта (табл. 3). Например, отметили сопряженность низкого уровня варьирования показателей длины проростка и корней (11.0 и 8.4%) при обработке семян Споробактерином с получением наибольшей прибавки урожайности зерна – 0.52 т/га. При повышении уровня варьирования до 14.7 и 9.7% в варианте, где применяли Триходермин, урожайность увеличилась на 0.40 т/га по сравнению с контролем.
Таблица 3.
Урожайность яровой пшеницы в зависимости от развития растений в начальный период роста
| Вариант | Длина проростка | Длина корней | Урожайность | Прибавка | ||
|---|---|---|---|---|---|---|
| $\bar {X}$, см | V, % | $\bar {X}$, см | V, % | т/га | ||
| Контроль | 17.6 | 14.4 | 5.6 | 8.5 | 1.81 | – |
| Триходермин | 20.0 | 14.7 | 5.6 | 9.7 | 2.21 | 0.40 |
| Споробактерин | 18.2 | 11.0 | 6.0 | 8.4 | 2.33 | 0.52 |
| НСР05 | 0.26 | |||||
ЗАКЛЮЧЕНИЕ
В условиях лабораторного и полевого экспериментов воздействие биологических препаратов на рост растений пшеницы на начальных этапах органогенеза различалось. Например, в лабораторном опыте наблюдали только стимуляцию роста корней при применении Споробактерина. В полевом опыте в этом варианте отмечали аналогичное воздействие, но также выявили достоверное влияние на рост надземной части растений.
Учет параметров роста надземных и подземных органов проростков и их варьирования, установленные на ранних этапах органогенеза яровой пшеницы, может быть положен в основу предварительной оценки влияния препаратов на урожайность культуры.
Список литературы
Левина Н.С., Тертышная Ю.В., Бидей И.А., Елизарова О.В., Шибряева Л.С. Посевные качества семян мягкой яровой пшеницы (Triticum aestivum L.) при разных режимах воздействия низкочастотным электромагнитным полем // Сел.-хоз. биол. 2017. Т. 52. № 3. С. 580–587. https://doi.org/10.15389/agrobiology.2017.3.580rus
Макрушин Н.М. Экологические основы промышленного семеноводства зерновых культур. М.: Агропромиздат, 1985. 280 с.
Ларионов Ю.С. Современное семеноводство, семеноведение и их теоретические аспекты // Проблемы аграрного сектора Южного Урала и пути их решения: Сб. научн. тр. ЧГАУ. Челябинск, 2000. С. 19–31.
Сосненко С.В. Определение урожайных свойств семян яровой пшеницы на основе оценки органов проростков: Автореф. дис. … канд. с.-х. наук. Курган: Курган. ГСХА им. Т.С. Мальцева, 2002. 17 с.
Ткачева З.Г. Влияние биологически активных веществ на посевные и урожайные свойства семян яровой пшеницы сорта Казахстанская раннеспелая // Проблемы аграрного сектора Южного Урала и пути их решения: Сб. научн. тр. / Под ред. Липпа В.А. Челябинск: ЧГАУ, 2002. С. 51–55.
Бутковская Л.К., Кузьмин Д.Н., Агеева Г.М. Оценка урожайных свойств партий семян сортов яровой пшеницы по параметрам органов проростков в условиях Красноярской лесостепи // Достиж. науки и техн. АПК. 2019. Т. 33. № 7. С. 37–40. https://doi.org/10.24411/0235-2451-2019-10709
Кузьмина Л.Ю., Архипова Т.Н. Колонизация ризосферы пшеницы штаммами Bacillus subtilis с различным уровнем продукции цитокининов // Вестн. Башкир. ун-та. 2014. Т. 19. № 3. С. 848–851.
Radhakrishnan R., Hashem A., Abd_Allah E.F. Bacillus: A Biological tool for crop improvement through bio-molecular changes in adverse environments // Front. Physiol. 2017. V. 8(1). P. 1–14. https://doi.org/10.3389/fphys.2017.00667
Захарова Н.Г., Сираева З.Ю., Демидова И.П., Егоров С.Ю. Создание биопрепаратов, перспективных для сельского хозяйства // Учен. зап. Казан. ун-та. Сер. Естеств. науки. 2006. № 2. С. 102–111.
Коробов В.А., Леляк А.И., Леляк А.А. Эффективность препарата на основе бактерий р. Bacillus в борьбе с корневыми гнилями яровой пшеницы // Защита и карантин раст. 2014. № 11. С. 31–32.
Harman G.E., Howell C.R., Viterbo A., Chet I., Lorito M. Trichoderma species – opportunistic, avirulent plant symbionts // Nat. Rev. Microbiol. 2004. V. 2. P. 43–56. https://doi.org/10.1038/nrmicro797
Harman G.E. Overview of mechanisms and uses of Trichoderma spp. // Phytopathology. 2006. V. 96 (2). P. 190–193. https://doi.org/10.1094/PHYTO-96-0190
Lorito M., Woo S.L., Harman G.E., Monte E. Translational research on Trichoderma: from omics to the field // Ann. Rev. Phytopathol. 2010. V. 48. P. 395–417. https://doi.org/10.1146/annurev-phyto-073009-114314
Mastouri F., Bjorkman T., Harman G.E. Seed treatment with Trichoderma harzianum alleviates biotic, abiotic, and physiological stresses in germinating seeds and seedlings // Phytopathology. 2010. V. 100 (11). P. 1213–1221. https://doi.org/10.1094/PHYTO-03-10-0091
Применение биофунгицидов на яровой пшенице в 2020 году. 25.09.2020. ФГБУ Россельхозцентр. URL: https://rosselhoscenter. com/index.php/ otchjoty-4/24306-primenenie-biofungitsidov-na-yarovoj-pshenitse-v-2020-godu (Дата обращения 25.03.2021).
Корнилова Н.А., Марквичев Н.С. Ростстимулирующее действие грибов рода Trichoderma // Усп. в химии и хим. технол. 2011. Т. 25. № 10 (126). С. 61–65.
ГОСТ 12038-84. Семена сельскохозяйственных культур. Методы анализа: Сб. ГОСТов. М.: ИПК Издательство стандартов, 2004. 47 с.
ГОСТ 12044-93. Семена сельскохозяйственных культур. Методы определения зараженности болезнями. М.: Стандартинформ, 2011. 55 с.
Торопова Е.Ю., Кириченко А.А. Фитосанитарный экологический мониторинг. Методические указания к лабораторно-практическим занятиям и контрольной работе. Новосибирск: НГАУ, 2012. 38 с.
ГОСТ 10842-89. Зерно зерновых и бобовых культур и семена масличных культур. Метод определения массы 1000 зерен или 1000 семян. М.: ИПК Изд-во стандартов, 1990. 4 с.
Сорокин О.Д. Прикладная статистика на компьютере. 2-е изд. Новосибирск, 2012. 282 с.
Дополнительные материалы отсутствуют.


