Агрохимия, 2021, № 3, стр. 51-59
Оценка влияния засоления на аллелопатическую активность микромицетов в дерново-подзолистой почве
А. О. Герасимов 1, *, Ю. М. Поляк 1
1 Санкт-Петербургский научно-исследовательский центр экологической безопасности РАН
197110 Санкт-Петербург, Корпусная ул., 18, Россия
* E-mail: recchi@rambler.ru
Поступила в редакцию 03.03.2020
После доработки 04.04.2020
Принята к публикации 10.12.2020
Аннотация
В условиях полевого опыта проведено исследование влияния хлоридного засоления на фитотоксичность дерново-подзолистой суглинистой почвы и аллелопатическую активность почвенных микромицетов. Показано, что фитотоксичность почвы, подвергшейся засолению, может быть связана не только с ингибирующим действием солей на развитие растений, но и с биологически активными вторичными метаболитами токсигенных видов микроскопических грибов. При засолении почвы в сообществе почвенных микроорганизмов возрастала доля микромицетов-токсинообразователей, обладающих высокой аллелопатической активностью, что приводило к перестройке микробного сообщества и оказывало негативное действие на растения.
ВВЕДЕНИЕ
Загрязнение почв солями различного вида и происхождения является одним из основных антропогенных факторов, негативно влияющих на окружающую среду. В настоящее время порядка 1/4 всех почв Земли в той или иной степени засолена. Различают первичное засоление (природное) и вторичное – вызванное деятельностью человека. К факторам, определяющим развитие первичного засоления почв, относят особенности климата, рельефа, дренированность территории, засоленность почвообразующих и подстилающих пород, наличие минерализованных грунтовых вод.
Вторичное засоление почв чаще всего является результатом неправильного режима орошения в растениеводстве. Вторичное засоление – один из главных деградационных процессов, определяющих экологическое состояние земель [1]. Помимо сельскохозяйственной деятельности, заметную роль в засолении различных природных ландшафтов играют соли противогололедных средств, попадающие в почвы вместе со снегом и накапливающиеся в них.
Засоление территорий приводит к сокращению биоразнообразия и снижению продуктивности агро- и биоценозов, ухудшению почвенных условий, подавлению роста и репродукции растений [2, 3]. Среди возможных последствий засоления – изменение химического состава почв и нарушение их физических характеристик, что может привести к структурным и функциональным трансформациям почвенных экосистем и грозит гибелью растениям и почвенной микробиоте [4].
Засоление влияет на биомассу микроорганизмов и их метаболическую активность. Известно, что почвенная микробиота первой реагирует на различные виды загрязнения, при этом уже на начальных стадиях загрязнения могут изменяться состав, численность микроорганизмов, их метаболизм и активность почвенных ферментов [5]. Высокий уровень засоления почвообразующих субстратов сдерживает формирование микробного блока в молодых почвах. Кроме того, в засоленных почвах уменьшается интенсивность некоторых микробиологических процессов [6].
Токсичность загрязненных почв может быть вызвана не только непосредственно действием поллютантов, но также обусловливаться токсинами, выделяемыми представителями почвенного микробного сообщества [7]. Токсины (биологически активные вторичные метаболиты) образуют многие виды почвенных микроорганизмов. Как вещества, обладающие ингибирующими свойствами, микробные токсины играют важную роль в аллелопатических взаимодействиях, происходящих в почве.
Термин “аллелопатия”, происходящий от древнегреческих слов ἀλλήλων (“взаимно”) и πάθος (“страдание”), впервые употребил в 1937 г. Ханс Молиш для описания биохимических взаимодействий, при которых растения ингибируют рост соседних растений [8]. В последующие годы формулировка понятия аллелопатия несколько раз незначительно изменялась.
Применительно к нашему исследованию, под аллелопатией следует понимать биологическое явление, с помощью которого организм вырабатывает определенные химические соединения, влияющие на прорастание, рост, выживание и размножение других организмов в фитоценозах. Эти соединения известны как аллелопатически активные вещества и могут воздействовать на другие организмы благоприятно (стимулировать – положительная аллелопатия) или пагубно (подавлять – отрицательная аллелопатия).
Образование аллелопатически активных веществ обусловлено как биотическими (патогены, паразиты, вредители растений, взаимодействие с другими растениями), так и абиотическими факторами (температура, водный стресс, дефицит фосфора и влаги) [9]. К аллелопатическим взаимодействиям способны многие растения и микроорганизмы. Среди микроорганизмов образовывать аллелопатические соединения могут представители самых разных таксономических групп, но фитотоксические свойства чаще других проявляют почвенные микромицеты [10]. Известно множество видов токсинобразующих микромицетов, распространенных в почвенных экосистемах, относящихся к родам Aspergillus, Penicillium, Fusarium, Triсhoderma, Botrytis и др. [11, 12].
Среди 4-х групп веществ, ответственных за аллелопатию – выделяемые микроорганизмами антибиотики (для подавления жизнедеятельности других микроорганизмов) и маразмины (для подавления высших растений), а также выделяемые растениями фитонциды (для подавления микроорганизмов) и колины (для подавления других растений) [13].
Следует отметить, что аллелопатические взаимодействия являются важным фактором в успехе многих инвазионных видов растений, таких как борщевик, пятнистый василек, чесночница черешчатая, казуарина. В то же время многие исследователи до сих пор рассматривают аллелопатию как обычную форму экологической конкуренции между организмами в биоценозах [8].
В настоящее время известно значительное число работ, посвященных использованию явления аллелопатии в сельском хозяйстве (влиянию сорняков на сельскохозяйственные культуры, посевов на сорняки, а также сельскохозяйственных культур друг на друга) [14]. В них рассматривается, в частности, возможность использования аллелопатически активных веществ в качестве регуляторов роста и естественных гербицидов в целях содействия сельскому хозяйству. Однако изучение аллелопатических эффектов, возникающих в почве при засолении, до настоящего времени не проводили, что обусловило новизну и актуальность данного исследования. Цель работы – изучение аллелопатических свойств микобиоты засоленной почвы и оценка влияния хлоридного засоления на фитотоксичность и уровень аллелопатической активности микроорганизмов-токсинобразователей.
МЕТОДИКА ИССЛЕДОВАНИЯ
Натурный мелкоделяночный эксперимент был заложен на территории опытного поля Аграрного университета (г. Пушкин). Объектом исследования служила дерново-подзолистая суглинистая почва на карбонатной морене (Eutric Albic Retisol (abrupt, loamic, aric, ochric)). Содержание органического углерода в почве составляло 2.9%, доступного фосфора – 175 мг/кг, калия – 250 мг/кг, pH 6.8. В начале вегетационного сезона (в мае) в исследованную почву вносили в растворенном виде хлорид натрия в концентрациях 20, 50 и 150 г/м2. В конце вегетационного сезона (конец сентября) отбирали образцы почвы для анализа. Полученные результаты сравнивали с показателями незагрязненных контрольных образцов.
Показателем содержания растворенных солей в почвах служила электрическая проводимость водных вытяжек из почвенных образцов (соотношение почва : дистиллированная вода = 1 : 5), которую определяли с помощью многодиапазонного кондуктометра “Hanna” HI 8733. Подготовку водных вытяжек проводили по ГОСТ 26423-85 “Почвы. Методы определения удельной электрической проводимости, рН и плотного остатка водной вытяжки”.
Токсикологическую оценку почвенных образцов проводили методом фитотестирования с использованием в качестве тест-организма пшеницы мягкой Triticum aestivum L. [15].
Почвенные микромицеты выделяли по общепринятым методикам [16] на среде Чапека со стрептомицином и идентифицировали по определителям [17–22]. Для характеристики комплекса микромицетов рассчитывали показатели частоты встречаемости (доля числа образцов, где вид был встречен, в общем числе образцов, в %) и обилия видов (доля численности данного вида к общей численности микромицетов, в %) [16]. Для разделения видов на группы по частоте встречаемости использовали градации [23]: доминирующие (≥60%) > частые (≥30%) > редкие (≥10%) > > случайные (<10%). Разделение видов на группы по обилию проводили в соответствии со следующими градациями: доминирующие (≥30%) > типичные (≥10%) > редкие (<10%) [23].
Уровень аллелопатической активности оценивали по суммарной фитотоксичности комплекса почвенных микромицетов, которую определяли модифицированным методом Даниловой [24, 25]. Для этого почвенную суспензию высевали на агаризованную среду Чапека со стрептомицином и инкубировали в течение 14 сут при температуре 24°С. После инкубации агаровую пластину с выросшими на ней микромицетами переворачивали и на обратной стороне пластины раскладывали семена пшеницы Triticum aestivum L. (20 шт./на чашку Петри). Всхожесть семян, длину корней и колеоптилей измеряли через 3-е сут после помещения семян на пластину. Расчет аллелопатической активности грибного комплекса проводили в сравнении с контролем, представлявшим собой стерильную среду Чапека со стрептомицином, по формуле (1):
где К – коэффициент аллелопатической активности, рассчитанный по ингибированию длины проростков; Lоп – длина проростков в опыте; Lк – длина проростков в контроле.Статистическую обработку результатов исследования проводили с использованием программы Statistica (версия 10, Statsoft).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Результаты определения содержания легкорастворимых солей по удельной электропроводности водных вытяжек из почв, загрязненных хлоридом натрия, представлены в табл. 1. Выявили заметное превышение фонового уровня содержания солей (примерно в 35 раз) при внесении максимальной дозы хлорида натрия в почву, что соответствовало слабозасоленным почвам (4 мСм/см). При внесении средних доз хлорида натрия электропроводность достигала 1.56 мСм/см, что можно считать допустимым.
Таблица 1.
Удельная электропроводность водных вытяжек из загрязненных NaCl почв, мСм/см
| Концентрация хлорида натрия, г/м2 | Начало вегетационного сезона | Конец вегетационного сезона |
|---|---|---|
| 0 | 0.11a | 0.09a |
| 20 | 0.72b | 0.14b |
| 50 | 1.56c | 0.17c |
| 150 | 3.92d | 0.29d |
К концу вегетационного сезона под действием внешних факторов содержание солей в почве снизилось до фоновых показателей. Наибольшая электропроводность была равна 0.29 мСм/см. На основании этих данных можно говорить о практически полном вымывании соли из верхних горизонтов почвы за вегетационный период.
Токсикологическая оценка почвенных образцов методом фитотестирования показала, что в начале и конце вегетационного сезона загрязненные хлоридом натрия почвы оказывали различное действие на высшие растения. На рис. 1 представлены результаты изучения фитотоксичности загрязненных почв и влияния разных концентраций хлорида натрия на всхожесть проростков пшеницы, длину их корней и колеоптилей. В начале вегетационного сезона при всех исследованных концентрациях хлорида натрия наблюдали значительное подавление развития растений, выражавшееся в задержке прорастания семян и уменьшении длины проростков. При минимальной концентрации соли угнетение роста составило 50%, при максимальной концентрации – 100% (семена не взошли).
Рис. 1.
Влияние NaCl на проростки пшеницы Triticum aestivum L.: воздействие на всхожесть семян (а), длину корней (б), длину колеоптилей (в).
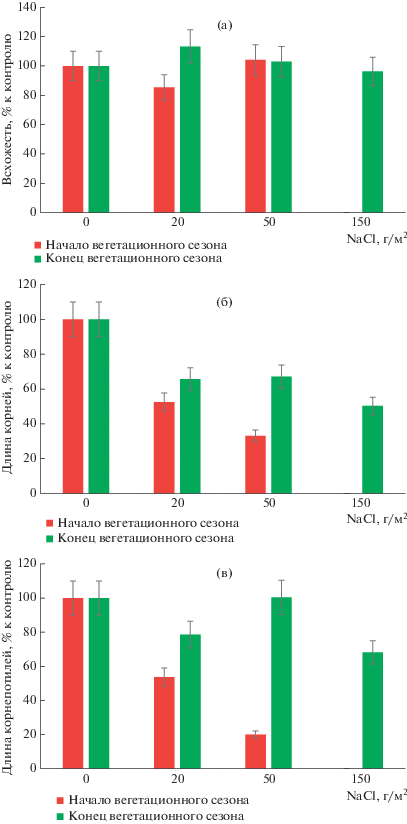
В течение вегетационного сезона внесенный в почву хлорид натрия подвергался воздействию различных факторов, в том числе растворению и вымыванию из верхних почвенных горизонтов под действием атмосферных осадков. Процесс самоочищения загрязненной солью почвы сопровождался снижением ее токсичности. По окончании вегетационного сезона степень негативного воздействия NaCl на растения снизилась. Всхожесть семян не отличалась от контрольного варианта, воздействие NaCl на колеоптили уменьшилось до уровня “малой токсичности” (22–32%). Тем не менее, почва всех образцов оказывала ингибирующее действие на развитие корней растений. При максимальной исходной концентрации хлорида натрия (150 г/м2) угнетение корней проростков составило 50%, что соответствовало “умеренной токсичности”.
Учитывая, что по результатам определения удельной электропроводности содержание солей в верхнем горизонте засоленных почв в конце вегетационного сезона приблизилось к контрольным показателям, сохранение определенных фитотоксических свойств на этом этапе указывало на наличие в почве факторов дополнительного токсического действия на растения.
Токсичность почвенных образцов могла быть связана не только с повышенным содержанием солей, но и с изменением структуры микробного сообщества почвы, сопровождавшимся развитием микроорганизмов-продуцентов токсинов, прежде всего, микроскопических грибов. Токсины грибов обладают ярко выраженными ингибирующими свойствами, что определяет их важную роль в аллелопатических взаимодействиях с растениями [9].
Было установлено, что на начальном этапе в почвах с повышенным содержанием солей происходило снижение численности почвенных микроскопических грибов на 43–58%, по сравнению с сообществом микромицетов незагрязненной почвы (рис. 2). В конце вегетационного сезона численность КОЕ микромицетов возрастала и достигала уровня незагрязненной почвы.
Рис. 2.
Влияние NaCl на численность КОЕ микромицетов дерново-подзолистой почвы в начале (а) и конце (б) вегетационного сезона.
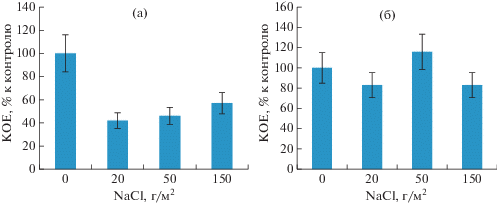
Действие солей проявлялось не только в снижении численности микромицетов, но и в изменении структуры микробного сообщества. В незагрязненной почве доминантными по частоте встречаемости и обилию были представители родов Aspergillus и Mucor, к частым видам относились микромицеты родов Fusarium, Penicillium, Paecilomyces. В засоленной почве доминировали микромицеты родов Penicillium и Aspergillus, среди частых видов выявлены представители родов Alternaria, Cladosporium и Rhizopus.
Доминантами по обилию в незагрязненной почве были Aspergillus terreus, Aspergillus flavus, Mucor sp. В засоленных почвах преобладали Penicillium funiculosum, Aspergillus flavus, Aspergillus fumigatus. В почве с максимальным содержанием солей (150 г/м2) помимо Penicillium и Aspergillus доминировал Fusarium oxysporum.
В конце вегетационного сезона, когда содержание солей в почве снизилось, различия в структуре почвенной микобиоты сохранились, несмотря на то что численность микромицетов в засоленной почве к этому времени не отличалась от контрольной. В засоленной почве как типичные присутствовали фитотоксичные виды микромицетов Aspergillus flavus, A. fumigatus, A. terreus, Cladosporium sp., Fusarium oxysporum, Penicillium funiculosum, P. verrucosum. Из типичных видов общими для незагрязненной и загрязненной почвы были 3 вида: Aspergillus flavus, A. fumigatus, Fusarium oxysporum. В еще большей степени различались количество и состав редких видов. Общими редкими видами для незагрязненной и загрязненной почвы были только Penicillium cyclopium и Penicillium oxalicum.
Важным отличием засоленных почв является доминирование некоторых представителей родов Aspergillus и Penicillium. Например, микромицет Aspergillus ochraceus был выделен как доминирующий из почвы, содержащей 50 и 150 г/м2 NaCl. Aspergillus flavus доминировал во всех вариантах засоленных почв. Cladosporium sp. был выделен как доминирующий лишь в почвах с наиболее высоким уровнем загрязнения (150 г/м2).
Расчет индексов сходства Сёренсена–Чекановского (S) подтвердил направленность происходящих в засоленных почвах изменений. Сходство грибных сообществ, выделенных из засоленных почв, с сообществом контрольной почвы было низким (S = 0.19–0.27) и уменьшалось по мере увеличения засоленности. При этом максимальное сходство (S = 0.44) отмечено между сообществами микромицетов почв с наиболее высоким уровнем засоления – 50 и 150 г/м2.
Таким образом, в засоленной почве происходило снижение численности микромицетов. Отдельные фитотоксичные виды микромицетов, которые в контрольной почве не выделяли, или они были классифицированы в качестве редких, в засоленной почве переходили в разряд типичных и даже доминирующих. Несмотря на то, что по окончании вегетационного сезона численность микромицетов в засоленной почве восстановилась, общее грибное разнообразие по-прежнему отличалось от незагрязненной почвы. Максимальные отличия состава и структуры грибных сообществ выявлены в почве с наиболее высоким уровнем засоления (150 г/м2), в которой доминировали представители рр. Penicillium, Aspergillus, Fusarium.
В связи с большой значимостью этой группы грибов в биоценозе, актуальной задачей является изучение их токсигенных свойств. На рис. 3 представлены результаты анализа аллелопатической активности сообщества микромицетов засоленных почв в сравнении с контролем. Показано, что они негативно влияли на всхожесть семян пшеницы мягкой, снижая ее на 10–58% в сравнении с контролем. Метаболиты грибов оказывали влияние и на морфометрические показатели растений: угнетение развития корней составило 27–39, колеоптилей – 20–28% к клнтролю.
Рис. 3.
Влияние NaCl на аллелопатическую активность почвенных микромицетов: действие продуктов метаболизма микромицетов на всхожесть семян Triticum aestivum L. (а), длину корней (б), длину колеоптилей (в).
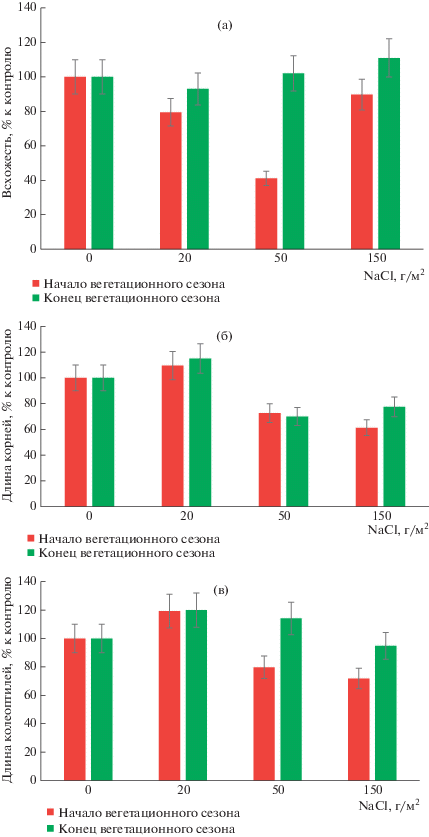
В конце вегетационного сезона аллелопатическая активность микромицетов снизилась, статистически значимые различия между засоленной и контрольной почвами по всхожести и длине колеоптилей отсутствовали. Тем не менее, ингибирующее действие микробных метаболитов на длину корней растений проявилось и на этом этапе. При содержании солей в почве 50–150 г/м2 угнетение развития корней составило 23–30% в сравнении с контролем.
Изменение токсичности микробных метаболитов в зависимости от концентрации NaCl наглядно показали коэффициенты аллелопатической активности комплекса почвенных микромицетов, рассчитанные по длине корней (К1) и колеоптилей (К2) пшеницы. При определении К1 было выявлено превышение пороговых показателей (0.3) при уровне загрязнения >50 г NaCl/м2 (рис. 4). Максимальных величин коэффициенты аллелопатической активности достигали в начале эксперимента. Величина К1 составила 0.49–0.53 (163–183% в сравнении с коэффициентами аллелопатической активности микобиоты контрольной почвы). В почве с минимальным содержанием солей (20 г NaCl/м2) коэффициент К1 не превышал контроль.
Рис. 4.
Влияние NaCl на коэффициенты аллелопатической активности почвенных микромицетов К1 (а) и К2 (б) в начале и конце вегетационного сезона.
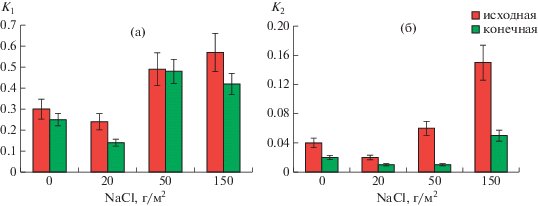
Для коэффициента К2 пороговый показатель 0.3 не был превышен ни в одном из исследованных вариантов, тем не менее, в начале эксперимента при содержании солей в почве 50 и 150 г/м2, К2 был больше контроля в 2.0 и 3.7 раза соответственно.
По окончании вегетационного сезона аллелопатическая активность микромицетов в почве с содержанием солей 50 и 150 г/м2 оставалась высокой: К1 составил 0.48 (189% к контролю) и 0.42 (167%) соответственно. Можно предположить, что токсичность почвы для растений, выявленная методами фитотестирования, определялась не только влиянием хлорида натрия, но и токсинами микроскопических грибов, перестройкой сообщества микромицетов, при которой активизировались микромицеты-токсинообразователи. Повышенная аллелопатическая активность почвенных микромицетов вносила свой вклад в фитотоксические свойства засоленных почв.
Данный эффект – возрастание численности токсигенных грибов в антропогенно-загрязненных почвах и стрессовых условиях отмечен в работах ряда авторов [25–27]. Усиление фитотоксических свойств под действием неблагоприятных факторов среды дает токсинообразующим грибам определенное преимущество в борьбе за питательный субстрат и связано с их высокой устойчивостью к различным типам антропогенного воздействия. Токсикоз почвы, обусловленный влиянием микроскопических грибов, проявляется при содержании 50 г NaCl/м2 почвы и более, и сохраняется на протяжении всего вегетационного сезона.
ЗАКЛЮЧЕНИЕ
Несмотря на интенсивное изучение феномена аллелопатии, сведения об аллелопатических взаимодействиях ограниченны или дискуссионны, что особенно касается почвенных процессов. Для сохранения почвенного покрова, повышения плодородия почв и реабилитации нарушенных земель в условиях антропогенного воздействия необычайно важным является понимание динамики экологического состояния почвы и ее биоты, в том числе изменения аллелопатической активности обитающих в почве микроорганизмов.
Результаты проведенного исследования показали, что фитотоксичность почв, подвергшихся хлоридному засолению, может быть связана не только с ингибирующим действием солей на развитие растений, но и с биологически активными вторичными метаболитами токсигенных видов микроскопических грибов. При засолении почв в сообществе микромицетов возрастала доля видов с фитотоксическими свойствами, и формировалось микробное сообщество, в котором доминировали микромицеты, обладающие высокой аллелопатической активностью. Среди исследованных параметров коэффициенты аллелопатической активности были наиболее чувствительными показателями изменений, происходящих в микробоценозе, и свидетельствовали о продолжительности негативного действия повышенного содержания солей на почвенную микобиоту.
Список литературы
Засоление почв: проблема и пути решения. Интернет-ресурс: http://agropraktik.ru/blog/1097.html (Дата обращения: 05.02.2020).
Хасан Д., Ковтун И.С., Ефимова М.В. Влияние хлоридного засоления на прорастание семян и рост проростков Brassica napus L. // Вестн. ТомскГУ. Биология. 2011. № 4 (16). С. 108–112.
Bronicka M., Raman A., Hodgkins D., Nicol H. Abundance and diversity of fungi in a saline soil in central-west New South Wales, Australia // Sydowia. 2007. № 59 (1). P. 7–24.
Якубов Х.Г., Николаевский В.С. Удаление натрия и хлоридов из почв города в целях улучшения условий роста и развития древесных растений // Экология большого города. Альманах “Проблемы содержания зеленых насаждений в условиях Москвы”. 2001. № 5. С. 100–105.
Поляк Ю.М., Сухаревич В.И. Почвенные ферменты и загрязнение почв: биодеградация, биоремедиация, биоиндикация // Агрохимия. 2020. № 3. С. 83–93.
Якутин М.В., Анопченко Л.Ю., Андриевский В.С. Влияние засоления на биомассу микроорганизмов в разновозрастных почвах в лесостепной зоне Западной Сибири // Почвоведение. 2016. № 12. С. 1500–1505.
Терехова В.А. Микромицеты в экологической оценке водных и наземных экосистем. М.: Наука, 2007. 215 с.
Rick J. Willis. The History of Allelopathy. Springer, 2007. P. 3.
Поляк Ю.М., Сухаревич В.И. Аллелопатические взаимоотношения растений и микроорганизмов в почвенных экосистемах // Усп. совр. биол. 2019. Т. 2. С. 147–160.
Берестецкий О.А. Фитотоксины почвенных микроорганизмов и их экологическая роль // Фитотоксические свойства почвенных микроорганизмов. Л.: ВНИИСХМБ, 1978. С. 7–80.
Марфенина О.Е. Микологический мониторинг почв: возможности и перспективы // Почвоведение. 1994. № 1. С. 75–80.
Свистова И.Д., Щербаков А.П., Фролова Л.О. Фитотоксическая активность сапротрофных микромицетов чернозема: специфичность, сорбция и стабильность фитотоксинов в почве // Прикл. биохим. микробиол. 2003. Т. 39. № 4. С. 441–445.
Гродзинский А.М. Аллелопатия растений и почвоутомление. Киев: Наукова думка, 1991. 432 с.
Kong C.H., Hu F., Wang P., Wu J.L. Effect of allelopathic rice varieties combined with cultural management options on paddy field weeds // Pest Manag. Sci. 2008. V. 64. P. 276–282.
Методика выполнения измерений всхожести семян и длины корней проростков высших растений для определения токсичности техногенно загрязненных почв. М-П-2006. Федеральный реестр. ФР.1.39.2006.02264. СПб. 2009. 22 с.
Звягинцев Д.Г. Методы почвенной микробиологии и биохимии. М.: Изд-во МГУ, 1991. 304 с.
Пидопличко Н.М. Пенициллин (Ключи для определения видов). Киев: Наукова думка, 1972. 151 с.
Билай В.И., Коваль Э.З. Аспергиллы. Определитель. Киев: Наукова думка, 1988. 204 с.
Билай В.И., Курбацкая З.А. Определитель токсинообразующих микромицетов. Киев: Наукова думка, 1990. 234 с.
De Hoog G.S., Guarro J. Atlas of Clinical Fungi. Centraalbureau voor Schimmelcultures, 2000. 1126 p.
Watanabe T. Pictorial atlas of soil and seed fungi: Morfologies of cultured fungi and Key to species. Florida, 2000. 411 p.
Саттон Д., Фотергилл А., Ринальди М. Определитель патогенных и условно патогенных грибов. М.: Мир, 2001. 468 с.
Мирчинк Т.Г. Почвенная микология. М.: Изд-во МГУ, 1988. 220 с.
Данилова А.А. Фитотоксичность грибного комплекса в выщелоченном черноземе Приобья при различных способах основной обработки почвы // Сел.-хоз. биол. 2010. № 3. С. 108–111.
Поляк Ю.М., Бакина Л.Г., Маячкина Н.В., Галдиянц А.А. Роль аллелопатических взаимодействий в структурных и функциональных изменениях антропогенно-нарушенных почв // Гумус и почвообразование. 2017. № 21. С. 65–69.
Киреева Н.А., Кузяхметов Г.Г., Мифтахова А.М., Водопьянов В.В. Фитотоксичность антропогеннозагрязненных почв. Уфа: Гилем, 2003. 266 с.
Свистова И.Д., Щербаков А.П., Фролова Л.О. Токсины микромицетов чернозема: спектр антибиотического действия и роль в формировании микробного сообщества // Почвоведение. 2004. № 10. С. 1220–1227.
Дополнительные материалы отсутствуют.


