Агрохимия, 2021, № 4, стр. 87-96
Эффективность ассоциаций растений семейства бобовых и ростстимулирующих бактерий для восстановления нефтезагрязненных почв
Е. В. Кузина 1, Г. Ф. Рафикова 1, *, Е. А. Столярова 1, О. Н. Логинов 1
1 Уфимский Институт биологии – обособленное структурное подразделение
Уфимского федерального исследовательского центра РАН
450054 Уфа, просп. Октября, 69, лит. Е, Россия
* E-mail: lab.biotech@yandex.ru
Поступила в редакцию 17.07.2020
После доработки 02.09.2020
Принята к публикации 11.01.2021
Аннотация
В условиях вегетационного опыта проведена оценка устойчивости нута бараньего Cicer arietinum L. и люцерны изменчивой Medicago varia Mart. к присутствию в почве углеводородов нефти в концентрации 5% по массе. Приведены данные, характеризующие влияние поллютанта на морфометрические и морфологические показатели растений. Установлено положительное воздействие предпосевной обработки семян этих видов растений ростстимулирующими бактериями Paenibacillus peoriae АНТ 13 и Pseudomonas laurentiana АНТ 17 на выживаемость, рост и развитие растений в условиях нефтяного загрязнения. Показано, что степень биодеструкции нефти с использованием нута составила 45, люцерны – 29%, при этом биоаугментация способствовала снижению содержания углеводородов в почве дополнительно на 6–14%.
ВВЕДЕНИЕ
Биоремедиация представляет собой эффективный вариант восстановления загрязненной нефтью окружающей среды путем использования деградационных возможностей растений и микроорганизмов. Одним из направлений исследований биоремедиации является поиск видов растений, которые демонстрируют высокую устойчивость к углеводородному загрязнению почвы и, следовательно, могут выступать перспективными агентами фиторемедиации. Большая часть опубликованных работ посвящена изучению возможности применения для очистки земель, загрязненных углеводородами, видов Poaceae. Культуры семейства Fabaceae упоминаются гораздо реже в качестве растений-фиторемедиаторов [1, 2]. По сравнению с представителями злаковых трав растения семейства мотыльковых отличают невысокие темпы деградации нефтяных загрязнений [3]. Бобовые культуры обеспечивают не только рекультивацию загрязненной почвы, но и за счет симбиотических отношений с аборигенными микроорганизмами-азотфиксаторами способствуют восстановлению баланса азота и углерода, нарушаемого при попадании в почву углеводородов.
При изучении влияния, которое нефть оказывает на представителей семейства бобовых, установлено, что растения могут переносить ее присутствие в почве в концентрации 3–8% [2, 4]. С целью повышения фиторемедиационного потенциала бобовых культур предлагается использовать агробактериальную трансформацию [5].
В нашей стране при рекультивации земель, загрязненных нефтепродуктами, из бобовых культур наиболее широко используют разных представителей родов люцерна и клевер. Это могут быть как чистые культуры, так и бобово-злаковые травосмеси [6]. Изучение индикативных характеристик растений показало, что, с одной стороны, низкие концентрации нефти могут стимулировать их рост. С другой стороны, нефтезагрязнители оказывают токсическое воздействие на развитие растений, следствием чего становится преждевременное пожелтение листьев, мелколистность, усыхание побегов [7].
Нами ранее были проведены исследования оценки устойчивости растений гороха посевного Pisum sativum L. и клевера лугового Trifolium pratense L. к присутствию в почве углеводородов нефти [8]. Было показано, что загрязнение нефтью в концентрации 4–8% снижало прорастание семян клевера более чем в 2 раза. На всхожесть растений гороха наличие в почве нефти в таком количестве отрицательного влияния не оказывало, но приводило к уменьшению длины побегов, массы и длины корней растений.
Очевидно, что морфологические изменения, происходящие с растениями под влиянием нефтяного загрязнения, обусловлены в первую очередь затруднениями с поступлением влаги к корням. В этой связи, на наш взгляд, особый интерес представляют засухоустойчивые бобовые культуры, способные переносить недостаток влаги в почве длительное время и сохранять жизнеспособность при обезвоживании. Одной из самых засухоустойчивых зернобобовых культур, возделываемых на территории Российской Федерации, является нут бараний Cicer arietinum L. [9, 10]. Среди других ксерофитов семейства мотыльковых следует упомянуть роды Lens Medik., Lathyrus L., Melilotus Mill., Medicago L. При этом, если, например, люцерна как растение-фитомелиорант изучена достаточно хорошо, нуту, как фиторемедианту, посвящены единичные публикации [1, 4].
В ряде экспериментов было показано, что совместное использование для восстановления природного потенциала нефтезагрязненных земель бактерий, продуцирующих фитогормоны, и люцерны в качестве фитомелиоранта позволяет повысить эффективность деструкции поллютантов [11–13]. Коллекция Уфимского Института биологии УФИЦ РАН имеет в своем перечне несколько штаммов бактерий родов Paenibacillus и Pseudomonas, для которых доказана способность стимулировать рост зернобобовых культур и кормовых трав [14]. Цель работы – сравнение эффективности ризоремедиации нефтезагрязненной почвы с использованием в качестве фитомелиорантов устойчивых к засухе растений нута бараньего и люцерны изменчивой с применением инокуляции семян ростстимулирующими бактериями родов Paenibacillus и Pseudomonas.
МЕТОДИКА ИССЛЕДОВАНИЯ
Экспериментальное исследование проводили в рамках вегетационного опыта в 2019 г. В качестве фитомелиорантов были использованы нут бараний Cicer arietinum L. сорта Приво 1 и люцерна изменчивая Medicago varia Mart. сорта Галия. Семена произведены и предоставлены Башкирским научно-исследовательским институтом сельского хозяйства УФИЦ РАН.
Растения выращивали в сосудах объемом 0.5 л и высотой 14 см, в которые для оптимизации водно-воздушного режима помещали дренаж, а также стеклянные трубочки. Опыт проводили с использованием светодиодной подсветки: плотность потока фотонов ФАР 240 мкмоль/м2/с, фотопериод – 14 ч. Сосуды заполняли почвой, предварительно смешанной с песком (соотношение почва : песок = 9 : 1) и загрязненной товарной нефтью в концентрации 5% по массе. В качестве контроля служили растения, которые росли на незагрязненной нефтью почве. Почва – чернозем обыкновенный, содержание гумуса – 4.2% (по Тюрину), рН – 6.3, обеспеченность подвижными формами (по Чирикову) фосфора – 5.6, калия – 8.2 мг/100 г, содержание общего азота (по Кьельдалю) – 0.5%. Полив осуществляли из расчета 80% ПВ в начале эксперимента, далее – 60% ПВ.
Семена растений стерилизовали замачиванием в 1%-ном растворе перманганата калия в течение 30 мин, после чего 5-кратно промывали большим количеством стерильной водопроводной воды, далее помещали на увлажненную фильтровальную бумагу для проращивания при комнатной температуре. Для посева брали проросшие семена в количестве 4 и 10 шт. на один сосуд для нута и люцерны соответственно. Перед посадкой проростки замачивали на 20 мин в жидкой культуре бактерий, разбавленной водой до титра 106 КОЕ/мл. В опыте использовали следующие ростстимулирующие штаммы бактерий из коллекции Уфимского Института биологии УФИЦ РАН: Paenibacillus peoriae АНТ 13, Pseudomonas laurentiana АНТ 17, Pseudomonas koreensis ИБ-4, Paenibacillus ehimensis IB 739.
Экспозицию растений нута продолжали в течение 3-х нед, люцерны – 6-ти нед. В конце эксперимента оценивали количество выживших растений, нодуляцию, определяли воздушно-сухую массу побегов и корней. Выживаемость рассчитывали, как отношение числа растений, оставшихся к концу эксперимента, к числу посаженных проростков (%).
Оценку ремедиационных возможностей сельскохозяйственных культур проводили, опираясь на данные остаточного количества углеводородов в почве в конце опыта. Для этого использовали гравиметрический метод, основанный на экстракции нефтепродуктов из почвы гексаном. Эффективность биодеградации (D) рассчитывали по формуле:
где С0 – исходная концентрация углеводородов нефти (50 г/кг почвы), С1 – концентрация углеводородов нефти в образцах в конце эксперимента.С целью получения образцов для анализа ризосферного грунта корни растений с налипшими на них комочками почвы весом 1 г помещали в колбы, содержащие 100 мл стерильной водопроводной воды, и взбалтывали в течение 3 мин на качалке (180 об./мин). Затем стерильным крючком корни извлекали, а почвенные суспензии в колбах дополнительно перемешивали в течение 5 мин. Учет численности гетеротрофов, олигонитрофилов, микромицетов проводили путем посева разведений почвенной суспензии на общепринятые агаризованные среды [15], углеводородокисляющих микроорганизмов (УОМ) – на питательную среду Раймонда с дизельным топливом в качестве источника углерода [16].
Эксперименты осуществляли в трехкратной повторности, статистическую обработку проводили с использованием программного обеспечения Microsoft Office Excel. Рассчитаны показатели: среднее ± стандартная ошибка среднего, произведена оценка достоверности различий по t-критерию Стьюдента.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
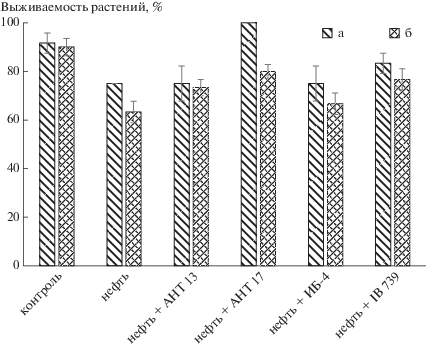
Одной из основных задач проведенных исследований являлась оценка реакции выбранных сельскохозяйственных культур на присутствие в почве нефти. Показано, что выживаемость обоих видов растений на нефтезагрязненной почве снизилась: на 17% – нута и на 27% – люцерны (рис. 1). При этом на фоне нефтяного загрязнения бактеризация семян штаммами P. peoriae АНТ 13, P. laurentiana АНТ 17, P. ehimensis IB 739способствовала повышению выживаемости обеих культур в среднем на 8–25 и 10–17% в вариантах с нутом и люцерной соответственно. При обработке семян нута штаммом P. laurentiana АНТ 17 на почве с нефтью выжили все растения, в то время как даже в контрольном варианте (без нефти) этот показатель составил только 92%.
Рис. 1.
Влияние интродукции бактерий на выживаемость растений в условиях нефтяного загрязнения: а – нут, б – люцерна.
Было отмечено, что на ранних стадиях эксперимента основная масса корней нута в сосудах с нефтью располагалась в верхнем слое почвы –преимущественно 0–8 см (рис. 2а). Несмотря на это, по истечении 3-х нед опыта для нута не установлено статистически значимых различий между сухой массой корней и побегов растений, выросших на незагрязненной почве, и почве, содержащей нефть (табл. 1).
Рис. 2.
Развитие корневой системы нута на 6-е сут после помещения проростков в почву: (а) – вид сбоку (слева – контроль, справа – почва c содержанием нефти 50 г/кг), (б) – вид сверху (почва c содержанием нефти 50 г/кг).

Таблица 1.
Влияние нефтяного загрязнения на морфометрические показатели растений нута и люцерны, в том числе в присутствии штаммов ростстимулирующих бактерий
| Вариант | Сухая масса побегов, мг | Сухая масса корней, мг | Корень: побег | Клубеньки, шт./растение |
|---|---|---|---|---|
| мг/растение | ||||
| Нут | ||||
| Контроль | 54.3 ± 2.3а | 28.5 ± 2.1a | 0.52 | – |
| Нефть | 56.6 ± 1.8а | 33.3 ± 3.3ab | 0.59 | – |
| Нефть + АНТ 13 | 64.9 ± 2.9b | 35.8 ± 3.4b | 0.55 | – |
| Нефть + АНТ 17 | 62.3 ± 2.6b | 38.6 ± 2.6b | 0.62 | – |
| Нефть + ИБ-4 | 66.8 ± 2.5b | 33.7 ± 4.5ab | 0.50 | – |
| Нефть + IB 739 | 53.5 ± 2.3a | 33.3 ± 4.6ab | 0.62 | – |
| Люцерна | ||||
| Контроль | 9.75 ± 0.86a | 1.18 ± 0.21a | 0.12 | 6.7 ± 0.2a |
| Нефть | 2.41 ± 0.19b | 1.79 ± 0.14b | 0.74 | 2.8 ± 0.2b |
| Нефть + АНТ 13 | 3.58 ± 0.27cd | 2.19 ± 0.20cd | 0.61 | 4.3 ± 0.3c |
| Нефть + АНТ 17 | 3.56 ± 0.47cd | 1.80 ± 0.06b | 0.51 | 3.7 ± 0.4cd |
| Нефть + ИБ-4 | 4.09 ± 0.29c | 2.24 ± 0.19c | 0.55 | 3.7 ± 0.4cd |
| Нефть + IB 739 | 3.26 ± 0.26d | 1.88 ± 0.12bd | 0.58 | 3.3 ± 0.2d |
Примечания. 1. Достоверно отличающиеся величины помечены разными буквами (p ≤ 0.05, t-тест). То же в табл. 2. 2. Прочерк – показатель не определен.
В свою очередь интродукция бактерий в присутствии в почве поллютанта стимулировала рост побегов и корней. У растений нута, обработанных штаммами P. peoriae АНТ 13, P. laurentiana АНТ 17, P. koreensis ИБ-4, масса побега выросла на 14.8–23.1% по сравнению с контролем, увеличение массы корней в вариантах с бактеризацией культурами P. peoriae АНТ 13 и P. laurentiana АНТ 17 составило 25.7 и 35.5% соответственно.
Токсическое действие нефти на растения люцерны выражалось в первую очередь в существенном замедлении роста побегов. К концу эксперимента в вариантах с загрязненной почвой растения люцерны имели 4 настоящих листа, в варианте без загрязнения сформировалось в среднем 5–6 листьев. Вследствие этого, сухая зеленая масса в варианте, где использовали нефть, уменьшилась по сравнению с контролем в 4.0 раза. Бактеризация помогала растениям справиться со стрессом. Во всех вариантах с использованием штаммов микроорганизмов отмечено увеличение массы надземной части в среднем на 35.3–69.7% по отношению к варианту с нефтью, но без обработки бактериями. Внешне данный эффект выражался не в приросте количества листьев, а в увеличении размеров листовых пластинок.
Что качается корневой системы люцерны, то в отличие от побегов загрязнение почвы нефтью привело к тому, что ее масса увеличилась в 1.5 раза. Обработка растений такими штаммами как P. peoriae АНТ 13 и P. koreensis ИБ-4 дополнительно повысила этот показатель у растений еще на 22.3–25.1%.
Таким образом, на нефтезагрязненной почве у нута выявлена тенденция к незначительному увеличению роста как надземной, так и подземной частей растений, следовательно, присутствие нефти практически не повлияло на отношение массы корня к массе побега (табл. 1). В то время как у люцерны этот показатель вырос до 0.74 на почве с нефтью против 0.12 в контрольном варианте. Бактеризация заметнее сказалась на росте побегов растений, чем корней и позволила несколько снизить соотношение корень : побег, что составило 0.51–0.61.
Ранее было показано, что штаммы P. koreensis ИБ-4 и P. ehimensis IB 739 не только улучшают рост бобовых растений, но и стимулируют у них процесс клубенькообразования [14, 17]. Образование первых клубеньков у люцерны в условиях данного опыта отмечено через 2.5 нед после начала эксперимента. Было установлено, что в присутствии нефти нодуляция у люцерны снизилась в 2.4 раза. В вариантах с инокуляцией штаммами бактерий количество клубеньков увеличилось на 17.9–53.6%, но не превысило контроль. На корнях нута клубеньков обнаружить не удалось даже в контрольном варианте. Это связано с тем, что в отличие от люцерны нут не относится к числу широко возделываемых в Республике Башкортостан сельскохозяйственных культур, поэтому в почвах данного региона отсутствуют специфичные для этой культуры штаммы клубеньковых бактерий.
Через 3 нед после начала эксперимента было проведено количественное сравнение некоторых физиологических групп микроорганизмов в ризосфере нута, выросшего на контрольной почве и почве, содержащей нефть (табл. 2). Показано, что численность представляющей наибольший интерес группы УОМ в варианте с загрязнением нефтью, но без внесения бактерий, выросла по сравнению с контролем в 4.3 раза. Интродукция бактерий практически не повлекла за собой увеличения количества данной группы микроорганизмов, исключение – вариант со штаммом P. peoriae АНТ 13.
Таблица 2.
Влияние нефтяного загрязнения на численность различных физиологических групп микроорганизмов в ризосфере нута, КОЕ/г
| Вариант | Гетеро- трофы, ×107 | Олигони- трофилы, ×106 | Микро- мицеты, ×104 | УОМ, ×105 |
|---|---|---|---|---|
| Контроль | 3.4 ± 0.7a | 8.0 ± 0.6a | 5.3 ± 0.8a | 4.4 ± 0.9a |
| Нефть | 8.5 ± 0.7b | 0.8 ± 0.3b | 1.6 ± 0.5b | 18.9 ± 2.3b |
| Нефть + АНТ 13 | 18.6 ± 1.6cd | 2.8 ± 0.5c | 9.5 ± 0.9c | 25.3 ± 1.5c |
| Нефть + АНТ 17 | 20.4 ± 1.5c | 1.8 ± 0.4de | 7.7 ± 0.8d | 20.8 ± 1.6b |
| Нефть + ИБ-4 | 15.2 ± 0.9e | 1.3 ± 0.4bd | 4.5 ± 0.8a | 16.3 ± 1.9bd |
| Нефть + IB 739 | 15.7 ± 1.4de | 2.4 ± 0.5ce | 5.9 ± 0.7a | 14.1 ± 1.3d |
Отмечено, что в конце опыта количество гетеротрофных микроорганизмов в ризосфере неинокулированных растений нута, выросших в присутствии нефти, увеличилось в 2.5 раза по сравнению с контролем, а в случае инокуляции – до 1.5–2.0 × 108 КОЕ/г. В противоположность этому, присутствие поллютанта отрицательным образом сказалось на численности азотфиксирующих микроорганизмов: в почве с нефтью их количество сократилось на порядок. При этом в 3-х из 4-х вариантов, в которых вносили дополнительно ростстимулирующие бактерии, олигонитрофилов стало больше в среднем в 2.3–3.5 раза, чем в варианте с нефтью без интродукции. Что касается микроскопических грибов, то загрязнение почвы нефтью привело к снижению численности микромицетов в 3.3 раза. В вариантах, где семена нута были инокулированы штаммами бактерий, численность мицелиальных грибов повысилась до контрольного уровня, а в случае со штаммами P. peoriae АНТ 13, P. laurentiana АНТ 17 – превысила его в 1.5–1.8 раза.
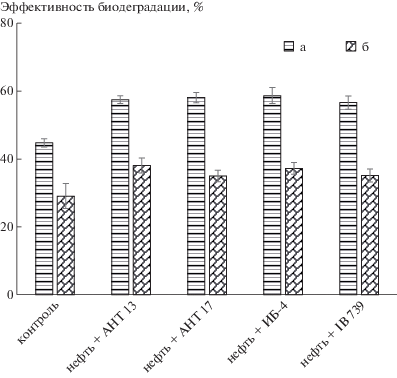
Выявлено, что степень биодеструкции нефти с использованием нута за 3 нед эксперимента составила 45 против 29% в варианте с люцерной при продолжительности опыта, равной 6-ти нед (рис. 3). Инокуляция растений штаммами бактерий дополнительно способствовала снижению содержания в почве поллютанта: на 12–14 и на 6–9% для нута и люцерны соответственно. При этом статистически достоверных отличий показателя деструктивной активности варианты с использованием штаммов бактерий между собой не имели.
Рис. 3.
Биодеструкция нефти при различных вариантах рекультивации: а – нут (3 нед эксперимента), б – люцерна (6 нед эксперимента).
В целом по показателям роста на нефтезагрязненной почве обоих видов растений наименее эффективным показал себя штамм P. ehimensis IB 739, наименьшее число выживших растений нута и люцерны отмечено в варианте с использованием штамма P. koreensis ИБ-4. Тем не менее, оба вида растений продемонстрировали высокую отзывчивость на бактеризацию в присутствии углеводородов нефти, что в свою очередь повлияло на эффективность процесса фиторемедиации.
При оценке такого важного критерия как выживаемость растений на почвах, загрязненных нефтепродуктами, принято считать, что среднюю и высокую устойчивость демонстрируют культуры, у которых сохраняется свыше 80% растений от количества всходов [6, 18]. Как правило, это многолетние травы семейства мятликовых. В работе [11] оценили устойчивость растений к углеводородному загрязнению в чашках Петри, регистрируя их приживаемость на 10-е сут при концентрации нефти 5% от массы субстрата. В этих исследованиях степень устойчивости люцерны оказалась равной 49%. В нашем опыте при таком же уровне нефтяного загрязнения в течение 1.5 мес. выIB жили 63% растений данного вида, при этом предпосевная обработка ростстимулирующими штаммами бактерий увеличила данный показатель до 77–80% (рис. 1).
Опубликовано большое количество исследований, ставящих себе целью описать реакцию растений на нефтяные углеводороды в зависимости от видовой принадлежности, массы семян, особенностей прорастания, длительности жизненного цикла и т.п. [19, 20]. На сегодняшний день не существует единого мнения, какие именно характеристики семян повышают толерантность растений к загрязнению почвы. В нашем исследовании в начале эксперимента наблюдали относительную устойчивость растений нута к токсичному действию нефти. Это могло быть связано с тем, что масса семян бараньего гороха превосходила массу семян люцерны более чем в 150 раз. Крупные семядоли, выполняя функцию вместилища запасных веществ, позволили растению на начальном этапе развития адаптироваться к стрессовым условиям окружающей среды. Действительно, в течение первых 1.5 нед контаминация почвы углеводородами не влияла на скорость роста растений нута. Но в дальнейшем листья стали терять зеленую окраску и усыхать, начиная с кончиков.
В противоположность этому токсическое действие нефти на культуру люцерны было отмечено уже на этапе появления всходов и выражалось в том, что в несколько раз снизилась скорость роста побегов. В то же время на протяжении всего эксперимента не наблюдали пожелтения и засыхания листьев, хотя многие авторы указывали, что хлороз является характерной стресс-реакцией люцерны на загрязнение почвы углеводородами [7, 21].
В начале роста растения корневая система обычно развивается более быстрыми темпами, чем надземные органы. В условиях нашего опыта уже на 3-и сут эксперимента на незагрязненной почве корни нута достигли дна сосуда. На почве, содержащей нефть, глубина проникновения корней была в 2 раза меньше. Кроме того, в варианте с загрязнением было выявлено изменение направления роста корней – они появились над поверхностью почвы (рис. 2). Известно, что отрицательное воздействие нефтяного загрязнения на растения связано не только с токсичностью составляющих его компонентов. Оно происходит также и опосредованно через влияние на физико-химические свойства почвы [22, 23]. Корневая система растений вынуждена приспосабливаться к существующим условиям, используя для этого различные механизмы. Внешне это может проявляться как изменение ориентации корней относительно поверхности субстрата [24], гидротропизмом и аэротропизмом [25].
Очевидно, что торможение роста побегов на фоне стресса от присутствия в почве нефти необходимо растениям, чтобы уменьшить испарение воды и одновременно освободить ресурсы для поддержания роста корней, увеличивая таким образом их поглотительную способность. В нашем опыте растения люцерны изменчивой Medicago varia Mart. на почве с нефтью (50 г/кг) демонстрировали задержку роста стеблей, снижение площади листьев и их количества и, как следствие, через 6 нед эксперимента существенное понижение величины общей зеленой массы (табл. 1). По данным литературы, другие виды люцерны также плохо переносят нефть даже в более низких концентрациях [21, 26, 27]. В сравнении с люцерной нут бараний не показал статистически значимых различий между показателями сухой биомассы, сформировавшейся в течение 3-х нед на загрязненной и чистой почве. Ранее уже были получены аналогичные результаты при сравнении устойчивости кормовых трав и зернобобовых растений к нефтяному загрязнению. Было показано, что на начальных этапах развития мелкосеменные бобовые культуры более уязвимы, чем растения с крупными семенами [8].
Одной из основных задач исследования являлось подтверждение возможности повысить эффективность фиторемедиации за счет интродукции бактерий. Установлено, что обработка семян штаммами P. peoriae АНТ 13, P. laurentiana АНТ 17, P. koreensis ИБ-4, P. ehimensis IB 739 способствовала снижению отрицательного влияния нефти на рост и развитие растений. Совместное использование растений и бактерий для рекультивации почв, загрязненных углеводородами, обусловлено взаимовыгодными отношениями, которые существуют между ними: растение обеспечивает бактерии легкодоступными источниками питания, бактерии помогают растениям выживать в токсичной среде, стимулируя их рост, а также снижая концентрацию вредных веществ в почве [28]. Известно, что растения избирательны в отношении микроорганизмов, образующих микробиом их ризосферы [29, 30]. Литературные данные подтверждают эффективность использования биопрепаратов на основе штаммов Pseudomonas совместно с растениями люцерны посевной Medicago sativa L. или люцерны серповидной Medicago falcata L. при восстановлении нефтезагрязненных земель [12, 13].
В ряде работ [30, 31] отмечено, какую важную роль играют органические загрязнители в формировании состава микробных сообществ ризосферы. С одной стороны, они могут быть токсичны, подавляя определенные почвенные микроорганизмы, с другой стороны, загрязнители могут служить источником питания для членов сообщества. Полученные нами данные по численности азотфиксирующих и углеводородокисляющих микроорганизмов в почве, содержащей нефть, могут служить наглядной иллюстрацией данного утверждения (табл. 2).
ЗАКЛЮЧЕНИЕ
Таким образом, изучение возможности использования для восстановления нефтезагрязненной почвы в качестве фитомелиорантов растений нута бараньего и люцерны изменчивой показало, что выбранные тест-культуры демонстрировали среднюю устойчивость к концентрации нефти в почве 50 г/кг. Токсическое действие нефти на растения выражалось в снижении выживаемости обеих тест-культур. При этом установлено, что нут и люцерна значительно отличались по тому, какие морфологические изменения происходили с ними под воздействием нефти.
Полученные результаты показали, что применение инокуляции семян штаммами ростстимулирующих бактерий родов Paenibacillus и Pseudomonas способствовало повышению устойчивости бобовых культур к действию поллютанта, стимулировало их рост в неблагоприятных условиях, а также ускоряло процесс деструкции нефти. В рамках данного вегетационного опыта наиболее значительного снижения содержания углеводородов в почве (более чем в 2 раза) удалось достичь в варианте с использованием нута бараньего и ассоциированных с ним штаммов бактерий: по истечении 3-х нед эксперимента количество углеводородов в почве составило 20.7–21.7 г/кг.
Список литературы
Varazi T., Kurashvili M., Pruidze M., Khatisashvili G., Gagelidze N., Adamia G., Zaalishvili G., Gordeziani M., Sutton M. A new approach and tools for perfecting phytoremediation technology // Am. J. Environ. Protect. 2015. V. 4. № 3–1. P. 143–147. https://doi.org/10.11648/j.ajep.s.2015040301.32
Riskuwa-Shehu M.L., Ijah U.J.J., Manga S.B., Bilbis L.S. Evaluation of the use of legumes for biodegradation of petroleum hydrocarbons in soil // Inter. J. Environ. Sci. Technol. 2017. V. 14. P. 2205–2214. https://doi.org/10.1007/s13762-017-1303-5
Hall J., Soole K., Bentham R. Hydrocarbon phytoremediation in the family Fabaceae – a review // Inter. J. Phytoremediat. 2011. V. 13. № 4. P. 317–332.https://doi.org/10.1080/15226514.2010.495143
Mishra A., Nautiyal C.S. Functional diversity of the microbial community in the rhizosphere of chickpea grown in diesel fuel-spiked soil amended with Trichoderma ressei using sole-carbon-source utilization profiles // World J. Microbiol. Biotechnol. 2009. V. 25. P. 1175–1180.https://doi.org/10.1007/s11274-009-9998-1
Степанова А.Ю., Орлова Е.В., Терешонок Д.В., Долгих Ю.И. Получение трансгенных растений люцерны посевной (Medicago sativa L.) для повышения эффективности фиторемедиации нефтезагрязненных почв // Экол. генетика. 2015. Т. 13. № 2. С. 127–135.
Мухаярова Е.И. Подбор и использование травосмесей оптимального состава для проведения биологической рекультивации на территории СЗФО // Наука и технол. трубопровод. транспорта нефти и нефтепродуктов. 2014. № 4 (16). С. 98–103.
Гафарова Б.Т., Мамедова А.О. Исследование индикативных свойств Medicago sativa L. в условиях нефтяного загрязнения // Бюл. науки и практ. 2019. Т. 5. № 2. С. 19–25.
Высоцкая Л.Б., Архипова Т.Н., Кузина Е.В., Рафикова Г.Ф., Ахтямова З.А., Иванов Р.С., Тимергалина Л.Н., Кудоярова Г.Р. Сравнение реакции растений различных видов на нефтяное загрязнение // Биомика. 2019. Т. 11(1). С. 86–100.
Елибай Е., Садыбекова Л.С., Кулкеев Е.Е., Толтаева Б. Урожайность и экономическая эффективность возделывания нута в условиях юга Казахстана // Евраз. союз ученых. 2016. № 2–5 (23). С. 62–64.
Асаналиев А.Ж., Султанбаева В.А., Хегай С.В., Содомбеков И.С. Продуктивность нута в зависимости от сроков и схем посева в предгорной зоне Чуйской долины // Усп. совр. естествознания. 2017. № 3. С. 46–50.
Отрошко Д.Н., Волченко Н.Н., Самков А.А., Худокормов А.А. Отбор растений и микроорганизмов для дальнейшего применения в ризоремедиации // Теор. и прикл. экол. 2016. № 2. С. 86–92.
Agnello A.C., Bagard M., Van Hullebusch E.D., Esposito G., Huguenot D. Comparative bioremediation of heavy metals and petroleum hydrocarbons cocontaminated soil by natural attenuation, phytoremediation, bioaugmentation and bioaugmentation–assisted phytoremediation // Sci. Total Environ. 2016. V. 563–564. P. 693–703.https://doi.org/10.1016/j.scitotenv.2015.10.061
Галкина Н.А., Назаренко О.А., Шафран В.Н., Суслова М.В., Вяткин К.А. Эколого-экономическая оценка технологии рекультивации нефтезагрязненных земель с использованием эффективного биопрепарата // Изв. Самар. НЦ РАН. 2017. Т. 19. № 2 (2). С. 244–248.
Миннебаев Л.Ф., Кузина Е.В., Рафикова Г.Ф., Чанышев И.О., Логинов О.Н. Продуктивность бобово-ризобиального комплекса под влиянием ростстимулирующих штаммов микроорганизмов // Сел.-хоз. биол. 2019. Т. 54. № 3. С. 481–493.https://doi.org/10.15389/agrobiology.2019.3.481rus
Дзержинская И.С. Питательные среды для выделения и культивирования микроорганизмов. Астрахань: Изд-во АГТУ, 2008. 348 с.
Raymond R.L. Microbial oxidation of n-paraffinic hydrocarbons // Develop. Ind. Microbiol. 1961. V. 2. P. 23–32.
Кузина Е.В., Рафикова Г.Ф., Столярова Е.А., Мухаматдьярова С.Р., Логинов О.Н. Перспектива использования бактериальных препаратов против семенной инфекции нута // Земледелие. 2020. № 2. С. 44–47.https://doi.org/10.24411/0044-3913-2020-10211
Rutherford P.M., Dickinson S.J., Arocena J.M. Emergence, survival and growth of selected plant species in petroleum-impacted flare pit soils // Can. J. Soil Sci. 2005. V. 85. № 1. P. 139–148.https://doi.org/10.4141/S03-088
Robson D.B., Germida J.J., Farrell R.E., Knight D.J. Hydrocarbon tolerance correlates with seed mass and relative growth rate // Bioremed. J. 2004. V. 8. № 3–4. P. 185–199.https://doi.org/10.1080/10889860490887536
Potashev K., Sharonova N., Breus I. The use of cluster analysis for plant grouping by their tolerance to soil contamination with hydrocarbons at the germination stage // Sci. Total Environ. 2014. V. 485–486. P. 71–82.https://doi.org/10.1016/j.scitotenv.2014.03.067
Minoui S., Minai-Tehrani D., Shahriari M. Phytoremediation of crude oil-contaminated soil by Medicago sativa (Alfalfa) and the effect of oil on its growth // Phytoremed. Green Energy. 2015. P. 123–129.https://doi.org/10.1007/978-94-007-7887-0_8
Каменщикова В.И. Влияние техногенного загрязнения на биофизические и биохимические свойства дерново-подзолистых почв таежно-лесной зоны // Вестн. Перм. ун-та. Сер. Биология. 2012. № 2. С. 45–50.
Abosede E.E. Effect of crude oil pollution on some soil physical properties // J. Agric. Vet. Sci. 2013. V. 6. № 3. P. 14–17.
Буньо Л.В., Цвилынюк О.Н. Особенности морфогенеза осоки шершавой (Carex hirta L.) на нефтезагрязненной почве // Cибир. экол. журн. 2015. Т. 22. № 5. С. 800–809.https://doi.org/10.15372/sej20150512
Muthert L.W.F., Izzo L.G., Van Zanten M., Aronne G. Root tropisms: investigations on earth and in space to unravel plant growth direction // Front. Plant Sci. 2019. V. 10. P. 1807.https://doi.org/10.3389/fpls.2019.01807
Дубровская Е.В., Позднякова Н.Н., Муратова А.Ю., Голубев С.Н., Бондаренкова А.Д., Турковская О.В. Влияние нефтяного загрязнения на растения в условиях пониженной влажности // Экобиотехнология. 2019. Т. 2. № 3. С. 391–401.https://doi.org/10.31163/2618-964x-2019-2-3-391-401
Terek O., Laphyna O., Velychko O., Bunyo L., Dovgaiuk-Semeniuk M. Crude oil contamination and plants // J. Central Eur. Green Innov. 2015. V. 3. № 2. P. 175–184.https://doi.org/10.22004/ag.econ.206656
Khan S., Afzal M., Iqbal S., Khan Q.M. Plant-bacteria partnerships for the remediation of hydrocarbon contaminated soils // Chemosphere. 2013. V. 90. № 4. P. 1317–1332.https://doi.org/10.1016/j.chemosphere.2012.09.045
Donate-Correa J., Leon-Barrios M., Perez-Galdona R. Screening for plant growth-promoting rhizobacteria in Chamaecytisus proliferus (tagasaste), a forage tree-shrub legume endemic to the Canary Islands // Plant and Soil. 2005. V. 266. P. 261–272.https://doi.org/10.1007/s11104-005-0754-5
Jambon I., Thijs S., Weyens N., Vangronsveld J. Harnessing plant–bacteria–fungi interactions to improve plant growth and degradation of organic pollutants // J. Plant Interact. 2018. V. 13. № 1. P. 119–130.https://doi.org/10.1080/17429145.2018.1441450
Назаров А.В. Влияние нефтяного загрязнения почвы на растения // Вестн. Перм. ун-та. 2007. № 5 (10). С. 134–141.
Дополнительные материалы отсутствуют.


