Агрохимия, 2021, № 6, стр. 65-72
Влияние цианобактерий и лигногумата на рост и биохимические показатели растений ячменя
Е. В. Коваль 1, *, С. Ю. Огородникова 1, 2
1 Государственный аграрный университет Северного Зауралья
625003 Тюмень, ул. Республики, 7, Россия
2 Институт биологии Коми научного центра Уральского отделения РАН
167982 Сыктывкар, ул. Коммунистическая, 28, Россия
* E-mail: undina2-10@yandex.ru
Поступила в редакцию 27.04.2020
После доработки 29.09.2020
Принята к публикации 10.12.2020
Аннотация
Изучено влияние препарата лигногумат (ЛГ) на цианобактерии (ЦБ) рода Nostoc и природные биопленки с доминированием ЦБ, а также их совместное действие на биохимические показатели и рост растений ячменя. Установлено, что биопленки и ЦБ Nostoc muscorum более устойчивы к действию ЛГ. Высокая чувствительность к ЛГ характерна для ЦБ N. linckia и N. paludosum, что проявилось в активации процессов перекисного окисления липидов в клетках и снижении содержания хлорофилла а. Предпосевная обработка семян ЦБ N. muscorum усиливала защитные свойства ЛГ: отмечали снижение интенсивности процессов перекисного окисления липидов в листьях, накопление антоцианов и каротиноидов. Фитостимулирующее действие ЦБ N. muscorum и ЛГ проявилось в увеличении линейных размеров побегов и корней растений ячменя.
ВВЕДЕНИЕ
Для повышения устойчивости растений, улучшения их свойств и жизнеспособности используют множество гуминовых препаратов [1, 2]. В настоящее время доступны препараты, которые снижают токсическое действие поллютантов [3–6]. Лигногумат (ЛГ) – это гуминовый препарат с высоким содержанием солей гуминовых кислот, состоит на 60% из гуминовых кислот и на 40% из фульвокислот, обогащен биофильными элементами, в том числе серой и такими микроэлементами как Fe, Cu, Mn, Mo, Zn, Se, B, Co. Препарат применяют в растениеводстве, в качестве биологически активных кормовых добавок в животноводстве, в восстановлении почв, а также в биотехнологиях при производстве меристемных культур [7]. Известно, что привнесение лигногумата увеличивает урожайность сельскохозяйственных культур и улучшает качество продукции [8], усиливает иммунитет растений, а также снимает стресс после внекорневых обработок пестицидами и сложными смесями [9]. Однако при увеличении концентрации >1% препарат проявляет свойства ингибитора [4]. Действующие вещества препарата имеют достаточно сложную структуру, которая позволяет связывать токсиканты, переводя их в малоподвижную форму [10].
В современном растениеводстве используют биопрепараты на основе цианобактерий (ЦБ). Ряд ЦБ проявляют функции, схожие с действием препарата лигногумат. Они могут оказывать не только ростстимулирующее действие, но и антибиотическое, способны улучшать состояние растений в условиях сильного загрязнения [11, 12]. Благодаря своим уникальным свойствам и чувствительности к ряду токсикантов, ЦБ используют в целях биотестирования.
Действие препарата лигногумат и цианобактерий на растения можно оценить по ответным реакциям растений ячменя, в частности, по изменению интенсивности процессов перекисного окисления липидов (ПОЛ) и содержанию пластидных пигментов. Содержание пигментов – это чувствительный показатель функционального состояния растений. Факторы разной природы (засуха, чрезмерная инсоляция, поллютанты, насекомые и т.п.) вызывают изменения в пигментном комплексе растений.
Повышенная активация процессов ПОЛ в стрессовых условиях приводит к окислительной деградации макромолекул, инактивации ферментов, нарушению функции мембран митохондрий и хлоропластов и, как следствие, снижению содержания пластидных пигментов [13–15]. В ответ на рост концентрации свободных радикалов в клетке происходит запуск антиоксидантной системы растений. К клеточным антиоксидантам относятся пигменты каротиноиды и антоцианы. Антиоксиданты выполняют защитные функции в клетке, подавляя в растительных тканях окислительные процессы.
Цианобактерии обладают доказанными свойствами улучшать среду обитания растений и образовывать с ними симбиозы, что положительно влияет на жизнедеятельность растений. Например, обработка семян горчицы N. linсkia приводила к усилению фиторемедиационных способностей растения, ЦБ также обладают устойчивостью к нефтепродуктам и метилфосфонатам [16, 17]. Штамм N. paludosum способен восстанавливать супрессивность химически и микологически загрязненных почв [18]. Почвы, инокулированные N. musсorum, проявляют большую устойчивость к деградации во время смачивания и физического разрушения [19]. Эта особенность может помочь предотвратить эрозию почвы, а также способствует повышению вероятности прорастания семян в почвах, содержащих N. musсorum [19, 20]. Выбор ячменя в качестве объекта исследования был обусловлен его высокой хозяйственной ценностью как для пищевой промышленности, так и для сельского хозяйства [21]. Цель работы – изучение влияния цианобактерий и лигногумата на рост и биохимические показатели растений ячменя.
МЕТОДИКА ИССЛЕДОВАНИЯ
Объектами исследования служили альгологически чистые культуры цианобактерий N. linсkia (Roth.) Born and Flah. № 271, N. paludosum Kütz. № 18, N. muscorum Ag. № 13, природные биопленки с доминированием N. commune, а также ячмень двурядный сорта Новичок (Hordeum distichum L.).
Видовой и количественный состав альго-цианобактериальной микрофлоры определяли путем прямого микроскопирования в сочетании с методами чашечных и водных культур [22]. Видовой состав БП включал следующие виды: N. commune, N. punctiforne, Phormidium autumnale, Ph. molle, Ph. uncinatum, Leotolyngbya fragilis, L. foveolarum, Chlorella mirabilis, L. поstoсоrит, Borzila trilocularis. Доля ЦБ N. commune в данной биопленке составила 81.6%, прочие 18.4% пришлись на другие гетероцистные и безгетороцистные ЦБ и зеленые водоросли [23]. Биопленки были собраны вдоль обочины железной дороги на песчано-гравийной насыпи.
Титр клеток ЦБ и БП определяли с использованием камеры Горяева [24]. Цианобактерии для экспериментов выбирали по возрасту и титру клеток в фазе экспоненциального роста. Возраст БП исчислялся с момента внесения сухой пленки в питательную среду Громова. Возраст ЦБ и БП составил 5 нед. Титр: N. linсkia – 1.7 × 107 кл./мл, N. paludosum – 1.2 × 107 кл./мл, N. muscorum – 2.7 × 107 кл./мл, природных биопленок с доминированием N. commune – 2.4 × 107 кл./мл.
Культуры цианобактерий и биопленок пересаживали на питательные растворы с соблюдением норм стерильности. Культивировали биопленки и цианобактерии на среде Громова № 6 без азота в течение 5 нед в люминостате при постоянной температуре 25°С и 12-часовом освещении 3000 лк.
Были проведены 2 серии опытов. В первой серии опытов проводили оценку влияния ЛГ на ЦБ и природные БП с доминированием N. commune. Для этого культуры микроорганизмов (2 мл) выдерживали в пробирках на растворе ЛГ (3 мл) в концентрации 1 г/л в течение 24 ч, после чего в клетках определяли содержание хлорофилла а и интенсивность процессов перекисного окисления липидов.
Во 2-й серии опытов семена ячменя в количестве 40 шт. проращивали на увлажненной дистиллированной водой фильтровальной бумаге в чашках Петри в присутствии ЦБ N. muscorum (по 2 мл суспензии на чашку Петри) и без них. Семена проращивали 4 сут в климатостате при постоянной температуре 20°С. Затем проростки пересаживали в водную среду, в качестве которой использовали питательный раствор Кнопа (контроль) и в раствор лигногумата (1 г/л), приготовленный на растворе Кнопа. Дальнейшее проращивание проходило в климатостате при температуре 25°С и 12-часовом освещении 3000 лк.
В фазе 2-х листьев оценивали влияние обработки растений ЦБ, ЛГ и их совместного действия на функциональный статус растений ячменя по биохимическим показателям (интенсивность процессов перекисного окисления липидов (ПОЛ), содержание пластидных пигментов и антоцианов) и линейному росту.
Для изучения влияния ЦБ, ЛГ и их совместного действия на ростовые процессы отбирали по 30 растений каждого варианта, разделяли по органам, измеряли длину корней и побегов.
Интенсивность ПОЛ анализировали по цветной реакции тиобарбитуровой кислоты с малоновым диальдегидом (МДА), который образуется в процессе ПОЛ [25]. Определяли накопление МДА в культуре ЦБ (нмоль/мл) и в листьях и корнях ячменя (нмоль/г сырой массы).
Экстракцию и количественное определение антоцианов проводили согласно методике [26]. Содержание фотосинтетических пигментов в листьях ячменя определяли фотометрическим методом на спектрофотометре “Specol 1300” (Analytik Jena, Германия) в ацетоновой вытяжке (при длинах волн 662 и 644 нм – хлорофиллы а и б соответственно [27]. Определение каротиноидов проводили при 470 нм [28]. Содержание хлорофилла а в культуре ЦБ оценивали спектрофотометрическим методом при длинах волн 665 и 750 нм [29].
Все эксперименты были выполнены в трехкратной повторности. Полученные данные обрабатывали с использованием стандартных статистических методов [30]. В таблицах приведены средние арифметические величины и стандартное отклонение. Достоверность различий между 2-мя средними оценивали с использованием t-критерия Стьюдента.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Лигногумат относится к препаратам 4-го класса опасности и не оказывает токсическое, мутагенное и канцерогенное действие на растения и здоровье человека. Однако при превышении концентрации >1% препарат проявляет свойства ингибитора. Действие различных концентраций на растения хорошо изучено, но влияние ЛГ на ЦБ и прочие микроорганизмы изучено слабо. Именно поэтому была выбрана концентрация ЛГ (1 г/л), которая рекомендована производителем для использования и ее наиболее часто применяют, т.к. она не способна оказывать токсическое влияние на растения.
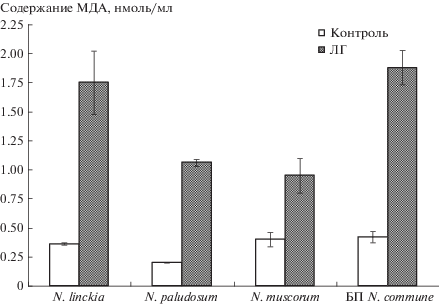
В первой серии опытов было установлено, что ЛГ (1 г/л) вызывал рост интенсивности процессов ПОЛ в клетках ЦБ. Во всех вариантах эксперимента, как в альгологически чистых культурах ЦБ, так и природных БП, отмечали возрастание уровня МДА – основного продукта реакций ПОЛ (рис. 1). Накопление МДА является одним из симптомов развития окислительных процессов в клетках [31]. Наибольшее содержание МДА отмечали в варианте с использованием ЦБ N. linckia и БП, где интенсивность процессов ПОЛ была более чем в 4 раза больше по сравнению с контролем.
Рис. 1.
Влияние лигногумата на активность перекисного окисления липидов в клетках цианобактерий и природных биопленок с доминированием N. commune.
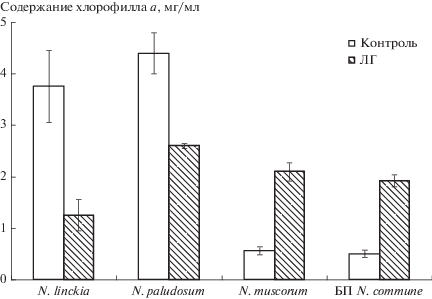
В вариантах с действием ЛГ на N. linckia и N. paludosum активация ПОЛ сопровождалась значительным снижением количества хлорофилла а в клетках (рис. 2). Уменьшение содержания хлорофилла а может быть следствием активации окислительных процессов, в ходе которых происходила деградация молекул хлорофилла, а также инактивация ферментов биосинтеза пигментов. Цианобактерия N. muscorum и природные БП были более устойчивы к действию ЛГ. Под влиянием ЛГ содержание зеленого пигмента в клетках ЦБ возрастало более чем в 3 раза по сравнению с контролем.
Рис. 2.
Влияние лигногумата на содержание хлорофилла а в клетках цианобактерий и природных биопленок с доминированием N. commune.
В стрессовых условиях изменение интенсивности процессов ПОЛ может свидетельствовать как о патологических состояниях, так и о процессах адаптации [32]. Устойчивость к факторам внешней среды БП обеспечивается их поликомпонентностью: фототрофные и сапротрофные микроорганизмы и их бактерии-спутники [33, 34]. Ранее была показана устойчивость ЦБ N. muscorum к действию фосфорорганического ксенобиотика – метилфосфоновой кислоты [35]. Вероятно, при высокой интенсивности процессов ПОЛ разрушению хлорофилла а препятствовала эффективная работа антиоксидантной системы в клетках ЦБ, которая включает множество активных веществ. Известно, что высокую устойчивость ЦБ к действию стрессовых факторов обеспечивает содержание токоферола и фенольных соединений [36], каротиноидов [37], антиоксидантов аскорбат-глутатионового цикла [38], флавоноидов [39]. В случае БП и ЦБ N. muscorum повышенное накопление МДА могло свидетельствовать о процессах адаптации.
На основании ответных реакций ЦБ можно сделать вывод о высокой чувствительности ЦБ N. linckia и N. paludosum к действию ЛГ. Биопленки с доминированием N. commune и ЦБ N. muscorum, напротив, отличались повышенной устойчивостью к гуминовому препарату.
Для исследования эффектов ЦБ и ЛГ на жизнедеятельность растений ячменя была выбрана ЦБ N. muscorum, как наиболее устойчивая к действию ЛГ. Во 2-й серии опытов семена ячменя инокулировали при проращивании ЦБ и переносили в питательный раствор, содержащий лигногумат.
Известно, что лигногумат (0.2, 0.5 и 1 г/л) не оказывает влияние на всхожесть и энергию прорастания семян ячменя [40]. Предварительная инокуляция семян ячменя ЦБ N. muscorum вызывала повышение их жизнеспособности [35].
Установлено, что ЦБ N. muscorum вызывала активацию процессов ПОЛ в листьях ячменя (рис. 3а). В вариантах с действием ЛГ, напротив, уровень МДА в листьях был меньше на 20% по сравнению с контролем.
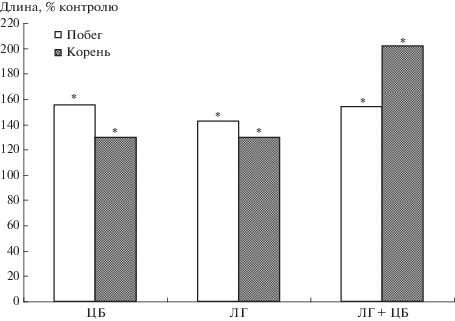
Рис. 3.
Влияние препарата лигногумат и цианобактерии N. muscorum на активность перекисного окисления липидов: (а) – в листьях, (б) – корнях растений ячменя.
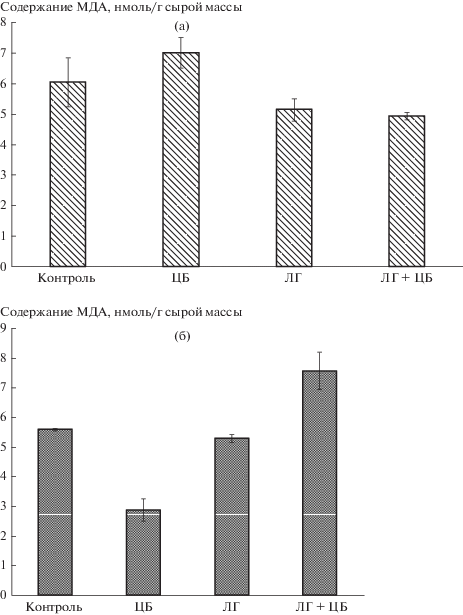
По сравнению с надземной частью, корни реагировали на ЛГ и ЦБ N. muscorum иначе (рис. 3б). Обработка семян ЦБ N. muscorum приводила к снижению интенсивности процессов ПОЛ в корнях (на 49% меньше контроля). При действии ЛГ также отмечали незначительное снижение МДА в корнях. Однако совместное действие на растения ЦБ и ЛГ вызывало активацию процессов ПОЛ в корнях. Это могло быть связано с комплексным действием на корни ЛГ, ЦБ и экзометаболитов ЦБ и направлено на адаптацию растений к условиям произрастания.
Развитие окислительных процессов в клетках листьев ячменя оценивали по накоплению веществ с антиоксидантыми свойствами – каротиноидов и антоцианов. В листьях растений, которые перед посадкой были обработаны N. muscorum, содержание каротиноидов было близко к контролю, но уровень антоцианов значительно возрастал (табл. 1). Ранее было показано, что ЦБ вызывали активацию процессов ПОЛ в листьях растений этого варианта. По-видимому, N. muscorum индуцировала развитие окислительных процессов в клетках листьев ячменя, которые способствовали адаптации к действию ЦБ. Результатом эффективной работы антиоксидантной системы являлся уровень хлорофиллов в листьях. В варианте с инокуляцией семян ЦБ содержание хлорофиллов было больше, чем в контроле.
Таблица 1.
Влияние лигногумата и цианобактерии N. muscorum на содержание пигментов в листьях ячменя
| Вариант | Содержание пластидных пигментов, мг/г сухой массы | Содержание антоцианов, % | ||
|---|---|---|---|---|
| хлорофилл | каротиноиды | |||
| а | б | |||
| Контроль | 6.65 ± 0.14 | 2.51 ± 0.50 | 1.60 ± 0.03 | 0.0390 ± 0.0029 |
| ЦБ | 7.05 ± 0.38 | 2.80 ± 0.19 | 1.49 ± 0.07 | 0.0540 ± 0.0034* |
| ЛГ | 6.81 ± 0.52 | 2.86 ± 0.40 | 1.84 ± 0.13 | 0.0770 ± 0.0092* |
| ЛГ + ЦБ | 6.67 ± 0.32 | 2.78 ± 0.05 | 1.73 ± 0.16 | 0.0580 ± 0.0082* |
В опытах с действием на растения ЛГ и ЛГ с ЦБ N. muscorum также отмечали накопление в листьях антиоксидантов – антоцианов и каротиноидов, при этом интенсивность процессов ПОЛ была снижена по сравнению с контролем. В присутствии ЛГ в листьях ячменя содержание хлорофиллов было больше по сравнению с контрольными растениями.
Интегральным процессом, который отражает степень приспособления растений к условиям обитания, является рост. Предпосевная инокуляция семян ЦБ N. muscorum, как и ЛГ, стимулировала процессы линейного роста органов ячменя (рис. 4). В большей степени ростактивирующее действие на растения ячменя проявилось в варианте с совместным действием ЛГ и ЦБ N. muscorum. В большей степени происходила стимуляция роста корней по сравнению с надземными органами.
ВЫВОДЫ
1. На основании изучения интенсивности процессов перекисного окисления липидов (ПОЛ) и накопления хлорофилла а в клетках цианобактерий (ЦБ) установлено, что лигногумат (ЛГ) в концентрации 1 г/л оказывал неоднозначное действие на ЦБ. Для ряда культур ЛГ в исследованной концентрации выступал в качестве стресс-фактора.
2. Высокая чувствительность к ЛГ, которая проявилась в многократном росте интенсивности процессов ПОЛ в клетках и существенном снижении уровня хлорофилла а, отмечена у ЦБ N. linckia и N. paludosum. ЦБ N. muscorum и природные биопленки с доминированием ЦБ N. commune были наиболее устойчивы к действию гуминового препарата ЛГ.
3. Предпосевная обработка семян ЦБ N. muscorum оказывала фитостимулирующее действие на опытные растения. В листьях растений ячменя, выращенных с использованием ЦБ в присутствии ЛГ, отмечено снижение интенсивности процессов ПОЛ. В корнях ячменя при совместном действии ЛГ и ЦБ, напротив происходило накопление МДА. Выявлена стимуляция ростовых процессов в проростках опытных растений. Цианобактериальная инокуляция семян N. muscorum и использование ЛГ способствовала росту корней и побегов ячменя. Установленная закономерность может быть использована для разработки биопрепарата для повышения устойчивости растений.
Выражаем благодарность доктору биологических наук, профессору Л.В. Кондаковой за предоставленные для исследования природные биопленки с доминированием цианобактерий и определение их видового состава.
Благодарим музей фототрофных микроорганизмов кафедры ботаники, физиологии растений и микробиологии им. Э.А. Штиной ВятГСХА (г. Киров) за опытные культуры цианобактерий.
Список литературы
Yakimenko O., Izosimov A. Structure and properties of humates from coallified materials, peat and sapropel // Humic substances in ecosystems. Slovakia, Soporna, 2009. P. 43–45.
Неверова О.А., Егорова И.Н., Жеребцов С.И., Исмагилов З.Р. Влияние гуминовых препаратов на процесс прорастания и активность амилолитических ферментов семян Sinaps аlba L. // Вестн. АлтайГАУ. 2013. № 6 (104). С. 43–46.
Дагуров А.В., Стом Д.И., Вятчина О.Ф., Балаян А.Э., Кушнарев Д.Ф. О механизме антидотного действия гуматов по отношению к нефтепродуктам // Бюл. ВСНЦ СО РАМН. 2005. № 6. С. 143–145.
Коновалов А.С. Оценка детоксикации гуматами растворов соли мышьяка методами биотестирования // Acta Biomed. Sci. 2013. № 2 (1). С. 115–119.
Антонова О.И., Зубченко Е.Б., Скокова О.В. Эффективность использования гуматов при загрязнении почв тяжелыми металлами // Вестн. АлтайГАУ. 2003. № 2. С. 21–26.
Таран Д.О., Саксонов М.Н., Плеханов С.Е. Токсическое действие ароматических соединений на гидробионты и его ослабление гуминовыми веществами // Вестн. ИрГСХА. 2012. № 50. С. 87–94.
Лигногумат: общая информация, методика и результат применения. Рекоменд. для агрономов. СПб., 2011. 48 с.
Перминова И.В., Жилин Д.М. Гуминовые вещества в контексте зеленой химии // Зеленая химия в России / Под. ред. Лунина В.В. Сб. научн. ст. М.: Изд-во МГУ, 2004. С. 146–162.
Стифеев А.И., Шамин Д.В., Казначеев А.М. Эффективность гуминовых препаратов на посевах яровых зерновых культур // Вестн. КурскГСХА. 2008. № 3. С. 12–14.
Исхаков Х.А. Гуминовые комплексы // Вестн. КузГТУ. 2010. № 6. С. 126–129.
Трефилова Л.В. Использование цианобактерий в агробиотехнологии: Автореф. дис. … канд. биол. наук. Саратов: ИБФРМ РАН, 2008. 26 с.
Домрачева Л.И. Биологическая защита сеянцев от болезней в питомниках // Леса Кировской области / Под ред. Видякина А.И., Ашихминой Т.Я., Новоселовой С.Д. Киров: ОАО “Кировская областная типография”, 2008. С. 292–299.
Veronesi C., Rickaner M., Fournier J., Pouenat M.-L., Esquerre-Tugaye M.-T. Lipoxygenase gene expression in the Tobacco–Phytophtora parasitica nicotianae interaction // Plant Physiol. 1996. V. 112. P. 997–1004.
Владимиров Ю.А. Биологические мембраны и незапланированная смерть клетки // Сорос. образ. журн. 1999. Т. 6. № 9. С. 2–9.
Владимиров Ю.А. Свободные радикалы в биологических системах // Сорос. образ. журн. 1999. Т. 6. № 12. С. 13–19.
Горностаева Е.А., Фокина А. И., Лаптев Д.С. Влияние ионов меди (II) на биохемилюминесценцию почвенных цианобактерий // Мат-лы Всерос. конф. “Адаптационные реакции живых систем на стрессорные воздействия”. Киров, 2012. С. 114–120.
Коваль Е.В., Огородникова С.Ю. Влияние цианобактерии Nostoc linckia на показатели жизнедеятельности растений ячменя, выращенных в модельных опытах в присутствии метилфосфоновой кислоты // Агрохимия. 2014. № 12. С. 65–70.
Домрачева Л.И., Кондакова Л.В., Ашихмина Т.Я. Применение тетразольно-топографического метода определения гидрогеназной активности цианобактерий в загрязненных средах // Теор. и прикл. экол. 2008. № 2. С. 23–28.
Rogers S.L., Burns R.G. Changes in aggregate stability, nutrient status, indigenous microbial populations, and seedling emergence, following inoculation of soil with Nostoc muscorum // Biol. Fertil. Soil. 1994. V. 18. № 3. P. 209–215.
Cameron R.E. Communities of soil algae occurring in the sonoran desert in Arizona // J. Arizona Acad. Sci. 1960. V. 1. № 3. P. 85–88.
Губанов И.А. Hordeum vulgare L. – ячмень обыкновенный // Иллюстрированный определитель растений Средней России в 3 т. М.: Тов-во науч. изд. КМК, Ин-т технолог. исслед., 2002. 259 с.
Голлербах М.М., Штина Э.А. Почвенные водоросли. Л.: Наука, 1969. 228 с.
Горностаева Е.А., Фокина А.И., Кондакова Л.В., Огородникова С.Ю., Домрачева Л.И., Лаптев Д.С., Сластникова Е.М. Потенциал природных биопленок Nostoc commune как сорбентов тяжелых металлов в водной среде // Вода: химия и экология. 2013. С. 93–101.
Нетрусов А.И. Практикум по микробиологии: учеб. пособие для студ. высш. уч. завед. М.: Издат. дом “Академия”, 2005. 608 с.
Лукаткин А.С. Холодовое повреждение теплолюбивых растений и окислительный стресс. Саранск: Изд-во Мордов. ун-та, 2002. 208 с.
Муравьева Д.А., Бубенчикова В.Н., Беликов В.В. Спектрофотометрическое определение суммы антоцианов в цветках василька синего // Фармация. 1987. № 5. С. 28–29.
Шлык А.А. Определение хлорофиллов и каротиноидов в экстрактах зеленых листьев // Биохимические методы в физиологии растений / Под ред. Павлиновой О.А. М.: Наука, 1971. С. 154–170.
Маслова Т.Г., Попова И.А., Попова О.Ф. Критическая оценка спектрофотометрического метода количественного определения каротиноидов // Физиология растений. 1986. Т. 39. Вып. 6. С. 615–619.
Aminot A., Rey F. Standard procedure for the determination of chlorophyll a by spectroscopic methods. Denmark, Copengagen: ICES Tech-niques in Marine Environmental Sciences, 2000. 25 p.
Лакин Г. Ф. Биометрия. М.: Высш. шк., 1973. 343 с.
Blokhina O., Virolainen E., Fagerstedt K.V. Antioxidants, oxidative damage and oxygen deprivation stress: a review // Annal. Bot. 2003. V. 91. P. 179–194.
Лелевич В.В. Биологическая химия. Гродно: ГрГМУ, 2009. 275 с.
Домрачева Л.И., Кондакова Л.В., Пегушина О.А., Фокина А.И. Биопленки Nostoc commune – особая микробная сфера // Теор. и прикл. экол. 2007. № 1. С. 15–20.
Панкратова Е.М., Трефилова Л.В., Зяблых Р.Ю., Устюжанин И.А. Цианобактерия Nostoc paludosum Kutz как основа для создания агрономически полезных микробных ассоциаций на примере бактерий рода Rhizobium // Микробиология. 2008. Т. 77. № 2. С. 266–272.
Коваль Е.В., Огородникова С.Ю. Влияние цианобактерии Nostoc muscorum на устойчивость растений ячменя к действию метилфосфоновой кислоты // Теор. и прикл. экол. 2014. № 2. С. 61–66.
Storme J.Y., Golubic S., Wilmotte A. Raman characterization of the UV-protective pigment gloeocapsin and its role in the survival of Cyanobacteria // Astrobiology. 2015. V. 10. P. 843–857.
Schagerl M., Muller B. Acclimation of chlorophyll a and carotinoid levels to different irradiances in four freshwater // J. Plant Physiol. 2006. V. 163. P. 709–716.
Latifi A., Ruiz M., Zhang Ch.-C. Oxidative stress in cyanobacteria // FEMS Microbiol. Rev. 2009. V. 33. P. 258–278.
Singh D.P., Prabha R., Meena K.K. Induced accumulation of polyphenolics and flavonoids in cyanobacteria under salt stress protects organisms through enhanced antioxidant activity // Am. J. Plant Sci. 2014. V. 5. P. 726–735.
Огородникова С.Ю. Эффекты лигногумата на фитотоксичность фосфорсодержащих соединений (модельные опыты) // Вестн. НижневартовскГУ. 2020. № 1. С. 60–68.
Дополнительные материалы отсутствуют.