Агрохимия, 2021, № 6, стр. 79-90
Оценка воздействия меди на проростки сортов ярового двурядного ячменя (Hordeum vulgare L.) различного географического происхождения
А. В. Дикарев 1, *, В. Г. Дикарев 1, Н. С. Дикарева 1
1 Всероссийский научно-исследовательский институт радиологии и агроэкологии
249032 Калужская обл., Обнинск, Киевское шоссе, 109 км, Россия
* E-mail: ar.djuna@yandex.ru
Поступила в редакцию 17.01.2020
После доработки 25.03.2020
Принята к публикации 11.03.2021
Аннотация
Исследовано воздействие тяжелого металла (ТМ) – меди на проростки нескольких сортов ярового ячменя различного географического происхождения. Оценивали морфометрические параметры растений – длину проростка и корня, количество всхожих семян и сильных проростков. Отмечено подавление развития проростков по мере увеличения концентрации ТМ, возникновение морфологических аномалий корней. На основе полученных данных сделаны выводы о критической дозе Cu2+, вызывающей значимое, но не летальное угнетение указанных параметров, выявлены сорта, обладающие повышенной устойчивостью или чувствительностью к данному ТМ. Для раскрытия механизмов формирования показанных эффектов был проведен цитогенетический анализ клеток апикальной меристемы корней проростков одного из использованных сортов. По мере роста дозы Cu2+ отмечено нарастание частоты аберрантных клеток и возникновение цитогенетических аномалий, главным образом связанных с повреждением аппарата веретена деления. Сделаны выводы о механизмах формирования ответа растительного организма на действие повреждающих агентов химической природы на примере меди, определена критическая доза этого ТМ, пригодная для дифференциации сортов ячменя по их устойчивости.
ВВЕДЕНИЕ
Между всеми циркулирующими в биосфере химическими элементами имеется некое соотношение, обеспечивающее нормальное функционирование экосистем в течение неограниченного времени. Однако деятельность человека ведет к нарушению этого соотношения за счет истощения одних элементов и избыточного накопления других. Например, в процессе добычи полиметаллических руд, в которых совместно встречаются такие элементы, как медь, свинец, кадмий, никель, цинк, происходит их неизбежное накопление в окружающей среде [1, 2]. Накапливаясь в почвах сельскохозяйственных угодий, соединения этих металлов оказывают токсическое воздействие на возделываемые в этих условиях культуры, ограничивая их продуктивность и создавая потенциальную угрозу для здоровья человека и домашних животных. Помимо этого, дополнительно способствует накоплению в почвах токсичных соединений также и внесение минеральных удобрений (фосфатные удобрения могут содержать тяжелые металлы), а также использование для полива промышленных сточных вод [2, 3]. Все эти процессы, ведущие к увеличению содержания в почвах доступных для растений соединений тяжелых металлов (ТМ), делают весьма актуальной задачу исследования механизмов формирования устойчивости растений к их токсическому действию.
Одним из значимых представителей группы ТМ является медь. Данный металл может быть и микроэлементом, необходимым для нормального функционирования растительного организма. Ионы Cu2+ входят в состав ряда важных белков, участвующих в различных жизненных процессах, например, пластоцианинов, Cu/Zn-супероксиддисмутазы, цитохром С-оксидазы, лакказы, аминооксидазы, полифенилоксидазы [4, 5]. Медь вовлечена в ряд метаболических процессов, таких как фотосинтез, дыхание, детоксикация супероксид-радикалов, лигнификация и другие [6]. В то же время в больших количествах медь весьма токсична для растений [7], а вследствие хозяйственной деятельности человека ее содержание в природных и аграрных экосистемах постоянно растет [8]. Основным путем, по которому медь способна проникать в организм растения, является поглощение почвенного раствора через корень.
Учитывая высокое значение для народного хозяйства проблемы загрязнения почв сельскохозяйственных угодий ТМ, становится важной задача глубокого изучения ответа на их воздействие основных групп культурных растений и выведения таких сортов, которые обладали бы повышенной устойчивостью к токсическому стрессу [9, 10]. Подходящим объектом для таких исследований является яровой ячмень (Hordeum vulgare L.). Таковым данное растение делают его следующие особенности. Ячмень – однолетник с коротким жизненным циклом, он обладает диплоидным набором из всего лишь 7-ми пар хромосом, легкость в культивировании позволяет выполнять на этом объекте множество разнообразных тестов, разные сорта ячменя обладают широкой вариабельностью физиологических, генетических и морфологических свойств, геном ячменя полностью расшифрован и картирован [11]. Помимо этого, ячмень является одной из важнейших сельскохозяйственных культур, занимая 4-е место по распространению в мире после риса, пшеницы и кукурузы [12]. Его широко возделывают в самых разнообразных почвенно-климатических условиях, и он известен с глубочайшей древности. В связи с этим представляет интерес выполнение такого исследования с использованием сортов ячменя различного географического происхождения, которое позволило бы выявить варианты с повышенной устойчивостью к ТМ, в том числе, к меди. Собранные в его рамках данные могут быть использованы для поиска кандидатных генетических ресурсов в целях селекционной работы, направленной на выведение таких сортов ячменя, которые бы успешно переносили техногенный стресс, и в то же время позволяли получать качественную и безопасную сельскохозяйственную продукцию.
Таким образом, цель работы – определение критической дозы Cu2+ в растворе для проростков ячменя по морфометрическим и цитогенетическим показателям на примере нескольких сортов данной культуры различного географического происхождения. Под критической дозой в этом случае понимали такую, которая вызывала существенное угнетение жизненных процессов проростков ячменя и возникновение различных эффектов, наблюдаемых на всех уровнях биологической организации, но еще не была летальной, позволяя растениям относительно нормально развиваться. Помимо этого, важной задачей также являлось выполнение цитогенетического анализа воздействия меди на пролиферативную активность клеток апикальной меристемы корней проростков.
Научной новизной данного исследования явилось то, что впервые была установлена на основе морфометрических и цитогенетических критериев критическая доза Cu2+, пригодная для дифференциации различных сортов ячменя на устойчивые и чувствительные к данному ТМ. Это открывает дорогу для анализа внутривидового полиморфизма этой культуры по ответу растений на токсическое воздействие меди и подбора исходного материала для селекционной работы, направленной на формирование повышенной устойчивости к ТМ.
МЕТОДИКА ИССЛЕДОВАНИЯ
Выбор сортов для настоящей работы определяли собранные ранее данные [13–15] по исследованию ответа 100 сортов ярового ячменя различного географического происхождения на действие критических концентраций Pb2+ и Cd2+. Было интересно выяснить, будут ли сорта ячменя, ранее, с двумя другими ТМ показавшие себя как устойчивые или чувствительные соответственно к кадмию и и/или свинцу сохранять свой статус и для меди. Таким образом, были взяты семена 4-х сортов ярового двурядного ячменя – Симфония (Харьковская обл.), Pek (Югославия), Jelen (Югославия), Местный (Удмуртия). Растения выращивали рулонным методом в сосудах с 300 мл раствора Cu(NO3)2 в течение 5-ти сут при 20°С, как рекомендовано в работе [16], в каждом варианте брали по 100 семян. Содержание Cu2+ в растворах составляло: 0, 0.05, 0.1, 0.15, 0.2, 0.25, 0.3, 0.35 мг/мл, всего по 8 вариантов для каждого сорта. После завершения указанного срока у проростков оценивали следующие показатели: среднюю длину проростков и корней, число всхожих семян и сильных проростков. Под сильными проростками понимали нормально развитые [16], у которых росток занимал не менее половины колеоптиля, а также имелось как минимум 3 корня длиной >5 мм.
Цитогенетический анализ клеток апикальной меристемы корней был выполнен с использованием анафазного метода на проростках сорта Симфония [17, 18]. Семена проращивали рулонным методом в растворах Cu(NO3)2 с концентрациями 0, 0.01, 0.03, 0.07, 0.1 мг/мл. Корни длиной ≈10 мм на стадии 1-го митоза фиксировали в фиксаторе Кларка (этанол 95% : ледяная уксусная кислота = 3 : 1). Временные давленные препараты апикальной меристемы корней проростков окрашивали ацетоорсеином и анализировали при увеличении 40 × 10 на микроскопе “Nikon Eclipse E200” (Япония). В каждом варианте анализировали 6–7 тыс. ана-телофаз. Учитывали частоту (в %) следующих цитогенетических нарушений: мостов, фрагментов, отставаний хромосом, мультиполярных митозов, слипаний хромосом, патологических анафаз, неправильных расхождений хромосом. Для оценки пролиферативной активности клеток апикальной меристемы рассчитывали митотический индекс для 12-ти препаратов. В каждом варианте изучали ≈1–1.5 тыс. клеток. Достоверность собранных данных определяли за счет вычисления оптимального объема выборки, дисперсии, стандартных ошибок и отклонения, доверительного интервала. Расчеты производили в программной среде MS Excel.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Анализ ответа проростков 4-х сортов ячменя на действие диапазона концентраций меди по морфометрическим параметрам дал следующие результаты. Длина корней у всех сортов (рис. 1а) значительно сокращалась уже при минимальной концентрации 0.05 мг Cu2+/мл (до 15–30% от контроля). В дальнейшем уменьшение средних длин корней происходило постепенно до дозы 0.15 мг Cu2+/мл, но далее существенно не менялось. При максимальной дозе 0.35 мг Cu2+/мл корни у большинства проростков практически отсутствовали у всех 4-х сортов. По этому показателю дифференцировать сорта по устойчивости к меди с уверенностью не удалось – изменения показателя во всех случаях находились в пределах ошибки. Только при минимальной концентрации 0.05 мг Cu2+/мл один из сортов (Jelen) имел значимо более меньшую длину корней, чем у других сортов.
Рис. 1.
Влияние разных концентраций меди на проростки 4-х сортов ярового ячменя: (а) – длина корней, (б) – длина проростков, (в) – число сильных проростков, (г) – количество всхожих семян.
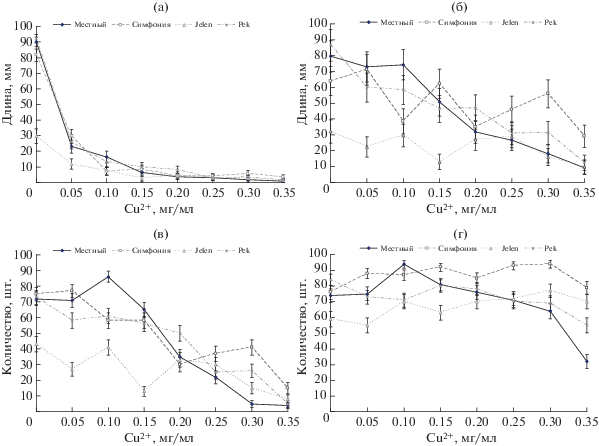
Иную закономерность наблюдали для второго из рассмотренных показателей – длины проростков (рис. 1б). В целом отмечено постепенное сокращение длины проростков по мере возрастания концентрации ТМ. Для сорта Местный концентрация Cu2+, вызывавшая сокращение в 2 раза рассмотренных показателей, составила 0.2 мг Cu2+/мл. Для сорта Симфония наблюдали синусоидальное изменение величин этого показателя, и в 2 раза он сокращался лишь при максимальной дозе 0.35 мг Cu2+/мл; у сорта Pek тоже отмечены изменения этого показателя, но менее резкие, и сокращение величины показателя в 2 раза наблюдали при концентрации 0.15 мг Cu2+/мл. Интерпретировать данные анализа показателей сорта Jelen оказалось затруднительно, в виду того, что при всех рассмотренных дозах они оказались довольно низкими по сравнению с другими сортами (в том числе в контрольном варианте). Таким образом, по длине проростков удалось выявить разделение испытанных сортов на более или менее устойчивые к действию меди. Наиболее устойчивыми оказались сорта Местный и Симфония, а Jelen продемонстрировал высокую чувствительность к Cu2+. Показатели сорта Pek находились примерно на уровне первых 2-х сортов, но не демонстрировали заметной устойчивости или чувствительности к меди.
По количеству сильных проростков (рис. 1в) также отмечали дифференциацию особенностей ответа исследованных сортов на действие меди. У сорта Местный количество таких проростков не сокращалось до концентрации 0.15 мг Cu2+/мл, более того, при 0.1 мг Cu2+/мл сильных проростков оказалось значимо больше, чем в контрольном варианте. Сокращение количества сильных проростков в 2 раза у этого сорта отмечено лишь при концентрации 0.2 мг Cu2+/мл, далее оно постепенно уменьшалось до дозы 0.3 мг Cu2+/мл и затем уже не менялось при полном угнетении развития растений.
Достаточно устойчивым оказался и сорт Симфония. Сокращение количества сильных проростков под воздействием меди у этого сорта наблюдали с дозы 0.1 мг Cu2+/мл, но оно было не слишком резким. Критическую дозу, вызывавшую сокращение показателя в 2 раза, в данном случае уверенно выявить не удалось, поскольку сокращение этого показателя после концентрации 0.2 мг Cu2+/мл сменялось его постепенным ростом до концентрации 0.3 мг Cu2+/мл. Лишь при максимальной дозе 0.35 мг Cu2+/мл наблюдали угнетение развития проростков. Сорт Pek продемонстрировал более предсказуемый ответ на действие поллютанта. По мере возрастания концентрации меди отмечено постепенное уменьшение величины исследованного показателя, и критической оказалась доза 0.25 мг Cu2+/мл. Сорт Jelen показал аналогичную с предыдущим показателем (длиной проростков) закономерность: наблюдали изменения этого параметра, но при этом уже при минимальных концентрациях ТМ они были довольно низкими, как и в контроле. Сильных проростков у этого сорта стало в 2 раза меньше, чем в контрольном варианте при концентрации 0.3 мг Cu2+/мл.
Показатель “число всхожих семян” оказался наименее чувствительным к действию меди. У всех изученных сортов наблюдали несущественные изменения этого параметра, в ряде случаев – его рост по сравнению с контрольным вариантом. Даже при максимальной концентрации ТМ (0.35 мг Cu2+/мл) у двух сортов Симфония и Jelen этот параметр был значимо больше контроля. Только сорт Pek показал постепенное уменьшение величины показателя, но при этом отмечены существенные изменения при различных дозах ТМ. Иная закономерность проявилась для сорта Местный, у которого в начале до дозы 0.1 мг Cu2+/мл величина этого показателя возрастала, становясь значимо более высокой, чем в контроле, но затем постепенно уменьшалась. Однако значимо меньше контроля этот показатель для сорта Местный становился только при максимальной концентрации 0.35 мг Cu2+/мл.
Резюмируя полученные при анализе всех дозовых зависимостей данные, можно сказать, что наиболее информативными показателями оказались средняя длина проростков и количество сильных проростков. Два других не позволили выявить отчетливых закономерностей. Относительную устойчивость к токсическому действию меди показали сорта Местный и Симфония, а наиболее чувствительным оказался сорт Jelen.
Вместе с описанными изменениями в морфометрических параметрах воздействие меди провоцировало визуально заметные нарушения морфологии корней проростков (рис. 2): утрату геотропизма некоторых проростков при высоких концентрациях ТМ, изменение цвета с белого на буро-желтый и исчезновение корневых волосков, вздутие кончиков корней, изменение плотности тканей и другие. Аналогичные сообщения об изменениях в морфологии корней под действием ТМ уже неоднократно публиковались ранее [19], и они же были отмечены в нашем исследовании, посвященном влиянию Pb2+ на проростки ячменя [13–15].
Рис. 2.
Изменения морфологии корней 5-суточных проростков ярового ячменя сорта Симфония: (а) – контроль, (б) – 0.15 мг Cu2+/мл.

Чтобы изучить возможные причины формирования рассмотренных в предыдущем эксперименте эффектов, а также чтобы сделать определение критической концентрации Cu2+ более точным и комплексным, т.е. учитывающим особенности ответа растительного организма на действие ТМ на разных уровнях организации, был выполнен цитогенетический анализ. Используя такой метод, возможно обнаружить различные нарушения в функционировании живой системы на хромосомном уровне, прежде чем воздействие токсиканта проявится визуально на морфологическом уровне. Были изучены клетки апикальной меристемы проростков сорта Симфония, его выбор для работы был обусловлен тем, что данный сорт проявил себя относительно устойчивым к действию меди, что позволило рассмотреть достаточно широкий диапазон доз поллютанта, проследив постепенное развитие стрессовых эффектов. Кроме того, данный сорт ранее [13–15] также показал свою устойчивость к свинцу и кадмию.
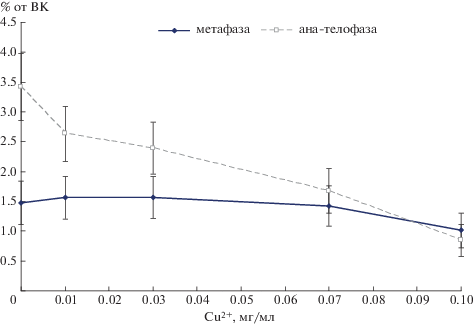
Выявлено, что митотический индекс (МИ) – показатель, позволяющий оценить митотическую активность клеток апикальной меристемы корней проростков, под действием меди изменялся не существенно (рис. 3). При невысоких дозах поллютанта (0.01–0.03 мг Cu2+/мл) наблюдали определенные изменения этого показателя, однако они отклонялись от контроля на незначимую величину. При более высоких концентрациях Cu2+ (0.07 и 0.1 мг/мл) МИ все же был меньше контроля, однако все равно мало отличался от варианта 0.01 мг Cu2+/мл (различия в пределах ошибки). Отмечено, что форма кривой для частоты профаз была практически идентична таковой для МИ. Из этого следует вывод, что делящиеся клетки главным образом находились на этой стадии клеточного деления. Логично предположить, что такой феномен связан с тем, что токсическое воздействие меди приводило к задержке митоза, в итоге делящиеся клетки не могли нормально завершить этот процесс и перейти в интерфазу.
Рис. 3.
Митотический индекс и частота профаз в клетках апикальной меристемы корней проростков ячменя сорта Симфония при действии различных концентраций меди.

Дозовые зависимости для остальных фаз митоза приведены на рис. 4. Хорошо видно, что частота метафаз во всем исследованном диапазоне концентраций оставалась стабильной, и отклонения во всех вариантах были минимальными. Иную ситуацию отметили для ана-телофаз: фактически происходило линейное сокращение частот поздних фаз митоза, и при максимальной дозе 0.1 мг Cu2+/мл таковых частот были значимо меньше контроля. Учитывая, что в этих фазах ключевое значение имеет функционирование аппарата веретена деления, можно с уверенностью предположить, что воздействие меди приводило к нарушениям в его работе. Следует отметить, что нами были предприняты попытки изучить воздействие на клеточное деление и более высоких концентраций меди, однако это оказалось невозможным: делящиеся клетки практически исчезали. В этой связи надо указать также и на сближение кривых МИ и профаз, и это говорит о том, что все больше клеток теряют способность миновать данную стадию митоза, и определяется такой феномен накоплением тяжелых цитогенетических аномалий. Фактически хромосомы теряют подвижность и деградируют, слипаясь в неопределенную массу, и это делает переход на поздние фазы митоза крайне затруднительным. Таким образом, величина МИ остается стабильной, несмотря на исчезновение клеток в ана-телофазах, и она определяется главным образом профазами. Полученные нами данные о реакции процесса пролиферации на действие меди в основном соответствуют эффектам, наблюдавшимся в наших предшествующих исследованиях, выполненных на том же объекте (яровом ячмене), но при действии других ТМ – свинца и кадмия [13–15]. Имеются и сообщения иных авторов [20], получивших сходные результаты на других объектах.
Рис. 4.
Частота клеток в мета- и ана-телофазах апикальной меристемы корней проростков сорта Симфония при действии различных концентраций меди.
Высказанное выше предположение о том, что воздействие меди на клетки апикальной меристемы приводит к повреждению аппарата веретена деления, подтверждается анализом частоты и спектра цитогенетических нарушений. Отмечено, что в отличие от эффектов, вызываемых действием, например, ионизирующего излучения, в рассмотренном случае не отмечено увеличения выхода аномалий, связанных с повреждением собственно вещества хромосом и ДНК (фрагментов, мостов). В то же время нарушения, сопряженные с повреждением веретена деления и сбоями нормального процесса кариокинеза (отставание и слипание хромосом, многополюсные митозы, патологические анафазы, неправильные расхождения хромосом) составляли основное количество регистрируемых аномалий, и их частоты, как правило, возрастали по мере увеличения дозы ТМ (табл. 1). В целом дозовая зависимость для частоты аберрантных клеток показала практически линейный рост по мере увеличения концентрации меди, описываемый прямой с постоянным углом наклона (рис. 5). Сравнивая результаты, полученные при цитогенетическом анализе ответа клеток апикальной меристемы корней проростков ячменя для 3-х ТМ (свинца, кадмия и меди), можно отметить общие закономерности –высокий выход нарушений, связанных с повреждением веретена деления.
Таблица 1.
Спектр цитогенетических нарушений в клетках апикальной меристемы корней проростков сорта Симфония при действии различных концентраций Cu2+
| Cu2+, мг/мл | Число клеток с разными типами нарушений | Всего | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| f ' | f '' | m' | m'' | g | mp | ndis | agg | pata | and | ||
| 0 | 0.018 | 0.236 | 0.109 | 0.055 | 0.672 | 0 | 0 | 0 | 0 | 0 | 1.090 |
| 0.25 | 0.087 | 0.115 | 0.144 | 0.087 | 0.505 | 0.115 | 0.115 | 0 | 0.014 | 0.058 | 1.140 |
| 0.5 | 0.060 | 0.120 | 0.040 | 0.180 | 0.779 | 0.180 | 0.180 | 0 | 0 | 0.140 | 1.499 |
| 0.7 | 0.025 | 0.126 | 0.101 | 0.226 | 1.056 | 0.277 | 0.277 | 0.050 | 0.126 | 0.251 | 2.237 |
| 1 | 0.081 | 0.363 | 0.040 | 0.081 | 1.410 | 0.443 | 0.443 | 0.242 | 0.081 | 0.322 | 3.062 |
Примечания. 1. f ' – фрагмент одинарный, f '' – фрагмент двойной, m' – мост одинарный, m'' – мост двойной, g – отставание, mp – многополюсный митоз, ndis – нерасхождение хромосом, agg – слипание хромосом, pata – патологическая анафаза, and – неправильное расхождение хромосом. 2. Данные достоверны при p = 0.05.
Таким образом, угнетение процесса кариокинеза следует считать общим явлением, характерным для воздействия различных ТМ. При этом в плане токсичности рассмотренные ТМ можно разместить в ряд: Pb < Cd < Cu. Например, для свинца действующие дозы были максимальными (1–3 мг/мл) [13–15], и частота аберрантных клеток (АК) сначала возрастала несущественно, выходя на плато (диапазон 1–2 мг/мл), и лишь при 3 мг/мл отмечали резкий рост частоты АК. Для кадмия действующие дозы были меньше (0.25–1.5 мг/мл), а частоты АК возрастали более резко, но кривая имела два перелома: 0.5 мг/мл (рост по сравнению с контролем примерно в 2 раза) и 1 мг/мл (рост по сравнению с контролем в 8 раз, при максимальной дозе 0.5 мг/мл – 16 раз). В случае с медью частота АК возрастала во всем диапазоне концентраций равномерно.
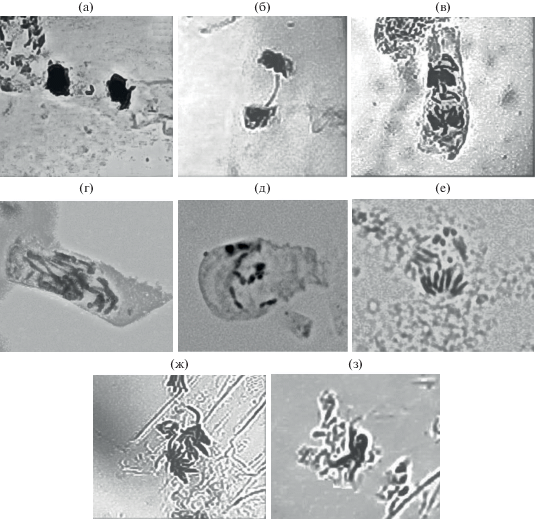
На основе полученных данных можно утверждать, что воздействие меди на клетки апикальной меристемы корней проростков ячменя препятствовали нормальному митозу. Главным образом наблюдали повреждение структур хромосом и сбои в работе аппарата веретена деления. Вследствие этого процесс пролиферации останавливался на стадии профазы или метафазы. Подобные явления отмечены для действия всех ТМ, а также других ядов, вызывающих цитотоксические эффекты, таких как колхицин [17, 18]. Фотографии основных типов нарушений приведены на рис. 6.
Рис. 6.
Типы цитогенетических аномалий, отмеченных при действии Cu2+ на клетки апикальной меристемы корней проростков ячменя: (а) – фрагмент, (б) – мост, (в) – отставания хромосом, (г) – нерасхождение хромосом, (д) – неправильное расхождение хромосом, (е) – патологическая анафаза, (ж) – трехполюсный митоз, (з) – слипание хромосом.
Известно, что медь, равно как и другие ТМ, поступает в растительный организм в первую очередь через корень. Процесс корневого поглощения так или иначе регулирует накопление и распределение Cu2+ в тканях растений [21, 22]. При этом, несмотря на то что медь является ценным микроэлементом, ее избыток способен вызывать серьезные нарушения в работе различных систем и органов растения [23], что и было показано в нашем исследовании: уже при относительно низких концентрациях данного ТМ в питательном растворе (0.05, а особенно >0.15 мг Cu2+/мл) наблюдали существенное угнетение развития корней проростков на ранних стадиях их развития. По мере возрастания дозы меди эти эффекты лишь усиливались, и токсический стресс выявляли уже по изменению и других параметров (например, сокращалась средняя длина проростков, отмечали повышенный выход цитогенетических аномалий). Таким образом, основываясь на полученных данных, можно утверждать, что корень является наиболее чувствительным к стрессовым воздействиям органом растения. В этой связи необходимо отметить, что именно оценку особенностей развития корней используют в ряде исследований [7] как удобный и надежный тест для изучения ответа различных видов растений на действие техногенных поллютантов, в том числе меди.
Очевидно, что развитие корней прямо зависит от процесса митоза. Например, в работе [24] показано, что у чувствительных к действию ТМ сортов и линий различных видов растений угнетение их развития связано с разнообразными нарушениями процесса пролиферации. Митотический индекс, характеризующий общее количество делящихся клеток, часто используют для оценки цитотоксичности различных агентов. Таковая может быть обнаружена посредством увеличения или сокращения МИ [25]. В соответствии с [26], МИ, значимо более низкий, чем в контроле (без воздействия токсического агента), может отражать изменения, происходящие с растением под действием стресса. С другой стороны, рост МИ и следовательно активизация клеточного деления, также указывает на негативные изменения в клетках. Излишняя митотическая активность опасна для клеток, поскольку ведет к дезорганизации процесса деления и даже развитию патологических состояний (наподобие злокачественных опухолей у животных).
Однако как сокращение, так и рост МИ являются важными индикаторами при мониторинге загрязнения окружающей среды, особенно для оценки эффектов, вызываемых поллютантами с доказанным цитотоксическим потенциалом [26]. Например, в работе [27] показано, что сокращение МИ в меристематических клетках Allium cepa L. можно считать надежным маркером для определения наличия токсических веществ в окружающей среде. Таким образом, величина МИ – подходящий тест для оценки уровней загрязнения. Поэтому в ряде исследований [25, 27, 28] МИ использовали для изучения цитотоксических эффектов и зачастую удавалось получить удовлетворительные результаты.
Данные, полученные в настоящей работе, показали явное негативное воздействие меди на митотический процесс, что выражалось в повышении выхода цитогенетических аномалий, а также возникновении блокировок пролиферации на поздних стадиях. Аналогичные результаты получены в исследованиях, посвященных сходным темам [24, 29]. Хотя следует заметить, что в отличие от приведенных в указанных источниках данных, нами не выявлено снижение МИ, что вероятно было связано с меньшим временем экспозиции проростков в содержащем Cu2+ растворе. Учитывая, что было отмечено постепенное исчезновение поздних фаз митоза по мере роста концентрации ТМ, можно предположить, что при более длительной выдержке проростков в растворе делящиеся клетки в апикальной меристеме корней проростков постепенно могли исчезнуть или, как минимум, начать встречаться гораздо реже.
Также отмечено, что основными типами цитогенетических нарушений, вызванных действием меди, были такие, которые связаны с деградацией вещества хромосом или повреждением аппарата веретена деления (трехполюсные митозы, слипание хромосом и др.). Похожие результаты были получены и в работе [30]. Исследователи оценивали частоты цитогенетических аномалий в апикальной меристеме корней Allium cepa с целью выяснить ответ этого растения на действие различных концентраций сточных вод с медных рудников. Полученные результаты показали явную дозовую зависимость, отражающую подавление МИ по мере роста концентрации ТМ. При этом наиболее частыми типами цитогенетических нарушений были разные виды деградации вещества хромосом, их отставания и слипания, мосты.
К аналогичным выводам, что воздействие ТМ приводит к развитию нарушений в структуре хромосом, пришли и в работе [31]. Авторы связывали такой феномен с тем, что действие ТМ вызывает нарушения в нативной структуре различных белков хромосом, таких как гистоны, что препятствует нормальному распределению хромосом, и, как следствие, провоцирует возникновение нарушений. При этом, если сравнивать различные типы аномалий, то К-митозы и хромосомные мосты можно считать более легкими нарушениями, чем отмеченное нами слипание хромосом. Последнее указывало на больший токсический стресс, и скорее всего вероятность того, что клетка восстановится после таких повреждений, не слишком высока, и накопление таких аберраций в конечном счете ведет к клеточной смерти [29]. Внешне все эти процессы выражаются в замедлении развития проростков и возникновении всевозможных нарушений морфологии корней, которые и были отмечены нами.
Выявленное в нашей работе сокращение частот клеток, проходящих поздние фазы пролиферации, можно увязать с особенностями синтеза и функционирования микротрубочек. Они встречаются практически у всех эукариот и состоят из белков α- и β-тубулинов. Микротрубочки вовлечены в формирование таких структур, как кортикальные пучки в интерфазе, веретена деления, фрагмопласт, играющих важную роль в различных процессах, например, транслокации хромосом, дифференциации клеток и их движении [32, 33]. В работе [34] показано, микротрубочки формируют в делящихся клетках 4 типа последовательных пучков, наличие которых связано с конкретной стадией клеточного цикла. Эти агрегаты принимают участие в разнообразных клеточных процессах, связанных с пролиферацией, например, формируют цитоскелет [35].
Ряд исследований [35, 36] показали, что микротрубочки весьма чувствительны к стрессовым воздействиям, и их размещение в клетке и процесс синтеза способны существенно модифицироваться в ответ на изменения температуры, введение в среду органических веществ или ионов металлов. Имеются сведения [33, 37], что воздействие меди как раз приводит к изменениям в структуре микротрубочек, что можно увязать с повышенным выходом цитогенетических аномалий, связанных с работой аппарата веретена деления. Еще сообщали [34], что по мере роста концентрации меди отмечено уменьшение экспрессии α-тубулина – одного из составляющих веществ микротрубочек. При этом любые изменения в концентрации этого белка негативным образом отражаются на структуре микротрубочек и соответственно отрицательно сказываются на их функциях. В качестве одной из причин, ведущей к таким последствиям, в работе [38] называли снижение концентрации кальмодулина и/или нарушение гомеостаза Ca2+ в цитозоле. В другом исследовании [39] отмечено, что разрушение цитоскелета и повреждение микротрубочек хорошо коррелируют с накоплением в клетке активных форм кислорода (АФК), которые окисляют и разрушают белки этих структур. В конечном счете повреждения микротрубочек прямо связаны с сокращением митотической активности [34]. В работе [32] показано, что нарушения организации и деполимеризация микротрубочек препятствуют формированию веретена деления, отвечающего за перемещение хромосом в процессе цитокинеза, эти явления и ведут к развитию цитогенетических аномалий, наблюдавшихся в нашей работе. Таким образом, можно утверждать, что наличие в клеточной среде ионов меди действительно способствует повреждению аппарата веретена деления, и, как следствие, угнетает процесс пролиферации и развития корней. Такие процессы, видимо, проявляются как угнетение развития растений ячменя по мере возрастания концентрации меди в питательной среде, что и наблюдали в настоящей работе.
ЗАКЛЮЧЕНИЕ
Таким образом, оценили ряд морфометрических и цитогенетических параметров, характеризующих ответ проростков ярового ячменя 4-х сортов на действие диапазона концентраций Cu2+. Выяснено, что воздействие меди вело к существенному угнетению развития проростков ячменя, что проявилось как на уровне целого организма (изменение морфометрических показателей, появление аномалий морфологии корней), так и на клеточном уровне организации растения (накопление цитогенетических аномалий). При этом особенности ответа растений ячменя на действие данного ТМ были связаны с внутривидовой (межсортовой) изменчивостью. Удалось выявить дозу Cu2+, которая вызывает значимое угнетение изученных показателей, хотя еще не является летальной. Полученные данные могут быть использованы для исследования устойчивости различных сортов ячменя к действию меди с целью выявить варианты с повышенной устойчивостью или чувствительностью. Собранные данные могут служить в качестве исходного материала для нужд селекционной работы, направленной на создание таких сортов этой сельскохозяйственной культуры, которые могли бы успешно развиваться в условиях наличия избыточных концентраций меди (а потенциально и других ТМ) в почвах.
В процессе исследования были получены новые данные о различных аспектах ответа проростков ячменя на действие меди с использованием цитогенетических и морфометрических показателей. Показано цитотоксическое действие Cu2+, вызывающее повышение выхода цитогенетических аномалий, преимущественно связанных с работой аппарата веретена деления и нарушением нативной структуры хромосом. С привлечением данных литературы были проанализированы причины развития наблюдаемых феноменов.
На основе рассмотренных показателей выявлен полиморфизм ответа различных сортов ячменя на действие меди, выявлены варианты с повышенной устойчивостью или чувствительностью к данному ТМ. С привлечением материалов предшествующих исследований было показано, что некоторые из использованных сортов могут показывать устойчивость или чувствительность не только к Cu2+, но и к другим тяжелым металлам, таким как свинец и кадмий.
Список литературы
Holmgren G.G.S., Meyer M.W., Chaney R.L., Daniels R.B. Cadmium, lead, zinc, copper and nickel in agricultural soils of the United States of America // J. Environ. Qual. 1993. V. 22. № 4. P. 335–348.
Stefanov I., Frank J., Gedamu L., Misra S. Effect of cadmium treatment on the expression of chimeric genes in transgenic tobacco seedlings and calli // Plant Cell Reports. 1997. V. 16. P. 291–294.
Foy C.D., Chaney R.L., White M.C. The physiology of metal toxicity in plants // Annu. Rev. Plant Physiol. 1978. V. 29. P. 511–566.
Burkhead J.L., Reynolds K.A.G., Abdel-Ghany S.E., Cohu C.M., Pilon M. Copper homeostasis // New Phytol. 2009. V. 182. P. 799–816.
Yruela I. Copper in plants: Acquisition, transport and interactions // Funct. Plant Biol. 2009. V. 36. P. 409–430.
Andres-Colas N., Perea-Garcia A., Puig S., Penarrubia L. Deregulated copper transport affects Arabidopsis development specially in the absence of environmental cycles // Plant Physiol. 2010. V. 153. P. 170–184.
Meng Q.M., Zou J., Jiang W.S., Liu D.H. Effect of Cu2+ concentration on growth, antioxidant enzyme activity and malondialdehyde content in garlic (Allium sativum L.) // Acta Biol. Cracov. Ser. Bot. 2007. V. 49. P. 95–101.
Wang Y.T., Bjorn L.O. Heavy metal pollution in Guangdong province, China, and the strategies to manage the situation // Front. Environ. Sci. 2014. V. 2. P. 1–12.
Черных Н.А., Эдмон С.А. Оценка содержания тяжелых металлов в почвах и сельскохозяйственных растениях Республики Кот-д’Ивуар // Агрохимия. 2004. № 10. С. 78–85.
Минкина Т.М. Групповой состав соединений тяжелых металлов в почвах агроценозов, загрязненных аэрозольными выбросами Новочеркасской ГРЭС // Агрохимия. 2011. № 6. С. 68–77.
Forster B.P., Ellis R.P., Thomas W.T.B., Newton A.C., Tuberosa R., This D., Elenein R.A., Bahri M.H., Ben Salem M. The development and application of molecular markers for abiotic stress tolerance in barley // J. Exp. Bot. 2000. V. 51. № 342. P. 19–27.
Bengtsson B.O. Barley genetics // Trends in genetics. 1992. V. 8. P. 3–5.
Дикарев А.В., Дикарев В.Г., Дикарева Н.С., Гераськин С.А. Внутривидовой полиморфизм ярового ячменя (Hordeum vulgare L.) по устойчивости к действию свинца // Сел.-хоз. биол. 2014. № 5. С. 78–87.
Дикарев А.В., Дикарев В.Г., Дикарева Н.С. Влияние нитрата свинца на морфологические и цитогенетические показатели растений ярового двурядного ячменя (Hordeum vulgare L.) // Агрохимия. 2014. № 7. С. 45–52.
Дикарев А.В., Дикарев В.Г., Дикарева Н.С. Исследование продуктивности, морфометрических и физиолого-биохимических показателей контрастных по устойчивости к свинцу сортов ярового двурядного ячменя // Агрохимия. 2019. № 10. С. 72–84.
Семена сельскохозяйственных культур. Методы определения всхожести / Под ред. Василенко T.И. М.: Изд-во стандартов, 2010. 30 с.
Паушева З.П. Практикум по цитологии растений. М.: Колос, 1974. 288 с.
Атабекова А.И., Устинова Е.И. Цитология растений. М.: Колос, 1971. 256 с.
Таланова В.В., Tитов A.Ф., Боева Н.П. Влияние свинца и кадмия на проростки ячменя // Физиол. и биохим. культ. раст. 2001. Т. 33. № 1. С. 33–37.
Wierzbicka M. Resumption of mitotic activity in Allium cepa L. root tips during treatment with lead salts // Environ. Exp. Bot. 1994. V. 34. P. 173–180.
Song J., Zhao F.J., Luo Y.M., McGrath S.P., Zhang H. Copper uptake by Elsholtzia splendens and Silene vulgaris and assessment of copper phytoavailability in contaminated soils // Environ. Pollut. 2004. V. 128. P. 307–315.
Geremias R., Fattorini D., Favere V.T.D., Pedrosa R.C. Bioaccumulation and toxic effects of copper in common onion Allium cepa L. // Chem. Ecol. 2010. V. 26. P. 19–26.
Ducic T., Polle A. Transport and detoxification of manganese and copper in plants // Brazil. J. Plant Physiol. 2005. V. 17. P. 103–112.
Souguir D., Ferjani E., Ledoigt G., Goupil P. Exposure of Vicia faba and Pisum sativum to copper-induced genotoxicity // Protoplasma. 2008. V. 233. P. 203–207.
Fernandes T.C.C., Mazzeo D.E.C., Marin-Morales M.A. Mechanism of micronuclei formation in polyploidized cells of Allium cepa exposed to trifluralin herbicide // Pest. Biochem. Physiol. 2007. V. 88. P. 252–259.
Leme D.M., Marin-Morales M.A. Allium cepa test in environmental monitoring: a review on its application // Mutat. Res. 2009. V. 682. P. 71–81.
Smaka-Kinci V., Stegnar P., Lovka M., Toman M.J. The evaluation of waste, surface and ground water quality using the Allium test procedure // Mutat. Res. 1996. V. 368. P. 171–179.
Leme D.M., Marin-Morales M.A. Chromosome aberration and micronucleus frequencies in Allium cepa test exposed to petroleum polluted water – a case study // Mutat. Res. 2008. V. 650. P. 80–86.
Liu D.H., Jiang W.S., Li M.X. Effects of cadmium on root growth, cell division and nucleoli in root tip cells of garlic // Biol. Plant (Prague). 2003/2004. V. 47. P. 79–83.
Inceer H., Beyazoglu O., Ergul H.A. Cytogenetic effects of wastes of copper mine on root tip cells of Allium cepa L. // Pak. J. Biol. Sci. 2000. V. 3. P. 376–377.
Saxena P.N., Gupta S.K., Murthy R.C. Carbofuran induced cytogenetic effects in root meristem cells of Allium cepa and Allium sativum: A spectroscopic approach for chromosome damage // Pestic. Biochem. Physiol. 2010. V. 96. P. 93–100.
Wade R.H. On and around microtubules: An overview // Mol. Biotechnol. 2009. V. 43. P. 177–191.
Soltys D., Rudzinska-Langwald A., Kurek W., Gniazdowska A., Sliwinska E., Bogatek R. Cyanamide mode of action during inhibition of onion (Allium cepa L.) root growth involves disturbances in cell division and cytoskeleton formation // Planta. 2011. V. 234. P. 609–621.
Qin R., Wang C., Chen D., Bjorn L.O., Li S. Copper-induced root growth inhibition of Allium cepa var. Agrogarum L. involves disturbances in cell division and DNA damage // Environ. Toxicol. Chem. 2015. V. 34. № 5. P. 1045–1055.
Elefthereos P.E., Ioannis-Dimosthenis S.A., Pelagia M. Effects of hexavalent chromium on microtubule organization, ER distribution and callose deposition in root tip cells of Allium cepa L. // Protoplasma. 2012. V. 249. P. 401–416.
Shimizu Y., Shimizu T., Nara M., Kikumoto M., Kojima H., Morii H. Effects of the KIF2C neck peptide on microtubules: Lateral disintegration of microtubules and structure formation // FEBS J. 2013. V. 280. P. 1681–1692.
Gichner T., Patkova Z., Szakova J., Znidar I., Mukherjee A. DNA damage in potato plants induced by cadmium, ethyl methanesulphonate and γ-rays // Environ. Exp. Bot. 2008. V. 62. P. 113–119.
Buljan V., Yeung S., Rushdi S., Delikatny E.J., Hambly B. Mercury and cadmium effects on microtubule polymerization and depolymerization // Biophys. J. 2001. V. 80. P. 99A.
Rudrappa T., Bonsall J., Gallagher J.L., Seliskar D.M., Bais H.P. Root-secreted allelochemical in the noxious weed Phragmites australis deploys a reactive oxygen species response and microtubule assembly disruption to execute rhizotoxicity // J. Chem. Ecol. 2007. V. 33. P. 1898–1918.
Дополнительные материалы отсутствуют.



