Агрохимия, 2021, № 8, стр. 49-56
Анализ внутривидового полиморфизма ячменя по устойчивости к действию кадмия
С. А. Гераськин 1, *, А. В. Дикарев 1, В. Г. Дикарев 1, Н. С. Дикарева 1
1 Всероссийский научно-исследовательский институт радиологии и агроэкологии
249032 Обнинск, Калужская обл., Киевское шоссе, 109 км, Россия
* E-mail: stgeraskin@gmail.com
Поступила в редакцию 05.11.2020
После доработки 12.01.2021
Принята к публикации 11.05.2021
Аннотация
Фитотоксичность тяжелых металлов является одним из факторов, ограничивающих урожайность и пищевую ценность сельскохозяйственных культур. Оценена фитотоксичность кадмия для 50-ти селекционно отдаленных сортов ярового ячменя разного географического происхождения из коллекции Всероссийского НИИ растениеводства. Показано наличие выраженного внутривидового полиморфизма ярового ячменя по этому показателю. На основе анализа морфологических показателей проростков выделены контрастные по устойчивости к действию кадмия сорта.
ВВЕДЕНИЕ
В условиях роста населения Земли и изменений климата важное значение приобретает продовольственная проблема. В то же время интенсивное развитие промышленного производства, направленное на удовлетворение растущих потребностей населения, приводит к прогрессирующему загрязнению окружающей среды. Наиболее опасно загрязнение агросферы, поскольку через продукцию сельского хозяйства поллютанты попадают в организм сельскохозяйственных животных и человека. Многие техногенные поллютанты способны негативно влиять на рост и развитие выращиваемых на загрязненных территориях сельскохозяйственных культур, что ведет не только к сокращению объема получаемой продукции, но и к ухудшению ее качества.
Важной группой загрязнителей являются тяжелые металлы (ТМ). Некоторые ТМ необходимы растениям как микроэлементы, хотя их избыток ведет к токсическим эффектам и даже гибели. Однако существуют металлы, не принимающие заметного участия в метаболизме растений. Их присутствие в окружающей среде может существенно влиять на состояние растений, поэтому фитотоксичность ТМ является одним из факторов, ограничивающих урожайность и пищевую ценность сельскохозяйственных культур.
Одним из наиболее опасных ТМ является кадмий. Это широко распространенный элемент, не выполняющий биологических функций в клетках растений и животных [1]. Его накопление в окружающей среде связано с промышленным производством, приблизительно 30 тыс. т кадмия попадает в атмосферу каждый год [2]. Его применяют в гальванопластике, как минеральный пигмент в лакокрасочных материалах, в автономных источниках питания. Кадмий – побочный продукт при добыче и выплавке свинца и цинка. Растворимые соединения кадмия (нитраты и хлориды) легко проникают в растения с почвенным раствором, накапливаясь в значительных количествах в вегетативных органах и зерне [3].
Перед современным сельским хозяйством стоит задача создания новых сортов основных сельскохозяйственных культур, обладающих высокой продуктивностью и устойчивостью к загрязнителям. Такие сорта должны меньше накапливать поллютанты в товарной части растения, чтобы не создавать угрозы здоровью человека и животных. Осуществленная в Канаде программа анализа внутривидового полиморфизма по накоплению кадмия в зерне твердой пшеницы, подсолнечника, риса и соевых бобов привела, в частности, к созданию коммерчески успешного сорта твердой пшеницы с пониженным накоплением кадмия и высокой продуктивностью, который, после выхода на рынок занял значительную долю посевных площадей [4].
Основными методами адаптации растений к избыточной концентрации металлов в среде являются уменьшение поступления, активация выведения, метаболическая изоляция и индукция защитных систем для ослабления их токсичности [2]. По реакции на избыток ТМ в среде растения делят на аккумуляторы, накапливающие их больше, чем в среде, исключители, содержащие их меньше, чем в среде, и индикаторы, содержащие ионы металлов в том же количестве, что и в среде [5]. Большинство растений относятся ко 2-й группе. Гипераккумуляция ТМ растениями также представляет интерес в целях разработки экологических методов очистки загрязненных почв. Результаты изучения популяций растений, в течение десятилетий произраставших на загрязненных территориях (например, в районах добычи полиметаллических руд), указывают на перспективность этого подхода [6]. Существенные внутривидовые различия по устойчивости к кадмию были обнаружены у сортов риса [7], гороха [8] и горчицы [9].
Одним из популярных модельных объектов для исследования токсического действия ТМ является яровой двурядный ячмень (Hordeum vulgare L.). Ячмень – 4-я по значимости сельскохозяйственная культура [10], известная с глубокой древности и широко возделываемая по всему миру в разных климатических и почвенных условиях. Ячмень хорошо изучен на разных уровнях организации: биохимическом [11, 12], клеточном [13, 14] и организменном [15, 16].
Цель работы – оценка внутривидового полиморфизма ярового двурядного ячменя по устойчивости к действию кадмия и отбор контрастных по этому показателю сортов.
МЕТОДИКА ИССЛЕДОВАНИЯ
Для оценки тестирующей концентрации кадмия, вызывающей существенное угнетение развития ячменя, было проведено 2 предварительных эксперимента. В первом опыте было оценено действие кадмия на проростки ячменя сорта Зазерский 85 (Белоруссия) в широком диапазоне доз. С этой целью были использованы растворы с концентрациями Cd(NO3)2: 0, 0.005, 0.01, 0.02, 0.04, 0.08, 0.16, 0.2, 0.32, 0.4, 0.5, 0.6, 0.7, 1.0, 1.5 мг/мл. В этих растворах объемом по 200 мл в течение 5-ти сут выращивали по 100 семян рулонным методом при температуре 20°С [17]. По окончанию этого срока рулоны разворачивали и фиксировали длину проростка и его корня.
На следующем этапе был проведен эксперимент с 4-мя сортами: Зазерский 85, Jelen (Югославия), Челябинский 1 (Челябинская обл.), Заря (Кировская обл.). Были использованы следующие концентрации: 0, 0.1, 0.3, 0.5, 0.7, 1, 1.3 мг Cd(NO3)2/мл. Использованные в предыдущем эксперименте максимальные и минимальные концентрации были исключены из рассмотрения ввиду их низкой информативности.
Анализ внутривидового полиморфизма ячменя по устойчивости к действию кадмия проводили на семенах 50-ти селекционно отдаленных сортов разного географического происхождения. На основе результатов 2-х предыдущих экспериментов в качестве тестирующей дозы была выбрана концентрация Cd(NO3)2, вызывавшая 50%-ное угнетение жизненных процессов. Для каждого сорта брали по 100 семян для контрольного и столько же для экспериментального варианта. Фиксируемые показатели и методика их оценки были те же, что и в предыдущих экспериментах.
Отбор контрастных по устойчивости к кадмию сортов ячменя производили с помощью коэффициента депрессии (DC):
где MVc – величина показателя в контрольном варианте, MVd – величина показателя при тестирующей концентрации кадмия. Величину DC рассчитывали для длины проростков и их корней. Затем эти величины суммировали. Если сумма оказывалась <60, сорт признавали устойчивым, если >130 – чувствительным.Для статистического анализа экспериментальных данных использовали программные пакеты MS Excel 2003 и Statistica 10.0. Эмпирические распределения на соответствие нормальному закону проверяли с помощью критерия Колмогорова–Смирнова, значимость различий оценивали по t-критерию Стьюдента. На рисунках приведены среднеарифметические величины в расчете на одно растение и доверительные интервалы определенных показателей (в % к контролю) при 95%-ном уровне значимости.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
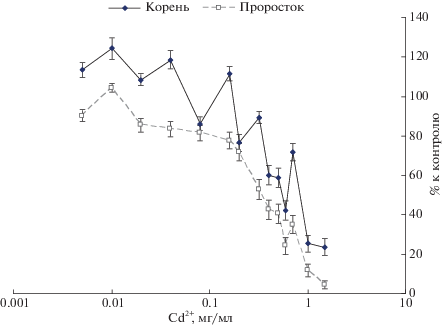
Оценка тестирующей концентрации. В рамках первого эксперимента было исследовано влияние широкого диапазона концентраций кадмия (0.005–1.5 мг/мл) на ростовые процессы ячменя сорта Зазерский 85. При низких концентрациях (0.01–0.04, 0.16 мг/мл) наблюдали стимуляцию (p < 0.05) развития корней (но не проростков). Дальнейшее увеличение концентраций кадмия вело к снижению размера корня (рис. 1). Резкое снижение размеров корня происходит после 0.2 мг/мл. Проросток был менее чувствителен к действию кадмия, хотя, начиная с концентрации 0.2 мг/мл, его длина также снижалась.
Полученные данные подтвердили, что главным барьером на пути поступления в растения кадмия является корень. Пока его барьерные функции препятствуют проникновению кадмия, растение нормально растет и развивается. При концентрациях >0.2 мг/мл кадмий преодолевал защитные барьеры корня, что вело к угнетению ростовых процессов.
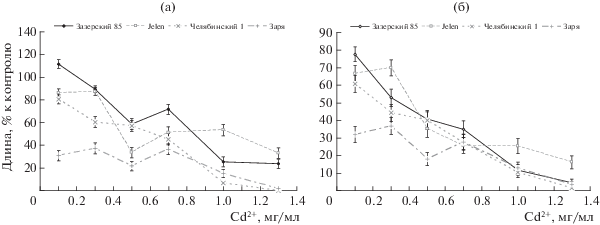
На следующем этапе влияние токсических концентраций кадмия (0.1–1.3 мг/мл) на ростовые процессы было исследовано на 4-х сортах ярового ячменя разного географического происхождения. Анализ длины проростков 4-х сортов (рис. 2а) показал, что уже при 0.1 мг Сd/мл этот показатель уменьшался по сравнению с контролем. При бóльших концентрациях происходило постепенное снижение длины проростков всех 4-х сортов, при 1 мг/мл этот показатель у всех сортов становился статистически значимо меньше контроля. При максимальной концентрации у 2-х сортов Заря и Челябинский 1 развития проростков практически не происходило. Таким образом, наиболее устойчивыми к кадмию в отношении развития проростков оказались сорта Зазерский 85 и Jelen, наименее – Челябинский 1 и Заря.
Средняя длина корня как и в первом эксперименте, оказалась более надежным показателем для исследования влияния кадмия на проростки ячменя, поскольку этот показатель плавно уменьшался и становился близким к нулю при максимальной концентрации кадмия, а его вариация была меньше, чем длина проростков (рис. 2б). Как и в случае с проростками, наиболее устойчивыми к кадмию оказались сорта Зазерский 85 и Jelen.
Кроме сокращения длины, наблюдали также патологические изменения морфологии корней: уплотнение тканей, изменение цвета, нарушения геотропизма. Аналогичные эффекты были обнаружены в работах [18–20]. Это подтвердило мнение о том, что основные механизмы, обеспечивающие первичную защиту растения от действия ионов металлов, связаны с работой корня. Сокращая число корневых волосков, насыщая клеточные стенки каллозой и суберином [21], растение ограничивает количество ТМ в растворе, поступающем в его надземную часть.
Первыми реакциями растений на поступление ТМ являлись снижение скорости роста корней и уменьшение интенсивности их ветвления (рис. 3). Торможение роста корней регистрировали [22] при концентрациях свинца 10–2–10–6 М в растворе или при содержании свинца в почве >10 мг/кг. При низких концентрациях ТМ у проростков Zea mays в большей степени был угнетен процесс развития и растяжения главного корня, боковые корни страдали меньше [23]. В нашем эксперименте торможение роста корней фиксировали, начиная с концентраций кадмия 0.2 мг/мл (рис. 1, 2).
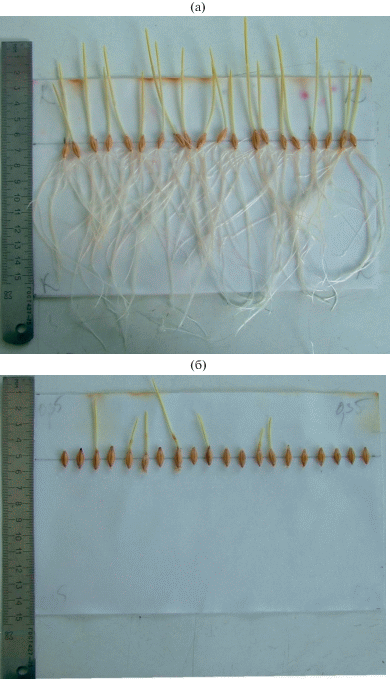
Рис. 3.
Изменение морфологии 5-суточных проростков ярового ячменя чувствительного сорта Заря в контроле (а) и при концентрации кадмия 0.35 мг/мл (б).
По результатам проведенных экспериментов была определена тестирующая концентрация кадмия, вызывающая 50%-ное сокращение длины проростков и корней (ЕС50). Усреднение полученных в этих экспериментах результатов показало, что 50%-ное угнетение развития корней и проростков растений ячменя вызывала концентрация 0.36 мг/мл. В целях удобства приготовления рабочих растворов было решено использовать концентрацию 0.35 мг/мл, поскольку по данным выполненных экспериментов, изменение концентрации кадмия на 0.1 мг/мл в большинстве случаев не меняло существенно изученные характеристики проростков.
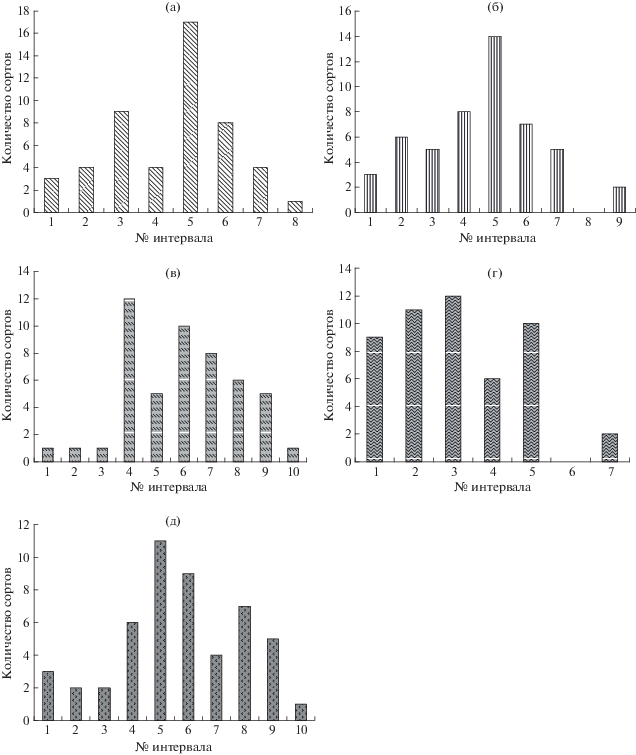
Анализ структуры внутривидового полиморфизма. Оцененную в предварительных экспериментах концентрацию 0.35 мг Cd(NO3)2/мл использовали для тестирования 50-ти селекционно отдаленных сортов разного географического происхождения. Длина проростков тестированных сортов в этом эксперименте менялась в диапазоне 5.2–48.5 мм, корней – 9.5–74.9 мм. Таким образом, по длине проростков тестируемые сорта различались в 9 раз, по длине корней – в 8 раз. В целях графического представления данных диапазон изменчивости этих показателей был поделен на равные интервалы с шагом в 10 мм для проростков и 5 мм – для корней, по оси ординат представлено количество сортов, попавших в каждый интервал (рис. 4). Таким образом, в правой части диаграммы оказались наиболее устойчивые сорта, в левой – самые чувствительные. С помощью критерия Колмогорова–Смирнова было оценено соответствие эмпирических распределений нормальному закону. Во всех 5-ти случаях эмпирические распределения не обнаружили статистически значимых отклонений от нормального закона (Dа = 0.1134, Dб = 0.0856, Dв = 0.1047, Dг = 0.0960, Dд = 0.0810, p > 0.05), что свидетельствовало об однородности исследованной выборки и наличии в ней небольших групп устойчивых/чувствительных к исследованному фактору сортов.
Рис. 4.
Распределение сортов ячменя: по длинам проростков – в контроле (а) и при воздействии 0.35 мг Cd(NO3)2/мл (б), длинам корней – в контроле (в) и при 0.35 мг Cd(NO3)2/мл (г), по коэффициенту депрессии DC (д).
Обнаруженное у исследованных сортов существенное (почти на порядок) различие линейных параметров проростков позволило выделить сорта, контрастные по реакции на действие кадмия. Отбор контрастных сортов выполняли с использованием процедуры, описанной в разделе “Методика исследования”. Аналогичный подход был использован для выделения контрастных по устойчивости к действию ионизирующего излучения сортов пшеницы [24] и исследования устойчивости сортов льна к действию ТМ [25]. Было выделено 14 сортов (по 7 устойчивых и чувствительных), коэффициенты депрессии для которых представлены в табл. 1. Интересно отметить, что средние размеры проростка и корня устойчивых сортов в контроле были статистически значимыми (р < 0.05) менее, чем у чувствительных. При действии тестирующей концентрации кадмия соотношение размеров проростков и корней устойчивых и чувствительных сортов менялось на противоположное и тоже статистически значимое (р < 0.05). Аналогичные закономерности были выявлены при исследовании действия кадмия на проростки горчицы [9]. Замедленное развитие устойчивых сортов в контроле было связано с тем, что часть их ресурсов, даже в отсутствие загрязнения, расходуется на поддержание механизмов, обеспечивающих устойчивость в присутствии повышенных концентраций металлов [26, 27].
Таблица 1.
Контрастные по устойчивости к действию кадмия сорта ярового ячменя
| Устойчивые | Чувствительные | ||
|---|---|---|---|
| Название, происхождение | DC | Название, происхождение | DC |
| Местный (Удмуртия) | –3.89 | Blenheim (Великобритания) | 136.8 |
| Оренбургский 4 (Оренбургская обл.) | 26.24 | Ca 220702 (Дания) | 180.46 |
| Линия 15 (Московская обл.) | –20.73 | Malva (Латвия) | 157.74 |
| Икар (Кировская обл.) | 34.24 | Saloon (Чехия) | 165.35 |
| Гетьман (Ставропольский край) | 55.36 | Pongo (Швеция) | 150.92 |
| Русский (Ставропольский край) | –4.74 | Jelen (Сербия) | 149.94 |
| Симфония (Харьковская обл.) | –10.21 | Ansis (Латвия) | 155.65 |
Четыре из семи устойчивых сортов (Местный, Линия 15, Русский, Симфония) имели отрицательные величины DC, т.е. тестирующая доза стимулировала развитие проростков этих сортов по сравнению с контролем. Иную закономерность наблюдали в отношении чувствительных сортов – коэффициент депрессии всех этих сортов превышал 130, т.е. тестирующая доза приводила к существенному угнетению их развития. Сравнение полученных в настоящей работе данных с результатами анализа внутривидового полиморфизма сортов ячменя по устойчивости к действию свинца [28] показало, что только один сорт (Симфония) оказался устойчивым к обоим тяжелым металлам и один (Jelen) – чувствительным. При этом устойчивый к свинцу сорт Pongo оказался чувствительным к кадмию (табл. 1). Таким образом, существенные различия в механизмах поступления и биологического действия свинца и кадмия [29] предопределяли различия в составе контрастных по устойчивости к этим металлам сортов ячменя. Разные сорта [30] и даже линии внутри популяции [31] могут иметь качественно различные стратегии адаптации к повышенным концентрациям ТМ, что служит одной из причин формирования внутривидового полиморфизма по этому признаку.
ЗАКЛЮЧЕНИЕ
Наблюдаемые видовые и сортовые отличия по устойчивости к действию ТМ связаны с генетически детерминированными различиями как в процессах транспорта ионов из корня [2, 32], их детоксикации в клетке [2, 33], так и в эффективности антиоксидантных и репарационных механизмов растений [1, 18, 34]. Сравнение разных видов покрытосеменных растений по реакции на действие ТМ показало, что уровни их накопления в проростках генетически детерминированы и филогенетически обусловлены [35]. В целом, в настоящей работе показано наличие выраженного внутривидового полиморфизма ярового ячменя по устойчивости к токсическому действию кадмия и выделены контрастные по этому показателю сорта. Эти данные подтвердили результаты исследований [7–9, 24, 25], выполненных на разных видах растений с использованием разных факторов воздействия и свидетельствовали о существовании генетически обусловленного [36] полиморфизма по устойчивости к действию стрессора, что позволяет выделить группы контрастных по устойчивости к этому фактору сортов, которые могут служить донорами полигенных систем устойчивости к действию неблагоприятных факторов окружающей среды.
Список литературы
Sanita di Toppi L., Gabbrielli R. Response to cadmium in higher plant // Environ. Exp. Bot. 1999. V. 41. P. 105–130.
Gallego S.M., Pena L.B., Barcia R.A., Azpilicueta C.E., Iannone M.F., Rosales E.P., Zawoznik M.S., Groppa M.D., Benavides M.P. Unravelling cadmium toxicity and tolerance in plants: Insight into regulatory mechanisms // Environ. Exp. Bot. 2012. V. 83. P. 33–46.
Wagner G.J. Accumulation of cadmium in crop plants and its consequences to human health // Adv. Agron. 1993. V. 51. P. 173–212.
Grant C.A., Clarke J.M., Duguid S., Chaney R.L. Selection and breeding of plant cultivars to minimize cadmium accumulation // Sci. Total Environ. 2008. V. 390. P. 301–310.
Baker A.J.M. Metal tolerance // New Phytologist. 1987. V. 106. P. 93–111.
Smith R.A.H., Bradshaw A.D. The use of metal tolerant plant populations for the reclamation of the metalliferous wastes // J. Appl. Ecol. 1979. V. 16. P. 595–612.
Cardoso P.F., Molina S.M.G., Pereira G.J.G., Vitoria A.P., Azevedo R.A. Response of rice inbred lines to cadmium exposure // J. Plant Nutr. 2002. V. 25. P. 927–944.
Belimov A.A., Safronova V.I., Tsyganov V.E., Borisov A.Y., Kozhemyakov A.P., Stepanok V.V., Martenson A.M., Gianinazzi-Pearson V., Tikhonovich I.A. Genetic variability in tolerance to cadmium and accumulation of heavy metals in pea (Pisum sativum L.) // Euphytica. 2003. V. 131. P. 25–35.
Belimov A.A., Safronova V.I., Demchinskaya S.V., Dzyuba O.O. Intraspecific variability of cadmium tolerance in hydroponically grown Indian mustard (Brassica juncea (L.) Czern.) seedlings // Acta Physiol. Plant. 2007. V. 29. P. 473–478.
Cai K., Chen X., Han Z., Wu X., Zhang S., Li Q., Nazir M.M., Zhang G., Zeng F. Screening of worldwide barley collection for drought tolerance: the assessment of various physiological measures as the selection criteria // Front. Plant Sci. 2020. V. 11. P. 1159.
Wu F., Zhang G., Dominy P. Four barley genotypes respond differently to cadmium: lipid peroxidation and activities of antioxidant capacity // Environ. Exp. Bot. 2003. V. 50. P. 67–78.
Битаришвили С.В., Волкова П.Ю., Гераськин С.А. Влияние γ-облучения семян на фитогормональный статус проростков ячменя // Физиология растений. 2018. Т. 65. № 3. С. 223–231.
Pan J-W., Zhu M-Y., Chen H. Aluminum-induced cell death in root-tip cells of barley // Environ. Exp. Bot. 2001. V. 46. P. 71–79.
Geras’kin S.A., Kim J.K., Dikarev V.G., Oudalova A.A., Dikareva N.S., Spirin Ye.V. Cytogenetic effects of combined radioactive (137Cs) and chemical (Cd, Pb and 2,4-D herbicide) contamination on spring barley intercalar meristem cells // Mutation Res. 2005. V. 586. P. 147–159.
Дикарев А.В., Дикарев В.Г., Дикарева Н.С. Исследование продуктивности, морфометрических и физиолого-биохимических показателей контрастных по устойчивости к свинцу сортов ярового двурядного ячменя // Агрохимия. 2019. № 10. С. 72–84.
Гераськин С.А., Дикарев А.В., Лыченкова М.А. Дифференциация сортов ячменя по устойчивости к кадмию сохраняется на протяжении всего жизненного цикла растений // Агрохимия. 2021. № 2. С. 78–85.
ГОСТ 12038-84. Семена сельскохозяйственных культур. Методы определения всхожести. М.: Стандартинформ, 2010. 25 с.
Серегин И.В., Иванов В.Б. Физиологические аспекты токсического действия кадмия и свинца на высшие растения // Физиология растений. 2001. Т. 48. № 4. С. 606–630.
Таланова В.В., Tитов A.Ф., Боева Н.П. Влияние свинца и кадмия на проростки ячменя // Физиол. и биохим. культ. раст. 2001. Т. 33. № 1. С. 33–37.
Kopittke P.M., Asher C.J., Kopittke R.A. Toxic effects of Pb2+ on growth of cowpea (Vigna inguiculata) // Environ. Pollut. 2007. V. 150. P. 280–287.
Гуральчук Ж.З. Механизмы устойчивости растений к действию тяжелых металлов // Физиол. и биохим. культ. раст. 1994. Т. 26. № 2. С. 107–117.
Breckle S.W. Growth under stress. Heavy metals // Plant Roots: The Hidden Half / Eds. Y. Waisel, A. Eshel, U. Kalkafi. N.Y.: Marcel Dekker Inc., 1991. P. 351–373.
Obroucheva N.V., Bystrova E.I., Ivanov V.B., Anupova O.V., Seregin I.V. Root growth responses to lead in young maize seedlings // Plant Soil. 1998. V. 200. P. 55–61.
Корнеев Н.А., Сарапульцев Б.И., Моргунова Е.А. Внутривидовой полиморфизм радиорезистентности семян гексаплоидной пшеницы // Радиобиология. 1985. Т. 25. № 6. С. 768–773.
Soudek P., Katrusakova A., Sedlacek L. Effect of heavy metals on inhibition of root elongation in 23 cultivars of flax (Linum usitatissimum L.) // Arch. Environ. Contam. Toxicol. 2010. V. 59. P. 194–203.
Hickey D.A., McNeilly T. Competition between metal tolerant and normal plant populations; a field experiment on normal soil // Evolution. 1975. V. 29. P. 458–464.
Geras’kin S., Evseeva T., Oudalova A. Effects of long-term chronic exposure to radionuclides in plant populations // J. Environ. Radioactiv. 2013. V. 121. P. 22–32.
Дикарев А.В., Дикарев В.Г., Дикарева Н.С., Гераськин С.А. Внутривидовой полиморфизм ярового ячменя (Hordeum vulgare L.) по устойчивости к действию свинца // Сел.-хоз. биол. 2014. № 5. С. 78–87.
Санжарова Н.И., Цыгвинцев П.Н. Тяжелые металлы в агроценозах: миграция, действие, нормирование. Обнинск: ВНИИРАЭ, 2019. 398 с.
Алексеева-Попова Н.В. Токсическое действие свинца на высшие растения. Л.: Наука, 1991. 241 с.
Жуйкова Т.В., Позолотина В.Н., Безель В.С. Разные стратегии адаптации культурных растений к токсическому загрязнению среды тяжелыми металлами на примере Taraxacum officinale // Экология. 1999. № 3. С. 189–196.
Harris N.S., Taylor G.J. Cadmium uptake and translocation in seedlings of near isogenic lines of durum wheat that differ in grain cadmium accumulation // BMC Plant Biol. 2004. 4:4. https://doi.org/10.1186/1471-2229-4-4
Hall J.L. Cellular mechanisms for heavy metal detoxification and tolerance // J. Exp. Bot. 2002. V. 53. P. 1–11.
Феник С.И., Трофимяк Т.Б., Блюм Я.Б. Механизмы формирования устойчивости растений к тяжелым металлам // Усп. совр. биол. 1995. Т. 115. № 3. С. 261–276.
Broadley M.R., Willey N.J., Wilkins J.C. Phylogenetic variation in heavy metal accumulation in angiosperms // New Phytol. 2001. V. 152. P. 1–19.
Lindberg S., Greger M. Plant genotypic differences under metal deficient and enriched conditions // Physiology and biochemistry of metal toxicity and tolerance in plants / Eds. Prasad M.N.V., Stralska K. Kluwer, Dordrecht. P. 357–393.
Дополнительные материалы отсутствуют.