Агрохимия, 2021, № 8, стр. 27-42
Модели повышения устойчивости к филлоксере и качества винограда методом гормональной регуляции
Р. Э. Казахмедов *
Дагестанская селекционная опытная станция виноградарства и овощеводства –
филиал Северо-Кавказского федерального научного центра садоводства, виноградарства, виноделия
368601 Дербент, ул. Вавилова, 9, Россия
* E-mail: dsosvio@mail.ru
Поступила в редакцию 12.02.2021
После доработки 05.03.2021
Принята к публикации 11.05.2021
Аннотация
Обобщили результаты исследования 1987–2020 гг. применения регуляторов роста и физиологически активных веществ (ФАС) на винограде. На этой основе разработана комбинированная технология применения ФАС, которая позволяет при минимальных затратах материальных и трудовых ресурсов повысить устойчивость винограда к стрессорам (в первую очередь, к филлоксере), продуктивность и качество урожая корнесобственных насаждений культуры. Объектом исследования были более 60-ти сортов винограда. В разные годы исследования испытывали различные ФАС – регуляторы роста гибберелинового (Гк3, гибберсиб), ауксинового (калиевая соль α-НУК, ФАС-2), цитокининового (тидиазурон, препарат дропп, ФАС-1), трофического (ФАС-3) действия, антибиотик аминогликозидной группы – стрептомицин (Str.), крезацин (3-этил-аминовая соль о-крезоуксусной кислоты), а также жасмоновая (ЖАС) и борная (H3BO3) кислоты, мочевина, поливинилпирролидон (ПВП) и глифосат (Гл). Изучали влияние регуляторов роста при раздельном и совместном применении на различных этапах развития репродуктивных органов. Раскрыты механизмы формирования устойчивости винограда к филлоксере, формирования бессемянных ягод и ускорения начала созревания винограда. Предложены модели и регламенты практического применения регуляторов роста на корнесобственных растениях винограда семенных сортов для повышения качества урожая и устойчивости к филлоксере.
ВВЕДЕНИЕ
Внедрение прогрессивных ресурсосберегающих, в т.ч. сорториентированных технологий повышения урожайности, устойчивости к стрессорам и качества продукции винограда является ключевым фактором конкурентоспособности и актуальной задачей современного виноградарства. Известно, что реализация генетического потенциала сортов растений, в частности, винограда, осуществляется путем взаимодействия их генотипов и факторов среды через гормональную систему растений, выступающей в качестве медиатора (рис. 1). Эндогенные фитогормоны представляют промежуточное передаточное звено между экспрессирующими генами и основными метаболическими центрами растений, которые постоянно взаимодействуют [1].
Рис. 1.
Схема взаимодействия генотипа и окружающей среды, где гормональная система выступает медиатором и участвует в реализации генетического потенциала растений.

Регуляторы роста растений (РРР) – соединения, стимулирующие или ингибирующие процессы роста растений, широко применяются в сельскохозяйственной практике [2–4]. Обладая высокой физиологической активностью, они способны влиять на интенсивность всех процессов, происходящих в растительном организме, выполняют важную роль в регуляции и саморегуляции физиолого-биохимических, морфофизиологических и продукционных процессов и в этом смысле они являются уникальными средствами воздействия на растения, в отличие от удобрений, орошения, агротехники и т.п. Эффективные технологии использования РРР должны базироваться на теории, системно отражающей наиболее глубокие, внутренние связи в растительном организме.
В виноградарстве регуляторы роста используют при производстве посадочного материала для улучшения укореняемости черенков, срастания привитых черенков и дефолиации саженцев в школке; для повышения продуктивности виноградного растения и улучшения товарных качеств продукции, ингибирования роста побегов [5].
С 1987 г. по настоящее время, в том числе в 2002–2020 гг. в условиях Дагестана накоплен обширный экспериментальный материал по влиянию гормональных соединений или физиологически активных веществ (ФАС) – аналогов фитогормонов на виноградное растение [6–21].
Разработку сорториентированных моделей производственного применения физиологически активных соединений гормональной природы на корнесобственных насаждениях винограда для повышения рентабельности их возделывания, на наш взгляд, следует признать актуальной. Стратегическая цель наших исследований – научное обеспечение и управление продуктивностью, качеством урожая и устойчивостью к филлоксере корнесобственных насаждений винограда юга России методом гормональной регуляции. Цель данной работы – обобщение результатов исследований 1987–2020 гг. и разработка моделей применения РРР на винограде.
МЕТОДИКА ИССЛЕДОВАНИЯ
Исследование проводили в период с 1987 по 2020 г. на кафедре виноградарства и виноделия, в лаборатории регуляторов роста и развития сельскохозяйственных растений отдела сельскохозяйственной биотехнологии РГАУ им. К.А. Тимирязева, лаборатории ДСОСВиО, в ЦКП “Аналитический” СКФНЦСВВ с использованием лабораторных, вегетационных и полевых опытов и методических указаний [22–25]. Полевые исследования проводили в винсовхозе им. Казимова Самаркандской обл. республики Узбекистан, в НПО “Дагагровинпром” (Дербентский р-н), в совхозе “Магарамкентский” Республики Дагестан, а также на экспериментальной базе и Ампелографической коллекции Дагестанской селекционной опытной станции виноградарства и овощеводства филиала СКФНЦСВВ.
В разные годы исследования испытывали ФАС – регуляторы роста гибберелинового (Гк3, гибберсиб), ауксинового (калиевая соль α-НУК, ФАС-2), цитокининового (тидиазурон, препарат дропп, ФАС-1), трофического (ФАС-3) действия, жасмоновую кислоту (ЖАС), антибиотик аминогликозидной группы – стрептомицин (Str.), крезацин (3-этил-аминовую соль о-крезоуксусной кислоты), а также борную кислоту (H3BO3) мочевину, поливинилпирролидон (ПВП) и глифосат (Гл). Количественный состав и способ применения всех ФАС – интеллектуальная собственность автора. Изучали влияние ФАС при раздельном и совместном применении на различных этапах развития репродуктивной сферы винограда: а) бутонизации (5–3 сут до начала цветения), б) опыления и оплодотворение (массовое цветение), в) постоплодотворения (3–7 сут после окончания цветения), г) начала эмбриогенеза и эмбриогенеза (10–12 и 20–25 сут после окончания цветения), д) начала созревания урожая.
Объектом для проведения исследования служили соцветие (гроздь) и различные его элементы (бутоны, завязи, семяпочки, околоплодники, гребни, ягоды, семена), а также молодые (саженцы, 2–4-летние растения, не вступившие в плодоношение) и плодоносящие растения винограда в отсутствии филлоксеры и угнетенные вредителем.
Для исследований были взяты более 60 сортов винограда в т.ч. семенные – Агадаи, Молдова, Первенец Магарача, Антей магарачский, Баян ширей, Хусайне белый, Тайфи розовый, Катта-курган, Кардинал, Кульджинский, Ризамат, Паркентский, Ркацители, Саперави, Каберне-Совиньон, Рислинг рейнский, Мускат венгерский, Фетяска белая и др., сорта селекции ДСОСВиО, аборигенные дагестанские сорта, бессемянные сорта – Кишмиш черный, Кишмиш белый, Кишмиш лучистый, Кишмиш дербентский, Кишмиш молдавский, Коринка черная.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Было выдвинуто несколько гипотез и реализованы новые подходы в разработке способов повышения устойчивости винограда к корневой форме филлоксеры, продуктивности и качества урожая на основе современных знаний физиологии и гормональной системы винограда, а также многолетних результатов собственных экспериментальных исследований по изучению реакции виноградного растения на применение ФАС гормонального действия.
Управление устойчивостью винограда к филлоксере. Известно, что многолетние усилия научного мира по решению проблемы филлоксеры не смогли снять ее с повестки дня, и в настоящее время она остается актуальной. Следует выделить несколько путей решения проблемы филлоксеры – ведение привитой культуры, создание и внедрение устойчивых генотипов к вредителю на основе современных достижений генетики и селекции и повышение физиологического иммунитета винограда к вредителю.
Переход на привитую культуру винограда позволил решить проблему спасения виноградарства от филлоксеры, однако, на наш взгляд, недостатки привитой культуры (высокая изреженность насаждений к началу плодоношения, подверженность кустов бактериальному раку и хлорозу, задержка созревания урожая, снижение качества виноматериалов, значительные материальные затраты для восстановления насаждений после экстремально низких температур, повышение пестицидной нагрузки на ампелоценозы при возделывании восприимчивых к болезням и филлоксере сортов в привитой культуре) свидетельствуют, что проблема полностью не решена.
Кроме перевода винограда на привитую культуру, есть результаты по созданию нового генома принципиально новой виноградной лозы. Созданы синтетические виды носителей нового генома винограда n = 19, состоящего из хромосом обоих видов (10 хромосом от вида Vitis rotunolifoliа + 9 хромосом от вида Vitis vinifera) с высокой устойчивостью к болезням и филлоксере [26]. Однако внедрение синтетических видов винограда требует времени и детального их изучения на практике, и пока они не могут отвечать возросшим требованиям современного виноградарства и виноделия в практическом аспекте.
Важно отметить, что в настоящее время в арсенале виноградарства достаточно много высококачественных сортов отечественной селекции (институт “Магарач”, АЗОСВиВ) толерантных к корневой филлоксере [27–31], пригодных для возделывания в корнесобственной культуре.
Более того, в связи с недостатками привитой культуры возрастает необходимость сохранения и расширения корнесобственной культуры винограда, что послужило основанием для проведения целенаправленных комплексных исследований по разработке способов повышения устойчивости корнесобственных растений винограда к корневой филлоксере зав 2012–2020 гг. Сущность исследований состояла в повышении репарационной и регенеративной способности корневой системы, устойчивости ее к патогенной микрофлоре почвы и гниению, а также снижении потенциала размножения филлоксеры через изменение биохимического состава и гормонального статуса корней путем обработки физиологически активными соединениями листовой поверхности вегетирующих корнесобственных растений винограда.
В результате обобщения литературных и собственных экспериментальных данных на первом этапе исследований (2002–2013 гг.) [6, 18, 21, 32–34] были выделены перспективные ФАС гормональной природы. Впервые на основе анализа теоретического и экспериментального материала, представленного в мировой и отечественной литературе, а также собственных результатов научных исследований в лабораторных и вегетационных опытах были представлены теоретические положения для разработки физиологических основ повышения устойчивости винограда к филлоксере (2014–2016 гг.).
Выявлена перспективность применения физиологически активных соединений (аналогов фитогормонов) с целью повышения регенерационной способности корневой системы, физиологического и иммунного статуса растений и увеличения срока эксплуатации корнесобственных насаждений винограда (2017–2019 гг.). Состав, концентрации, соотношение и регламенты применения препаратов ФАС можно будет уточнить в полевых исследованиях и производственных испытаниях с выходом на внедрение и реализацию инновационной продукции (2020–2022 гг.).
В результате исследований установлено, что физиологически активные соединения гормональной природы являются средством эффективного воздействия на развитие корневой системы винограда при внекорневой обработке листовой поверхности. Особое значение этот факт имеет в связи с тем, что других средств воздействия на развитие корневой системы, поврежденной или повреждаемой филлоксерой, не существует, или они мало эффективны. Реакция на обработку ФАС зависела от биологических особенностей сортов и физиологических свойств препаратов. Обработка ФАС оказывала положительное действие непосредственно в год обработки, а также последействие на развитие кустов в последующие годы после применения [12]. Совместное применение ФАС цитокининовой и ауксиновой природы, а также трофического характера влияния на определенных этапах вегетации виноградного растения позволило молодым растениям винограда противостоять воздействию корневой филлоксеры.
В лабораторных условиях установлено, что чем хуже развита корневая система к моменту обработки, тем сильнее было положительное влияние ФАС. Препарат цитокининового действия также повышал показатель соотношения длины корень : побег. При совместном его применении с препаратами ауксинового и трофического действия проявлялся синергетический эффект [7], который был выражен значительным усилением развития сети боковых корней, что предполагало адаптивность винограда к стрессовым условиям, в т.ч. при заражении и угнетении корневой филлоксерой. Этот факт, на наш взгляд, имеет важное практическое значение, т.к. свидетельствует о перспективности применения ФАС на растениях с поврежденной филлоксерой корневой системой, а также о возможности профилактических обработок плодоносящих растений винограда на фоне филлоксеры, при первых признаках угнетения вегетативного роста растений.
Анализ развития корневой системы через 30 сут в условиях лабораторных опытов также показал, что обработка препаратом цитокининового действия листовой поверхности модельных растений с удаленной корневой системой способствовала дополнительной закладке и формированию новых корней. При этом их количество превышало число корней модельных растений контрольного варианта (без удаления корней) почти в 2 раза. Влияние препарата цитокининового действия на формирование новых корней и процесс регенерации корневой системы также было выражено сильнее, чем препарата ауксиновой природы.
Таким образом, исследования показали, что изученные препараты цитокининового и ауксинового действия обладали дистанционным эффектом, который был выражен в морфофизиологическом влиянии на развитие корневой системы при обработке листовой поверхности вегетирующих растений. Это согласовалось с данными иностранных авторов, что экзогенные цитокинины могут иметь дистанционные эффекты, а не проявлять действие только в месте нанесения или введения. Более того, установлено, что ФАС как гормонального, так и трофического действия, значительно повышали трофический потенциал корней при внекорневой обработке растений – содержание углеводов возрастало в 10–20 раз, аминокислот – в 1.5–4.0 раза в зависимости от природы препарата и его концентрации (табл. 1). Последействие ФАС на вегетативный рост молодых растений восприимчивого сорта Агадаи проявлялось сильнее по сравнению с толерантным сортом Первенец Магарача, независимо от степени влагообеспеченности почвы, что следует признать особенно важным фактом, т.к. представляет практический интерес именно повышение устойчивости к филлоксере восприимчивых сортов [11].
Таблица 1.
Влияние ФАС на биохимический состав корней модельных растений винограда сорта Агадаи (2018 г.)
| Вариант | Углеводы, г/кг | Аминокислоты, мг/кг | |||||
|---|---|---|---|---|---|---|---|
| фруктоза | глюкоза | сахароза | сумма сахаров | ||||
| Контроль | 3.9 | 1.1 | 1.6 | 6.6 | 3240 | ||
| Удаление корней | – | – | – | – | – | ||
| Удаление корней | препарат | мг/л | |||||
| ФАС-1 | 20 | 3.3 | 6.1 | 15.8 | 25.2 | 4110 | |
| 40 | 5.9 | 0.8 | 35.4 | 42.1 | 9550 | ||
| ФАС-2 | 2.5 | 2.7 | 2.1 | 23.2 | 28.0 | 7120 | |
| 5 | 0.15 | 0.24 | 39 | 39.4 | 5290 | ||
| ФАС-3 | 50 | 0.3 | 0.2 | 22.9 | 23.4 | 6700 | |
| 100 | 0.32 | 0.2 | 16.3 | 16.8 | 12 100 | ||
Многолетнее применение ФАС гормональной и трофической природы при совместном использовании оказывало значительное положительное последействие на угнетенные корневой филлоксерой растения восприимчивых сортов, которое выражалось в значительном повышении плодоносности кустов и урожайности. Урожай и общий прирост кустов винограда на фоне заражения филлоксерой в опытных вариантах был больше по сравнению с контролем в 3–10 раз, что свидетельствовало о перспективности применения изученных ФАС для повышения устойчивости винограда к филлоксере и возможности их применения для увеличения срока эксплуатации насаждений восприимчивых сортов винограда в корнесобственной культуре [12]. Поиск критериев устойчивости к филлоксере показал, что чем больше пасынкообразующая способность побегов гибридных форм, тем выше их толерантность к корневой форме филлоксеры [13]. В этой связи важно отметить, что при использовании ФАС наблюдают усиление пасынкообразующей способности угнетенных филлоксерой кустов, возможно за счет увеличения синтеза цитокининов в корнях, что также косвенно указывает на повышение активности деятельности собственно корневой системы. Соответственно, предлагаем использовать способность к образованию пасынков не только в качестве критерия толерантности сеянцев и сортов винограда к корневой форме филлоксеры, но и повышения жизнеспособности угнетенных филлоксерой растений винограда.
Некоторые авторы выявили связь устойчивости винограда к филлоксере с углеводным, фенольным и ауксиновым обменами и присутствием патогеной микрофлоры в почве [23, 37–39].
В этой связи нами в вегетационном опыте было изучено содержание фитогормонов и биологически активных веществ в элементах корневой системы сортов винограда, различавшихся по устойчивости к корневой филлоксере на фоне искусственного заражения филлоксерой и обработки раствором ФАС. На основании результатов исследования предположили, что биохимическая основа толерантности (сорт Первенец Магарача) и устойчивости (сорт Кобер 5 ББ) винограда к филлоксере имеет различную природу. Заражение филлоксерой модельных растений значительно изменяло биохимический состав корней винограда, а характер изменений зависел от биологических особенностей сортов. Результаты биохимических исследований 2015–2020 гг. подтвердили, что толерантность винограда к корневой филлоксере сопряжена с фенольным, белковым, углеводным обменами и гормональным статусом корней, и полагаем, что ФАС, определяя метаболический и гормональный статусы корневой системы при атаке и повреждении филлоксерой, могут служить фактором повышения специфической/неспецифической устойчивости винограда к корневой форме филлоксеры.
Общим для изученных сортов следует признать значительное снижение содержания аминокислот и повышение содержания углеводов и фенольных соединений на фоне заражения филлоксерой. Особо следует отметить, что обработка ФАС на фоне филлоксеры способствовала повышению содержания аминокислот в корневой системе восприимчивого сорта Агадаи в 3.7 раза, и что нам кажется важным, за счет увеличения содержания именно тех аминокислот (пролина, треонина, серина, аланина), которые в большем количестве представлены у толерантного сорта Первенец Магарача. В этой связи считаем важным также отметить, что содержание ФАС в листьях и корнях изученных сортов имеет противоположную тенденцию – чем устойчивее сорт к корневой филлоксере, тем больше содержание ФАС первичного синтеза в листьях и наоборот.
Сорта винограда, толерантные к корневой филлоксере, имеют разный биохимический и гормональный статусы вне заражения вредителем, которые изменяются в различной степени в ответ на заражение и обработку ФАС. Результаты исследований еще раз свидетельствовали о сопряженности и вовлеченности углеводного, аминокислотного и фенольного обменов в процесс ответной реакции и приспособление виноградного растения к вредителю при соответствующем гормональном статусе, но этот процесс не носит однозначный и однонаправленный характер. Эффекты применения жасмоновой кислоты (ЖАС) – повышение содержания АБК, ароматических аминокислот тирозина и фенилаланина, лежащих в основе шикиматного метаболического пути – связующего звена между первичным и вторичным обменом веществ – на фоне снижения содержания фенолкарбоновых кислот, позволяют предположить усиление действия ФАС (1 + 2 + 3) на устойчивость винограда к корневой филлоксере при совместном применении с жасмоновой кислотой [33]. Результаты лабораторных и вегетационных опытов были апробированы на корнесобственных молодых и угнетенных филлоксерой растениях восприимчивых сортов Агадаи и Мускат дербентский.
Исследования показали, что обработка листовой поверхности вегетирующих растений раствором ФАС позволяет молодым корнесобственным растениям достичь начала плодоношения на 4-й год вегетации на фоне филлоксеры, тогда как без применения ФАС растения контрольного варианта не вступали в плодоношение [11]. Влияние ФАС на угнетенные филлоксерой растения в значительной степени определялось их воздействием на плодоносность растений предшествующими обработками, а не только изменением показателей продуктивности в год обработки. У сортов Агадаи и Мускат дербентский после 4-х лет применения ФАС на 5-й год было значительно больше гроздей на кусте, чем в контрольном варианте. Это косвенное доказательство тому, что растения на фоне филлоксеры стали восстанавливать свою жизнеспособность, в первую очередь через восстановление корневой системы. Соответственно, улучшались и повышались показатели урожая текущего года, даже без непосредственного воздействия в данный вегетационный период раствором ФАС. Все это повышало урожай с куста и урожайность в целом [12]. На основании лабораторных, вегетационных и полевых исследований 2012–2020 гг. считаем возможным представить модель управления устойчивостью корнесобственных ампелоценозов к корневой форме филлоксеры (рис. 2).
Рис. 2.
Модель управления устойчивостью ампелоценозов к корневой филлоксере на основе закономерностей влияния ФАС на морфофизиологию и биохимию корней винограда, в т.ч. на фоне заражения филлоксерой, которые проявляются регенерацией и репарацией корней, изменением содержания физиологически активных веществ, повышением трофического потенциала корней, снижением потенциала размножения вредителя.
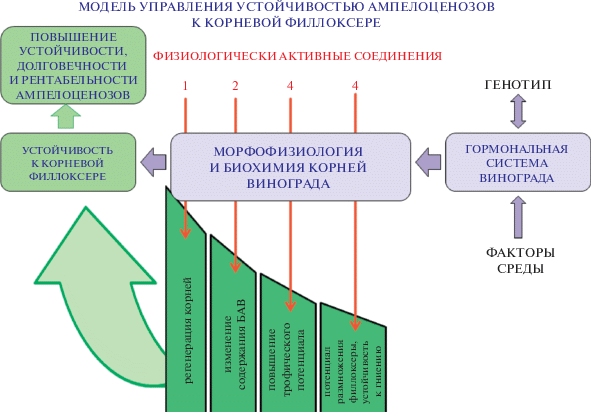
В структуре модели лежат параметры, определяющие устойчивость винограда к стрессорам абиотического и биотического характера, результаты исследований на сортах с различной устойчивостью к филлоксере, биохимические реакции их генотипов на атаку филлоксерой и изменения этой реакции при обработке ФАС.
В основе реализации модели – параметры морфофизиологии и биохимии элементов корневой системы корнесобственного растения винограда, их связь с устойчивостью к корневой филлоксере: 1 – в естественных условиях без заражения вредителем, 2 – при атаке филлоксеры и 3 – при применении ФАС.
На основе результатов наших исследований, полагаем, что именно морфофизиология и биохимия элементов корневой системы в значительной степени определяют устойчивость и толерантность сортов винограда к корневой форме филлоксеры. В этой связи важную роль в попытках экзогенного контроля обменных процессов в корневой системе и, соответственно, повышения устойчивости генотипов к корневой филлоксере может играть гормональная регуляция морфофизиологических и биохимических процессов в корневой системе растений винограда при повреждении вредителем.
Исследования показали, что воздействие ФАС с определенным морфофизиологическим (ФАС-1), биохимическим (ФАС-2), трофическим (ФАС-3), сигнальным и опосредованно инсектоакарицидным, антистрессовым (жасмоновая кислота) действием позволяет повысить физиологическую устойчивость корнесобственных растений винограда к корневой форме филлоксеры, а следовательно долговечность, продуктивность и рентабельность корнесобственных насаждений винограда.
Исследования 2012–2020 гг. показали, что применение ФАС на фоне сплошного заражения филлоксерой также позволяет сохранять продуктивность корнесобственных насаждений винограда сорта Мускат дербентский. Их действие имело пролонгирующий эффект и сохранялось в последующие 5 лет без обработок раствором ФАС. Наибольшую эффективность проявлял препарат ФАС-1, его действие усиливалось при сочетании с препаратом ФАС-3 и сохранялось при включении в их смесь препарата ФАС-2.
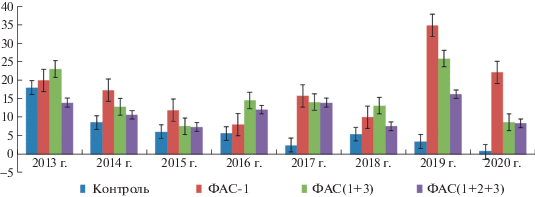
Для наглядности представлена динамика урожайности сорта Мускат дербентский по годам с начала исследования (рис. 3). Урожайность в эффективных и практически значимых вариантах была больше, начиная с первых лет применения ФАС, за счет непосредственного влияния ФАС на элементы урожая текущего года (количество ягод в грозди и масса ягод). Однако существенное повышение урожая с куста отмечали с 4-го года применения ФАС, что было связано с повышением плодоносности растений и улучшением их физиологического состояния. Следует отметить, что последействие ФАС не только сохранялось, но и усиливалось в течение 4-х лет отсутствия обработок. И только к 2020 г. выявили некоторое уменьшение урожая, что коррелировало со снижением показателей-критериев жизнеспособности и физиологического состояния растений – плодоносности и длины побегов перед цветением.
Рис. 3.
Динамика урожая сорта Мускат дербентский (2013–2020 гг.), кг/куст. С 3-го года применения ФАС на угнетенных филлоксерой корнесобственных растениях винограда отмечено повышение урожая в опытных вариантах. Действие ФАС имело пролонгирующий эффект и сохранялось в последующие годы.
Известно, что существует зависимость между развитием корневой системы и вегетативным ростом винограда, реализуемая через взаимоотношения между органами растения и связи с участием гормональных факторов, в первую очередь, взаимодействия цитокининов и ауксинов. Установлено, что в опытных вариантах прирост куста был в 1.8–3.1 раза больше, чем в контроле. При этом влияние препарата ФАС-1 проявлялось сильнее, чем препаратов ауксинового (ФАС-2) и трофического (ФАС-3) действия. Надо отметить, что синергетический эффект от их совместного применения на вегетативный рост не был выявлен (табл. 2).
Таблица 2.
Общий прирост побегов сорта винограда Мускат дербентский (2020 г.)
| Вариант | Прирост побегов, см | % к контролю | |||
|---|---|---|---|---|---|
| всего | вызревшая часть | всего | вызревшая часть | ||
| ФАС(1 + 2 + 3) | 1790 ± 90 | 762 | 212 | 142 | |
| ФАС-1 | 40 мг/л | 2610 ± 130 | 1410 | 310 | 263 |
| ФАС-2 | 5 мг/л | 2220 ± 110 | 1070 | 263 | 200 |
| ФАС-3 | 50 мг/л | 2020 ± 100 | 925 | 240 | 172 |
| ФАС(1+2) | 1490 ± 70 | 631 | 176 | 118 | |
| ФАС(1+3) | 1640 ± 80 | 866 | 194 | 162 | |
| Контроль | 842 ± 42 | 537 | 100 | 100 | |
В целом, считаем возможным сделать следующие выводы, использовав результаты стационарного многолетнего опыта:
1. Исследование показало, что во всех вариантах опыта с применением ФАС отмечено их положительное воздействие на увологические показатели сорта Мускат дербентский. Применение ФАС различного механизма действия позволило корнесобственным растениям восприимчивого к корневой филлоксере сорта Мускат дербентский противостоять вредителю, восстановить вегетативный рост, повысить продуктивность и реализовать генетический потенциал на фоне заражения филлоксерой;
2. Установлено, что высокую эффективность в повышении толерантности к филлоксере проявил цитокининовый препарат ФАС-1. Вопрос его совместного применения в производстве с препаратами ФАС-2 и ФАС-3 остается открытым. Можно предположить, что их совместное применение рационально в первые 1–2 года “реанимирования” или предупреждения негативного влияния филлоксеры на зараженных участках, с последующими обработками ФАС-1 или смесью ФАС(1 + 3) для достижения необходимых параметров плодоносности и урожая.
Считаем возможным предложить регламенты применения ФАС при необходимости “реанимирования” филлоксерных корнесобственных насаждений. Целесообразно производить ежегодные двукратные обработки растворами ФАС по листовой поверхности в период вегетации (перед цветением и в начале созревания урожая, расход жидкости – 0.5 л/куст) в течение 3–4 лет до достижения необходимых параметров плодоносности и урожая. Далее, при их достижении приостановить применение ФАС до начала снижения показателей – критериев физиологического состояния растений (плодоносности, количества завязавшихся гроздей, длины побега перед цветением).
Управление качеством урожая винограда. Для бессемянных сортов винограда разработана эффективная технология применения регуляторов роста, в частности, гиббереллина для повышения продуктивности насаждений и качества сушеной продукции. Многолетние наши исследования позволили предложить элементы технологии применения ФАС для повышения качества урожая столовых и технических сортов винограда в условиях юга России. Технология направлена на применение ФАС в виноградарстве с целью повышения содержания сахаров в ягодах и ускорения созревания винограда. Она предназначена для специализированных виноградарских, фермерских и личных хозяйств, занимающихся возделыванием столовых и технических сортов винограда. Предлагаются также элементы практического применения ФАС – регуляторов роста для повышения качества продукции с высокой коммерческой ценностью семенных столовых сортов винограда Vitis vinifera L. в ранние сроки [21].
Основу технологии составляют систематизированная база данных многолетних исследований по изучению реакции генеративных органов на применение ФАС и их механизм действия на процесс созревания и сахаронакопления в ягодах. Она базируется на банке данных с 1987 по 2020 г., сопряженных с изучением реакции генеративных органов виноградного растения на применение ФАС различного регуляторного механизма (гиббереллины, цитокинины, ауксины, стрептомицин), концентраций, соотношения и сроков их применения на развитие элементов ягоды более 60-ти семенных и бессемянных сортов винограда различной генеалогии в разных эколого-климатических условиях (Дагестан, Ростовская обл., Узбекистан).
В основе практической реализации технологии лежит компьютерная программа для подбора целесообразных регламентов применения регуляторов роста, которая реализована в среде разработки Delphi XE8 на языке программирования Delphi [16].
Исходной биологической величиной, характеризующей сорт и лежащей в основе работы цифровой программы, является семенной индекс сорта – отношение массы мякоти к массе семян. Семенной индекс сорта является показателем, характеризующим морфофизиологические процессы в ягоде, отражающие генетическую предрасположенность сорта к преимущественному росту семян или околоплодника.
Реализация элементов технологии достигается путем использования цифровой программы, которая позволяет подобрать регламенты применения регуляторов роста для конкретного семенного сорта по величине его семенного индекса.
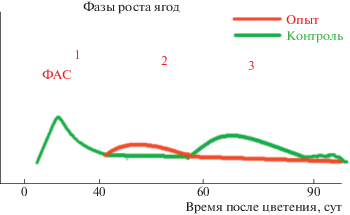
Механизм действия на процесс созревания и сахаронакопления в ягодах винограда заключается в следующем. При обработке виноградного растения на определенных стадиях развития семяпочек соцветий винограда, запускается механизм абортации зародыша в семени вследствие нарушения гормонального баланса в семяпочках. При этом развитие интегументов не нарушается, размеры и форма семян соответствуют сортовым особенностям. В то же время масса семян снижается почти в 2–3 раза. Отсутствие нормально развивающегося зародыша запускает механизм старения генеративных органов винограда (ягод), что выражается в переходе ягод винограда после 1-й фазы роста к 3-й, минуя 2-ю. За счет отсутствия 2-й фазы роста ускоряется начало созревания ягод винограда при обработке регуляторами роста и отмечается более высокое содержание сахаров к моменту сбора урожая. Предполагаем, что именно накопление ассимилятов в околоплоднике из-за нарушения развития зародыша и эндосперма может являться причиной более высокого содержания сухих веществ в соке ягод (у винограда они представлены моносахарами) (рис. 4).
Рис. 4.
Механизм ускорения срока созревания ягод винограда. При обработке виноградного растения на определенных стадиях развития семяпочек соцветий винограда запускается механизм абортации зародыша в семени вследствие нарушения гормонального баланса в семяпочках. За счет отсутствия 2-й фазы роста ускоряется начало созревания винограда и отмечается более высокое содержание сахаров в ягодах к моменту сбора урожая.
Состав, соотношение и сроки применения регуляторов роста зависят от особенностей сортов и от цели их применения – полное отсутствие семян или ускорение созревания урожая, получение столового винограда или на переработку. Элементы технологии применения регуляторов роста на семенных сортах винограда подразумевают получение оптимальных регламентов применения ФАС для повышения содержания сахаров и ускорения начала созревания урожая семенных сортов, таких как вид ФАС, сроки применения, кратность обработки, метод обработки, состав смеси, концентрации регуляторов роста, эффективный календарный интервал обработки, нагрузка кустов урожаем.
Отмечено, что при равных других условиях, в основе эффективного применения регуляторов роста лежит и имеет более важное значение правильный подбор срока их применения [18]. Также нами установлено, что реакция сортов межвидового происхождения отличается от таковой сортов Vitis vinifera L. В этой связи следует использовать ФАС на определенных этапах развития генеративной сферы семенных сортов винограда в различных соотношениях в зависимости от происхождения сортов. Для сортов Vitis vinifera L. (Агадаи, Мускат гамбургский, Ркацители и др.) их следует применять на этапе органогенеза (срок обработки)–начало эмбриогенеза (10–15 сут после окончания цветения) в концентрациях: гиббереллин А3 – 10, 25 мг/л, цитокинины – 2.5, 5.0 мг/л, ауксины – 2.5, 5.0 мг/л, стрептомицин – 100, 200, 400 мг/л. Для сортов межвидового происхождения (Молдова, Кодрянка и др.) целесообразны обработки на этапе развития (срок обработки)–эмбриогенез (15–25 сут после окончания цветения) в концентрациях: гиббереллин А3 – 25, 50 мг/л, цитокинины – 2.5, 5.0 мг/л, ауксины – 2.5, 5.0 мг/л, стрептомицин – 400 мг/л.
Важно отметить, что у обеих групп сортов использование соответствующих сочетаний препаратов в более ранние сроки увеличивает долю бессемянных ягод в грозди. Однако при этом необходимо использовать более низкие концентрации препаратов и ожидать некоторое снижение массы отдельных ягод, которое слабо отражается на массе грозди и качестве урожая.
Подбор регламентов применения (состав, соотношение в смеси, концентрации действующего вещества, срок обработки) регуляторов роста проводятся по величине сортового семенного индекса, в т.ч. с использованием разработанной нами цифровой программы [16].
Определение семенного индекса (СИ) проводят путем нахождения массы 100 ягод конкретного столового сорта и массы семян в них. Рассчитывают индекс как отношение массы мякоти (а) к массе семян (в), он является безразмерным показателем и меняется в пределах 5–45, у крупноягодных сортов нового поколения может достигать более высоких показателей – 50–70:
Например, для сорта Агадаи при семенном индексе в условиях Дагестана, равном 24.9, и введении его величины в окно цифровой программы и запуске программы выдается оптимальный вариант применения регуляторов роста для данного сорта, а именно, состав смеси, концентрации препаратов и срок обработки: в данном случае гиббереллин – 25 мг/л, цитокинин – 5 мг/л, ауксин – 2.5 мг/л, стрептомицин – 400 мг/л, срок обработки – IV (начало эмбриогенеза), 15 сут после окончания цветения.
Для сорта Молдова в условиях ДСОСВиО при семенном индексе 18.5 оптимальный вариант применения регуляторов роста следующий: гиббереллин – 50 мг/л, цитокинин – 5.0 мг/л, ауксин – 2.5 мг/л, стрептомицин – 400 мг/л, срок обработки – V (эмбриогенез), 25 сут после окончания цветения.
Важно отметить и учитывать тот факт, что регламенты применения ФАС на одном и том же сорте зависят от конкретных условий возделывания данного сорта, от условий года, от культуры ведения насаждений, даже от времени обработки растений в течение суток (эффективнее вечерние обработки, чем утренние) и в этой связи для получения высококачественной рентабельной продукции (с высоким содержанием сахаров в ранние сроки, в т.ч. бессемянной) необходимо корректировать регламенты для каждой микрозоны возделывания конкретного сорта.
Технология подразумевает обработку как соцветий методом обмакивания, так и кустов методом опрыскивания преимущественно соцветий в зависимости от биологических особенностей сортов. При обработке методом обмакивания соцветия окунают в сосуд с рабочим раствором на 2–3 с. При обработке кустов растения опрыскивают рабочим раствором с помощью ранцевого опрыскивателя, преимущественно попадая на генеративные органы (соцветия). В этом случае рекомендуется удаление бесплодных и слабых побегов для лучшего смачивания соцветий. Эффективность применения элементов технологии к фазе начала созревания урожая семенных сортов селекции ДСОСВиО и поздних сортов Агадаи и Молдова приведена на рис. 5, 6.
Рис. 5.
Содержание сахаров в ягодах семенных сортов винограда при применении регуляторов роста (г/дм3): к началу созревания урожай больше в опытном варианте за счет формирования феноспермических ягод.
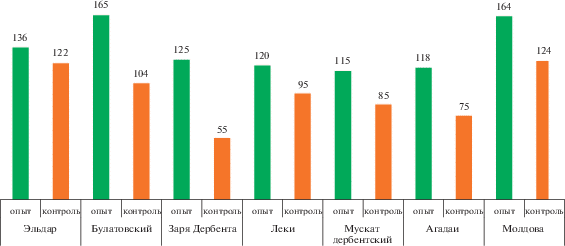
Рис. 6.
Примеры ускорения созревания урожая семенных сортов – формирование феноспермических ягод: (а) – сорт Булатовский, (б) – Молдова, (в) – Мускат дербентский. Развитие интегументов не нарушается, размеры и форма семян соответствуют сортовым особенностям. Масса семян снижается в 2–3 раза. Отсутствие нормально развивающегося зародыша запускает процесс созревания ягод (механизм старения генеративных органов винограда) и его ускорение.

Технологический эффект применения ФАС выражается в повышении содержания сахаров в ягодах на 20–50 г/дм3 и ускорении начала созревания урожая на 15–20 сут. Экономическая эффективность внедрения технологии основана на получении конкурентоспособной продукции семенных сортов с высокой коммерческой и потребительской ценностью (содержание сахаров в ягодах больше на 20–50 г/дм3, недоразвитость семян в связи с отсутствием зародыша и эндосперма, ускорение начала созревания на 15–20 сут), в сравнении с урожаем без применения элементов технологии, реализуемой по более высокой рыночной цене с увеличением дохода на 50–70%.
Предложены элементы практического применения регуляторов роста для получения бессемянной продукции с высокой коммерческой ценностью у семенных столовых сортов винограда Vitis vinifera L.
В основе технологии лежит систематизированная база данных многолетних исследований (1987–2015 гг.) по изучению формирования генеративных органов и влияния регуляторов роста различного механизма действия (гиббереллины, цитокинины, ауксины, стрептомицин), концентраций, соотношения и сроков их применения на развитие элементов ягоды более 50-ти семенных сортов винограда различной генеалогии в разных эколого-климатических условиях (Дагестан, Ростовская обл., Узбекистан).
База данных содержит информацию о влиянии 3-х групп регуляторов роста стимулирующего действия и антибиотика при раздельном и совместном применении. В основе практической реализации технологии лежит компьютерная программа для подбора целесообразных регламентов применения регуляторов роста, которая реализована в среде разработки Delphi XE8 на языке программирования Delphi.
Исходной биологической величиной, характеризующей сорт и лежащей в основе работы цифровой программы, является семенной индекс сорта – отношение массы мякоти к массе семян. Семенной индекс сорта является показателем, характеризующим морфофизиологические процессы в ягоде, отражающие генетическую предрасположенность сорта к преимущественному росту семян или околоплодника. Реализация элементов технологии достигается путем использования цифровой программы, которая позволяет подобрать регламенты применения (состав, соотношение в смеси, концентрации действующего вещества, срок обработки) регуляторов роста для конкретного семенного сорта по величине его семенного индекса.
Программный продукт подразумевает получение оптимальных регламентов (регуляторы роста, сроки применения, кратность обработки, метод обработки, состав смеси, концентрации регуляторов роста, эффективный календарный интервал обработки, нагрузка кустов урожаем) применения регуляторов роста для индукции различной степени бессемянности и ускорения начала созревания урожая семенных сортов (рис. 7, 8).
Рис. 7.
Механизмы формирования и технологическая инструкция получения бессемянных ягод, в основе которых лежит влияние ФАС на элементы ягоды семенных сортов винограда с различной склонностью к преимущественному росту семяпочки или околоплодника. Интегральным показателем для подбора регламентов применения ФАС выступает семенной индекс семенного сорта.
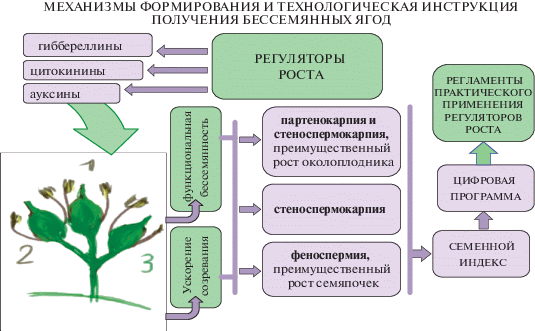
Рис. 8.
Примеры получения бессемянной продукции семенных сортов: подбор сроков, концентраций и соотношения ФАС в зависимости от генеалогии семенного сорта позволяет достичь полную бессемянность ягод с высокой коммерческой ценностью урожая и в ранние сроки: (а) – сорт Агадаи, (б) – Кодрянка, (в) – Ркацители, (г) – Молдова.

Например, для сорта Агадаи при семенном индексе в условиях Дагестана, равном 24.9, и введении его величины в окно цифровой программы и запуске программы выдается оптимальный вариант применения регуляторов роста для данного сорта, а именно состав смеси, концентрации препаратов и срок обработки: гиббереллин – 25 мг/л, цитокинин – 5.0 мг/л, ауксин – 5.0 мг/л, стрептомицин – 400 мг/л, срок обработки – III (постоплодотворение).
Для сорта Мускат гамбургский в условиях АО “Геджух” Дербентского р-на РД при семенном индексе 34.5 оптимальный вариант применения регуляторов роста следующий: гиббереллин – 25 г/л, цитокинин – 5.0 мг/л, ауксин – 2.5 мг/л, стрептомицин – 400 мг/л, срок обработки – IV (начало эмбриогенеза).
Технология подразумевает обработку как соцветий методом обмакивания, так и кустов методом опрыскивания преимущественно соцветий в зависимости от биологических особенностей сортов. При обработке методом обмакивания соцветия окунают в сосуд с рабочим раствором на 2–3 с. При обработке кустов растения опрыскивают рабочим раствором с помощью ранцевого опрыскивателя, преимущественно попадая на генеративные органы (соцветия). В этом случае рекомендовано удаление бесплодных и слабых побегов для лучшего смачивания соцветий. Технологический эффект применения ФАС выражается в формировании бессемянных ягод или семенных ягод с рудиментарными или без эндосперма семенами с более высоким содержанием сахаров и в более ранние сроки. Экономическая эффективность внедрения технологии основана на получении конкурентоспособной бессемянной продукции семенных сортов с высокой коммерческой и потребительской ценностью (содержание сахаров в ягодах выше на 20–50 г/дм3, отсутствие или недоразвитость семян, ускорение начала созревания на 15–20 сут), в сравнении с урожаем без применения элементов технологии, реализуемой по более высокой рыночной цене с увеличением дохода на 50–70%.
Использованные ФАС относятся к группе малотоксичных соединений. Соблюдение особых условий и регламентов при их применении не требуется, достаточно выполнения рекомендаций по работе с малотоксичными соединениями. Рекомендовано использовать защитные средства на руках (перчатки) при обработке соцветий методом обмакивания для предотвращения местного воздействия аллергического характера.
ЗАКЛЮЧЕНИЕ
На основании лабораторных, вегетационных и полевых исследований 2012–2020 гг. представлена модель управления устойчивостью корнесобственных ампелоценозов к корневой форме филлоксеры.
В структуре модели лежат параметры, определяющие устойчивость винограда к стрессорам абиотического и биотического характера, результаты исследований на сортах с различной устойчивостью к филлоксере, биохимические реакции их генотипов на атаку филлоксерой и изменения этой реакции при обработке физиологически активными веществами (ФАС).
В основе реализации модели – параметры морфофизиологии и биохимии элементов корневой системы корнесобственного растения винограда, их связь с устойчивостью к корневой филлоксере: 1 – в естественных условиях без заражения вредителем, 2 – при атаке филлоксеры и 3 – при применении ФАС. Созданы модели и программные продукты, которые подразумевают получение оптимальных регламентов (регуляторы роста, сроки применения, кратность обработки, метод обработки, состав смеси, концентрации регуляторов роста, эффективный календарный интервал обработки, нагрузка кустов урожаем) применения ФАС для индукции различной степени бессемянности и ускорения начала созревания урожая семенных сортов. Основу технологии составляют систематизированная база данных многолетних исследований по изучению реакции генеративных органов на применение ФАС и их механизм действия на процесс созревания и сахаронакопления в ягодах. Она базируется на банке данных с 1987 по 2020 г., сопряженных с изучением реакции генеративных органов виноградного растения на применение ФАС различного регуляторного механизма (гиббереллины, цитокинины, ауксины, стрептомицин), концентраций, соотношения и сроков их применения на развитие элементов ягод более 60 семенных и бессемянных сортов винограда различной генеалогии в разных эколого-климатических условиях (Дагестан, Ростовская обл., Узбекистан). Экономическая эффективность внедрения технологии основана на получении конкурентоспособной продукции семенных сортов с высокой коммерческой и потребительской ценностью (содержание сахаров в ягодах больше на 20–50 г/дм3, недоразвитость семян в связи с отсутствием зародыша и эндосперма, ускорение начала созревания на 15–20 сут) в сравнении с урожаем без применения элементов технологии, и реализуемой по более высокой рыночной цене с увеличением дохода на 50–70%.
Список литературы
Полевой В.В. Физиология растений. М.: Высш. Шк., 1989. 464 с.
Шаповал О.А., Можарова И.П. Регуляторы роста растений в сельском хозяйстве // Защита и карантин растений. 2019. № 4. С. 9–14.
Никольский М.А., Панкин М.И., Султанова З.К., Казыбаева С.Ж., Сычева Е.С. Улучшение качественных показателей саженцев винограда под воздействием регуляторов роста // Виноделие и виноградарство. 2016. № 4. С. 46–50.
Сычев В.Г., Шаповал О.А., Можарова И.П., Пономарева А.С., Веревкина Т.М., Коршунов А.А., Вознесенская Т.Ю., Козлов И.Г., Кононова Т.В. Бюллетень регуляторов роста растений и агрохимикатов, прошедших регистрационные испытания в период с 2015–2017 гг. / Под ред. П.А. Чекмарева. Произв.-практ. изд. М.: Плодородие, 2018. 340 с.
Смирнов К.В., Малтабар Л.М., Раджабов А.К., Мутузок Н.В. Виноградарство / Под ред. Смирнова К.В. М.: МСХА, 1998. 511 с.
Казахмедов Р.Э., Тагирбекова Э.А. Филлоксера и физиологически активные соединения: от идеи к результатам // Плод-во и виноград-во Юга России. 2013. № 22 (4). С. 122–126.
Казахмедов Р.Э., Шихсефиев А.Т. Влияние физиологически активных соединений на развитие элементов корневой системы модельных растений винограда // Пробл. развития АПК региона. 2015. № 3. С. 40–43.
Казахмедов Р.Э., Агаханов А.Х., Шихсефиев А.Т. Филлоксера и физиологически активные соединения: развитие элементов корневой системы растений винограда // Науч. тр. гос. научн. учрежд. Северо-Кавказского зонального НИИ садоводства и виноградарства РАСХН. 2015. Т. 8. С. 222–229.
Казахмедов Р.Э. Физиологические методы повышения устойчивости винограда к филлоксере // Винодел. и виноград-во. 2015. № 2. С. 48–51.
Казахмедов Р.Э., Шихсефиев А.Т. Биохимическая основа толерантности винограда и гормональная регуляция физиологической устойчивости к филлоксере // Пробл. развития АПК региона. 2016. № 4. С. 22–25.
Казахмедов Р.Э., Магомедова М.А. Филлоксера и физиологически активные соединения: развитие молодых растений винограда на фоне заражения филлоксерой // Научн. тр. гос. научн. учрежд. Северо-Кавказского зонального НИИ садоводства и виноградарства РАСХН. 2017. Т. 13. С. 114–117.
Казахмедов Р.Э., Магомедова М.А. Филлоксера и физиологически активные соединения: продуктивность плодоносящих растений винограда, угнетенных филлоксерой // Там же. С. 118–123.
Казахмедов Р.Э., Мамедова С.М. Ранняя диагностика устойчивости гибридных форм винограда к филлоксере // Винодел. и виноград-во. 2016. № 3. С. 36–39.
Казахмедов Р.Э., Магомедова М.А., Мамедова С.М. Генотипы винограда дагестанской селекции для получения высококачественной бессемянной продукции // Плод-во и виноград-во Юга России. 2013. № 49 (01). С. 107–125.
Казахмедов Р.Э., Магомедова М.А. Филлоксера и физиологически активные соединения: от идеи к внедрению // Научн. тр. Северо-Кавказ. фед. научн. центра сад-ва, виноград-ва, винодел. 2018. Т. 18. С. 97–100.
Казахмедов Р.Э., Казахмедов Т.Р. Перспективы цифровизации технологий применения регуляторов роста в виноградарстве // Научн. тр. Северо-Кавказ. фед. научн. центра сад-ва, виноград-ва, винодел. 2019. Т. 24. С. 87–92.
Казахмедов Р.Э. Физиологические аспекты повышения толерантности винограда к корневой филлоксере // Агрохимия. 2019. № 6. С. 18–26.
Казахмедов Р.Э., Агаханов А.Х., Халифатов М.С., Ремиханова Т.Ф. Регуляторы роста на виноградниках Дагестана // Винодел. и виноград-во. 2008. № 3. С. 44–45.
Казахмедов Р.Э., Магомедова М.А. Перспективы применения физиологически активных соединений в виноградарстве и овощеводстве республики Дагестан // Пробл. разв. АПК региона. 2018. № 3 (35). С. 30–35.
Казахмедов Р.Э. Трофическая регуляция формирования генеративных органов винограда // Винодел. и виноград-во. 2017. № 6. С. 35–38.
Казахмедов Р.Э. Физиологические основы применения регуляторов роста на семенных сортах винограда Vitis vinifera L. // Винодел. и виноград-во. 2013. № 2. С. 36–37.
Лазаревский М.А. Изучение сортов винограда. Ростов н/Д.: Изд-во Ростов ун-та, 1963. 151 с.
Недов П.Н. Иммунитет винограда к филлоксере и возбудителям гниения корней // Кишинев: изд-во “Штиинца”, 1977. 171 с.
Агротехнические исследования по созданию интенсивных виноградных насаждений на промышленной основе / Под ред. В.П. Бондарева, Е.И. Захароваа. Новочеркасск, 1978. 178 с.
Доспехов Б.А. Методика полевого опыта. М.: Агропромиздат, 1985. 351 с.
Топалэ Ш.Г., Даду К.Я. Филлоксера – проблема мирового виноградарства // Винодел. и виноград-во. 2007. № 5. С. 15–18.
Никулушкина Г.Е., Хмырова И.Л., Коваленко А.Г. Новые гибридные формы винограда селекции азосвив – потенциал отечественного виноградарства // Плод-во и виноград-во Юга России. 2017. № 47 (5). С. 33–40.
Никулушкина Г.Е., Ларькина М.Д. Технические сорта винограда селекции АЗОС, толерантные к филлоксере, – потенциал отечественного виноградарства // Виноград-во и винодел. 2015. Т. 45. С. 56–58.
Ларькина М.Д., Никулушкина Г.Е., Щербаков С.В. Филлоксероустойчивые гибридные формы винограда технического направления для совершенствования сортимента // Плод-во и виноград-во Юга России. 2014. № 29 (5). С. 10–17.
Никулушкина Г.Е., Ларькина М.Д. Потенциал сортов анапской зосвив технического направления, толерантных к филлоксере // Научн. тр. Северо-Кавказ. зонал. НИИ сад-ва и виноград-ва РАСХН. 2014. Т. 6. С. 184–188.
Казахмедов Р.Э. Адаптивный и генетический потенциал сорта Первенец Магарача и перспективы его использования в селекции и производстве в республике Дагестан // Пробл. разв. АПК региона. 2020. № 4 (44). С. 88–97.
Казахмедов Р.Э., Агаханов А.Х. Получение бессемянных ягод у семенных сортов винограда // Винодел. и виноград-во. 2004. № 5. С. 34–37.
Казахмедов Р.Э., Агаханов А.Х. Обработка регуляторами роста перспективных семенных сортов для получения бессемянных ягод винограда // Винодел. и виноград-во. 2007. № 3. С. 35.
Казахмедов Р.Э., Ремиханова Т.Ф., Смирнов К.В. Прогноз эффективности обработки регуляторами роста семенных сортов винограда // Винодел. и виноград-во. 2009. № 3. С. 46–48.
Казахмедов Р.Э. Виноград и филлоксера: влияние физиологически активных соединений на биохимические особенности корневой системы винограда // Плод-во и виноград-во юга России. 2020. № 66 (6). С. 250–269.
Петров В.С., Алейникова Г.Ю., Панкин М.И., Руссо Д.Э., Красильников А.А., Воробьева Т.Н., Лукьянов А.А., Казахмедов Р.Э. Управление устойчивостью ампелоценозов в условиях антропогенной интенсификации производства и изменений климата юга России // Плод-во и виноград-во Юга России. 2020. № 66 (6). С. 123–148.
Зотов В.В. Особенности биохимических процессов в корнях винограда, пораженных филлоксерой // Биохимия плодов и овощей. Иммунитет и покой картофеля, плодов и овощей. М.: Наука, 1964. С. 118–129.
Денисова Т.В. Биохимическая характеристика филлоксероустойчивости винограда: Автореф. дис. … канд. биол. наук. М., 1965. 25 с.
Недов П.Н. Иммунитет винограда к филлоксере и возбудителям гниения корней и его практическое использование: Автореф. дис. … д-ра биол. наук. Л., 1978. 40 с.
Дополнительные материалы отсутствуют.


