Агрохимия, 2021, № 8, стр. 82-96
Органоглины – новый класс перспективных сорбентов для ремедиации химически загрязненных объектов окружающей среды
Л. В. Переломов 1, *, Ю. М. Атрощенко 1, Т. М. Минкина 2, И. В. Переломова 3, Т. В. Бауэр 4, Д. Л. Пинский 5
1 Тульский государственный педагогический университет им. Л. Н. Толстого
300026 Тула, просп. Ленина, 125, Россия
2 Академия биологии и биотехнологии им. Д. И. Ивановского Южного федерального университета
344090 Ростов-на-Дону, просп. Стачки, 194/1, Россия
3 Тульский государственный университет
300026 Тула, просп. Ленина, 92, Россия
4 Южный научный центр РАН
344006 Ростов-на-Дону, ул. Чехова, 41, Россия
5 Пущинский научный центр биологических исследований–
Институт физико-химических и биологических проблем почвоведения РАН
142290 Пущино, Московская обл., ул. Институтская, 2, Россия
* E-mail: perelomov@rambler.ru
Поступила в редакцию 13.03.2021
После доработки 28.04.2021
Принята к публикации 11.05.2021
Аннотация
Важнейшей областью экологических исследований в индустриальных условиях является поиск и создание эффективных сорбентов химических загрязнителей, доступных и недорогих, не наносящих вред окружающей среде, обладающих требующейся селективностью поглощения. Модифицированные органическими веществами глинистые минералы в полной мере отвечают данным требованиям. В обзоре описаны свойства глинистых минералов и органических веществ, определяющие особенности их взаимодействий при получении органоглин. Приведены данные об эффективном использовании органоглин на основе различных глинистых минералов по отношению к широкому спектру химических загрязнителей.
СОРБЦИОННЫЕ СВОЙСТВА ПРИРОДНЫХ ФИЛЛОСИЛИКАТОВ
Глинистые минералы – одни из важнейших компонентов почв, контролирующих подвижность и биологическую доступность химических соединений в наземных экосистемах. Слоистая структура, большая удельная поверхность, химическая и механическая стабильность, способность многих минералов к набуханию, наличие реактивных функциональных групп, заряд поверхностей делают глинистые минералы отличными адсорбирующими материалами [1–3]. Глины являются хорошими адсорбентами из-за существования разнообразных типов активных центров на их поверхности, среди которых Ван Ольфен [4] различал следующие:
1 – кислотные центры Бренстеда или доноры протонов, созданные взаимодействием адсорбированных или межслоевых молекул воды;
2 – кислотные центры Льюиса или акцепторы электронов, возникающие из-за дегидроксилирования;
3 – окислительные центры, образующиеся из-за присутствия некоторых катионов в октаэдрических позициях или из-за адсорбированного кислорода на поверхности;
4 – восстановительные центры, образующиеся из-за присутствия некоторых катионов;
5 – поверхностные гидроксильные группы, в основном находящиеся на краях, связанные с Si, Al или другими октаэдрическими катионами. Краевые гидроксильные группы активны для различных типов взаимодействий.
Преимущества глин как адсорбентов также обусловлены тем, что это материалы естественного происхождения, широко распространенные, обычно нетоксичные, их легко добывать, и они относительно недороги. Например, в настоящее время ежегодно добывают >16 млн т бентонитовых глин и 44 млн т каолиновых [5]. Цена глин составляет 0.005–0.46 $/кг, при этом цена монтмориллонита – ≈0.04–0.12 $/кг, что в 20 раз дешевле активированного угля [6, 7].
Сорбционные свойства глин на протяжении длительного времени активно используют для иммобилизации различных загрязнителей в почвах, очистки природных и сточных вод, в промышленности. Природный монтмориллонит используют для поглощения различных загрязняющих веществ катионной природы, особенно тяжелых металлов и красителей [8]. Адсорбционная способность зависит от типа минерала и различается от металла к металлу [9]. Для смектитов ряд поглощения одновалентных катионов выглядит следующим образом: Cs+ > Rb+ > K+ > Na+ > > Li+, для двухвалентных: Ba2+ > Sr2+ > Ca2+ > > Mg2+ [10]. Глины оказались эффективными материалами для дезактивации одежды, техники, строительных материалов при ликвидации последствий аварии на Чернобыльской АЭС [11]. Для этих целей применяли бентонит и палыгорскит в виде водных паст (12–15%) и суспензий (2–7%). Природные глины и цеолиты обладают высокой эффективностью в поглощении Cs+ из радиоактивных отходов [12].
Поскольку глинистые минералы в целом заряжены отрицательно, способность поглощать анионные вещества у них невелика и составляет <5 смоль/кг для смектитов [13] и ≤2 смоль/кг для каолинитов [14]. Анионный обмен обычно происходит на краях алюмосиликатных слоев и зависит от pH среды [14].
Отрицательный заряд поверхности глин обусловливает их высокое химическое сродство также к органическим катионам. Бентонит использовали для предотвращения загрязнения речных вод пестицидами паракватом и дикватом [15]. Churchman [8] показал, что некоторые бентониты могут удалять разнообразные белки из отходов скотобоен, которые в противном случае могли бы вызвать эвтрофикацию природных водных экосистем. Широко используют бентонитовые глины для удаления белков из вина во время его производства [16]. В работе [17] выяснили, что мелкозернистые морские отложения, содержащие каолинит и монтмориллонит, способны адсорбировать сильнодействующий токсин микроцистин–LR, вырабатываемый пресноводными сине-зелеными водорослями.
Несмотря на то, что поверхность глинистых минералов гидрофильна, ее значительная площадь и объем мелких пор позволяют глинам адсорбировать неионогенные вещества, например, масла и жиры [18]. Было показано, что вирусы [19], простейшие [20] и бактерии [21] удаляются из воды путем добавления глины, которая действует как адсорбент и флокулянт для микроорганизмов.
МОДИФИКАЦИЯ ГЛИНИСТЫХ МИНЕРАЛОВ
В индустриальных условиях важнейшей задачей экологических исследований является поиск и создание новых сорбционных материалов с высокой эффективностью, обладающих требующейся селективностью поглощения, доступных и недорогих. Глинистые минералы обладают уникальными свойствами, позволяющими отнести их к группе наиболее перспективных материалов для производства таких сорбентов. В качестве модификаторов глинистых минералов могут быть использованы разнообразные неорганические и органические вещества.
Модифицирование природных глин различными способами позволяет улучшить пористую структуру глины, а также изменить ее состав и свойства. Идея модификации глинистых минералов неорганическими веществами заключается во введении в структуру набухшей глины полиоксокатионов различных металлов, которые представляют собой большие комплексы (≈1 нМ), состоящие из кластеров атомов кислорода и металлов. Соответствующий заряд способствует катионному обмену и последующему взаимодействию с отрицательно заряженным алюмосиликатным слоем. В результате возникают трехмерные галереи, способные предотвратить коллапс межслойного пространства при дегидратации. После прокаливания образуют прочные столбы (колонны, пиллары) оксидов, разделяющие плоскости силикатов. Колонны препятствуют сближению слоев, образуя устойчивую двухмерную микропористую структуру, где межслоевое расстояние увеличено по сравнению с исходным материалом (от 0.3 до 2.0 нм). Таким образом, величину пор между слоями можно изменять путем варьирования размера катиона, его формы и концентрации [22]. Используя данный подход, получают полусинтетические микропористые сорбенты на основе слоистых силикатов с расширяющейся структурной ячейкой и основных солей алюминия, титана, хрома, ванадия и других металлов – так называемые пиллар-глины. Среди большого количества глин для интеркалирования наиболее часто используют минералы группы смектита, тем не менее, другие слоистые силикаты могут быть использованы для получения пиллар-глин [3].
Впервые пиллар-глины были получены Д. Бриндли и Р. Семпельс в 1977 г. частичным замещением катионов обменного Na+ катионами гидроксиалюминия в межслоевом пространстве минерала группы смектита бейделлита. Прокаливание образцов привело к образованию интеркалированной глины с удельной площадью поверхности до 500 м2/г и увеличенным межпакетным расстоянием [4].
Способность глинистых минералов к модификации органическими веществами обусловлена тем, что их внешняя и внутренняя поверхность гидрофильная и полярная. Это облегчает смачивание и проникновение в межплоскостное пространство как низко-, так и высокомолекулярных органических веществ, главным образом, катионной природы, но также и других молекул, содержащих разнообразные полярные группы. Среди таких соединений – ацетон и его производные, метилметакрилат, аминокислоты, белки и другие соединения с гидроксильными и аминогруппами. Так же эффективно осуществляется интеркаляция минералов веществами, в состав которых входят сложноэфирные группы за счет их специфического взаимодействия с катионами и гидроксильными группами на поверхности силикатных пластин [22].
Идея использования интеркаляции для преобразования глинистого минерала в пористый аналог возникла в середине 1950-х гг. Barrer and MacLeod изучали адсорбцию монтмориллонитом и интеркалирование минерала различными газами и парами [24], а в статье 1955 г. описали, что замена обменных неорганических катионов в монтмориллоните катионами N(CH3)$_{4}^{ + }$ и N(C2H5)$_{4}^{ + }$ увеличивает межслоевое расстояние и вызывает глубокие изменения в сорбции органических молекул. В работе была также продемонстрирована сорбционная селективность на основе молекулярных диаметров поперечного сечения адсорбатов [25]. Несмотря на перспективность использования молекулярных просеивающих свойств алкиламмонийных форм смектитовых глин, в связи с практически одновременным открытием синтетических цеолитов, интерес к модифицированным смектитам был вновь проявлен только через 20 лет. Синтетические цеолиты как неорганические молекулярные сита имели площадь поверхности и объем пор, сравнимые с интеркалированными глинами, но были гораздо более термически стабильными по сравнению с алкиламмониевыми формами смектитовых глин.
ОПРЕДЕЛЕНИЕ ОРГАНОГЛИН И ФАКТОРЫ, ВЛИЯЮЩИЕ НА ИХ СВОЙСТВА
Модификация глинистых минералов неорганическими и органическими веществами, при которой упорядоченные слои алюмосиликатов продолжают располагаться параллельно друг другу, разделенные колоннами из оксидов переходных металлов или органическими молекулами определенного типа, ведет к образованию интеркалированных нанокомпозитов [26]. При интеркалировании слоистых силикатов органическими веществами, которое не приводит к их эксфолиированию, речь идет о получении органоглин. Органоглины – это модифицированные адсорбцией молекул органического поверхностно-активного вещества и/или иного органического вещества глинистые минералы (филлосиликаты, реже – ленточные минералы), сохраняющие структуру исходного минерала [27, 28]. Ряд исследователей называет адсорбирующими органоглинами органически-модифицированные смектиты, синтезированные путем замены неорганических противоионов короткоцепочечными компактными катионными соединениями, такими как тетраметиламмоний, тетраэтиламмоний и триметилфениламмоний [27, 29]. Органически модифицированные минералы, полученные интеркалированием длинноцепочечных ионов алкиламмония ([H3N]R+) или четвертичного аммония ([CH3]3NR+), где R представляет собой алкильную цепь (например, гексадецил) относят к органофильным органоглинам [29]. При замене исходных межслоевых катионов на органические катионы образуется поверхность, состоящая из химически связанных органических фрагментов. При этом может сохраняться как гидрофильный характер поверхности, так и формироваться гидрофобная или амфифильная поверхность, что значительно расширяет спектр потенциальных сорбатов. В последние годы использованию органоглин для иммобилизации различных загрязнителей в почвах и грунтах, очистке природных и сточных вод уделяется большое внимание [3, 27, 30].
В данной статье обобщены известные литературные данные по использованию органоглин на основе различных филлосиликатов для актуализации интереса к ним среди исследователей и возможного более интенсивного применения этих экологичных и эффективных сорбентов в практике сельского хозяйства и охраны природы.
Основными свойствами, определяющими адсорбционную эффективность органоглин, являются: наличие или отсутствие дефектов кристаллической решетки, катионный состав межпакетных плоскостей и емкость катионного обмена минерала, на основе которого она была синтезирована, а также свойства интеркалируемого органического вещества (молекулярная масса, длина и разветвленность углеродной цепи и наличие функциональных групп в молекуле) и его количество.
Если в исходном минерале имеются дефекты кристаллической решетки, такие как изгибы и разрывы октаэдрических и тетраэдрических слоев, микросбросы, образование выпуклых и вогнутых поверхностей, то нарушается плотная упаковка и соответственно, с одной стороны, это может отрицательно влиять на качество органоглин, изменяя однородность распределения слоев органического вещества [31]. С другой стороны, плоские дефекты кристаллических структур, точечные и линейные дефекты кристаллов (дислокации) во многом определяют способность исходных глинистых минералов к адсорбции ионов. Lagaly [32] указывает, что неоднородность заряда является характерным свойством 2 : 1 глинистых минералов, в частности, смектита. Он отмечает, что плотность заряда может изменяться от слоя к слою или внутри отдельных слоев, и заряды, по-видимому, более равномерно распределены в центре глинистых частиц по сравнению с краевыми участками [33]. Дефекты структуры минералов и, соответственно, неоднородность распределения зарядов ведут к локальной агрегации органических веществ на этих участках и способствуют набуханию и эксфолиированию минералов при нагрузке большими количествами интеркалируемого вещества.
Величина и распределение заряда являются характеристикой природного минерала. Например, среди трехслойных слоистых силикатов вермикулит имеет более высокий заряд на своей поверхности по сравнению со смектитом и показывает более однородное и регулярное расширение при обработке органическими катионами [33].
Различные замещения катионов в слоях пакета трехслойных филлосиликатов вызывают постоянный структурный заряд около базальной плоскости. Даже идеальная структура пирофиллита без какого-либо постоянного структурного заряда сохраняет электрическое поле вблизи базальной плоскости [34].
Наиболее заметными ионами, обнаруженными на поверхности глины, являются Ca2+, Mg2+, H+, Na+, K+, NH$_{4}^{ + }$, Li+, SO$_{4}^{{2 - }}$, Cl−, PO$_{4}^{{3 - }}$ и NO$_{3}^{ - }$. Эти ионы могут относительно легко обмениваться с другими ионами, не влияя на структуру глинистого минерала [2]. Присутствие катионов в межпакетном пространстве не компенсирует отрицательный заряд кристаллической решетки минерала полностью, поскольку отрицательный потенциал октаэдрических слоев в значительной степени экранируется наружными тетраэдрическими слоями. Таким образом, базальные поверхности смектитов заряжены отрицательно. Помимо обменных ионов, в межслоевом пространстве всегда присутствуют молекулы связанной воды [31].
Катионный состав смектитов различен в зависимости от месторождения минерала. Образование Na- и Ca-монтмориллонитов определяется палеогеографическими условиями седиментации. В талассогенных бассейнах с солеными и рассольными водами Na–Cl состава на глинистых частицах закрепляются натрий и калий, а в континентальных пресноводных водах на них осаждаются щелочноземельные элементы – кальций и магний [35]. Двухвалентные катионы обеспечивают более сильное притяжение между пакетами по сравнению с одновалентными, в связи с чем бентонит с преобладанием в составе обменных катионов кальция (кальциевый бентонит) хуже диспергируется и обладает низкой степенью набухания (увеличивает объем в 8 раз) в отличие от натриевого бентонита (набухает в 15 раз). При этом межпакетное расстояние составляет от 1–5 нм (для Ca-монтмориллонита) до 15–20 нм (для Nа-монтмориллонита) [35]. Заряд иона также влияет на кинетику ионного обмена. Как правило, скорость обмена снижается с увеличением заряда обменивающихся катионов [36].
При образовании органоглин в зависимости от свойств минерала и интеркалируемого вещества могут быть задействованы электростатические и ион-дипольные взаимодействия, водородные связи и силы Ван-дер-Ваальса [27]. Заряд базальной поверхности пакета отвечает за набухание и сорбцию ионов по катионообменному механизму. Напротив, рН-зависимое поглощение катионов контролируется реакциями протонирования/депротонирования на краевых участках слоев.
Ориентация интеркалированных органических молекул с короткими алкильными цепями в основном определяется электростатическими взаимодействиями их полярных групп со слоями силиката, тогда как соединения с более длинной цепью взаимодействуют с поверхностью минерала при помощи Ван-дер-Ваальсовых сил. Удерживание адсорбированных молекул зависит от поляризующей способности межслоевых катионов. Многовалентные катионы с их сильным электростатическим полем удерживают большее количество органических соединений, чем ионы щелочных металлов и аммония [37]. Мягкость или жесткость обменных катионов, расположенных в межпакетном пространстве, определяет тип координационного связывания алифатических и ароматических аминов. Мягкие катионы, такие как Zn2+, Cd2+, Cu2+ и Ag+ и другие напрямую связывают амины, в то время как между аминами и жесткими катионами (ионами щелочных и щелочноземельных металлов) образуются водные мостики [38]. Например, пиридин напрямую координируется с ионами меди, но связан водными мостиками с межслоевыми катионами магния и кальция [39].
На эффективность адсорбции органоглинами влияет и наличие сопутствующих ионов. Например, в присутствии электролита (NaCl) как неионные (суммарно нейтральные), так и катионные органоглины демонстрируют снижение своей эффективности в поглощении ряда фармпрепаратов (за исключением катионных), в то время как в водной среде поглощение идет успешно [40].
Химическое сродство между органическим соединением и минеральной поверхностью зависит от структуры (молекулярной массы, длины цепи и т.п.) органической молекулы, функциональных групп и фрагментов, присутствующих в органической молекуле, таких как гидрофобные группы (–C–C–C–C–), положительно заряженные группы (–NH$_{3}^{ + }$), отрицательно заряженные группы (–COO–, фенолят, –SO$_{3}^{ - }$), электроотрицательные группы, (–C=O, –C–O–C–, –OH), π‑связи (–C–C–, ароматические кольца), конфигурации присутствующей органической молекулы, наличия и свойств водной фазы [41].
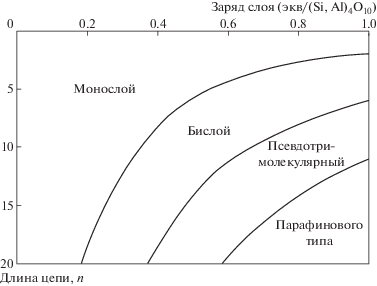
Органические вещества, имеющие одну алифатическую цепь или плоское строение молекулы, формируют в межпакетном пространстве один или два слоя, параллельные поверхности минерала [22]. Примером могут служить плоско лежащие интеркалированные жирные кислоты [42]. Стабильная монослойная структура получается при концентрации катиона алкиламмония, близкой к емкости катионного обмена минерала, когда площадь катиона меньше площади, приходящейся на один обменный сайт [43]. При увеличении концентрации органического вещества [30] или в случае, когда площадь, занимаемая органическим катионом, превышает площадь обменного сайта [43], возможно двухслойное и трехслойное расположение алифатических цепей. На длину алифатической цепи, при которой происходит переход от монослоя к бислою, влияет также величина и равномерность распределения заряда силикатной поверхности. Если филлосиликат имеет однородный заряд, то переход происходит резко и характеризуется одинаковой длиной цепи. Однако обычно заряд между слоями изменяется, так что переходы происходят при разном количестве атомов углерода в цепи – от 6 до 13 [30, 33, 43].
Длинноцепочечные ионы алкиламмония и четвертичного аммония могут иметь псевдотрехслойное расположение, где положительные поверхностно-активные группы присоединены к силикатным слоям, в то время как алкильные цепи принимают тримолекулярное расположение с перегибами. В случае смектитов и вермикулитов с высоким зарядом межслоевые органические катионы могут принимать расположение парафинового типа под определенным углом к поверхности минерала [30, 44]. Также этому способствует наличие нескольких длинных алифатических цепей в молекуле [43]. Интеркаляция длинноцепочечных катионов алкиламмония облегчает проникновение других мономеров (и полимеров) в межслоевое пространство [43].
Ряд линейных неионных полимеров может проникать в межслоевое пространство только когда глинистый минерал диспергирован в водных или органических растворителях полимеров. Некоторые типы макромолекул, имеющих техническое значение, интеркалируются из водных растворов. Многие полимеры интеркалируются в более вытянутой и плоской конформациях и находятся в прочном контакте с одним или двумя слоями силиката. Разворачивание полилизина и полиглутаминовой кислоты во время интеркаляции в монтмориллонит описано Gougeon et al. [45]. Причиной предпочтения цепочек перед петлями является Ван-дер-Ваальсово взаимодействие между сегментами полимера и поверхностными атомами кислорода. В отличие от адсорбции полимера на внешней поверхности, в межслойной адсорбции активнее участвуют молекулы с меньшей молекулярной массой [43]. Общая зависимость пространственного расположения органических молекул в ходе интеркаляции от заряда минерала и длины углеродной цепи показаны на рис. 1 [46].
Рис 1.
Влияние заряда слоя и длины алкильной цепи на расположение алкиламмониевых ионов в межпакетном пространстве [46].
КЛАССИФИКАЦИЯ ОРГАНОГЛИН НА ОСНОВЕ СПОСОБНОСТИ К РАСШИРЕНИЮ СТРУКТУРЫ ИСПОЛЬЗОВАННОГО МИНЕРАЛА И ЕГО ЗАРЯДА
Поскольку сорбционные свойства органоглин в значительной степени определяются видом и свойствами филлосиликатов, использованных для их синтеза, то классификация органоглин может строиться на глинистом минерале, лежащем в ее основе.
Основная классификация глинистых филлосиликатов построена на соотношении кремнекислородных тетраэдров и алюмогидроксильных октаэдров в их пакетах и силе связи между ними, определяемой слоевым зарядом. Две эти структурные особенности филлосиликатов в значительной степени определяют удельную площадь поверхности минералов и емкость катионного обмена. Кроме того, интерес представляет заряд структурных ячеек минералов. По данным признакам различают следующие группы слоистых силикатов (табл. 1) [47].
Таблица 1.
Классификация глинистых минералов на основе соотношения кремнекислородных тетраэдров и алюмогидроксильных октаэдров и заряда поверхности слоя [47]
| Структура минерала | Заряд слоя | Группа | Подгруппа | Примеры минералов |
|---|---|---|---|---|
| 1 : 1 | 0 | Каолинит–серпентин | Каолинит | Каолинит, диккит, накрит |
| Серпентин | Хризотил, лизардит, амезит | |||
| 2 : 1 | 0 | Тальк–пирофиллит | Тальк | Тальк |
| Пирофиллит | Пирофиллит | |||
| 0.2–0.6 | Смектит | Монтмолиллонит | Монтмориллонит, бейделлит, нонтронит | |
| Сапонит | Сапонит, лапонит, гекторит | |||
| 0.6–0.9 | Вермикулит | Диоктаэдрический | Диоктаэдрический вермикулит | |
| Триоктаэдрический | Триоктаэдрический вермикулит | |||
| 1 | Слюда | Диоктаэдрический | Мусковит, иллит, глауконит, парагонит | |
| Триоктаэдрический | Флогопит, биотит, лепидолит | |||
| 2 | Хрупкая слюда | Диоктаэдрический | Маргарит | |
| Триоктаэдрический | Клинтонит, анандит | |||
| 2 : 1 : 1 | Вариабельный | Хлорит | Диоктаэдрический | Донбассит |
| Триоктаэдрический | Клинохлор, шамозит, нимит | |||
| Ди, триоктаэдрический | Кукеит, сюдоит | |||
| Ленточные силикаты | 0.1 | Палыгорскит–сепиолит | Диоктаэдрический | Непуит |
| Палыгорскит | Палыгорскит | |||
| Сепиолит | Сепиолит |
Следует отметить, что 70% всех глин месторождений имеют сложный состав, состоящий одновременно из нескольких филлосиликатов с преобладанием одного или нескольких минералов [48].
Органоглины на основе двухслойных минералов. Из-за неспособности к набуханию минералов группы каолинита их использование в качестве матрицы для синтеза органоглин ограничено. Диапазон катионообменной способности каолинита составляет от 1 до 10 мг-экв/100 г при небольшой площади удельной поверхности (7–30 м2/г) [49]. Среди глинистых минералов группы 1 : 1 только минералы подгруппы каолинита взаимодействуют с различными органическими молекулами, серпентины неактивны [30]. Прививаемые вещества можно отнести к 3-м группам: 1 – вещества, формирующие водородные связи (гидразин, мочевина, формамид), 2 – вещества с высоким дипольным моментом (диметилсульфоксид, пиридин-N-оксид), 3 – калиевые, рубидиевые, цезиевые и аммониевые соли короткоцепочечных жирных кислот (ацетаты, пропионаты, бутираты и изовалераты). Механизм их взаимодействия с каолинитом не ясен [30]. Тем не менее, широкая распространенность и дешевизна каолинитовых глин являются причиной их использования для синтеза органоглин. Синтез органоглин происходит с помощью мягких химических обработок, в частности, путем присоединения в ходе плавления алкиламмониевых ионных жидкостей. Соли алкиламмония с короткой алкильной цепью прививаются непосредственно в ходе плавления при 180°C в атмосфере азота, когда происходит замещение in situ диметилсульфоксида (ДМСО), предварительно присоединенного к каолиниту. Для более длинных алкильных цепей прививку проводят в 2 этапа. На первом этапе соответствующий аминоспирт присоединяется к каолиниту путем вытеснения ДМСО. Второй этап заключается в кватернизации привитого материала путем реакции с йодметаном или йодэтаном [50]. Модифицированный метоксигруппой каолинит был использован в качестве носителя для поглощения гербицида 3-амино-1,2,4-триазола, известного как амитрол. Метокси-модификацию каолинита проводили путем добавления метанола к каолиниту, предварительно обработанному ДМСО. Поглощение амитрола органоглиной в 2 раза превосходило его поглощение каолинитом [51].
В другом минерале подгруппы каолинита – галлуазите водородные связи между соседними пакетами слабее, и он способен к межпакетному поглощению веществ. Для него также характерно образование трубчатых агрегатов, вызванное несоразмерностью октаэдрического и тетраэдрического слоев.
Образец органоглины, полученный путем ковалентного связывания галлуазита с гиперретикулированной циклодекстриновой сеткой, был исследован в качестве потенциального носителя для полифенольных соединений [52]. Органоглину на основе галлуазита использовали для адсорбции анионных загрязнителей из сточных вод [53]. Исследована адсорбция фенола, 2-,3-,4-хлорфенола, 2-,4-дихлорфенола и 2-,4-,6-трихлорфенола на галлуазитных нанотрубках, модифицированных гексадецилтриметиламмонийбромидом [54]. Theng [43] отмечает перспективность использования для синтеза глино-полимерных комплексов галлуазита, частицы которого могут иметь плоскую, сфероидальную или мелкую трубчатую (решетчатую) морфологию.
Органоглины на основе трехслойных минералов. Тальк и пирофиллит относятся к слюдоподобным минералам, которые имеют слоистое строение кристаллической решетки, что обусловливает их свойство расщепляться на тонкие листочки. Степень упругости этих листочков для разных минералов не одинакова, что связано с их химическим составом, находящим свое отражение в деталях строения кристаллических решеток. Заряды внутри сеток в структуре талька и пирофиллита почти полностью компенсированы, поэтому их пакеты связаны между собой очень слабыми остаточными Ван-дер-Ваальсовыми силами. Этим объясняются очень низкая твердость талька и пирофиллита, их необычайно легкая расщепляемость на эластичные пластинки и отсутствие упругости в последних. Вследствие данных свойств эти минералы практически не используют для синтеза органоглин. Тем не менее, имеются данные о взаимодействиях филлосиликатов этой группы с различными органическими веществами. Так была исследована адсорбция тальком 2-х модельных ароматических углеводородов – бензола и толуола – из воды. И бензол, и толуол дали линейные изотермы. Наклон изотермы для толуола был круче, чем для бензола, что указывало на то, что толуол имеет большее сродство к тальку [55]. Реологические свойства суспензии пирофиллит–вода различны в присутствии 3-х поверхностно-активных веществ анионной, катионной и неионной природы. Вязкость сильно зависит от типов поверхностно-активного вещества, адсорбированного на поверхности глины, и поверхностного потенциала после адсорбции. Величина базального рефлекса d001 пирофиллитовой глины не изменялась после адсорбции поверхностно-активных веществ, что указывало на то, что они не интеркалируются в межпакетное пространство [56]. Примером использования пирофиллитовой глины является исследование, в котором поверхность минерала была модифицирована путем обработки 3-(2-аминоэтиламино) пропил-метилдиметоксисиланом для последующего поглощения ионов Pb2+ из водных растворов. По данным авторов, модифицированный пирофиллит адсорбировал примерно 93% ионов Pb2+ при исходной концентрации элемента 20 мг/л, тогда как природный пирофиллит при тех же условиях адсорбировал только 35% металла [57].
Глинистые минералы группы смектита (монтмориллонит, бентонит, бейделлит, нонтронит, соконит, сапонит), отличающиеся незначительной силой ионной связи между пакетами, сильно диспергируются и обладают свойством внутрикристаллического набухания. Все минералы монтмориллонитовой группы имеют низкую величину заряда (0.2–0.6 ед. на элементарную ячейку) за счет невысокой степени изоморфного замещения ионов в тетраэдрических или октаэдрических позициях, что приводит к слабому электростатическому взаимодействию между отрицательно заряженными пакетами и межпакетными катионами. Внешняя удельная поверхность смектитовых глин достигает 40–70 м2/г, общая удельная поверхность – 450–850 м2/г [58, 59], пористость – ≈0.006–0.010 см3/г [60]. Емкость катионного обмена, определенная общепринятыми методами, для смектитов из разных месторождений составляет 65–135 ммоль-экв/100 г [61].
Трехслойные филлосиликаты с расширяющейся структурной ячейкой (группа смектита) являются основными минералами для синтеза органоглин, причем монтмориллонит, сапонит и гекторит являются наиболее часто используемыми для этого филлосиликатами [43, 62].
Органоглины на основе бентонита используют как адсорбенты нефти и нефтепродуктов [63, 64], фенола и его производных [65, 66], бензойной кислоты и гидрохинона [67], нафталина и фенантрена [68, 69], пестицидов симазина [70], метилпаратиона и тетрахлорвинфоса [71], атразина, бутахлора, карбендазима, карбофурана, имидаклоприда, изопротурона, пендиметалина, метил тиофаната и тиаметоксама [72], фармацевтических препаратов амоксициллина, норфлоксацина, сульфаметоксазола, метопролола, карбамазепина и триметоприма [73], диклофенака [74, 75], промышленных красителей [76].
Вермикулиты имеют более высокий заряд, чем минералы группы монтмориллонита (табл. 1) и также относятся к набухающим минералам. Однако они не обладают способностью к неограниченному набуханию и количество воды в межпакетном пространстве ограничено 4-мя молекулами на элементарную ячейку. Величина емкости катионного обмена вермикулитов в 1.5–2.0 раза больше таковой монтмориллонитов, а площадь удельной поверхности может достигать 800 м2/г [77]. Вермикулиты обладают высокой селективностью поглощения и способностью к необратимому поглощению в межпакетных пространствах крупных, слабо гидратированных катионов [78].
Сравнение сорбционных свойств органоглин на основе вермикулита и монтмориллонита, модифицированных поверхностно-активным веществом Гемини (дихлоридом 2,2'-бис (додецилдиметиламмонио)-этилового эфира) по отношению к конго красному показало, что при установлении равновесия адсорбция достигает 298 и 154 мг/кг соответственно. Адсорбционная способность этих органоглин зависела от их гидрофобности. Термодинамические параметры показали, что процессы поглощенного красителя изученными органоглинами были эндотермическими и самопроизвольными [79]. Органо-вермикулиты, модифицированные гексадецилтриметиламмонием и бензилдиметилгексадециламмонием при концентрациях поверхностно-активных веществ, равных 0.5, 1.0 и 2.0 катионообменной емкости, были использованы для поглощения анионных форм As(III) и As(V). Увеличение концентрации ПАВ сопровождалось изменением морфологии зерен минерала, частичной гидрофобизацией поверхности, ухудшением текстурных параметров и увеличением межслоевого пространства. Было замечено, что изученные органоглины адсорбировали As(V) в большей степени по сравнению с As(III). Наибольшее поглощение солей мышьяка происходило при максимальном количестве модификаторов [80].
Адсорбционные свойства монтмориллонита и вермикулита, модифицированных гексадецилпиридинием, гексадецилтриметиламмонием и бензэтонием, по отношению к Cr(VI) были исследованы при pH 3.0–9.0 [81]. Структура межслоевого пространства у органо-вермикулитов была парафиновой, а у органо-монтмориллонитов – псевдотримолекулярной. В результате обработки органическими катионами поверхностный заряд глин изменился с отрицательного на положительный; на него сильно влияли удельная поверхность, заряд слоя и величина pH. В зависимости от вида органического катиона органо-вермикулиты и органо-бентониты показали сопоставимую адсорбционную способность по отношению к Cr(VI). Для всех органоглин адсорбированное количество Cr(VI) уменьшалось с увеличением pH. Влияние конкурирующих анионов Cl–, NO$_{3}^{ - }$ и SO$_{4}^{{2 - }}$ на адсорбцию Cr(VI) оказалось небольшим. Для органо-вермикулитов бóльшая часть центров адсорбции анионов располагалась в межслоевом пространстве.
Возможность интеркалирования у слюд и, в меньшей степени, у гидрослюд ограничена из-за высокого заряда (1 – у слюд, 0.8 – у гидрослюд), локализованного в тетраэдрическом слое, т.е. в непосредственной близости от межпакетного катиона, который определяет прочное электростатическое взаимодействие пакетов и препятствует значительному расширению межпакетного пространства. Экспериментальная емкость катионного обмена этих минералов находится в диапазоне 20–50 ммоль-экв/100 г минерала [36, 82]. Заряд хрупких слюд (клинтонитов) еще более высокий, и они имеют более выраженный основной характер. При замене двухвалентных межслойных катионов емкость катионного обмена у клинтонитов будет в 2 раза больше, чем у настоящей слюды, однако такая замена практически невозможна из-за очень прочной электростатической связи [83]. Кинетика катионного обмена в слюдах является медленной, поскольку в данных минералах широко представлены частично разрушенные участки межслоевого пространства (особенно в выветренных формах), через которые катионы диффундируют с трудом [36]. Наличие данных участков (клиновидных зон) и их расположение влияют на селективность катионного обмена. Крупные гидратированные неорганические катионы, такие как Ca2+ и Mg2+, и органические катионы не могут попасть в эти зоны, особенно если они располагаются не на краю межпакетного пространства, а внутри [36].
При интеркалировании мусковита солями аммония было отмечено, что изменения объема элементарной ячейки минерала пренебрежимо малы при обмене межслоевого K+ на ион NH$_{4}^{ + }$, в то же время наблюдали их расширение на 4% при обмене K+ на метиламмоний CH3NH$_{3}^{ + }$ [84].
В связи с трудностью прямого интеркалирования слюд были предложены более сложные методы их модификации. Ранее различные группы исследователей [85, 86] использовали Li и катионы щелочноземельных металлов (Ba, Ca и Mg) для первой стадии ионообменной обработки мусковита с целью изменения его структуры. Однако эффективный метод для облегчения последующей интеркаляции органическими веществами был предложен только в 2005 г. Zhao et al. [87]. Он предполагает обработку мусковита расплавленным нитратом лития при 350°C в течение 12 ч. При этом удельная поверхность мусковита увеличилась с 3.5 до 170 м2/г. Реакция с нитратами некоторых других щелочных металлов не приводила к заметному увеличению удельной поверхности.
Weng-Lip et al. [88] провели интеркалирование мусковита катионами бромида цетилтриметиламмония с помощью двухступенчатого метода, который включал вначале сплавление минерала с нитратом лития при 300°C, а на втором этапе – взаимодействие с раствором органического вещества в автоклаве при 180°C. Методом инфракрасной спектроскопии с преобразованием Фурье было показано, что катионы цетилтриметиламмония диффундируют в прослойки алюмосиликата и образуют прочную электростатическую связь с поверхностью глины. Кроме того, интеркалированные цепи органического катиона равномерно распределены и образуют парафиноподобные структуры в мусковитовой глине.
Гидрослюды отличаются от слюд бóльшим содержанием легко удаляющейся связанной воды и меньшим содержанием катионов, образующих связи между слоями. Поэтому органоглины на их основе распространены более широко. Было изучено поглощение неионных органических соединений (бензола, толуола, этилбензола, пропилбензола, бутилбензола, трет-бутилбензола, нафталина и бифенила) органоглинами на основе ряда филлосиликатов, в том числе иллита, интеркалированного гексадецилтриметиламмонием [89]. В работе [90] исследовали сорбцию пестицида параквата иллитом, бентонитом и сепиолитом, а также органоглинами на их основе. Для иллита отмечены наибольшие показатели максимальной адсорбции параквата среди рассматриваемых минералов. Однако при его модификации хлоридом нониламмония максимальная адсорбция парквата увеличилась не более чем на 10%, а при модификация хлоридом додециламмония – даже уменьшилась. Рассмотрена сорбция иллитом, модифицированным гексадецилтриметиламмонием, 1,2-дихлорбензола, 1,3-дихлорбензола и 1,4-дихлорбензола [91]. Глауконит, модифицированный стеариновой кислотой, использовали как адсорбент для поглощения нефти и нефтепродуктов [92].
Возможность использования четырехслойных минералов для синтеза органоглин. Хлориты относятся к четырехслойным слоистым силикатам и обозначаются индексом 2 : 1 : 1. В их кристаллической решетке трехслойные пакеты 2 : 1 чередуются с еще одним добавочным октаэдрическим слоем, состав которого всегда отличается от состава основного октаэдрического слоя. Благодаря присутствию добавочного октаэдрического слоя между трехслойными пакетами, невыветрелые минералы группы хлоритов не имеют химически активной внутренней поверхности и не способны к межпакетной сорбции вещества. Хлориты имеют низкие величины ЕКО. Удельная поверхность их также невелика и имеет показатели 26–45 м2/г [93].
Информация о синтезе органоглин из хлоритов практически отсутствует. Однако косвенные данные свидетельствуют о том, что данный процесс потенциально возможен. Исследовали адсорбцию растворимых внутриклеточных компонентов 4-х видов фитопланктона Phaeocystis globosa, Gymnodinium sanguineum, Scrippsiella trochoidea и Ditylum brightwellii на 3-х минералах: монтмориллоните, каолините и хлорите, при этом хлорит показал высокую сорбционную эффективность [94]. Хлорит и иллит эффективно адсорбировали макролидный антибиотик азитромицин и хинолоновый антибиотик левофлоксацин [95]. Катионное ПАВ – бромид цетилтриметиламмония было использовано для успешного синтеза органофильного материала на основе образца глины, состоящего из смектита (26%), хлорита (20%), иллита (17%) и каолинита (14%) [96].
Органоглины на основе ленточных силикатов. В основе строения кристаллической решетки минералов группы палыгорскита и сепиолита лежат вытянутые трехслойные структуры, в которых между 2-мя лентами тетраэдров, обращенных вершинами навстречу друг другу, находится лента октаэдров. Сепиолит отличается от палыгорскита несколько большей шириной лент. Отдельные ленты соединяются друг с другом также через общие вершины рядов тетраэдров, занимающих в лентах краевые позиции. При этом в структуре образуются полосы-каналы, вытянутые параллельно лентам, и формируется внутренняя поверхность [93]. Емкости катионного обмена сепиолита – 20–30 ммоль-экв/100 г [97], а волокнистая структура глины не набухает при добавлении воды или органических растворителей. Палыгорскит и сепиолит представляют собой длинные волокна длиной в несколько микрометров и шириной 10–30 нм с каналами, идущими параллельно длине волокна [43]. Недавно была опубликована краткая обзорная работа по сепиолит-органическим нанокомпозитам [97].
Органоглина на основе австралийского палыгорскита, модифицированного катионными ПАВ – октадецилтриметиламмонийбромидом и диоктадецилдиметиламмонийбромидом в различных дозах, была использована для адсорбции гербицида из группы синтетических ауксинов – 2,4-дихлорфеноксиуксусной кислоты. Молекулы поверхностно-активного вещества прикреплялись к поверхности стержневидных кристаллов минерала и, таким образом, ослабляли взаимодействия между монокристаллами [98]. Органоглины на основе смектита и аттапульгита были использованы для связывания эндотоксинов и показали высокую эффективность в водном растворе [99]. Палыгорскит, модифицированный четвертичной аммониевой солью, использовали для удаления масла из эмульсий [100].
ДРУГИЕ ВОЗМОЖНЫЕ КЛАССИФИКАЦИИ ОРГАНОГЛИН
Ряд исследователей [27] выделяет группы органоглин на основе заряда использованных для модификации органических веществ (катионной, цвиттер-ионной и неионной природы). Предполагается, что интеркалирование катионных поверхностно-активных веществ посредством ионного обмена с неорганическими катионами внутри межслоевого пространства ведет к изменению заряда поверхностей минерала с отрицательного на положительный и изменению их гидрофильных свойств на гидрофобные. В зависимости от длины алкильных цепей катионных ПАВ органоглины можно разделить на 2 основные группы. Для ПАВ с короткой алкильной цепью интеркаляция ограничивается одним слоем и количеством, близким к емкости катионного обмена, увеличивая межслоевое пространство до ограниченной величины. При этом изотерма адсорбции удовлетворительно описывается уравнением Ленгмюра [101]. Это т.н. адсорбирующие органоглины, которые демонстрируют хорошо локализованные специфические участки адсорбции с введением органических катионов. Для ПАВ с длинной алкильной цепью адсорбция может превышать величину ЕКО, когда дополнительные органические катионы могут интеркалироваться за счет гидрофобного взаимодействия между алкильными цепями [27]. Цвиттерионные поверхностно-активные вещества (такие как 3-(N,N-диметилдодециламмонио)пропансульфонат) во всех диапазонах pH демонстрируют как положительно (алкиламмониевые фрагменты), так и отрицательно (сульфонатные фрагменты) заряженные группы. При концентрациях меньше ЕКО минерала эти ПАВ интеркалируются посредством ионного обмена как катионы и, вероятно, за счет ион-дипольного взаимодействия. При концентрациях, превышающих ЕКО, агрегаты ПАВ самоорганизуются за счет гидрофобного (между алкильными цепями) и электростатического (между противоположно заряженными функциональными группами) взаимодействий, расширяя межслоевое пространство на большое расстояние [102, 103]. Многие неионные поверхностно-активные вещества (не обладающие зарядом во всем диапазоне рН) обладают такими свойствами как хорошая биоразлагаемость, термическая и химическая стабильность, а также низкая токсичность или, по крайней мере, гораздо меньшая по сравнению с катионными аналогами [104]. Среди органических модификаторов неионной природы можно отметить полиоксиэтилен, полиэтиленгликоль, ряд полиоксиэтиленалкиловых эфиров и других подобных амфифильных соединений. Их взаимодействия с глинами определяют, по-видимому, главным образом ион-дипольные взаимодействия. При этом при адсорбции подобных соединений в структуре глинистого минерала сохраняются неорганические обменные катионы, что расширяет область использования синтезированных гидрофильно-гидрофобных органоглин [104]. Более логичным является описание гидрофильно-гидрофобных свойств и характера заряда не модификаторов, а самих органоглин. В связи с этим можно выделить гидрофильные и гидрофобные органоглины, а среди первых – катионные, анионные и цвиттер-ионные органоглины.
В качестве модификаторов в структуру органоглин могут быть включены как синтетические, так и природные органические соединения. В работе [105] показаны наиболее часто используемые для синтеза органоглин органические вещества и их структура. В качестве природных модификаторов были использованы аминокислоты (например, аргинин, лизин) [106], витамины (тиамин) [107], хитозан [108, 109], гумусовые вещества [110, 111].
ЗАКЛЮЧЕНИЕ
Таким образом, органоглины на основе различных глинистых минералов и органических модификаторов являются перспективными сорбентами для широкого спектра химических загрязнителей окружающей среды. Знание особенностей химических и физико-химических взаимодействий между глинистым минералом и органическим веществом, влияния свойств исходных компонентов на свойства конечного адсорбента, оптимальных условий синтеза позволяет получить органоглины с заданными свойствами. Сырьем для получения органоглин могут служить не только слоистые силикаты группы смектита, но и слоистые минералы других групп и ленточные минералы.
Список литературы
Churchman G.J., Gates W.P., Theng B.K.G., Yuan G. Chapter 11.1. Clays and clay minerals for pollution control // Handbook of Clay Science. Amsterdam: Elsevier, 2013. P. 625–675.
Srinivasan R. Advances in application of natural clay and its composites in removal of biological, organic, and inorganic contaminants from drinking water // Adv. Material. Sci. Engin. 2011. V. 2011. Art. ID 872531. 17 p.
Sarkar B., Rusmin R., Ugochukwu U.C., Mukhopadhyay R., Manjaiah K.M. Modified clay minerals for environmental applications // Modified clay and zeolite nanocomposite materials: environmental and pharmaceutical applications / Eds. Mercurio M., Sarkar B., Langella A. Elsevier, 2019. P. 113–127.
Van Olphen H. An introduction to clay colloid chemistry. 2nd ed. N.Y., London, Sydney, Toronto: John Wiley & Sons, 1977. 318 p.
United States Geological Survey. National Minerals Information Center. Clays Statistics and Information. Annual Publications. Mineral Commodity Summaries. 2021. https://pubs.usgs.gov/periodicals/mcs2021/mcs2021-clays.pdf
Bailey S.E., Olin T.J., Bricka R.M., Adrian D.D. A review of potentially low-cost sorbents for heavy metals // Water Res. 1999. V. 33. № 11. P. 2469–2479.
Babel S., Kurniawan T.A. Low-cost adsorbents for heavy metals uptake from contaminated water: a review // J. Hazard. Mater. 2003. V. 97. № 1–3. P. 219–243.
Churchman G.J. The role of clays in the restoration of perturbed ecosystems // Soil mineral-organic matter-microorganism interactions and ecosystem health. Development in soil science 28A / Eds. Violante A., Huang P.M., Bollag J.-M., Gianfreda L. Amsterdam: Elsevier, 2002. P. 333–350.
Переломов Л.В., Чилачава К.Б., Швыкин А.Ю., Атрощенко Ю.М. Влияние органических веществ гумуса на поглощение тяжелых металлов глинистыми минералами // Агрохимия. 2017. № 2. С. 99–107.
Ugochukwu U.C. Characteristics of clay minerals relevant to bioremediation of environmental contaminated systems // Modified clay and zeolite nanocomposite materials. Elsevier, 2019. P. 219–242.
Кретинин А.А. Оптимизация параметров экранирующего слоя в приповерхностных хранилищах радиоактивных отходов: Дис. … канд. техн. наук. М.: МГГУ, 2004. 129 с.
Yıldız B., Erten H.N., Kış M. The sorption behavior of Cs+ ion on clay minerals and zeolite in radioactive waste management: sorption kinetics and thermodynamics // J. Radioanalyt. Nucl. Chem. 2011. V. 288(2). P. 475–483.
Borchardt G. Smectites // Minerals in soil environments. 2nd ed. / Eds. Dixon J.B., Weed S.B. SSSA Book Series. № I. 1989. P. 675–727.
Dixon J.B. Kaolin and serpentine group minerals // Taм жe. P. 467–525.
Stansfield R.A. The diquat incident at Woodkirk, Yorkshire // Europ. Water Sewage. 1986. V. 90. P. 450–451.
Pocock K.F., Salazar F.N., Waters E.J. The effect of bentonite fining at different stages of white winemaking on protein stability // Austral. J. Grape Wine Res. 2011. V. 17 (2). P. 280–284.
Morris R.J., Williams D.E., Luu H.A., Holmes C.F.B., Andersen R.J., Calvert S.E. The adsorption of mycrocystin-LR by natural clay particles // Toxicon. 2000. V. 38. P. 303–308.
Dehmani Y., Ed-Dra A., Zennouhi O., Bouymajane A., Rhazi Filali F., Nassiri L., Abouarnadasse S. Chemical characterization and adsorption of oil mill wastewater on Moroccan clay in order to be used in the agricultural field // Heliyon. 2020. V. 6 (1). e03164.
Syngouna V.I., Chrysikopoulos C.V. Interaction between viruses and clays in static and dynamic batch systems // Environ. Sci. Technol. 2010. V. 44(12). P. 4539–4544.
Bradford S.A., Morales V.L., Zhang W., Harvey R.W., Packman A.I., Mohanram A., Welty C. Transport and fate of microbial pathogens in agricultural settings // Critic. Rev. Environ. Sci. Technol. 2013. V. 43(8). P. 775–893.
Fomina M., Skorochod I. Microbial interaction with clay minerals and its environmental and biotechnological implications // Minerals. 2020. V. 10(10). P. 861.
Герасин В.А., Антипов Е.М., Карбушев В.В. Куличихин В.Г., Карпачева Г.П., Тальрозе Р.В., Кудрявцев Я.В. Новые подходы к созданию гибридных полимерных нанокомпозитов: от конструкционных материалов к высокотехнологичным применениям // Усп. химии. 2013. Т. 82. № 4. С. 303–332.
Brindley G., Sempels R. Preparation and properties of some hydroxy-aluminium beidellites // Clay Minerals. 1977. V. 12 (3). P. 229–237.
Barrer R.M., MacLeod D. M. Intercalation and sorption by montmorillonite // Transact. Faraday Soc. 1954. V. 50. P. 980–989
Barrer R.M., MacLeod D.M. Activation of montmorillonite by ion exchange and sorption complexes of tetra-alkyl ammonium montmorillonites // Transact. Faraday Soc. 1955. V. 51. P. 1290–1300.
Bardziński P.J. On the impact of intermolecular interactions between the quaternary ammonium ions on interlayer spacing of quat-intercalated montmorillonite: A molecular mechanics and ab-initio study // Appl. Clay Sci. 2014. V. 95. P. 323–339.
Guégan R. Organoclay applications and limits in the environment // Comptes Rendus Chimie. 2018. V. 22 (2–3). P. 132–141.
Mukhopadhyay R., Bhaduri D., Sarkar B., Rusmin R., Hou D., Khanam R., … Ok Y.S. Clay-polymer nanocomposites: Progress and challenges for use in sustainable water treatment // J. Hazard. Mater. 2020. V. 383. № 121125.
Brixie J.M., Boyd S.A. Treatment of contaminated soils with organoclays to reduce leachable pentachlorophenol // J. Environ. Qual. 1994. V. 23(6). P. 1283–1290.
Lagaly G., Ogawa M., Dékány I. Clay mineral-organic interactions // Handbook of clay science. Developments in clay science. V. 5 / Eds. Bergaya F., Lagaly G. Elsevier, 2013. P. 435–505.
Наседкин В.В., Демиденок К.В., Боева Н.М., Белоусов П.Е., Васильев А.Л. Органоглины. Производство и основные направления использования // Актуал. инновац. исслед-я: наука и практика. 2012. № 3. 19 с.
Lagaly G. Layer charge determination by alkylammonium ions // Clay minerals society workshop lectures. V. 6. Layer charge characteristics of 2 : 1 silicate clay minerals / Ed. Mermut A.R. Boulder: The Clay Minerals Society, Colorado, 1994. P. 1–46.
Lee S.Y., Kim S.J. Expansion characteristics of organoclay as a precursor to nanocomposites // Colloids and surfaces A: Physicochemical and engineering aspects. 2002. V. 211 (1). P. 19–26.
Churakov S.V. Ab initio study of edge sites reactivity on pyrophyllite // Inter. Meet. “Clays in Natural & Engineered Barriers for Radioactive Waste Confinement”. France, Tours, 2005. P. 219–220.
Попов В.Г., Абдрахманов Р.Ф. Ионообменная концепция в генетической гидрогеохимии. Уфа: Гилем, Башкир. энциклопедия, 2013. 356 с.
Sparks D.L. Environmental soil chemistry. Elsevier, 2003. 352 p.
Brindley G.W. Ethylene glycol and glycerol complexes of smectites and vermiculites // Clay Miner. 1966. V. 6. P. 237–259.
Cloos P., Laura R.D., Badot C. Adsorption of ethylene diamine on montmorillonite saturated with different cations-V: ammonium- and triethylammonium-montmorillonite: ion exchange, protonation and hydrogen-bonding // Clays Clay Miner. 1975. V. 23. P. 417–423.
Farmer V.C., Mortland M.M. An infrared study of the coordination of pyridine and water to exchangeable cations in montmorillonite and saponite // J. Chem. Soc. A. 1966. P. 344–351.
Guégan R., De Oliveira T., Le Gleuher J., Sugahara Y. Tuning down the environmental interests of organoclays for emerging pollutants: Pharmaceuticals in presence of electrolytes // Chemosphere. 2019. V. 239. № 124730.
Kowalska M., Güler H., Cocke D.L. Interactions of clay minerals with organic pollutants // Sci. Total Environ. 1994. V. 141 (1–3) P. 223–240.
Brindley G.W., Moll W.F. Complexes of natural and synthetic Ca-montmorillonites with fatty acids // Amer. Mineral. 1965. V. 50. P. 1355–1370.
Theng B.K.G. Polymer-clay nanocomposites // Developments in clay science. V. 4 / Ed. Theng B.K.G. Elsevier, 2012. P. 201–241.
He H., Ma Y., Zhu J., Yuan P., Qing Y. Organoclays prepared from montmorillonites with different cation exchange capacity and surfactant configuration // Appl. Clay Sci. 2010. V. 48. P. 67–72.
Gougeon R.D., Soulard M., Reinholdt M., Miehe-Brendle J., Chezeau J.M., Le Dred R., Marchal R., Jeandet P. Polypeptide adsorption on a synthetic montmorillonite: a combined solid-state NMR spectroscopy, X-ray diffraction, thermal analysis and N2 adsorption study // Eur. J. Inorg. Chem. 2003. P. 1366–1372.
Lagaly G. Interaction of alkylamines with different types of layered compounds // Solid State Ion. 1986. V. 22. P. 43–51.
Wang A., Wang W. Introduction // Nanomaterials from clay minerals. 1st ed. A new approach to green functional materials / Eds. Wang A., Wang W. Elsevier, 2019. P. 1–20.
Rahromostaqim M., Sahimi M. Molecular dynamics study of the effect of layer charge and interlayer cations on swelling of mixed-layer chlorite-montmorillonite clays // J. Phys. Chem. C. 2020. V. 124. № 4. P. 2553–2561.
Kumar A., Lingfa P. Sodium bentonite and kaolin clays: Comparative study on their FT-IR, XRF, and XRD // Materials Today: Proceedings. 2020. V. 22. P. 737–732.
Letaief S., Detellier C. Functionalization of the interlayer surfaces of kaolinite by alkylammonium groups from ionic liquids // Clays Clay Miner. 2009. V. 57. P. 638–648.
Tan D., Yuan P., Annabi-Bergaya F. Methoxy-modified kaolinite as a novel carrier for high-capacity loading and controlled-release of the herbicide amitrole // Sci. Rep. 2015. V. 5. № 8870.
Massaro M., Riela S. Organo-clay nanomaterials based on halloysite and cyclodextrin as carriers for polyphenolic compounds // J. Funct. Biomater. 2018. V. 9 (4). 61 p.
Xi Y., Mallavarapu M., Naidu R. Preparation, characterization of surfactants modified clay minerals and nitrate adsorption // Appl. Clay Sci. 2010. P. 92–96.
Słomkiewicz P., Szczepanik B., Czaplicka M. Adsorption of phenol and chlorophenols by HDTMA modified halloysite nanotubes // Materials. 2020. V. 13 (15). № 3309.
Hashizume H. Adsorption of aromatic compounds in water by talc // Clay Sci. 2009. V. 14. P. 61–64.
Desai H., Biswal N.R., Paria S. Rheological behavior of pyrophyllite-water slurry in the presence of anionic, cationic, and nonionic surfactants // Industr. Engin. Chem. Res. 2010. V. 49 (11). P. 5400–5406.
Erdemoğlu M., Erdemoǧlu S., Sayilkan F., Akarsu M., Şener Ş., Sayılkan H. Organo-functional modified pyrophyllite: preparation, characterisation and Pb(II) ion adsorption property // Appl. Clay Sci. 2004. V. 27. P. 41–52.
Осипов В.И., Соколов В.H., Румянцева Н.А. Микроструктура глинистых пород / Под ред. Сергеева Е.М. M.: Недра, 1989. 211 с.
Покидько Б.В., Буканова Е.Ф., Туторский И.А., Ильина М.Б. Влияние ионов кальция на адсорбцию ионных и неионных ПАВ на бентоните // Вестн. МИТХТ. 2009. Т. 4. № 1. С. 77–83.
Fetter G., Bosch P. Microwave effect on clay pillaring // Pillared Clays and Related Catalysts / Eds. Gil A., Korili S.A., Trujillano R., Vicente M.A. N.Y., Dordrecht, Heidelberg, London: Springer, 2010. P. 1–21.
Ammann L., Bergaya F., Lagaly G. Determination of the cation exchange capacity of clays with copper complexes revisited // Clay Minerals. 2005. V. 40. P. 441–453.
Ray S.S. Introduction to environmentally friendly polymer nanocomposites // Environmentally Friendly Polymer Nanocomposites, Types, Processing and Properties. 1st ed. Woodhead Publishing, 2013. P. 3–24.
Mohamed A.I.A., Hussein I.A., Sultan A.S., Al–Muntasheri G.A. Use of organoclay as a stabilizer for water-in-oil emulsions under high-temperature high-salinity conditions // J. Petrol. Sci. Engin. 2018. V. 160. P. 302–312.
Moazed H., Viraraghavan T. Removal of oil from water by bentonite organoclay // Practic. Period.Hazard. Toxic Radioact. Waste Manag. 2005. V. 9(2). P. 130–134.
Nafees M., Waseem A. Organoclays as sorbent material for phenolic compounds: a review // CLEAN – Soil, Air, Water. 2014. V. 42 (11). P. 1500–1508.
Li Z., Yao M., Lin J., Yang B., Zhang X., Lei L. Pentachlorophenol sorption in the cetyltrimethylammonium bromide/bentonite one-step process in single and multiple solute systems // J. Chem. Engin. Data. 2013. V. 58. P. 2610–2615.
Yildiz N., Gonulsen R., Koyuncu H., Calimli A. Adsorption of benzoic acid and hydroquinone by organically modified bentonites // Colloid. Surfac. A: Physicochem. Engin. Aspects. 2005. V. 260. P. 87–94.
Changchaivong S., Khaodhiar S. Adsorption of naphthalene and phenanthrene on dodecylpyridinium-modified bentonite // Appl. Clay Sci. 2009. V. 43. P. 317–321.
Xu L., Zhang M., Zhu L. Adsorption-desorption behavior of naphthalene onto CDMBA modified bentonite: Contribution of the π-π interaction // Appl. Clay Sci. 2014. V. 100. V. 29–34.
Cruz-Guzman M., Cells R., Hermosin M.C., Cornejo J. Adsorption of the herbicide simazine by montmorillonite modified with natural organic cations // Environ. Sci. Technol. 2004. V. 38. P. 180–186.
El-Nahhal Y., Undabeytia T., Polubesova T., Mishael Y.G., Nir S., Rubin B. Organo-clay formulations of pesticides: reduced leaching and photodegradation // Appl. Clay Sci. 2001. V. 18 (5–6). P. 309–326.
Narayanan N., Gajbhiye V.T., Gupta S., Manjaiah K.M. Novel biopolymer-nano-organoclay composites for the decontamination of pesticides from water // Pestic. Res. J. 2016. V. 28. P. 25–34.
Guégan R., De Oliveira T., Le Gleuher J., Sugahara Y. Tuning down the environmental interests of organoclays for emerging pollutants: Pharmaceuticals in presence of electrolytes // Chemosphere. 2019. V. 239. 124730. 10 p.
De Oliveira T., Guégan R., Thiebault T., Milbeau C.L, Muller F., Teixeira V., Giovanela M., Boussafir M. Adsorption of diclofenac onto organoclays: Effects of surfactant and environmental (pH and temperature) conditions // J. Hazard. Mater. 2017. V. 323(Pt A). P. 558–566.
França D.B., Trigueiro P., Silva Filho E.C., Fonseca M.G., Jaber M. Monitoring diclofenac adsorption by organophilic alkylpyridinium bentonites // Chemosphere. 2020. V. 242. № 125109.
Huang P., Kazlauciunas A., Menzel R., Lin L. Determining the mechanism and efficiency of industrial dye adsorption through facile structural control of organo-montmorillonite adsorbents // ACS Appl. Mater. Interfac. 2017. V. 9 (31). P. 26383–26391.
Huggett J.M. Clay minerals. Reference module in Earth systems and environmental sciences. Elsevier, 2015. https://doi.org/10.1016/B978-0-12-409548-9.09519-1
Трофимов С.Я., Соколова Т.А., Дронова Т.Я., Толпешта И.И. Минеральные компоненты почв. Тула: Гриф и К, 2007. 104 с.
Ding F., Gao M., Shen T., Zeng H., Xiang Y. Comparative study of organo-vermiculite, organo-montmorillonite and organo-silica nanosheets functionalized by an ether–spacer–containing Gemini surfactant: Congo red adsorption and wettability // Chem. Engin. J. 2018. V. 349. P. 388–396.
Tuchowska M., Wołowiec M., Solińska A., Kościelniak A., Bajda T. Organo-modified vermiculite: preparation, characterization, and sorption of arsenic compounds // Minerals. 2019. V. 9 (8). № 483.
Dultz S., An J.-H., Riebe B. Organic cation exchanged montmorillonite and vermiculite as adsorbents for Cr(VI): Effect of layer charge on adsorption properties // Appl. Clay Sci. 2012. V. 67–68. P. 125–133.
Osman M.A., Suter U.W. Determination of the cation-exchange capacity of muscovite mica // J. Colloid Interface Sci. 2000. V. 224 (1). P. 112–115.
Ravella R. Swelling mica-type clays of variable charge: synthesis, characterization and ion exchange studies. A PhD Thesis in soil science. The Pennsylvania State University, 2006. 163 p.
Yu C.J., Choe S.H., Jang Y.M., Jang G.H., Pae Y.H. First-principles study of organically modified muscovite mica with ammonium (NH4+) or methylammonium (CH3NH3+) ion // J. Mater. Sci. 2016. V. 51. P. 10806–10818.
Bracke G., Satir M., Krauss P. The Cryptand [222] for exchanging cations of micas // Clays Clay Miner. 1995. V. 43. P. 732–737.
Shimizu K., Hasegawa K., Nakamuro Y., Kodama T., Komarneni S. Alkaline earth cation exchange with novel Na-3-mica: kinetics and thermodynamic selectivities // J. Mater. Chem. 2004. V. 14 (6). P. 1031–1035.
Zhao L.Y., Wang X.K., Wu N.Z. et al. Cleaving of muscovite powder by molten lithium nitrate // Colloid. Polym. Sci. 2005. V. 283. P. 699–702.
Weng-Lip L., Salleh N.M., Rahman N.A. Enhanced intercalation of organo-muscovite prepared via hydrothermal reaction at low temperature // Bull. Mater. Sci. 2019. V. 42. № 242. 11 p.
Jaynes W.F., Boyd S.A. Clay mineral type and organic compound sorption by hexadecyltrimethylammonium-exchanged clays // Soil Sci. Soc. Amer. J. 1991. V. 55 (1). P. 43–48.
Seki Y., Yurdakoç K. Paraquat adsorption onto clays and organoclays from aqueous solution // J. Colloid Interface Science 2005. V. 287 (1). P. 1–5.
Sheng G., Boyd S.A. Polarity effect on dichlorobenzene sorption by hexadecyltrimethylammonium-exchanged clays // Clays Clay Miner. 2000. V. 48. P. 43–50.
Peregudov Y.S., Mejri R., Gorbunova E.M., Niftaliev S.I. Glauconite-based sorbents for skimming oil and oil products // Kondensirovannye Sredy I Mezhfaznye Granitsy (Condensed Matter and Interphases). 2020. V. 22 (2). P. 257–265.
Скрябина О.А. Минералогический состав почв и почвообразующих пород. Пермь: Пермская ГСХА, 2010. 120 с.
Satterberg J., Arnarson T.S., Lessard E.J., Keil R.G. Sorption of organic matter from four phytoplankton species to montmorillonite, chlorite and kaolinite in seawater // Marine Chem. 2003. V. 81 (1–2). P. 11–18.
Hanamoto S., Ogawa F. Predicting the sorption of azithromycin and levofloxacin to sediments from mineral and organic components // Environ. Pollut. 2019. V. 255. № 113180.
Acikyildiz M., Gurses A., Yolcu H.H. Synthesis of super hydrophobic clay by solution intercalation method from aqueous dispersions // Proceed. of the 4th Inter. Congr. APMAS2014, 2014, Fethiye, Turkey. Acta Phys. Polonica A. 2015. V. 127. №. 4. P. 1156–1160.
Zaini N.A.M., Ismail H., Rusli A. Short review on sepiolite-filled polymer nanocomposites // Polymer-Plastic. Technol. Engin. 2017. V. 56 (15). P. 1665–1679.
Xi Y., Mallavarapu M., Naidu R. Adsorption of the herbicide 2,4-D on organo-palygorskite // Appl. Clay Sci. 2010. V. 49 (3). P. 255–261.
Schaumberger S., Ladinig A., Reisinger N., Ritzmann M., Schatzmayr G. Evaluation of the endotoxin binding efficiency of clay minerals using the Limulus amebocyte lysate test: an in vitro study // AMB Express. 2014. V. 4 (1). № 1. 9 p.
Silva V.C., Batista T.S., Ramos I.B.M., Barros T.R.B., de Sousa B.V. Organophilization process and characterization of palygorskite clay (attapulgite) // Mater. Sci. Forum. 2016. V. 881. P. 218–223.
Alther G. Using organoclays to enhance carbon filtration // Waste Manag. 2002. V. 22 (5). P. 507–513.
Zhu R., Zhao J., Ge F., Zhu L., Zhu J., Tao Q., He H. Restricting layer collapse enhances the adsorption capacity of reduced-charge organoclays // Appl. Clay Sci. 2014. V. 88–89. P. 73–77.
Zhu J., Qing Y., Wang T., Zhu R., Wei J., Tao Q., He H. Preparation and characterization of zwitterionic surfactant-modified montmorillonites // J. Colloid Interface Sci. 2011. V. 360 (2). P. 386–392.
Guégan R., Veron E., Le Forestier L., Ogawa M., Cadars S. Structure and dynamics of nonionic surfactant aggregates in layered materials // Langmuir. 2017. V. 33 (38). P. 9759–9771.
Zhu R., Zhou Q., Zhu J., Xi Y., He H. Organo-clays as sorbents of hydrophobic organic contaminants: sorptive characteristics and approaches to enhancing sorption capacity // Clays Clay Miner. 2015. V. 63 (3). P. 199–221.
Shokri E., Yegani R., Pourabbas B., Ghofrani B. Evaluation of modified montmorillonite with di-cationic surfactants as efficient and environmentally friendly adsorbents for arsenic removal from contaminated water // Water Sci. Technol. Water Supply. 2018. V. 18 (2). P. 460–472.
Ben Moshe S., Rytwo G. Thiamine-based organoclay for phenol removal from water // Appl. Clay Sci. 2018. V. 155. P. 50–56.
El-Dib F.I., Tawfik F.M., Eshaq G., Hefni H.H.H., ElMetwally A.E. Remediation of distilleries wastewater using chitosan immobilized bentonite and bentonite based organoclays // Inter. J. Biol. Macromolecul. 2016. V. 86. P. 750–755.
Kahraman H.T. Development of an adsorbent via chitosan nano-organoclay assembly to remove hexavalent chromium from wastewater // Inter. J. Biol. Macromolecul. 2017. V. 94. P. 202–209.
Osman M.A., Kishk F.M., Moussa A.A. Gaber H.M. Sorption and desorption of atrazine on natural bentonite and organically modified bentonite // Alexandria Sci. Exchange J. 2017. V. 38. P. 271–283.
Jemeljanova M., Ozola R., Klavins M. Physical-chemical properties and possible applications of clay minerals and humic acid composite materials // Agron. Res. 2019. V. 17 (S1). P. 1023–1032.
Дополнительные материалы отсутствуют.


