Агрохимия, 2021, № 8, стр. 62-69
Разработка новых методов синтеза компонентов феромона золотистой двухпятнистой совки Chrysodeixis Chalcites Esper
Е. В. Синицына 1, *, В. Э. Глебов 1, Н. З. Федосеев 1, Н. И. Кулакова 1
1 Всероссийский центр карантина растений – ВНИИКР
140150 п. Быково, Московская обл., ул. Пограничная, 32, Россия
* E-mail: katesinitsyna@gmail.com
Поступила в редакцию 25.01.2021
После доработки 24.03.2021
Принята к публикации 11.05.2021
Аннотация
Разработан феромонный препарат для выявления и мониторинга золотистой двухпятнистой совки Chrysodeixis chalcites – ограниченно распространенного на территории Российской Федерации карантинного вредителя ряда экономически важных сельскохозяйственных культур. В ходе первого этапа исследования в 2020 г. была разработана новая методика синтеза ряда компонентов феромона золотистой двухпятнистой совки. Новые схемы синтеза предусматривали использование для получения ацетатов моноеновых спиртов в качестве ключевых стадий реакции алкилирования α-бром-Ω-хлоралканами соответствующих литиевых производных в жидком аммиаке, что позволило сократить количество стадий синтеза и избежать необходимости хроматографической очистки полученных промежуточных соединений. Таким способом, был осуществлен синтез ацетата Z7-додецен-1-ола (Z7–12Ac) и ацетата Z9-тетрадецен-1-ола (Z9–14Ac). Разработанная схема синтеза ацетата Z11-гексадецен-1-ола (Z11–16Ac) методом алкилирования тетрагидропиранового эфира 10-бромдекан-1-ола литиевым производным 1-гексина в жидком аммиаке позволила достичь высокой 99%-ной стереоизомерной чистоты продукта. Метод получения ацетата Z-9-додецен-1-ола (Z9–12Ac), при котором в качестве ключевой стадии использовали алкилирование литиевого производного тетрагидропиранилового эфира 9-децин-1-ола бромэтаном в жидком аммиаке, позволил избежать работы с опасным газообразным бутином-1. В ходе первичных биоиспытаний была подтверждена аттрактивность 4-х вариантов синтетической феромонной смеси. Роль каждого из компонентов предстоит выяснить в ходе дальнейших экспериментов.
ВВЕДЕНИЕ
Совки рода Chrysodeixis (Lepidoptera: Noctuidae) широко известны как опасные карантинные вредители многих полевых и овощных культур, а также декоративных растений [1, 2]. Несмотря на то, что виды данного рода обитают преимущественно в странах тропического и субтропического пояса, вредоносные временные популяции часто образуются в летний период в гораздо более северных регионах [3–8]. В странах умеренного климата совки рода Chrysodeixis наиболее опасны в теплицах, где они могут развиваться без диапаузы, т.е. непрерывно в течение сезона [9–12]. В частности, от гусениц золотистой двухпятнистой совки Chrysodeixis chalcites (Esper, 1789) часто страдают растения томата, перца, огурца, гороха, салата, укропа, гвоздики, хризантемы, герберы, амариллиса [12–18]. Многие из перечисленных культур являются экономически важными и их традиционно выращивают в южных регионах европейской части России в открытом и закрытом грунте. Повреждения, наносимые гусеницами в процессе питания, приводят к уменьшению урожая, снижению его качества и росту производственной стоимости растительной продукции [19]. Золотистая двухпятнистая совка Chrysodeixis chalcites представляет серьезную экономическую опасность для агропромышленного комплекса РФ и входит в Перечень ограниченно распространенных карантинных объектов ЕАЭС [20].
Одной из основных задач национальных организаций по карантину и защите растений является установление фитосанитарного состояния территории страны. Фитосанитарный мониторинг территории Российской Федерации по выявлению золотистой двухпятнистой совки ни разу не проводили. Создание синтетического феромонного препарата для проведения такого мониторинга является актуальной задачей.
Основными преимуществами феромонных ловушек является их строгая видоспецифичность, высокая чувствительность, длительность работы и дальность действия. Синтетический половой феромон насекомого, нанесенный на специфический диспенсер, может обеспечить эффективную работу ловушки на протяжении от 1‑го до 3-х мес. При этом имаго вредителя могут быть выявлены на подконтрольной территории, начиная с самых ранних стадий внедрения, при столь низкой численности, при которой выявление визуальным методом практически невозможно.
В литературе самыми распространенными методами синтеза известных компонентов феромона Chrysodeixis chalcites – ацетатов Z7-додецен-1-ола (Z7–12Ac) (I), Z9-тетрадецен-1-ола (Z9–14Ac) (II), Z11-гексадецен-1-ола (Z11–16Ac) (III) и Z9-додецен-1-ола (Z9–12Ac) (IV) – являются синтезы на основе ацетиленовых соединений, в которых используются реакции алкилирования терминальных ацетиленовых групп функционально замещенными галогенидами [21–27]. Стереоселективное превращение тройной связи в Z‑двойную связь достигается либо гидроборированием алкинов стерически затрудненными боранами [28], либо каталитическим гидрированием над палладиевыми катализаторами [25, 29] или над коллоидальным никелевым катализатором [21–27, 30]. Кроме этих методов существуют способы синтеза соединений I–IV с использованием реакции Виттига, в которых Z-двойная связь образуется в результате реакции алкилидентрифенилфосфоранов с карбонильными соединениями [30, 31]. При использовании уже известных способов синтеза ацетиленовых соединений возникает необходимость защиты гидроксильной группы, чаще всего для этого используют тетрагидропиранильную защиту, которая очень неустойчива при высоких температурах и в кислых условиях. При этом в схеме синтеза добавляются 2 дополнительные стадии (постановки и снятия защиты). В случае замены гидроксильной группы на хлор таких неудобств не возникает. При использовании реакции Виттига продукт получается с примесью транс-изомера, избавиться от которого весьма затруднительно, также при этом приходится работать с неустойчивыми альдегидами. По нашему мнению, описанные схемы синтеза могут быть усовершенствованы. Данная работа посвящена поиску новых методов синтеза, позволяющих получать компоненты феромона золотистой двухпятнистой совки из недорогих и более доступных реагентов с хорошим качеством и выходом веществ.
МЕТОДИКА ИССЛЕДОВАНИЯ
Все стадии синтеза выполняли в химической лаборатории, оборудованной в соответствии с действующими требованиями техники безопасности, предъявляемыми к работе с пожаро- и взрывоопасными, ядовитыми и сильнодействующими веществами. Работы проводили в вытяжном шкафу, с применением средств индивидуальной защиты. Для регистрации ИК-спектров использовали спектрометр Nicolet IR 200 (в пленке). Газохроматографический анализ проводили на хроматографе Agilent 7890A c пламенно-ионизационным детектором. Использовали колонку НР-5, L = 30 м, внутренний диаметр 0.25 мм, газ-носитель – азот. Масс-спектры были записаны на хроматографе 7890А с масс-спектрометрической приставкой Agilent 5975C при ионизирующем напряжении 70 eV. Использовали колонку DB–17MS, L = 30 м, внутренний диаметр 0.25 мм, газ-носитель – гелий.
Все синтезы с участием веществ, чувствительных к влаге и кислороду воздуха, проводили в атмосфере аргона. Растворители (эфир, ацетонитрил, бензол, тетрагидрофуран, пиридин, пентан, дихлорметан, толуол, диметилсульфоксид) перед использованием перегоняли; эфир, бензол и тетрагидрофуран были дополнительно перегнаны над натрием металлическим, а дихлорметан абсолютирован над окисью фосфора (V). Сульфат магния и сульфат натрия были прокалены в муфельной печи при 500°С.
ХОД ВЫПОЛНЕНИЯ СИНТЕЗА
Синтез ацетата Z7-додецен-1-ола (I) (Z7–12Ac). Синтез ацетата (I) осуществлен по схеме, изображенной на рис. 1, где в качестве ключевой стадии было использовано алкилирование литиевого производного гексина-1 1-бром-6-хлоргексаном в жидком аммиаке.
Раствор 1,6-гександиола в бензоле интенсивно перемешивали при кипячении с разбавленной (3 : 2) соляной кислотой и получали 6-хлоргексан-1-ол (V), который обрабатывали трибромидом фосфора при температуре –25°С, затем нагревали при 35°С 2 ч и после обработки получали 1-бром-6-хлоргексан (VI).
Альтернативный путь получения 1-бром-6-хлоргексана (VI) заключался в обработке 1,6-гександиола бромистоводородной кислотой, с получением 6-бромгексан-1-ола (VII), хлорируя который тионилхлоридом, получали 1-бром-6-хлоргексан (VI). В жидком аммиаке получали литиевое производное 1-гексина, которое алкилировали 1-бром-6-хлоргексаном (VI) в тетрагидрофуране и после обработки выделяли 1-хлордодец-7-ин (VIII). Раствор 1-хлордодец-7-ина (VIII) в этаноле гидрировали над никель-боридным катализатором в присутствии этилендиамина и получали (Z7)-1-хлордодец-7-ен (IX), нагревание которого в ледяной уксусной кислоте с ацетатом калия приводило к ацетату Z7-додецен-1-ола (I). Общий выход продукта по схеме составил 57%, чистота продукта по ГЖХ – 98.6%.
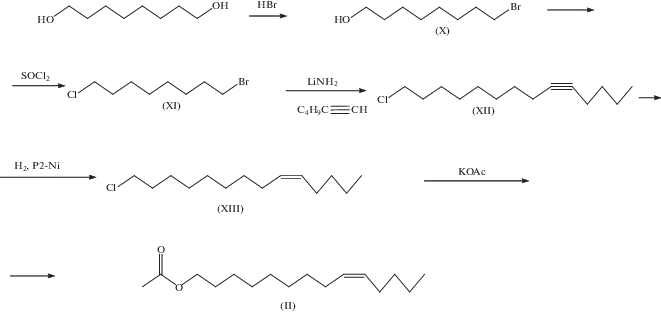
Синтез ацетата Z9-тетрадецен-1-ола (II) (Z9-14Ac). Синтез ацетата (II) осуществлен по схеме, представленной на рис. 2. В качестве ключевой стадии было использовано алкилирование литиевого производного гексина-1 8-хлороктан-1-бромидом в жидком аммиаке.
Раствор 1,8-октандиол в толуоле обрабатывали при кипячении и интенсивном перемешивании 48%-ной бромистоводородной кислотой и получали 8-бромоктан-1-ол (X), который обрабатывали тионилхлоридом при температуре –25°С, затем нагревали при 75°С 2 ч и после обработки получали 8-бромоктан-1-хлорид (XI). В жидком аммиаке получали литиевое производное 1-гексина, которое алкилировали 8-бромоктан-1-хлоридом(XI) в тетрагидрофуране и после обработки выделяли 9-тетрадецин-1-хлорид (XII). Раствор 9-тетрадецин-1-хлорида (XII) в этаноле гидрировали над никель-боридным катализатором в присутствии этилендиамина и получали Z9-тетрадецен-1-хлорид (XIII), нагревание которого в ледяной уксусной кислоте с ацетатом калия приводило к ацетату Z9-тетрадецен-1-ола (II). Общий выход продукта по схеме составил 48%, чистота продукта по ГЖХ – 99.7%.
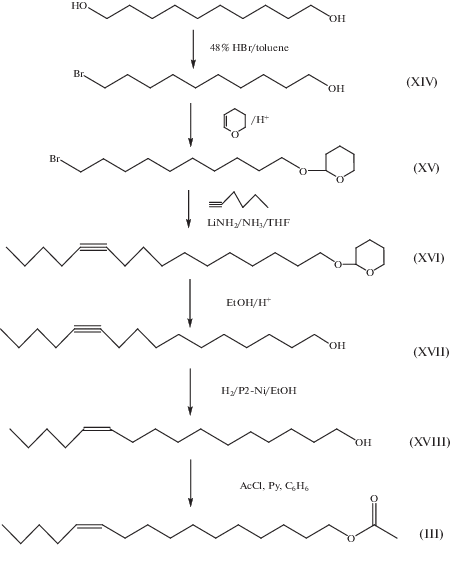
Синтез ацетата Z11-гексадецен-1-ола (III) (Z11-16Ac). Синтез ацетата (III) осуществлен по схеме, представленной на рис. 3, где ключевой стадией являлось алкилирование тетрагидропиранилового эфира 10-бромдекан-1-ола литиевым производным 1-гексина в жидком аммиаке. Раствор 1.10-декандиола в толуоле обрабатывали при кипячении 48%-ным раствором HBr и после обработки получали 10-бромдекан-1-ол (XIV). 10-Бромдекан-1-ол (XIV) обрабатывали 3,4-дигидро-2Н-пираном в кислой среде и получали после обработки и выделения тетрагидропирановый эфир (XV), алкилированием которого литиевым производным 1-гексина в жидком аммиаке получали тетрагидропирановый эфир 11-гексадецин-1-ола (XVI), раствор которого в метаноле обрабатывали п-толуолсульфокислотой и получали 11-гексадецин-1-ол (XVII). Раствор 11-гексадецин-1-ола (XVII) в этаноле гидрировали над никель-боридным катализатором в присутствии этилендиамина и после обработки получали Z11-гексадецен-1-ол (XVIII), обработка раствора которого в бензоле ацетил хлоридом в присутствии пиридина приводила к ацетату Z11-гексадецен-1-ола (III). Общий выход продукта по схеме составил 39%, чистота продукта по ГЖХ – 97.4%, изомерная чистота – 98.8%.
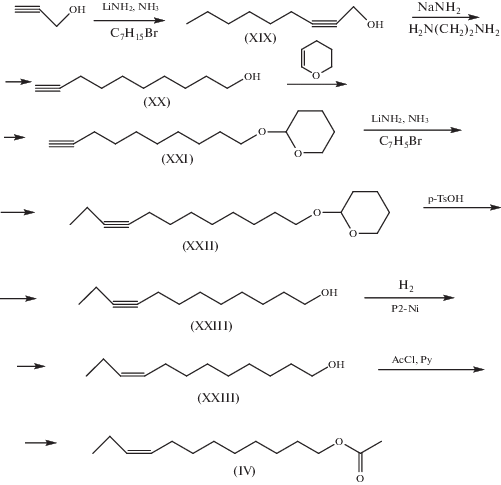
Синтез ацетата Z9-додецен-1-ола (IV) (Z9-12Ac). Синтез ацетата (IV) осуществлен по схеме, представленной на рис. 4, где ключевой стадией являлось алкилирование литиевого производного тетрагидропиранилового эфира 9-децин-1-ола бромэтаном в жидком аммиаке. Пропаргиловый спирт алкилировали в жидком аммиаке 1-бромгептаном до 2-децин-1-ола (XIX), который действием амида натрия в этилендиамине изомеризовался в 9-децин-1-ол (XX). Алкилирование тетрагидропиранильного эфира (XXI) в жидком аммиаке бромэтаном приводило к получению защищенного 9-додецин-1-ола (XXII), последующий гидролиз которого дал 9-додецин-1-ол (XXIII). Гидрированием над никель-боридным катализатором этот ацетиленовый спирт превращали в Z9-додецен-1-ол (XXIV). Ацетилированием раствора спирта (XXI) в бензоле ацетилхлоридом в присутствии пиридина получали ацетат Z9-додецен-1-ола (IV). Общий выход продукта по схеме составил 25%, чистота продукта по ГЖХ – 99%.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В качестве альтернативы описанным в литературе методам синтеза моноеновых спиртов и ацетатов проведен синтез ацетата Z–7-додецен-1-ола (I) (Z7–12Ac) с использованием в качестве ключевой стадии алкилирования литиевого производного гексина-1 1-бром-6-хлоргексаном в жидком аммиаке. По аналогичной схеме проведен синтез ацетата Z–9-тетрадецен-1-ола (II) (Z9-14Ac) с использованием в качестве ключевой стадии алкилирования литиевого производного гексина-1 8-хлороктан-1-бромидом в жидком аммиаке. Новый подход в методике синтеза 2-х вышеописанных компонентов феромона золотистой двухпятнистой совки – с заменой тетрагидропиранильной группы, которая очень неустойчива при высоких температурах и в кислых условиях, позволил сократить количество стадий синтеза (постановки и снятия защиты) и избежать необходимости в трудоемкой хроматографической очистке промежуточных соединений. Метод получения ацетата Z–9-додецен-1-ола (Z9–12Ac), при котором в качестве ключевой стадии использовали алкилирование литиевого производного тетрагидропиранилового эфира 9-децин-1-ола бромэтаном в жидком аммиаке, позволил избежать работы с опасным газообразным бутином-1.
ЗАКЛЮЧЕНИЕ
На основе анализа и оценки имеющихся данных о методах получения синтетического полового феромона золотистой двухпятнистой совки Chrysodeixis chalcites были разработаны и осуществлены новые схемы синтеза его известных компонентов. Разработанный метод предусматривает использование для получения ацетатов моноеновых спиртов в качестве ключевой стадии реакции алкилирования α–бром–Ω–хлоралканами соответствующих литиевых производных в жидком аммиаке.
Замена тетрагидропиранильной группы на хлор-соединение при синтезе ацетата Z7-додецен-1-ола (Z7–12Ac), а также ацетата Z9-тетрадецен-1-ола (Z9–14Ac), позволила сократить количество стадий синтеза (постановки и снятия защиты) и избежать необходимости трудоемкой хроматографической очистки промежуточных соединений.
Разработанный метод синтеза ацетата Z11–гексадецен-1-ола (Z11–16Ac) методом алкилирования тетрагидропиранового эфира 10-бромдекан-1-ола литиевым производным 1-гексина в жидком аммиаке, с получением после снятия защитной группы 16%-ным раствором H2SO4 в этаноле 11-гексадецин-1-ола, позволил достичь высокой 99%-ной стереоизомерной чистоты продукта, что, безусловно, влияло на эффективность феромонного препарата.
При получении ацетата Z–9–додецен-1-ола (Z9–12Ac) в качестве ключевой стадии использовали алкилирование литиевого производного тетрагидропиранилового эфира 9-децин-1-ола бромэтаном в жидком аммиаке, что позволило избежать работы с опасным газообразным бутином-1.
Разработанные схемы позволили упростить и удешевить производство компонентов синтетического феромона для выявления и мониторинга золотистой двухпятнистой совки Chrysodeixis chalcites, сделать феромонный препарат более доступным для широкого применения в практике службами карантина и защиты растений.
Список литературы
CABI. Crop Protection Compendium. Wallingford, UK: CAB International. 2007. www.cabicompendium.org/cpc
Анализ фитосанитарного риска совок Chrysodeixis chalcites (Esper, 1789) и Chrysodeixis eriosoma (Doublday, 1843) для территории Российской Федерации. Всероссийский центр карантина растений (ВНИИКР), 2007. 27 с.
Jor J. Plusia chalcites Esp., found on Funen (Lep., Noctuidae) // Entomol. Meddelels. 1973. V. 41. P. 187–188.
Bretherton R.F. Noctuidae and Agaristidae // The moths and butterflies of Great Britain and Ireland / Eds. Heath J., Maitland E.A. V. 10. Noctuidae (Part 11) and Agaristidae. Colchester, UK: Harley Books, 1983.
Hachler M., Jermini M., Brunetti R. Two new harmful noctuids on tomatoes in glasshouse in South and Western Switzerland // Revue Suisse de Viticulture, d’Arboriculture et d’Horticulture. 1998. V. 30. P. 281–285 (in French).
Palmqvist G. Remarkable records of Macrolepidoptera in Sweden 1997 // Entomol. Tidskrift. 1998. V. 119. P. 13–27.
Palmqvist G. Remarkable records of Macrolepidoptera in Sweden 2001 // Entomol. Tidskrift. 2002. V. 123. P. 53–63.
Murillo H., Hunt D.W.A., Van Laerhoven S.L. First records of Chrysodeixis chalcites (Lepidoptera: Noctuidae: Plusiinae) for east-central Canada // Canad. Entomol. 2013. V. 145. P. 1–5.
Lempke B.J. Interesting observations and catches of Lepidoptera in 1980 // Entomol. Berichten (Amsterdam). 1982. V. 42. P. 116–119.
Vos R. de, Rutten A.L.M. Migrating Lepidoptera in 1992 // Entomol. Berichten. 1995. V. 55. P. 37–46.
van de Veire M. First observations in glasshouse sweet peppers in Belgium and laboratory rearing of the parasitic wasp Eulophus pennicornis (Hym.: Eulophidae) // Entomophaga. 1993. V. 38. P. 61–62.
Van Oers M.M., Herniou E.A., Usmany M., Messelink G.J., Vlak J.M. Identification and characterization of a DNA photolyase-containing baculovirus from Chrysodeixis chalcites // Virology. 2004. V. 330. P. 460–470.
Loginova E. Some new pests of glasshouse crops in Bulgaria and their control by an IPM programme // Bul. OEPP/EPPO Bul. 1992. V. 22. P. 357–361.
Uygun N., Ozgur F. Identification of pests of greenhouse vegetables in the Icel and Adana regions, and the effects of endosulfan smoke tablets and pirimicarb on Myzus persicae (Sulz.) // Turkiye Bitki Koruma Dergisi. 1980. V. 4. P. 185–192.
Harakly F.A., Farag S.S. Biological studies on the tomato looper Chrysodeixis chalcytes (Esper) in Egypt // Bul. Societe Entomol. d’Egypte. 1975. V. 59. P. 295–299.
EPPO. Good plant protection practice, solanaceous crops under protected cultivation // EPPO Bul. 2004. V. 34. P. 65–77.
Avidov Z., Harpaz I. Plant pests of Israel. Jerusalem, Israel: Israel Universities Press, 1969.
Inserra S., Calabretta C. Attack by noctuids: a recurring problem in greenhouse crops of the Ragusa coast // Tecnica Agricola. 1985. V. 37. P. 283–297.
Taylor D.E., Kunjeku E. Development of an economic threshold for semi-loopers (Lepidoptera: Noctuidae) on soya-beans in Zimbabwe // Zimbabwe J. Agric. Res. 1983. V. 21. P. 89–100.
Единый перечень Европейского экономического союза [Электр. ресурс]. Режим доступа: http://www.eurasiancommission.org/ ru/act/texnreg/depsanmer/regulation/Documents/Для%20Сайта%20ЕПКО%20из.%20№%2025,%20№%2074.pdf, свободный.
Holan G., O’Keefe D.F. An improved synthesis of insect sex attractant: cis-8-dodecen-1-ol acetate // Tetrahedron Let. 1973. № 9. P. 673–674.
Schwarz M., Waters R.M. Insect sex attractant; XII. An Efficient procedure for the preparation of unsaturated alcohols and acetates // Synthesis. 1972. P. 567–568.
Одиноков В.Н., Ишмуратов Г.Ю., Балезина Г.Г., Толстиков Г.А. Феромоны насекомых и их аналоги. XIII. Синтез додец-8Е-енил- и додец-8Z-енил-ацетатов – компонентов половых феромонов Grapholitha funebrana и Grapholitha molesta // Химия природ. соед. 1985. № 3. С. 398–400.
Henrick C.A. The synthesis of insect sex pheromones // Tetrahedron. 1977. V. 33. № 15. P. 1845–1889.
Ковалев Б.Г., Матвеева Е.Д., Стан В.В., Вовк Г.А., Юдин Л.Г., Кост А.Н. О синтезе высших ацетиленовых спиртов // ЖОХ. 1980. Т. 16. № 10. С. 2032–2037.
Buchina I.K., Kholbekov O.K., Abduvakhabov A.A. Detection and synthesis of a synergist of the sex pheromone of the cotton bollworm // Chem. Nat. Comp. 1994. № 1. P. 121–123.
Brown H.C., Zweifel G. Hydroboration. XI. The hydroboration of acetylenes – a convenient conversion of internal acetylenes into cis-olefins and of terminal acetylenes into aldehydes // J. Am. Chem. Soc. 1961. V. 83. № 20. P. 3834–3840.
Lindlar H., Dubuis R. Palladium catalyst for partial reduction of acetylenes // Org. Synth. 1966. V. 46. № 1. P. 89–92.
Rossi R. Insect pheromones. 1. Synthesis of achiral components of insect pheromones // Synthesis. 1977. № 12. P. 817–836.
Bestmann H.J., Vostrowsky O. Synthesis of pheromones by stereoselective carbonyl olefination: a unitized construction principle // Chem. Phys. Lipids. 1979. V. 24. № 4. P. 335–389.
Brown C.A., Ahuja V.K. “P-2 Nickel” catalyst with ethylenediamine, a novel system for highly stereospecific reduction of alkynes to cis-olefin // J. Chem. Soc. Chem. Commun. 1973. № 16. P. 553–554.
Дополнительные материалы отсутствуют.