Агрохимия, 2021, № 9, стр. 62-74
Закономерности миграции Cd и Zn в системе дерново-подзолистая почва–почвенный раствор–ячмень при совместном загрязнении
Л. Н. Анисимова 1, *, В. С. Анисимов 1, П. Ю. Волкова 1, Д. В. Крыленкин 1, Р. А. Фригидов 1, А. И. Санжаров 1, Д. В. Дикарев 1, А. В. Саруханов 1, Ю. Н. Корнеев 1
1 Всероссийский научно-исследовательский институт радиологии и агроэкологии
249032 Обнинск, Калужская обл., Киевское шоссе, 109 км, Россия
* E-mail: lanisimovan@list.ru
Поступила в редакцию 23.03.2021
После доработки 07.05.2021
Принята к публикации 12.06.2021
Аннотация
Изучены закономерности (дозовые и временные зависимости) конкурентного взаимодействия тяжелого металла (ТМ) – ксенобиотика (Cd) и микроэлемента (Zn) в системе почва–почвенный раствор–растение. Исследованы в динамике переход ТМ в почвенный раствор, транслокация в различные органы растения, изменение биомассы растений. Установлены параметры уравнений, аппроксимирующих соответствующие процессы. Для всех вариантов опыта отмечено существенное увеличение содержания Zn и Cd в корнях ячменя (в отличие от надземных органов) с возрастом. Выявлено существенное снижение концентрациикадмия в корнях с увеличением количества (дозы) внесенного цинка при неизменной концентрации Cd в надземных органах. Рассчитаны отношения массовых концентраций [Cd] : [Zn] в надземных органах и корнях ячменя, которые резко снижались при дополнительном внесении в почву Zn. Анализ экспрессии генов в корнях растений ячменя на 19-е сут прорастания указывал на возможное снижение производства H2S в клетках растений при воздействии ТМ, снижении транспорта Zn и увеличении концентраций стрессового фитогормона АБК, а также показал возможное снижение аккумуляции Zn и Cd в растениях за счет подавления экспрессии гомолога АТФазы – HMA4.
ВВЕДЕНИЕ
Закономерности миграции в почве и транслокации в различные части растений тяжелых металлов (ТМ) являются теоретическим базисом, на основе которого формируются научно-практические подходы к решению проблемы реабилитации техногенно-загрязненных территорий. Основными аспектами последней являются снижение миграционной способности ТМ в почве и перехода их в природные воды, а также ограничение транслокации в сельскохозяйственные растения. Для системы почвенный раствор–растение изучение закономерностей корневого поглощения ТМ и их транслокации в растения позволяет вскрыть механизмы слежения за этими процессами на разных уровнях организации растительного организма. Интересно изучение закономерностей (дозовых и временных зависимостей) конкурентного взаимодействия ТМ-ксенобиотиков (например, Cd) с микро- и макроэлементами на этапе поглощения из субстрата корнями и последующей транслокации, а также ответных реакций растений как на физиолого-биохимическом уровне (в виде изменения фитотоксичности ТМ-ксенобиотиков), так и на молекулярно-генетическом уровне (изучение экспрессии ряда генов-кандидатов). Доступность растениям (подвижность) ТМ определяется свойствами почвы, изменяя которые можно существенно влиять на их накопление в растительной продукции. К почвенным факторам относятся: гранулометрический состав, содержание органического вещества, реакция среды, емкость катионного обмена, содержание подвижных соединений железа, марганца, алюминия, фосфора и др. [1, 2]. В работе приведены результаты комплексного вегетационного эксперимента. Исследования проводили с растениями ячменя (Hordeum vulgare L.) на фоне загрязнения почвы 2-мя ТМ: биогенного Zn и ксенобиотика Cd. Цинк необходим для жизнедеятельности растений, поскольку принимает участие в белковом и углеводном обмене, окислительных процессах, влияет на формирование генеративных органов, проницаемость мембран, стабилизирует клеточные компоненты. Zn участвует также в синтезе РНК и хлорофилла [2]. В малых количествах, являясь жизненно важным элементом, при накоплении в высоких концентрациях Zn может оказывать токсическое действие на организм [3, 4]. Тем не менее, уровень фитотоксичных концентраций его в тканях растений достаточно высок: 100–500 мг/кг [4]. Поглощение Zn корнями растений может быть как активным процессом, так и пассивным, в зависимости от его концентрации в субстрате [3–5]. Механизмы процессов поглощения и транслокации ТМ растениями установлены не полностью, поэтому требуется проведение дальнейших исследований по изучению закономерностей корневого поглощения поллютантов. В системе почва–растение фитотоксичность Zn контролируется не только способностью растений ограничивать поступление ТМ, но и эдафическими свойствами почв.
Загрязнение почвы кадмием является одним из наиболее опасных экологических явлений. Кадмий по химическим свойствам близок к цинку и отличается от него еще большей подвижностью в кислых средах. Концентрация Cd в почвенных растворах находится в интервале 0.2–6 мкг/л [4]. Содержание Cd в растениях зависит от концентрации его подвижных форм в почве. В незагрязненных почвах его содержание в сухой биомассе растений, как правило, не превышает 0.1–0.8 мг/кг [6]. Биологическая роль Cd изучена очень слабо. Известно, что Cd – токсикант, канцероген, тератоген. Он негативно влияет на рост и развитие растений [4, 7]. Считается, что кадмий выступает в роли природного антагониста цинка, препятствуя поступлению последнего в растения [4, 6]. Поступление Cd в надземные части происходит по барьерному типу [8, 9]. Высокая фитотоксичность кадмия объясняется его близостью по химическим свойствам к цинку. Кадмий может выступать в роли цинка во многих биохимических процессах, нарушая работу таких ферментов как карбоангидраза, различные дегидрогеназы, фосфатазы, связанных с дыханием растений и другими физиологическими процессами, а также протеиназ и пептидаз, участвующих в белковом обмене, ферментов обмена нуклеиновых кислот и др. Как химический аналог цинка, кадмий может заменять его в ферментной системе, необходимой для фосфорилирования глюкозы и сопровождающей процесс образования и потребления углеводов [6].
Особенности транспорта, накопления кадмия и цинка, а также морфологического ответа растений на их комплексное действие, по-видимому, связаны с дифференциальной экспрессией генов, вовлеченных в транспорт этих ТМ и в ответ растений на их накопление. Среди потенциальных генов, экспрессия которых в корнях может отражать особенности транспорта и накопления цинка и кадмия при совместном действии, можно выделить гомологи генов DCD, LCD, ZIP4, HMA4, PCR1. Функции данных генов в основном известны из исследований на модельном растении Arabidopsis thaliana L., а информация об экспрессии их гомологов у сельскохозяйственных культур фрагментарна. Ген DCD кодирует D-цистеиндесульфгидразу, разлагающую D-цистеин на пируват, сероводород (H2S) и аммиак (NH3). Молекулы газа H2S участвуют в ответе растений на кадмиевый стресс, а производство H2S при участии D-цистеиндесульфгидразы увеличивает устойчивость к кадмию в модельном растении A. thaliana. Мутантная линия, в которой был нокаутирован ген DCD, аккумулировала больше кадмия и активных форм кислорода (АФК) и в целом характеризовалась повышенной чувствительность к кадмию. В то же время трансгенная линия, сверхэкспрессирующая DCD, характеризовалась сниженным накоплением кадмия и АФК, а также была более устойчива к кадмию по сравнению с растениями дикого типа. Активация экспрессии гена DCD в ответ на воздействие кадмия связана с работой индуцируемого кадмием транскрипционного фактора WRKY13 [10]. Ген LCD кодирует L-цистеиндесульфгидразу, разлагающую L-цистеин также на пируват, сероводород и аммиак. Таким образом, белки DCD и LCD участвуют в производстве H2S, который связан с устойчивостью растений и других организмов к действию кадмия [11]. По-видимому, H2S, продуцируемый DCD и LCD, может снижать накопление кадмия за счет усиления экспрессии генов, кодирующих транспортеры кадмия из клетки в апопласт [10]. PCR1 кодирует белок plant cadmium resistance 1 (PCR1), и растения с повышенной экспрессией этого гена более устойчивы к действию кадмия [12], при этом белок PCR1 вовлечен в радиальный транспорт кальция Ca2+ в корнях и его дальнейшее перемещение в надземную часть растений [13]. Усиление экспрессии этого гена и снижение аккумуляции кадмия также может быть вызвано действием H2S, синтезирующегося в реакциях с участием цистеиндесульфгидраз [10]. Ген ZIP4 кодирует предшественник цинкового транспортера 4, который принадлежит к белковому семейству ZIP. Транскрипционная активность гена ZIP4 повышается в ответ на дефицит цинка в корнях и побегах. Использование экзогенной абсцизовой кислоты (АБК) ингибирует экспрессию ZIP4 в растениях A. thaliana, подвергшихся воздействию кадмия [14]. Экспрессия гена ZIP4 взаимосвязана с локальными концентрациями цинка в корнях и побегах растений [15–17]. HMA4 кодирует АТФазу 4, ассоциированную с ТМ, которая связана с загрузкой Cd2+ в ксилему для транспорта от корней к побегам [10]. Эта АТФаза также участвует в транслокации цинка от корней к побегам, а повышенная экспрессия гена HMA4 приводит к гипераккумуляции кадмия и цинка в растениях [18]. Экспрессия данного гена регулируется жасмонатным сигнальным путем: добавление в среду экзогенного метилжасмоната приводит к снижению экспрессии HMA4 и уменьшению накопления кадмия [19].
Цель работы – выявление закономерности распределения и оценка параметров миграции Zn и Cd в системе почва–почвенный раствор–растение в динамике в условиях совместного загрязнения дерново-подзолистой почвы легкого гранулометрического состава этими ТМ, а также анализ экспрессии вышеупомянутых генов, связанных с транспортом и накоплением Zn и Cd в корнях экспериментальных растений и с ответом на ТМ-стресс.
МЕТОДИКА ИССЛЕДОВАНИЯ
Анализ закономерностей миграции Cd и Zn в системе дерново-подзолистая почва–почвенный раствор–ячмень. Поведение Zn и Cd в системе почва–растение изучали в вегетационных опытах в теплице до достижения растениями возраста 79 сут (температура 25–35°С, относительная влажность воздуха 60–70%, влажность почвы – 55% ПВ), (рис. 1).
Рис. 1.
Вегетационный опыт с совместным внесением Zn и Cd в дерново-подзолистую супесчаную почву (тепличный бокс).

Объектом исследования был ячмень (Hordeum vulgare L.) сорта Зазерский 85, выращенный на дерново-подзолистой супесчаной почве, тяжелые металлы Zn и Cd. Физические и химические показатели почвы определяли общепринятыми методами (табл. 1) [20, 21]. Варианты опыта – Cd10Zn0, Cd10Zn0, Cd10Zn50, Cd10Zn100, Cd10Zn150. Максимальный возраст тест-растений – 79 сут. Повторность вегетационного опыта четырехкратная.
Таблица 1.
Основные характеристики исследованной дерново-подзолистой почвы
| Показатель | |
|---|---|
| pHKCl | 5.05 ± 0.01 |
| pH$_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}$ | 6.04 ± 0.01 |
| Гумус, % | 1.0 ± 0.01 |
| Hг, мг-экв/100 г почвы | 1.89 ± 0.02 |
| Сумма обменных оснований, мг-экв/100 г почвы | 5.3 ± 0.1 |
| Обменный K2O, мг/кг (по Масловой) | 77.7 ± 1.3 |
| Подвижный P2O5, мг/кг (по Кирсанову) | 127 ± 1.9 |
| Zn валовый, мг/кг почвы | 30.7 ± 2.2 |
| Cd валовый, мг/кг почвы | 0.4 ± 0.02 |
Растения выращивали в пластиковых сосудах, содержащих 5 кг почвы. Были высажены пророщенные 3-суточные семена в количестве 25 шт./сосуд. Не менее чем за 30 сут перед посадкой проростков в почву вносили Zn в виде водного раствора нитрата в количестве 0 (контроль), 50, 100, 150 мг/кг, вместе с Cd (также в виде водного раствора нитрата) в количестве 10 мг/кг. Дозы ТМ подбирали, исходя из установленных в предыдущих исследованиях [7] субкритических концентраций металлов для дерново-подзолистой почвы. Общая концентрация цинка в почве при этом составляла 30.7, 80.7, 130.7, 180.7 мг/кг, кадмия – 0.4 и 10.4 мг/кг. Затем добавляли питательные элементы в виде водных растворов солей (NH4NO3, KH2PO4, K2SO4) из расчета N200P100K100. При этом в каждом варианте, включая контрольный, количество внесенного азота корректировали с помощью азотнокислого аммония до указанной величины содержания его в почве 200 мг/кг.
После внесения растворов солей почву в сосудах инкубировали в течение 30 сут. Контролем служил вариант NPKZn0Cd0. Отдельные показатели регистрировали в динамике. Для этого из части сосудов через 18, 40, 60 и 79 сут после посева снимали урожай надземной биомассы, проводили анализ морфометрических показателей растений, извлекали почвенные растворы и определяли формы нахождения ТМ в почвах. Концентрацию Zn и Cd в корнях и надземных частях ячменя, содержание подвижных форм и валовое количество элементов в почвах определяли в соответствии с методиками [20–22]. Квазиравновесные почвенные растворы были получены центрифугированием в соответствии с методикой [23]. В почвенных растворах определяли pH, содержание Zn, Cd, микро- и макроэлементов. Концентрацию Zn и Cd определяли методом ICP-OES на приборе Liberty II фирмы “Varian”.
Прирост надземной биомассы растений описывали с помощью логистической (S-образной) функции [23–25]:
(1)
$M(t) = \frac{{{{M}_{{\max }}}}}{{1 + \frac{{{{M}_{{\max }}}}}{{{{M}_{0}}}} \times \exp ( - \mu \times t)}},$Содержание Zn и Cd в растениях увеличивается в ходе онтогенеза. При этом зависимость изменения концентраций Zn в вегетативных органах растений от времени носит асимптотический характер, приближаясь к максимуму [Zn]max,раст, характерному для каждой концентрации Zn в почве и вида растения. Подобная зависимость может быть описана уравнением:
(2)
${{[{\text{Zn]}}}_{{{\text{раст}}}}} = {{[{\text{Zn]}}}_{{{\text{max,раст}}}}} \times [1 - \exp ( - \beta t)],$Величины параметров уравнений (1), (2) – Mmax, M0, μ, [Zn]max, раст и β подбирали с использованием модуля “поиск решения” программы Excel с алгоритмом последовательных итераций, с минимизацией ошибки E = $\sum {[{{K}_{c}}} $(расч) – Kc (измерен)]2.
Для характеристики степени криволинейной зависимости использовали корреляционное отношение η, величины ошибки (sη) и критерия существенности корреляционного отношения (tη) [26]. Корреляционное отношение рассчитывали по формуле:
(3)
$\eta = \sqrt {\frac{{\sum {{{{(Y - \bar {Y})}}^{2}}} - \sum {{{{(Y - {{{\bar {Y}}}_{x}})}}^{2}}} }}{{\sum {{{{(Y - \bar {Y})}}^{2}}} }}} ,$Анализ экспрессии генов, ассоциированных с транспортом кадмия и цинка и устойчивостью к ним, в корнях растений ячменя. Последовательности гомологов целевых генов в геноме ячменя обыкновенного Hordeum vulgare L. были подобраны при помощи инструмента BLAST в базе данных Ensembl Plants, содержащей геном ячменя обыкновенного. В программе Primer BLAST были подобраны праймеры для данных генов с анализом специфичности против базы данных последовательностей ячменя обыкновенного, доступных в NCBI. Последовательности праймеров приведены в табл. 2. Все разработанные праймеры характеризовались хорошей специфичностью (продукты амплификации были проанализированы в 2%-ном агарозном геле).
Таблица 2.
Последовательности праймеров, использованных в работе
| Ген | Прямой/обратный | Последовательность праймера |
|---|---|---|
| DCD | Прямой | CAAGTGGAATGGGCGGAAAG |
| Обратный | CCAACGCATAATGGAAGCGG | |
| LCD | Прямой | TTGTTCAGGACTCTGCGCTT |
| Обратный | ATGGAATCCTTTGCCGTCGT | |
| ZIP4 | Прямой | GCTGGGCTGCAGATTCATTT |
| Обратный | TGCAAGCATGGACAACTTACTG | |
| HMA4 | Прямой | TGAAGCTGCCTGAGATCGTG |
| Обратный | CCATCCCCACCGATTTCCAT | |
| PCR1 | Прямой | TGCCTTGCTCTACGTGTGAAT |
| Обратный | CGACATTAACGCACACACGTT |
Корни ячменя, отобранные на 19-е сут прорастания в загрязненной ТМ почве, промыли в дистиллированной воде для удаления почвенных частиц. Затем ткани корней заморозили в жидком азоте и хранили в нем до анализа. Было отобрано по 4 образца тканей корней в каждом экспериментальном варианте: Cd0Zn0, Cd10Zn0, Cd10Zn50, Cd10Zn100, Cd10Zn150. Выделение тотальной РНК проводили из не более чем 100 мг сырой массы корней, гомогенизируя ткань в жидком азоте с добавлением поливинилпирролидона, а затем используя колонки GeneJET Plant RNA kit (Thermo Fisher Scientific) по протоколу производителя. Качество выделенной РНК проверяли на спектрофотометре NanoDrop-2000. Показатели чистоты образцов варьировали: показатель A260/230 составил от 0.30 до 2.26, указывая на загрязнение некоторых образцов фенольными соединениями, а показатель A260/280 составил от 1.91 до 2.24, свидетельствуя о низком содержании белков в очищенных образцах РНК. 0.1 мкг выделенной РНК подвергли обработке ДНКазой (DNase I, Thermo Fisher Scientific) и затем без разбавления использовали для синтеза кДНК с набором MMLV RT kit (Евроген) по протоколу производителя. Полученную матрицу использовали для проведения ОТ-ПЦР в реальном времени на приборе ДТ-96 (ДНК–Технология) с применением набора qPCRmix-HS SYBR Green (Евроген) по протоколу производителя. Дифференциальную экспрессию генов оценивали при помощи метода –ΔΔСp.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В эксперименте изучали динамику трансформации подвижных форм Zn и Cd в почве (рис. 2). С увеличением дозы Zn содержание подвижных форм Zn в почве возрастало. Полученная зависимость, усредненная по времени отбора проб, может быть удовлетворительно описана с помощью линейной функции [Zn]подв.(%) = 0.27[Zn]вал, R2 = 0.99.
Содержание подвижных форм Cd в почве также возрастало: сначала с 0.18 ± 0.12 до 4.5 ± 3.0 мг/кг при внесении в почву металла в количестве 10 мг/кг и далее не изменялось, варьируя в диапазоне (4.9 ± 2.3) – (5.3 ± 2.7) мг/кг с увеличением количества внесенного в почву Zn (от 50 до 150 мг/кг).
Из диаграмм на рис. 2 следует, что несмотря на общепринятое положение о близости химических характеристик исследованных металлов Zn и Cd [4, 6], нельзя не отметить и их довольно существенное различие при взаимодействии с химически неоднородными почвенными компонентами. Например, соотношение относительного содержания кадмия к относительному содержанию цинка в подвижной форме в исследованной к почве составило в среднем 0.45, незначительно отклоняясь от этой величины в разных вариантах опыта.
В течение вегетационного периода из почвенных сосудов сразу после высаживания пророщенных семян ячменя (на 1-е сут после внесения Zn и Cd в почву), а также на 18-е, 23-и, 34-е, 40-е, 58-е и 79-е сут после внесения металлов в почву, извлекали почвенные растворы. Установлено, что уменьшение концентрации Zn в почвенном растворе в зависимости от времени можно удовлетворительно описать экспоненциальными уравнениями вида: [Zn]почв. раствор = Aexp(–Bt), где A и B – параметры, t – время, сут (рис. 3). Величины параметров A и B и величины коэффициентов детерминации (R2) соответственно для вариантов опыта составили: Zn0Cd0 (0.98, 0.02, 0.39), Zn0Cd10 (0.78, 0.02, 0.31), Zn50Cd10 (12.82, 0.03, 0.70), Zn100Cd10 (32.78, 0.05, 0.90), Zn150Cd10 (76.81, 0.05, 0.87).
Рис. 3.
Динамика изменения концентрации Zn (а) и Cd (б) в почвенных растворах, извлеченных из почвы вариантов Zn0Cd0, Zn0Cd10, Zn50Cd10, Zn100Cd10, Zn150Cd10, мг/дм3.
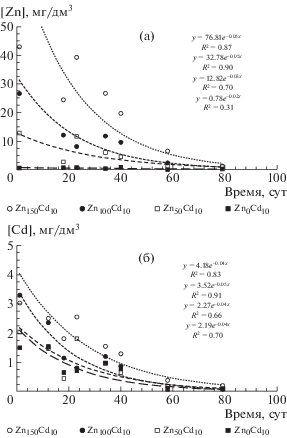
Во всех вариантах опыта (за исключением варианта Cd0) установлено, что концентрации Cd в почвенном растворе уменьшались со временем в соответствии с обратной экспоненциальной зависимостью. Динамику концентрации Cd в почвенных растворах, так же как и в случае с Zn, можно удовлетворительно описать экспоненциальными уравнениями вида: [Cd]почв. раствор = = C exp(–Dt), где C и D – параметры, t – время, сут. Величины параметров C и D и величины коэффициентов детерминации (R2) соответственно в вариантах опыта составили: Zn0Cd0 (корреляция отсутствует), Zn0Cd10 (2.19, 0.04, 0.82), Zn50Cd10 (2.27, 0.03, 0.80), Zn100Cd10 (3.52, 0.05, 0.90), Zn150Cd10 (4.18, 0.04, 0.93).
Снижение концентрации Zn и Cd в почвенных растворах (за исключением вариантов Zn0 и Cd0), отобранных из сосудов с вегетирующими растениями, было связано как с истощением запаса водорастворимых форм металлов в почве в результате непрерывного поглощения корнями растений, не компенсируемого десорбцией Zn и Cd из почвенного поглощающего комплекса (ППК) в почвенный раствор, так и с процессами возможной трансформации подвижных (доступных растениям) форм нахождения металла в малоподвижные (“фиксации” Zn и Cd). Для вариантов Zn0 и Cd0 вышеуказанный тренд выявить не удалось из-за высокой вариабельности экспериментальных данных.
Экспериментально получены величины сухой биомассы надземных органов и корней ячменя на 1-е, 18-е, 40-е, 60-е и 79-е сут после появления всходов. Приблизительно после 50-х сут вегетации в варианте Zn0Cd0 и 75-х сут вегетации в остальных вариантах опыта положительную динамику изменения биомассы не отмечали. На основании этих данных построены логистические кривые, аппроксимирующие динамику сухой биомассы надземных органов растений и полиномы 2-й степени, удовлетворительно аппроксимирующие динамику сухой биомассы корней (рис. 4).
Рис. 4.
Динамика изменения сухой биомассы надземных органов и корней ячменя, выращенного на дерново-подзолистой супесчаной почве, г/раст. Варианты: (а) – Zn0Cd0, (б) – Zn0Cd10, (в) – Zn50Cd10, (г) – Zn100Cd10, (д) – Zn150Cd10.
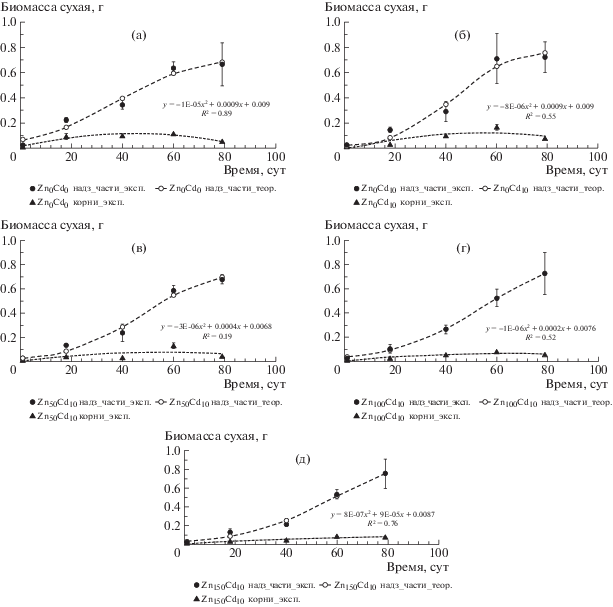
Величины параметров логистических кривых Mmax (г) M0 (г), μ (сут–1) для исследованной почвы при различных дозах внесенных Zn и Cd представлены в табл. 3.
Таблица 3.
Количественные параметры логистических кривых изменения сухой надземной биомассы ячменя (в пересчете на одно растение), выращенного до фазы молочной спелости (n = 5, ν = 3)
| Вариант | Mmax (максимальная возможная масса 1-го растения), г | M0 (начальная масса 1-го растения, расчетная величина), г | μ (удельная скорость прироста биомассы растения), сут–1 | η2/Sη/tη(α*) |
|---|---|---|---|---|
| Cd0Zn0 | 0.733 | 0.067 | 0.063 | 0.91/0.23/3.89(0/05) |
| Cd10Zn0 | 0.803 | 0.018 | 0.089 | 0.93/0.22/4.20(0.05) |
| Cd10Zn50 | 0.766 | 0.026 | 0.072 | 0.98/0.11/8.90(0.01) |
| Cd10Zn100 | 0.897 | 0.036 | 0.059 | 0.96/0.17/5.69(0.05) |
| Cd10Zn150 | 1.000 | 0.035 | 0.057 | 0.97/0.15/6.66(0.01) |
Полученные данные по накоплению биомассы растений в условиях вегетационного опыта показали, что внесение в почву ТМ в субкритических концентрациях (кадмия – до 10, цинка – до 150 мг/кг) не приводило к выраженным фитотоксическим эффектам, определяемым на основании морфометрических показателей (уменьшение скорости созревания ячменя, изменения биомассы надземных органов и корней растений).
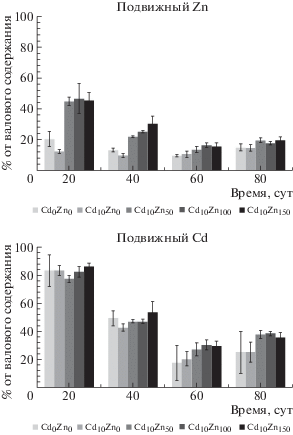
На рис. 5 представлены данные по изменению содержания Zn и Cd в различных органах тест-растений в зависимости от концентрации металлов в почве, а также от времени, прошедшего с момента начала вегетации, которые показали, что концентрационная зависимость между содержанием Cd в почве и надземных органах ячменя присутствует только в вариантах с внесением металла в почву и без внесения. Внесение возрастающих количеств Zn в остальных вариантах опыта при неизменном количестве (дозе) внесенного Cd не влияло на содержание последнего в надземных органах растений.
В то же время внесение в почву возрастающих количеств Zn при одинаковой дозе внесенного Cd (10 мг/кг) привело к увеличению накопления первого в надземных органах растений в соответствии с линейной зависимостью: [Zn]раст = = 4.34[Zn]почв (рис. 6). Показано, что достоверных различий в накоплении Zn надземными органами растений при дополнительном внесении в почву Cd в варианте Cd10Zn0 по сравнению с контрольным вариантом Cd0Zn0 не обнаружено.
Рис. 6.
Зависимость между концентрацией Zn в почве и его содержанием в надземных органах растений (средние в сроки учета растений (18, 40, 60, 79 сут).

Экспериментальный материал в графической форме для последующего анализа данных об изменении транслокационного соотношения (ТОТМ) = ТМнадз.органы : ТМкорни в динамике при совместном внесении в дерново-подзолистую супесчаную почву Zn и Cd в разных вариантах опыта представлен на рис. 7а: ТОZn снижалось по мере развития растений, но достоверно не изменялось по мере повышения дозы Zn, внесенного в почву одновременно с кадмием.
Рис. 7.
Изменение транслокационных отношений Znнадз.органы : Znкорни (а) и Cdнадз.органы : Cdкорни (б) в динамике при совместном внесении в почву Zn и Cd.
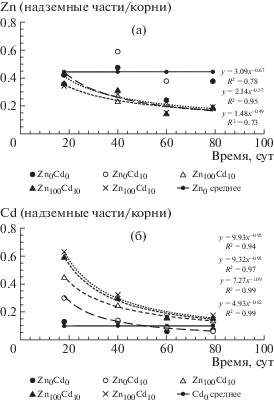
На рис. 7б дано изменение транслокационного отношения ТОCd = (Cdнадз.органы : Cdкорни) в различных органах растений (надземных и корнях) в динамике при совместном внесении в почву Zn и Cd в разных вариантах опыта. ТОCd не только снижалось по мере развития растений, но увеличивалось по мере повышения дозы Zn, внесенного в почву одновременно с кадмием. При этом общее содержание кадмия в надземных частях ячменя фактически не изменялось в вариантах опыта с внесением Cd, варьируя в диапазоне 20–45 мг/кг сухой массы. Однако существенно снижалась концентрация кадмия в корнях с увеличением количества (дозы) внесенного цинка. Кроме того, общее содержание Cd в корнях ячменя с возрастом также повышалось (рис. 5в). Это свидетельствовало по меньшей мере о 2-х аспектах проблемы корневого поглощения кадмия: 1 – конкурентного взаимодействия Zn и Cd при поглощении ионов металлов из почвенного раствора корневым поглощающим комплексом (КПК) – чем больше соотношение [Zn] : [Cd] в почвенном растворе, тем больше соответствующее соотношение в КПК (при ограниченной емкости последнего); 2 – наличия стабильного и не зависящего от конкурентного взаимодействия с Zn канала поступления кадмия в симпласт растений ячменя.
Согласно некоторым литературным данным [4], важное значение при оценке фитотоксического эффекта от повышенной концентрации кадмия в надземных органах растений играет соотношение массовых концентраций [Cd] : [Zn] в корнях: чем оно меньше, тем слабее фитотоксический эффект. Полученные результаты (табл. 4) показали очевидное снижение фитотоксического эффекта Cd при дополнительном внесении в почву Zn. Временная динамика соотношения [Cd] : [Zn] в корнях не была выявлена. В то же время, для надземных органов ячменя был отмечен незначительный нисходящий тренд вышеуказанного соотношения.
Таблица 4.
Соотношения концентраций Zn и Cd в различных органах ячменя, выращенного на дерново-подзолистой супесчаной почве до фазы молочной спелости
| Вариант | [Cd] : [Zn] | |||
|---|---|---|---|---|
| время отбора проб, сут после всходов | ||||
| 18 | 40 | 60 | 79 | |
| Cd0Zn0 | $\frac{{0.02}}{{0.04}}$ | $\frac{{0.01}}{{0.05}}$ | $\frac{{0.01}}{{0.04}}$ | $\frac{{0.01}}{{0.06}}$ |
| Cd10Zn0 | $\frac{{0.57}}{{0.80}}$ | $\frac{{0.43}}{{2.08}}$ | $\frac{{0.33}}{{1.42}}$ | $\frac{{0.33}}{{3.99}}$ |
| Cd10Zn50 | $\frac{{0.14}}{{0.13}}$ | $\frac{{0.13}}{{0.12}}$ | $\frac{{0.10}}{{0.13}}$ | $\frac{{0.09}}{{0.12}}$ |
| Cd10Zn100 | $\frac{{0.08}}{{0.06}}$ | $\frac{{0.06}}{{0.06}}$ | $\frac{{0.06}}{{0.06}}$ | $\frac{{0.05}}{{0.06}}$ |
| Cd10Zn150 | $\frac{{0.06}}{{0.03}}$ | $\frac{{0.04}}{{0.04}}$ | $\frac{{0.04}}{{0.04}}$ | $\frac{{0.04}}{{0.04}}$ |
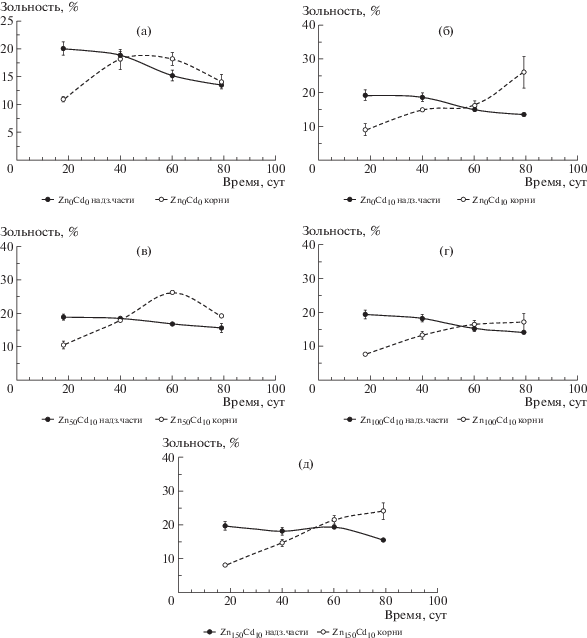
При оценке в ходе настоящего эксперимента зольности различных частей ячменя в динамике удалось зафиксировать тенденцию к снижению данного показателя, начиная с 18-суточного возраста и вплоть до фазы начала молочной спелости (79 сут), для вегетативной массы растений. Зольность корней, напротив, постепенно возрастала (рис. 8). Причем для последних наблюдали и отклонения от вышеуказанной тенденции. Возможно, это было связанно с недоучетом массы корней в последний срок отбора образцов в связи с методическими затруднениями при промывке корней в фазе созревания семян.
Рис. 8.
Динамика изменения зольности надземных органов и корней ячменя, выращенного на дерново-подзолистой супесчаной почве, %. Варианты: (а) – Zn0Cd0, (б) – Zn0Cd10, (в) – Zn50Cd10, (г) – Zn100Cd10, (д) – Zn150Cd10.
Анализ экспрессии генов, связанных с транспортом ТМ и с клеточным ответом на Cd и Zn, может прояснить молекулярные механизмы отмеченных закономерностей переноса и накопления данных ТМ. Кратность изменения экспрессии изученных генов (Fold Change, FC) в корнях растений ячменя по сравнению с контрольным вариантом Cd0Zn0 для разных концентраций тяжелых металлов в почве приведена в табл. 5.
Таблица 5.
Нормализованная экспрессия изученных генов (FC) в корнях растений ячменя по сравнению с контролем (Cd0Zn0) для вариантов разных концентраций тяжелых металлов в почве
| Ген | Вариант | FC |
|---|---|---|
| DCD | Cd10Zn0 | –1.2 |
| Cd10Zn50 | 1.1 | |
| Cd10Zn100 | 1.4 | |
| Cd10Zn150 | –1.2 | |
| LCD | Cd10Zn0 | 2.2* |
| Cd10Zn50 | 1.2 | |
| Cd10Zn100 | –3.0* | |
| Cd10Zn150 | –1.6 | |
| ZIP4 | Cd10Zn0 | –1.3 |
| Cd10Zn50 | –3.9* | |
| Cd10Zn100 | –14.4* | |
| Cd10Zn150 | –5.6* | |
| HMA4 | Cd10Zn0 | –4.0* |
| Cd10Zn50 | –6.2* | |
| Cd10Zn100 | –24.7* | |
| Cd10Zn150 | –3.8* | |
| PCR1 | Cd10Zn0 | 2.0* |
| Cd10Zn50 | 2.9* | |
| Cd10Zn100 | 5.9* | |
| Cd10Zn150 | 2.7* |
Выявлено, что воздействие Cd и Zn не оказало значимого эффекта на экспрессию гомолога гена DCD. При этом минимальная концентрация Zn 50 мкг/кг приводила к двукратному увеличению транскрипционной активности по сравнению с контролем, а концентрации цинка 100 и 150 мг/кг приводили к подавлению экспрессии гомолога гена LCD. В корнях растений, произраставших на почве с содержанием кадмия 10 мг/кг, наблюдали резкое снижение экспрессии гомолога HMA4, не зависящее от концентрации Zn. Противоположную ситуацию наблюдали в отношении экспрессии гомолога гена PCR1, где 10 мг Cd/кг привели к существенному увеличению транскрипционной активности данного гена. Подавление экспрессии гомологов генов LCD, ZIP4 и HMA4 могло свидетельствовать о снижении производства H2S [10] в клетках изученного сорта ячменя при воздействии ТМ, снижении транспорта Zn и увеличении концентраций стрессового фитогормона АБК [14], а также о снижении аккумуляции Zn и Cd в растениях за счет подавления экспрессии гомолога АТФазы HMA4. Данный ген является перспективным для исследования снижения накопления Cd в корнях при повышении концентраций Zn. Стрессовый ответ растений на ксенобиотик Cd также мог быть выражен в повышении экспрессии гомолога гена PCR1, ассоциированного с увеличением устойчивости к действию Cd и с возможным накоплением кальция в листьях растений. Для выявления молекулярных причин снижения накопления Cd в корнях при повышении концентраций Zn необходимо расширить выборку изучаемых генов-кандидатов, однако предварительные данные свидетельствовали о возможной роли гомолога гена HMA4 в данном процессе.
ЗАКЛЮЧЕНИЕ
В ходе вегетационных опытов с ячменем на дерново-подзолистой супесчаной почве, в которую дополнительно вносили Zn в дозах Zn0, Zn50, Zn100, Zn150 и Cd в дозе 10 мг/кг, установлено следующее.
Содержание подвижных форм Zn в почве возрастало с увеличением концентрации металла в соответствии с зависимостью, которая может быть описана с помощью линейной функции: [Zn]подв.(%) = 0.27 × [Zn]вал. (мг/кг), R2 = 0.99. Содержание подвижных форм Cd в почве также возрастало при внесении металла в дозе Cd10 с 0.18 ± ± 0.12 до 4.5–5.3 мг/кг. Соотношение относительного содержания подвижных форм кадмия и цинка в исследованной почве составило в среднем 0.45.
Во всех вариантах опыта (за исключением вариантов Zn0 и Cd0) установлено, что концентрации Zn и Cd в почвенном растворе уменьшались со временем в соответствии с обратной экспоненциальной зависимостью вследствие процесса истощения запаса водорастворимых форм Zn и Cd в почве в результате непрерывного поглощения корнями растений.
Изменение биомассы ячменя в вариантах опыта хорошо аппроксимируется логистическими кривыми. Установлено, что внесение в почву ТМ в субкритических концентрациях (кадмия – до 10 мг/кг, Zn – до 150 мг/кг) не приводило к выраженным фитотоксическим эффектам.
Внесение возрастающих количеств Zn при одинаковой дозе внесенного Cd (10 мг/кг) привело к увеличению накопления первого в надземных органах растений в соответствии с линейной зависимостью: [Zn]раст = 4.34[Zn]почв. При дополнительном добавлении в почву Cd в варианте Cd10Zn0 по сравнению с контрольным вариантом Cd0Zn0 достоверные различия в накоплении Zn надземными органами растений отсутствовали.
Транслокационное отношение ТОCd = = (Cdнадз.органы : Cdкорни) в различных органах растений (надземных и корнях) увеличивалось по мере повышения дозы Zn, внесенного в почву одновременно с кадмием. При этом общее содержание кадмия в надземных органах ячменя фактически не изменялось в вариантах опыта с внесением Cd, варьируя в диапазоне 20–45 мг/кг сухой массы. С увеличением количества внесенного цинка существенно снижалась концентрация кадмия в корнях. Общее содержание Cd в корнях ячменя с возрастом также увеличивалось. Величины ТОZn в различных органах растений (надземных и корнях) уменьшались по мере развития растений, но достоверно не изменялись по мере повышения дозы Zn, внесенного в почву одновременно с кадмием. Подобно Cd, содержание цинка в корнях достоверно увеличивалось до фазы цветения (60 сут), а затем снижалось. Временнóй динамики соотношения [Cd] : [Zn] в корнях выявить не удалось. В то же время для надземных органов ячменя был отмечен незначительный нисходящий тренд вышеуказанного отношения.
Начиная с 18-суточного возраста и вплоть до фазы начала молочной спелости (79 сут), наблюдали снижение зольности вегетативной массы растений, в то время как зольность корней, напротив, постепенно возрастала.
Воздействие Cd и Zn не оказало значимого эффекта на экспрессию гомолога гена DCD. Все использованные концентрации Zn привели к значимому ингибированию экспрессии гомолога гена ZIP4, а также гомологов генов LCD и HMA4.
Список литературы
Черных H.A., Ладонин В.Ф. Нормирование загрязнения почв тяжелыми металлами // Агрохимия. 1995. № 6. С. 71–80.
Соколов О.А., Черников В.А., Лукин С.В. Атлас распределения тяжелых металлов в объектах окружающей среды. 2-е изд., доп. Белгород: КОНСТАНТА, 2008. 188 с.
Barber S.A., Chen J.-H. Using a mechanistic model to evaluate the effect of soil pH on phosphorus uptake // Plant and Soil. 1990. V. 124. P. 183–186.
Kabata-Pendias A. Trace elements in soils and plants. London: CRC Press, 2011. 505 p.
Pandey R. Mineral nutrition of plants // Plant biology and biotechnology. V. I: Plant diversity, organization, function and improvement / Ed. Bahadur B. India: Springer, 2015. P. 499–538.
Алексеев Ю.В. Тяжелые металлы в агроландшафте. СПб.: Изд-во ПИЯФ РАН, 2008. 216 с.
Тяжелые металлы в агроценозах: миграция, действие, нормирование / Под ред. Санжаровой Н.И., Цыгвинцева П.Н. Обнинск: ФГБНУ ВНИИРАЭ, 2019. 398 с.
Baker A.J.M. Accumulators and excluders – strategies in the response of plants to heavy metals // J. Plant Nutr. 1981. V. 3. P. 643–654.
Ковалевский А.Л. Биогеохимия растений и поиски рудных месторождений: Автореф. дис. … д-ра геол.-минерал. наук. М.: Изд-во МГУ, 1983. 49 с.
Zhang Q., Cai W., Ji T.-T. Ye L., Lu Y.-T., Yuan T.-T. WRKY13 enhances cadmium tolerance by promoting D-CYSTEINE DESULFHYDRASE and hydrogen sulfide production // Plant Physiol. 2020. V. 183. Is. 1. P. 345–357.
Shen J.J., Qiao Z.J., Xing T.J., Zhang L.P., Liang Y.L., Jin Z.P., Yang G.D., Wang R., Pei Y.X. Cadmium toxicity is alleviated by AtLCD and AtDCD in Escherichia coli // J. Appl. Microbiol. 2012. V. 113. P. 1130–1138.
Song W.-Y., Choi K.S., Kim D.Y., Geisler M., Park J., Vincenzetti V., Schellenberg M., Kim S.H., Lim Y.P., Noh E.W., Lee Y., Martinoia E. Arabidopsis PCR2 is a zinc exporter involved in both zinc extrusion and long-distance zinc transport // Plant Cell. 2010. V. 22. P. 2237–2252
Zeng L., Zhu T., Gao Y., Wang Y., Ning C., Björn L.O., Chen D., Li S. Effects of Ca addition on the uptake, translocation, and distribution of Cd in Arabidopsis thaliana // Ecotoxicol. Environ. Saf. 2017. V. 139. P. 228–237.
Pan W., You Y., Shentu J.-L., Weng Y.-N., Wang S.-T., Xu Q.-R., Liu H.-J., Du S.-T. Abscisic acid (ABA)-importing transporter 1 (AIT1) contributes to the inhibition of Cd accumulation via exogenous ABA application in Arabidopsis // J. Hazard. Mater. 2020. V. 391. Art. 122189.
Campos A.C.A.L., Kruijer W., Alexander R., Akkers R.C., Danku J., Salt D.E., Aarts M.G.M. Natural variation in Arabidopsis thaliana reveals shoot ionome, biomass, and gene expression changes as biomarkers for zinc deficiency tolerance // J. Exp. Bot. 2017. V. 68. Is. 13. P. 3643–3656.
Sinclair S.A., Senger T., Talke I.N. Cobbett C.S., Haydon M.J., Krämer U. Systemic upregulation of MTP2- and HMA2-mediated Zn partitioning to the shoot supplements local Zn deficiency responses // Plant Cell. 2018. V. 30. P. 2463–2479.
Pita-Barbosa A., Ricachenevsky F.K., Wilson M., Dottorini T., Salt D.E. Transcriptional plasticity buffers genetic variation in zinc homeostasis // Sci. Rep. 2019. V. 9. Art. 19482.
Lekeux G., Crowet J.-M., Nouet C., Joris M., Jadoul A., Bosman B., Carnol M., Motte P., Lins L., Galleni M., Hanikenne M. Homology modeling and in vivo functional characterization of the zinc permeation pathway in a heavy metal P-type ATPase // J. Exp. Bot. 2019. V. 70. Is. 1. P. 329–341.
Lei G.J., Sun L., Sun Y., Zhu X.F., Li G.X., Zheng S.J. Jasmonic acid alleviates cadmium toxicity in Arabidopsis via suppression of cadmium uptake and translocation // J. Integrat. Plant Biol. 2019. V. 62. Is. 2. P. 218–227.
Минеев В.Г. Избранное. Сб. статей в 2-х ч. Агрохимия и качество пшеницы. Экологические проблемы и функции агрохимии. М.: Изд-во МГУ, 2005. 601 с.
Методические указания по определению тяжелых металлов в почвах сельхозугодий и продукции растениеводства. изд. 2-е, перераб. и доп. М.: ЦИНАО, 1992. 61 с.
Анисимов В.С., Анисимова Л.Н., Фригидова Л.М., Дикарев Д.В. Оценка миграционной способности Zn в системе почва–растение // Почвоведение. 2018. № 4. С. 427–438.
Анисимов В.С., Анисимова Л.Н., Фригидова Л.М., Корнеев Ю.Н., Фригидов Р.А., Санжаров А.И., Дикарев Д.В., Кочетков И.В. Исследование миграционной способности Zn в системе дерново-подзолистая почва–кормовые бобы в условиях вегетационного опыта // Агрохимия. 2019. № 3. С. 72–84.
Витковская С.Е., Дричко В.Ф., Хофман О.В. Оценка скорости нарастания биомассы сельскохозяйственных культур // Докл. РАСХН. 2014. № 1. С. 50–53.
Дричко В.Ф., Изосимова А.А. Влияние возрастающих доз извести на урожай и скорость роста растений рапса и овса // Агрохимия. 2005. № 8. С. 19–23.
Доспехов Б.А. Методика полевого опыта (с основами статистической обработки результатов исследований). М.: Агропромиздат, 1985. 351 с.
Химия тяжелых металлов, мышьяка и молибдена в почвах / Под ред. Зырина Н.Г., Садовниковой Л.К. М.: Изд-во МГУ, 1985. 208 с.
Дополнительные материалы отсутствуют.