Агрохимия, 2022, № 4, стр. 36-45
Антидоты гербицидов на основе сиднонимина
И. А. Черепанов 1, Ю. Я. Спиридонов 2, В. А. Абубикеров 2, И. Ю. Спиридонова 2, Н. В. Калганова 1, Д. А. Лапшин 3, С. К. Моисеев 1, *
1 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
119991 Москва, ул. Вавилова, 28, Россия
2 Всероссийский научно-исследовательский институт фитопатологии
143050 Московская обл., Одинцовский р-н, р. п. Большие Вяземы, ул. Институт, влад. 5, Россия
3 Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Миусская пл., 9, Россия
* E-mail: skm@ineos.ac.ru
Поступила в редакцию 17.11.2021
После доработки 07.12.2021
Принята к публикации 15.01.2022
- EDN: IMWIFG
- DOI: 10.31857/S0002188122040056
Аннотация
Впервые показано, что производные сиднонимина – мезоионного гетероциклического соединения – способны проявлять свойства антидотов гербицидов. В вегетационных опытах установлено, что N(3)-замещенные 4-(арилгидроксиметил)сиднонимины в виде гидрохлоридов или N6-трет-бутоксикарбонильных, либо N6-тозилатных производных при использовании для предпосевной обработки семян кукурузы в дозах 0.25–1.0 г/т семян стимулировали рост растений, а также были способны снижать или полностью устранять гербицидный эффект метсульфурон-метила, присутствующего в почве в дозе 2 г/га.
ВВЕДЕНИЕ
Современное эффективное сельскохозяйственное производство невозможно без использования пестицидов. Однако их широкое применение оказывает нарастающее антропогенное воздействие на окружающую среду. Поэтому важное значение имеет поиск новых, экологически более безопасных средств защиты растений, в том числе эффективных в очень малых дозах.
В России лидирующее место среди агрохимикатов занимают гербициды. Однако известно, что при длительном использовании прибавка урожая, обусловленная их применением, сильно снижается из-за накопления в почве остатков гербицидов, которые оказывают негативное воздействие на культурные растения [1]. Для повышения эффективности и безопасности применения гербицидов в сочетании с ними используют антидоты, которые являются индукторами устойчивости растений к действию фитотоксикантов. Антидоты гербицидов повышают селективность действия гербицидов в отношении сорняков и снижают их негативное воздействие на культурные растения, а также снижают или полностью устраняют отрицательный эффект от остатков гербицидов при возделывании сельскохозяйственных культур на почвах, содержащих такие остатки после выращивания предшествующих культур [2, 3]. Остатки гербицидов в почве могут вызывать снижение урожайности культурных растений до 35%. Поэтому применение антидотов позволяет расширить выбор культур, пригодных для использования в севооборотах.
Особенно опасны в отношении негативного воздействия на сельскохозяйственные культуры гербициды класса сульфонилмочевин, которые получили очень широкое распространение в сельском хозяйстве. Они способны оказывать свой эффект в малых дозах и медленно подвергаются биодеградации. Снижение или полное устранение отрицательного эффекта сульфонилмочевин на культурные растения привело бы к значительному снижению сельскохозяйственных потерь, вызываемых этим фактором.
К настоящему времени выявлено большое число антидотов, которые снижают фитотоксичность гербицидов в отношении важнейших видов культурных растений. Вещества, проявляющие антидотные свойства, принадлежат к различным классам химических соединений, основными из которых являются амиды галогенкарбоновых кислот (в первую очередь дихлоруксусной кислоты) и среди них – диаллиламид дихлоруксусной кислоты (дихлормид), производные карбоновых кислот и других карбонильных соединений (в том числе, мочевины), нафталевый ангидрид и его производные, производные гидроксиламина и сульфокислот [2–6]. Антидотный эффект проявляют также представители других классов химических соединений [2] и продукты, извлекаемые из растительного сырья [7].
Однако наибольшее число антидотов относится к гетероциклическим соединениям, в том числе содержащим несколько различных гетероатомов. Тем не менее, имеется потребность в разработке новых антидотов против наиболее распространенных гербицидов [4].
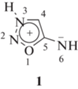
Недавно нами было показано, что сиднонимины – производные мезоионного гетероциклического соединения 1 – при использовании для предпосевной обработки семян в очень малых дозах (0.25–10.0 г/т семян) способны проявлять свойства регуляторов роста растений [8–10]. Очевидно, это связано со способностью сиднониминов генерировать в процессе метаболизма оксид азота (II) (NO) и супероксид-анион (${\text{O}}_{2}^{ - }$), которые являются сигнальными молекулами во многих клеточных процессах в живых организмах [11–14], в том числе влияющих на рост растений [14].
В этой связи целью работы была проверка возможности проявления сиднониминами антидотных свойств, которые ранее для мезоионных гетероциклических соединений известны не были. Конкретно, в работе исследовали способность сиднониминов функционировать в качестве индукторов устойчивости растений к действию фитотоксикантов на примере метсульфурон-метила, одного из важнейших представителей гербицидов класса сульфонилмочевин.
МЕТОДИКА ИССЛЕДОВАНИЯ
В качестве объектов исследования использовали 4-арилгидроксиметильные производные сиднонимина 2–11.
N6-трет-Бутоксикарбонилзамещенные (Boc-замещенные) соединения 3, 5, 8–11 и соли (гидрохлориды) N6-незамещенных производных (2, 4, 6) были получены в соответствии со схемой по методикам, описанным в работе [10].
Использованные для этого в качестве исходных соединений C(4)-незамещенные N6-Boc-производные сиднониминов (12) получали по методу, описанному в работе [15]. Замещенное по положению C(4) N6-тозильное производное 7 было синтезировано аналогично N6-Boc-производному 8 из соответствующего C(4)-незамещенного N6-тозилата [10].
Вегетационные эксперименты по изучению влияния соединений 2–11 на рост растений проводили с использованием в качестве тест-растения кукурузы сорта Краснодарский 291 АМВ. Сиднонимины 2–11 применяли для предпосевной обработки семян.
Для испытаний каждого вещества в 3-х дозах 0.25, 0.5 и 1.0 г/т семян взвешивали по 30 г семян кукурузы и помещали их в круглодонные колбы объемом 100 мл. Далее готовили растворы для выбранных доз испытуемого вещества. Для этого брали навеску 10 мг испытуемого соединения, помещали в пробирку и добавляли 10 мл дистиллированной воды или 75% этанола или диметилсульфоксида. К аликвотам полученного раствора добавляли воду для получения разбавленных растворов, соответствующих дозам 0.25, 0.5 и 1.0 г/т семян. Разбавленные растворы испытанных веществ вносили в колбы с семенами. Для смачивания 30 г семян кукурузы использовали по 2 мл соответствующего раствора. Для контрольного варианта с не обработанными семенами (водный контроль, Кводн) 30 г семян кукурузы смачивали 2 мл дистиллированной воды. Содержимое колб встряхивали вручную до полного поглощения жидкости семенами в течение 15–20 мин. После этого обработанные таким образом семена высыпали в чашки Петри и оставляли на 3 сут при комнатной температуре в открытом виде. Через 3 сут для проведения вегетационных опытов по определению рострегулирующей активности обработанные семена высевали в дерново-подзолистую почву, помещенную в парафинированные бумажные стаканы вместимостью 600 г, по 5 шт./сосуд. Повторность опыта пятикратная.
Для проведения вегетационных опытов на антидотную активность дерново-подзолистую почву предварительно подготавливали, обрабатывая ее с помощью лабораторного опрыскивателя гербицидом метсульфурон-метил (Зингер, СП) в дозе 2 г/га. Через 1 сут обработанную гербицидом почву распределяли в парафинированные бумажные стаканы вместимостью 600 г и проводили посев семян кукурузы по 5 шт./сосуд. Повторность опыта пятикратная. Для гербицидного контроля (Кгерб) в обработанную гербицидом почву высевали семена кукурузы, не обработанные испытуемыми веществами.
Выращивание тест-растений осуществляли в контролируемых условиях лаборатории искусственного климата (ЛИК): влажность воздуха в камере 70%, длительность дня 16 ч, ночи – 8 ч, освещенность днем 20 000 лк, температура воздуха днем 25°C, ночью 16°C, влажность почвы поддерживали на уровне 60% ПВ путем ежедневного полива по массе каждого вегетационного сосуда водопроводной обессоленной водой. Через 18–21 сут надземную массу тест-растений срезали и взвешивали.
Для корректного сравнения результатов опыты по определению рострегулирующей и антидотной активности сиднониминов охватывали одновременно все описанные выше варианты и их проводили одновременно в одной и той же камере ЛИК. Таким образом, схема эксперимента позволяла в ходе одного опыта получать данные как о рострегулирующей, так и об антидотной активности испытанных соединений.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В настоящей работе были исследованы производные сиднонимина 2–11, замещенные по положению N(3) алкильной группой. В положении C(4) испытуемые соединения содержали арилгидроксиметильный заместитель. Соединения 3, 5, 8–11 содержали в положении N6 Boc-заместитель, а соединение 7 – тозильную группу, в то время как остальные сиднонимины (2, 4, 6) представляли собой незамещенные по N6-положению соли (гидрохлориды). Как сообщалось нами ранее, сиднонимины именно с таким типом замещения показали себя стимуляторами роста кукурузы [10]. В частности, стимуляторами роста показали себя соединения 2–5 в дозах 0.25–5.0 г/т семян. Это свидетельствовало о том, что соединения указанного структурного типа способны стимулировать в растении процессы, ответственные за его развитие и рост. Данное обстоятельство побудило проверить, не способны ли такие соединения благоприятно влиять на организм растения в условиях гербицидного стресса, т.е., не могут ли они являться индукторами устойчивости растений к действию фитотоксикантов (антидотами гербицидов).
Кроме того, выбор для исследования соединений 2–11 обусловлен тем, что такой набор производных способен дать определенную информацию о взаимосвязи между молекулярной структурой соединений и их биологической активностью. С одной стороны, соли сиднониминов хорошо растворимы в воде, в то время как N6-замещенные производные более липофильны. Это может привести к существенному изменению характера распределения веществ в растении и, соответственно, повлиять на активность соединений. С другой стороны, можно ожидать, что липофильная Boc-группа, влияя на транспорт соединения в организме растения, способна, благодаря своим химическим свойствам, легко удаляться из молекулы в процессе метаболизма, генерируя N6-незамещенное производное. Тозилатный же заместитель должен менее активно, чем Boc-группа, участвовать в метаболизме. Сравнение свойств соединений 8–11 может дать информацию о влиянии природы алкильной группы в положении N(3) молекулы на активность соединений.
Показано (табл. 1), что соль сиднонимина 2, в которой арильный заместитель представляет собой незамещенную фенильную группу, во всех использованных дозах являлась стимулятором роста кукурузы, причем эффект имел дозозависимый характер и достигал 64%. Соответствующее N6-Boc-производное 3 также проявляло свойства стимулятора роста, однако его эффект не был зависим от дозы и менее выражен (≈40%). В экспериментах на антидотную активность оба соединения 2 и 3 полностью устраняли гербицидный эффект метсульфурон-метила в дозе 2 г/га (Кгерб), снижавший рост кукурузы на 28%. Этот результат не может быть объяснен простой компенсацией гербицидного эффекта метсульфурон-метила ростстмулирующим действием соединений 2 и 3, поскольку оба соединения в дозах 0.5 и 1.0 г/т семян снижали эффект гербицида до абсолютно одинакового уровня, несмотря на существенное различие в величине ростстимулирующего действия, которое они показали в этих дозах.
Таблица 1.
Рострегулирующая и антидотная активность соединений 2–5 на тест-растениях кукурузы сорта Краснодарский 291 АМВ
| Вариант | Доза гербицида Зингер, СП | Надземная масса тест-растений, г | Снижение массы тест-растений, % к контролю* | ||||||
|---|---|---|---|---|---|---|---|---|---|
| соединение | доза, г/т семян | г/га | повторности | сред-няя | |||||
| 1 | 2 | 3 | 4 | 5 | |||||
| 2 | 0.25 | – | 5.6 | 6.2 | 5.3 | 6.0 | 5.7 | 5.8 | –23 |
| 0.5 | – | 7.4 | 7.4 | 8.0 | 7.2 | 6.8 | 7.4 | –57 | |
| 1.0 | – | 7.3 | 7.6 | 8.0 | 7.2 | 8.2 | 7.7 | –64 | |
| 0.25 | 2.0 | 4.4 | 3.6 | 4.3 | 4.3 | 4.8 | 4.3 | 9 | |
| 0.5 | 2.0 | 4.5 | 5.3 | 4.5 | 4.4 | 4.7 | 4.7 | 0 | |
| 1.0 | 2.0 | 4.4 | 5.7 | 5.0 | 4.4 | 5.1 | 4.9 | –4 | |
| 3 | 0.25 | – | 6.9 | 6.3 | 6.6 | 6.5 | 6.5 | 6.6 | –40 |
| 0.5 | – | 6.0 | 6.5 | 5.9 | 6.2 | 8.0 | 6.5 | –38 | |
| 1.0 | – | 6.4 | 6.0 | 6.3 | 7.0 | 6.2 | 6.4 | –36 | |
| 0.25 | 2.0 | 5.0 | 4.8 | 4.4 | 4.9 | 4.8 | 4.8 | –2 | |
| 0.5 | 2.0 | 4.6 | 5.0 | 4.7 | 4.3 | 5.0 | 4.7 | 0 | |
| 1.0 | 2.0 | 4.2 | 5.3 | 5.0 | 5.2 | 4.9 | 4.9 | –4 | |
| 4 | 0.25 | – | 7.7 | 7.8 | 8.1 | 6.9 | 7.1 | 7.5 | –60 |
| 0.5 | – | 7.1 | 6.2 | 6.5 | 5.1 | 6.1 | 6.2 | –32 | |
| 1.0 | – | 5.4 | 5.0 | 6.1 | 5.4 | 5.2 | 5.4 | –15 | |
| 0.25 | 2.0 | 3.7 | 3.5 | 3.1 | 3.4 | 3.4 | 3.4 | 28 | |
| 0.5 | 2.0 | 5.3 | 3.8 | 3.9 | 3.8 | 3.5 | 4.1 | 13 | |
| 1.0 | 2.0 | 3.8 | 4.7 | 3.8 | 3.8 | 4.2 | 4.1 | 13 | |
| 5 | 0.25 | – | 6.1 | 5.9 | 5.9 | 5.7 | 5.7 | 5.9 | –26 |
| 0.5 | – | 5.4 | 4.9 | 5.3 | 5.3 | 5.9 | 5.4 | –15 | |
| 1.0 | – | 7.3 | 6.5 | 7.0 | 7.8 | 6.5 | 7.0 | –49 | |
| 0.25 | 2.0 | 3.7 | 4.1 | 3.8 | 3.8 | 3.7 | 3.8 | 19 | |
| 0.5 | 2.0 | 6.4 | 5.2 | 5.5 | 5.3 | 5.6 | 5.6 | –19 | |
| 1.0 | 2.0 | 3.9 | 4.1 | 5.2 | 3.9 | 4.3 | 4.3 | 9 | |
| Контроль Кгерб | 2.0 | 3.4 | 3.1 | 3.4 | 3.5 | 3.5 | 3.4 | 28 | |
| Контроль Кводн | – | 4.7 | 4.7 | 4.2 | 5.0 | 4.7 | 4.7 | 0 | |
| НСР05 | 0.17 | ||||||||
* Отрицательные показатели – стимуляция роста растений. То же в табл. 2.
Сиднонимины 4 и 5, структурно родственные соединениям 2 и 3 и отличающиеся от них только наличием трифторометильной группы в арильном заместителе, также показали себя дозозависимыми стимуляторами роста кукурузы. Причем, если соль 4 наиболее эффективно стимулировала рост в минимальной дозе 0.25 г/т семян (60%), то в случае N6-Boc-производного 5 стимулирующий эффект был наиболее выражен (49%) в максимальной дозе. В присутствии гербицида оба соединения в дозах 0.5 и 1.0 г/т семян снижали его негативное влияние на рост кукурузы, а соединение 5 в дозе 0.5 г/т семян даже стимулировало рост растений. Интересно, что при этом оба соединения наиболее благоприятно влияли на рост кукурузы в тех дозах, в которых их ростстимулирующий эффект был наименее выражен. Более того, соединение 4 в дозе 0.25 г/т семян, в которой его ростстимулирующее действие было максимальным, в присутствии гербицида не оказало вообще никакого влияния на эффект последнего, а антидотный эффект сиднонимина 5 в дозе 0.5 г/т семян оказался настолько велик (стимуляция роста в присутствии гербицида на 19%), что превзошел его ростстимулирующий эффект в этой дозе в отсутствие гербицида (15%).
Влияние молекулярного строения производных сиднонимина на их рострегулирующие свойства было исследовано на 4-хлорофенилзамещенных соединениях 6–11 (табл. 2). Гидрохлорид 6 не стимулировал рост кукурузы. Более того, в дозе 0.5 г/т семян он проявил заметный гербицидный эффект, снижая рост тест-растений на 19%. Однако в присутствии метсульфурон-метила, гербицидный эффект которого в дозе 2.0 г/га (Кгерб) составлял в данном эксперименте 25%, соединение 6 показало дозозависимый антидотный эффект, который был наиболее выражен (полное устранение эффекта гербицида и стимуляция роста кукурузы на 14%) именно в дозе 0.5 г/т семян, в которой соединение 6 в отсутствие гербицида само действовало как гербицид.
Таблица 2.
Рострегулирующая и антидотная активность соединений 6–11 на тест-растениях кукурузы сорта Краснодарский 291 АМВ
| Вариант | Доза гербицида Зингер, СП | Надземная масса тест-растений, г | Снижение массы тест-растений, % к контролю* | ||||||
|---|---|---|---|---|---|---|---|---|---|
| соединение | доза, г/т семян | г/га | по повторностям | сред-няя | |||||
| 1 | 2 | 3 | 4 | 5 | |||||
| 6 | 0.25 | – | 3.7 | 3.4 | 3.5 | 3.9 | 3.8 | 3.7 | –3 |
| 0.5 | – | 3.2 | 2.8 | 2.8 | 2.8 | 2.9 | 2.9 | 19 | |
| 1.0 | – | 3.8 | 3.7 | 3.9 | 4.2 | 4.1 | 3.9 | –8 | |
| 0.25 | 2.0 | 3.3 | 3.5 | 3.1 | 3.3 | 3.1 | 3.3 | 8 | |
| 0.5 | 2.0 | 4.1 | 4.0 | 4.0 | 4.3 | 4.0 | 4.1 | –14 | |
| 1.0 | 2.0 | 2.8 | 3.1 | 3.6 | 2.9 | 3.0 | 3.1 | 14 | |
| 7 | 0.25 | – | 3.8 | 4.2 | 4.0 | 4.3 | 4.8 | 4.2 | –17 |
| 0.5 | – | 5.0 | 3.3 | 4.3 | 4.1 | 3.4 | 4.0 | –11 | |
| 1.0 | – | 5.8 | 5.2 | 4.8 | 5.3 | 4.8 | 5.2 | –44 | |
| 0.25 | 2.0 | 4.5 | 4.0 | 3.2 | 3.7 | 2.9 | 3.7 | –3 | |
| 0.5 | 2.0 | 3.2 | 3.6 | 3.4 | 3.1 | 3.7 | 3.4 | 6 | |
| 1.0 | 2.0 | 3.1 | 2.5 | 2.6 | 3.4 | 2.9 | 2.9 | 19 | |
| 8 | 0.25 | – | 4.1 | 5.4 | 3.6 | 4.5 | 4.7 | 4.5 | –25 |
| 0.5 | – | 3.1 | 3.9 | 3.8 | 4.0 | 2.9 | 3.5 | 3 | |
| 1.0 | – | 1.2 | 0.9 | 0.8 | 0.8 | 0.9 | 0.9 | 75 | |
| 0.25 | 2.0 | 3.0 | 3.3 | 3.1 | 3.1 | 3.1 | 3.1 | 14 | |
| 0.5 | 2.0 | 2.4 | 3.1 | 2.4 | 2.0 | 2.2 | 2.4 | 33 | |
| 1.0 | 2.0 | 1.2 | 1.2 | 1.1 | 1.3 | 1.2 | 1.2 | 67 | |
| 9 | 0.25 | – | 3.0 | 3.6 | 3.6 | 3.7 | 3.9 | 3.6 | 0 |
| 0.5 | – | 3.8 | 3.9 | 3.6 | 4.4 | 3.8 | 3.9 | –8 | |
| 1.0 | – | 3.6 | 3.5 | 3.7 | 3.6 | 3.4 | 3.6 | 0 | |
| 0.25 | 2.0 | 3.5 | 3.0 | 2.8 | 2.6 | 3.1 | 3.0 | 17 | |
| 0.5 | 2.0 | 3.1 | 3.3 | 3.3 | 3.2 | 2.6 | 3.1 | 14 | |
| 1.0 | 2.0 | 2.4 | 2.8 | 2.8 | 2.8 | 2.7 | 2.7 | 25 | |
| 10 | 0.25 | – | 4.3 | 4.0 | 3.6 | 3.5 | 3.8 | 3.8 | –6 |
| 0.5 | – | 4.2 | 4.6 | 3.8 | 4.5 | 4.0 | 4.2 | –17 | |
| 1.0 | – | 3.5 | 3.5 | 3.4 | 3.3 | 3.3 | 3.4 | 6 | |
| 0.25 | 2.0 | 2.6 | 2.8 | 3.6 | 3.1 | 3.2 | 3.1 | 14 | |
| 0.5 | 2.0 | 2.4 | 2.7 | 2.3 | 3.1 | 2.6 | 2.6 | 28 | |
| 1.0 | 2.0 | 2.0 | 2.3 | 2.5 | 2.4 | 2.3 | 2.3 | 36 | |
| 11 | 0.25 | – | 4.5 | 4.0 | 3.3 | 4.1 | 4.5 | 4.1 | –14 |
| 0.5 | – | 3.8 | 3.4 | 3.3 | 3.7 | 3.5 | 3.5 | 3 | |
| 1.0 | – | 3.1 | 3.6 | 3.1 | 3.4 | 3.7 | 3.4 | 6 | |
| 0.25 | 2.0 | 3.2 | 3.7 | 3.2 | 2.9 | 2.8 | 3.2 | 11 | |
| 0.5 | 2.0 | 2.9 | 2.7 | 3.2 | 2.3 | 2.5 | 2.7 | 25 | |
| 1.0 | 2.0 | 3.3 | 4.0 | 4.3 | 3.6 | 4.7 | 4.0 | –11 | |
| Контроль Кгерб. | 2.0 | 3.1 | 3.4 | 2.4 | 2.0 | 2.7 | 2.7 | 25 | |
| Контроль Кводн. | – | 4.0 | 3.9 | 3.2 | 3.3 | 3.6 | 3.6 | 0 | |
| НСР05 | 0.21 | ||||||||
N6-Тозильное производное 7 показало себя дозозависимым стимулятором роста кукурузы. Максимальный стимулирующий эффект (44%) это соединение проявило в дозе 1.0 г/т семян. Однако в присутствии метсульфурон-метила сиднонимин 7 в дозе 1.0 г/т семян сильного влияния на эффект гербицида не оказал. Между тем, в более низких дозах (0.25 и 0.5 г/т семян), в которых соединение 7 в отсутствие гербицида показывало наименьшую стимуляцию роста тест-растений, оно полностью устраняло негативное действие метсульфурон-метила.
N6-Boc-замещенный сиднонимин 8, содержащий в положении N(3) изопропильную группу, в дозе 0.25 г/т семян стимулировал рост кукурузы. Однако в дозе 0.5 г/т семян он на рост растений уже не влиял, а в дозе 1.0 г/т семян показал ярко выраженные гербицидные свойства, снижая рост кукурузы на 75%. В отличие от своего структурного N6-тозильного аналога 7, антидотными свойствами соединение 8, по-видимому, не обладало, а некоторое снижение гербицидного эффекта метсульфурон-метила в присутствии 8 в дозе 0.25 г/т семян, очевидно, объясняется вкладом ростстимулирующего эффекта соединения 8, проявляемого именно в этой дозе.
Замена изопропильного заместителя в положении N(3) молекулы 8 на пропильную группу приводит к сиднонимину 9, который, как показали эксперименты, в исследованных дозах не оказывал статистически достоверного влияния на рост кукурузы. Некоторое снижение гербицидного эффекта метсульфурон-метила в присутствии соединения 9 в дозах 0.25 и 0.5 г/т семян можно объяснить наличием у этого соединения слабо выраженных антидотных свойств. Соединение 10, 3-этилзамещенный аналог сиднониминов 8 и 9, антидотными свойствами, очевидно, не обладал, в отличие от 3-метилзамещенного производного 11, которое в дозе 1.0 г/т семян не только полностью устраняло гербицидный эффект метсульфурон-метила, но даже приводило к некоторой стимуляции роста кукурузы, хотя в отсутствие гербицида ростстимулирующих свойств не проявляло. Совершенно аналогичное влияние длины алкильной цепи в положении N(3) сиднониминов, не имеющих заместителя в положении C(4), на их рострегулирующие свойства наблюдали ранее [9].
Таким образом, с точки зрения взаимосвязи “структура–активность”, на рострегулирующие свойства сиднониминов влияли заместители в положениях N6 и N(3) этих мезоионных соединений, а также заместитель в пара-положении арильной группы, присутствующей во фрагменте, присоединенном к атому C(4) мезоионного гетероцикла. Однако прямой взаимосвязи между присутствием в молекуле сиднонимина определенных заместителей и наличием у соединения конкретного вида рострегулирующей активности (ростстимулирующей, гербицидной, антидотной) обнаружено не было. Получены дополнительные свидетельства справедливости выводов более ранней работы авторов [9] о том, что разветвленная алкильная (изопропильная) или метильная группа в положении N(3) способствует появлению активности, в то время как соединения с неразветвленными алкильными группами в этом положении не активны.
Выше приведен лишь качественный анализ данных, представленных в табл. 1 и 2, с целью выявления результатов, которые могут указывать на наличие среди исследованных веществ соединений с антидотной активностью. Однако для корректной интерпретации экспериментальных результатов необходимо проанализировать их на количественном уровне, чтобы отличить случаи проявления тестируемыми соединениями истинно антидотной активности от случаев компенсации гербицидного эффекта метсульфурон-метила ростстимулирующими эффектами сиднониминов. Для этого было проведено сопоставление экспериментальных данных рострегулирующего эффекта комбинаций производных сиднонимина с метсульфурон-метилом с соответствущими величинами, ожидаемыми на основании расчета. Величину рострегулирующего эффекта комбинации тестируемого соединения с метсульфурон-метилом можно рассчитать с помощью формулы (1) [16].
где E – ожидаемый рост в присутствии 2-х активных веществ X и Y (взятых в использованных в эксперименте дозах), выраженный в процентах от контроля;x – экспериментальная величина роста в присутствии активного вещества X (взятого в соответствующей дозе), выраженное в процентах от контроля;
y – экспериментальная величина роста в присутствии активного вещества Y (взятого в соответствующей дозе), выраженное в процентах от контроля.
Величины x и y могут быть вычислены из экспериментальных величин ингибирования роста, выраженных в процентах от контроля, по формулам (2) и (3):
где x' – экспериментальная величина ингибирования роста (в процентах от контроля) активным веществом X (взятым в соответствующей дозе); y' – экспериментальная величина ингибирования роста (в процентах от контроля) активным веществом Y (взятым в соответствующей дозе).Формула (1) предполагает, что 2 активных вещества воздействуют на рост растений независимо друг от друга (не влияют на активность друг друга). Тогда, например, если каждое из веществ, взятых в определенных дозах, снижает рост в 2 раза, то комбинация этих веществ в тех же дозах должна снижать рост в 4 раза. Если же эксперимент показывает отличие реального результата от расчетного, то это свидетельствует о наличии влияния одного вещества на активность другого.
Например, данные табл. 1 показали, что стимуляция роста кукурузы соединением 5 в дозе 0.5 г/т семян составляла 15%, при этом метсульфурон-метил в дозе 2.0 г/га снижал рост на 28%, т.е. величина роста кукурузы от контроля Кводн составляла для этих случаев соответственно 100 + + 15 = 115% и 100 – 28 = 72%. Тогда расчет по формуле (1) показал, что при независимом друг от друга влиянии обоих активных соединений на рост кукурузы результат одновременного действия соединения 5 и метсульфурон-метила в указанных дозах должен ожидаться на уровне (115 × 72) : 100 = 83%, т.е. должно наблюдаться ингибирование роста кукурузы на 17% по сравнению с Кводн. Между тем в эксперименте наблюдали стимуляцию роста на 19% (т.е. 119% от Кводн). Таким образом, разность между наблюдаемой и ожидаемой величиной рострегулирующего эффекта комбинации сиднонимина 5 и гербицида является весьма значительной и составляет 119 ‒ 83 = 36%. Положительная разность указывает на то, что соединение 5 в дозе 0.5 г/т семян подавляло гербицидное действие метсульфурон-метила, т.е. проявляло выраженный антагонистический эффект.
Напротив, стимуляция роста кукурузы соединением 2 в дозе 1.0 г/т семян составляла 64%, при этом метсульфурон-метил в дозе 2.0 г/га снижал рост на 28%, т.е. прирост кукурузы от контроля Кводн составлял для этих случаев соответственно 100 + 64 = 164% и 100 – 28 = 72%. Тогда расчет по формуле (1) показывает, что совместный результат одновременного действия соединения 2 и метсульфурон-метила в указанных дозах должен ожидаться на уровне (164 × 72) : 100 = 118%, т.е. должны наблюдать стимуляцию роста кукурузы на 18% по сравнению с Кводн. Между тем в эксперименте наблюдали стимуляцию роста только на 4% (т.е. 104% от Кводн). Разность между наблюдаемой и ожидаемой величиной рострегулирующего эффекта была существенна и составляла 104 ‒ 118 = –14%. Отрицательная разность указывала на то, что в данном случае именно гербицид подавлял ростстимулирующее действие соединения 2 в дозе 1.0 г/т семян, не давая ему проявиться в полной мере, т.е. гербицид антагонизировал стимулятору роста.
В табл. 3 приведены полученные из данных табл. 1 и 2 экспериментальные (Eэксп) и рассчитанные (Eрасч) по формуле (1) величины рострегулирующего эффекта для комбинаций сиднониминов 2–11 и гербицида метсульфурон-метил, а также разность Eэксп – Eрасч (в %). Небольшие величины этой разности (независимо от знака) свидетельствовали о том, что производное сиднонимна и гербицид проявляли свои рострегулирующие свойства независимо друг от друга, и общий эффект от комбинации 2-х соединений соответствовал расчетному. Большие разности указывали на антагонизм между сиднонимином и гербицидом, причем если разность была положительной, то сиднонимин являлся антагонистом гербицида, а если разность была отрицательной, то гербицид антагонизировал действию сиднонимина. Однако последнее заключение справедливо лишь в тех случаях, когда испытанное соединение является стимулятором роста; если оба соединения являются гербицидами, то вопрос о том, кто из них оказывал антидотное действие по отношению к другому, остается открытым (примером является комбинация метсульфурон-метила и сиднонимина 8 в дозе 1.0 г/т семян). Данные табл. 3 показали, что среди исследованных в работе сиднониминов 2–11 соединения 5–7 и 11 при использовании в соответствующих дозах обладали свойствами антагонистов метсульфурон-метила.
Таблица 3.
Эффект комбинации сиднониминов 2–11 и гербицида метсульфурон-метил на рост кукурузы сорта Краснодарский 291 АМВ
| Сиднонимин | Доза гербицида, г/га | Рострегулирующий эффект E, % к контролю (Кводн = 100%) | Eэксп – Eрасч, % | ||
|---|---|---|---|---|---|
| номер | доза, г/т семян | эксперимент, Eэксп. | расчет по формуле (1), Eрасч. | ||
| 2 | 0.25 | 2.0 | 91 | 89 | 2 |
| 0.5 | 2.0 | 100 | 113 | –13 | |
| 1.0 | 2.0 | 104 | 118 | –14 | |
| 3 | 0.25 | 2.0 | 102 | 101 | 1 |
| 0.5 | 2.0 | 100 | 99 | 1 | |
| 1.0 | 2.0 | 104 | 102 | 2 | |
| 4 | 0.25 | 2.0 | 72 | 115 | –43 |
| 0.5 | 2.0 | 87 | 95 | –8 | |
| 1.0 | 2.0 | 87 | 83 | 4 | |
| 5 | 0.25 | 2.0 | 81 | 91 | –10 |
| 0.5 | 2.0 | 119 | 83 | 36 | |
| 1.0 | 2.0 | 91 | 107 | –16 | |
| 6 | 0.25 | 2.0 | 92 | 77 | 15 |
| 0.5 | 2.0 | 114 | 61 | 53 | |
| 1.0 | 2.0 | 86 | 81 | 5 | |
| 7 | 0.25 | 2.0 | 103 | 88 | 15 |
| 0.5 | 2.0 | 94 | 83 | 11 | |
| 1.0 | 2.0 | 81 | 108 | –27 | |
| 8 | 0.25 | 2.0 | 86 | 94 | –8 |
| 0.5 | 2.0 | 67 | 73 | –6 | |
| 1.0 | 2.0 | 33 | 19 | 14 | |
| 9 | 0.25 | 2.0 | 83 | 75 | 8 |
| 0.5 | 2.0 | 86 | 81 | 5 | |
| 1.0 | 2.0 | 75 | 75 | 0 | |
| 10 | 0.25 | 2.0 | 86 | 80 | 6 |
| 0.5 | 2.0 | 72 | 88 | –16 | |
| 1.0 | 2.0 | 64 | 71 | –7 | |
| 11 | 0.25 | 2.0 | 89 | 86 | 3 |
| 0.5 | 2.0 | 75 | 73 | 2 | |
| 1.0 | 2.0 | 111 | 71 | 40 | |
ЗАКЛЮЧЕНИЕ
Таким образом, N(3)-алкилзамещенные 4-(арилгидроксиметил)сиднонимины при использовании для предпосевной обработки семян кукурузы в дозах 0.25–1.0 г/т семян стимулировали рост надземной части растений (до 64%). Впервые показано, что некоторые производные сиднонимина в указанных дозах проявляли свойства антидотов гербицидов, снижая или полностью устраняя гербицидный эффект метсульфурон-метила, присутствующего в почве в дозе 2.0 г/га. Оба эффекта имели дозозависимый характер. Изучение взаимосвязи “структура–активность” показало, что на ростстимулирующий и антидотный эффекты оказывали влияние строение алкильного заместителя в положении N(3), характер заместителя в положении N6 и заместитель в пара-положении арильного заместителя спиртового фрагмента при C(4).
Список литературы
Спиридонов Ю.Я. Последействие сульфонилмочевиновых гербицидов в почвах РФ // Вестн. защиты раст. 2009. № 3. С. 10–19.
Спиридонов Ю.Я., Хохлов П.С., Шестаков В.Г. Антидоты гербицидов // Агрохимия. 2009. № 5. С. 81–91.
Davies J. Herbicide safeners – commercial products and tools for agrochemical research // Pestic. Outlook. 2001. V. 12. № 1. P. 10–15.
Abu-Qare A.W., Duncan H.J. Herbicide safeners: uses, limitations, metabolism, and mechanisms of action // Chemosphere. 2002. V. 48. № 9. P. 965–974.
Sivey J.D., Lehmler H.-J., Salice C.J., Ricko A.N., Cwiertny D.M. Environmental fate and effects of dichloroacetamide herbicide safeners: “Inert” yet biologically active agrochemical ingredients // Environ. Sci. Technol. Lett. 2015. V. 2. № 10. P. 260–269.
Rosinger C., Bartsch K., Schulte W. Safeners for herbicides // Modern crop protection compounds (2nd ed.) / Kraemer W. 2012. V. 1. P. 371–397.
Tang X., Zhou X., Wu J., Li J., Bai L. A novel function of sanshools: the alleviation of injury from metolachlor in rice seedlings // Pest. Biochem. Physiol. 2014. V. 110. № 1. P. 44–49.
Ольшевская В.А., Черепанов И.А., Спиридонов Ю.Я., Спиридонова Г.С., Макаренков А.В., Самарская А.С., Пономарев А.Б., Моисеев С.К. Гербицидная активность производных карборанов, сиднонимина, ферроцена // Агрохимия. 2017. № 4. С. 16–21.
Черепанов И.А., Спиридонов Ю.Я., Чичварина О.А., Самарская А.С., Пономарев А.Б., Моисеев С.К. Ростстимулирующая активность производных сиднонимина // Агрохимия. 2018. № 9. С. 50–55.
Cherepanov I.A., Shevaldina E.V., Lapshin D.A., Spiridonov Yu.Ya., Abubikerov V.A., Moiseev S.K. 4‑Lithiosydnone imines: generation and stability. Plant growth regulating activity of 4–hydroxymethyl derivatives of sydnone imines // J. Organometal. Chem. 2021. V. 943. 121841.
Граник В.Г., Рябова С.Ю., Григорьев Н.Б. Экзогенные доноры оксида азота и ингибиторы его образования (химический аспект) // Усп. химии. 1997. Т. 66. № 8. С. 792–807.
Rőszer T. The Biology of subcellular nitric oxide. Dordrecht– Heidelberg–London–N.Y.: Springer, 2012. 209 p.
Shapiro A.D. Nitric oxide signaling in plants // Vitam. Horm. 2005. V. 72. P. 339–398.
Tsukagoshi H. Control of root growth and development by reactive oxygen species // Curr. Opin. Plant Biol. 2016. V. 29. P. 57–63.
Cherepanov I.A., Samarskaya A.S., Godovikov I.A., Lyssenko K.A., Pankratova A.A., Kalinin V.N. N6-tert-Butoxycarbonyl derivatives of sydnone imines: preparation and synthetic use // Tetrahedron Lett. 2018. V. 59. № 8. P. 727–729.
Colby S.R. Calculating synergistic and antagonistic responses of herbicide combinations // Weeds. 1967. V. 15. № 1. P. 20–22.
Дополнительные материалы отсутствуют.