Агрохимия, 2023, № 1, стр. 49-56
Действие штаммов бактерий с разной способностью к синтезу ауксинов и цитокининов на рост и водный обмен растений пшеницы
Е. В. Мартыненко 1, *, Т. Н. Архипова 1, З. А. Ахтямова 1, Л. Ю. Кузьмина 1
1 Уфимский Институт биологии УФИЦ РАН
450054 Уфа, просп. Октября, 69, Россия
* E-mail: evmart08@mail.ru
Поступила в редакцию 05.05.2022
После доработки 26.07.2022
Принята к публикации 14.10.2022
- EDN: GOFTGP
- DOI: 10.31857/S0002188123010064
Аннотация
Оценили содержание цитокининов, ауксинов, хлорофилла, транспирацию, содержание и относительное содержание воды, водный и осмотический потенциалы, гидравлическую проводимость, морфологические параметры растений твердой пшеницы (Triticum durum Desf.) после введения в их ризосферу штаммов цитокининпродуцирующих (Bacillus subtilis IB-22) или ауксинпродуцирующих (Pseudomonas mandelii IB-Кi14) бактерий. Эксперименты проводили в лабораторных условиях в сосудах с агрочерноземом при оптимальном уровне освещенности. Показано, что цитокининпродуцирующий штамм в большей степени стимулировал рост растений, накопление хлорофилла, увеличение транспирации по сравнению с растениями, обработанными ауксинпродуцирующим штаммом. Растения под влиянием штамма B. subtilis IB-22 теряли больше воды при транспирации, при этом снижения уровня оводненности и тургора не происходило. Сделан вывод о том, что “бактериальные цитокинины” влияют на водный обмен растений пшеницы за счет увеличения гидравлической проводимости, а “бактериальные ауксины” – в большей степени за счет осмотической регуляции. Более выраженную стимуляцию роста растений бактериями штамма B. subtilis IB-22 можно объяснить также способностью цитокининов в большей степени влиять на содержание хлорофилла по сравнению с ауксинами.
ВВЕДЕНИЕ
Одной из главнейших отраслей мирового сельского хозяйства остается производство зерна. Пшеница является важнейшей сельскохозяйственной культурой, требовательной к условиям выращивания. Повышение ее урожайности всегда является актуальной задачей. В последнее время для активации роста растений и увеличения урожайности стали использовать ростстимулирующие бактерии. Механизм их положительного влияния на растения до конца не известен, однако часто ростстимулирующее действие некоторых микроорганизмов на растения связывают с их способностью синтезировать фитогормоны [1–3]. Присутствие в ризосфере микроорганизмов, продуцирующих гормоны, способно влиять на содержание гормонов и в почве, и в растениях. В свою очередь это может иметь значение для роста растений [4, 5].
Активация роста растений под влиянием ризосферных бактерий сопровождается увеличением площади листьев, с которой испаряется вода, способствуя возрастанию транспирации, что может привести к снижению оводненности листьев. Тем не менее, этого не происходит, и во многих публикациях сообщается о том, что присутствие в ризосфере ростстимулирующих бактерий не снижает содержание воды в растениях [1, 6, 7]. Эти результаты свидетельствуют о том, что бактерии влияют не только на рост растений, но и на водный обмен. Однако сведений о сравнении влияния на растения разных продуцируемых бактериями гормонов, участвующих в регуляции водного обмена, недостаточно. В своих экспериментах ранее мы использовали либо ауксин-, либо цитокининпродуцирующие бактерии, которые оказывали ростстимулирующее действие на растения пшеницы. Поэтому представляло интерес выяснить, как проявят себя бактерии, синтезирующие разные фитогормоны (цитокинины или ауксины), в одном эксперименте.
Цель работы – изучение влияния на рост и водный обмен растений пшеницы ризосферных микроорганизмов в зависимости от их способности продуцировать ауксины либо цитокинины.
МЕТОДИКА ИССЛЕДОВАНИЯ
В качестве объекта для сравнения влияния ростстимулирующих бактерий с разной способностью к синтезу ауксинов и цитокининов на рост и водный обмен растений использовали твердую яровую пшеницу Triticum durum Desf. сорта Башкирская 27.
Для инокуляции растений использовали грамположительные аэробные спорообразующие цитокининпродуцирующие бактерии Bacillus subtilis IB-22 (GenBank MT590663) [8] и грамотрицательные ауксинпродуцирующие бактерии Pseudomonas mandelii IB-Кi14 (ВКМ В-3250) [9] из коллекции микроорганизмов Уфимского института биологии УФИЦ РАН. Бактериальные препараты получали культивированием штаммов на средах: B. subtilis IB-22 – на среде К1G [10], P. mandelii IB-Кi14 – на среде Кинг Б [11]. Штаммы микроорганизмов культивировали в колбах Эрленмейера с соответствующей питательной средой на шейкере (160 об./мин): бациллы – в течение 72 ч при температуре 37°С, грамотрицательные бактерии – 48 ч при 28°С.
Исследования проводили в лабораторных условиях. Для обеспечения дренажа слой гравия помещали на дно сосудов объемом 500 см3. После установки стеклянной трубки для газообмена сосуды заполняли 0.45 кг сухой почвы (агрочернозем, характеризующийся средней гумусированностью (6.3%), слабокислой реакцией среды), содержащей 10% песка [12]. За 3-е сут до начала эксперимента почву в сосудах поливали водой до 100% ППВ. Семена пшеницы стерилизовали, замачивая их в растворе 96%-ного этанола и 3%-ного Н2О2 (1 : 1, v/v) в течение 5 мин и затем многократно промывали дистиллированной водой. В каждый сосуд помещали 12 семян, одновременно внося по 1 мл бактериальной суспензии на семя (107 КОЕ/мл). Растения выращивали на светоплощадке с освещенностью 420 ммоль/м2/с PAR, 14-часовым фотопериодом при 24°C. В качестве контроля использовали сосуды с растениями, выращенными в почве без внесения бактерий. Влажность почвы поддерживали на уровне 70% ППВ, поливая растения дистиллированной водой. Количество необходимой для полива воды рассчитывали, ежедневно взвешивая сосуды с растениями. Через 14 сут с момента инокуляции растений оценивали сырую и сухую массу корней и побегов, площадь листьев. Показатели водного обмена – транспирацию, содержание воды в корнях и листьях, относительное содержание воды (ОСВ) в зрелом первом листе, осмоляльность листьев, водный потенциал почвы и побега, гидравлическую проводимость оценивали на 13-е сут с начала эксперимента.
Транспирацию измеряли весовым методом на 13-е сут с начала эксперимента в течение 4 ч, предварительно закрывая почву для предотвращения испарения воды. Интенсивность транспирации рассчитывали по уменьшению массы сосудов с растениями, поделенной на время между измерениями и на количество растений в сосуде (для измерения транспирации использовали 4 сосуда в варианте).
Оводненность листьев рассчитывали по формуле: ((сырая масса – сухая масса) / сырая масса) × 100%. Для определения относительного содержания воды сформированный первый лист нескольких растений взвешивали и погружали основанием в дистиллированную воду, налитую в стеклянный сосуд, который затем закрывали для насыщения воздуха влагой и помещали в темноту при комнатной температуре. Через 24 ч листья взвешивали для определения тургорной массы, высушивали и рассчитывали показатель ОСВ по формуле: ОСВ = ((сырая масса – сухая масса)/(тургорная масса – сухая масса)) × 100%.
Образцы для измерения осмотического потенциала были получены путем замораживания и оттаивания тканей побегов и последующего центрифугирования. Осмотический потенциал полученного клеточного сока измеряли с помощью цифрового микроосмометра (CAMLAB Limited, UK).
Водный потенциал побега (зрелого листа) и почвы оценивали с помощью психрометра (PSYPRO, “Wescor”, США).
Гидравлическую проводимость при транспорте воды из корней в листья (L) рассчитывали по формуле: L = T/[(Ψs–Ψl)*Р], где T – транспирация, Р – масса корней, Ψs и Ψl – водный потенциал почвы и листа соответственно (модифицировано по [13]).
Содержание хлорофилла в листьях оценивали с помощью прибора DUALEX SCIENTIFIC+ (FORCE-A, France) на 14-е сути эксперимента.
Для анализа гормонов отбирали образцы побегов и корней 5-ти растений из разных сосудов (n = 6). Гормоны экстрагировали в течение 16 ч 80%-ным этанолом в соотношении 1 : 10. Затем отделенный фильтрацией спиртовой экстракт упаривали до водного остатка. Ауксины (ИУК) экстрагировали диэтиловым эфиром, как описано в [14] из половины водного остатка. Определение содержания цитокининов (суммы зеатина, его рибозида и нуклеотида) проводили после очистки и концентрирования другой половины водного остатка на картридже С18 (Waters Corporation, USA) и хроматографического разделения форм цитокининов [15]. Количественное определение гормонов проводили с помощью твердофазного иммуноферментного анализа с использованием специфических антител, как описано в [16].
Статистическую обработку данных проводили по стандартным программам MS Excel. На рисунках и в таблицах представлены средние и ошибки средних. Достоверность различий оценивали по t-критерию Стьюдента.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Введение бактерий в ризосферу растений пшеницы увеличивало массу побегов и площадь листьев по сравнению с соответствующим контролем, что свидетельствовало о стимуляции роста растений (табл. 1). Отмечено увеличение сырой массы побегов: на 30% по сравнению с контрольными растениями под влиянием цитокининпродуцирующих бацилл. В варианте с псевдомонадами прибавка массы побега была меньше (17% по отношению к контрольным растениям). При этом сырая масса корней была меньше всего у растений, обработанных бациллами (на 19% меньше, чем в контроле), что соответствует данным о способности цитокининов (в том числе продуцируемых бактериями этого штамма) подавлять рост корней [17].
Таблица 1.
Морфологические параметры роста 14-суточных растений твердой яровой пшеницы Triticum durum Desf. (сырая масса корней (n = 10), побегов (n = 40) и площадь листьев (n = 40)) при интродукции в ризосферу гормонпродуцирующих бактерий
| Вариант | Сырая масса корней | Сырая масса побегов | Площадь листьев, см2/растение |
|---|---|---|---|
| мг/растение | |||
| Контроль без обработки | 96 ± 11б | 305 ± 8а | 15.2 ± 0.7а |
| P. mandelii IB-Кi14 | 90 ± 8б | 357 ± 13б | 19.3 ± 0.6б |
| B. subtilis IB-22 | 77 ± 6а | 395 ± 10в | 21.1 ± 0.8в |
Примечание. Указаны средние и их ошибки. Значимые различия между средними в столбцах обозначены различными буквами (p ≤ 0.05, t-test). То же в табл. 2.
В присутствии цитокининпродуцирующей бактерии B. subtilis IB-22 наблюдали большее увеличение площади листьев растений пшеницы по сравнению с растениями, инокулированными P. mandelii IB-Кi14: под влиянием псевдомонад площадь листьев увеличивалась на 27, а под влиянием бацилл – на 40% соответственно.
Интродукция бактерий в ризосферу повышала содержание ауксинов в корнях растений, обработанных псевдомонадами (рис. 1), в то время как по содержанию ауксинов в побегах не было достоверных различий между вариантами.
Рис. 1.
Содержание ауксинов (ИУК) в корнях (а) и побегах (б) растений пшеницы на 6-е сут после воздействия P. mandelii IB-Ki14 и B. subtilis IB-22. Звездочками обозначены средние, достоверно отличающиеся от контроля (n = 6, p ≤ 0.05, t-test).

Введение в ризосферу растений цитокининпродуцирующей бактерии B. subtilis IB-22 приводило к наибольшому увеличению содержания цитокининов в побегах и корнях растений пшеницы (рис. 2). Накопление происходило в основном за счет зеатина, в меньшей степени - за счет зеатинрибозида. Под воздействием псевдомонад было отмечено небольшое увеличение содержания цитокининов в побегах растений по сравнению с контролем за счет накопления зеатиннуклеотида.
Рис. 2.
Содержание цитокининов (Z – зеатин, ZN – зеатиннуклеотид, ZR – зеатинрибозид) в корнях (а) и побегах (б) растений пшеницы на 6-е сут после воздействия P. mandelii IB-Ki14 и B. subtilis IB-22. Звездочками обозначены средние, достоверно отличающиеся от контроля (n = 6, p ≤ 0.05, t-test).

Такое накопление ауксинов и цитокининов в растениях могло быть обусловлено поглощением гормонов, продуцируемых бактериями. Хотя не во всех случаях повышение уровня гормонов под влиянием бактерий можно было объяснить способностью бактерий продуцировать эти гормоны [18], действие P. mandelii IB-Кi14 и B. subtilis IB-22 на содержание ауксинов и цитокининов в растениях соответствовало их способности синтезировать данные гормоны. Как цитокинины, так и ауксины относятся к гормонам стимулирующего типа действия по отношению к побегам растений. Тем не менее, повышение концентрации цитокининов в растениях под влиянием бацилл оказывало более заметное стимулирующее действие на рост побега, чем повышение содержания ауксинов.
Бактеризация приводила к увеличению транспирации растений в расчете на целый лист (табл. 2), что могло быть следствием как увеличения площади листьев, так и открытия устьиц. При расчете на единицу площади в варианте с обработкой псевдомонадами этот показатель оставался на уровне контрольных растений (10.9 мг/см2/ч в варианте обработки P. mandelii IB-Кi14 по сравнению с 11.3 мг/см2/ч в контроле). А в случае обработки B. subtilis IB-22 потери воды на единицу площади были на 30% больше, чем в контроле (14.6 мг/см2/ч по сравнению с 11.3 мг/см2/ч). Транспирация при воздействии бацилл возрастала в меньшей степени при расчете на единицу площади, чем на целый лист.
Таблица 2.
Транспирация и гидравлическая проводимость растений пшеницы на 13-е сут при интродукции в ризосферу гормонпродуцирующих бактерий
| Вариант | Транспирация | Гидравлическая проводимость, мг H2O/ч/МПа/мг корней | |
|---|---|---|---|
| мг/растение/ч | мг/см2/ч | ||
| Контроль | 171 ± 6а | 11.3 ± 0.9а | 11.9 ± 2.0а |
| P. mandelii IB-Кi14 | 211 ± 3б | 10.9 ± 0. 5а | 9.2 ± 1.5а |
| B. subtilis IB-22 | 308 ± 12в | 14.6 ± 1.1б | 17.3 ± 2.7б |
Очевидно, при обработке псевдомонадами более высокий уровень транспирации у инокулированных растений был обусловлен большей площадью листьев, с которой испарялась вода, в то время как по скорости потерь воды в расчете на единицу площади обработанные растения были на уровне контроля. Для варианта обработки бациллами отмечено увеличение транспирации и в расчете на целое растение, и на единицу площади (30% по сравнению с контролем). Это означает, что с единицы площади испарялось большее количество воды, чем у контрольных растений. Эти результаты свидетельствовали о возрастании устьичной проводимости под влиянием бацилл, что соответствовало сведениям о способности цитокининов, продуцируемых бактериями данного штамма, поддерживать устьица в открытом состоянии [19].
По содержанию воды в побегах и корнях и ОСВ в листьях не было обнаружено достоверных различий между растениями разных вариантов обработки (рис. 3). При воздействии бациллами величина водного потенциала листьев достоверно не отличалась от контроля. Важно было понять, каким образом растения смогли поддерживать оводненность своих тканей, несмотря на повышение скорости потери воды с транспирацией под влиянием бактерий.
Рис. 3.
Содержание воды в корнях (а), ОСВ и содержание воды в побегах (б) растений пшеницы (n = 7) на 13-е сут после воздействия P. mandelii IB-Ki14 и B. subtilis IB-22.

Отмечено снижение водного потенциала в варианте с обработкой псевдомонадами, что способствовало увеличению движущей силы для подъема воды из корней (рис. 4). При этом наблюдали достоверное снижение осмотического потенциала листьев растений, обработанных ауксинпродуцентами по сравнению с контрольными растениями, что обеспечивало поддержание тургора.
Рис. 4.
Водный и осмотический потенциал листьев пшеницы на 13-е сут после воздействия P. mandelii IB-Ki14 и B. subtilis IB-22. Звездочками обозначены средние, достоверно отличающиеся от контроля (n = 5, p ≤ 0.05, t-test).
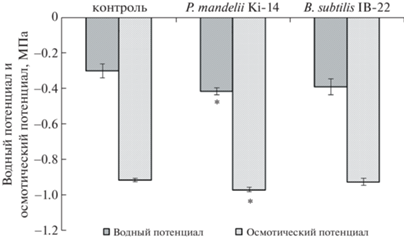
Но насколько эти небольшие изменения функционально значимы для растений, неизвестно. Можно предположить, что они играют роль в стабилизации водного баланса растений в данном варианте обработки.
Уже давно было замечено, что гидравлическая проводимость меняется в соответствие с транспирационным запросом: возрастает у транспирирующих растений и снижается в отсутствии транспирации [20–22]. Это соответствует полученным нами данным, когда при обработке B. subtilis IB-22 отмечали большее испарение, сопровождавшееся увеличением гидравлической проводимости. Возрастание этого показателя с увеличением транспирационного потока обеспечивало поддержание баланса между поглощением и испарением воды. Изменение гидравлической проводимости корней могло быть обусловлено модуляцией активности аквапоринов. В литературе была показана способность бактерий повышать экспрессию генов, кодирующих аквапорины растений кукурузы [23], но требуются дальнейшие исследования для того, чтобы проверить, каким образом влияли бациллы на активность аквапоринов.
Транспирация растений пшеницы при обработке P. mandelii IB-Ki14 была больше, чем в контроле (табл. 2). Бактерии стимулировали рост, что свидетельствовало о том, что растения справлялись с возросшими потерями воды. У растений пшеницы под воздействием бацилл транспирация была еще выше, чем у растений, обработанных псевдомонадами. Несмотря на это, снижения оводненности растений не происходило, вероятно, за счет того, что “бактериальные гормоны” – цитокинины, синтезируемые B. subtilis IB-22, в большей степени способствовали поддержанию оводненности на уровне контроля за счет увеличения гидравлической проводимости. В то же время ауксины, продуцируемые P. mandelii IB-Кi14, могли влиять на водный обмен за счет осморегуляции.
В ходе эксперимента зарегистрировали повышение содержания хлорофилла в обработанных бактериями растениях, при этом больший эффект проявлялся при обработке B. subtilis IB-22 (рис. 5). Это могло быть обусловлено продукцией цитокининов данным штаммом, поскольку физиологическая роль этого фитогормона в клетках растений многообразна и включает регуляцию многих процессов, лежащих в основе жизнедеятельности растений на протяжении всего онтогенеза, в том числе и фотосинтеза [24]. Повышение уровня хлорофилла должно вносить существенный вклад в процесс накопления биомассы растений, и этим можно объяснять бóльшую ростстимулирующую способность B. subtilis IB-22.
ЗАКЛЮЧЕНИЕ
Сравнительное изучение влияния воздействия штаммов бактерий, продуцирующих либо цитокинины (B. subtilis IB-22), либо ауксины (P. mandelii IB-Кi14), выявило их способность повышать содержание в растениях пшеницы тех гормонов, которые синтезировали данные бактерии. Оба штамма бактерий стимулировали рост растений. Тем не менее, можно отметить наиболее выраженное положительное влияние цитокининпродуцентов на рост и водный обмен растений пшеницы, что предположительно можно связать с продукцией цитокининов бактериями. Бóльшую эффективность штамма бацилл можно объяснить тем, что под их влиянием возрастал уровень устьичной проводимости и газообмена (о чем свидетельствовал более высокий уровень транспирации в расчете на единицу площади), а также содержание хлорофилла, что способствовало активации фотосинтеза. Оба эти показателя контролируют цитокинины, и увеличение уровня этих гормонов под влиянием бацилл очевидно было тем фактором, который способствовал большей стимуляции роста растений по сравнению с псевдомонадами.
Список литературы
Dodd I.C., Zinovkina N.Y., Safronova V.I., Belimov A.A. Rhizobacterial mediation of plant hormone status // Ann. Appl. Biol. 2010. V. 157. P. 361–379. https://doi.org/10.1111/j.1744-7348.2010.00439.x
Spaepen S., Vanderleyden J. Auxin and plant-microbe interactions. // Cold Spring Harb. Perspect. Biol. 2011. V. 3(4). https://doi.org/10.1101/cshperspect.a001438
Shi T.-Q., Peng H., Zeng S.-Y., Ji R.-Y., Shi K., Huang H., Ji X.-J. Microbial production of plant. V. Hormones: opportunities and challenges // Bioengineered. 2017. V. 157. P. 124–128. https://doi.org/10.1080/21655979.2016.1212138
Siyar S., Inayat N., Hussain F. Plant growth promoting rhizobacteria and plants’ improvement: a mini-review // PSM Biol. Res. 2019. V. 41. P. 1–5.
Kudoyarova G., Arkhipova T., Korshunova T., Bakaeva M., Loginov O., Dodd I. Phytohormone mediation of interactions between plants and non-symbiotic growth promoting bacteria under edaphic stresses // Front. Plant Sci. 2019. V. 10. P. 1368. https://doi.org/10.3389/fpls.2019.01368
Grover M., Madhubala R., Ali S.Z., Yadav S.K., Venkateswarlu B. Influence of Bacillus spp. strains on seedling growth and physiological parameters of sorghum under moisture stress conditions // J. Basic Microbiol. 2014. V. 54. P. 951–961. https://doi.org/10.1002/jobm.201300250
Mohanty P., Singh P., Chakraborty D., Mishra. S, Pattnaik R. Insight into the role of PGPR in sustainable agriculture and environment // Front. Sustain. Food Syst. 2021. V. 5. P. 667150. https://doi.org/10.3389/fsufs.2021.667150
Архипова Т.Н., Веселов С.Ю., Мелентьев А.И., Мартыненко Е.В., Кудоярова Г.Р. Сравнение действия штаммов бактерий, различающихся по способности синтезировать цитокинины, на рост и содержание цитокининов в растениях пшеницы // Физиология растений. 2006. Т. 53. № 4. С. 567–573.
Кузьмина Л.Ю., Высоцкая Л.Б., Галимзянова Н.Ф., Гильванова Е.В., Рябова А.С., Мелентьев А.И. Новые штаммы фосфатмобилизующих бактерий, продуцирующих ауксин, перспективные для сельскохозяйственной биотехнологии // Изв. УНЦ РАН. 2015. № 1. С. 40–46.
Кузьмина Л.Ю., Архипова Т.Н., Актуганов Г.Э., Галимзянова Н.Ф., Четвериков С.П., Мелентьев А.И. Бактерии родов Advenella, Bacillus и Pseudomonas – перспективная основа биопрепаратов для растениеводства // Биомика. 2018. Т. 10. № 1. С. 16–19. https://doi.org/10.31301/2221-6197.bmcs.2018-47
King E.O., Ward M.K., Raney D.E. Two simple media for the demonstration of pyocyanin and fluorescein // J. Lab. Clin. Med. 1954. V. 44. P. 301–307.
Габбасова И.М., Гарипов Т.Т., Галимзянова Н.Ф., Сулейманов Р.Р., Комиссаров М.А., Сидорова Л.В., Гималетдинова Г.А. Использование удобрения на основе сплавины для повышения плодородия эродированного чернозема типичного // Агрохимия. 2014. № 6. С. 35–42.
Bunce J.A., Ziska L.H. Decreased hydraulic conductance in plants at elevated carbon dioxide. // Plant Cell Environ. 1998. V. 21. P. 121–126.
Veselov S.Yu., Kudoyarova G.R., Egutkin N.L., Gyuli-Zade V.G., Mustafina A.R., Kof E.K. Modified solvent partitioning scheme providing increased specificity and rapidity of immunoassay for indole 3-acetic acid // Physiol. Plantarum. 1992. V. 86. P. 93–96.
Arkhipova T.N., Evseeva N.V., Tkachenko O.V., Burygin G.L., Vysotskaya L.B., Akhtyamova Z.A., Kudoyarova G.R. Effect of rhizobacteria on phytohormone status of potato microclones under osmotic stress in vitro // Biomolecules. 2020. V. 10. P. 1231.
Веселов С.Ю. Использование антител для количественного определения, очистки и локализации регуляторов роста растений // Уфа: Изд-во БГУ, 1998. 138 с.
Werner T., Motyka V., Laucou V., Smets R., Oneckelen H.V., Schmülling T.H. Cytokinin-deficient transgenic Arabidopsis plants show multiple developemental alterations idicating opposite functions of cytokininsin the regulation of shoot and meristem activity // Plant Cell. 2003. V. 15. P. 2532–2550.
Contesto C., Milesi S., Mantelin S., Zancarini A., Desbrosses G., Varoquaux F., Bellini C., Kowalczyk M., Touraine B. The auxin-signaling pathway is required for the lateral root response of Arabidopsis to the rhizobacterium Phyllobacterium brassicacearum // Planta. 2010. V. 232. P. 1455–1470.
Davies W.J., Kudoyarova G., Hartung W. Long-distance ABA signaling and its relation to other signaling pathways in the detection of soil drying and the mediation of the plant’s response to drought // J. Plant Growth Regul. 2005. V. 24. № 4. P. 285–295
Brouwer R. The regulating influence of transpiration and suction tension on the water and salt uptake by the roots of intact Vicia faba plants // Acta Bot. Neerl. 1954. V. 3. P. 264–312.
Steudle E. Water uptake by roots: effects of water deficit // J. Exp. Bot. 2000. V. 51. P. 1531–1542. https://doi.org/10.1093/jexbot/51.350.1531
Kudoyarova G., Veselova S., Hartung W., Farhutdinov R., Veselov D., Sharipova G. Involvement of root ABA and hydraulic conductivity in the control of water relations in wheat plants exposed to increased evaporative demand // Planta. 2011. V. 233(1). P. 87–94. https://doi.org/10.1007/s00425-010-1286-7
Marulanda A., Azcón R., Chaumont F., Ruiz-Lozano J. M., Aroca R. Regulation of plasma membrane aquaporins by inoculation with a Bacillus megaterium strain in maize (Zea mays L.) plants under unstressed and salt-stressed conditions // Planta. 2010. V. 232. P. 533–543. https://doi.org/10.1007/s00425-010-1196-8
Cortleven A., Schmülling T. Regulation of chloroplast development and function by cytokinin // J. Exp. Bot. 2015. V. 66(16). P. 4999–5013. https://doi.org/10.1093/jxb/erv132
Дополнительные материалы отсутствуют.



