Акустический журнал, 2019, T. 65, № 2, стр. 147-157
Ускорение тепловой абляции объемов биологической ткани с использованием фокусированных ультразвуковых пучков с ударными фронтами
Ю. С. Андрияхина a, *, М. М. Карзова a, П. В. Юлдашев a, В. А. Хохлова a
a Московский государственный университет им. М.В. Ломоносова, физический факультет
119991 Ленинские горы, Москва, ГСП-1, Россия
* E-mail: julia_andriakhina@mail.ru
Поступила в редакцию 13.07.2018
После доработки 30.10.2018
Принята к публикации 17.10.2018
Аннотация
Представлены результаты численного эксперимента по сравнению скорости объемной тепловой абляции ткани говяжьей печени ex vivo, создаваемой с помощью многоэлементной ультразвуковой фазированной решетки системы Sonalleve V1 3.0T, Philips Healthcare. Использовались импульсно-периодические режимы облучения с одинаковой средней по времени, но различной пиковой мощностью и скважностью. Облучение проводилось по траектории, состоящей из дискретного набора единичных фокусов, расположенных в центре и по периметру двух окружностей. Фокусировка пучка в ткани описывалась с помощью уравнения Вестервельта, температурное поле рассчитывалось с помощью уравнения теплопроводности, порог разрушения определялся в соответствии с величиной тепловой дозы. Показано, что использование импульсного ударно-волнового режима облучения позволяет получить до трех раз более быстрое тепловое разрушение объема ткани по сравнению с гармоническим воздействием.
1. ВВЕДЕНИЕ
В последние два десятилетия происходит быстрое развитие новых медицинских приложений фокусированного ультразвука высокой интенсивности (HIFU, от английской аббревиатуры “High Intensity Focused Ultrasound”) для неинвазивного разрушения опухолей различных внутренних органов – матки, предстательной железы, печени, почек, щитовидной железы [1–3]. Принцип работы HIFU основан на фокусировке мощного ультразвукового пучка через согласующую среду в область планируемого разрушения, а само разрушение ткани может происходить как за счет теплового некроза ткани вследствие ее локального нагревания, так и за счет механического воздействия [4, 5].
Для традиционно используемых в клинической практике режимов теплового разрушения ткани при облучении ее гармоническими волнами уже был выявлен ряд ограничений, среди которых можно выделить невысокую скорость объемной абляции и непредсказуемость конечного объема разрушения [6, 7]. Для их преодоления было предложено использовать нелинейные импульсно-периодические режимы облучения, когда средняя по времени мощность пучка остается постоянной, а увеличение пиковой мощности компенсируется уменьшением коэффициента заполнения [8–10]. При сильном проявлении нелинейных эффектов в фокусе излучателя формируются высокоамплитудные ударные фронты. Резкое увеличение поглощения энергии пучка на разрывах позволяет ускорить процесс тепловой абляции ткани и получить более локализованные разрушения за счет уменьшения эффектов тепловой диффузии [10–13].
Возможность ускорения нагревания ткани в ударно-волновом режиме по сравнению с гармоническим детально исследованы для одиночного фокуса. Высокая степень фокусировки ударных фронтов в сочетании с быстрым нагреванием приводят к тому, что одиночные тепловые разрушения формируются в течение миллисекунд и имеют заметно меньшие размеры по сравнению с разрушениями, получаемыми при гармоническом воздействии [10–12]. При увеличении времени ударно-волнового облучения происходит вскипание ткани в области фокуса, что вызывает резкое изменение формы и размеров разрушения [12]. Таким образом, использование нелинейных эффектов для повышения эффективности теплового воздействия в одиночном фокусе без кипения возможно лишь для быстрого получения разрушений очень небольшого объема.
В клинических приложениях требуется за достаточно короткое время создавать объемные разрушения ткани с размерами, по крайней мере, в несколько кубических сантиметров. Для этого фокус излучателя перемещается вдоль некоторой траектории – либо непрерывной [14], либо дискретной, состоящей из последовательности одиночных фокусов [15, 16]. Возможно также создание многофокусных конфигураций с использованием многоэлементных решеток [17, 18]. При этом за счет диффузии тепла от нагреваемого объема могут проявляться побочные эффекты перегрева тканей в ближней зоне пучка, а также возникать трудности при облучении областей, расположенных близко к костям либо к сосудам [6, 19, 20]. Нелинейные режимы облучения с образованием высокоамплитудных разрывов в фокусе излучателя потенциально могут помочь в преодолении этих побочных эффектов, однако такие режимы начали рассматриваться лишь в последнее время [13, 16, 21].
Целью данной работы являлось численное исследование эффективности использования ударно-волновых режимов для получения объемных тепловых разрушений ткани, которые могли бы использоваться в существующей клинической установке HIFU.
2. ПОСТАНОВКА ЗАДАЧИ
Геометрия численного эксперимента проиллюстрирована на рис. 1. В качестве излучателя рассматривалась мощная фазированная решетка клинической системы MRg HIFU Sonalleve V1 3.0T, Philips Healthcare, состоящая из 256 элементов круглой формы с диаметром 6.6 мм и частотой f0 = 1.2 МГц, расположенных на сегменте сферической поверхности с радиусом a = 64 мм и фокусным расстоянием F = 120 мм [15, 22].
Рис. 1.
(а) Схема численного эксперимента. Ультразвуковой пучок создается HIFU-решеткой с апертурой 2а = 128 мм и фокусным расстоянием F =120 мм; решетка состоит из 256 элементов с рабочей частотой 1.2 МГц, центр кривизны поверхности решетки расположен в центре образца ткани печени толщиной h = 5 см; излучатель и образец помещены в воду. (б) Последовательность электронного перемещения фокуса решетки в плоскости z = F вдоль траектории, состоящей из дискретного набора фокусов, расположенных в центре кривизны решетки и на двух окружностях с радиусами 2 и 4 мм. Точками показаны центры создаваемых разрушений.
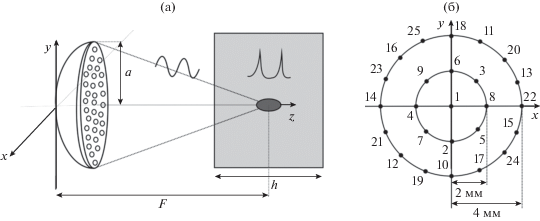
Ультразвуковой пучок, проходя через согласующую среду (воду), фокусировался на глубине 2.5 см в образце говяжьей печени с размерами 5 × 5 × × 5 см (рис. 1а). Фокус решетки перемещался перпендикулярно ее оси с начальной точкой облучения в центре образца и далее по круговым траекториям с радиусами 2 и 4 мм, состоящим из дискретной последовательности одиночных фокусов, расположенных на расстоянии около 2 мм друг от друга (рис. 1б). При этом последовательность облучения единичных фокусов на каждой окружности выбиралась таким образом, чтобы они были максимально далеко расположены друг от друга (показано с помощью нумерации на рис. 1б). Подобная траектория используется в клинической практике и также соответствует недавним экспериментам по механическому разрушению ткани говяжьей печени ex vivo с использованием ударно-волновых режимов фокусировки [15, 16].
Для сравнения были выбраны два импульсно-периодических режима с интенсивностью на элементах решетки I01 = 1.2 Вт/см2 и I02 = 15 Вт/см2. Пиковая акустическая мощность решетки в первом режиме составляла 105 Вт, что является характерной для клинического использования величиной [7]. Второй, высокоамплитудный режим с мощностью 1.3 кВт достижим в данной системе при использовании в исследовательских целях [16, 21, 22]. Проведенные ранее измерения и моделирование полей, создаваемых в данной системе при фокусировке в воде, показали, что образование ударного фронта в фокусе происходит при акустической мощности решетки около 250 Вт [22]. Таким образом, в первом случае, при мощности 105 Вт, реализовывался режим квазилинейной фокусировки; во втором случае, при мощности 1.3 кВт – режим формирования высокоамплитудных ударных фронтов в фокусе решетки. Длительности нагревающих ткань импульсов theat при облучении единичного фокуса выбирались таким образом, чтобы полная энергия в импульсе была одинаковой, и составляли t1 = 20 мс для квазигармонического режима и t2 = 1.6 мс для ударно-волнового. Перемещение единичного фокуса решетки вдоль траектории происходило одновременно с началом каждого последующего импульса, интервал времени между перемещениями составлял Δt = 20 мс.
3. ЧИСЛЕННАЯ МОДЕЛЬ
3.1. Ультразвуковое поле и тепловые источники
Фокусировка ультразвукового пучка в воде, а затем в образце говяжьей печени описывалась с помощью модифицированного уравнения Вестервельта, которое учитывает нелинейные и дифракционные эффекты, а также поглощение в ткани [10]:
(1)
$\frac{{{{\partial }^{2}}p}}{{\partial \tau \partial z}} = \frac{{{{c}_{0}}}}{2}\Delta p + \frac{\beta }{{2{{\rho }_{0}}c_{0}^{3}}}\frac{{{{\partial }^{2}}{{p}^{2}}}}{{\partial {{\tau }^{2}}}} + \frac{\delta }{{2c_{0}^{3}}}\frac{{{{\partial }^{3}}p}}{{\partial {{\tau }^{3}}}} + L(p),$(2)
${{\alpha }_{t}}(f) = {{\alpha }_{0}}\frac{f}{{{{f}_{0}}}},\;\;\;\frac{{c(f) - {{c}_{0}}}}{{{{c}_{0}}}} = \frac{{{{c}_{0}}{{\alpha }_{0}}}}{{{{\pi }^{2}}{{f}_{0}}}}\ln \left( {\frac{f}{{f{}_{0}}}} \right).$Здесь ${{\alpha }_{0}}$ – коэффициент поглощения в ткани на частоте f0. Значения физических констант в уравнении (1) соответствовали комнатной температуре 20°C и были равны ρ0 = 998 кг/м3, c0 = 1485 м/с, β = 3.5, δ = = 4.33 × 10–6 м2/с для воды и ρ0 = 1050 кг/м3, c0 = = 1580 м/с, β = 4.0 для печени. Коэффициент поглощения ${{\alpha }_{0}}$в печени полагался равным 8.43 м–1 на частоте f0 = 1.2 МГц [23].
Для моделирования уравнения Вестервельта (1) использовался ранее развитый алгоритм, подробно описанный в работах [10, 22, 24]. Граничные условия cначала задавались на сферической поверхности решетки в виде равномерного распределения колебательной скорости на ее элементах и затем переносились на плоскость, проходящую через вершину излучателя перпендикулярно ее оси [24]. Результаты моделирования использовались для определения трехмерного пространственного распределения плотности мощности тепловых источников Q(x,y,z) в ткани, которая находилась как скорость убыли полной интенсивности волны при вычислении оператора нелинейности и поглощения на каждом шаге сетки dz [10, 24]:
где $I\left( {x,y,z} \right) = I({\mathbf{r}})$ − сумма интенсивностей всех гармоник нелинейной волны:(4)
$I({\mathbf{r}}) = \frac{1}{{2{{\rho }_{0}}{{c}_{0}}}}\sum\limits_{n = 1}^{{{N}_{{}}}} {{{{\left| {{{p}_{n}}({\mathbf{r}})} \right|}}^{2}}} ,$3.2. Температурное поле
Температурное поле в образце ткани печени описывалось с помощью неоднородного уравнения теплопроводности:
где $T\left( {{\mathbf{r}},t} \right) = T(x,y,z,t)$ – температура в ткани, t – время, χ – коэффициент температуропроводности, ${{C}_{v}}$ – удельная теплоемкость образца, $Q({\mathbf{r}})$ – плотность мощности тепловых источников в ткани (3). Значения физических параметров в уравнении (5) соответствовали ткани говяжьей печени и были равны χ = 1.93 × 10–7 м2/с, ${{C}_{v}}$ = 3.06 × 106 Дж/(м3 °C) [10].Прямой подход к моделированию уравнения (5) с помощью конечно-разностных методов требует использования больших массивов данных и длительных расчетов, поскольку изменение температуры включает в себя два сильно различающихся временных масштаба: быстрое локальное воздействие в единичном фокусе и гораздо более медленное нагревание полного рассматриваемого объема ткани. В данной работе предложен способ, учитывающий такое различие временных масштабов и позволяющий существенно оптимизировать расчеты. Процесс моделирования при этом разделялся на две части: предварительный расчет одиночного теплового воздействия и нагревание полного объема ткани по траектории, состоящей из единичных фокусов (рис. 1б).
Для численного расчета температурного поля в ткани применялся спектральный подход. Решение уравнения теплопроводности $T\left( {{\mathbf{r}},t} \right)$ (5) представлялось в виде преобразования Фурье в ${\mathbf{k}}$-пространстве:
(6)
$\begin{gathered} T({\mathbf{r}},t) = \\ = \int\limits_{ - \infty }^\infty {\int\limits_{ - \infty }^\infty {\int\limits_{ - \infty }^\infty {\hat {T}({\mathbf{k}},t)\exp \left( {2\pi i({{k}_{x}}x + {{k}_{y}}y + {{k}_{z}}z)} \right)} } } \times \\ \times \,\,d{{k}_{x}}d{{k}_{y}}d{{k}_{z}}, \\ \end{gathered} $(7)
$\begin{gathered} \hat {T}({\mathbf{k}},t) = \\ = \int\limits_{ - \infty }^\infty {\int\limits_{ - \infty }^\infty {\int\limits_{ - \infty }^\infty {T({\mathbf{r}},t)\exp \left( { - 2\pi i({{k}_{x}}x + {{k}_{y}}y + {{k}_{z}}z)} \right)} } } \times \\ \times \,\,dxdydz. \\ \end{gathered} $Уравнение (5) после подстановки разложения (6) в предположении постоянства тепловых источников $Q({\mathbf{r}})$ во времени преобразуется к следующему виду для пространственных спектральных компонент поля:
(8)
$\frac{{\partial{ \hat {T}}({\mathbf{k}},t)}}{{\partial t}} = - 4{{\pi }^{2}}{{{\mathbf{k}}}^{2}}\chi \hat {T}({\mathbf{k}},t) + \frac{{\hat {Q}({\mathbf{k}})}}{{{{C}_{{\text{v}}}}}},$(9)
$\begin{gathered} \hat {T}({\mathbf{k}},t) = {{{\hat {T}}}_{0}}({\mathbf{k}})\exp \left( { - 4{{\pi }^{2}}{{{\mathbf{k}}}^{2}}\chi t} \right) + \\ + \,\,\frac{{\hat {Q}({\mathbf{k}})}}{{4{{\pi }^{2}}{{{\mathbf{k}}}^{2}}\chi {{C}_{{\text{v}}}}}}\left( {1 - \exp \left( { - 4{{\pi }^{2}}{{{\mathbf{k}}}^{2}}\chi t} \right)} \right), \\ \end{gathered} $Сначала был проведен расчет теплового воздействия в единичном фокусе и получено решение для повышения температуры ${{T}_{{{\text{single}}}}}({\mathbf{r}},\Delta t)$ в окрестности фокуса в момент времени Δt = 20 мс, соответствующий моменту перемещения фокуса решетки в следующую точку траектории. С учетом различного времени облучения для каждого из двух рассматриваемых режимов, решение для пространственного спектра изменения температуры будет состоять из двух временных компонент:
(10)
$\begin{gathered} {{{\hat {T}}}_{{{\text{single}}}}}({\mathbf{k}},\Delta t) = \frac{{\hat {Q}({\mathbf{k}})}}{{4{{\pi }^{2}}{{{\mathbf{k}}}^{2}}\chi {{C}_{{\text{v}}}}}} \times \\ \times \,\,\left( {1 - \exp \left( { - 4{{\pi }^{2}}{{{\mathbf{k}}}^{2}}\chi {{t}_{{{\text{heat}}}}}} \right)} \right)\, \times \\ \times \,\,\exp \left( { - 4{{\pi }^{2}}{{{\mathbf{k}}}^{2}}\chi \left( {\Delta t - {{t}_{{{\text{heat}}}}}} \right)} \right). \\ \end{gathered} $Здесь первые два сомножителя описывают пространственный спектр единичного воздействия в момент времени окончания нагревающего импульса длительностью theat (20 и 1.6 мс), а третий сомножитель – в момент времени Δt переключения фокуса на следующую точку траектории. Предполагается, что начальное распределение температуры в области облучаемого фокуса при t = 0 с было равномерным, поскольку каждое последующее положение фокуса выбиралось на достаточном расстоянии от предыдущего (рис. 1б).
Температурное распределение в полном объеме ткани на каждом шаге сетки по времени Δt от момента t к моменту t + Δt рассчитывалось в три этапа. Сначала в k-пространстве находилось решение уравнения диффузии (9) без источников:
(11)
${{\hat {T}}_{{{\text{diff}}}}}({\mathbf{k}},t + \Delta t) = \hat {T}({\mathbf{k}},t)\exp \left( { - 4{{\pi }^{2}}{{{\mathbf{k}}}^{2}}\chi \Delta t} \right).$Затем решение (11) преобразовывалось к пространственным координатам с помощью (6) и определялось ${{T}_{{{\text{diff}}}}}({\mathbf{r}},t + \Delta t).$ На третьем шаге к полученному распределению температуры ${{T}_{{{\text{diff}}}}}({\mathbf{r}},t + \Delta t)$ добавлялось преобразованное к пространственным координатам с помощью (6) решение (10), описывающее результат единичного воздействия:
(12)
$T({\mathbf{r}},t + \Delta t) = {{T}_{{{\text{diff}}}}}({\mathbf{r}},t + \Delta t) + {{T}_{{{\text{single}}}}}({\mathbf{r}},\Delta t).$Указанная процедура (11), (12) выполнялась последовательно в моменты перемещения фокуса вдоль траектории (рис. 2).
Рис. 2.
Схематичное представление численного расчета уравнения теплопроводности в полном облучаемом объеме в окне с размерами xmax × ymax × zmax = = 30 × 30 × 40 мм. На рисунке показана геометрия численной сетки: 1200 узлов сетки в фокальной плоскости xy с пространственным шагом 0.025 мм и 400 узлов в направлении распространения пучка z с шагом 0.1 мм, а также траектория положения одиночных фокусов в центре фокусировки F ультразвукового пучка. Серым цветом выделен объем температурного распределения Tsingle единичного фокуса, соответствующий линейному режиму облучения с начальной интенсивностью 1.2 Вт/см2 на элементах решетки.
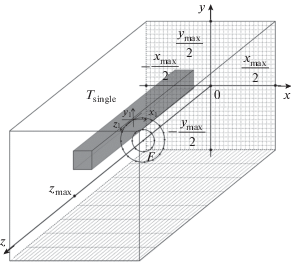
Вспомогательный расчет единичного воздействия (6), (10) проводился на сетке, состоящей из 480 узлов по каждой из поперечных координат x и y с пространственным шагом 0.025 мм и 400 узлов вдоль оси пучка z с шагом 0.1 мм (рис. 2). Полученные распределения обрезались по каждому из направлений с учетом режима облучения таким образом, чтобы повышение температуры на границе окна не превышало 0.02°С. Для интенсивности 1.2 Вт/см2 на элементах решетки размеры окна составили 5.0 × 5.0 × 30 мм, а для начальной интенсивности 15 Вт/см2 – 2.5 × 2.5 × 14.0 мм.
При расчете объемных разрушений размер пространственных шагов не менялся, а сетка состояла из 1200 узлов по каждой из поперечных координат x и y и 400 узлов вдоль оси пучка, т.е. размеры окна составили 30 × 30 × 40 мм (рис. 2); шаг по времени соответствовал времени перемещения фокуса фазированной решетки Δt = 20 мс.
Такой подход позволяет один раз заранее рассчитать температурное распределение ${{T}_{{{\text{single}}}}}$ при единичном воздействии и далее проводить расчет температурного поля во всей области с крупным временным шагом, равным времени перемещения фокуса по траектории облучения.
3.3. Тепловая доза
В качестве критерия тепловой абляции ткани использовалась величина тепловой дозы, рассчитываемая в каждой точке облучаемой области [1, 10, 25]:
(13)
${{t}_{{{\text{56}}{\text{.0}}}}} = \int\limits_0^{{{t}_{{{\text{heat}}}}}} {{{R}_{0}}^{{(56.0 - T({\mathbf{r}},t))}}dt} \geqslant 1.76,$Поскольку тепловая доза является интегральной величиной, при моделировании разрушения объема ткани необходимо добавлять каждые Δt = = 20 мс в решение для тепловой дозы соответствующее распределение тепловой дозы от единичного воздействия. Вспомогательный расчет величины тепловой дозы при единичном воздействии проводился относительно начальной температуры 20°C с временным шагом 16 мкс в течение 20 мс. Далее, при добавлении распределения дозы от единичного воздействия в распределение дозы по объему делалась поправка на начальную температуру $T({\mathbf{r}},t)$в соответствующем фокусе:
(14)
${{t}_{{56.0}}} = \int\limits_0^{{{t}_{{{\text{heat}}}}}} {{{R}_{0}}^{{56.0 - \left[ {T({\mathbf{r}},t) + \Delta T} \right]}}dt} = {{D}_{0}}{{R}_{0}}^{{ - \Delta T}},$В моделировании облучение ткани проводилось до того момента, пока на контуре внешней окружности не достигалось пороговое значение тепловой дозы. Расчет температуры и тепловой дозы продолжался и после окончания облучения до момента, когда область разрушения переставала увеличиваться за счет диффузии тепла в окружающие ткани.
Распределение единичной тепловой дозы сначала рассчитывалось в том же пространственном окне, как и расчет температуры в одиночном фокусе, затем обрезалось по каждому из направлений таким образом, чтобы на границе нового окна значение тепловой дозы не превышало 0.01. Так, для интенсивности 1.2 Вт/см2 на элементах решетки размеры окна составили 3 × 3 × 12 мм, для начальной интенсивности 15 Вт/см2 – 1 × 1 × 6 мм.
4. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
4.1. Акустическое поле в единичном фокусе
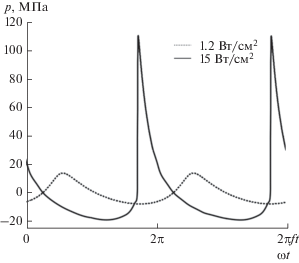
На рис. 3 представлены рассчитанные с помощью уравнения Вестервельта (1) профили давления в фокусе HIFU-решетки, соответствующие двум выбранным режимам облучения и фокусировке в середину образца ткани печени на глубину 2.5 см. Режим с начальной интенсивностью I0 = 1.2 Вт/см2 соответствует квазигармоническому нагреву, который принято определять критерием перехода не более 10% энергии волны в фокусе в высшие гармоники [27–29]. При начальной интенсивности I0 = 15 Вт/см2 в профиле волны в фокусе формируются высокоамплитудные ударные фронты, на которых ожидается эффективное поглощение энергии ультразвукового пучка. Как видно из рис. 3, нижнее значение фронта смещено в область отрицательных давлений. Такой профиль волны соответствует началу проявления эффектов нелинейного насыщения в фокусе [28–31].
Рис. 3.
Волновые профили давления в фокусе при облучении образца ткани с интенсивностью I0 = 1.2 Вт/см2 (пунктирная линия) и 15 Вт/см2 (сплошная линия) на элементах решетки.
Полученные с помощью численного решения уравнения Вестервельта распределения плотности мощности тепловых источников Q в образце ткани печени показаны на рис. 4. Видно, что для начальной интенсивности 1.2 Вт/см2, когда в профиле волны нет ударного фронта (рис. 4а, 4б), область концентрации тепловых источников имеет гораздо большие размеры по сравнению со случаем начальной интенсивности 15 Вт/см2, когда в фокальном профиле волны уже сформировался развитый разрыв (рис. 4в, 4г) [28, 29]. За счет острой фокусировки ударных фронтов эффективное поглощение акустической энергии сосредоточено в малом объеме по сравнению с низкоамплитудным режимом. Характерные размеры теплового пятна, определяемые по уровню e–1 от максимума, составили 10 и 4 мм в аксиальном направлении и 2 и 0.4 мм в поперечном направлении в фокальной плоскости для интенсивностей I0 = 1.2 и 15 Вт/см2 на элементах решетки соответственно. В фокусе решетки соответствующие интенсивности составили 3 и 47 кВт/см2. При различии интенсивностей в фокусе в ударно-волновом режиме по сравнению с квазигармоническим в 15.7 раз различие максимальных значений плотности мощности тепловых источников составило 411.3 раза. Таким образом, использование ударно-волнового режима с развитым разрывом в профиле волны в фокусе позволило в 26 раз увеличить эффективность локального теплового воздействия ультразвука на ткань.
Рис. 4.
Пространственные распределения плотности мощности тепловых источников в ткани в (а, в) фокальной и (б, г) аксиальной плоскостях для (а, б) квазилинейного режима облучения ткани с интенсивностью I0 = 1.2 Вт/см2 и (в, г) нелинейного режима с интенсивностью 15 Вт/см2 на элементах решетки.

Рассмотрим теперь более подробно характеристики одиночного теплового воздействия на ткань для различных интенсивностей I0 на элементах решетки в ее рабочем диапазоне. На рис. 5а показано отношение плотности мощности тепловых источников Q (мощности тепловыделения) в фокусе к соответствующей величине в линейном пучке Qlin в зависимости от интенсивности I0. При малых интенсивностях (до 2 Вт/см2) отношение Q/Qlin близко к единице, затем, в области интенсивностей, когда в фокусе излучателя начинает формироваться ударный фронт (4–5 Вт/см2), оно резко возрастает. В момент образования развитого разрыва в фокусе излучателя (вертикальный пунктир 2 на рис. 5а) мощность тепловыделения Q в 35 раз превышает мощность тепловыделения в линейном пучке Qlin. После образования развитого разрыва начинают заметно проявляться эффекты нелинейного насыщения амплитуды разрыва в фокальном профиле волны, что приводит к замедлению роста зависимости Q/Qlin от начальной интенсивности [28–31]. В режиме насыщения мощность тепловыделения в точке фокуса оказывается примерно в 50 раз выше, чем в линейном пучке (вертикальный пунктир 3 на рис. 5а).
Рис. 5.
Зависимости параметров теплового воздействия ультразвука на ткань в области фокуса нелинейного пучка, создаваемого многоэлементной решеткой, от интенсивности I0 на ее элементах (сплошные кривые): (а) плотность мощности тепловых источников Q в фокусе, нормированная на соответствующую величину Qlin в линейном пучке; (б) объем фокальной области VF плотности мощности тепловых источников, определяемый по уровню 10% от ее максимальной величины; (в) мощность тепловых источников WF, выделяемая в объеме фокальной области VF, lin, нормированная на соответствующую величину WF, lin в линейном пучке. Штриховые горизонтальные кривые соответствуют случаю линейной фокусировки: Q/Qlin = 1, VF, lin = 27.5 мм3, WF/WF, lin = 1. Вертикальные пунктирные линии, отмеченные цифрами 1, 2 и 3, соответствуют случаям с начальной интенсивностью 1.2 Вт/см2 (квазигармонический режим), 8 Вт/см2 (режим с развитым разрывом) и 15 Вт/см2 (режим насыщения) соответственно.
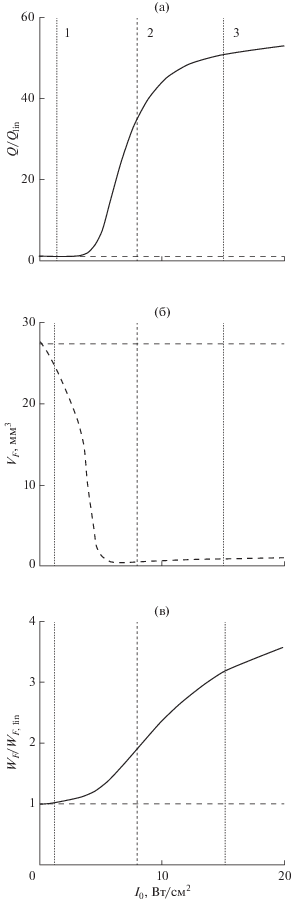
Высокая пространственная локализация ударных фронтов при фокусировке приводит также к существенному (более чем в 20 раз) уменьшению фокального объема плотности мощности тепловых источников в нелинейном пучке, определяемого, например, по уровню 10% от ее максимальной величины (рис. 5б). Минимальный объем концентрации тепловых источников при этом достигается в случае, когда ударный фронт только образовался в профиле волны в фокусе. При дальнейшем увеличении интенсивности на элементах решетки объем фокальной области начинает медленно расти, что связано с образованием ударных фронтов в большей области вокруг фокуса, увеличиваясь в два раза при достижении режима насыщения по сравнению с минимальным объемом. Очевидно, что в линейном пучке объем фокальной области меняться не будет (штриховая горизонтальная линия на рис. 5б).
Таким образом, в нелинейном пучке резко возрастает эффективность нагрева в фокусе, но размеры фокальной области, напротив, сильно уменьшаются по сравнению с линейным случаем. Для одновременного учета этих двух эффектов при оценке эффективности нагревания конечных объемов ткани в различных режимах фокусировки необходимо сравнить мощности тепловых источников W, полученные путем интегрирования плотности мощности Q по объему фокальной области VF : $W = \int_{{{V}_{F}}} Q dV$ (рис. 4в). Расчеты показали, что использование ударно-волнового режима с развитым разрывом в фокусе позволяет увеличить мощность тепловыделения в фокальной области до двух раз по сравнению с линейным пучком (вертикальный пунктир 2 на рис. 5в), а предельное увеличение эффективности нагрева в режиме насыщения составляет 3.5 раза.
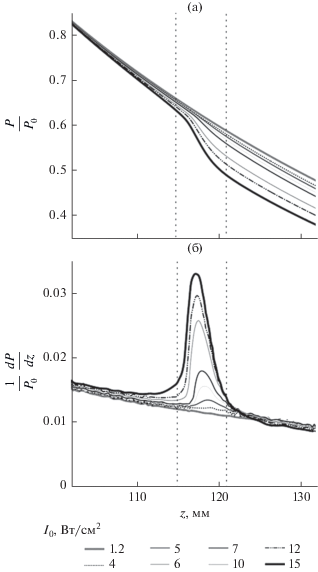
Для оценки эффективности теплового воздействия ультразвука на ткань важно также рассмотреть изменение полной акустической мощности пучка в области фокуса и оценить расстояния, на которых потери мощности максимальны. В линейном случае полная акустическая мощность пучка убывает по экспоненциальному закону [1, 4]. Присутствие ударных фронтов в профиле волны приводит к дополнительному тепловыделению, мощность которого пропорциональна амплитуде разрыва в третьей степени [4, 11, 12]. Как видно на рис. 6а, для нелинейных режимов с I0 = 6…15 Вт/см2 в области фокуса происходит заметное отклонение от экспоненциального закона изменения полной мощности по сравнению с квазилинейным режимом (I0 = 1.2 Вт/см2). При этом в сильно нелинейных режимах, когда в профиле волны в фокусе уже образовался развитый разрыв, происходит резкий скачок выделения тепла в локализованной области вблизи фокуса F = 120 см (рис. 6б). В режиме с максимальной величиной ударного фронта, при I0 = 15 Вт/см2, толщина слоя, в котором происходит эффективное выделение тепла, составляет вдоль оси пучка около 5 мм (вертикальные штриховые линии на рис. 6б). Для создания объемных разрушений с размерами, превышающими 5 мм вдоль каждой координаты, можно использовать послойное разрушение ткани, при котором на каждом слое облучение ведется по траектории из одиночных фокусов, а расстояние между слоями составляет порядка 5 мм [16].
Рис. 6.
Изменение (а) полной акустической мощности ультразвукового пучка P и (б) потерь мощности dP/dz в ткани, нормированных на начальную акустическую мощность P0, вдоль оси пучка z для различных значений интенсивностей I0 на элементах решетки. Вертикальными штриховыми линиями обозначена 5-мм область фокуса, в которой наблюдается эффективное поглощение энергии.
Отметим, что важность аналогичных эффектов резкого локального усиления поглощения ультразвука при образовании ударных фронтов вблизи фокуса отмечалась, к примеру, в недавних публикациях при анализе величины радиационной силы в поле фокусированного гауссовского пучка в поглощающей среде [32], исследовании механизма взрывной неустойчивости перегретой капли в акустическом фонтане на основе модели эволюции стоячих волн в сферическом резонаторе [33], а также для оценки возможности осуществления механического разрушения опухолей мозга при фокусировке мощного импульсного ультразвука через интактный череп [34].
4.2. Температурное поле в единичном фокусе
За время единичного облучения в квазилинейном режиме (I0 = 1.2 Вт/см2) нагрев ткани в фокусе решетки за 20 мс происходит всего лишь на 3–4°C (рис. 7а), в то время как в ударно-волновом режиме (I0 = 15 Вт/см2) ткань достигает температур кипения за время порядка одной миллисекунды (рис. 7г). Рост температуры в фокусе во время облучения ткани в обоих случаях оказался линейно зависящим от времени (рис. 7а, 7г), что говорит о несущественном влиянии эффектов диффузии на данных временных интервалах и, как следствие, о преобладании роли второго слагаемого в уравнении (9) над первым. После выключения HIFU-решетки происходит остывание ткани за счет диффузии тепла (рис. 7а, 7г).
Рис. 7.
Зависимости температуры в фокусе решетки от времени (а, г) и распределения температуры в (б, д) фокальной и (в, е) аксиальной плоскостях ультразвукового пучка для линейного (а–в, I0 = 1.2 Вт/см2, время облучения t = 20 мс) и ударно-волнового (г–е, I0 = 15 Вт/см2, t =1.6 мс) режимов облучения одиночного фокуса в ткани. Пространственные распределения температуры (б, в, д, е) построены в моменты времени 1.6, 20 и 100 мс.
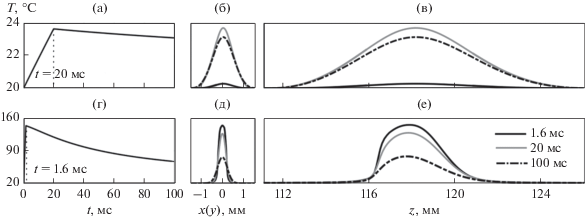
Сравнение пространственных распределений температуры в фокальной плоскости (рис. 7б, 7д) и вдоль оси пучка (рис. 7в, 7е) для двух режимов облучения с начальной интенсивностью 1.2 Вт/см2 (верхний ряд, рис. 7б, 7в) и 15 Вт/см2 (нижний ряд, рис. 7д, 7е) на элементах решетки позволяет выявить принципиальные отличия использования квазигармонического и ударно-волнового режимов фокусировки. Во‑первых, время, необходимое для достижения тепловой абляции ткани, отличается на несколько порядков. Для низкоинтенсивного режима (рис. 7б, 7в) к моменту времени t = 1.6 мс пространственные распределения температуры практически не изменились по отношению к начальным, а максимальный рост в центре теплового пятна составил всего 0.3°C. Для ударно-волнового режима (рис. 7д, 7е) за время облучения t = 1.6 мс температура в центре увеличилась на 120°C, а разрушение ткани произошло в области с размерами 0.4 × 0.4 мм в фокальной плоскости и порядка 5 мм в аксиальной плоскости, что точно соответствует размерам тепловых источников той же начальной интенсивности (рис. 4в, 4г). Во-вторых, использование ударно-волновых режимов перспективно по сравнению с квазилинейными режимами для подавления эффектов диффузии, поскольку нагрев происходит в четко локализованной области, а воздействие на ткань оказывается очень быстрым. Локализация теплового воздействия хорошо видна по резкому градиенту температуры вдоль оси z (рис. 7е) в области фокуса, а миллисекундное облучение оказывается достаточным для достижения температур кипения. Кроме того, остывание после выключения HIFU-решетки также происходит достаточно быстро (рис. 7д, 7е, случай 100 мс).
Таким образом, при использовании ударно-волнового режима облучения резкое уменьшение полной акустической мощности пучка в области фокуса и быстрый локальный нагрев ткани в одиночном фокусе HIFU-решетки позволяют предположить возможность ускорения процесса тепловой абляции и получения предсказуемых объемов разрушения клинически значимых объемов ткани [11–13].
4.3. Облучение клинически значимого объема
Рассмотрим параметры получаемых объемных разрушений ткани в случае квазилинейного (I0 = = 1.2 Вт/см2) и нелинейного (I0 = 15 Вт/см2) режимов облучения по круговым траекториям (рис. 1б). Для квазилинейного режима облучение длилось 15.8 с, после чего на внешней окружности траектории было достигнуто пороговое значение тепловой дозы, а затем в течение 12 с происходило остывание ткани. В ударно-волновом режиме времена облучения и остывания составили 4.6 и 7 с соответственно.
Квазилинейный режим облучения (рис. 8а, 8б) позволяет получить однородный нагрев ткани без резких пространственных градиентов температуры внутри разрушенного объема ткани (серый контур на рис. 8а, 8б). В нелинейном режиме (рис. 7в, 7г) температурные распределения неоднородны, при этом внутри контура достижения тепловой дозы наблюдаются участки с разностью температур более 30°С.
Рис. 8.
Пространственные распределения температуры в момент окончания облучения объема ткани в (а, в) фокальной и (б, г) аксиальной плоскостях для интенсивностей (а, б) I0 = 1.2 и (в, г) 15 Вт/см2 на элементах решетки. Для каждого случая указано время t окончания облучения. Серый контур показывает границы области, внутри которой тепловая доза, определенная относительно температуры 56°C, достигла t56.0 = 1.76 с после остывания облученного объема ткани.

В квазилинейном режиме гораздо сильнее, чем в случае нелинейного режима, проявляются эффекты диффузии тепла от нагреваемой области в окружающие слои ткани в аксиальном направлении, что приводит к увеличению области разрушения вдоль оси пучка (рис. 8б, 8г). Напротив, разрушенная область в нелинейном режиме имеет четкие контуры, которые соответствуют начальным контурам тепловых источников (рис. 4в, 4г). В таком режиме диффузионные эффекты сильно подавлены за счет быстрого воздействия на ткань, что потенциально снижает риск повреждения окружающих тканей.
В медицинской практике требуется за достаточно короткое время создавать объемные разрушения с четкими границами. Скорость получения таких разрушений рассчитывается как отношение объема, в котором тепловая доза достигла порогового значения, ко времени облучения. Для рассматриваемых случаев начальных интенсивностей 1.2 и 15 Вт/см2 объем полученных разрушений составил 293 и 192 мм3, соответственно, а скорости объемных разрушений оказались равными 18.5 и 41.7 мм3/с. Таким образом, выигрыш в скорости при использовании ударно-волнового режима с начальной интенсивностью I0 = 15 Вт/см2 составил 2.3 раза по сравнению с квазилинейным (I0 = 1.2 Вт/см2) традиционным режимом облучения с помощью HIFU-решетки. Для осуществления более однородного нагрева ткани в ударно-волновых режимах необходимо оптимизировать траекторию облучения, уменьшив расстояние между соседними фокусами, а также контролировать достижение порогового значения тепловой дозы на каждой из окружностей траектории движения фокуса.
5. ЗАКЛЮЧЕНИЕ
В работе развит алгоритм численного расчета объемных тепловых разрушений биологической ткани, получаемых при электронном перемещении фокуса ультразвуковой фазированной решетки системы Sonalleve V1 3.0T (Philips Healthcare) по круговым траекториям, используемым в клинической практике. Проведено сравнение эффективности нагревания клинически значимого объема биологической ткани при квазигармоническом и ударно–волновом режимах облучения с одинаковой средней по времени мощностью, но различными пиковыми значениями мощности и скважности импульсно-периодического облучения. Показано, что при использовании ударно-волнового режима облучения скорость абляции ткани увеличивается примерно вдвое по сравнению с квазигармоническим, а получаемые разрушения по форме соответствуют облучаемой области за счет подавления диффузии тепла вдоль оси пучка. Результаты численного эксперимента показали также, что для обеспечения более равномерного нагрева ткани ударно-волновым пучком необходима оптимизация траектории движения фокуса. Разработка таких траекторий, а также протокола облучения нескольких слоев ткани для увеличения получаемого объема разрушения являются предметами дальнейших исследований с целью усовершенствования медицинской технологии HIFU.
Работа выполнена при поддержке гранта РНФ 14-12-00974-П и Focused Ultrasound Foundation. Авторы благодарны Л.Р. Гаврилову за полезные замечания.
Список литературы
Хилл К.Р., Бэмбер Дж. Ультразвук в медицине. Физические основы применения / Под ред. тер Хаар Г. Пер. с англ. М.: Физматлит, 2008.
Dubinsky T.J., Cuevas C., Dighe M.K., Kolokythas O., Hwang J.H. High-intensity focused ultrasound: current potential and oncologic applications // AJR Am. J. Roentgenol. 2008. V. 190. P. 191–199.
Гаврилов Л.Р. Фокусированный ультразвук высокой интенсивности в медицине. М.: Фазис, 2013.
Бэйли М.Р., Хохлова В.А., Сапожников О.А., Каргл С.Г., Крам Л.А. Физические механизмы воздействия терапевтического ультразвука на биологическую ткань (обзор) // Акуст. журн. 2003. Т. 49. № 4. С. 437–464.
Hoogenboom M., Eikelenboom D., den Brok M.H., Heerschap A., Fütterer J.J., Adema G.J. Mechanical high-intensity focused ultrasound destruction of soft tissue: Working mechanisms and physiologic effects // Ultrasound Med. Biol. 2015. V. 41. №. 6. P. 1500−1517.
Mougenot C., Köhler M.O., Enholm J., Quesson B., Moonen C. Quantification of near-field heating during volumetric MR-HIFU ablation // Med. Phys. 2011. V. 38. P. 272–282.
Venkatesan A.M., Partanen A., Pulanic T.K., Dreher M.R., Fischer J., Zurawin R.K., Muthupillai R., Sokka S., Nieminen H.J., Sinaii N., Merino M., Wood B.J., Stratton P. Magnetic resonance imaging-guided volumetric ablation of symptomatic leiomyomata: correlation of imaging with histology // J. Vasc. Interv. Radiol. 2012. V. 23. № 6. P. 786−794.
Khokhlova V.A., Bailey M.R., Reed J.A., Cunitz B.W., Kaczkowski P.J., Crum L.A. Effects of nonlinear propagation, cavitation, and boiling in lesion formation by high intensity focused ultrasound in a gel phantom // J. Acoust. Soc. Am. 2006. V. 119. № 3. P. 1834−1848.
Hynynen K. Demonstration of enhanced temperature elevation due to nonlinear propagation of focussed ultrasound in dog’s thigh in vivo // Ultrasound Med. & Biol. 1987. V. 36. № 2. P. 85–91.
Yuldashev P., Shmeleva S., Ilyin S., Sapozhnikov O., Gavrilov L., Khokhlova V. The role of acoustic nonlinearity in tissue heating behind the rib cage using high intensity focused ultrasound phased array // Phys. Med. Biol. 2013. V. 58. № 8. P. 2537–2559.
Филоненко E.А., Хохлова В.А. Эффекты акустической нелинейности при терапевтическом воздействии мощного фокусированного ультразвука на биологическую ткань // Акуст. журн. 2001. Т. 47. № 4. С. 541–549.
Canney M., Khokhlova V., Bessonova O., Bailey M., Crum L. Shock-induced heating and millisecond boiling in gels and tissue due to high intensity focused ultrasound // Ultrasound Med. & Biol. 2010. V. 36. P. 250–267.
Ramaekers P., De Greef M., Van Breugel J.M.M., Moonen C.T.W., Ries M. Increasing the HIFU ablation rate through an MRI-guided sonication strategy using shock waves: feasibility in the in vivo porcine liver // Phys. Med. Biol. 2016. V. 61. P. 1057–1077.
Wu F., Wang Z.B., Chen W.Z., Wang W., Gui Y., Zhang M., Zheng G., Zhou Y., Xu G., Li M., Zhang C., Ye H., Feng R. Extracorporeal high intensity focused ultrasound ablation in the treatment of 1038 patients with solid carcinomas in China: An overview // Ultrason. Sonochem. 2004. V. 11. P. 149–154.
Köhler M.O., Mougenot C., Quesson B., Enholm J., Le Bail B., Laurent C., Moonen C.T.W., Ehnholm G.J. Volumetric HIFU ablation under 3D guidance of rapid MRI thermometry // Med. Phys. 2009. V. 36. № 8. P. 3521–3535.
Khokhlova V.A., Maxwell A.D., Khokhlova T., Kreider W., Bailey M., Partanen A., Farr N., Sapozhnikov O. Generation of volumetric boiling histotripsy lesions in tissue using a multi-element array of a clinical HIFU system // Abstract Book of 14th International Symposium for Therapeutic Ultrasound. Las Vegas, Nevada, USA. 2014.
Daum D.R., Hynynen K. Thermal dose optimization via temporal switching in ultrasound surgery // IEEE Trans. Ultrason. Ferroelect. Freq. Contr. 1998. V. 45. № 1. P. 208–215.
Hand J.W., Shaw A., Sadhoo N., Dickinson R.J., Gavrilov L.R. Initial testing of a prototype phased array device for delivery of high intensity focused ultrasound (HIFU) // Phys. Med. Biol. 2009. V. 54. № 19. P. 5675–5693.
Quesson B., Merle M., Kohler M.O., Mougenot C., Roujol S., de Senneville B.D., Moonen C.T. A method for MRI guidance of intercostal high intensity focused ultrasound ablation in the liver // Med. Phys. 2010. V. 37. № 6. P. 2533–2540.
Aubry J.-F., Pernot M., Marquet F., Tanter M., Fink M. Transcostal high-intensity-focused ultrasound: ex vivo adaptive focusing feasibility study // Phys. Med. Biol. 2008. V. 53. № 11. P. 2937–2951.
Eranki A., Farr N., Partanen A., Sharma K.V., Chen H., Rossi C.T., Kothapalli S.V., Oetgen M., Kim A., Negussie A.H., Woods D., Wood B.J., Kim P.C.W., Yarmolenko P.S. Boiling histotripsy lesion characterization on a clinical magnetic resonance imaging-guided high intensity focused ultrasound system // PLoS ONE. 2017. V. 12. № 3. P. e0173867-1-23.
Kreider W., Yuldashev P.V., Sapozhnikov O.A., Farr N., Partanen A., Bailey M.R., Khokhlova V.A. Characterization of a multi-element clinical HIFU system using acoustic holography and nonlinear modeling // IEEE Trans. Ultrason. Ferroelectr. Freq. Control. 2003. V. 60. № 8. P. 1683–1698.
Duck F.A. Physical Properties of Tissue. London: Academic Press, 1990.
Юлдашев П.В., Хохлова В.А. Моделирование трехмерных нелинейных полей ультразвуковых терапевтических решеток // Акуст. журн. 2011. Т. 57. № 3. С. 337−347.
Sapareto S.A., Dewey W.C. Thermal dose determination in cancer therapy // Int. J. Radiation Oncology Biol. Phys. 1984. V. 10. № 6. P. 787–800.
Kopelman D., Inbar Y., Hanannel A., Freundlich D., Castel D., Perel A., Greenfeld A., Salamon T., Sareli M., Valeanu A., Papa M. Magnetic resonance-guided focused ultrasound surgery (MRgFUS): Ablation of liver tissue in a porcine model // Eur. J. Radiol. 2006. V. 59. P. 157–162.
Ultrasonics – Field characterization – In situ exposure estimation in finite-amplitude ultrasonic beams. IEC TS 61949. 2007.
Rosnitskiy P.B., Yuldashev P.V., Sapozhnikov O.A., Maxwell A.D., Kreider W., Bailey M.R., Khokhlova V.A. Design of HIFU transducers for generating specified nonlinear ultrasound fields // IEEE Trans. Ultrason. Ferroelect. Freq. Contr. 2017. V. 64. № 2. P. 374–390.
Росницкий П.Б., Юлдашев П.В., Хохлова В.А. Влияние угловой апертуры медицинских ультразвуковых излучателей на параметры нелинейного ударно-волнового поля в фокусе // Акуст. журн. 2015. Т. 61. № 3. С. 325–332.
Карзова М.М., Аверьянов М.В., Сапожников О.А., Хохлова В.А. Механизмы насыщения в нелинейных фокусированных импульсных и периодических акустических пучках // Акуст. журн. 2012. Т. 58. № 1. С. 93–102.
Бессонова О.В., Хохлова В.А., Бэйли М.Р., Кэнни М.С., Крам Л.А. Фокусировка мощных ультразвуковых пучков и предельные значения параметров разрывных волн // Акуст. журн. 2009. Т. 55. № 4–5. С. 445–456.
Руденко О.В., Гурбатов С.Н. Обратная задача нелинейной акустики: синтез интенсивных сигналов для усиления теплового и радиационного воздействия ультразвука // Акуст. журн. 2016. Т. 62. № 4. С. 412–423.
Росницкий П.Б., Гаврилов Л.Р., Юлдашев П.В., Сапожников О.А., Хохлова В.А. О возможности применения многоэлементных фазированных решеток для ударно-волнового воздействия на глубокие структуры мозга // Акуст. журн. 2016. Т. 63. № 5. С. 489–500.
Сапожников О.А., Анненкова Е.А. Нелинейные сферические стоячие волны в акустически возбужденной жидкой капле // Акуст. журн. 2016. Т. 64. № 3. С. 308–317.
Дополнительные материалы отсутствуют.
Инструменты
Акустический журнал


