Журнал аналитической химии, 2019, T. 74, № 1, стр. 3-14
Новые ионные жидкости для экстракционного концентрированияС. В. Смирнова, И. В. Плетнев
С. В. Смирнова 1, И. В. Плетнев 1, *
1 Московский государственный университет имени М.В. Ломоносова, химический факультет
119991 Москва, ГСП-1, Ленинскиe горы, 1, стр. 3, Россия
* E-mail: pletnev@analyt.chem.msu.ru
Поступила в редакцию 27.02.2018
После доработки 20.07.2018
Принята к публикации 20.07.2018
Аннотация
Обзор работ авторов в области применения в экстракции новых ионных жидкостей (ИЖ) – солей четвертичных аммониевых катионов с анионами карбоновых или сульфокислот. Обсуждаются важные для экстракции свойства этих растворителей, проведено сравнение с “классическими” ИЖ, в состав которых входят катионы замещенного имидазолия и фторсодержащие анионы. Представлены наиболее важные применения ИЖ для извлечения из водных растворов органических соединений разных классов, в том числе аналитических реагентов. Приведены данные по экстракции ионов металлов; обсуждаются различные подходы к использованию ИЖ для экстракции в качестве “инертных” разбавителей комплексообразующих реагентов и экстракционных растворителей/экстрагентов, активных по отношению к экстрагируемому веществу. Обсуждаются особенности и достоинства микроэкстракции с диспергированием растворителя в ИЖ, образующейся in situ.
Одной из насущных задач современной аналитической химии является переход к новым экологически чистым и эффективным вариантам методов выделения и концентрирования, которые часто являются необходимым этапом подготовки образца к анализу. Жидкость–жидкостная экстракция (ЖЖЭ) – чрезвычайно распространенный, простой, доступный, быстрый и универсальный метод концентрирования. Тем не менее, традиционная ЖЖЭ имеет ряд существенных недостатков: использование больших объемов дорогостоящих растворителей/экстрагентов, не всегда достаточная эффективность и не очень высокие коэффициенты концентрирования, трудности автоматизации. Серьезнейшая проблема связана с использованием и необходимостью утилизации небезопасных, в том числе токсичных, летучих органических растворителей.
В связи с этим актуально развитие микроэкстракции, позволяющей значительно сократить расход реагентов, а нередко и повысить эффективность и селективность извлечения. Чрезвычайно желателен также отказ от традиционных органических растворителей, имеющих ряд существенных недостатков (горючесть, летучесть, токсичность и т.д.). При этом необходимо сохранить или повысить экспрессность и эффективность жидкостной экстракции, особенно в отношении относительно гидрофильных соединений.
В последние десятилетия интерес к жидкостно–жидкостной экстракции как методу концентрирования существенно возрос. Это, несомненно, связано с появлением и развитием новых подходов и приемов для экстракционного концентрирования, связанных, прежде всего, с использованием новых растворителей и, шире, новых двухфазных систем жидкость–жидкость. Новые системы позволяют уйти от необходимости применения традиционных органических растворителей. Наиболее известно использование несмешивающихся с водой ионных жидкостей. Параллельно активно исследуются различные варианты экстракции без органического растворителя – экстракция в двухфазных водных системах и др. Не менее важно появление и постепенное распространение новых технических приемов проведения экстракции — переход к микроэкстракции.
Ионные жидкости – это расплавы органических солей, жидкие при комнатной температуре. Они негорючи, обладают пренебрежимо малым давлением паров, термической и химической стабильностью, низкой (по сравнению с традиционными растворителями) токсичностью, проводят электрический ток. Несмотря на то, что ионные жидкости известны давно (нитрат этиламмония описан в 1914 г.), только в конце прошлого столетия исследователи обратили внимание на них как на принципиально новые, экологически чистые органические растворители с уникальными свойствами. Важнейшая их особенность – низкая летучесть, обусловливающая отсутствие ряда недостатков обычных растворителей. Другая особенность ИЖ как класса – потенциальная возможность получения множества растворителей (в том числе, не смешивающихся с водой) с различными сольватационными/экстракционными характеристиками путем варьирования катиона и аниона жидкой соли.
В настоящее время ИЖ используют во всех видах экстракции. Так, многие ИЖ способны извлекать из газовых фаз пары воды, углекислый газ, углеводороды, эфиры, спирты и альдегиды. Некоторые эвтектические холинсодержащие ИЖ оказались способны к солюбилизации твердых оксидов металлов, этой же способностью по отношению к оксидам и гидроксидам металлов обладает ряд карбоксилсодержащих ИЖ. Однако исторически первым и наиболее важным с практической точки зрения является применение ИЖ в жидкость–жидкостной экстракции, в первую очередь, из водных растворов.
Жидкость–жидкостная экстракция основана на распределении растворенного вещества между двумя несмешивающимися, находящимися в контакте жидкими фазами. Обычно одна из фаз – это вода, другая – неводный органический растворитель. В экстракции существует два широко используемых подхода. Во-первых, это – применение специальных реагентов, так называемых “экстрагентов” – соединений (обычно в органической фазе, т.е. в несмешивающемся с водой растворителе), ответственных за образование экстрагируемого соединения. Экстрагент образует с экстрагируемым соединением комплекс, который имеет более высокую растворимость в неводной фазе и тем самым обеспечивает экстракцию. Во-вторых, применяют экстракцию обычным растворителем, т.е. в отсутствие экстрагента, так называемую “non-reactive extraction”. Исторически экстракцию с комплексообразующими экстрагентами широко использовали и используют для извлечения неорганических веществ, которые обычно плохо растворяются в органических растворителях, тогда как экстракция в органический растворитель в отсутствие экстрагента имеет широкое распространение для извлечения органических веществ. Важно, что ИЖ можно использовать в обоих вариантах экстракции.
Для ИЖ в двухфазных экстракционных системах предпочтительно использовать термин “экстракционный растворитель” (extraction solvent). Ионная жидкость – это экстракционный растворитель, который можно использовать для растворения некоторых экстрагентов, специально вводимых для взаимодействия с экстрагируемым веществом с целью образования экстрагирующегося соединения. Но в некоторых случаях ИЖ – экстракционный растворитель – может быть вовсе не инертным по отношению к экстрагируемому веществу, а действовать как экстрагент. (Конечно, такие примеры, но реже встречающиеся, есть и среди молекулярных растворителей, достаточно упомянуть трибутилфосфат.) Наконец, ИЖ может не быть экстракционным растворителем, но являться экстрагентом, который добавляют к разбавителю – молекулярному растворителю или ИЖ.
Развитие экстракционной химии с применением ИЖ в качестве экстракционного растворителя включает два основных направления: 1) использование координационно-инертных ИЖ в качестве удобных, эффективных и “зеленых” разбавителей для тех же экстрагентов, которые применяют в традиционной экстракции; 2) синтез и применение координационно-активных или комплексообразующих ИЖ с функционально-аналитическими группами (ФАГ), инкорпорированными в катионную и/или анионную составляющую ИЖ, причем спектр действия этих ФАГ может быть весьма широк. Частный случай таких ИЖ – высокоспециализированные ИЖ (task specific ionic liquids), создаваемые под конкретную экстракционную задачу или узкий круг задач.
Классические ИЖ. Первые примеры использования ИЖ в экстракции появились в самом конце 20-го в. Это касается как органических соединений [1] (1998), так и ионов металлов [2, 3]. В этих первых исследованиях применяли ИЖ на основе катионов диалкилимидазолия и фторированных анионов. Наиболее яркие представители ионных жидкостей такого типа, так называемых “классических” ИЖ, – гексафторфосфат 1-бутил-3-метилимидазолия, C1C4ImPF6, и бис(трифлил)имид 1-бутил-3-метилимидазолия, C1C4ImTf2N, – привлекали широкое внимание исследователей в течение длительного периода (с начала 90-х гг. и в течение последующих двух десятилетий). Классические ИЖ оказались подходящими для экстракции гидрофобными растворителями по многим причинам, которые напрямую связаны с присутствием атомов фтора. В частности, фторирование имеет благоприятный “разжижающий” эффект: высокофторированные соединения, как правило, имеют более низкую температуру плавления, чем их нефторированные аналоги; фторированные соединения часто не смешиваются с водой и имеют низкую растворимость в воде (эти общие тенденции связаны с относительно низкой электронной поляризуемостью атомов фтора, что является причиной снижения силы межмолекулярных дисперсионных взаимодействий). Еще одним преимуществом фторсодержащих ИЖ является их относительно невысокая для ионных жидкостей вязкость (хотя она, конечно, гораздо выше, чем вязкость молекулярных растворителей). Помимо перечисленных достоинств основное значение имела высокая эффективность экстракции в имидазолиевые ИЖ, а в ряде случаев и высокая селективность.
Тем не менее, быстро стало ясно, что “классические” ИЖ далеки от совершенства по ряду причин. Они не экономичны и не всегда легкодоступны. В некоторых случаях они слишком хорошо растворимы в воде и гидролитически нестабильны (гексафторфосфат медленно разлагается в водном растворе с образованием плавиковой кислоты). Кроме того, фторированные соединения характеризуются низкой биоразлагаемостью и/или биосовместимостью. Что касается гидрофобности катионных и анионных составляющих “классических” гидрофобных ИЖ, они во многих случаях оказываются недостаточно гидрофобны. В связи с этим при ионообменном механизме экстракции потери катионной/анионной составляющей ИЖ весьма существенны и значительная часть ИЖ теряется. По крайней мере, некоторые из перечисленных недостатков могут быть связаны с наличием фторсодержащих компонентов в ИЖ.
Это привело к все еще продолжающемуся поиску новых ИЖ с улучшенными свойствами для целей экстракции. В целом за последние десятилетия отмечена огромная активность в поиске новых не смешивающихся с водой ИЖ, не содержащих фторированных компонентов, более экономичных и доступных, с улучшенными свойствами, полезными для экстракции. Ведется поиск новых катионных составляющих – альтернативы диалкилимидазолиевым катионам, а также новых анионных составляющих, активных при взаимодействии с экстрагируемыми соединениями.
Гидрофильно-гидрофобные ионные жидкости. Свойства, взаимная растворимость с водой. Мы синтезировали несколько несмешивающихся с водой ИЖ с “нестандартными” анионами, содержащими карбоксилатную группу, и изучили их свойства, в том числе экстракционные. Они резко отличаются от свойств солей замещенного имидазолия с фторированными анионами. Получены, в частности, следующие ИЖ: салицилат триоктилметиламмония (TOMAS), N-лауроилсаркозинат тетраоктиламмония (TOALS) и дигексилсульфосукцинат тетрагексиламмония (THADHSS) [4, 5].
Важно отметить, что эти ИЖ содержат доступные и относительно дешевые анионные компоненты – дигексилсульфосукцинат, N-лауроилсаркозинат – анионы промышленно выпускаемых ПАВ. Ионные жидкости характеризуются хорошей биоразлагаемостью, содержат нетоксичные анионы, способные проявлять комплексообразующие свойства по отношению к ионам металлов. Они легкодоступны, относительно дешевы по сравнению с типичными фторированными и функционализированными ИЖ, синтез их несложен.
Чрезвычайно интересно, что новые ИЖ не смешиваются с водой, однако содержание воды в них весьма значительно (в случае TOALS – более 10 мас. %). При этом растворимость ИЖ в воде крайне мала. Так, растворимость в воде TOALS, TOMAS и THADHSS составляет (1.1 ± 0.5) × 10–5, (2.0 ± 0.2) × 10–4 и (8.6 ± 0.5) × 10–5 М [5, 6] соответственно. Эти значения на два–три порядка ниже растворимости классических имидазолиевых ИЖ, широко используемых в экстракции (растворимость в воде гексафторфосфата и бис(трифлил)имида 1-бутил-3-метилимидазолия 0.075 и 0.018 М [6]). Очевидно, что низкая растворимость в воде – благоприятный фактор, обусловливающий как низкую степень загрязнения водных фаз, так и возможность многократного использования ИЖ в экстракции.
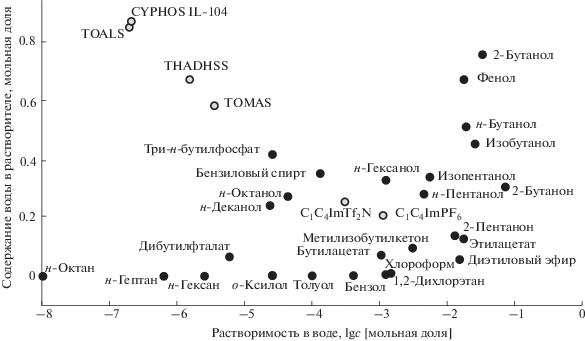
В то же время эти ИЖ содержат большое количество растворенной воды после насыщения: 13.2, 4.8 и 5.0 мас. % для TOALS, TOMAS и THADHSS соответственно, что в мольных долях составляет 0.86, 0.59 и 0.68. Согласно данным Мойера [7] для “мокрых” растворителей (“wet solvents”) содержание воды χw > 0.13. В соответствии с этим TOALS, TOMAS и THADHSS являются экстремально “мокрыми”. В действительности они содержат так много воды, как самые “увлажненные” из известных молекулярных растворителей (χw составляет 0.42 для три-н-бутилфосфата, 0.52 для н-бутанола, 0.67 для фенола [8]). Необычный гидрофильно-гидрофобный характер ИЖ TOALS, TOMAS и THADHSS демонстрирует рис. 1, представляющий общую картину взаимной растворимости выбранных гидрофобных растворителей и воды (данные для молекулярных растворителей взяты из монографии Маркуса [8]). Как видно, аммониевые ИЖ располагаются в отдельной области вдали от молекулярных растворителей и классических ИЖ. Эти ИЖ имеют, таким образом, гидрофильно-гидрофобную природу и являются гидрофильно-гидрофобными ионными жидкостями (ГГИЖ).
Низкая растворимость ГГИЖ в воде, несомненно, объясняется относительно высокой гидрофобностью их длинноцепочечных катионов алкиламмония. Высокая растворимость воды в ГГИЖ может быть связана с относительно высокой гидрофильностью их анионов – салицилата, N-лауроилсаркозината и дигексилсульфосукцината. Теоретические расчеты, представленные в работе [9], показали, что, по-видимому, существует два вида воды в бинарной смеси TOALS–вода: свободная вода (1–2 молекулы на кластер, 15–18%) и кластеризованная вода (82–85%). В соответствии со средним расчетным размером кластеров (1.01–1.6 нм) эти кластеры воды в насыщенном водой TOALS занимают скорее промежуточное положение между молекулярными и наночастицами. Громоздкие алкильные заместители в составе катиона ИЖ TOALS создают структурные пустоты, размеры которых позволяют вместить кластеры воды. В целом, однако, молекулы воды предпочитают локализоваться ближе к анионам ИЖ, чем к катионам, что можно объяснить образованием водородных связей с атомами кислорода карбонильной группы аниона.
Описано несколько примеров ИЖ, которые также можно отнести к ГГИЖ. Высокое содержание воды (20–30 мас. %) в фосфониевых ИЖ с аминокислотными анионами [10]. Довольно “влажными” оказались фосфониевые ИЖ CYPHOS®: мольная доля воды (25°С) в насыщенных водой бис(2,4,4-триметилпентил)фосфинате, деканоате, хлориде, бромиде и дицианамиде тридецилтетрагексилфосфония составила 0.891, 0.864, 0.817, 0.678 и 0.510 соответственно [11]. Интересно, что для насыщенной водой ИЖ бис(2,4,4-триметилпентил)фосфинат тридецилтетрагексилфосфония (CYPHOS IL 104) (рис. 1) на одну молекулу ИЖ приходится 8 молекул воды [12]. Вопрос о состоянии воды (гидратационная вода, вода в виде кластеров, обращенных мицелл или других агрегатов) в таких ИЖ по-прежнему остается открытым. Высокое содержание воды в некоторых фосфониевых ИЖ объясняют образованием обратных мицелл [13].
При помощи сольватохромного зонда красителя Райхардта [14] охарактеризована полярность ГГИЖ и показано, что они более полярны, чем такие молекулярные растворители, как хлороформ, ацетон, ацетонитрил. По шкале Димрота–Райхардта сольватохромный параметр ET(30) составляет для TOALS 46.7, для THADHSS 46.5, для TOMAS 48.2. Как видно, полярности всех ИЖ близки; из известных молекулярных растворителей близкой полярностью характеризуется ацетонитрил, ET(30) = 45.4. Для сравнения: для дихлорметана ET(30) = 40.8, для хлороформа 41.0; полярность известных имидазолиевых ИЖ с фторированными анионами заметно выше: для бис(трифлил)имида бутилметилмидазолия 51.6, для бис(трифлил)имида гексилметилимидазолия 51.8, для гексафторфосфата бутилметилимидазолия 52.5.
Экстракция металлов в новые ионные жидкости (в отсутствие реагента). Анионы новых ИЖ потенциально способны к комплексообразованию. Салицилатные комплексы металлов хорошо известны; лауроилсаркозинат – анион замещенной аминокислоты – обладает выраженной комплексообразующей способностью. Это позволило нам использовать их для извлечения ионов металлов в отсутствие дополнительных реагентов, которые требуются при экстракции в “классические” ИЖ с инертными анионами. Присутствие в составе TOMAS салицилат-иона, а в составе TOALS N-лауроилсаркозината должно влиять на экстракционные свойства, делая ИЖ не просто инертным растворителем, но еще и комплексообразующим реагентом. Заметим, что, поскольку “реагент” является составной частью растворителя, его концентрация весьма высока. Рассчитанная исходя из стехиометрии катион : анион = 1 : 1 концентрация N-лауроилсаркозината в ИЖ TOALS составляет 1.26 М, концентрация салицилат-иона в TOMAS – 1.86 М. Таким образом, очевидна потенциальная перспективность этих ИЖ для экстракции и концентрирования ионов металлов из водных растворов.
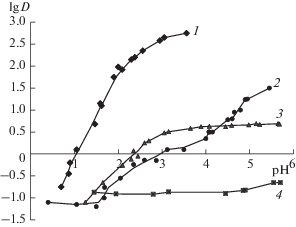
Подробно изучена экстракция ионов переходных металлов в ГГИЖ. Степень извлечения Fe3+ и Cu2+ в TOMAS составила 99 и 89% (VИЖ : Vв = 1 : 5) соответственно в отсутствие дополнительных реагентов [4]. Очевидно преимущество этой ИЖ при экстракции ионов металлов, имеющих наибольшие значения констант устойчивости салицилатных комплексов. Так, максимальное значение коэффициента распределения для Fe3+ (lgD = = 2.70, pH 3.0) в TOMAS значительно выше, чем для Cu2+ (1.49, pH 5.5), Ni2+ (0.70, pH 5.5) и Mn2+ (–0.65, pH 5.5). Эффективность экстракции, значения lgDmax, pH50 хорошо согласуются с константами устойчивости салицилатных комплексов соответствующих металлов. Низкое извлечение марганца можно объяснить нестабильностью его салицилатных комплексов. При снижении рН экстракция ионов металлов в ИЖ резко уменьшается, что можно объяснить диссоциацией салицилатных комплексов из-за протонирования салицилат-иона.
Общее равновесие для экстракции Fe3+ можно представить следующим образом:
Это уравнение подразумевает высвобождение двух протонов в водную фазу, что хорошо согласуется с наблюдаемым угловым коэффициентом рН-профиля экстракции Fe3+ (рис. 2). Данный механизм подтверждается также результатами спектрального анализа водных фаз и экстрактов.
Рис. 2.
Зависимость коэффициентов распределения Fe3+(1), Cu2+ (2), Ni2+ (3), Mn2+(4) в системе TOM-AS–вода от рН (сМе = 1 × 10–4 М, Vo : Vв = 1 : 5).
В случае ионов двухвалентных металлов общее уравнение процесса экстракции можно представить следующим образом:
Коэффициенты селективности αFe/M для Fe3+ по отношению к обычно сопутствующим ему ионам металлов оказались довольно высокими, за исключением пары Fe/Cr, однако даже в этом случае значение α вполне удовлетворительное (для М = Mn2+, Co2+, Zn2+, Ni2+, Cr3+ αFe/M равно 490, 387, 382, 370, 62 соответственно).
Таким образом, TOMAS является высокоэффективным экстракционным растворителем для извлечения некоторых ионов переходных металлов из водных растворов. Важно, что оба исходных вещества, используемые для синтеза, легкодоступны и недороги, и процедура синтеза довольно проста.
Отдельного внимания заслуживает экстракция некоторых токсичных ионов металлов, концентрирование и определение которых представляет практический интерес (например, Cd2+, Pb2+, Hg2+ и др.) в ГГИЖ в отсутствие дополнительных комплексообразующих реагентов.
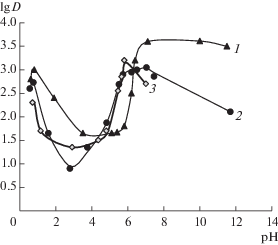
Показано, что экстракция кадмия(II) в TOALS из солянокислых (рН 1–2) и нейтральных растворов (рН > 5) является количественной в отсутствие дополнительных экстрагентов, коэффициенты распределения (lg D) > 3 для диапазона концентраций Сd2+ 1 × 10–5–1 × 10–3 М при соотношении VTOALS : Vв = 1 : 10 [15] (рис. 3). При рН 3–4 на кривых экстракции наблюдается уменьшение извлечения, что, несомненно, указывает на смену экстракционного механизма при увеличении рН. Исследование зависимости экстракции от рН, концентраций N-лауроилсаркозината и хлорид-ионов, а также элементный анализ экстрактов позволили предположить возможные механизмы извлечения ионов кадмия в TOALS. Экстракцию кадмия из нейтральных и слабощелочных водных растворов (с учетом состава экстрактов) можно представить следующим равновесием:
Рис. 3.
Зависимость коэффициентов распределения Cd2+ (1), Pb2+ (2), Hg2+ (3) в системе TOALS–вода от рН (сМе = 1 × 10–4М, Vo : Vв = 1 : 10).
Состав комплекса металла указан “с точностью до” возможного присутствия координированных молекул воды. Отметим, что приведенная схема не является единственно возможной и, вообще говоря, нуждается в дополнительном прямом подтверждении (например, в прямом доказательстве координации различных лигандов кадмием). Однако она согласуется с приведенным набором косвенных доказательств.
При рН 1–2 вероятно извлечение анионных хлоридных комплексов кадмия по механизму ионного обмена; при этом хлорокадматные анионы должны переходить в фазу ионной жидкости, а стехиометрическое количество аниона ИЖ – в воду. (Возможной альтернативой является извлечение нейтральных частиц металлокомплексной кислоты). Это предположение подтверждено изучением влияния концентрации хлорид-иона на экстракцию. Хорошо известна склонность кадмия к образованию анионных галогенидных комплексов, способных экстрагироваться в присутствии крупных катионов-партнеров, например тетраалкиламмония, в сравнительно полярные органические растворители. В случае ионной жидкости нет необходимости во введении специального катиона-партнера, эту роль успешно может играть тетраоктиламмонийный катион самой ионной жидкости.
Общий вид зависимостей коэффициентов распределения Pb2+ и Hg2+ в системе TOALS–вода от рН аналогичен описанному для Cd2+. Количественную экстракцию наблюдали как для извлечения из сильнокислых сред, так и из растворов с pH, близкими к нейтральному. Это позволяет говорить также о подобии механизмов экстракции указанных металлов: в “левой” области (рН < 3) происходит извлечение хлоридных комплексов металлов, в “правой” (рН > 5) – извлечение комплексов, содержащих анион ИЖ и, возможно, хлорид и гидроксил. Из ионной жидкости возможна реэкстракция металлов комплексообразующими реагентами. Так, Hg2+ можно реэкстрагировать раствором тиомочевины с эффективностью около 70%.
Интересно, что подобные различия в экстракционном поведении при разной кислотности и сложный характер рН-зависимостей отмечается в литературе и для некоторых других аммониевых ИЖ с анионами, способными к комплексообразованию с ионами металлов. Так, при рН > 7 в олеаты тетраалкиламмония экстрагируются олеатные комплексы марганца, кобальта и никеля, а при рН < 1 извлекаются тетрахлорокобальтат и тетрахлороманганаты, никель же не образует хлоридные комплексы и не экстрагируется [16].
Экстракция металлов водорастворимыми реагентами. Гидрофильно-гидрофобные ионные жидкости TOMAS и TOALS эффективно извлекают переходные металлы (Fe, Cd, Cu и др.) в отсутствие дополнительных экстрагентов и без разбавителя. Но ГГИЖ имеют некоторые особенные свойства: не смешиваются с водой, но содержат много воды при насыщении (мольная доля воды в насыщенных водой TOALS и TOMAS составляет 86 и 59% соответственно). Такие растворители являются подходящей средой для солюбилизации водорастворимых реагентов и экстракции комплексов металлов с водорастворимыми реагентами, т.е. ГГИЖ могут являться и разбавителями экстрагентов.
Нами исследовано распределение классических водорастворимых реагентов (ВРР) арсеназо I, арсеназо III, ксиленолового оранжевого (КО), ализаринового красного С (АКС), нитрозо-Р-соли (НРС) между водой и ионными жидкостями TOMAS и TOАLS. Все исследованные реагенты гидрофильны, содержат одну или две сульфогруппы помимо других ионогенных и полярных групп, что делает их водорастворимыми и малопригодными для экстракции и извлечения их комплексов с ионами металлов. Тем не менее, эти реагенты интересны тем, что проявляют комплексообразующую способность, например, арсеназо III является избирательным реагентом для ряда металлов – Sc, Zr, Hg(II), U(VI), РЗЭ. Необходимая избирательность в каждом случае обеспечивается соответствующими условиями работы, например, установлением высокой кислотности или применением маскирующих реагентов. Арсеназо III, так же как и его аналоги, не растворяется в органических растворителях и неспособен экстрагироваться. То же относится к соответствующим комплексам с элементами. Обычно для экстракции комплексов металлов с арсеназо III, так же как и с другими водорастворимыми реагентами, используют подходящие гидрофобные катионы (например, дифенилгуанидиний), блокирующие сульфогруппы реагента, и активные растворители, например спирты.
Нами показано, что все перечисленные выше ВРР количественно экстрагируются в ГГИЖ, причем при соотношении объемов органической и водной фаз 1 : 20. Время достижения экстракционного равновесия составляет 5–10 мин для всех изученных реагентов [17]. Арсеназо III (5 × 10–5–1 × 10–2 М) количественно экстрагируется в T-OMAS при рН 5.9–9.1 (lg D = 3.05), в TOALS при рН 6.2–10.4 (lg D = 3.39) (рис. 4). Экстракция в обе ИЖ незначительно понижается при уменьшении рН (lg D > 2) до рН 1.8. Для арсеназо I степень извлечения составила 80–95%. Таким образом, экстракция азореагентов практически не зависит от ионного состояния реагента в растворе. Интересно отметить, что значения коэффициента распределения (lg D) арсеназо III при рН 3.5 в TOALS и TOMAS cоответственно 2.2 и 2.15 близки к значению 2.3, полученному для распределения этого реагента в двухфазной водной системе (ДФВС) на основе полиэтиленгликоля (ПЭГ) [рН 3.5; ПЭГ (15%, по массе)–(NH4)2SO4 (14.4%, по массе)] [18]. Заметим, что коэффициент распределения НРС для той же ДФВС при оптимальном рН 5.5 существенно ниже (~100), чем для систем ГГИЖ–вода: lg DНРС > 3 (рис. 4).
Рис. 4.
Распределение водорастворимых реагентов 4-(2-пиридилазо)резорцина (ПАР), нитрозо-Р соли (НРС), арсеназо III, арсеназо I, ксиленолового оранжевого (КО), ализаринового красного С (АКС) в системах ГГИЖ–вода (с = 1 × 10–4–1 × 10–3 М, Vo : Vв = 1 : 20).
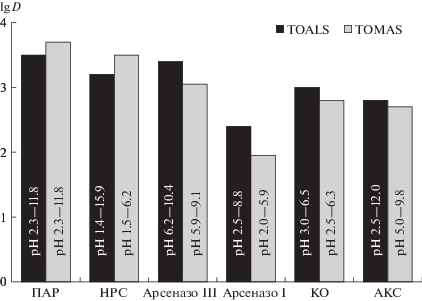
Трифенилметановый краситель ксиленоловый оранжевый широко используют в комплексонометрии в чувствительных и контрастных реакциях с ионами металлов, а также в спектрофотометрии для определения не менее 20 металлов (Zr, Nb, Tl, Bi, Th и др). Ксиленоловый оранжевый количественно экстрагируется в обе ИЖ в виде одно-, двух- и трехзарядных анионов, которые преобладают при рН 2.5–6.5; извлечение многозарядных анионов КО снижается при рН > 7.5 лишь до 75–80%. Количественная экстракция АКС наблюдается в широком диапазоне концентраций 1 × 10–4–1 × 10–2 М и практически нечувствительна к ионному состоянию реагента.
Как известно, экстракция в молекулярные растворители ухудшается с ростом заряда экстрагируемого соединения. Однако ГГИЖ свойственна эффективная экстракция многозарядных анионов. Гидрофобные катионы тертаалкиламмония, по-видимому, выполняют функцию противоиона при экстракции анионных форм ВРР. Кроме того, на распределении ВРР в системе ИЖ–вода сказывается гидрофильно-гидрофобный характер ИЖ, высокое содержание воды после насыщения.
Способность к солюбилизации гидрофильных аналитических реагентов в сочетании с гидрофильным характером исследуемых ионных жидкостей создает предпосылки для экстракции комплексов металлов с изученными водорастворимыми реагентами. Это продемонстрировано на примере экстракции скандия(III) с арсеназо III и кобальта(II) с НРС [17].
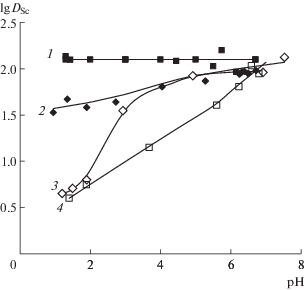
Скандий(III) экстрагируется с арсеназо III в обе ИЖ (рис. 5). Следует отметить, что скандий экстрагируется в TOMAS из нейтральных водных растворов и в отсутствие дополнительных реагентов. Это объясняется комплексообразующими свойствами аниона ИЖ – салицилата. Однако извлечение зависит от рН и резко уменьшается при его понижении. Извлечение из кислых растворов не превосходит 20%. В присутствии арсеназо III извлечение скандия из кислых растворов становится близким к количественному: lg DSc = 2.1 при рН 1.3–6.7. Аналогичный эффект имеет место при экстракции в TOALS. Время достижения экстракционного равновесия не превышает 15 мин. Соотношение компонентов скандий : арсеназо III в экстрагирующемся комплексе составило 1 : 1. (Для сравнения экстракция скандия в присутствии арсеназо III в ДФВС на основе ПЭГ незначительна: коэффициент распределения (D) при рН > 4 составляет менее 1).
Рис. 5.
Зависимость коэффициента распределения скандия (8 × 10–5 М) в системах ИЖ–вода от рН в присутствии и в отсутствие арсеназо III (8 × 10–4 М), VИЖ : Vв = 1 : 10. 1 – Sc–арсеназо III–TOMAS, 2 – Sc–арсеназо III–TOALS, 3 – Sc–TOALS, 4 – Sc–TOMAS.
Кобальт(II) (5 × 10–5 М) экстрагируется количественно в присутствии НРС (5 × 10–4 М) при рН 1.5–5.5 в TOALS и при рН 1.1–6.3 в TOMAS. Время достижения экстракционного равновесия не превышает 10 мин, Vo : Vв = 1 : 10. Интересно, что в отсутствие комплексообразующих реагентов кобальт(II) не экстрагируется в исследуемые ИЖ. Установлено, что соотношение кобальт : НРС в экстрагирующемся комплексе составляет 1 : 2. Максимум поглощения комплексов кобальта(II) c НРС при 490 нм в фазе ГГИЖ совпадает с максимумом поглощения комплекса в водном растворе. Для устранения мешающего влияния ионов Fe(III), Ni(II), Cu(II), способных образовывать устойчивые комплексы с НРС, использовали реэкстракцию солянокислыми растворами. Посторонние металлы при этом количественно переходят в реэкстракт, комплекс кобальта остается в органической фазе. Предложена методика экстракционно-фотометрического определения кобальта в реальных объектах c пределами обнаружения 0.011 (TOMAS) и 0.017 мкг/мл (TOALS).
В ГГИЖ можно проводить групповое концентрирование металлов в присутствии подходящего группового реагента. Так, 4-(2-пиридилазо)резорцин (ПАР) является неселективным реагентом, поскольку образует устойчивые водорастворимые комплексы со многими металлами. Высокая чувствительность реакций комплексообразования ПАР с ионами металлов является несомненным достоинством для группового концентрирования. Комплексы металлов с ПАР можно экстрагировать и в традиционные для экстракции растворители, например в хлороформ, однако для этого требуется вводить гидрофобные катионы-партнеры, например дифенилгуанидиний, тетраалкиламмоний, тетразолий и др.
В ГГИЖ ПАР (5 × 10–4–1 × 10–2М) количественно экстрагируется в широком интервале рН 2.3–11.8; коэффициенты распределения (lg D) составили 3.5 и 3.7 (Vиж : Vв = 1 : 20) для TOALS и TOMAS соответственно [19]. Примечательно, что степень извлечения ПАР не зависит от его ионного состояния в водном растворе, а время достижения экстракционного равновесия не превышает 5 мин. В молекулярные растворители, например в хлороформ, ПАР экстрагируется только в нейтральной форме, при этом коэффициент распределения (D) составляет <100 в узком диапазоне рН 3–5 [20]. В присутствии объемных гидрофобных катионов, таких как тетрафениларсоний или тетрафенилфосфоний, при pH 3–10 наблюдается ион-парная экстракция однозарядного аниона реагента. В диалкилимидазолиевые ИЖ ПАР экстрагируется предпочтительно в молекулярной форме, коэффициент распределения составляет 10–100 при Vиж : Vв = 1 : 5. Практически количественную экстракцию ПАР наблюдали в ИЖ тетрафторборат 1-метил-3-октилимидазолия в присутствии значительного количества высаливателя, при этом время достижения экстракционного равновесия составляет не менее 40 мин [21]. Как видно, имидазолиевые ИЖ по своей экстрагирующей способности существенно уступают ГГИЖ на основе катионов тетраалкиламмония и анионов карбоновых кислот. Водорастворимый реагент ПАР извлекается количественно в TOALS и TOMAS в широком диапазоне рН независимо от его ионного состояния в отсутствие высаливающих агентов и противоионов. Все это создает предпосылки для эффективной экстракции комплексов металлов с ПАР в ионные жидкости.
В присутствии ПАР (1 × 10–4 М) Сd2+, Pb2+, Cu2+, Zn2+ и Co2+ количественно экстрагируются в TOALS и TOMAS (VИЖ : Vв = 1 : 10) из водных растворов при рН > 6. Экстракционное равновесие достигается менее чем за 15 мин. Примечательно, что экстракция кобальта, не извлекающегося в ИЖ в отсутствие реагента, в присутствии ПАР количественна в широком диапазоне рН 4–11, для двух ИЖ TOALS и TOMAS lg DСо составляют 2.5 и 3.0 при рН 6.5 соответственно. Установлено, что соотношение кобальт(II) : ПАР в экстрагирующемся соединении составляет 1 : 2.
Экстракция ионов металлов в образующиеся in situ ионные жидкости. Интересным и перспективным с точки зрения повышения эффективности экстракции, простоты ее осуществления и отсутствия необходимости предварительного синтеза ИЖ является вариант, недавно предложенный зарубежными исследователями. Это – микроэкстракция в ИЖ, образующуюся in situ, т.е. “по месту использования” [22, 23]. Метод заключается в применении для экстракции гидрофильной ионной жидкости, из которой в ходе реакции обмена при добавлении соответствующей соли – анионообменного агента, in situ образуется гидрофобная ИЖ, выделяющаяся в отдельный от воды слой. На сегодняшний день имеется около трех десятков работ, в которых для экстракции ионов металлов in situ получали только “классические” диалкилимидазолиевые ИЖ с фторированными анионами, причем только исходя из водорастворимых ИЖ. Как известно, фторированные анионы неустойчивы по отношению к гидролизу, что ставит под сомнение экологичность используемых систем.
Нами показано [24], что для получения ИЖ in situ необязательно использовать гидрофильную ИЖ. “Возникающий экстрагент” – гидрофобная ИЖ–может быть получен при смешении в водном растворе солей, содержащих компоненты ИЖ, даже если обе соли твердые. Образующаяся ИЖ отделяется от воды и может использоваться для разделения и концентрирования. Получены in situ ионные жидкости на основе катионов четвертичного аммония и нефторированных анионов N-лауроилсаркозината тетраоктиламмония (TOALS), диоктилсульфосукцинатов тетрагексиламмония (THADOSS) и тетрабутиламмония (TBADOSS); исследована экстракция ионов металлов в образующиеся in situ ИЖ.
Так, при совместном растворении в воде бромида тетраоктиламмония и N-лауроилсаркозината натрия образуется in situ не смешивающаяся с водой ионная жидкость N-лауроилсаркозинат тетраоктиламмония (TOALS). В возникающую таким образом новую фазу из водного раствора можно экстрагировать в присутствии ПАР ионы Cd, Co, Cu, Ni, Pb и Zn, а ионы кадмия – и в отсутствие ПАР. На степень извлечения металлов в образующуюся ИЖ влияет соотношение катионной и анионной составляющих ИЖ при ее получении. Это соотношение определяет количество образующейся ИЖ, степень диспергирования и, что существенно, легкость разделения фаз. Максимальное извлечение достигается при отношении LSNa : ТОАBr = 1 : 1. Низкая растворимость TOALS в воде позволяет избежать потерь ИЖ при экстракции. Такие потери весьма существенны при получении in situ фторированных ИЖ, для их снижения вводят избыток анионобменного агента, понижающего растворимость ИЖ. На эффективность экстракции в TOALS заметно влияет pH водных растворов. В оптимальных условиях (VИЖ : Vв = 1 : 40, VИЖ = 100 мкл, сПАР = 1 × 10–2 М, сМе = 0.2–1.0 мг/л) для количественной экстракции Cd (рН 1.6–2.6, 9.0–12.0) и Co (9.2–11.0) достаточно встряхивания в течение 1 мин.
Показана возможность и найдены оптимальные условия количественного извлечения ряда металлов в образующиеся in situ ИЖ диоктилсульфосукцинаты тетрагексиламмония (THADOSS) и тетрабутиламмония (TBADOSS) и их определения методом атомно-эмиссионной спектрометрии с микроволновой плазмой, в том числе в режиме in situ. (Эти ИЖ синтезировали зарубежные коллеги [25], но для экстракции их не использовали). В присутствии ПАР (1 × 10–3 М) при рН 5 ионы Cd2+, Co2+, Pb2+, Ni2+, Zn2+, Cu2+ (200 мкг/л) количественно экстрагируются в образующуюся in situ ИЖ THADOSS при двукратном избытке THABr по отношению к DOSSNa при VИЖ : Vо = = 1 : 40.
Экстракция органических соединений. Наша группа систематически исследовала экстракцию органических соединений различных классов (фенолы, кислоты, амины, катехоламины и различные полифункциональные соединения) в классические ИЖ и аммониевые ГГИЖ [5, 26–30]. Ряд публикаций [26–28, 30] посвящен экстракции фенольных соединений, что чрезвычайно важно с практической точки зрения, поскольку производные фенола зачастую весьма токсичны и являются распространенными загрязнителями природных вод, и проблема их извлечения и мониторинга весьма актуальна. Для определения следовых количеств фенольных соединений обычно требуется предварительное концентрирование и отделение от сопутствующих веществ, однако извлечение традиционными органическими растворителями в этом случае часто не приносит желаемых результатов из-за невысоких эффективности и селективности. Кроме того, фенольные соединения представляют большой класс структурно разнообразных веществ, что позволяет на их примере проследить закономерности влияния структуры извлекаемого соединения на экстракционно-сольватационное поведение ИЖ.
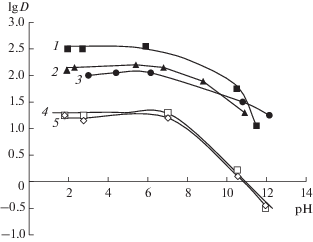
Для ИЖ характерно максимальное извлечение незамещенного фенола в кислой и нейтральной областях, где преобладает незаряженная форма, и уменьшение коэффициента распределения в щелочной области (рис. 6). Для имидазолиевых ИЖ бис(трифлил)имидов 1-гексил-3-метилимидазолия и 1-децил-3-метилимидазолия, HMImTf2N и DMImTf2N соответственно, характерно резкое падение экстракции в щелочной области, и при рН > 12 степень извлечения становится незначительной и составляет менее 10%. Коэффициенты распределения фенола для аммониевых ГГИЖ примерно на порядок выше, чем для имидазолиевых ИЖ. Кроме того, даже при рН 12 извлечение фенола в ГГИЖ все еще остается заметным (R ~ ~ 40–50%).
Рис. 6.
Влияние рН на распределение фенола (1 × 10–4 М) в ионные жидкости. VИЖ : Vв = 1 : 20 для THADHSS (1), TOALS (2), TOMAS (3); VИЖ : Vв = 1 : 3 для HMImTf2N (4), DMImTf2N (5).
При экстракции в ГГИЖ замещенных фенолов (нитрофенолы, нафтолы) количественное извлечение наблюдается практически во всем изученном диапазоне pH без выраженного спада в щелочной области. Причем во всех случаях коэффициенты распределения в THADHSS, TOALS и TOMAS значительно выше, чем в “классические” ИЖ (таблица). Такое поведение заметно отличает ГГИЖ и от молекулярных растворителей, и от “классических” имидазолиевых ИЖ с фторированными анионами, которые экстрагируют фенолы в молекулярной форме, т.е. предпочтительно из кислых сред. Это указывает на возможность извлечения фенолят-ионов из щелочных сред по механизму анионного обмена в дополнение к экстракции нейтральных форм. Естественно, что анионный обмен эффективнее для более гидрофобных нитрофенолов и нафтолов, чем для фенола. Вклад анионообменной экстракции подтвержден на примере извлечения 2,4-динитрофенола в TOMAS – наблюдали прирост концентраций аниона ИЖ и салицилата в водной фазе после экстракции.
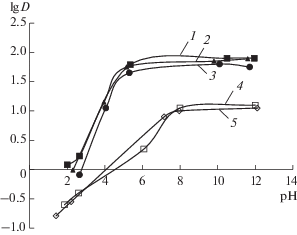
В случае экстракции аминов pH-зависимости извлечения в ГГИЖ аналогичны таковым для молекулярных растворителей и “классических” ИЖ (экстракция наиболее эффективна при pH > pKa), что свидетельствует об извлечении незаряженных форм (рис. 7). В отличие от фенолов, ароматические амины плохо экстрагируются в ионизованной форме. Наиболее эффективно извлекается самый гидрофобный из исследованных аминов (триптамин), наименее эффективно – самый гидрофильный (кофеин) (таблица).
Рис. 7.
Влияние рН на распределение анилина (1 × × 10–4 М) в ионные жидкости. VИЖ : Vв = 1 : 20 для THADHSS (1), TOALS (2), TOMAS (3); VИЖ : Vв = 1 : 3 для HMImTf2N (4), DMImTf2N (5).
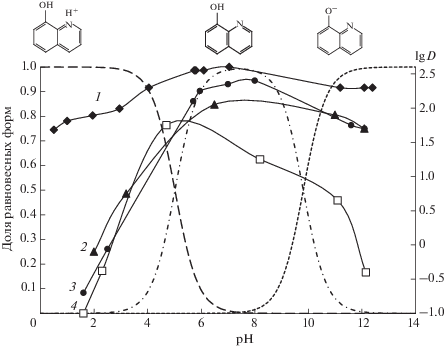
Характерным примером экстракции амфотерных соединений является зависимость коэффициентов распределения 8-гидроксихинолина от рН (рис. 8 ). Его катионная форма практически не извлекается в ИЖ, в то время как анионная форма достаточно хорошо экстрагируется в TOMAS, TOALS и THADHSS, но не в HMImTf2N. Это свидетельствует в пользу вклада анионообменного механизма в экстракцию 8-гидроксихинолина в аммониевые ГГИЖ. Следует отметить, что TOMAS, TOALS и THADHSS – более эффективные экстракционные растворители для амфотерных соединений, чем имидазолиевые ИЖ.
В анионной форме в ГГИЖ эффективно экстрагируются такие гидрофильные соединения, как рибофлавин и аминокислоты. Для рибофлавина характерно увеличение степени извлечения до 95% в случае TOALS и до 80% в случае TOMAS при рН > 8 (VИЖ : Vв.= 1 : 10, время экстракции 15 мин). Коэффициенты распределения рибофлавина (lg D) составили 2.1 и 1.6 для TOALS и TOMAS соответственно. Степень извлечения молекулярной формы рибофлавина в ГГИЖ из кислых и нейтральных растворов не ниже 40–50%. Рибофлавин можно определять по собственной флуоресценции в фазе ионной жидкости после экстракции. На примере экстракции триптофана и фенилаланина (1 × 10–4М) показано, что максимальное извлечение аминокислот в ГГИЖ наблюдается в щелочной области. При рН > 10 степень извлечения триптофана в TOALS достигает 65 ± 3%, в TOMAS – 84 ± 3% при соотношении объемов органической и водной фаз 1 : 10; коэффициенты распределения составили 1.2 и 1.6 для TOALS и TOMAS соответственно. В имидазолиевые ИЖ аминокислоты экстрагируются количественно в катионной форме только в присутствии краун-эфира ДЦГ18К6 [29].
Рис. 8.
Зависимость коэффициента распределения 8-гидроксихинолина (5 × 10–4 М) в системах ИЖ–вода от рН. 1 – TOALS, 2 – TOMAS, 3 – THADHSS, 4 – HMImTf2N; (----) – анион, (- -·-·-) – молекула, (– – –) – катион.
В целом, способность к экстракции и сольватации анионных форм ионогенных соединений – универсальная особенность исследованных гидрофильно-гидрофобных ионных жидкостей на основе катионов четвертичного аммония (THADHSS, TOMAS и TOALS), которые являются высокоэффективными экстрагентами различных органи-ческих соединений. Практически всегда ГГИЖ по экстракционной способности превосходят “классические” имидазолиевые ИЖ с фторированными анионами. Высокие значения коэффициентов распределения (для большинства изученных соединений) в ГГИЖ открывают широкие перспективы для применения этих растворителей в экстракции и анализе.
Таблица 1.
Коэффициенты распределения (lg D) фенолов и аминов в системе ионная жидкость–вода
| Экстрагируемое соединение | lg Pow | THADHSS | TOMAS | TOALS | HMImTf2N |
|---|---|---|---|---|---|
| Фенол | 1.46 | 2.5 | 2.1 | 2.1 | 1.30 |
| 4-Нитрофенол | 1.91 | 3.6 | 3.4 | 3.2 | 1.60 |
| 2,4-Динитрофенол | 1.67 | 4.1 | 3.5 | 3.3 | 1.86 |
| 2,6-Динитрофенол | 1.37 | 4.0 | 3.6 | 3.4 | 1.67 |
| 2,4,6-Тринитрофенол | 1.33 | 3.9 | 3.8 | 3.6 | 1.69 |
| 1-Нафтол | 2.85 | 3.8 | 3.4 | 3.7 | 2.5 |
| 2-Нафтол | 2.70 | 3.7 | 3.2 | 3.6 | 2.4 |
| Анилин | 0.90 | 1.9 | 1.8 | 2.0 | 1.16 |
| п-Толуидин | 1.39 | 2.0 | 2.0 | 2.1 | 1.46 |
| 3-Нитроанилин | 1.37 | 2.3 | 2.3 | – | 1.62 |
| Триптамин | 1.55 | 3.5 | 2.6 | – | – |
Список литературы
Huddleston J.G., Rogers R.D. Room temperature ionic liquids as novel media for ‘clean’ liquid–liquid extraction // Chem. Commun. 1998. № 16. P. 1765.
Dai S., Ju Y.H., Barnes C.E. Solvent extraction of strontium nitrate by a crown ether using room-temperature ionic liquids // J. Chem. Soc. Dalton Trans. 1999. № 8. P. 1201.
Visser A.E., Swatloski I.P., Reichert W.M., Griffin S.T., Rogers R.D. Traditional extractants in nontraditional solvents: Groups 1 and 2 extraction by crown ethers in room-temperature ionic liquids // Ind. Eng. Chem. Res. 2000. V. 39. № 10. P. 3596.
Egorov V.M., Djigailo D.I., Momotenko D.S., Chernyshov D.V., Torocheshnikova I.I., Smirnova S.V., Pletnev I.V. Task-specific ionic liquid trioctylmethylammonium salicylate as extraction solvent for transition metal ions // Talanta. 2010. V. 80. № 3. P. 1177.
Egorov V.M., Smirnova S.V., Pletnev I.V. Highly efficient extraction of phenols and aromatic amines into novel ionic liquids incorporating quaternary ammonium cation // Sep. Purif. Technol. 2008. V. 63. P. 710.
Shvedene N.V., Borovskaya S.V., Sviridov V.V., Pletnev I.V. Measuring the solubilities of ionic liquids in water using ion-selective electrodes // Anal. Bioanal. Chem. 2005. V. 381. № 2. P. 427.
Moyer B. A., Sun Y. Solvent Extraction of Alkali Metal Ions / Ion Exchange and Solvent Extraction / Eds. Marcus Y., Marinsky J.A. N.Y.: Marcel Dekker, 1997. V. 13. P. 295.
Marcus Y. The properties of solvents. Wiley, 1998. 264 p.
Popov I.V., Tchougréeff A.L. Applying group functions to description of ionic liquids // Comput. Theor. Chem. 2017. V. 1116. P. 141.
Kagimoto J., Taguchi S., Fukumoto K., Ohno H. Hydrophobic and low-density amino acid ionic liquids // J. Mol. Liq. 2010. V. 153. № 2–3. P. 133.
Freire M.G., Carvalho P.J., Gardas R.L., Santos L.M.N., Marrucho I.M., Coutinho J.A.P. Solubility of water in tetradecyltrihexylphosphonium-based ionic liquids // J. Chem. Eng. Data. 2008. V. 53. № 10. P. 2378.
Blahusiak M., Schlosser S., Martak J. Extraction of butyric acid with a solvent containing ammonium ionic liquid // Sep. Purif. Technol. 2013. V. 119. P. 102.
Marták J., Schlosser Š. Extraction of lactic acid by phosphonium ionic liquids // Sep. Purif. Technol. 2007. V. 57. № 3. P. 483.
Reichardt C. Polarity of ionic liquids determined empirically by means of solvatochromic pyridinium N-phenolate betaine dyes // Green Chem. 2005. V. 7. № 5. P. 339
Смирнова С.В., Баулин В.Е., Торочешникова И.И., Плетнев И.В. Экстракция ионов кадмия, свинца, кобальта, меди и цинка из водных растворов в гидрофильно-гидрофобные ионные жидкости // Вестн. Моск. ун-та. Сер. 2. Химия. 2016. Т. 57. № 1. С. 11. (Smirnova S.V., Pletnev I.V., Baulin V.E., Torocheshnikova I.I. Extraction of cadmium, lead, cobalt, copper, and zinc ions from aqueous solutions into hydrophilic–hydrophobic ionic liquids // Moscow Univ. Chem. Bull. 2016. V. 71. № 1. P. 81).
Parmentier D., Vander Hoogerstraete T., Metz S.J., Binnemans K. Selective extraction of metals from chloride solutions with the tetraoctylphosphonium oleate ionic liquid // Ind. Eng. Chem. Res. 2015. V. 54. № 18. P. 5149.
Smirnova S.V., Samarina T.O., Pletnev I.V. Hydrophobic–hydrophilic ionic liquids for the extraction and determination of metal ions with water-soluble reagents // Anal. Methods. 2015. V. 7. № 22. P. 9629.
Zvarova T.I., Shkinev V.M., Spivakov B.Ya., Zolotov Yu.A. Liquid extraction in the system of aqueous salt solution aqueous polyethylene-glycol solution // Dokl. Akad. Nauk SSSR. 1983. V. 273. P. 107.
Смирнова С.В., Самарина Т.О., Ильин Д.В., Плетнев И.В. Солюбилизация 4-(2-пиридилазо)резорцина в гидрофильно-гидрофобных ионных жидкостях и экстракция ионов тяжелых металлов из водных растворов. 2015. Т. 56. № 5. P. 286. (Smirnova S.V., Samarina T.O., Ilin D.V., Pletnev I.V. Solubilization of 4-(2-pyridylazo)resorcinol in hydrophobic–hydrophilic ionic liquids and extraction of heavy metal ions from aqueous solutions // Moscow Univ. Chem. Bull. 2016. V. 70. № 5. P. 229).
Marić L., Široki M. Extraction of 4-(2-pyridylazo) resorcinol and 4-(2-thiazolylazo) resorcinol with chloroform and tetraphenylarsonium and phosphonium chlorides // Anal. Chim. Acta. 1996. V. 318. № 3. P. 345.
Fan J., Fan Y., Zhang S., Wang J. Extraction of azo dyes from aqueous solutions with room temperature ionic liquids // Sep. Sci. Technol. 2011. V. 46. № 7. P. 1172.
Baghdadi M., Shemirani F. In situ solvent formation microextraction based on ionic liquids: A novel sample preparation technique for determination of inorganic species in saline solutions // Anal. Chim. Acta. 2009. V. 634. № 2. P. 186.
Yao C., Anderson J.L. Dispersive liquid–liquid microextraction using an in situ metathesis reaction to form an ionic liquid extraction phase for the preconcentration of aromatic compounds from water // Anal. Bioanal. Chem. 2009. V. 395. № 5. P. 1491.
Смирнова С.В., Самарина Т.О., Плетнев И.В., Золотов Ю.А. Метод возникающего растворителя: экстракция ионов металлов из водных растворов в образующуюся in situ ионную жидкость // Докл. АН. 2016. Т. 469. № 6. P. 691.
Nishi N., Kawakami E., Shigematsu F., Yamamoto M., Kakiuchi T. // Fluorine-free and hydrophobic room-temperature ionic liquids, tetraalkylammonium bis(2-ethylhexyl)sulfosuccinates, and their ionic liquid-water two-phase properties // Green Chem. 2006. V. 8. № 4. P. 349.
Плетнев И.В., Смирнова С.В., Хачатрян К.С., Зернов В.В. Применение ионных жидкостей в экстракции // Рос. хим. журн. 2004. Т. 48. P. 51.
Khachatryan K.S., Smirnova S.V., Torocheshnikova I.I., Shvedene N.V., Formanovsky A.A., Pletnev I.V. Solvent extraction and extraction-voltammetric determination of phenols using room temperature ionic liquid // Anal. Bioanal. Chem. 2005. V. 381. № 2. P. 464.
Pletnev I.V., Smirnova S.V., Egorov V. M. Liquid-Liquid Extraction of Organic Compounds / Ionic Liquids in Chemical Analysis / Ed. Koel M. CRC Press, 2008. P. 243.
Smirnova S.V., Torocheshnikova I.I., Formanovsky A.A., Pletnev I.V. Solvent extraction of amino acids into a room temperature ionic liquid with dicyclohexano-18-crown-6 // Anal. Bioanal. Chem. 2004. V. 378. № 5. P. 1369.
Smirnova S.V., Samarina T.O., Pletnev I.V. Novel Ionic Liquids for Liquid–Liquid Extraction / Analytical Applications of Ionic Liquids / Ed. Koel M. World Scientific, 2016. P. 139.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии