Журнал аналитической химии, 2019, T. 74, № 3, стр. 163-172
Твердофазная экстракция органических веществ: нетрадиционные методы и подходы
П. С. Федотов 1, *, Г. И. Малофеева 1, Е. Ю. Савонина 1, Б. Я. Спиваков 1
1 Институт геохимии и аналитической химии им. В.И. Вернадского Российской академии наук
119991 Москва, ул. Косыгина, 19, Россия
* E-mail: fedotov_ps@mail.ru
Поступила в редакцию 16.04.2017
После доработки 19.06.2018
Принята к публикации 29.06.2018
Аннотация
Охарактеризованы активно развивающиеся “нетрадиционные” методы твердофазной экстракции (ТФЭ) органических веществ, такие как твердофазная микроэкстракция, динамическая ТФЭ, дисперсионная ТФЭ, матричное твердофазное диспергирование, микроэкстракция в набивном патроне и др. Рассмотрены основные отличительные черты методов, области и перспективы их применения. Показано, что наиболее востребованной является твердофазная микроэкстракция, во многом благодаря возможности полной автоматизации процессов выделения и определения аналитов и легкости сочетания с газовой и жидкостной хроматографией, а также другими аналитическими методами.
Определение следовых количеств органических веществ представляет собой важную, быстро развивающуюся область аналитической химии. Несмотря на высокую эффективность современных физико-химических методов детектирования, определение органических, как и других веществ, в ряде случаев требует специальной подготовки образца к анализу – избирательного выделения аналита и его концентрирования [1, 2].
Перечень органических соединений, прежде всего, входящих в список экологически вредных и поэтому нормируемых, достаточно обширен: пестициды, фенолы, полициклические ароматические углеводороды (ПАУ), лекарственные препараты, наркотические вещества и др. Если принять во внимание разнообразие матриц, которые нужно анализировать (образцы окружающей среды, биологические объекты, пищевые продукты), то становится понятным, насколько сложной является задача разработки методов определения органических соединений [1, 2]
Для выделения и концентрирования органических веществ применяют различные методы, в том числе сорбционные [2], среди которых значительное место занимает твердофазная экстракция с использованием модифицированных силикагелей [1–5]. Термин “твердофазная экстракция” (solid phase extraction, SPE) встречается практически повсеместно в современной зарубежной литературе. Несмотря на смысловое преимущество слова “сорбция” (sorption), мы также будет придерживаться данного термина, что делали и ранее как в оригинальных статьях, так и в обзоре, посвященном применению ТФЭ при выделении и определении неорганических веществ [6].
Применению метода ТФЭ в органическом анализе посвящены многочисленные работы, в том числе ряд обзоров и монографий [2, 7–9]. Следует особо отметить подробный критический обзор, который был недавно опубликован и состоит из двух частей [7, 8]. В первой части рассмотрены физико-химические основы метода ТФЭ, используемые сорбенты (алкилированные силикагели, сополимеры, гидрофильно-липофильно сбалансированные полимеры – hydrophilic lypophilic balanced polymers; полимеры с молекулярными отпечатками – molecularly imprinted polymers; углеродные наноматериалы – нанотрубки, фуллерены, графен и его оксиды; магнитные и другие сорбенты), а также возможности автоматизации метода ТФЭ и детектирования в режиме реального времени (on-line) [7]. Во второй части основное внимание уделено оценке преимуществ и недостатков жидкостной экстракции и ТФЭ, областям практического применения ТФЭ, а также проблеме выбора наиболее приемлемых сорбентов (на примере выделения пестицидов и антибиотиков) [8].
В перечисленных выше работах главным образом рассмотрены методы ТФЭ, которые мы будем называть “традиционными”. К ним относятся методы, основанные на использовании гранулированных материалов, которыми заполнены картриджи, колонки или шприцы. Традиционные методы включают и сочетание концентрирования и выделения органических веществ с помощью ТФЭ с их последующим (оff-line) или одновременным (on-line) определением с использованием, например, хроматографии с масс-спектрометрическим детектированием.
Вместе с этим в последние годы активно развиваются другие “нетрадиционные” и весьма перспективные методы ТФЭ, такие как твердофазная микроэкстракция (solid phase micro extraction), динамическая ТФЭ (solid phase dynamic extraction), дисперсионная ТФЭ (dispersive SPE), матричное твердофазное диспергирование (matrix solid phase dispersion), микроэкстракция в набивном патроне (micro extraction in a packed syringe) и др. Часть перечисленных приемов и методов описана в недавно опубликованном обзоре, посвященном миниатюризации ТФЭ [9].
Цель настоящей работы – обобщить последние данные о нетрадиционных методах ТФЭ, оценить возможности и перспективы их применения для выделения и концентрирования органических веществ. Нетрадиционные методы ТФЭ будут в основном рассмотрены на примере силикагеля как наиболее часто используемого сорбента. Будут затронуты вопросы его модифицирования с целью повышения селективности, а следовательно, и эффективности ТФЭ. Также будут упомянуты сплавленный силикагель, покрытый полидиметилсилоксаном и дивинилбензолом, оксид алюминия, углеродные нанотрубки, магнитные наночастицы и другие сорбенты.
Поскольку некоторые нетрадиционные методы ТФЭ в русскоязычной литературе до сих пор известны не были, в табл. 1 мы предлагаем соответствие англо- и русскоязычных терминов, используемых в обзоре.
ТВЕРДОФАЗНАЯ МИКРОЭКСТРАКЦИЯ
Наиболее активно развивающимся методом нетрадиционной ТФЭ является на сегодняшний день твердофазная микроэкстракция (ТФМЭ – solid phase micro extraction, SPME). Этот метод был предложен в 1990 г., чтобы уйти от основных недостатков “классической” ТФЭ, к которым можно отнести сложности автоматизации и инструментального оформления метода; зависящий от используемых растворителей и кислотности среды “химизм” процесса сорбции; требуемые в ряде случаев несколько стадий сорбции, и, как следствие, длительность анализа [9]. Твердофазная микроэкстракция включает в себя лишь две основные стадии: 1) адсорбцию аналита на поверхности сорбента; 2) десорбцию аналита при повышении температуры. Прежде всего, метод позволяет избавиться от необходимости использования органических растворителей и существенно сократить продолжительность анализа. Следует отметить, что уход от органических растворителей возможен и в традиционной ТФЭ, например, при использовании для десорбции воды в субкритическом состоянии [10].
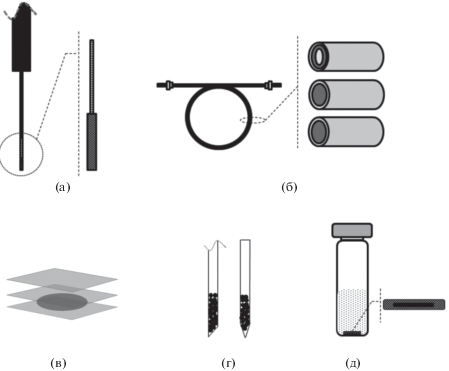
Инструментальные решения для проведения ТФМЭ могут быть различными [11]. В большинстве случаев устройство для ТФМЭ включает в себя твердую нить (стержень) из сплавленного силикагеля, на который нанесена сорбирующая фаза (рис. 1а), что позволяет полностью автоматизировать анализ при сочетании ТФМЭ и газовой хроматографии (ГХ). Автоматизация при сочетании концентрирования и выделения аналитов с помощью ТФМЭ и их определения методом жидкостной хроматографии (ЖХ) может быть достигнута при использовании сорбента, нанесенного на внутренние стенки трубки из сплавленного силикагеля (рис. 1б). Кроме показанных на рисунке, существует еще ряд инструментальных решений для метода ТФМЭ: вращающийся диск, вращающийся стержень и др.
Достаточно простое аппаратурное оформление ТФМЭ и возможность полной автоматизации способствуют разработке новых сорбентов и постоянно растущему числу выделяемых аналитов и анализируемых сложных матриц, включая почвы и донные отложения [11]. Практические приложения ТФМЭ занимают заметное место в современной аналитической химии. Данному направлению посвящен ряд обзорных работ [11–18].
Следует подчеркнуть, что в отличие от жидкостной экстракции и классической ТФЭ, которые подразумевают количественное извлечение определяемых веществ и являются “исчерпывающими” (exhaustive) методами разделения, ТФМЭ основана на равновесном распределении аналита между фазой сорбента и матрицей образца. Волокно, представляющее собой модифицированный силикагель, может быть непосредственно введено в образец (direct immersion) или помещено в газовую фазу над образцом (headspace). Когда сорбирующая фаза находится в непосредственном контакте с образцом, количество аналита, экстрагируемого в равновесных условиях (ne), может быть описано следующим уравнением:
Таким образом, величина ne пропорциональна коэффициенту распределения аналита между экстрагирующим покрытием волокна силикагеля и матрицей образца (Kfs), объему сорбирующей фазы (Vf), объему образца (Vs) и концентрации аналита в образце (cs). Иными словами, количество аналита, извлеченного сорбирующим слоем (ne), прямо пропорционально концентрации аналита в образце (cs). Это и есть основа количественного анализа с использованием ТФМЭ.
Если объем сорбента пренебрежимо мал по сравнению с объемом образца (Vs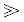 KfsVf), то уравнение (1) может быть упрощено:
KfsVf), то уравнение (1) может быть упрощено:
По сути, уравнение (2) показывает, что количество экстрагируемого в равновесных условиях аналита прямо пропорционально его концентрации в образце и не зависит от объема образца. Это имеет первостепенное значение, прежде всего, при использовании ТМФЭ в анализе объектов окружающей среды (природных вод, воздуха и т.д.) [11]. В ряде случаев, чтобы сократить продолжительность анализа, процесс сорбции прерывают заведомо до установления равновесия. Однако и при этих условиях сохранятся линейное отношение между количеством сорбированного аналита и его концентрацией в исследуемом образце.
В целом теоретические аспекты ТФМЭ имеют ряд особенностей, которые выходят за рамки настоящего обзора, но рассмотрены в работах [19–24].
Особого внимания заслуживает применение ТФМЭ при анализе почв и донных отложений. Наиболее простым способом анализа является введение сорбента непосредственно в исследуемый образец [11]. При этом происходит распределение аналитов между матрицей образца и сорбирующим покрытием. Поскольку объем сорбента очень мал и образец не перемешивают, в данном случае могут быть извлечены только те аналиты, которые контактируют с сорбентом. Следовательно, определяемые концентрации не отражают содержание аналитов в массе негомогенного образца. Другой подход основан на приготовлении суспензии образца в воде и переходе аналитов в раствор перед их извлечением с помощью ТФМЭ. Однако в данном случае могут быть определены только водорастворимые компоненты. В связи с этим для предварительного экстрагирования часто используют органические растворители, поверхностно-активные вещества и ионные жидкости. Для интенсификации процесса экстрагирования иногда применяют физические поля (микроволновое, ультразвуковое и другие) [11].
Следует отметить, что при введении сорбента непосредственно в исследуемый образец почвы или донного отложения возможны повреждения сорбирующего покрытия. В режиме парофазного анализа (headspace) время службы сорбента существенно увеличивается. Однако в данном случае аналиты должны перейти в газовую фазу. Для “высвобождения” аналитов из пор почвы используют модификаторы, например воду, а также физические поля. Самым простым способом переведения аналитов в газовую фазу является повышение температуры образца, достаточное для преодоления энергетического барьера десорбции аналитов из пор почвы. Вместе с тем нагревание сорбента приводит к снижению коэффициента распределения аналитов и, следовательно, к снижению чувствительности их определения. Для решения этой проблемы был предложен вариант “тепло-холодной” ТФМЭ (CF-SPME), который основан на нагревании образца и одновременном охлаждении сорбента (твердой нити с покрытием). При этом улучшается массоперенос аналитов в газовую фазу и не происходит снижения их коэффициента распределения. Тепло-холодную ТФМЭ применяют при определении бензола, толуола, ксилолов и ПАУ в почвах и донных отложениях. В некоторых случаях при этом достигается количественное извлечение аналитов, т.е. “исчерпывающая” сорбция. Более того, данный вариант ТФМЭ хорошо подходит для полностью автоматизированных систем анализа [11]. Среди других развивающихся подходов к реализации ТФМЭ нужно упомянуть тонкослойную ТФМЭ (thin-film microextraction – TFME) и ТФЭ с перемешиванием (stir-bar sorptive extraction – SBSE) (рисунок) [25].
Что касается покрытия твердой нити из сплавленного силикагеля, наиболее часто применяют полидиметилсилоксан (ПДМС), который хорошо подходит для извлечения умеренно летучих гидрофобных соединений, таких как ПАУ и пестициды. Непористая структура ПДМС-покрытия обусловливает снижение матричных эффектов при работе с такими сложными образцами, как почвы и донные отложения. При этом покрытие из полиакрилата часто предпочтительно для сорбции полярных соединений, таких как 2,4,6-тринитротолуол, хлорфенолы, фосфорорганические пестициды [11]. Нижние границы определяемых содержаний аналитов в почвах при использовании ТФМЭ в комбинированных методах анализа находятся в ряде случаев на уровне пикограммов на грамм образца. Наряду с почвами и донными отложениями, ТФМЭ используют и при анализе вод, в том числе сточных [11].
Отдельной областью применения ТФМЭ является анализ пищевых продуктов [12, 17]. Много работ посвящено выделению и определению летучих компонентов различных продуктов (овощей, фруктов, мяса), а также вин и крепких напитков. Среди нелетучих компонентов наибольшее внимание привлекают пестициды и фармацевтические препараты. Успех применения ТФМЭ во многом зависит от свойств покрытия твердой нити. Наиболее популярными покрытиями являются ПДМС, ПДМС/дивинилбензол (ДВБ) и ПДМС/ДВБ/ПДМС. Время сорбции, как правило, составляет 30–60 мин, а температура 20–60°С. Нужно подчеркнуть, что на сегодняшний день в анализе пищевых продуктов ТФМЭ в основном применяют при определении летучих ароматических соединений и некоторых загрязняющих веществ (таких как пестициды). Примеры определения эндогенных нелетучих веществ, особенно высокополярных, пока малочисленны. Предполагают, что в недалеком будущем ТФМЭ найдет более широкое применение в анализе продуктов питания, в частности, для мониторинга накопления, транспорта и метаболизма загрязняющих веществ в режиме реального времени [17].
Нельзя не упомянуть об использовании ТФМЭ в клиническом анализе при исследовании крови, мочи, мышц и других биологических жидкостей и тканей [13, 15]. Твердофазная микроэкстракция позволяет выделять десятки различных соединений для их последующего анализа, как правило, методом жидкостной или газовой хроматографии с масс-спектрометрическим детектированием. При этом вместе с новыми сорбентами и покрытиями довольно часто применяют и “классический” С18, например, для извлечения фармацевтических препаратов, в том числе кокаина и диазепама, из мочи [13]. Отдельным, быстро развивающимся направлением является использование ТФМЭ в метаболомике [18].
В целом ТМФЭ не требует применения органических растворителей; дает возможность работать со сложными образцами в твердом, жидком и газообразном состояниях; является основой аналитических систем, позволяющих проводить одновременное выделение, концентрирование и определение веществ; легко сочетается с ЖХ, ВЭЖХ, ГХ, капиллярным электрофорезом в режимах off-line и on-line; обеспечивает высокую чувствительность определения (на уровне пикограммов на грамм); – позволяет создать полностью автоматизированные аналитические системы.
Стоит еще раз повторить, что интерес к ТФМЭ органических веществ неуклонно растет, данной теме посвящены сотни работ. Метод уже прочно занял место в рутинном анализе [4, 19].
ДИНАМИЧЕСКАЯ ТВЕРДОФАЗНАЯ ЭКСТРАКЦИЯ
Техническое решение этого метода отличается от описанных выше приемов ТФМЭ. В данном случае слой сорбирующего покрытия нанесен на внутренние стенки иглы, что увеличивает поверхность контакта между фазами образца и сорбента. Впервые динамическая ТФЭ была использована при определении пестицидов в воде [9]. С помощью динамической ТФЭ успешно извлекали летучие компонентов из биологических жидкостей [26], фракции летучих компонентов из пива [27], лекарственные препараты из волос и т.д. [9]. По сравнению с ТФМЭ, динамическая ТФЭ требует меньших объемов пробы (сотые доли миллилитра) и позволяет сократить время сорбции до 2–10 мин. Срок службы сорбента в динамической ТФЭ больше, чем в ТФМЭ. Вместе с этим сложность процессов сорбции и десорбции, а также проблемы массопереноса (связанные с тем, что аналиты могут оставаться на внутренней стенке иглы) являются недостатками метода и ограничивают его широкое применение [9].
ДИСПЕРСИОННАЯ ТВЕРДОФАЗНАЯ ЭКСТРАКЦИЯ
Дисперсионная твердофазная экстракция (ДТФЭ) основана на добавлении сорбента к анализируемому раствору, интенсивном перемешивании смеси и последующем отделении сорбента при помощи центрифугирования. Метод в основном используют для удаления мешающих компонентов матрицы образца [28].
Ярким примером использования ДТФЭ на стадии пробоподготовки является комбинированный метод идентификации и количественного определения нескольких десятков различных по типу и свойствам (в том числе полярности) пестицидов в красном, белом и розовом винах [29]. Следует подчеркнуть, что вино – сложный для анализа многокомпонентный образец, который содержит ряд веществ, таких как жирные кислоты и их эфиры, фенолы и т.д. Показано, что применение жидкостной экстракции (ЖЭ) ацетонитрилом, высаливания (хлоридом натрия, цитратом натрия и сульфатом магния) и последующей очистки экстракта с использованием сорбента С18 в режиме ДТФЭ позволяет получить надежные и воспроизводимые результаты. Анализ очищенного экстракта основан на газовой хроматографии с масс-спектрометрическим детектированием (ГХ–МС). Метод апробирован при анализе 30 образцов вина. Показано, что степень извлечения целевых пестицидов, в том числе “проблемных”, составляет при оптимизированных условиях пробоподготовки не менее 80%.
При определении 16 ПАУ в образцах чая ДТФЭ успешно использовали на стадии очистки экстракта, полученного с помощью ацетонитрила, от нежелательных примесей для дальнейшего определения аналитов методом ГХ–МС/МС [30]. Применение ДТФЭ на стадии пробоподготовки возможно и при определении пестицидов в лепестках роз [31], а также при одновременном определении пестицидов и антиоксидантов в растительном масле [32]. Одновременная оценка содержания почти четырехсот органических загрязняющих веществ (включая пестициды, полихло-рированные дифенилы и ПАУ) в овощах и фруктах стала возможной благодаря ДТФЭ-очистке полученного с использованием этилацетата экстракта и его последующему анализу методом ГХ–МС/МС с ионизацией электронным ударом [33].
Сочетание ЖЭ и ДТФЭ на стадии пробоподготовки и детектирования методом газовой или жидкостной хромато-масс-спектрометрии стало основой метода QuEChERS (Quick, Easy, Cheap, Effective, Rugged, and Safe – быстро, просто, дешево, эффективно, надежно и безопасно), который широко используют при определении пестицидов в напитках и продуктах питания [34, 35]. Метод ориентирован не на селективное выделение аналитов, а на устранение мешающих их определению компонентов матрицы образца. Популярность метода QuEChERS стремительно растет. Главная причина этого – требование современных лабораторий к чувствительности анализа, уменьшению объема растворителя, сокращению продолжительности анализа и его стоимости. Следует упомянуть о применении метода в судебно-медицинской экспертизе для одновременного определения более 90 препаратов, включая яды [36]. Метод QuEChERS также используют при анализе объектов окружающей среды. Показана возможность определения 26 гербицидов в почвах. На стадии очистки экстракта опробовано более десяти сорбентов, лучшие результаты получены с применением оксида алюминия [37].
Примеров использования ДТФЭ для выделения аналитов немного. Следует упомянуть хлорфенолы. Прививка к поверхности силикагеля функциональных соединений, содержащих бензольные кольца и аминогруппы, позволила создать сорбент для выделения хлорфенолов из образцов природной воды в режиме ДТФЭ. Степень извлечения составляет 90–100% при времени сорбции, равном 15 мин [38]. Кроме этого, ДТФЭ использовали для выделения ряда цитостатических препаратов из мочи [39]. Определение аналитов методом ультраэффективной жидкостной хроматографии с МС/МС-детектированием позволило достичь пределов обнаружения на уровне сотых долей мкг/л.
Комбинация выделения аналитов с помощью ДТФЭ и их определения методом инфракрасной спектроскопии с преобразованием Фурье позволила предложить способ идентификации и количественного определения соединений нервнопаралитического действия и их маркеров, в частности органофосфонатов [40]. В данном случае ДТФЭ позволяет эффективно и быстро (в течение 10 мин) выделять аналиты, которые затем определяют непосредственно в фазе сорбента. Метод используют в сети специализированных лабораторий, работающих в рамках выполнения договора о запрещении химического оружия.
МАТРИЧНОЕ ТВЕРДОФАЗНОЕ ДИСПЕРГИРОВАНИЕ
Метод матричного твердофазного диспергирования (МТФД) основан на добавлении сорбента непосредственно к анализируемому образцу (твердому или жидкому). Образец смешивают и диспергируют с сорбентом, затем переносят смесь в полипропиленовый картридж или шприц, на дне которого находится либо тот же самый сорбент, либо другой сорбент для очистки (извлечения мешающих компонентов). Таким образом, МТФД позволяет объединить стадии выделения аналитов и их очистки. Изначально метод разработан для анализа пищевых продуктов и биологических образцов, затем его стали использовать и для анализа объектов окружающей среды (почв и донных отложений).
Рассмотрим применение МТФД в анализе продуктов питания на примере определения перфторированных соединений в моллюсках и рыбе [41]. Измельченный образец диспергируют с минеральным сорбентом на основе диатомовой земли и переносят в полипропиленовый шприц, содержащий сорбент-очиститель (силикагель). Аналиты затем элюируют ацетонитрилом для ЖХ–MC/МС-анализа, что позволяет достичь предела обнаружения на уровне нг/г.
Довольно много работ посвящено применению МТФД при определении остаточных концентраций фосфорорганических пестицидов (ФОП) в сложных пищевых матрицах. Предложен метод выделения ФОП из прополиса с использованием сорбента С18 [42]. Прополис содержит воск, смолы, сахара, фенолы, лигнины, терпены, жирные кислоты, неорганические компоненты, что требует большого внимания к пробоподготовке и удалению компонентов матрицы, мешающих ГХ–МС-определению ФОП. С целью повышения эффективности элюирования аналита и минимизации выделения мешающих компонентов авторы предложили комбинацию липофильного сорбента для извлечения ФОП и относительного полярного растворителя (этилацетата) для их элюирования. Для выделения гербицидов (триазинов) из моллюсков опробован ряд сорбентов, используемых как при диспергировании, так и на стадии очистки. Наилучшие результаты при диспергировании получены с сорбентом С18 [43].
Метод, основанный на комбинации МТФД, ТФЭ и ВЭЖХ предложен для извлечения и количественного определения группы ФОП различной полярности в бычьей печени [44]. Небольшое количество образца (50 мг) анализируют без дополнительной пробоподготовки, а системы МТФД и ТФЭ непосредственно соединены с хроматографом с помощью динамической ячейки для перемешивания. Степень извлечения ФОП составляет от 90 до 100%, а предел определения не превышает 0.25 мкг/г, что позволяет использовать метод при ветеринарном контроле.
Комбинация МТФД и ЖХ–МС/МС с электрораспылением позволяет определять пестициды в луке на уровне сотых долей мкг/г [45]. Для решения более сложной задачи, а именно для выделения 15 ФОП и 9 триазинов из фруктов, предложена интенсификация процесса МТФД ультразвуком [46]. Сорбент С8 использован при диспергировании, а этилацетат как растворитель для элюирования. Для определения аналитов применяли ГХ–МС/МС. По сравнению с обычной МТФД, метод МТДФ с ультразвуковой обработкой позволяет провести выделение аналитов за несколько минут и увеличить степень их извлечения до 80% и более. Следует упомянуть, что МТДФ с ультразвуковой обработкой применяли и при определении флавоноидов в грейпфрутах и биологических жидкостях [47].
Использование МТФЭ позволило предложить быстрый метод выделения и ГХ-определения ФОП и хлорорганических пестицидов (ХОП) в молоке [48]. В целом среди ряда методов выделения пестицидов из жирной пищи животного и растительного происхождения МТФЭ занимает заметное место [49]. В обзорной работе [50], посвященной определению остаточной концентрации ХОП в жирной пище, показано, что метод МТФЭ применим к большинству образцов, независимо от содержания воды и липидов. Он может быть легко адаптирован для выделения остаточной концентрации пестицидов практически из любых продуктов питания. Помимо пестицидов, МТФД применяют при определении консервантов (парабенов) в морепродуктах [51, 52]. Метод МТФД позволяет выделять микотоксины из зерен кукурузы [53], действующие компоненты из лекарственных растений [54–56] и т.д. При определении антибиотиков тетрациклинового ряда в молоке используют комбинацию МФТД и капиллярного электрофореза [57].
В серии работ последних лет изучена возможность применения МТФД в анализе объектов окружающей среды. Для газохроматографического определения ХОП (включая ДДТ) в почве образцы диспергировали с силикагелем и модифицированным силикагелем С18, затем элюировали аналиты смесью дихлорометана и гексана. В большинстве случаев степень извлечения ХОП была не менее 75% [58]. Те же сорбенты применяли и для выделения полибромированных дифенилэфиров из почвы для их последующего определения методом ГХ–МС с отрицательной химической ионизацией [59]. При определении триазинов в морских донных отложениях достигнуто количественное извлечение аналитов при диспергировании образцов с графитированной сажей [60]. Совсем недавно МТФД стали использовать для выделения лекарственных препаратов из ила городских водоочистительных сооружений [61]. Диспергирование с сорбентом С18 и последующее элюирование смесью метанола, ацетонитрила и щавелевой кислоты оказались вполне приемлемыми при одновременном ЖХ–МС/МС-определении в иле 45 самых различных лекарственных препаратов. Степень извлечения аналитов составила 50–100% [62]. При выделении антибиотиков удовлетворительные результаты были получены с помощью смеси силикагеля и многостенных углеродных нанотрубок [63].
МИКРОЭКСТРАКЦИЯ В НАБИВНОМ ПАТРОНЕ
Микроэкстракция в набивном патроне (МЭНП) – недавно предложенный метод пробоподготовки образца, основанный на миниатюризации традиционной ТФЭ [64]. В МЭНП приблизительно 1 мг сорбента упаковывают внутрь шприца (патрона) объемом 100–250 мкл в виде слоя или между поршнем и иглой. В коммерчески доступных устройствах для МЭНП используют те же сорбенты, что и в традиционной ТФЭ. Когда образец пропускают через шприц, аналиты сорбируются, затем их элюируют органическим растворителем. По сравнению c ТФЭ и ТФМЭ, метод является более экспрессным – время сорбции сокращается с 10–20 до 1–4 мин [9].
Микроэкстракцию в набивном патроне успешно применяют для выделения и определения широкого спектра аналитов, включая лекарственные препараты и их метаболиты, пестициды и другие органические загрязняющие вещества в объектах окружающей среды (воды, сточные воды и почвы) и биологических жидкостях [9]. Метод также использован в анализе пищевых продуктов при определении биологически активных флавонолов в вине и пиве [9]. Есть сообщения о применении МЭНП для фракционирования соединений, содержащихся в экстракте кутикулярного воска листьев растений [65].
Таблица 1.
Нетрадиционные варианты твердофазной экстракции: соответствие англо- и русскоязычных терминов
| Англоязычный термин | Русскоязычный термин |
|---|---|
| Solid phase micro extraction (SPME) | Твердофазная микроэкстракция (ТФМЭ) |
| Solid phase dynamic extraction (SPDE) | Динамическая твердофазная экстракция (динамическая ТФЭ) |
| Dispersive solid phase extraction (DSPE) | Дисперсионная твердофазная экстракция (ДТФЭ) |
| Matrix solid phase dispersion (MSPD) | Матричное твердофазное диспергирование (МТФД) |
| Microextraction in a packed syringe (MEPS) | Микроэкстракция в набивном патроне (МЭНП) |
| Thin-film microextraction (TFME) | Тонкослойная твердофазная микроэкстракция (тонкослойная ТФМЭ) |
| Stir-bar sorptive extraction (SBSE) | Твердофазная экстракция с перемешиванием (ТФЭ с перемешиванием) |
| Magnetic solid phase extraction (MSPE) | Магнитная твердофазная экстракция (магнитная ТФЭ) |
| Porous membrane protected micro-solid-phase extraction | Мембранная твердофазная микроэкстракция (мембранная ТФМЭ) |
Рис. 1.
Инструментальные решения для твердофазной микроэкстракции: (а) – твердая нить из сплавленного силикагеля с покрытием (fiber SPME); (б) – тонкая трубка с сорбирующим слоем внутри (in-tube SPME); (в) – тонкая пленка с сорбирующим слоем (thin-layer SPME); (г) – пипетка с гранулами сорбента (in-tip SPME); (д) – сосуд для ТФЭ с перемешиванием (stir-bar sorptive extraction – SBSE).
ДРУГИЕ НЕТРАДИЦИОННЫЕ МЕТОДЫ ТВЕРДОФАЗНОЙ ЭКСТРАКЦИИ
Помимо перечисленных выше методов и подходов, нельзя не упомянуть магнитную ТФЭ (magnetic SPE). Частицы сорбента в данном случае представляют собой магнитное ядро, покрытое оксидом кремния или алюминия золь–гель методом. К поверхности могут быть привиты различные функциональные группы. Аналиты адсорбируются на поверхности магнитных частиц, которые затем отделяют от раствора при помощи внешнего магнитного поля. Магнитную ТФЭ можно использовать в биомедицине для разделения клеток и выделения протеинов и пептидов; в анализе объектов окружающей среды для выделения пестицидов, красителей, поверхностно-активных веществ, ПАУ и лекарственных препаратов; в анализе продуктов питания для выделения пестицидов и антибиотиков [9]. Повышенный интерес вызывает применение сорбентов на основе магнитных наночастиц, минимальное количество которых позволяет выделять аналиты даже из больших объемов анализируемого образца [66]. В подавляющем большинстве случае ТФЭ на магнитных частицах проводят в статическом режиме, однако есть пример использования магнитных частиц и в динамическом режиме. ДНК из почв выделяли в проточной суспензионной колонке, частицы сорбента в которой удерживали за счет комбинации ультразвукового и магнитного полей [67].
Активно развивается мембранная ТФЭ (porous membrane protected micro-solid-phase extraction), которая основана на использовании пористой мембраны (обычно полипропиленовой), внутри которой упакован очень небольшой объем сорбента [9]. Края мембраны герметизированы, чтобы избежать потери сорбента. Метод позволяет одновременно проводить выделение, концентрирование и очистку аналитов. Мембранную ТФЭ успешно использовали для выделения пестицидов, лекарственных препаратов из продуктов питания, биологических образцов, объектов окружающей среды [68].
* * *
В заключение следует повторить, что нетрадиционные методы ТФЭ органических веществ – огромная область современного органического анализа. В данном обзоре охарактеризованы лишь основные тенденции развития данного направления. Нужно отметить, что наиболее востребованной является твердофазная микроэкстракция, во многом благодаря возможности полной автоматизации процессов выделения и определения аналитов и легкости сочетания с ГХ–МС/МС, ЖХ–МС/МС, капиллярным электрофорезом [69] и другими аналитическими методами. Особое место среди рассмотренных приемов занимает дисперсионная твердофазная экстракция, которую в основном используют не для выделения аналитов, а для удаления мешающих компонентов матрицы образца.
Список литературы
Байерман К. Определение следовых количеств органических веществ. М.: Мир, 1987. 462 с.
Thurman E.V., Mills M.S. Solid-phase extraction. Principles and practice. NY: John Wiley & Sons Inc., 1998. 372 p.
Майстренко В.Н., Клюев Н.А. Эколого-аналитический мониторинг стойких органических загрязнителей. М.: Бином. Лаборатория знаний, 2009. 322 с.
Другов Ю.С., Родин А.А. Пробоподготовка в экологическом анализе [Электронный ресурс]: практическое руководство. 4-е изд. (эл.). М.: Бином. Лаборатория знаний, 2013. 855 с.
Hennion M.C. Solid-phase extraction: method development, sorbents, and coupling with liquid chromatography // J. Chromatogr. A. 1999. V. 856. P. 3.
Spivakov B., Malofeeva G., Petrukhin O. Solid-phase extraction on alkyl-bonded silica gels in inorganic analysis // Anal. Sci. 2006. V. 22. P. 503.
Andrade-Eiroa A., Canle M., Leroy-Cancellieri V., Cerda V. Solid-phase extraction of organic compounds: A critical review (Part I) // Trends Anal. Chem. 2016. V. 80. P. 641.
Andrade-Eiroa A., Canle M., Leroy-Cancellieri V., Cerda V. Solid-phase extraction of organic compounds: A critical review (Part II) // Trends Anal. Chem. 2016. V. 80. P. 655.
Płotka-Wasylka J., Szczepańska N., de la Guardia M., Namieśnik J. Miniaturized solid-phase extraction techniques // Trends Anal. Chem. 2015. V. 73. P. 19.
Borisova D., Statkus M., Tsysin G., Zolotov Yu. On-line coupling of solid-phase extraction of phenols on porous graphitic carbon and LC separation on C18 silica gel column via subcritical water desorption // Sep. Sci. Technol. 2016. V. 51. № 12. P. 1979.
Souza-Silva É.A., Jiang R., Rodríguez-Lafuente A., Gionfriddo E., Pawliszyn J. A critical review of the state of the art of solid-phase microextraction of complex matrices I. Environmental analysis // Trends Anal. Chem. 2015. V. 71. P. 224.
Souza-Silva É.A., Gionfriddo E., Pawliszyn J. A critical review of the state of the art of solid-phase microextraction of complex matrices II. Food analysis // Trends Anal. Chem. 2015. V. 71. P. 236.
Souza-Silva E.A., Reyes-Garces N., Gomez-Rios G.A., Boyacı E., Bojko B., Pawliszyn J. A critical review of the state of the art of solid-phase microextraction of complex matrices III. Bioanalytical and clinical applications // Trends Anal. Chem. 2015. V. 71. P. 249.
Piri-Moghadam H., Ahmadi F., Pawliszyn J. A critical review of solid phase microextraction for analysis of water samples // Trends Anal. Chem. 2016. V. 85. P. 133
Moein M.M., Said R., Bassyouni F., Abdel-Rehim M. Solid phase microextraction and related techniques for drugs in biological samples // J. Anal. Methods Chem. 2014. http://dx.org/10.1155/2014/921350 (28.03.2018).
Zhang Q.-H., Zhou L.-D., Chen H., Wang Ch.-Zh., Xia Zh.-N., Yuan Ch.-S. Solid-phase microextraction technology for in vitro and in vivo metabolite analysis // Trends Anal. Chem. 2016. V. 80. P. 57.
Chang-Hua Xu Ch.-H., Chen G.-Sh., Xiong Zh.-H., Fan Y.-X., Wang X.-Ch., Liu Y. Applications of solid-phase microextraction in food analysis // Trends Anal. Chem. 2016. V. 80. P. 12.
Bojko B., Reyes-Garces N., Bessonneau V., Gorynski K., Mousavi F., Souza Silva E.A., Pawliszyn J. Solid-phase microextraction in metabolomics // Trends Anal. Chem. 2014. V. 61. P. 168.
Pawliszyn J. Handbook of solid phase microextraction. Beijing: Chemical Industry Press, 2009. 406 p.
Ai J. Solid phase microextraction for quantitative analysis in nonequilibrium situations // Anal. Chem. 1997. V. 69. P. 1230.
Arthur C.L., Killam L.M., Buchholz K.D., Pawliszyn J., Berg J.R. Automation and optimization of solid-phase microextraction // Anal. Chem. 1992. V. 64. P. 1960.
Pawliszyn J. Solid phase microextraction: theory and practice. NY: Wiley-VCH, 1997. 264 p.
Pawliszyn J. Applications of solid phase microextraction. Cambridge: RSC, 1999. 676 p.
Ai J. Headspace solid phase microextraction. Dynamics and quantitative analysis before reaching a partition equilibrium // Anal. Chem. 1997. V. 69. P. 3260.
Petretto G.L., Urgeghe P.P., Mascia I., Fadda C., Rourke J.P., Pintore G. Stir bar sorptive extraction coupled with GC/MS applied to honey: optimization of method and comparative study with headspace extraction techniques // Eur. Food Res. Technol. 2017. V. 243. № 5. P. 735.
Wang T.-M., Ding L.-Q., Jin H.-J., Shi R., Wu J.-S., Zhu L., Jia Y.-Q., Ma Y.-M. Simultaneous quantification of multiple volatile active components in rat plasma using a headspace-solid phase dynamic extraction method coupled to gas chromatography-tandem mass spectroscopy: application in a pharmacokinetic study of Longhu Rendan pills // RSC Advances. 2015. V. 5. № 38. P. 29631.
Castro L.F., Ross C.F., Vixie K.R. Optimization of a solid phase dynamic extraction (SPDE) method for beer volatile profiling // Food Anal. Methods. 2015. V. 8. № 8. P. 2115.
Gullick D.R., Bruckner J.V., White C.A., Chen C., Cummings B.S., Bartlett M.G. Quantitation of deltamethrin in rat liver and muscle homogenates using dispersive solid-phase extraction with GC-NCI-MS // J. AOAC Int. 2016. V. 99. № 3. P. 813.
Walorczyk S., Drozdzynski D., Gnusowski B. Multiresidue determination of 160 pesticides in wines employing mixed-mode dispersive-solid phase extraction and gas chromatography–tandem mass spectrometry // Talanta. 2011. V. 85. P. 1856.
Chen H., Gao G., Liu P., Pan R., Liu X., Lu Ch. Determination of 16 polycyclic aromatic hydrocarbons in tea by simultaneous dispersive solid-phase extraction and liquid–liquid extraction coupled with gas chromatography-tandem mass spectrometry // Food Anal. Met-hods. 2016. V. 9. № 8. P. 2374.
Tascone O., Shirshikova M., Roy C., Meierhenrich U.J. Pesticide determination in rose petals using dispersive solid-phase extraction followed by gas chromatography-tandem mass spectrometry // Anal. Bioanal. Chem. 2014. V. 406. № 30. P. 8041.
Fang Y., Tian W., Pei F., Li P., Shao X., Fan Y., Hu Q. Simultaneous determination of pesticide residues and antioxidants in blended oil using a liquid-liquid extraction combined with dispersive solid phase extraction method // Food Chem. 2017. V. 229. P. 347.
Banerjee K., Utture S., Dasgupta S., Kandaswamy C., Pradhan S., Kulkarni S., Adsule P. Multiresidue determination of 375 organic contaminants including pesticides, polychlorinated biphenyls and polyaromatic hydrocarbons in fruits and vegetables by gas chromatography-triple quadrupole mass spectrometry with introduction of semi-quantification approach // J. Chromatogr. A. 2012. V. 1270. P. 283.
Herrero A., Ortiz M.C., Sarabia L.A. D-optimal experimental design coupled with parallel factor analysis 2 decomposition a useful tool in the determination of triazines in oranges by programmed temperature vaporization-gas chromatography-mass spectrometry when using dispersive-solid phase extraction // J. Chromatogr. A. 2013. V. 1288. P. 111.
Gonzalez-Curbelo M.A., Socas-Rodriguez B., Herrera-Herrera A.V., Gonzalez-Saloma J., Hernandez-Borges J., Rodriguez-Delgado M.A. Evolution and applications of the QuEChERS method // Trends Anal. Chem. 2015. V. 71. P. 169.
Usui K., Hayashizaki Y., Hashiyada M., Masato F. Rapid drug extraction from human whole blood using a modified QuEChERS extraction method // Legal Medicine. 2012. V. 14. № 6. P. 286.
Kaczyński P., Łozowicka B., Jankowska M., Hrynko I. Rapid determination of acid herbicides in soil by liquid chromatography with tandem mass spectrometric detection based on dispersive solid phase extraction // Talanta. 2016. V. 152. P. 127.
Gao L., Wei Y. Fabrication of a novel hydrophobic/ion-exchange mixed-mode adsorbent for the dispersive solid-phase extraction of chlorophenols from environmental water samples // J. Sep. Sci. 2016. V. 39. № 16. P. 3186.
Fabrizi G., Fioretti M., Rocca L.M. Dispersive solid-phase extraction procedure coupled to UPLC-ESI-MS/MS analysis for the simultaneous determination of thirteen cytotoxic drugs in human urine // Biomed. Chromatogr. 2016. V. 30. № 8. P. 1297.
Garg P., Pardasani D., Mazumder A., Purohit A., Dubey D.K. Dispersive solid-phase extraction for in-sorbent Fourier-transform infrared detection and identification of nerve agent simulants in analysis for verification of chemical weapon convention // Anal. Bioanal. Chem. 2011. V. 399. P. 955.
Villaverde-de-Saa E., Quintana J.B., Rodil R., Ferrero-Refojos R., Rubi E., Cela R. Determination of perfluorinated compounds in mollusks by matrix solid-phase dispersion and liquid chromatography–tandem mass spectrometry // Anal. Bioanal. Chem. 2012. V. 402. P. 509.
Acosta-Tejada G.M., Medina-Peralta S., Moguel-Ordofiez V.B., Mufioz-Rodriguez D. Matrix solid-phase dispersion extraction of organophosphorus pesticides from propolis extracts and recovery evaluation by GC/MS // Anal. Bioanal. Chem. 2011. V. 400. P. 885.
Rodriguez-Gonzalez N., Gonzalez-Castro M.J., Beceiro-Gonzalez E., Muniategui-Lorenzo S. Development of a matrix solid phase dispersion methodology for the determination of triazine herbicides in mussels // Food Chem. 2015. V. 173. P. 391.
Guierrez Valencia T.M., Garcia de Liasera M.P. Determination of organophosphorus pesticides in bovine tissue by an on-line coupled matrix solid-phase dispersion–solid phase extraction–high performance liquid chromatography with diode array detection method // J. Chromatogr. A. 2011. V. 1218. P. 6869.
Rodrigues S.A., Caldas S.S., Gilberto Primel E. A simple; efficient and environmentally friendly method for the extraction of pesticides from onion by matrix solid-phase dispersion with liquid chromatography–tandem mass spectrometric detection // Anal. Chim. Acta. 2010. V. 678. P. 82.
Ramos J.J., Rial-Otero R., Ramos L., Capelo J.L. Ultrasonic-assisted matrix solid-phase dispersion as an improved methodology for the determination of pesticides in fruits // J. Chromatogr. A. 2008. V. 1212. P. 145.
Barfi B., Asghari A., Rajabi M., Barfi A., Saeidi I. Simplified miniaturized ultrasound-assisted matrix solid phase dispersion extraction and high performance liquid chromatographic determination of seven flavonoids in citrus fruit juice and human fluid samples: Hesperetin and naringenin as biomarkers // J. Chromatogr. A. 2013. V. 1311. P. 30.
Schenck F.J., Wagner R. Screening procedure for organochlorine and organophosphorus pesticide residues in milk using matrix solid phase dispersion (MSPD) extraction and gas chromatographic determination // Food Addit. Contam. 1995. V. 12. № 4. P. 535.
Li J., Liu D., Wu T., Zhao W., Zhou Z., Wang P. A simplified procedure for the determination of organochlorine pesticides and polychlorobiphenyls in edible vegetable oils // Food Chem. 2014. V. 151. P. 47.
Chung S.W.C., Chen B.L.S. Determination of organochlorine pesticide residues in fatty foods: A critical review on the analytical methods and their testing capabilities // J. Chromatogr. A. 2011. V. 1218. P. 5555.
Djatinika R., Hsieh C.-C., Chen J.-M., Ding W.-H. Determination of paraben preservatives in seafood using matrix solid-phase dispersion and on-line acetylation gas chromatography-mass spectrometry // J. Chromatogr. B. 2016. V. 1036. P. 93.
Villaverde-de-Saa E., Rodil R., Quintana J.B., Cela R. Matrix solid-phase dispersion combined to liquid chromatography-tandem mass spectrometry for the determination of paraben preservatives in mollusks // J. Chromatogr. A. 2016. V. 1459. P. 57.
Barros de Oliveira G., Menezes de Castro Gomes Vieira C., Orlando R.M., Faria A.F. Simultaneous determination of fumonisins B1 and B2 in different types of maize by matrix solid phase dispersion and HPLC-MS/MS // Food Chem. 2017. V. 233. P. 11.
Hong B., Wang Z., Xu T., Li Ch., Li W. Matrix solid-phase dispersion extraction followed by high performance liquid chromatography-diode array detection and ultra performance liquid chromatography-quadrupole-time of flight-mass spectrometer method for the determination of the main compounds from Carthamus tinctorius L. (Hong-hua) // J. Pharm. Biomed. Anal. 2015. V. 107. P. 464.
Wei Z., Pan Y., Li L., Huang Y., Qi X., Luo M., Zu Yu., Fu Yu. Simultaneous determination of phenolic compounds in Equisetum palustre L. by ultra high performance liquid chromatography with tandem mass spectrometry combined with matrix solid-phase dispersion extraction // J. Sep. Sci. 2014. V. 37. № 21. P. 3045.
Santos E.S.D., Navickiene S., Wanderley K.A., de Sa G.F., Junior S.A. MSPD Method for the determination of clofentezine, falin, and kesoxim-methyl residues in fresh and dehydrated forms of plantago major medicinal plant by HPLC/UV-DAD // J. Liq. Chromatogr. Relat. Technol. 2013. V. 36. № 13. P. 1802.
Mu G., Liu H., Xu L., Tian L., Luan F. Matrix solid-phase dispersion extraction and capillary electrophoresis determination of tetracycline residues in milk // Food Anal. Methods. 2012. V. 5. № 1. P. 148.
Salemi A., Shafiei E., Vosough M. Optimization of matrix solid phase dispersion coupled with gas chromatography electron capture detection for determination of chlorinated pesticides in soil // Talanta. 2012. V. 101. P. 504.
Iparraguirre A., Rodil R., Quintana J.B., Bizkarguenaga E., Prieto A., Zuloaga O., Cela R., Fernández L.A. Matrix solid-phase dispersion of polybrominated diphenyl ethers and their hydroxylated and methoxylated analogues in lettuce, carrot and soil // J. Chromatogr. A. 2014. V. 1360. P. 65.
Rodríguez-González N., González-Castro M.-J., Beceiro-González E., Muniategui-Lorenzo S. Development of a matrix solid phase dispersion methodology for the determination of triazine herbicides in marine sediments // Microchem. J. 2017. V. 133. P. 137.
Trinanes S., Casais M.C., Mejuto M.C., Cela R. Matrix solid-phase dispersion followed by liquid chromatography tandem mass spectrometry for the determination of selective ciclooxygenase-2 inhibitors in sewage sludge samples // J. Chromarogr. A. 2016. V. 1462. P. 35.
Li M., Sun Q., Li Y., Lv M., Lin L., Wu Y., Ashfag M., Yu C.-p. Simultaneous analysis of 45 pharmaceuticals and personal care products in sludge by matrix solid-phase dispersion and liquid chromatography tandem mass spectrometry // Anal. Bioanal. Chem. 2016. V. 408. № 18. P. 4953.
Vosough M., Onilghi M.N., Salemi A. Optimization of matrix solid-phase dispersion coupled with high performance liquid chromatography for determination of selected antibiotics in municipal sewage sludge // Anal. Methods. 2016. V. 8. № 24. P. 4853.
Moein M.M., Abdel-Rehim A., Abdel-Rehim M. Microextraction by packed sorbent (MEPS) // Trends Anal. Chem. 2015. V. 67. P. 34.
Halinski L.P., Stepnowski P. Fractionation of cuticular waxes from the leaves of solanaceae plant species using microextraction by packed sorbent // Acta Chromatogr. 2015. V. 27. № 4. P. 729.
Wierucka M., Biziuk M. Application of magnetic nanoparticles for magnetic solid-phase extraction in preparing biological, environmental and food samples // Trends Anal. Chem. 2014. V. 59. P. 50.
Dzhenloda R.K., Petrov D.G., Shkinev V.M., Spivakov B.Y. DNA recovery from environmental samples on suspension columns under a combined action of ultrasound and magnetic fields followed by polymerase chain reaction detection // Mend. Comm. 2017. V. 27. № 3. P. 302.
Sajid M. Porous membrane protected micro-solid-phase extraction: A review of features, advancements and applications // Anal. Chim. Acta. 2017. V. 965. P. 36.
Li P., Hu B., Li X. Zirconia coated stir bar sorptive extraction combined with large volume sample stacking capillary electrophoresis-indirect ultraviolet detection for the determination of chemical warfare agent degradation products in water samples // J. Chromatogr. A. 2012. V. 1247. P. 49.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии