Журнал аналитической химии, 2019, T. 74, № 5, стр. 381-396
Установление структур свободных и глюкуронидированных метаболитов α-пирролидиновалерофенона в моче человека методом жидкостной хромато-масс-спектрометрии при измерении точных масс
О. Л. Заикина 1, В. В. Шилов 2, А. Н. Лодягин 3, С. И. Глушков 3, А. М. Григорьев 4, *
1 Ленинградский областной наркологический диспансер, химико-токсикологическая лаборатория
188661 Ленинградская обл., Всеволожский район, д. Новое Девяткино, 19/1, Россия
2 Северо-западный государственный медицинский университет им. И.И. Мечникова Минздрава России
195067 Санкт-Петербург, Пискаревский пр., 47, пав. 26, Россия
3 Санкт-Петербургский научно-исследовательский институт скорой помощи им. И.И. Джанелидзе
192242, Санкт-Петербург, Будапештская ул., 3, лит. А, Россия
4 Бюро судебно-медицинской экспертизы, судебно-химическое отделение
111401 Москва, ул. 1-я Владимирская, 33, корп. 1, Россия
* E-mail: chrzond4250@yandex.ru
Поступила в редакцию 02.12.2017
После доработки 23.06.2018
Принята к публикации 23.06.2018
Аннотация
Стимулятор центральной нервной системы дизайнерский наркотик α-пирролидиновалерофенон (PVP), входящий в многочисленную группу производных катинона, высоко популярен среди наркозависимых групп населения. α-Пирролидиновалерофенон экстенсивно метаболизируется и выделяется с мочой в сопровождении значительного числа метаболитов. Методами жидкостной хроматографии–тандемной масс-спектрометрии определены структуры более 60 предполагаемых метаболитов PVP, присутствующих в моче человека как в свободной, так и в глюкуронидированной формах. Структурные особенности метаболитов определяли на основании расшифровки масс-спектров высокого разрешения и хроматографического удерживания при изменении кислотности элюента. Найденные соединения являются продуктами гидроксилирования пропильного, пиррольного и фенильного остатков, восстановления карбонильной группы до спирта, карбоксилирования, образования кетогрупп, окислительного дезаминирования, разрушения пиррольного цикла до первичного амина, а также комбинаций этих процессов. На основании результатов измерения относительных высот хроматографических пиков предложен оптимальный набор метаболитов для последующего рутинного скрининга проб мочи методом жидкостной хромато-масс-спектрометрии.
Согласно сообщениям Европейского центра мониторинга за наркотиками и наркотической зависимостью, число новых психоактивных средств, появившихся и распространяемых в мире, возросло более чем в 7 раз за период с 2005 по 2016 г. [1]. Синтетические катиноны – одна из двух основных групп психоактивных средств, которая (наряду с синтетическими каннабиноидами) лидирует как по числу новых соединений, так и по количеству, изымаемому органами контроля в Европе.
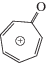
Несмотря на многочисленность группы синтетических катинонов (более 110 новых соединений формально зарегистрированы Европейским центром мониторинга за наркотиками и наркотической зависимостью за указанный период), их популярность среди потребителей различна, о чем свидетельствует частота обнаружения различных синтетических катинонов в биологических пробах. Согласно нашим наблюдениям, в РФ одним из наиболее часто обнаруживаемых соединений является PVP (α-пирролидиновалерофенон, α-PVP, 1-фенил-2-(пирролидин-1-ил)пентан-он-1) (рис. 1). Согласно выводам работы [2], сделанным в США на основании анализа значительного (более 34 тыс.) числа проб мочи, частота обнаружения PVP наиболее высокая среди шестнадцати синтетических катинонов и почти в полтора раза превышает частоту обнаружения популярного психостимулятора MDPV (3,4-метилендиоксипировалерон, “экстези”).
Несмотря на то, что синтез и некоторые свойства PVP впервые были описаны в 1963 г. [3], его присутствие на европейских рынках отмечается с 2012 г. [4]. Это вещество, нередко распространяемое как “соль для ванн”, является стимулятором центральной нервной системы, причем его психоактивное действие связано с повышением внеклеточного уровня моноаминов в головном мозге, вызванном ингибированием обратного захвата допамина и норэпинефрина. Основными способами приема являются оральный, внутривенный и назальный; дозировки составляют примерно 1–25 мг. Известно более чем 20 случаев острых отравлений в странах Европы (2012–2015 гг.) c летальным исходом, связанных с употреблением PVP [4, 5]. Оборот PVP контролируется в 16 странах Евросоюза и запрещен в РФ [4, 6].
Для определения PVP в биологических средах применяют методы газовой [2, 5, 7–10] и жидкостной [5, 10–12] хромато-масс-спектрометрии (ГХ–МС и ЖХ–МС/МС соответственно). Метод ГХ–МС менее предпочтителен ввиду малой информативности спектров электронной ионизации, характерных для PVP и его производных. Дополнительным ограничением метода является возможность образования хроматографических артефактов [9]. Тем не менее, этот метод относительно несложен в аппаратурном исполнении, экономичен и поэтому распространен. Описаны методы количественного определения PVP в моче [7, 8], сыворотке крови и тканях [8, 10, 11].
α-Пирролидиновалерофенон – экстенсивно метаболизируемое соединение и выделяется с мочой в смеси с метаболитами. Исследован метаболизм PVP у крыс методом ГХ–МС [13, 14], определены структуры моно- и дигидроксилированных метаболитов, продуктов гидроксилирования пиррольного цикла с последующим окислением гидроксильной группы (образование амида), продуктов разрушения пиррольного цикла и окисления пропильного остатка. Методом ЖХ–МС высокого разрешения изучены продукты ферментации PVP in vitro на печеночном цитозоле и микросомах человека [15], найдено дополнительное важнейшее направление метаболизма PVP – восстановление β-кетогруппы до спирта и дополнительное глюкуронидирование (М14.1, М14.3 и М14.4, рис. 1). Ценность подобных работ ограничена возможным отличием получаемых соединений от метаболитов, выделяемых с мочой человека. Работа [16] посвящена исследованию метаболизма сразу нескольких соединений, в том числе и PVP, в человеческой моче методом ЖХ с квадруполь-времяпролетной МС, однако авторы уделили мало внимания PVP. Авторы работы [17] определили содержание двух метаболитов (М4.1 и М14.1, рис. 1) в пробах мочи человека.
Дополнительным источником сведений о метаболизме и хромато-масс-спектрометрических характеристиках метаболитов PVP являются библиотеки для методов ГХ–МС [18] и ЖХ–МС/МС [19]. К сожалению, для метаболитов PVP они недостаточно информативны, возможно, по причине их формирования на основании анализа мочи лабораторных животных.
Цель настоящей работы – определение методом ЖХ–МС высокого разрешения структур более 60 предполагаемых метаболитов PVP, принадлежащих к фазам метаболизма I и II в пробах мочи человека, собранных при химико-токсикологическом освидетельствовании и при аутопсии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы и материалы. Использовали ацетонитрил и метанол (для ВЭЖХ) (Scharlab, S.L., Испания), формиат аммония (для ВЭЖХ), муравьиную кислоту (аналитической чистоты) и β-глюкуронидазу (тип HP-2) (Sigma-Aldrich, Германия). Для получения деионированной воды применяли систему очистки Milli-Q Advantage A10 (Merck, Германия). Все другие растворители и реагенты имели квалификацию не ниже ч. д. а. (Химмед, Россия).
Аппаратура. В работе использовали две жидкостные хромато–масс-спектрометрические системы. Первая система LCMS-8040 (Shimadzu, Япония) состояла из модульного жидкостного хроматографа Nexera XR c колонкой Shim-pack FC-ODS (150 × 2 мм, 3 мкм), соединенного с тандемным масс-спектрометром типа “тройной квадруполь” (ЖХ-КкКМС). Компоненты смесей элюировали бинарным элюентом, состоящим из фаз A (0.3 об. % муравьиной кислоты в воде) и B (ацетонитрил) согласно следующей программе: 1% B (2 мин), линейный градиент до 100% B (2–20 мин), 100% B (2 мин). Расход подвижной фазы 0.5 мл/мин. Масс-спектрометр работал в режиме электрораспылительной ионизации положительных ионов в следующих условиях: расходы газа-распылителя и осушающего газа (азот) 1.5 и 10 л/мин соответственно; температуры линии десольватации и нагревательного блока 250 и 300°C соответственно; напряжение на интерфейсе 4.5 кВ; давление газа для ячейки соударений (аргон) 230 кПа; энергия диссоциации, индуцируемой соударением (ДИС) 22 В. Эту систему применяли для первичного поиска основных метаболитов в пробах мочи и отбора положительных проб при поточном скрининговом анализе.
Вторая система (Agilent Technologies, США) состояла из жидкостного хроматографа 1290 Infinity с колонкой Zorbax Eclipse Plus C18 (100 × 2.1 мм, 3.5 мкм) и гибридного квадруполь-времяпролетного масс-спектрометра 6550 (ЖХ–К-ВПМС). Разделение выполняли с двумя подвижными фазами A (5 мМ формиата амония, 0.17 об. % муравьиной кислоты и 1 об. % метанола в воде, pH ~ 2.8) и B (метанол) согласно программе: 1% B (2 мин), линейный градиент до 100% B (2–18 мин), 100% B (2 мин). Для определения ионогенного характера метаболитов использовали подвижную фазу A другого состава (без добавки муравьиной кислоты, pH ~ 5.5). Расход подвижной фазы 0.3 мл/мин. Масс-спектрометр настраивали для режимов положительной и отрицательной электрораспылительной ионизации при следующих условиях: температура газа-осушителя 320°C (азот, 8 л/мин), давление в распылителе 35 psi (азот), напряжение на капилляре 3000 В, напряжение фрагментатора 150 В, давление газа для ячейки ДИС 23 psi (азот), энергия ДИС 20 эВ (если не указано иное), частота регистрации 2 ГГц. Динамическую калибровку величин m/z осуществляли смесью пурина и HP-091 в ацетонитриле с добавкой трифторацетата аммония (m/z в положительном режиме 121.05087 и 922.00980 соответственно, m/z в отрицательном режиме 119.03632 и 1033.98811 соответственно). Метаболит считали обнаруженным при интенсивности его пика не менее чем 2 × 103 ед. интенсивности (МС1). Данную систему применяли для определения структур метаболитов и измерения интенсивностей (высот) их пиков (МС1) по отношению к пику неизмененного PVP. Диапазон m/z при записи хроматограмм для измерения интенсивностей составлял 5 мДа.
Для обеих систем ЖХ–МС/МС объем вводимой пробы составлял 5 мкл, колонки термостатировали при 40°C.
Объекты анализа. Двадцать одну пробу мочи собирали при проведении химико-токсикологических освидетельствований на состояние одурманивания. Еще четырнадцать проб собирали при выполнении судебно-химических исследований в процессе отбора аутопсийного материала. Во всех указанных пробах при проведении рутинного скрининга методами ГХ–МС и ЖХ–МС/МС и на основании данных работ [9, 14–18] был обнаружен PVP.
Пробы мочи готовили по трем методикам. В первой методике к пробе мочи добавляли ацетонитрил (10 об. %), центрифугировали и вводили в хроматограф. Данную методику применяли при обнаружении и определении структур метаболитов фаз I и II (ЖХ–К-ВПМС) ввиду минимизации возможности получения артефактных результатов.
Во второй методике к пробе мочи (0.1 мл) добавляли охлажденный ацетонитрил (0.5 мл), тщательно перемешивали и охлаждали (–20°C, 20 мин.). Затем отбирали водно-ацетонитрильный слой и упаривали досуха. Остаток растворяли в смеси ацетонитрила и воды (10% об. ацетонитрила, 0.1 мл) и раствор вводили в хроматограф. Эту методику применяли для обнаружения и определения структур метаболитов фаз I и II (ЖХ–К-ВПМС и ЖХ–КкКМС), а также для измерения высот пиков (ЖХ–К-ВПМС).
В третьей методике к пробе мочи (0.1 мл) добавляли ацетатный буферный раствор (0.1 мл, 0.1 М, pH 4.8), раствор β-глюкуронидазы (0.1 мл) и после перемешивания инкубировали (37°C, 1 сут). Полученные деконъюгированные метаболиты (фазы I) экстрагировали ацетонитрилом согласно второй методике.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Несмотря на сравнительно простую структуру PVP (рис. 1), определение структур его метаболитов затруднено по следующим причинам: 1) наличие в молекуле двух алкильных остатков, содержащих одинаковое число (по 4) атомов углерода, что мешает однозначному определению положений функциональных групп, образующихся при метаболизме; 2) значительное число изобарных ионов, структуры которых могут кардинально различаться (это относится как к протонированным молекулам, так и к фрагментным ионам); 3) соэлюирование метаболитов (в том числе изобаров и диастереомеров). Данные затруднения ограничивают возможности масс-спектрометров при определении структур метаболитов (в том числе при измерении точных масс, К-ВПМС) и мешают получению чистых спектров. Дополнительные решения, предлагаемые в нашей работе, используют возможности ЖХ и включают: 1) варьирование условий разделения за счет состава элюента и типа обращенной фазы; 2) изменение pH элюента на величину, достаточную для смены заряда метаболитов PVP, обусловленного наличием ионогенных функциональных групп, что приводит к значительному изменению удерживания. Кроме того, в ряде случаев регистрировали спектры МС3, получаемые при ДИС ионов, образованных фрагментацией в источнике ионизации. Переход от режима положительной ионизации к отрицательной позволил получить дополнительное подтверждение наличия в структурах метаболитов карбоксильных групп. Интенсивность хроматографических пиков в режиме ионизации отрицательных ионов составляла примерно 30% от интенсивности в режиме ионизации положительных ионов для метаболитов фазы II и примерно 5–10% для метаболитов фазы I, содержащих карбоксильную группу.
Всего обнаружили более 60 метаболитов PVP, причем в это число вошли только соединения с наиболее точно определенными структурами, хотя общее число найденных соединений (со значительной вероятностью также являющихся метаболитами PVP) намного больше. В табл. 1 и 2 приведены хромато-масс-спектрометрические характеристики обнаруженных метаболитов, которые можно условно разделить на три основные серии: метаболиты, сохранившие карбонильную группу (β-кетоны, М1.1–М8.1, родоначальник – PVP), продукты восстановления этой группы (β-спирты, М14.1–М20.1, родоначальник – М14.1) и продукты разрушения пиррольного цикла обеих групп (М9.1–М13.1 и М21.1–М23.2), рис. 1. Выборочные медианы и размахи высот хроматографических пиков метаболитов, нормированных к высоте пиков неизмененного PVP (ЖХ–К-ВПМС, запись хроматограмм ±5 мДа) изображены на диаграммах (рис. 2). Ион-хроматограммы мочи, демонстрирующие основные метаболиты PVP (ЖХ–КкКМС), приведены на рис. 3.
Таблица 1.
Характеристики метаболитов α-пирролидиновалерофенона, полученные методом ЖХ–МС/МС
| Мета- болит | Метаболическая реакция | [M+H]+ | Δm/z, млн-1 | tR1, мин | tR2, мин | ΔtR, мин | |
|---|---|---|---|---|---|---|---|
| формула | m/z | ||||||
| PVP | – | C15H22NO | 232.16959 | 1.3 | 10.7 | 8.30 | 2.64 |
| M1.1 | Гидроксилирование (пропил) | C15H22NO2 | 248.16451 | 0.0 | 8.00 | – | 1.58 |
| M1.2 | C15H22NO2 | 248.16451 | –2.1 | 8.34 | – | 1.58 | |
| M2.1 | Гидроксилирование (фенил) | C15H22NO2 | 248.16451 | –2.1 | 9.52 | – | 1.05 |
| M2.2 | C15H22NO2 | 248.16451 | –0.9 | 9.62 | – | 1.91 | |
| M2.3 | Гидроксилирование (фенил) | C21H30NO8 | 424.19659 | –0.9 | 6.87 | – | –0.4 |
| M2.4 | + глюкуронидирование | C21H30NO8 | 424.19659 | –0.9 | 7.76 | – | –0.3 |
| M2.5 | C21H30NO8 | 424.19659 | –0.5 | 7.88 | – | –0.42 | |
| M3.1 | Гидроксилирование (пиррил) | C15H22NO2 | 248.16451 | 2.0 | 10.4 | – | 3.01 |
| M3.2 | C15H22NO2 | 248.16451 | 2.0 | 10.4 | – | 3.23 | |
| M3.3 | Гидроксилирование (пиррил) | C21H30NO8 | 424.19659 | 1.7 | 9.92 | – | 0.63 |
| M3.4 | + глюкуронидирование | C21H30NO8 | 424.19659 | –0.5 | 10.1 | – | 0.63 |
| M4.1 | Образование амида | C15H19NO2 | 246.14886 | 1.0 | 15.8 | 13.3 | –0.13 |
| M5.1 | Образование амида | C15H20NO3 | 262.14377 | 0.5 | 13.2 | 10.4 | –0.14 |
| M5.2 | + гидроксилирование (пропил) | C15H20NO3 | 262.14377 | 0.5 | 13.2 | 10.6 | –0.14 |
| M5.3 | C15H20NO3 | 262.14377 | 0.5 | 14.0 | 11.8 | –0.11 | |
| M5.4 | Образование амида | C21H28NO9 | 438.17586 | 2.4 | 11.8 | 9.60 | –2.17 |
| M5.5 | + гидроксилирование (пропил) | C21H28NO9 | 438.17586 | 2.4 | 11.8 | 9.70 | –2.17 |
| M5.6 | + глюкуронидирование | C21H28NO9 | 438.17586 | –0.6 | 12.5 | 9.82 | –2.30 |
| M6.1 | Образование амида | C15H20NO3 | 262.14377 | 0.5 | 14.6 | 11.7 | –0.09 |
| M6.2 | + гидроксилирование (фенил) | C15H20NO3 | 262.14377 | 2.0 | 14.6 | 11.9 | –0.09 |
| M6.3 | Образование амида | C21H28NO9 | 438.17586 | 0.6 | 12.5 | – | –1.96 |
| M6.4 | + гидроксилирование (фенил) + глюкуронидирование |
C21H28NO9 | 438.17586 | –1.5 | 12.8 | – | –2.07 |
| M7.1 | Образование амида | C15H20NO3 | 262.14377 | 0.5 | 14.3 | – | –0.09 |
| M7.2 | + гидроксилирование (пиррил) | C15H20NO3 | 262.14377 | 1.6 | 14.7 | – | –0.09 |
| M7.3 | C15H20NO3 | 262.14377 | 0.5 | 14.1 | – | –0.02 | |
| M7.4 | Образование амида | C21H28NO9 | 438.17586 | 0.1 | 14.1 | 11.6 | –1.84 |
| M7.5 | + гидроксилирование (пиррил) + глюкуронидирование | C21H28NO9 | 438.17586 | –0.6 | 13.0 | – | –1.83 |
| М8.1 | Карбоксилирование | C15H20NO3 | 262.14377 | 1.6 | 8.23 | 7.35 | –0.11 |
| M9.1 | Дезаминирование + карбоксилирование |
C15H22NO3 | 264.15942 | 1.1 | 10.8 | 8.25 | 0.37 |
| M9.2 | Дезаминирование + карбоксилирование + глюкуронидирование |
C21H30NO9 | 440.19151 | –0.3 | 10.2 | – | 0.25 |
| M10.1 | Дезаминирование + карбоксилирование + гидроксилирование (пропил) |
C15H22NO4 | 280.15434 | 1.3 | 8.69 | 7.55 | –0.11 |
| М11.1 | Дезаминирование | C15H22NO4 | 280.15434 | 2.0 | 9.37 | 7.66 | 0.19 |
| М11.2 | + карбоксилирование | C15H22NO4 | 280.15434 | 0.9 | 9.60 | 7.77 | 0.43 |
| + гидроксилирование (фенил) | – | ||||||
| M12.1 | Дезаминирование + карбоксилирование + образование амида |
C15H20NO4 | 278.13869 | 1.1 | 14.0 | 12.1 | –2.15 |
| M13.1 | N,N-Бис-дезалкилирование | C11H16NO | 178.12264 | –0.2 | 10.2 | 7.87 | 1.5 |
| M14.1 | Восстановление | C15H24NO | 234.18524 | 1.1 | 11.0 | 8.42 | 1.1 |
| M14.2 | Восстановление | C21H32NO7 | 410.21733 | –0.3 | 10.2 | – | –0.13 |
| M14.3 | + глюкуронидирование | C21H32NO7 | 410.21733 | 0.8 | 10.6 | – | –0.02 |
| M14.4 | C21H32NO7 | 410.21733 | 0.9 | 10.6 | – | 0.17 | |
| M15.1 | Восстановление | C15H24NO2 | 250.18016 | 1.0 | 7.51 | – | 0.63 |
| M15.2 | + гидроксилирование (пропил) | C15H24NO2 | 250.18016 | 0.6 | 8.32 | – | 0.73 |
| M16.1 | Восстановление | C15H24NO2 | 250.18016 | –1.4 | 8.76 | – | 0.75 |
| M16.2 | + гидроксилирование (фенил) | C15H24NO2 | 250.18016 | 0.6 | 8.58 | – | – |
| M17.1 | Восстановление | C15H24NO2 | 250.18016 | –1.0 | 10.7 | – | 1.4 |
| M17.2 | + гидроксилирование (пиррил) | C15H24NO2 | 250.18016 | –1.4 | 11.0 | – | 1.1 |
| M18.1 | Восстановление | C15H22NO2 | 248.16451 | 2.8 | 13.8 | 11.3 | –0.11 |
| M18.2 | + образование амида | C15H22NO2 | 248.16451 | 1.2 | 14.8 | 11.6 | –0.12 |
| M18.3 | Восстановление | C21H30NO8 | 424.19659 | –0.2 | 12.8 | – | –2.4 |
| M18.4 | + образование амида | C21H30NO8 | 424.19659 | –2.8 | 13.7 | – | –2.1 |
| M18.5 | + глюкуронидирование | C21H30NO8 | 424.19659 | 1.4 | 14.4 | – | –2.1 |
| M19.1 | Восстановление | C15H22NO3 | 264.15942 | 2.2 | 10.5 | 9.05 | –0.13 |
| M19.2 | + образование амида | C15H22NO3 | 264.15942 | 2.2 | 11.4 | 9.51 | –0.14 |
| + гидроксилирование (пропил) | – | ||||||
| M19.3 | Восстановление | C21H30NO9 | 440.19151 | 1.3 | 9.47 | – | –2.0 |
| M19.4 | + образование амида | C21H30NO9 | 440.19151 | 0.0 | 10.0 | – | –2.3 |
| M19.5 | + гидроксилирование (пропил) | C21H30NO9 | 440.19151 | 0.7 | 10.5 | – | –2.3 |
| M19.6 | + глюкуронидирование | C21H30NO9 | 440.19151 | –2.1 | 9.8 | – | –2.0 |
| M19.7 | C21H30NO9 | 440.19151 | 1.3 | 10.7 | – | –1.7 | |
| M19.8 | C21H30NO9 | 440.19151 | 2.0 | 10.9 | – | –1.7 | |
| M20.1 | Восстановление | C15H22NO3 | 264.15942 | –0.1 | 12.9 | – | –0.12 |
| + образование амида | – | ||||||
| + гидроксилирование (фенил) | – | ||||||
| M21.1 | Восстановление | C15H24NO3 | 266.17507 | –1.8 | 11.1 | 8.25 | 0.22 |
| M21.2 | + дезаминирование | C15H24NO3 | 266.17507 | –0.6 | 11.2 | 8.33 | 0.32 |
| + карбоксилирование | – | ||||||
| M22.1 | Восстановление | C15H22NO4 | 280.15434 | 0.2 | 13.0 | – | –2.2 |
| + дезаминирование | – | ||||||
| + карбоксилирование | – | ||||||
| + образование амида | – | ||||||
| M23.1 | Восстановление | C11H18NO | 180.13829 | –2.2 | 9.95 | 7.75 | 1.0 |
| M23.2 | + N,N-бис-дезалкилирование | C11H18NO | 180.13829 | –2.7 | 10.3 | 7.80 | 1.0 |
Таблица 2.
Величины m/z, брутто-формулы и предполагаемые структурные формулы ионов-продуктов
| m/z Ион |
55.0542 ${{{\text{C}}}_{{\text{4}}}}{\text{H}}_{7}^{ + }$ |
69.0335 C4H5O+ |
70.0651 C4H8N+ |
72.0808 C4H10N+ |
73.0284 ${{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{5}}{\text{O}}_{2}^{ + }$ |
77.0386 ${{{\text{C}}}_{{\text{6}}}}{\text{H}}_{5}^{ + }$ |
84.0808 C5H10N+ |
| Структура |  |
 |
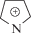 |
 |
 |
 |
 |
| m/z Ион |
86.0600 C4H8NO+ |
87.0441 ${{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{7}}{\text{O}}_{2}^{ + }$ |
91.0542 ${{{\text{C}}}_{{\text{7}}}}{\text{H}}_{7}^{ + }$ |
98.0600 C5H8NO+ |
101.0233 ${{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{5}}{\text{O}}_{3}^{ + }$ |
102.0550 ${{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{8}}{\text{NO}}_{2}^{ + }$ |
105.0335 C7H5O+ |
| Структура | 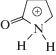 |
 |
 |
 |
 |
 |
 |
| m/z Ион |
107.0491 C7H7O+ |
118.0651 C8H8N+ |
120.0808 C8H10N+ |
121.0284 ${{{\text{C}}}_{{\text{7}}}}{{{\text{H}}}_{5}}{\text{O}}_{2}^{ + }$ |
126.1277 C8H16N+ |
140.1070 C8H14NO+ |
142.1226 C8H16NO+ |
| Структура |  |
 |
 |
 |
 |
 |
 |
| m/z Ион |
143.0855 ${{{\text{C}}}_{{{\text{11}}}}}{\text{H}}_{{11}}^{ + }$ |
145.1012 ${{{\text{C}}}_{{{\text{11}}}}}{\text{H}}_{{13}}^{ + }$ |
156.1019 ${{{\text{C}}}_{{\text{8}}}}{{{\text{H}}}_{{14}}}{\text{NO}}_{2}^{ + }$ |
159.0804 ${{{\text{C}}}_{{{\text{11}}}}}{{{\text{H}}}_{{11}}}{\text{O}}_{{}}^{ + }$ |
159.0804 C11H11O+ |
||
| Структура |  |
 |
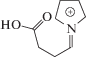 |
 |
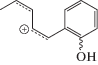 |
||
| m/z Ион |
160.1121 C11H14N+ |
161.0961 C11H13O+ |
161.0961 C11H13O+ |
161.0961 C11H13O+ |
162.1277 C11H16N+ |
||
| Структура | 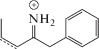 |
 |
 |
 |
 |
||
| m/z Ион |
172.1121 C12H14N+ |
173.1199 C12H15N+• |
177.0910 ${{{\text{C}}}_{{{\text{11}}}}}{{{\text{H}}}_{{{\text{13}}}}}{\text{O}}_{2}^{ + }$ |
188.1070 C12H14NO+ |
188.1070 C12H14NO+ |
||
| Структура |  |
 |
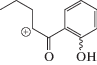 |
 |
 |
||
| m/z Ион |
188.1434 C13H18N+ |
189.1148 C12H15NO+• |
189.1148 C12H15NO+• |
189.1148 C12H15NO+ |
200.1070 C13H14NO+ |
||
| Структура |  |
 |
 |
 |
 |
||
| m/z Ион |
202.0863 ${{{\text{C}}}_{{{\text{12}}}}}{{{\text{H}}}_{{12}}}{\text{NO}}_{2}^{ + }$ |
202.0863 ${{{\text{C}}}_{{{\text{12}}}}}{{{\text{H}}}_{{12}}}{\text{NO}}_{2}^{ + }$ |
202.1226 C13H16NO+ |
204.1019 ${{{\text{C}}}_{{{\text{12}}}}}{{{\text{H}}}_{{14}}}{\text{NO}}_{2}^{ + }$ |
220.0968 ${{{\text{C}}}_{{{\text{12}}}}}{{{\text{H}}}_{{14}}}{\text{NO}}_{3}^{ + }$ |
||
| Структура |  |
 |
 |
 |
 |
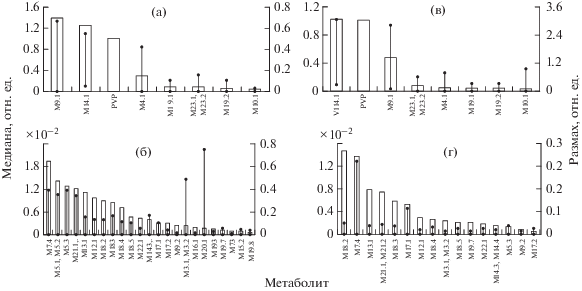
Рис. 2.
Выборочные медианы (левые оси) и размахи (правые оси) высот хроматографических пиков метаболитов α-пирролидиновалерофенона, нормированных к высоте пиков неизмененного α-пирролидиновалерофенона (метод ЖХ–К-ВМПС, запись хроматограмм ±5 мДа). Для проб мочи, собранные при проведении химико-токсикологических освидетельствований (а, б) и при аутопсии (в, г).
Выбор энергии ДИС для систем ЖХ–МС/МС обусловлен требованием подобия получаемых спектров. Выбранные величины (20 эВ для К-ВПМС и 22 эВ для КкКМС) позволили получить почти идентичные спектры на обеих системах. Они приведены на рис. 4 (основные метаболиты, КкКМС) и рис. 5, 6 (все остальные метаболиты, К-ВПМС).
Рис. 4.
Масс-спектры основных метаболитов α-пирролидиновалерофенона (метод ЖХ–КкКМС, энергия ДИС 22 эВ). Пояснения см. в тексте.

Рис. 5.
Масс-спектры метаболитов α-пирролидиновалерофенона (метод ЖХ–К-ВМПС). Энергия ДИС 20 эВ (а, б, г, ж, з, л) и 40 эВ (в, д, е, и, к, м).

Рис. 6.
Масс-спектры метаболитов α-пирролидиновалерофенона (метод ЖХ–К-ВМПС). Энергия ДИС 20 эВ (а, г–з, к–м) и 40 эВ (б, в, и).

Фрагментация неизмененного PVP (рис. 4а и табл. 2) достаточно характеристична. Ионы с m/z 126 и 161 являются продуктами элиминирования фенацильного и пиррильного остатков соответственно, ион-радикал с m/z 189 образован отщеплением пропила от протонированной молекулы. Ион с m/z 105 соответствует фенацильному остатку, возможно, находящемуся в форме кетотропилиевого катиона, а ион с m/z 91 соответствует самому катиону тропилия, причем его образование, скорее всего, связано с енолизацией структуры PVP и последующим элиминированием воды. Пиррильному циклу соответствуют два иона с m/z 70 и 72 (не указан), причем в спектрах метаболитов PVP второй ион (m/z 72), содержащий два протона у атома азота, или его модифицированное производное обычно имеют бо́льшую интенсивность, чем депротонированный ион (m/z 70). Образование всех этих ионов или их производных являлось основным признаком при обнаружении метаболитов и определении их структур. При увеличении pH элюента удерживание PVP значительно растет (табл. 1), что свидетельствует о депротонировании атома азота.
β-Кетоны (М1.1–М9.1). Простейшими метаболитами этой серии являются продукты моногидроксилирования.
Моногидроксилирование. Спектры двух метаболитов М1.1 и М1.2 содержат интенсивный пик иона с m/z 188 (рис. 5а), наличие которого вместе с ионами, имеющими m/z 72, 91 и 105, указывает на существование гидроксильной группы на пропильном остатке. Такое предположение подтверждается легкой дегидратацией М1.1 и М1.2 в ионном источнике, их малым удерживанием в подкисленном элюенте и ростом удерживания при увеличении pH. Содержание этих метаболитов крайне мало (что косвенно подтверждается данными работы [15]), а их глюкуронидированные формы не обнаружены. Структуры метаболитов М2.1 и М2.2 содержат гидроксильную группу на фенильном остатке, на что указывает наличие пиков ионов с m/z 107 и 177 в их спектрах (рис. 5б). Эти ионы, отличающиеся наличием атома кислорода от ионов с m/z 91 и 161 соответственно, вместе с ионом с m/z 121 можно считать надежным признаком присутствия фенольного остатка в молекуле метаболитов. В спектрах глюкуронидированных форм фенил-гидроксилированных метаболитов М2.3–М2.5 (рис. 5в) также имеются интенсивные пики ионов с m/z 107, 177 и 121, а также ион с m/z 248, образующийся при элиминировании остатка глюкуроновой кислоты и соответствующий протонированной молекуле метаболита фазы I. Следует отметить, что формирование подобных ионов характерно для глюкуронидов вообще, причем присутствие остатка глюкуроновой кислоты в спектрах положительных ионов в явном виде обычно не проявляется (хотя отчетливо заметно в спектрах отрицательных ионов). Метаболиты М3.1 и М3.2 соэлюируются в условиях ЖХ–К-ВПМС (кислый элюент), но частично разделяются в слабокислом элюенте и в условиях ЖХ–КкКМС. Их спектры почти идентичны (что вместе с удерживанием позволяет предположить их диастереомерную природу) и содержат ионы с m/z 91, 105 и 161 (рис. 5г), свидетельствующие о неизмененном характере пропильного и фенильного остатков. Гидроксильная группа у метаболитов М3.1 и М3.2 находится на пиррильном остатке, на что указывает также существование ионов с m/z 70 (дегидратированный моногидроксилированный пиррольный остаток) и m/z 142. Этим метаболитам соответствуют глюкуронидированные формы (М3.3 и М3.4), спектры которых содержат пики тех же ионов, что и у свободных форм вместе с ионом с m/z 248 (рис. 5д). Хроматографические пики метаболитов М3.1 и М3.2 наиболее интенсивны во всей серии моногидроксилированных метаболитов.
Удерживание моногидроксилированных метаболитов определяется положением гидроксильной группы согласно последовательности остатков: пропил < фенил < пиррол, причем подобный порядок удерживания сохраняется и для других метаболитов, изомерных по положению гидроксила. При переходе к слабокислому элюенту удерживание моногидроксилированных метаболитов фазы I растет (аналогично неизмененному PVP), и в наибольшей степени этот эффект проявляется для тех метаболитов, у которых гидроксильная группа близка к атому азота (М3.1 и М3.2). Удерживание глюкуронидированных форм снижается за счет диссоциации карбоксильной группы остатка глюкуроновой кислоты.
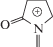
Образование амида и дополнительное гидроксилирование. Появление карбонильной группы в пиррольном цикле PVP (формирование лактама) – известный метаболический процесс [7–9, 13–17]. В спектре метаболита М4.1 (подобно неизмененному PVP) также присутствуют пики ионов с m/z 91, 105, и 161 (рис. 4б). Следствием наличия дополнительной карбонильной группы являются ионы с m/z 69, 86 и 128. Ион с m/z 143 (его пик малоинтенсивен в спектре неизмененного PVP) образуется вследствие дегидратации β-кетона и элиминирования лактамного остатка. В первой наиболее интенсивной ступени дегидратации протонированной молекулы М4.1 (ионы с m/z 228 и малоинтенсивный с m/z 210) участвует карбонильная группа вблизи фенильного цикла, что подтверждено спектром МС3 иона с m/z 228. В работе [9] сделано предположение о возможном частичном образовании М4.1 вследствие дегидратации метаболита М9.1 и, следовательно, о частично артефактной – неметаболической – природе происхождения М4.1. Возможно, вклад данного процесса важен при использовании метода ГХ–МС, однако значительная интенсивность его пика в наших условиях свидетельствует о его непосредственном присутствии в пробах мочи. Для М4.1 и аналогичных структур разница времен удерживания для двух элюентов мала вследствие снижения константы протонирования амидного азота.
Метаболит М4.1 подвержен дополнительному гидрокислированию, хотя пики его продуктов, как правило, менее интенсивны, чем пик М4.1. Фрагментация метаболитов М5.1–М5.3, предположительно являющихся продуктами дополнительного моногидроксилирования по пропильному остатку, выглядит несколько необычной (рис. 4в). Наиболее интенсивный ион с m/z 200 образован элиминированием части пропильного остатка (табл. 2). Можно предположить, что его образование включает стадию енолизации. Все три моногидроксилированных метаболита легко дегидратируются в источнике ионов. Метаболиты М5.1 и М5.2 соэлюировались в условиях ЖХ–К-ВПМС, но разделялись в системе ЖХ–КкКМС. Спектры трех глюкуронидированных форм (М5.4–М5.6, рис. 5е) содержат интенсивные пики ионов с m/z 86, 159 и 202, указывающие на присутствие глюкуронидированной гидроксильной группы на пропильном остатке. Подобно свободным формам, метаболиты М5.4 и М5.6 разделялись только в условиях ЖХ–КкКМС.
Два метаболита с гидроксильной группой на фенильном цикле М6.1 и М6.2 имеют несколько различные спектры (рис. 5ж и 5з). Общее сходство спектров заключается в присутствии ионов с m/z 86, 107 и 177, а главное различие – в интенсивности иона с m/z 140. Структура иона с m/z 159 для метаболита М6.2 отличается от таковой для М5.4–М5.6 (подтверждено МС3, табл. 2). Особенности фрагментации свободных форм справедливы и для глюкуронидов М6.3–М6.4 (рис. 5и, 5к).
Спектры трех гидроксилированных по лактамному циклу метаболитов М7.1–М7.3 (рис. 5л) подобны, а существование пиков ионов с m/z 102 и 156 вместе с ионами, имеющими m/z 143 и 161, прямо указывает на положение гидроксильной группы. Содержание этих метаболитов в негидролизованных пробах мочи весьма мало из-за высокой степени глюкуронидирования. Особенности фрагментации сохраняются и для глюкуронидированных форм М7.4 и М7.5 (рис. 5м).
Карбоксилирование. Образование карбоксильной группы на пропильном остатке (М8.1, рис. 6а) следует из наличия в его спектре ионов с m/z 72 (неизмененный пиррильный остаток) и 156 [16], а также разницы времен удерживания (–0.11 мин), свидетельствующей о появлении новой функциональной группы, диссоциирующей в слабокислом элюенте.
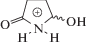
β-Спирты (М14.1-М20.1). Неизвестно, присутствует ли исходное соединение данной серии, М14.1, в моче крыс [13, 14], однако оно было обнаружено в моче людей [9, 10, 16, 17], причем высота его хроматографического пика, как правило, значительна. Ионы с m/z 145 и 173 (рис. 4и), образование которых связано с дегидратацией, можно считать явными признаками восстановления β‑карбонильной группы до спиртовой. Метаболит М14.1 существует, по крайней мере, в трех глюкуронидированных формах (М14.2–М14.4), причем две последние, по-видимому, являются диастереомерами. Они соэлюируются в условиях ЖХ–К-ВПМС (кислый элюент), но разделяются в слабокислом элюенте. Их фрагментация подобна М14.1 (рис. 6в).
Моногидроксилирование. В спектрах двух моногидроксилированных метаболитов М15.1 и М15.2 присутствуют интенсивные пики ионов с m/z 232 и 214, образованных последовательной дегидратацией (рис. 6г). Брутто-формула иона с m/z 143, образованного двойной дегидратацией двукратно гидроксилированной н-пентильной цепи, подобна формуле аналогичного иона, образующегося при фрагментации метаболитов β-кетонной серии с неизмененным пропильным остатком. Аналогично моногидроксилированным по пропильному остатку метаболитам β-кетонной серии (М5.1–М5.3), спектры М15.1 и М15.2 содержат интенсивный ион с m/z 188, образование которого связано с частичным элиминированием пропильного остатка.
Вместе с пиками ионов с m/z 107 (гидроксилированный фенильный остаток) и m/z 189 (табл. 2) в спектре метаболитов М16.1 и М16.2 присутствует и пик иона с m/z 161 (рис. 6д). В данном случае его структура иная, чем для серии β-кетонов, и гидроксил находится на фенильном остатке (подтверждено спектрами МС3).
Два метаболита, структуры которых включают дополнительные гидроксильные группы на пиррильном остатке, М17.1 и М17.2, определены по наличию пиков ионов с m/z 189 и 88, а также по продуктам их дегидратации – ионам с m/z 172 и 70 (рис. 6е). Для этих метаболитов (как и для М15, М16) разница времен удерживания близка к таковой для метаболита М14.1, что позволяет предположить малое влияние гидроксила в пиррильном цикле на протонирование атома азота или его удаленность от него.
Ни для одного из моногидроксилированных метаболитов β-спирта М14.1 не обнаружили глюкуронидированных форм.
Образование β-лактама и дополнительное гидроксилирование. Спектры диастереомеров М18.1 и М18.2 практически идентичны и содержат пики ионов с m/z 86 и 188 (рис. 6ж). Присутствие интенсивного пика иона с m/z 145 и небольшая разница времен удерживания для двух элюентов позволяют отнести метаболиты М18.1 и М18.2 к β-лактамам. Эти соединения существуют в глюкуронидированных формах (М18.3–М18.5, рис. 6з), причем особенности фрагментации сохраняются, а величина разницы времен удерживания по сравнении с другими соединениями указывает на наличие карбоксильной группы вместе с непротонированным атомом азота.
Наличие интенсивного пика иона с m/z 143 и иона с m/z 228 в спектрах метаболитов М19.1 и М19.2 (рис. 4к, гидроксилирование пропильного остатка) связано с дегидратацией двух гидроксильных групп, находящихся на пентановой цепи при сохранении β-лактамного цикла, что подтверждено спектрами МС3 и величиной разницы времен удерживания, характерной для β-лактамов. Поэтому метаболиты М19.1 и М19.2 отнесены к β-спиртам, несмотря на сходство их спектров со спектрами β-кетонов. В спектре МС3 иона с m/z 202 (C13H16NO+) присутствуют ионы с m/z 86 (лактамный цикл) и 117 (${{{\text{C}}}_{9}}{\text{H}}_{9}^{ + }$). Для свободных метаболитов, гидроксилированных по пропильному остатку, найдено шесть глюкуронидов (М19.3–М19.8), причем их спектры можно разделить на две части по признаку подобия. Спектры, характерные для каждой части (М19.3 и М19.6), приведены на рис. 6и, 6к соответственно. Подобно свободным формам, спектр М19.3 также содержит пики ионов с m/z 202 и 228, а также m/z 86, 143 и 161. В спектре М19.6 присутствует интенсивный пик иона с m/z 161 и малоинтенсивный – с m/z 228, причем ион с m/z 202, отсутствует. При энергии ДИС 40 эВ (не приведено) в спектре заметен также ион, имеющий m/z 143.
Единственный метаболит, дополнительно гидроксилированный по фенильному остатку, М20.1 (рис. 6л), глюкуронидирован в значительной степени и в пробах мочи почти не наблюдается в свободной форме. В его спектре имеется пик иона с m/z 107, (гидроксилирование фенильного остатка), в ионе с m/z 161 гидроксил также находится на фенильном остатке (подтверждено МС3). Ион с m/z 204 образован путем элиминирования пропильного остатка.
Продукты разрушения пиррольного цикла (М9.1–М13.1 и М21.1–М23.2). Как правило, интенсивность хроматографического пика метаболита М9.1 весьма велика [9]. В его спектре присутствуют пики ионов, соответствующие трем стадиям дегидратации и имеющие m/z 246, 228 и 210 (рис. 4г), а также характерные ионы с m/z 87 и 160, образующиеся при разрыве связи между атомом азота и пропилкарбоксильной цепью. Присутствие интенсивных пиков ионов с m/z 91, 161 и 143 свидетельствуют о сохранении неизмененной фенилпентоновой цепи. Найден глюкуронид метаболита М9.1 (М9.2, рис. 6б). Относительная высота его хроматографического пика (в отличие от свободной формы М9.1) очень мала, а фрагментация (и разницы времен удерживания в разных элюентах) подобна М9.1.
Хроматографический пик, обозначенный М10.1 (рис. 3 и 4д), в значительной степени асимметричен, что можно объяснить соэлюированием диастереомеров (и, возможно, изомеров положения гидроксильной группы на пропильном остатке). Его спектр практически одинаков вдоль профиля пика, и в нем интенсивны пики ионов с m/z 220 и 202, причем второй ион является продуктом дегидратации первого. Ион с m/z 87 соответствует пропилкарбоксильной цепи.
Метаболиты М11.1 и М11.2 подобны предыдущему, но в их структурах гидроксильная группа расположена на фенильном остатке. В спектре М11.1 (рис. 4е), подобно рассмотренному выше М6.1, присутствует интенсивный пик иона с m/z 140, а в спектрах обоих метаболитов – ионы с m/z 87, 107 и 177. Ион с m/z 176 образуется при элиминировании пропилкарбоксильной цепи.
Удерживание метаболита М12.1 существенно снижается при переходе к слабокислому элюенту (разница времен удерживания –2.15), поскольку в этом соединении присутствует карбоксильная группа, а атом азота участвует в образовании амидной связи. Наличие ионов с m/z 161 и 178 указывает на существование неизмененной фенилпентоновой цепи, а ионов с m/z 101 и 73 – на существование оксопропилкарбоксильной цепи (рис. 4ж). Ион с m/z 178, соответствует по структуре протонированной молекуле метаболита М13.1. Спектр самого М13.1 (рис. 4з) достаточно прост, ион с m/z 160 образуется при дегидратации, а с m/z 118 – при дегидратации и элиминировании пропильного остатка.
Диастереомеры М21.1 и М21.2 представляют собой продукты восстановления карбонильной группы метаболита М9.1. Это следует из наличия ионов с m/z 87, 145 и 162 (рис. 4л) и величины разницы времен удерживания для двух элюентов, примерно равной 0.3 мин.
Разница времен удерживания для двух элюентов (–2.23) для метаболита М22.1 аналогична метаболиту М12.1, и в его спектре также есть пики ионов с m/z 101 и 73 (рис. 6м). Присутствие ионов с m/z 145 и m/z 162 (интенсивный) указывает на принадлежность М22.1 к группе β-спиртов. Метаболит М22.1, предположительно, является продуктом восстановления М12.1.
Диастереомеры М23.1 и М23.2 представляют собой продукты восстановления М13.1. На это указывает наличие в их спектрах ионов с m/z 145, 120 и 119 (C8H9N+, не указан) (рис. 4м). Ион с m/z 106 (C7H8N+), образуется в результате перегруппировки.
Относительные высоты хроматографических пиков метаболитов PVP. Результаты измерений высот пиков метаболитов, нормированные к высоте пика PVP, приведены на рис. 2 (указаны только те метаболиты, для которых выборочные медианы были не ниже 0.001). Представленные выборки характеризуются значительными размахами, в несколько раз превышающими величины медиан. Подобные результаты можно считать нормальными при учете множества исходных различий: в размере принятой дозы, в промежутке времени между приемом PVP и отбором мочи, в состоянии и особенностях организма и пр. Столь большие размахи не позволяют отличить пробы мочи, собранные у живых лиц, от собранных при аутопсии. В пробах мочи, содержащих наибольшие концентрации любого из обсуждаемых соединений, как правило, превалировал сам PVP, что можно объяснить недостаточностью ферментных систем в условиях высоких дозировок наркотика. Однако и в этих случаях превышение высот пиков PVP для проб, собранных при аутопсии (что характерно лишь для двух проб из четырнадцати), над всеми пробами, собранными при химико-токсикологическом освидетельствовании, составляло не более 20–60%. В связи с этим даже для этих двух проб невозможно сделать уверенное заключение об отравлении PVP как причине смерти. В целом содержание PVP и его метаболитов в аутопсийных пробах несколько ниже, чем в пробах мочи, отобранных при химико-токсикологическом освидетельствовании на состояние одурманивания. Это объясняется целевым характером последнего.
* * *
Таким образом, методом ЖХ–МС/МС при анализе проб мочи человека установлено, что наиболее интенсивные хроматографические пики соответствуют самому PVP, лактаму, продуктам восстановления карбонильной группы (в том числе с разрушением пиррольного цикла до первичного амина или образованием лактама и гидроксилированием), окислительного дезаминирования (в том числе с дополнительным гидроксилированием). Основные метаболиты PVP присутствуют в моче главным образом в свободной форме (фаза I), что делает необязательной процедуру деконъюгирования при применении метода ГХ–МС.
Список литературы
European Monitoring Centre for Drugs and Drug Addiction. EMCDDA–Europol, 2016. Annual Report on the implementation of Council Decision 2005/387/JHA. 2017. http://www.emcdda.europa.eu/system/files/publications/ 4724/TDAN17001ENN_PDFWEB.pdf (25.11.2017 г.).
Uralets V., Rana S., Morgan S., Ross W. Testing for designer stimulants: metabolic profiles of 16 synthetic cathinones excreted free in human urine // J. Anal. Toxicol. 2014. V. 38. № 5. P. 233.
Thomae K. α-Pyrrolidino-ketones. Patent № GB 933507. 1963.
European Monitoring Centre for Drugs and Drug Addiction. EMCDDA–Europol. Report on the risk assessment of 1-phenyl-2-(pyrrolidin-1-yl)pentan-1-one (α-pyrrolidinovalerophenone, α-PVP). 2016. http://www.emcdda.europa.eu/system/files/publications/2934/TDAK16001ENN.pdf (25.11.2017 г.).
Zawilska J.B., Wojcieszak J. α-Pyrrolidinophenones: a new wave of designer cathinones // Forensic Toxicol. 2017. V. 35. № 2. P. 201.
Постановление Правительства Российской Федерации от 30.06.1998 г. № 681 “Об утверждении перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации”. URL: http://base.garant.ru/12112176 (25.11.2017 г.).
Namera A., Konuma K., Kawamura M., Saito T., Nakamoto A., Yahata M., Ohta S., Miyazaki S., Shiraishi H., Nagao M. Time-course profile of urinary excretion of intravenously administered a-pyrrolidinovalerophenone and a-pyrrolidinobutiophenone in a human // Forensic Toxicol. 2014. V. 32. № 1. P. 68.
Grapp M., Sauer C., Vidal C., Muller D. GC-MS analysis of the designer drug α‑pyrrolidinovalerophenone and its metabolites in urine and blood in an acute poisoning case // Forensic Sci. Int. 2016. V. 259. P. e14.
Мелентьев A.Б., Катаев С.С., Дворская О.Н. Дизайнерские наркотики. Метаболизм и подходы к анализу в биологических средах. М.: Перо, 2016. 325 с.
Sykutera M., Cychowska M., Bloch-Boguslawska E. A fatal case of pentedrone and α-pyrrolidinovalerophenone poisoning // J. Anal. Toxicol. 2015. V. 39. № 4. P. 324.
Hasegawa K., Suzuki O., Wurita A., Minakata K., Yamagishi I., Nozawa H., Gonmori K., Watanabe K. Postmortem distribution of α-pyrrolidinovalerophenone and its metabolite in body fluids and solid tissues in a fatal poisoning case measured by LC–MS–MS with the standard addition method // Forensic Toxicol. 2014. V. 32. № 2. P. 225.
Adamowicz P., Gieron J., Gil D., Lechowicz W., Skulska A., Tokarczyk B., Zuba D. Blood concentrations of α-pyrrolidinovalerophenone (α-PVP) determined in 66 forensic samples // Forensic Toxicol. 2016. V. 34. № 2. P. 227.
Haas C., Sauer C., Meyer M.R., Fritschi G., Maurer H.H., Peters F.T. Studies on the metabolism and toxicological analysis of the new designer drug alpha‑pyrrolidino–valerophenone (PVP) in rat urine using GC-MS techniques / Current Contributions to Forensic and Clinical Toxicology / Eds. Pragst F., Aderjan R. Bad Vilbel: GTFCH, 2008. P. 269.
Sauer C., Peters F.T., Haas C., Meyer M.R., Fritschi G., Maurer H.H. New designer drug α-pyrrolidinovalerophenone (PVP): studies on itsmetabolism and toxicological detection in rat urine using gas chromatographic/mass spectrometric techniques // J. Mass Spectrom. 2009. V. 44. P. 952.
Negreira N., Erratico C., Kosjek T., van Nuijs A.L.N., Heath E., Neels H., Covaci A. In vitro phase I and phase II metabolism of α-pyrrolidinovalerophenone (α‑PVP), methylenedioxypyrovalerone (MDPV) and methedrone by human liver microsomes and human liver cytosol // Anal. Bioanal. Chem. 2015. V. 407. № 19. P. 5803.
Tyrkko E., Pelander A., Ketola R.A., Ojanpera I. In silico and in vitro metabolism studies support identification of designer drugs in human urine by liquid chromatography/quadrupole-time-of-flight mass spectrometry // Anal. Bioanal. Chem. 2013. V. 405. P. 6697.
Shima N., Katagi M., Kamata H., Matsuta S., Sasaki K., Kamata T., Nishioka H., Miki A., Tatsuno M., Zaitsu K., Ishii A., Sato T., Tsuchihashi H., Suzuki K. Metabolism of the newly encountered designer drug α-pyrrolidinovalerophenone in humans: identification and quantitation of urinary metabolites // Forensic Toxicol. 2014. V. 32. № 1. P. 59.
Maurer H.H., Pfleger K., Weber A.A. MPW Edition 2011. Weinheim: Wiley-VCH Verlag GmbH & Co. KGaA, STM Databases, 2011.
Maurer H.H., Wissenbach D.K., Weber A.A. LC-MCn Library of Drugs, Poisons, and Their Metabolites. Wienheim: Wiley-VCH, 2014.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии




