Журнал аналитической химии, 2019, T. 74, № 5, стр. 365-372
Оценка возможности газохроматографического определения летучих органических соединений в выдыхаемом воздухе для неинвазивной диагностики рака легких
Э. М. Гашимова 1, *, А. З. Темердашев 1, В. А. Порханов 2, И. С. Поляков 2, Д. В. Перунов 2, А. А. Азарян 1, Е. В. Дмитриева 1
1 Кубанский государственный университет
350040 Краснодар, ул. Ставропольская, 149, Россия
2 Научно-исследовательский институт – Краевая клиническая больница № 1 им. С.В. Очаповского
350086 Краснодар, ул. 1 Мая, 167, Россия
* E-mail: elina.gashimova@yandex.ru
Поступила в редакцию 16.08.2018
После доработки 03.12.2018
Принята к публикации 03.12.2018
Аннотация
Изучена возможность определения летучих органических соединений, содержащихся в выдыхаемом воздухе, путем их концентрирования в сорбционных трубках, двухстадийной термодесорбции и определения методом газовой хроматографии с пламенно-ионизационным детектором на различных хроматографических колонках. Установлено, что оптимальным для концентрирования является сорбент Tenax TA, а наибольшая эффективность разделения достигается на колонке типа PLOT СP-Porabond-Q. Концентрирование аналитов без потерь достигнуто при пропускании через сорбент 0.5 л пробы со скоростью 200 мл/мин.
В последние годы выдыхаемый воздух как объект анализа привлекает все большее внимание для целей медицинской диагностики [1, 2]. С практической точки зрения этот объект удобен при массовых обследованиях в медицине, так как процедура анализа является простой, быстрой, неинвазивной и экспрессной; можно избежать болезненных или неприятных ощущений, уйти от повышенных требований к проведению измерений и квалификации персонала, а также к стерильности помещений.
Анализ выдыхаемого воздуха сегодня успешно применяют при установлении состояния алкогольного опьянения в ходе медицинского освидетельствования [3], подтверждении диагноза и мониторинга протекания бронхиальной астмы [4], проведении водородных [5] или 13С-дыхательных тестов [6] при диагностике некоторых заболеваний желудочно-кишечного тракта. Выдыхаемый воздух может быть полезен и для выявления маркеров других заболеваний [1, 7], а также для оценки индивидуального ежедневного воздействия опасных летучих соединений на работников, находящихся в условиях повышенной загрязненности [8, 9]. Известно [10, 11], что выдыхаемый воздух человека содержит большое количество соединений разных классов, концентрации которых могут существенно меняться из-за состава атмосферного воздуха, а также протекающих в организме метаболических процессов. Например, при сахарном диабете происходит нарушение усвоения глюкозы, вследствие чего в энергетический обмен включаются жирные кислоты, что обусловливает увеличение концентрации ацетона в выдыхаемом воздухе [12, 13].
В настоящее время актуален поиск веществ-маркеров онкологических заболеваний [14, 15], причем наиболее остро стоит вопрос выявления маркеров рака легких, так как ранняя диагностика в данном случае особенно затруднительна [16–18]. Для поиска онкомаркеров в выдыхаемом воздухе используют различные аналитические методы, такие как протонная масс-спектрометрия [19], масс-спектрометрия выбранных ионов в потоке [20], спектроскопия ионной подвижности [21], различные виды сенсорных систем [22–24], однако наиболее эффективным и удобным методом для идентификации потенциальных маркеров остается газовая хромато-масс-спектрометрия (ГХ–МС) [25–27]. Принимая во внимание возможность вариативности результатов в достаточно широких пределах, обусловленную особенностями метаболизма, целесообразно использовать для диагностики не только конкретные вещества, но и сопоставлять общие профили хроматограмм.
Учитывая разнообразие летучих органических соединений (ЛОС), входящих в состав выдыхаемого воздуха, провести их одновременное определение за один аналитический цикл практически невозможно. Необходимо выделить вещества-кандидаты, которые могут быть потенциальными маркерами тех или иных заболеваний. Анализ литературных данных [28–32] показал, что в ряде работ присутствуют одни и те же вещества-кандидаты: этанол, ацетон, бензол, толуол, 2-метилпентан, бутаналь, пентаналь, изопрен, гексан и пентанол-1, поэтому в дальнейших исследованиях мы уделяли особое внимание данным компонентам.
Известны работы, посвященные анализу выдыхаемого воздуха для выявления потенциальных онкомаркеров, с использованием методов газовой хроматографии и ГХ–МС с применением хроматографических колонок с различными неподвижными фазами, такими как полиэтиленгликоль [27], цианопропилфенил-метилполисилоксан [33], фенил‑диметилполисилоксан [34], диметилполисилоксан [30]. В некоторых работах разделение осуществляют на капиллярных колонках с пористым слоем на стенках (PLOT) [25, 27, 35]. Учитывая относительно небольшие концентрации эндогенных соединений в выдыхаемом воздухе, широкое распространение и применение при решении подобных задач получили методы предварительного концентрирования проб с использованием сорбционных трубок с различными типами сорбентов [27, 34] или волокон для твердофазной микроэкстракции [32, 33, 35] с последующей термодесорбцией.
Имеется большое количество публикаций, в которых предложен широкий перечень потенциальных веществ-маркеров, однако их результаты не всегда коррелируют между собой [26, 30, 34, 35].
Отсутствие единого подхода к вопросу разработки методик ранней диагностики онкологических заболеваний по выдыхаемому воздуху обусловливает необходимость подбора и оптимизации условий отбора, концентрирования и разделения определяемых веществ на основании сопоставления хроматографических профилей выдыхаемого воздуха здоровых людей и больных с подтвержденным онкологическим заболеванием (раком легких различных типов), что и являлось целью настоящей работы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объекты исследования. Компонентный состав выдыхаемого воздуха оценивали с участием двух групп добровольцев (по 70 человек в группе): люди с подтвержденным онкологическим заболеванием (раком легких различных типов) и здоровые, разных возрастных групп и гендерной принадлежности. Добровольцы делали несколько глубоких вдохов и выдохов с небольшим интервалом (для обеспечения полноты обновления альвеолярного воздуха), после чего совершали глубокий вдох, задерживали воздух на 10 с и совершали глубокий выдох в пакет для отбора проб, повторяя процедуру до заполнения пакета. Параллельно в этом же помещении отбирали холостую пробу воздушной среды для минимизации возможности возникновения ложных результатов на данном этапе исследований.
Материалы и методы. В качестве образцов сравнения при хроматографическом анализе использовали стандартные образцы этанола, бензола, толуола, ацетонитрила, изопрена, 1,4-пентадиена, бутаналя, пентаналя, пентанола-1, н-гексана (>95%, Sigma-Aldrich, США) ацетона (ос. ч., Экос-1, Россия) и пропанола-2 (х. ч., Вектон, Россия).
Приборы и оборудование. Использовали систему, состоящую из двухстадийного термодесорбера ТДС-1 (ЗАО СКБ “Хроматэк”, Россия) и газового хроматографа Хроматэк-Кристалл 5000.2 с пламенно-ионизационным детектором (ПИД) (ЗАО СКБ “Хроматэк”, Россия). Температура инжектора 250°C, температура ПИД 250°C, газ-носитель азот, деление потока 1 : 17. Эффективность разделения оценивали с использованием хроматографических колонок Agilent HP-FFAP (50 м × 0.32 мм, 0.5 мкм), SGE СR-5 (30 м × 0.32 мм, 1.0 мкм), SGE Equlity 1701 (30 м × 0.32 мм, 0.25 мкм), Bruker CP-Porabond-Q (50 м × 0.32 мм, 0.45 мкм). Управление и обработку данных проводили с использованием программного обеспечения Хроматэк Аналитик (ЗАО СКБ “Хроматэк”, Россия).
Отбор и концентрирование проб. Пробы отбирали в лавсановые пробоотборные пакеты ПП-1-5,0 (OOO НПФ “ЭКАН”) объемом 5 л, которые перед использованием пятикратно кондиционировали с использованием азота.
Для концентрирования ЛОС из выдыхаемого воздуха использовали сорбционные трубки с сорбентами Chromosorb 106 (60/80 меш), Тenax TA (35/60 меш), Porapak N (50/80 меш) и комбинированным сорбентом (Tenax GR, Carbopack B, Carbosieve SIII) (ЗАО СКБ “Хроматэк”, Россия), которые предварительно кондиционировали в соответствии с рекомендациями производителя. Для концентрирования ЛОС из выдыхаемого воздуха пробу из пакета пропускали через сорбент с помощью аспиратора ПВ-2 (ЗАО СКБ “Хроматэк”, Россия). Пробы переносили на сорбционные трубки не позднее, чем через 6 ч после заполнения пакета, образцы хранили при комнатной температуре.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Одной из наиболее важных задач являлось изучение эффективности и селективности применяемых хроматографических колонок по отношению к компонентам, присутствующим в выдыхаемом воздухе. Однако, учитывая широкий перечень веществ, выбрать одну колонку, обеспечивающую максимальную эффективность по отношению ко всем компонентам, не представлялось возможным. Особое внимание уделяли наиболее легким компонентам, присутствующим в выдыхаемом воздухе, поскольку более тяжелые компоненты согласно данным [36] склонны к растворению в конденсате, образующемся в пробоотборном пакете, что существенно снижает воспроизводимость результатов.
Для решения поставленной задачи изучали хроматографические колонки, отличающиеся по своим физико-химическим свойствам: Supelco Equility TM 1701, SGE СR5, Agilent HP-FFAP и Varian CP-Porabond-Q. Пробу объемом 5 л пропускали через сорбционную трубку с сорбентом Тenax TA со скоростью 200 мл/мин, анализ проводили в оптимизированных для каждой колонки и сорбента условиях (см. табл. 1, 2).
Таблица 1.
Условия газохроматографического определения исследуемых соединений на различных колонках
| Колонка | Температура, °С | Скорость подъема, град/мин | Время, мин | Расход газа-носителя, мл/мин |
|---|---|---|---|---|
| HP-FFAP | 41 | 0 | 3 | 1.55 |
| 180 | 7 | 15 | ||
| CR-5 и Equility TM 1701 | 35.0 | 0 | 3 | 1.25 |
| 260 | 7 | 0 | ||
| CP-Porabond-Q | 150.0 | 0 | 1 | 1.42 |
| 220 | 6 | 0 | ||
| 270 | 4 | 7 |
Таблица 2.
Режимы работы термодесорбера
| Параметр | Значение | |
|---|---|---|
| Температура крана, °С | 150 | |
| Температура переходной линии, °С | 180 | |
| Температура десорбции, °С | ||
| Tenax TA | 250 | |
| Комбинированный | 250 | |
| Chromosorb 106 | 220 | |
| Porapak N | 150 | |
| Время десорбции, мин | 5 | |
| Начальная температура ловушки, °С | –10 | |
| Конечная температура ловушки, °С | ||
| Tenax TA | 250 | |
| Комбинированный | 250 | |
| Chromosorb 106 | 220 | |
| Porapak N | 150 | |
| Время нагрева ловушки, мин | 2 | |
Колонка Equility TM 1701, хотя и является среднеполярной и позволяет разделять спирты и ароматические углеводороды, оказалась недостаточно эффективной при разделении представляющих наибольший интерес низкомолекулярных эндогенных соединений (рис. 1), поэтому использование этой колонки для анализа выдыхаемого воздуха нецелесообразно. Неполярная колонка СR-5 (рис. 2), как и ожидали, не обеспечивает эффективного разделения небольших полярных веществ, например ацетона и ацетонитрила, которые являются одними из основных компонентов выдыхаемого воздуха, что потенциально может привести к потере значительной части информации.
Рис. 1.
Хроматограмма пробы выдыхаемого воздуха, сконцентрированной в сорбционной трубке с сорбентом Tenax TA, на колонке Equility TM 1701. Условия хроматографирования указаны в тексте.
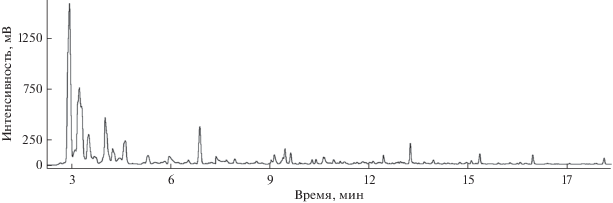
Рис. 2.
Хроматограмма пробы выдыхаемого воздуха, сконцентрированной в сорбционной трубке с сорбентом Tenax TA, на колонке СR5. Условия хроматографирования указаны в тексте.

Колонка HP FFAP (рис. 3) предназначена для эффективного разделения полярных соединений, в частности, спиртов и кетонов. Однако выдыхаемый воздух содержит ЛОС различных классов, в том числе и неполярные (алканы и алкены), которые также могут являться эндогенными и представляют интерес для дальнейшего изучения. При анализе выдыхаемого воздуха с использованием этой колонки (рис. 3) пик в начальной части хроматограммы, время удерживания которого совпадает с временем удерживания гексана, содержит и другие неполярные соединения. Таким образом, использование этой колонки также позволит изучить состав (профиль) ЛОС из выдыхаемого воздуха лишь частично.
Рис. 3.
Хроматограмма пробы выдыхаемого воздуха, сконцентрированной в сорбционной трубке с сорбентом Tenax TA, на колонке HP-FFAP. Условия хроматографирования указаны в тексте.

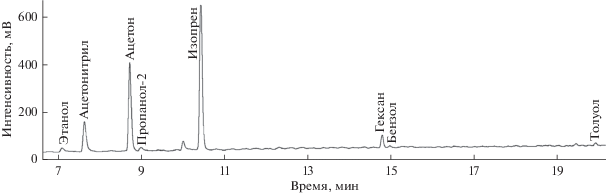
Колонка CP-Porabond-Q относится к молекулярным ситам и может быть использована для разделения как некоторых растворителей, так и легких летучих углеводородов. Помимо этого, она обладает достаточно высокой термической стабильностью, что дает возможность при необходимости варьировать условия хроматографического разделения в более широких пределах. Все это позволяет заключить, что колонка CP-Porabond-Q более всего подходит для определения летучих органических соединений, присутствующих в выдыхаемом воздухе (рис. 4).
Рис. 4.
Хроматограмма пробы выдыхаемого воздуха, сконцентрированной в сорбционной трубке с сорбентом Tenax TA, на колонке CP-Porabond-Q. Условия хроматографирования указаны в тексте.
Эффективность различных типов сорбентов для концентрирования ЛОС из выдыхаемого воздуха оценивали путем сравнения 4 наиболее распространенных коммерчески доступных типов сорбентов: Chromosorb 106, Тenax TA, Porapak N и комбинированный сорбент (Tenax GR, Carbopack B, Carbosieve SIII). Для этого отбирали пробу объемом 5 л. Воздух одной и той же пробы объемом 1 л со скоростью 50 мл/мин пропускали через каждый сорбент и анализировали на колонке CP-Porabond-Q. Следует отметить, что ни один сорбент не обеспечивал полноту извлечения всех компонентов, присутствующих в выдыхаемом воздухе. Так, этанол и ацетон лучше удерживались на сорбенте Тenax TА, ацетонитрил и гексан – на комбинированном сорбенте, а изопрен – практически одинаково удерживался на сорбенте Chromosorb 106, Тenax TA и Porapak N (рис. 5). Из всех сорбентов наименьшую емкость по отношению к определяемым ЛОС имел сорбент Porapak N.
Рис. 5.
Хроматограммы на колонке CP-Porabond-Q проб выдыхаемого воздуха, полученные с использованием сорбционных трубок с сорбентами Tenax TA (а), Porapak N (б), комбинированный (в), Chromosorb 106 (г). Условия хроматографирования указаны в тексте.
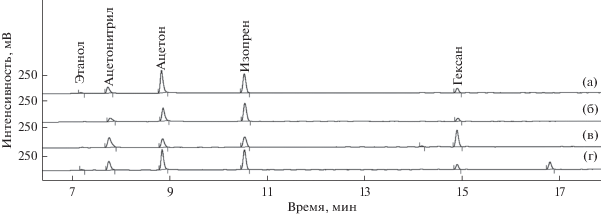
В случае сорбента Chromosorb 106 на хроматограммах также присутствовал системный пик, интенсивность которого практически не изменялась даже после многократного кондиционирования сорбционных трубок. Тем не менее, нельзя исключать присутствие соединений, время удерживания которых идентично времени удерживания системного пика. Корректная оценка содержания подобных компонентов в выдыхаемом воздухе невозможна. При пропускании большего объема пробы через комбинированный сорбент наблюдали расщепление некоторых пиков и их ассиметричную форму, несмотря на то, что во всех случаях использовали соответствующие ловушки в термодесорбере. В случае комбинированного сорбента это может быть обусловлено неравномерной десорбцией соединений из-за разных эффективных температур десорбции для сорбентов, которые использовались при упаковке трубок. Наиболее стабильные результаты достигнуты в случае сорбента Тenax TA, который выбрали для проведения анализа.
Оптимальный сорбируемый объем устанавливали следующим образом: к пробоотборному пакету с помощью силиконового шланга последовательно подсоединяли 2 сорбционные трубки и прокачивали различные объемы пробы со скоростью 50 мл/мин. Показано, что концентрирование без потерь для всех аналитов, за исключением этанола, достигнуто при пропускании 0.5 л пробы. Изучено влияние скорости пропускания пробы 50, 100 и 200 мл/мин через сорбционные трубки на эффективность концентрирования. Установлено, что увеличение скорости пропускания пробы не приводит к появлению проскока по определяемым компонентам, оптимальна скорость аспирирования 200 мл/мин, которая позволила существенно ускорить процесс концентрирования.
Полученные результаты применили для анализа реальных проб выдыхаемого воздуха здоровых и больных добровольцев, а также холостой пробы воздуха помещений, в которых проходил пробоотбор. Для учета влияния окружающего воздуха площадь компонента в выдыхаемом воздухе рассчитывали, как разность площадей компонента в пробе и в окружающем воздухе. Типичные профили хроматограмм здорового и больного человека представлены на рис. 6.
Рис. 6.
Хроматограммы на колонке CP-Porabond-Q проб выдыхаемого воздуха, сконцентрированных в сорбционной трубке с сорбентом Tenax TA, больного раком легких (а) и здорового (б) добровольцев. Условия хроматографирования указаны в тексте.

Стоит отметить достаточно большую вариативность интенсивностей пиков компонентов, присутствующих в пробе, что может привести к большому числу ложноположительных результатов. Для повышения надежности и точности результатов полученные данные по здоровым и больным добровольцам обрабатывали статистически. Применение теста Колмогорова−Смирнова показалo, что распределение данных не подчиняется нормальному закону, поэтому результаты обрабатывали с применением непараметрического теста Манна–Уитни для выявления аналитов, площади пиков которых статистически значимо отличны в группах больных и здоровых людей. В табл. 3 указаны вещества, площади пиков которых статистически отличаются у больных и здоровых людей. Значимым считали результат, при котором p-уровень составлял менее 0.05.
Таблица 3.
Перечень потенциальных веществ-маркеров, площади которых статистически отличаются у здоровых и больных добровольцев
| Вещество | p-Уровень |
|---|---|
| Этанол | 0.002488 |
| Ацетонитрил | 0.000000 |
| Изопрен | 0.020108 |
| 1,4-Пентадиен | 0.013389 |
| Бутаналь | 0.000129 |
| Гексан | 0.010593 |
| Бензол | 0.000091 |
| Пентаналь | 0.000837 |
| Пентанол-1 | 0.000426 |
| Толуол | 0.000002 |
Повышение концентрации этанола в выдыхаемом воздухе при наличии онкологических заболеваний неоднократно отмечено в различных работах [25, 31, 32], однако его присутствие может быть обусловлено не только эндогенным фактором. Источниками этанола могут быть дезинфицирующие средства [26], зубная паста, конфеты и других пищевые продукты [29]. Кроме того, в данной работе установлено, что этанол слабо удерживается на сорбенте Tenax TA, и, следовательно, его нельзя использовать в качестве потенциального маркера. Присутствие ацетонитрила, 1,4-пентадиена, бензола и толуола в выдыхаемом воздухе в основном связывают с курением [26, 29], что, впрочем, не исключает возможности применения этих веществ при диагностике легочных онкологических заболеваний. Сведения об изменении концентрации изопрена в выдыхаемом воздухе в связи с онкологией весьма неоднозначны: в одном случае концентрации изопрена понижались [29], в других повышались [25, 32], что может говорить о наличии разнонаправленного тренда у больных и здоровых. Исходя из полученных нами данных, можно отметить тенденцию к повышенному содержанию изопрена в выдыхаемом воздухе больных раком. Таким образом, говорить о существовании неких уникальных веществ-маркеров, наличие которых можно использовать в условиях ранней диагностики рака легких, нельзя. Однако изучение изменения содержания различных эндогенных ЛОС с последующей статистической обработкой данных, вероятнее всего, можно применять для предварительного неинвазивного скрининга после получения достаточно большого массива экспериментальных данных, что позволит снизить число вероятных ложноположительных и ложноотрицательных результатов.
Исследования проводились в рамках выполнения проекта № 4.2612.2017/ПЧ Минобрнауки РФ и при финансовой поддержке РФФИ, проект № 18-33-20009 мол_а_вед, с использованием научного оборудования ЦКП “Эколого-аналитический центр” Кубанского госуниверситета, уникальный идентификатор RFMEFI59317X0008.
Список литературы
Miekisch W., Schubert J.K., Noeldge-Schomburg G.F.E. Diagnostic potential of breath analysis–focus on volatile organic compounds // Clin. Chim. Acta. 2004. V. 347. № 1–2. P. 25.
Pereira J., Porto-Figueira P., Cavaco C., Taunk K., Rapole S., Dhakne R., Nagarajaram H., Camara J.S. Breath analysis as a potential and non-invasive frontier in disease diagnosis: an overview // Metabolites. 2015. V. 5. № 1. P. 5.
Приказ Минздрава России от 18.12.2015 № 933н “О порядке проведения медицинского освидетельствования на состояние опьянения (алкогольного, наркотического или иного токсического)”.
Silkoff P.E., Carlson M., Bourke T., Katial R., Ogren E., Szefler S.J. The Aerocrine exhaled nitric oxide monitoring system NIOX is cleared by the US Food and Drug Administration for monitoring therapy in asthma // J. Allergy Clin. Immunol. 2004. V. 114. № 5. P. 1241.
Casellas F., Malagelada J.R. Applicability of short hydrogen breath test for screening of lactose malabsorption // Dig. Dis. Sci. 2003. V. 48. № 7. P. 1333.
Modak A.S. Stable isotope breath tests in clinical medicine: a review // J. Breath Res. 2007. V. 1. № 1. doi https://doi.org/10.1088/1752-7155/1/1/014003
Buszewski B., Kesy M., Ligor T., Amann A. Human exhaled air analytics: biomarkers of diseases // Biomed. Chromatogr. 2007. V. 21. № 6. P. 553.
Vereb H., Dietrich A. M., Alfeeli B., Agah M. The possibilities will take your breath away: breath analysis for assessing environmental exposure // Environ. Sci. Technol. 2011. V. 45. № 19. P. 8167.
Pleil J.D., Stiegel M.A., Fent K.W.D. Exploratory breath analyses for assessing toxic dermal exposures of firefighters during suppression of structural burns // J. Breath Res. 2014. V. 8. № 3. doi https://doi.org/10.1088/1752-7155/8/3/037107
Ligor T., Ligor M., Amann A., Ager C., Bachler M., Dzien A., Buszewski B. The analysis of healthy volunteers exhaled breath by the use of solid-phase microextraction and GC-MS // J. Breath Res. 2008. V. 2. № 4. doi https://doi.org/10.1088/1752-7155/2/4/046006
Zaric B., Petrovic S., Bjekic M., Rajic I., Popovic A., Dordevic D. Analysis of human exhaled breath in a population of young volunteers // Arch. Biol. Sci. 2014. V. 66. № 4. P. 1529.
Li W., Liu Y., Lu X., Huang Y., Liu Y., Cheng S., Duan Y. A cross-sectional study of breath acetone based on diabetic metabolic disorders // J. Breath Res. 2015. V. 9. № 1. doi https://doi.org/10.1088/1752-7155/9/1/016005
Zhou M.-G., Liu Y., Li W.-W., Yuan X., Zhan X.-F., Li J., Duan Y.-X., Liu Y., Gao Z.-H., Cheng Y., Cheng S.-H., Li H., Liang Y. Investigation and identification of breath acetone as a potential biomarker for type 2 diabetes diagnosis // Chin. Sci. Bull. 2014. V. 59. № 17. P. 1992.
Krilaviciute A., Heiss J.A., Leja M., Kupcinskas J., Haick H., Brenner H. Detection of cancer through exhaled breath: a systematic review // Oncotarget. 2015. V. 6. № 36. P. 38643.
Peng G., Hakim M., Broza Y.Y., Billan S., Abdah-Bortnyak R., Kuten A., Tisch U., Haick H. Detection of lung, breast, colorectal, and prostate cancers from exhaled breath using a single array of nanosensors // Br. J. Cancer. 2010. V. 103. № 4. P. 542.
Dent A.G., Sutedja T.G., Zimmerman P.V. Exhaled breath analysis for lung cancer // J. Thorac. Dis. 2013. V. 5. № 5. P. 540.
Saalberg, Y., Wolff M. VOC breath biomarkers in lung cancer // Clin. Chim. Acta. 2016. V. 459. № 1. P. 5.
Babgi R.H., Ross B.M. Breath analysis as a diagnostic tool for lung cancer // J. Biomed. Pharm. Res. 2017. V. 6. № 1. P. 71.
Zhou W., Huang C., Zou X., Lu Y., Shen C., Ding X., Wang H., Jiang H., Chu Y. Exhaled breath online measurement for cervical cancer patients and healthy subjects by proton transfer reaction mass spectrometry // Anal. Bioanal. Chem. 2017. V. 409. № 23. P. 5603.
Kumar S., Huang J., Abbassi-Ghadi N., Mackenzie H.A., Veselkov K.A., Hoare J.M., Lovat L.B., Spanel P., Smith D., Hanna G.B. Mass spectrometric analysis of exhaled breath for the identification of volatile organic compound biomarkers in esophageal and gastric adenocarcinoma // Ann. Surg. 2015. V. 262. № 6. P. 981.
Handa H., Usuba A., Maddula S., Baumbach J.I., Mineshita M., Miyazawa T. Exhaled breath analysis for lung cancer detection using ion mobility spectrometry // PloS ONE. 2014. V. 9. № 12. doi org/https://doi.org/10.1371/journal.pone.0114555
Mazzone P.J., Wang X.F., Xu Y., Mekhail T., Beukemann M.C., Na J., Kemling J.W., Suslick K.S., Sasidhar M. Exhaled breath analysis with a colorimetric sensor array for the identification and characterization of lung cancer // J. Thorac. Oncol. 2012. V. 7. № 1. P. 137.
Nardi-Agmon I., Abud-Hawa M., Liran O., Gai-Mor N., Ilouze M., Onn A., Bar J., Shlomi D., Haick H., Peled N. Exhaled breath analysis for monitoring response to treatment in advanced lung cancer // J. Thorac. Oncol. 2016. V. 11. № 6. P. 827.
Kahn N., Lavie O., Paz M., Segev Y., Haick H. Dynamic nanoparticle-based flexible sensors: diagnosis of ovarian carcinoma from exhaled breath // Nano Lett. 2015. V. 15. № 10. P. 7023.
Rudnicka J., Walczak M., Kowalkowski T., Jezierski T., Buszewski B. Determination of volatile organic compounds as potential markers of lung cancer by gas chromatography-mass spectrometry versus trained dogs // Sens. Actuators B. 2014. V. 202. P. 615.
Ligor T., Pater L., Buszewski B. Application of an artificial neural network model for selection of potential lung cancer biomarkers // J. Breath Res. 2015. V. 9. № 2. doi https://doi.org/10.1088/1752-7155/9/2/027106
Gennaro G., Dragonieri S., Longobardi F., Musti M., Stallone G., Trizio L., Tutino M. Chemical characterization of exhaled breath to differentiate between patients with malignant plueral mesothelioma from subjects with similar professional asbestos exposure // Anal. Bioanal. Chem. 2010. V. 398. № 7–8. P. 3043.
Filipiak W., Filipiak A., Sponring A., Schmid T., Zelger B., Ager C., Klodzinska E., Denz H., Pizzini A., Lucciarini P., Jamnig H., Troppmair J., Amann A. Comparative analyses of volatile organic compounds (VOCs) from patients, tumors and transformed cell lines for the validation of lung cancer-derived breath markers // J. Breath Res. 2014. V. 8. № 2. doi https://doi.org/10.1088/1752-7155/8/2/027111
Ligor M., Ligor T., Bajtarevic A., Ager C., Pienz M., Klieber M., Denz H., Fiegl M., Hilbe W., Weiss W., Lukas P., Jamnig H., Hackl M., Buszewski B., Miekisch W., Schubert J., Amann A. Determination of volatile organic compounds in exhaled breath of patients with lung cancer using solid phase microextraction and gas chromatography mass spectrometry // J. Clin. Chem. Lab. Med. 2009. V. 47. № 5. P. 550.
Poli D., Carbognani P., Corradi M., Goldoni M., Acampa O., Balbi B., Bianchi L., Rusca M., Mutti A. Exhaled volatile organic compounds in patients with non-small cell lung cancer: cross sectional and nested short-term follow-up study // Respir. Res. 2005. V. 6. № 1. P. 71.
Poli D., Goldoni M., Corradi M., Acampa O., Carbognani P., Internullo E., Casalini A., Mutti A. Determination of aldehydes in exhaled breath of patients with lung cancer by means of on-fiber-derivatisation SPME-GH/MS // J. Chromatogr. B. 2010. V. 878. № 27. P. 2643.
Ulanowska A., Kowalkowski T., Trawińska E., Buszewski B. The application of statistical methods using VOCs to identify patients with lung cancer // J. Breath Res. 2011. V. 5. № 4. doi https://doi.org/10.1088/1752-7155/5/4/046008
Li J., Peng Y., Liu Y., Li W., Jin Y., Tang Z., Duan Y. Investigation of potential breath biomarkers for the early diagnosis of breast cancer using gas chromatography–mass spectrometry // Clin. Chim. Acta. 2014. V. 436. P. 59.
Phillips M., Altorki N., Austin J.H., Cameron R.B., Cataneo R.N., Greenberg J., Kloss R., Maxfield R.A., Munawar M.I., Pass H.I., Rashid A., Rom W.N., Schmitt P. Prediction of lung cancer using volatile biomarkers in breath // Cancer Biomark. 2007. V. 3. № 2. P. 95.
Song G., Qin T., Liu H., Xu G.-B., Pan Y.-Y., Xiong F.-X., Gu K.-S., Sun G.-P., Chen Z.-D. Quantitative breath analysis of volatile organic compounds of lung cancer patients // Lung Cancer. 2010. V. 67. № 2. P. 227.
García-Gómez D., Martínez-Lozano Sinues P., Barrios-Collado C., Vidal-de-Miguel G., Gaugg M., Zenobi R. Identification of 2-alkenals, 4-hydroxy-2-alkenals, and 4-hydroxy-2,6-alkadienals in exhaled breath condensate by UHPLC-HRMS and in breath by real-time HRMS // Anal. Chem. 2015. V. 87. № 5. P. 3087.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


