Журнал аналитической химии, 2019, T. 74, № 9, стр. 668-672
Использование твердофазной экстракции для определения aicar в моче методом ультравысокоэффективной жидкостной хроматографии–тандемной масс-спектрометрии
Е. В. Дмитриева a, *, А. З. Темердашев a, А. А. Азарян a, Э. М. Гашимова a
a Кубанский государственный университет
350040 Краснодар, ул. Ставропольская, 149, Россия
* E-mail: catherine_dmitrieva@outlook.com
Поступила в редакцию 25.04.2018
После доработки 01.10.2018
Принята к публикации 06.03.2019
Аннотация
Предложена методика определения AICAR (5-аминоимидазол-4-карбоксамид-1-β-D-рибофуранозид, акадезин), являющегося агонистом АМФ-активируемой протеинкиназы и запрещенного Всемирным антидопинговым агентством в 2009 г., в моче, которая включает очистку проб от матричных компонентов твердофазной экстракцией и определение аналита методом ультравысокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием с нагреваемым источником ионизации электрораспылением. Из-за эндогенной природы AICAR для его определения и оценки матричных эффектов применяли метод стандартных добавок. Предел обнаружения составил 5 нг/мл, градуировочные зависимости линейны в диапазоне 50–5000 нг/мл. Предложенная методика апробирована на реальных образцах.
Малоподвижный образ жизни приводит к увеличению риска появления различных хронических заболеваний (сердечно-сосудистых, ожирения и диабета второго типа) [1]. Физическая активность, напротив, способствует предотвращению этих заболеваний. Некоторые болезни, включая заболевания позвоночника, метаболические и сердечно-сосудистые расстройства, приводят к невозможности регулярных занятий спортом [2]. В подобных случаях огромный интерес представляет разработка пероральных препаратов, способных имитировать благоприятные эффекты от занятий спортом [3].
Примером подобных препаратов является AI-CAR (схема 1 ), который часто называют “упражнениями в таблетке”. Этот препарат является синтетическим аналогом аденозинмонофосфата (АМФ), активирующего АМФ-активируемую протеинкиназу (АМФК). Последняя играет важную роль в клеточном энергетическом метаболизме [4], вследствие чего получила название “энергетического сенсора” или “регулятора метаболизма” [5]. Так, в скелетной мышечной ткани активация АМФК приводит к увеличенному поглощению глюкозы, повышенной чувствительности к инсулину и окислению жирных кислот; в печени – к усилению окисления жирных кислот и уменьшению образования глюкозы [6–8]. Установлено, что введение AICAR приводит к увеличению выносливости крыс с малоподвижным образом жизни даже без физических упражнений [3]. Все это делает AICAR объектом повышенного внимания спортсменов и, как следствие, привело к запрету Всемирным антидопинговым агентством (ВАДА) [9].
Схема 1 . Структурная формула AICAR.
Принимая во внимание эндогенную природу AICAR и, следовательно, его значительное содержание в моче, требуется разработка методик определения высоких концентраций данного аналита [10]. Методом жидкостной хромато-масс-спектрометрии было проанализировано 499 образцов мочи спортсменов, средняя концентрация эндогенного AICAR в моче человека составила 2186 ± 1655 нг/мл, причем гендерная принадлежность не влияет на содержание данного соединения [11]. Недостаточное разбавление образца мочи [10, 11] может привести к значительному матричному эффекту, а в случае отсутствия предколонки – к быстрому износу аналитической колонки. В связи с этим для определения данного аналита в биологических жидкостях применяли подход “разбавил и вколол” с использованием обращенно-фазовой [12, 13] и гидрофильной (HILIC) [14] хроматографии. Ввиду высокой полярности AICAR слабо удерживается в обращенно-фазовой ВЭЖХ по сравнению с HILIC, но в то же время обращенно-фазовые сорбенты шире распространены в допинг-контроле. Из-за потенциальных матричных эффектов, возникающих при использовании процедуры “разбавил и вколол”, для корректной оценки содержания AICAR рекомендуют использовать изотопно-меченный внутренний стандарт [15].
Для получения более “чистых” проб возможно применение твердофазной экстракции (ТФЭ) или фракционирования на жидкостном хроматографе. Так, ВЭЖХ использовали для очистки образцов мочи с последующим определением 3-триметилсилильных производных AICAR методом изотопной газовой хромато-масс-спектрометрии с предварительным сжиганием [16, 17]. Несмотря на то, что данная процедура очистки проб мочи эффективна, ее недостатками являются длительность и трудоемкость.
Цель настоящей работы – разработка экспрессного и эффективного способа очистки проб мочи от матричных компонентов для последующего определения AICAR методом ультравысокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием (УВЭЖХ–МС/МС).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и реагенты. Использовали стандартный образец AICAR (5-аминоимидазол-4-карбоксамид-1-β-D-рибофуранозид) (Shanghai Soyoung Biotech. Inc., Китай), ацетонитрил для ВЭЖХ−МС (Biosolve, Израиль), муравьиную кислоту (98%) (Acros Organics). Воду 18.2 МΩ получали с помощью системы Milli-Q. Для проведения ТФЭ использовали патроны Sep-Pak Aminopropyl (NH2) Plus Short Cartridge, масса сорбента 360 мг (Waters, Milford, Massachusetts, USA).
Приборы и оборудование. Использовали систему УВЭЖХ–МС/МС, включающую тройной квадрупольный масс-спектрометр Thermo TSQ Access Max (San-Jose, USA) с нагреваемым источником ионизации электрораспылением и жидкостный хроматограф Dionex Ultimate-3000, состоящий из дегазатора, бинарного градиентного насоса, автоматического дозатора, термостата и колонки Phenomenex Kinetex С18 (100 × 2.1 мм, 1.7 мкм).
Условия определения. Подвижная фаза состояла из 0.1%-ной муравьиной кислоты в воде (элюент А) и 0.1%-ной муравьиной кислоты в метаноле (элюент B), элюировали в изократическом режиме при соотношении элюентов А и B (95 : 5, по объему). Расход подвижной фазы составил 0.45 мл/мин, температура термостата 40°С. Общая продолжительность анализа 6 мин. Объем вводимой пробы 10 мкл. До и после ввода пробы иглу автоматического дозатора промывали смесью ацетонитрил–изопропанол–вода (50 : 30 : 20, по объему).
Ионизацию аналита проводили с использованием нагреваемого источника ионизации электрораспылением в режиме регистрации положительных ионов со следующими значениями параметров: температура испарителя 400°С, температура трансферного капилляра 320°С, напряжение на источнике ионизации 4 кВ, расход газа распылителя (азот) 60 усл. ед., расход вспомогательного газа (азот) 10 усл. ед.
Аналит определяли в режиме мониторинга выбранных реакций (MRM) посредством диссоциации иона-предшественника, индуцируемой соударением, (газ-мишень аргон, давление 1.5 мторр) и детектирования ионов-продуктов. Согласно рекомендациям [15] для надежного определения аналита необходимо детектировать как минимум два перехода ион-предшественник–ион-продукт (табл. 1).
Таблица 1.
Программа детектирования AICAR в режиме мониторинга выбранных реакций
| Ион-предшественник, m/z | Ион-продукт, m/z | Энергия соударений, эВ | Интенсивность иона-продукта, % | tR, мин | Напряжение на экстрагирующей линзе, В |
|---|---|---|---|---|---|
| 259.1 | 110.1 | 24 | 100 | 0.75 | 48 |
| 127.1 | 11 | 83 ± 5 |
Приготовление стандартных растворов. Стандартный раствор AICAR с концентрацией 200 мкг/мл готовили растворением навески вещества в воде, градуировочные растворы получали разбавлением стандартного раствора ацетонитрилом. Растворы контроля качества готовили независимо от градуировочных растворов. Полученные растворы хранили при 4°С не более месяца.
Подготовка проб к анализу. Перед ТФЭ проводили десятикратное разбавление образца мочи (200 мкл) ацетонитрилом. Патроны для ТФЭ кондиционировали 2 мл ацетонитрила и вводили образец со скоростью 0.5 мл/мин. Далее патрон промывали ацетонитрилом для удаления мешающих компонентов матрицы, сушили его в токе азота и элюировали аналит 1 мл воды. Элюат анализировали методом УВЭЖХ–МС/МС.
Построение градуировочных зависимостей. Для установления степени извлечения AICAR с патрона для ТФЭ готовили водные модельные растворы с концентрациями 5, 12.5, 25, 37.5, 50, 125, 250, 375, 500, 1000, 2500, 5000 нг/мл путем десятикратного разбавления градуировочных растворов.
Из-за отсутствия изотопно-меченного внутреннего стандарта применяли метод стандартных добавок: аликвоту (200 мкл) мочи разбавляли в 10 раз ацетонитрилом, содержащим 100 мкл градуировочного раствора AICAR и проводили процедуру ТФЭ. Растворы контроля качества низкой (125 нг/мл), средней (500 нг/мл) и высокой (2500 нг/мл) концентрации готовили в тех же условиях и анализировали 3 раза в течение одного дня. Кроме того, для оценки матричных эффектов и предела обнаружения в аналогичных условиях получали градуировочные зависимости, используя образцы воды вместо мочи.
Все градуировочные зависимости строили 6 раз с использованием разных образцов мочи, полученных от добровольцев (мужчин и женщин).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для достижения удовлетворительного удерживания аналита изучали колонки с октадецильной и фенил-гексильной неподвижной фазами (обе колонки Phenomenex Kinetex, 100 × 2.1 мм, 1.7 мкм, с соответствующими предколонками). Полярный AICAR слабо удерживался на обеих колонках. Для разработки методики выбрана более распространенная колонка с октадецильной фазой. В качестве подвижной фазы изучали системы 0.1%-ная муравьиная кислота в ацетонитриле–0.1%-ная муравьиная кислота в воде и 0.1%-ная муравьиная кислота в метаноле–0.1%-ная муравьиная кислота в воде. При применении последней системы AICAR лучше удерживался на сорбенте. Поскольку метод ТФЭ позволил получить пробы, лишенные большинства матричных компонентов, слабое удерживание аналита на колонке было приемлемым.
При оптимизации процедуры очистки образцов мочи от матричных компонентов исследовали несколько типов сорбентов для ТФЭ: Biotage Isolute SCX (100 мг, 1 мл, Biotage, Charlotte, USA), Biotage Isolute HAX (100 мг, 1 мл, Biotage, Charlotte, USA), Oasis HLB (60 мг, 3 мл, Waters, Milford, USA) и Sep-Pak Aminopropyl (NH2) Plus Short Cartridge (360 мг, Waters, Milford, Massachusetts, USA), используя процедуры экстракции, рекомендуемые производителями (данные не представлены). Наилучшие результаты были получены с использованием сорбента с аминопропильными группами. В оптимальных условиях, описанных ранее, степень извлечения аналита с патрона составила 81 (±12)%. Загрузка бóльшего объема образца с его меньшим разбавлением приводила к проскоку аналита.
Предел обнаружения находили экспериментально путем анализа водных градуировочных растворов, прошедших стадию ТФЭ. При концентрации AICAR 5 нг/мл соотношение сигнал/шум составило 3 : 1. Предел определения также оценивали по градуировочным зависимостям, при концентрации 50 нг/мл погрешность определения аналита составила менее 15%. Градуировочные зависимости линейны в диапазоне концентраций 50–5000 нг/мл, коэффициент корреляции составил 0.999. Селективность методики устанавливали сравнением времен удерживания, а также по интенсивностям образующихся ионов-продуктов при масс-спектрометрическом детектировании в режиме мониторинга заданных реакций в стандартном образце и образце мочи после ТФЭ. Перекрестное загрязнение оценивали путем анализа холостой пробы (воды) после раствора контроля качества с высокой концентрацией (2500 нг/мл) (рис. 1).
Рис. 1.
Оценка перекрестного загрязнения: (а) – раствор контроля качества высокой концентрации (2500 нг/мл), (б) – холостой раствор.
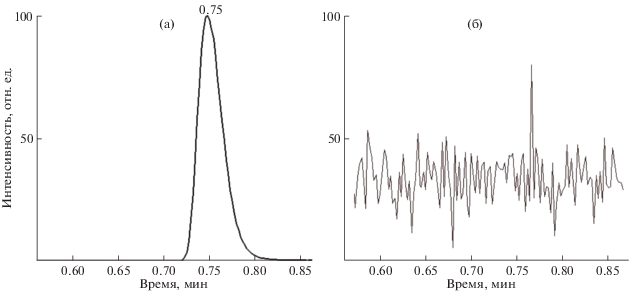
Матричные эффекты оценивали сопоставлением откликов аналита на разных уровнях концентраций, полученных при ТФЭ с использованием воды и образцов мочи с добавкой аналита. Их рассчитывали как отношение аналитического сигнала аналита в образце мочи (после пересчета с учетом содержания эндогенного AICAR) к аналитическому сигналу аналита, полученному в модельном растворе, и выражали в процентах. Матричные эффекты составили 89–102%, что указывает на незначительное влияние матричных компонентов на результаты количественного анализа.
Воспроизводимость (относительное стандартное отклонение) и правильность контролировали путем анализа растворов контроля качества низкой (125 нг/мл), средней (500 нг/мл) и высокой (2500 нг/мл) концентраций (табл. 2). Результат признавали удовлетворительным, если погрешность составляла менее 15% [18].
Таблица 2.
Результаты оценки правильности и воспроизводимости методики определения AICAR (n = 18)
| Введено, нг/мл | В один день | В разные дни | ||
|---|---|---|---|---|
| отн. погрешность, % | sr | отн. погрешность, % | sr | |
| 125 | 4.2 | 0.10 | 7.5 | 0.14 |
| 500 | 2.3 | 0.06 | 3.4 | 0.13 |
| 2500 | 1.4 | 0.05 | −3.1 | 0.09 |
Таким образом, использование ТФЭ позволяет эффективно очищать образцы мочи от матричных компонентов и определять AICAR в широком диапазоне концентраций с высокими точностью и надежностью.
Исследования проводили в рамках выполнения проекта № 4.2612.2017/ПЧ Минобрнауки РФ и при финансовой поддержке РФФИ, проект № 18-33-20009 мол_а_вед, с использованием научного оборудования ЦКП “Эколого-аналитический центр” Кубанского госуниверситета, уникальный идентификатор RFMEFI59317X0008.
Список литературы
Loef B., de Hollander E.L., Boot C.R.L., Proper K.I. Physical activity of workers with and without chronic diseases // Prev. Med. Rep. 2016. V. 3. P. 30.
Li S., Laher I. Exercise pills: At the starting line // Trends Pharmacol. Sci. 2015. V. 36. № 12. P. 906.
Narkar V.A., Downes M., Yu R.T., Embler E., Wang Y.X., Banayo E., Mihaylova M.M., Nelson M.C., Zou Y., Juguilon H., Kang H., Shaw R.J., Evans R.M. AMPK and PPARδ agonists are exercise mimetics // Cell. 2008. V. 134. № 3. P. 405.
Towler M.C., Hardie D.G. AMP-Activated protein kinase in metabolic control and insulin signaling // Circ. Res. 2007. V. 100. № 3. P. 328.
Pokrywka A., Cholbinski P., Kaliszewski P., Kowalczyk K., Konczak D., Zembron-Lacny A. Metabolic modulators of the exercise response: doping control analysis of an agonist of the peroxisome proliferator-activated receptor δ (GW501516) and 5-aminoimidazole-4-carboxamide ribonucleotide (AICAR) // J. Physiol. Pharmacol. 2014. V. 65. № 4. P. 469.
Musi N., Goodyear L.J. Targeting the AMP-activated protein kinase for the treatment of type 2 diabetes // Curr. Drug Targets Immune. Endocr. Metabol. Disord. 2002. V. 2. № 2. P. 119.
Viollet B., Mounier R., Leclerc J., Yazigi A., Foretz M., Andreelli F. Targeting AMP-activated protein kinase as a novel therapeutic approach for the treatment of metabolic disorders // Diabetes Metab. 2007. V. 33. № 6. P. 395.
Hardie D.G., Ross F.A., Hawley S.A. AMPK – a nutrient and energy sensor that maintains energy homeostasis // Nat. Rev. Mol. Cell. Biol. 2012. V. 13. № 4. P. 251.
World Anti-Doping Agency (2018). The World Anti-Doping Code. The 2018 Prohibited List. International Standard. https://www.wada-ama.org/sites/default/files/prohibited_list_2018_en.pdf (2018) (04.04.2018).
Guddat S., Solymos E., Orlovius A., Thomas A., Sigmund G., Geyer H., Thevis M., Schänzer W. High-throughput screening for various classes of doping agents using a new ‘dilute-and-shoot’ liquid chromatography-tandem mass spectrometry multi-target approach // Drug Test. Anal. 2011. V. 3. № 11–12. P. 836.
Thomas A., Beuck S., Eickhoff J.C., Guddat S., Krug O., Kamber M., Schänzer W., Thevis M. Quantification of urinary AICAR concentrations as a matter of doping controls // Anal. Bioanal. Chem. 2010. V. 396. № 8. P. 2899.
Kwok W.H., Choi T.L.S., Kwok K.Y., Chan G.H.M., Wong J.K.Y., Wan T.S.M. Doping control analysis of 46 polar drugs in horse plasma and urine using a ‘dilute-and-shoot’ ultra-high performance liquid chromatography-high resolution mass spectrometry approach // J. Chromatogr. A. 2016. V. 1451. P. 41.
Wong J.K.Y., Kwok W.H., Chan G.H.M., Choi T.L.S., Ho E.N.M., Jaubert M., Bailly-Chouriberry L., Bonnaire Y., Cawley A., Ming Williams H., Keledjian J., Brooks L., Chambers A., Lin Y., Wan T.S.M. Doping control study of AICAR in post-race urine and plasma samples from horses // Drug Test. Anal. 2017. V. 9. № 9. P. 1363.
Görgens C., Guddat S., Orlovius A.K., Sigmund G., Thomas A., Thevis M., Schänzer W. “Dilute-and-inject” multi-target screening assay for highly polar doping agents using hydrophilic interaction liquid chromatography high resolution/high accuracy mass spectrometry for sports drug testing // Anal. Bioanal. Chem. 2015. V. 407. № 18. P. 5365.
WADA Technical Document – TD2015IDCR, https://www.wada-ama.org/sites/default/files/resources/files/td2015idcr_-_eng.pdf (2018) (04.04.2018).
Buisson C., Frelat C., Mongongu C., Martinat N., Audran M. Implementation of AICAR analysis by GC-C-IRMS for anti-doping purposes // Drug Test. Anal. 2017. V. 9. № 11–12. P. 1704.
Piper T., Thomas A., Baume N., Sobolevsky T., Saugy M., Rodchenkov G., Schänzer W., Thevis M. Determination of 13C/12C ratios of endogenous urinary 5-aminoimidazole-4-carboxamide 1β-D-ribofuranoside (AICAR) // Rapid Commun. Mass Spectrom. 2014. V. 28. № 11. P. 1194.
FDA. Guidance for Industry: Bioanalytical Method Validation. US Department of Health and Human Services, Food and Drug Administration (FDA), Rockville, USA. https://www.fda.gov/downloads/drugs/guidances/ucm070107.Pdf (2018) (27.09.2018).
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии



