Журнал аналитической химии, 2019, T. 74, № 9-app, стр. 5-12
Синтез и применение тонких пленок полимеров с молекулярными отпечатками сальбутамола в пьезоэлектрических сенсорах
Т. Н. Ермолаева a, *, О. В. Фарафонова a, **, О. И. Бессонов a
a Липецкий государственный технический университет
398055 Липецк, ул. Московская, стр. 30, Россия
* E-mail: ermolaeva@stu.lipetsk.ru
** E-mail: farafonova.ov@mail.ru
Поступила в редакцию 26.04.2018
После доработки 16.03.2019
Принята к публикации 16.03.2019
Аннотация
Методом фотополимеризации с применением метакриловой кислоты и этиленгликольдиметакрилата в качестве функционального и кросс-мономеров синтезированы тонкопленочные молекулярно импринтированные сальбутамолом покрытия пьезоэлектрических сенсоров. Показано влияние концентрации сальбутамола, функционального и кросс-мономеров в предполимеризационной смеси на концентрацию поверхностных молекулярных отпечатков и устойчивость слоя полимера с молекулярными отпечатками. Оптимизированы условия синтеза полимерных слоев непосредственно на поверхности электрода сенсора. Рассчитаны аналитические характеристики сенсора для определения сальбутамола в водных растворах.
Одной из главных задач при разработке современных биосенсоров, предназначенных для работы в жидких средах, является выбор распознающего материала, имеющего сопоставимые с природными рецепторами характеристики. Наиболее часто применяемые в пьезоэлектрических сенсорах элементы распознавания, такие как антитела, антигены, иммуноглобулины и аптамеры, обладают высокой специфичностью и позволяют получать информацию о биохимической реакции практически в режиме реального времени. Однако их неустойчивость при хранении, воздействии органических растворителей и высоких концентраций электролитов, а также сложность получения стимулирует поиски “синтетических” антител, в качестве которых могут выступать полимеры с молекулярными отпечатками (ПМО), имеющие ряд несомненных достоинств по сравнению с природными рецепторами [1–6].
Значительное внимание к ПМО объясняется их уникальными свойствами обеспечивать высокую селективность молекулярного распознавания одних целевых молекул в присутствии других соединений близкого строения. Полимеры с молекулярными отпечатками устойчивы в агрессивных средах и при резком изменении pH, давления и температуры, могут быть синтезированы фактически для любого вещества и даже супертоксикантов, для которых, например, поликлональные антитела получить нельзя. Наиболее подробно изучен способ блочной полимеризации ПМО [7, 8]. Полученные полимеры после предварительного измельчения и фракционирования обрабатывают подходящим растворителем или смешивают с поливинилхлоридом и наносят в виде тонкого слоя на поверхность электрода сенсора [9]. Такой прием весьма трудоемок, длителен и характеризуется невысокой воспроизводимостью параметров сенсора. Отпечатанные места разнородны, и поэтому такие частицы проявляют сродство к молекулам близкого строения и демонстрируют невысокую селективность.
Более перспективно получение импринтированных полимерных пленок непосредственно на поверхности электрода, в частности, методом фотополимеризации [10–21]. Данный способ отличается простотой исполнения, малым расходом реактивов и высокой селективностью по сравнению с аналогичными покрытиями. Синтез пленок ПМО методом фотополимеризация осуществляют непосредственно на поверхности сенсора при воздействии УФ-излучения на смесь мономеров и темплата, в качестве которого выступает определяемое соединение. Однако проблемы синтеза полимерных пленок на поверхности сенсоров до сих пор остаются ключевыми в ПМО-технологии [2, 22], в частности, неспецифическое связывание определяемого соединения с пленкой ПМО или существенное снижение связывающей способности, проблемы ограниченной диффузии, приводящие к увеличению продолжительности взаимодействия аналитов с ПМО и, следовательно, регистрации аналитического сигнала. Известно, что ПМО получают ковалентным, нековалентным или металл-ион-медиаторным способами при поперечном сшивании реагентов [7, 8]. В то же время нековалентный синтез имеет важнейшее преимущество, позволяющее осуществлять быстрое и обратимое взаимодействие между полимером и темплатом.
Цель настоящей работы – оптимизация условий нековалентного синтеза специфичного распознающего покрытия пьезоэлектрического сенсора на основе пленок ПМО, полученных методом фотополимеризации, и применение пьезоэлектрического сенсора для определения сальбутамола в жидких средах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и оборудование. Применяли следующие реагенты: в качестве функционального мономера – метакриловую кислоту, МАК (Sigma-Aldrich, Великобритания); кросс-мономера – этиленгликольдиметакрилат, (Вектон, Россия); инициатора полимеризации – азобисизобутиронитрил, АИБН (Лабтех, Россия); темплата – сальбутамол (Sigma-Aldrich, Великобритания). Для исследования перекрестного реагирования сенсора использовали рактопамина гидрохлорид (Sigma-Aldrich, Великобритания), кленбутерола гидрохлорид (Abcam, Великобритания), пенициллин G (Биохимик, Россия). Растворители: ацетонитрил (Вектон, Россия), конц. CH3COOH (База № 1 химреактивов, Россия), тетрагидрофуран (Sigma-Aldrich, Великобритания), этиловый спирт х. ч. (ОАО “Метафракс”, Россия).
При синтезе импринтированного полимера применяли 0.1 М раствор сальбутамола, полученный растворением 23.9 мг сальбутамола в 1 мл смеси ацетонитрил–уксусная кислота–тетрагидрофуран (8.1 : 1.75 : 0.15, по объему). Для повторного встраивания в пленки ПМО применяли водный раствор сальбутамола с концентрацией 526 мкг/мл (раствор 1). Для построения градуировочной зависимости использовали растворы с концентрациями сальбутамола 350.7, 263, 131.5, 52.6, 26.3 мкг/мл, полученные разбавлением более концентрированного раствора бидистиллированной водой.
В качестве сенсоров применяли пьезокварцевые резонаторы с собственной частотой колебаний АТ-среза 10 МГц, 8 мм в диаметре с золотыми электродами диаметром 5 мм на двух сторонах (ЭТНА, Россия).
Для изучения закономерностей процесса полимеризации и свойств импринтированного полимера использовали данные, полученные методами пьезокварцевого микровзвешивания и инфракрасной спектроскопии (ИК-спектрометр Shimadzu Iraffinity-1, Япония).
Синтез полимера с молекулярными отпечатками методом фотополимеризации. К раствору сальбутамола (0, 0.5, 10, 15, 20 мкл) добавляли функциональный мономер (0.35, 0.43, 0.51, 0.60, 0.69 мкл), полученную смесь обрабатывали ультразвуком в течение 1 мин. Спустя 30 мин вводили кросс-мономер (3.85, 5.77, 7.70 мг), обрабатывали ультразвуком (ультразвуковая ванна ПСБ – 2835-03 (ПСБ – Галс, Россия) в течение 1 мин, после чего вносили 0.035 г инициатора полимеризации АИБН. Предполимеризационную смесь обрабатывали ультразвуком в течение 3 мин и 10 мкл полученной смеси дозировали на поверхность очищенного сенсора, помещали кристалл под УФ-лампу (газоразрядная дуговая ртутная лампа высокого давления мощностью 250 Ватт) на один час.
Для удаления молекул темплата с поверхности пленки ПМО сенсор погружали в 75 мл регенерирующего раствора (экстрагента) и выдерживали в течение фиксированного времени при постоянном перемешивании. Затем сенсор высушивали в потоке теплого воздуха до постоянной массы. В качестве регенерирующего раствора применяли водный раствор уксусной кислоты и этилового спирта.
Неимпринтированные полимерные пленки (НИП) синтезировали по аналогичной методике без введения сальбутамола в состав предполимеризационной смеси.
Характеристика пленок полимера с молекулярными отпечатками методом пьезокварцевого микровзвешивания. В качестве аналитического сигнала использовали изменение частоты колебаний сенсора при изменении массы распознающего слоя, который регистрировали после высушивания сенсора в потоке воздуха до и после формирования пленки ПМО, удаления и повторного встраивания молекул сальбутамола. Аналитический сигнал измеряли при комнатной температуре (25 ± 5°C) на воздухе после высушивания сенсора до постоянной массы на установке [23] на основе генератора колебаний Б5-30 и цифрового модуля Discope (Бафика, Россия), а также персонального компьютера.
Качество распознающего слоя ПМО контролировали методом пьезокварцевого микровзвешивания. Массу полимерного покрытия сенсора m рассчитывали по уравнению Зауэрбрея: ΔF = –2.3 × 106$F_{0}^{2}$m/S, где S – площадь электрода пьезокварцевого сенсора (0.10066 см2); F0 – базовая частота резонатора, Гц; ∆F = F1– F2, Гц, где F1, F2 – частоты колебаний сенсора до и после синтеза пленок ПМО.
Аналитический сигнал ПМО-сенсора измеряли относительно сенсора с НИП, что позволило исключить вклад неспецифической сорбции на поверхности сенсора: ∆Fан = ∆FПМО – ∆FНИП (Гц), где ∆FПМО и ∆FНИП рассчитывали как разность частот колебаний сенсора до и после контакта ПМО или НИП с раствором аналита. Массу извлеченного (ΔmПМО) и повторно встроенного сальбутамола рассчитывали по разности между массой пленки полимера до и после экстракции темплата.
Концентрацию поверхностных отпечатков темплата на поверхности ПМО (Rmax) и отпечатков после регенерации поверхности (R') рассчитывали как: R = mВС/(SМSlb), мкмоль/см2, где mВС – масса удаленных молекул темплата, мкг; МSlb – молекулярная масса сальбутамола (239.31 г/моль).
Кроме того, рассчитали концентрационную чувствительность сенсора, показывающую изменение частоты колебаний ПМО-сенсора при контакте с раствором сальбутамола с концентрацией 1 мкг/мл: Sc = ΔF '/сSlb (Гц мл/мкг), где ΔF ' – разница частот до и после встраивания молекул сальбутамола, Гц; сSlb –концентрация сальбутамола, мкг/мл.
Селективность пленок ПМО оценивали по коэффициентам перекрестного взаимодействия: CR, % = ΔFмеш/ΔFSlb, где ΔFSlb, ΔFмеш – аналитические сигналы ПМО-сенсора в растворе аналита и мешающего вещества соответственно.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
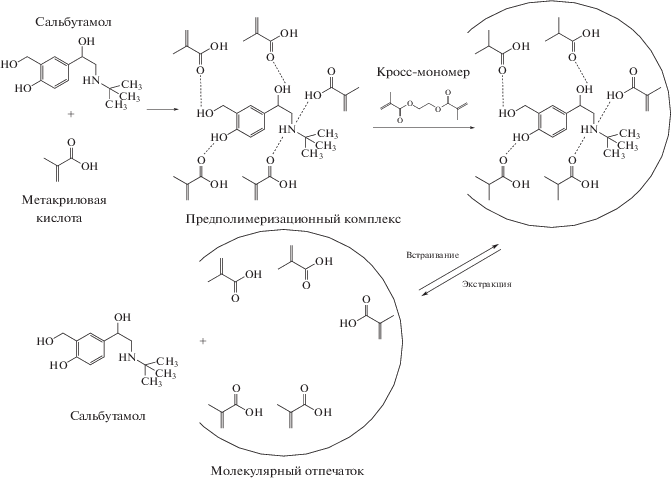
Для создания пленочного покрытия пьезоэлектрического сенсора на основе ПМО необходимо учитывать в первую очередь состав полимеризационной смеси и строение молекулы темплата. Множественность, сила и характер нековалентных взаимодействий между темплатом и функциональным мономером и стабильность предполимеризационного комплекса определяют аффинность ПМО [24, 25] и селективность последующего распознавания молекул темплата [26].
В качестве теплата при синтезе пленок ПМО непосредственно на поверхности электрода сенсора использовали сальбутамол, активный ингредиент лекарств для лечения астмы. Так как он способен не только увеличивать общую энергию при кардионагрузках, но и изменять механизм получения этой энергии за счет сжигания жира, сальбутамол отнесен к запрещенным в спорте препаратам. Всемирное антидопинговое агентство установило верхний порог его присутствия в организме атлета на уровне 1000 нг/мл.
Поскольку молярное соотношение между шаблоном, функциональным и кросс-мономерами при синтезе существенно влияет на количество поверхностных отпечатков и массу сальбутамола, сорбируемого ПМО, исследовали влияние на свойства импринтированного полимера состава полимеризационной смеси.
Влияние концентрации сальбутамола на свойства полимера с молекулярными отпечатками. Количество темплата в предполимеризационной смеси существенно влияет как на структуру и устойчивость покрытия, так и на количество отпечатков и, следовательно, на аналитический сигнал сенсора. Рассматривали составы полимеризационной смеси, отличающиеся мольным соотношение темплата, функционального и кросс-мономеров nt : nf : nk (табл. 1), для установления оптимального содержания каждого компонента. Так, увеличение мольной доли сальбутамола в полимеризационной смеси от 0.5 до 1.5 при постоянном мольном соотношении функционального и кросс-мономеров 4 : 20 приводит к росту количества поверхностных молекулярных отпечатков. Дальнейшее увеличение концентрации темплата негативно сказывается на свойствах пленки ПМО – полимер № 4 медленно разрушается под действием анализируемого раствора, что указывает на избыточное количество молекул темплата по отношению к функциональному мономеру, связывающему темплат в предполимеризационный комплекс. Это в итоге приводит к появлению в объеме полимера множества включений, не связанных с матрицей. Из-за этого при воздействии анализируемого и регенерующего растворов происходит деструкция распознающего покрытия. Следует также отметить, что избыточное количество темплата уменьшает скорость полимеризации за счет воздействия на стадию роста цепи, т.е. на взаимодействие свободных радикалов с мономерами.
Таблица 1.
Влияние состава полимеризационной смеси на характеристики пленочных слоев полимеров с молекулярными отпечатками сальбутамола
| Полимер | nt : nf : nk | ΔmВС1, мкг | R, мкмоль/см2 | ΔmВС2, мкг | R', мкмоль/см2 |
|---|---|---|---|---|---|
| № 1 | 0.5 : 4 : 20 | 0.0513 | 0.0021 | 0.0486 | 0.0020 |
| № 2 | 1 : 4 : 20 | 0.1238 | 0.0051 | 0.1009 | 0.0042 |
| № 3 | 1.5 : 4 : 20 | 0.1491 | 0.0062 | 0.0143 | 0.0006 |
| № 4 | 2 : 4 : 20 | –0.1080 | – | –0.014 | – |
| № 5 | 1 : 5 : 20 | 0.5861 | 0.0243 | 0.5392 | 0.0224 |
| № 6 | 1 : 6 : 20 | 1.0748 | 0.0446 | 0.9888 | 0.0411 |
| № 7 | 1 : 7 : 20 | 0.4013 | 0.0166 | 0.3751 | 0.0156 |
| № 8 | 1 : 8 : 20 | 0.1942 | 0.0081 | 0.1766 | 0.0073 |
| № 9 | 1 : 6 : 30 | 0.4442 | 0.0184 | 0.3972 | 0.0165 |
| № 10 | 1 : 6 : 40 | 0.3381 | 0.0140 | 0.2904 | 0.0121 |
При повышении концентрации темплата в полимерах № 1–3 одновременно с увеличением числа поверхностных отпечатков снижается устойчивость слоя ПМО. Так, полимер № 1 при повторном связывании “теряет” 5.3% “сайтов” связывания, № 2 – 10.4%, № 3 – 90.4%. В связи с этим оптимальное соотношение сальбутамол–мономеры не должно превышать 1 : 24, поскольку с помощью сенсора на основе полимера № 3 можно проводить только однократные измерения.
Влияние концентрации функционального мономера на свойства полимера с молекулярными отпечатками. Выбор в качестве функционального мономера метакриловой кислоты объясняется ее способностью к образованию водородных или координационных связей с молекулами темплата родственной структуры [27, 28], что главным образом определяет сорбционные свойства импринтированного покрытия. При создании импринтированного покрытия важным аспектом является оптимизация количества функционального мономера в полимеризационной смеси.
Концентрация и мольное соотношение кросс-мономера и темплата в полимерных смесях № 1, 5–8 оставалось постоянным, в то время как концентрацию функционального мономера в ходе эксперимента увеличивали в 2 раза (табл. 1). Небольшое количество функционального мономера способствуют образованию слабо взаимодействующих с темплатом “сайтов’ связывания, а увеличение концентрации сопровождается ростом отклика сенсора (полимеры № 5, 6). В то же время избыточное количество функционального мономера приводит к упрочнению его связей с темплатом, вследствие чего снижается эффективность удаления молекул последнего из полимерного слоя и лишь небольшая часть “сайтов” распознавания становится доступной для повторного связывания (полимеры № 7, 8).
Ухудшение характеристик импринтированных сальбутамолом покрытий сенсора при увеличении концентрации функционального мономера также, на наш взгляд, связано с гомополимеризацией метакриловой кислоты (часть метакриловой кислоты сополимеризуется, что приводит к уменьшению количества водородных связей и энергии взаимодействия полимер–темплат) и инклюзией “сайтов” связывания в объем полимерной матрицы, что существенно снижает их доступность.
Влияние концентрации кросс-мономера. Свойства импринтированного слоя существенно зависят от природы и количества кросс-мономера в полимеризационной смеси. За счет образования высоко сшитого полимерного каркаса из кросс-мономера достигается механическая и химическая устойчивость покрытия. Кроме того, полимерная матрица способствует формированию устойчивой трехмерной структуры “сайтов” импринтинга, за счет которых и осуществляется молекулярное распознавание. В связи с этим кросс-реагент сильно влияет на селективность и связывающую способность ПМО. В качестве кросс-мономера выбрали этиленгликольдиметакрилат, наиболее часто применяемый при синтезе ПМО на основе МАК.
Исследовали полимерные смеси № 6, 9, 10 (содержание в них темплата и функционального мономера постоянно, а содержание кросс-мономера увеличивалось) с целью выявления более стойкого покрытия с максимальной концентрацией поверхностных отпечатков. Увеличение концентрации кросс-мономера (табл. 1) приводит к уменьшению массы сорбируемого сальбутамола от 1.7048 до 0.3381 мкг, что может быть связано либо с “разбавлением” количества поверхностных отпечатков кросс-мономером, либо с их инклюзией в объем полиэтиленгликольдиметакрилата. Увеличение концентрации кросс-мономера не приводит к увеличению устойчивости покрытия, которая практическио постоянна для полимеров № 9 и 10. Таким образом, оптимальный состав соответствует полимерному покрытию с мольным соотношением nтемплат : nфункц. мономер : nкросс-мономер = = 1 : 6 : 20, характеризующемуся максимальной устойчивостью и относительно высокой концентрацией первичных поверхностных отпечатков 0.0446 мкмоль/см2.
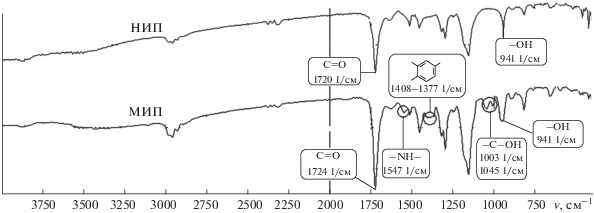
Изучение структуры полимера с молекулярными отпечатками сальбутамола методом ИК-спектроскопии. Для выявления связей, образующихся между ПМО и темплатом и установления функциональных групп, отвечающих за данное взаимодействие, сравнили ИК-спектры полимера с молекулярными отпечатками сальбутамола и неимпринтированного полимера. Смещение пика карбонильных групп в коротковолновую область на спектре ПМО (рис. 1) с 1720 до 1724 см–1, а также уширение пиков гидроксильных групп (941 см–1) свидетельствуют об их участии в образовании водородных связей с молекулой сальбутамола при формировании предполимеризационного комплекса (рис. 2).
Следует отметить, что присутствие полосы спиртовой группы –С–ОН (1003–1045 см–1) у ПМО сальбутамола и ее отсутствие в спектре НИП подтверждает наличие сальбутамола в полимерной матрице, а уширение линии на спектре ПМО говорит о ее участии в образовании водородных связей с функциональным мономером (рис. 2). Кроме того, только в ИК-спектре ПМО имеются линии –NH– (1547 см–1) и 1,2,4-замещенной ароматической группы (1408–1377 см–1), которые характерны для сальбутамола.
При полимеризации в присутствии кросс-мономера карбоксильные группы функционального мономера фиксируются полимерной матрицей в определенную трехмерную структуру. Таким образом, после экстракции темплата образуются “сайты” распознавания – полости, комплементарные молекулам темплата, которые впоследствии и отвечают за сорбцию аналита из раствора.
Характеристика пьезоэлектрического сенсора на основе пленок полимера с молекулярными отпечатками сальбутамола. Для создания условий многократного применения пьезоэлектрического сенсора на основе ПМО для определения сальбутамола необходимо выбрать состав регененирующего раствора, который должен хорошо растворять темплат и не оказывать деструктурирующего влияния на полимерную матрицу, обеспечивать удаление темплата с поверхности ПМО с высокой скоростью, не изменяя конфигурацию молекулярных отпечатков. Исследовали три раствора уксусной кислоты и этанола в воде при следующих объемных соотношениях уксусная кислота–этанол–вода: 6 : 36 : 10 (1), 1 : 6 : 10 (2), 1 : 6 : 100 (3). При использовании раствора (1) масса полимерного покрытия уменьшалась вплоть до его полного растворения; в случае раствора (2) сальбутамол удалялся только в первые 2 мин, а далее пленка начинала набухать и связывать воду, что приводило к деформации структуры молекулярных отпечатков. И только при применении раствора (3) отмечены удовлетворительные результаты как при удалении, так и при повторном встраивании молекул сальбутамола: на протяжении 4 мин происходит полное удаление темплата и за 3 мин максимальное встраивание в структуру ПМО молекул сальбутамола.
Характеристики пьезоэлектрического сенсора на основе пленок ПМО, приведенные в табл. 2, свидетельствуют о возможности его применения для определения сальбутамола в жидких средах: градуировочная функция для определения сальбутамола линейна в достаточно широком интервале концентраций 26–526 мкг/мл, предел обнаружения составляет 9.6 мкг/мл.
Таблица 2.
Характеристики пьезокварцевого сенсора на основе пленок полимера с молекулярными отпечатками сальбутамола (n = 5, Р = 0.95)
| Характеристика | Значение |
|---|---|
| Уравнение градуировочной функции | ΔF = 3.7с + 316 |
| Линейный диапазон функции, мкг/мл | 26–526 |
| Коэффициент корреляции | 0.95 |
| Предел обнаружения, мкг/мл | 9.6 |
| Sc, Гц мл/мкг | 3.7 |
| mПМО, мкг | 4 ± 1 (sr = 0.1) |
| ΔmВС max, мкг | 1.1 ± 0.4 (sr = 0.14) |
| Rmax, мкмоль/см2 | 0.05 ± 0.02 (sr = 0.14) |
| ΔmВС2, мкг | 1.0 ± 0.3 (sr = 0.14) |
| R ', мкмоль/см2 | 0.04 ± 0.01 (sr = 0.14) |
| ΔFПМО/ΔFНИП | 11 ± 3 (sr = 0.1) |
Сопоставление значений массы первоначально встроенного в структуру ПМО сальбутамола ($\Delta {{m}_{{{\text{В }}{{{\text{С }}}_{{{\text{max}}}}}}}}$) и повторно встроенной массы аналита ($\Delta {{m}_{{{\text{В }}{{{\text{С }}}_{2}}}}}$) показало незначительные отличия этих величин, что свидетельствует о стабильности и одинаковой доступности поверхностных отпечатков на пленке ПМО после регенерации сайтов молекулярного распознавания. Кроме того, сохраняются близкие значения поверхностной концентрации молекулярных отпечатков Rmax и R'. Устойчивость распознающего слоя сохраняется в пяти и более циклах измерений, аналитический сигнал не изменяется более чем на 5%. Толщина пленки ПМО составляла 180 ± 20 нм.
Концентрационная чувствительность (Sc = = 3.8, Гц мл/мкг) соответствует величине сигнала сенсора, приходящейся на единицу концентрации, и значению коэффициента чувствительности градуировочной функции.
Величина импринтинг фактора, рассчитанная как отношение аналитического сигнала сенсора на основе импринтированного и неимпринтированного полимеров ΔFПМО : ΔFНИП и позволяющая оценить вклад в аналитический сигнал сенсора специфических и неспецифических взаимодействий, составляет 11 ± 3, что превышает аналогичную величину для полимеров, полученных другими способами [29].
Селективность сенсора с полимером с молекулярными отпечатками оценивали с помощью коэффициента кросс-реактивности СR, % Установлено, что значения СR, % существенно зависят от структуры родственных соединений (табл. 3). В формулах веществ в табл. 3 выделены фрагменты молекул, за счет которых осуществляется сорбция пленками ПМО.
Таблица 3.
Оценка селективности определения сальбутамола с помощью ПМО-сенсоров с полимером с молекулярными отпечатками (концентрация соединений 52.6 мкг/мл)
| Аналит | Структурная формула | СR, % |
|---|---|---|
| Сальбутамол (Slb) |  |
100 |
| Рактопамин (Rac) |  |
10.9 |
| Кленбутерол (Сlb) |  |
14.4 |
| Пенициллин G (Pen G) |  |
2.31 |
| Цефотаксим |  |
3.04 |
Отмечена более высокая кросс-реактивность ПМО сальбутамола к бета-агонистам кленбутеролу и рактопамину, поэтому синтезированное покрытие ПМО можно использовать для селективного обнаружения сальбутамола в пробе только в присутствии одинаковых или более низких концентраций этих соединений. Селективность сенсора по отношению к лекарственным препаратам других классов (пенициллин, цефотаксин) достаточно высока, что позволяет определять сальбутамол в присутствии более высоких концентраций этих соединений.
* * *
Таким образом, можно заключить, что пьезоэлектрические сенсоры на основе ПМО, синтезированные методом фотополимеризации, позволяют с высокими чувствительностью и селективностью определять сальбутамол в жидких средах.
Исследования выполнены при финансовой поддержке РФФИ (грант 13-03-97505-р_центр_а) “Селективность и эффективность молекулярного распознавания и определения гормонов и бэта-агонистов с помощью пьезокварцевого иммуно- и биомиметического сенсора”.
Список литературы
Piletsky S., Turner A. Molecular Imprinting of Polymers. Georgetown, Texas: Landes Bioscience, 2006. P. 208.
Ye L., Haupt K. Molecularly imprinted polymers as antibody and receptor mimics for assays, sensors and drug discovery // Anal. Bioanal. Chem. 2004. V. 378. P. 1887.
Dickert F.L., Lieberzeit P., Tortschanoff M. Molecular imprints as artificial antibodies–a new generation of chemical sensors // Sens. Actuators B. 2000. V. 65. P. 186.
Haupt K., Mosbach K. Molecularly imprinted polymers and their use in biomimetic sensors // Chem. Rev. 2000. V. 100. № 7. P. 2495.
Ермолаева Т.Н., Чернышова В.Н., Чеснокова Е.В., Бессонов О.И. Пьезокварцевые сенсоры на основе полимеров с молекулярными отпечатками – формирование распознающего слоя на поверхности электрода сенсора // Сорбционные и хроматографические процессы. 2015. Т. 15. № 2. С. 151.
Ермолаева Т.Н., Чернышова В.Н., Бессонов О.И. Микро- и наночастицы полимеров с молекулярными отпечатками – синтез, характеристика и применение в пьезокварцевых сенсорах // Сорбционные и хроматографические процессы. 2015. Т. 15. № 3. С. 345.
Wulff G. Molecular imprinting in cross-linked materials with the aid of molecular templates–a way towards artificial antibodies // Angew. Chem. Int. Ed. Engl. 1995. V. 34. P. 1812.
Mosbach K. Molecular imprinting // Trends Biochem. Sci. 1994. V. 19. P. 9.
Yaqub S., Latif U., Dickert F.L. Plastic antibodies as chemical sensor material for atrazine detection // Sens. Actuators B. 2011. V. 160. P. 227.
Gültekin A., Karanfil G., Sönmezoğlu S., Say R. Development of a highly sensitive MIP based-QCM nanosensor for selective determination of cholic acid level in body fluids // Mater. Sci. Eng. C. 2014. V. 42. P. 436.
Wu A.H., Syu M.J. Synthesis of bilirubin imprinted polymer thin film for the continuous detection of bilirubin in an MIP/QCM/FIA system// Biosens. Bioelectron. 2006. V. 21. P. 2345.
Tsuru N., Kikuchi M., Kawaguchi H., Shiratori S. A quartz crystal microbalance sensor coated with MIP for “Bisphenol A” and its properties al // Thin Solid Films. 2006. V. 499. P. 380.
Shoji R., Takeuchi T., Kubo I. Atrazine sensor based on molecularly imprinted polymer-modified gold electrode // Anal. Chem. 2003. V. 75. № 18. P. 4882.
Panasyuk-Delaney T., Mirsky V.M., Wolfbeis O.S. Capacitive creatinine sensor based on a photografted molecularly imprinted polymer // Electroanalysis. 2002. V. 14. P. 221.
Lotierzo M., Henry O.Y.F., Piletsky S.A., Tothill I. Surface plasmon resonance sensor for domoic acid based on grafted imprinted polymer // Biosens. Bioelectron. 2005. V. 20. № 11. P. 2197.
Kubo I., Yokota N., Fuchiwaki Y., Nakane Y. Characteristics of molecularly imprinted polymer thin layer for bisphenol a and response of the MIP-modified sensor // Mater. Sci. 2012. P. 6.
Peeters M. Molecularly imprinted polymers (Mips) for bioanalytical sensors: strategies for incorporation of mips into sensing platforms // Austin J. Biosens. Bioelectron. 2015. V. 1. № 3. P. 1011.
Kikuchi M., Tsuru N., Shiratori S. Recognition of terpenes using molecular imprinted polymer coated quartz crystal microbalance in air phase // Sci. Technol. Adv. Mater. 2006. V. 7. P. 156.
Dickert F.L., Hayden O., Bindeus R. Bioimprinted QCM sensors for virus detection–screening of plant sap // Anal. Bioanal. Chem. 2004. V. 378. № 8. P. 1929.
Fuchs Y., Soppera O., Haup K. Photopolymerization and photostructuring of molecularly imprinted polymers for sensor applications–A review // Anal. Chim. Acta. 2012. V. 717. P. 7.
Avila M., Zougagh M., Rios A. Molecularly imprinted polymers for selective piezoelectric sensing of small molecules // Trends Anal. Chem. 2008. V. 27. № 1. P. 54.
Karaseva N., Ermolaeva T., Mizaikoff B. Piezoelectric sensors using molecularly imprinted nanospheres for the detection of antibiotics // Sens. Actuators B. 2016. V. 225. P. 199.
Haupt K. Molecularly imprinted polymers in analytical chemistry // Analyst. 2001. V. 126. P. 747.
Koohpaei A.R., Shahtaheri S.J., Ganjali M.R. Molecular imprinted solid phase extraction for determination of atrazine in environmental samples // Talanta. 2008. V. 75. P. 978.
Lenain P., De Saeger S., Mattiasson B., Hedström M. Affinity sensor based on immobilized molecular imprinted synthetic recognition elements // Biosens. Bioelectron. 2015. V. 69. P. 34.
Adali-Kaya Z., Tse Sum Bui B., Falcimaigne-Cordin A., Haupt K. Molecularly imprinted polymer nanomaterials and nanocomposites: atom-transfer radical polymerization with acidic monomers // Angew. Chem. Int. Ed. 2015. V. 54. P. 1.
Shi X., Wu A., Qu G., Li R., Zhang D. Development and characterisation of molecularly imprinted polymers based on methacrylic acid for selective recognition of drugs // Biomaterials. 2007. V. 28. P. 3741.
Кудринская В.А., Дмитриенко С.Г., Золотов Ю.А. Синтез и исследование сорбционных свойства полимеров с молекулярными отпечатками кверцетина // Вестн. Моск. ун-та. Сер. 2. Химия. 2009. Т. 50. № 9. С. 156.
Зяблов А.Н., Хальзова С.А., Селеменев В.Ф. Сорбция красных пищевых красителей полимерами с молекулярными отпечатками // Изв. вузов. Химия и хим. технология. 2017. Т. 60. № 7. С. 42.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии