Журнал аналитической химии, 2020, T. 75, № 1, стр. 31-42
Магнитная твердофазная экстракция и флуориметрическое определение некоторых фторхинолонов
О. Р. Егунова a, И. С. Решетникова a, К. О. Казимирова a, С. Н. Штыков a, *
a Саратовский национальный исследовательский государственный
университет им. Н.Г. Чернышевского, Институт химии
410012 Саратов, ул. Астраханская, 83, корп. 1, Россия
* E-mail: shtykovsn@mail.ru
Поступила в редакцию 24.08.2018
После доработки 08.12.2018
Принята к публикации 16.06.2019
Аннотация
Предложен подход к оценке содержания фторхинолонов, основанный на их сорбции и концентрировании магнитной твердофазной экстракцией на наночастицах магнетита, модифицированных катионами бромида цетилтриметиламмония (ЦТАБ) или катионным полиэлектролитом полиэтиленимином (ПЭИ), и флуориметрическом определении указанных лекарственных препаратов. Найдены оптимальные условия модификации наночастиц магнетита катионами ПЭИ, ЦТАБ. На примере энрофлоксацина, левофлоксацина и пефлоксацина выявлены закономерности их сорбции и концентрирования на модифицированных наночастицах магнетита. Апробированы методики флуориметрического определения энрофлоксацина и левофлоксацина в речной воде, плазмозаменяющем средстве и ветеринарных препаратах.
Фторхинолоны − синтетические антибиотики с широким спектром антимикробного действия по отношению как к грамположительным, так и к грамотрицательным бактериям и внутриклеточным возбудителям [1]. Высокая биодоступность и эффективность действия обусловили широкое применение фторхинолонов в клинической и ветеринарной практике. Их используют в пероральной и парентеральной лекарственных формах. Рост резистентности бактерий к фторхинолонам во многих странах является основной причиной необходимости контроля их содержания в воде и продуктах питания [2–6]. Низкие концентрации фторхинолонов необходимо определять также и при исследовании их фармакокинетики и фармакодинамики в биообъектах [7, 8].
В связи со сложным составом объектов анализа и малым содержанием фторхинолонов перед определением их отделяют от матрицы и разделяют методом жидкостной хроматографии в сочетании с масс-спектрометрическим [2–4], фотодиодным [5] или флуоресцентным [9] детекторами. При пробоподготовке для разделения и концентрирования применяют также методы QuEChERS [5], жидкостную микроэкстракцию [10] и твердофазную экстракцию [3, 4, 8]. Высокочувствительное и достаточно избирательное определение фтор-хинолонов обеспечивает применение флуоресцентного поляризационного иммуноанализа [6] и сенсибилизированной флуоресценции тербия(III) в присутствии мицелл поверхностно-активных веществ (ПАВ) [11, 12].
Перспективным вариантом твердофазной экстракции является магнитная твердофазная экстракция (МТФЭ), основанная на использовании суперпарамагнетизма магнитных наночастиц (МНЧ), среди которых наиболее часто применяют наночастицы магнетита [13, 14]. В химическом анализе МНЧ выполняют две основные функции: сорбционного концентрирования, и, что наиболее важно, быстрого отделения сорбента от жидкой матрицы с помощью внешнего магнитного поля. Магнитную твердофазную экстракцию применяют для определения антибиотиков тетрациклинового ряда [15, 16], сульфаниламидов [17, 18], 4-нонилфенола [19], пестицидов [20], фенолов и тяжелых металлов [21], а также в биоанализе [22–25]. Более полный перечень определяемых веществ, для концентрирования которых применяли метод МТФЭ, приведен в обзорах [13, 14, 26].
Магнитные наночастицы, как и другие наночастицы, вследствие высокого соотношения числа молекул на поверхности к их числу в объеме, обладают высокоразвитой энергетически активной поверхностью [27]. Негативным результатом этого является быстрое межчастичное взаимодействие МНЧ, их укрупнение и последующая агрегация в растворе. В связи с этим при получении МНЧ их поверхность одновременно стабилизируют. Для этого наночастицы покрывают защитной неорганической или органической оболочкой, препятствующей их окислению и агрегации при сохранении их однодоменности и суперпарамагнитных свойств. Часто стадию стабилизации совмещают со стадией модификации поверхности МНЧ, что позволяет в дальнейшем увеличивать селективность и эффективность сорбции аналитов [13, 14].
В публикациях, посвященных сорбции фтор-хинолонов методом МТФЭ, для модификации поверхности МНЧ применяли самые разнообразные вещества. Так, для концентрирования фтор-хинолонов в пробах природных вод поверхность магнетита модифицировали додецилсульфатом натрия и антибиотики далее определяли методом ВЭЖХ с УФ-детектором [28]. Для концентрирования и определения налидиксовой, оксалиновой кислот и флюмеквина в образцах мяса методом ультра-ВЭЖХ с флуориметрическим детектированием наночастицы магнетита модифицировали полиэтиленгликолем с включенными в полимер ионами Eu(III) и Tb(III) [29]. Семь представителей фторхинолонов концентрировали на магнетите, модифицированном сополимером 4-винилфенилборной кислоты и дивинилбензола, и затем определяли в природных водах методом ВЭЖХ с фотодиодным детектором [30]. Сочетание МНЧ, покрытых полидиметилсилоксаном с сорбированными многостенными углеродными нанотрубками, использовали для концентрирования офлоксацина, норфлоксацина, ципрофлоксацина и энрофлоксацина с последующим определением в минеральной воде и меде методом жидкостной хроматографии с УФ-детектированием [31].
В других работах для улучшения селективности определения фторхинолонов в природных водах методом ВЭЖХ-МС [2] и в молоке методом ВЭЖХ-УФ [32, 33] применяли метод молекулярного импринтинга с ципрофлоксацином [2], энрофлоксацином [32] и специальным коммерческим материалом в качестве темплатов [33]. Для модификации МНЧ использовали сшитую метакриловую кислоту [2], объемный мезопористый полисилоксан [32] и коммерческий SupelMIPTM [33]. Таким образом, для модификации поверхности магнетита в зависимости от природы фторхинолона и объекта анализа применяли самые разнообразные соединения, в основном анионного или неионного характера.
Ранее для концентрирования энрофлоксацина на наночастицах магнетита нами предложены катионные и дикатионные ПАВ [34], а также катионный полиэлектролит полиэтиленимин [35].
Цель работы состояла в сравнительном изучении сорбции и десорбции трех представителей 6‑фторхинолонов на наночастицах магнетита, модифицированных катионным ПАВ – цетилтриметиламмоний бромидом и полиэлектролитом ПЭИ, и в разработке методик сорбционно-флуориметрического определения этих препаратов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Аппаратура. Деионированную воду получали на установке водоочистки УВОИ–“М-Ф” (Медиана-Фильтр, Россия), ультразвуковую (УЗ) обработку проводили в ванне 1.3 л ТТЦ (Сапфир, Москва), механическое перемешивание растворов осуществляли на орбитальном шейкере с аналоговым управлением ELMI S-3.02 (ЭЛМИ, Латвия) и с помощью магнитной мешалки MINI MR STANDARD (IKA WERKE, Германия). Для магнитной сепарации наночастиц магнетита использовали постоянный магнит Nd–Fe–B с (ВН)макс = = 40 МГсЭ. Спектры флуоресценции получали на спектрофлуориметре Cary Eclipse (Agilent Technologies, США), ширина дифракционной щели возбуждения 10 нм, флуоресценции 5 нм. Размеры наночастиц измеряли на просвечивающем электронном микроскопе Libra 120 Carl Zeiss (Германия), анализаторе Zetasizer Nano-Z (Malvern Instruments Ltd., Великобритания), позволяющем измерять и дзета-потенциал наночастиц.
Реактивы. Для получения наночастиц магнетита методом соосаждения использовали FeCl2 ⋅ 4H2O, FeCl3 ⋅ 6H2O (99.8%, Aldrich), NaOH (99.8%, Fluka), азот (ГОСТ 9293-74). Для модификации их поверхности применяли ЦТАБ (99%, Acros Organics), 50%-ный раствор ПЭИ (60 кDa, Aldrich). Объектами исследования являлись антибиотики фторхинолонового ряда энрофлоксацин, левофлоксацин, пефлоксацин (99%, ICN Biomedicals Inc.). Использовали также TbCl3 · 6H2O, (99.9%, Acros Organics), додецилсульфат натрия (ДДС), (98%, AMRESCO, Biotechnology Grade), аммиак водный ч. д. а. (ГОСТ 3760-79, 25%-ный раствор), CH3COOH ч. д. а. (ГОСТ 61-75), C2H5OH ректификационный (ГОСТ 5962-67). Универсальная буферная смесь содержала необходимые соотношения фосфорной, уксусной и борной кислот. Объектами анализа являлись ГЕОПЛАЗМА БАЛАНС (раствор для инфузий 3%-ный, FRESENIUS KABI, Deutschland GmbH, содержащий 30 г/л желатина, 5.382 г/л хлорида натрия, 0.305 г/л гексагидрата хлорида магния, 0.373 г/л хлорида калия, 3.36 г/л лактата натрия), а также ветеринарные препараты “Лексофлон” и “Энронит” (ООО “Нита-Фарм”, Саратов, Россия). При оценке десорбции использовали 1 M раствор NaOH, водный 9.8 × 10–3 М раствор ДДС, ацетон, бутанол-2, этанол, хлороформ, диметилформамид, диметилсульфоксид, ацетонитрил и смеси ацетонитрил–ацетон (50 : 50, по объему), ацетонитрил–этанол (50 : 50, по объему), а также смеси ацетона и этанола с уксусной кислотой. Количественные результаты получали при десорбции фторхинолонов с сорбента МНЧ@ЦТАБ смесями ацетон–уксусная кислота (9 : 1, по объему) или этанол–уксусная кислота (9 : 1, по объему), которые использовали в дальнейшем.
Степень извлечения (R, %) при сорбции антибиотиков рассчитывали по формуле:
где с0 – концентрация определяемого соединения в исходном растворе до сорбции, с – концентрация в растворе после сорбции.Коэффициент концентрирования при извлечении из различных объемов водных растворов рассчитывали по формуле:
где m1 – масса анализируемого раствора, равная его объему, при условии, что плотность раствора равна единице, г; m2 – масса сорбента, г; R – степень извлечения.Перечень и некоторые физико-химические свойства исследованных фторхинолонов представлены в табл. 1 .
Методика определения энрофлоксацина и левофлоксацина в речной воде. Навеску сорбента ~18 мг, модифицированного ЦТАБ, помещали в мерную колбу емк. 50 мл, содержащую пробу исследуемой воды, в которую предварительно добавляли 0.1 М НСl до pH 3.2 ± 0.1, вводили аликвотную часть раствора антибиотика и помещали в УЗ-ванну на 20 мин. Далее сорбент отделяли от раствора магнитной сепарацией, промывали 1 раз деионированной водой, добавляли 4 мл смеси ацетон–уксусная кислота (9 : 1) и обрабатывали в УЗ-ванне в течение 20 мин. Отделяли сорбент с помощью постоянного магнита, отбирали надосадочную жидкость, упаривали ее на водяной бане досуха, добавляли 2 мл ацетатно-аммиачного буферного раствора с pH 3.2 и измеряли интенсивность флуоресценции раствора (λвозб = 282 нм, λфл = 450 нм). Количество антибиотика в пробе находили с помощью градуировочной зависимости.
Методика определения энрофлоксацина в плазме крови. В пластиковую пробирку вносили 1 мл коллоидного раствора, содержащего 3 мг магнетита, модифицированного ЦТАБ, аликвотную часть раствора, содержащую несколько микрограммов энрофлоксацина, и плазмозаменяющее средство, с pH, предварительно доведенным добавлением 0.1 M HCl до 3.2 ± 0.1. Общий объем раствора составил 4 мл. Далее сорбент отделяли с помощью постоянного магнита, промывали деионированной водой, добавляли 2 мл смеси ацетон–уксусная кислота (9 : 1) и перемешивали на шейкере в течение 20 мин. Затем надосадочную жидкость отделяли с помощью магнита, упаривали ее на водяной бане досуха, добавляли 4 мл ацетатно-аммиачного буферного раствора с pH 3.2 ± 0.1 и измеряли интенсивность флуоресценции при λвозб = 282 нм, λфл = 450 нм. Количество антибиотика в плазме находили с помощью градуировочной зависимости.
Определение энрофлоксацина в препарате “Энронит”. 1 мл жидкого ветеринарного препарата отбирали в мерную колбу емк. 25 мл и разбавляли до метки деионированной водой (концентрация ЭФ составляла ~0.01 М), затем приготовленный раствор разбавляли еще в 100 раз. Аликвотную часть этого раствора вносили в пробирку, содержащую 3 мг коллоидного магнетита, модифицированного ЦТАБ, добавляли ацетатно-аммиачный буферный раствор с pH 3.2 до общего объема 4 мл и перемешивали на шейкере в течение 15 мин. Далее отделяли сорбент от маточного раствора с помощью постоянного магнита, промывали его дистиллированной водой и отделяли надосадочную жидкость. К осадку добавляли 2 мл смеси ацетон−уксусная кислота (9 : 1), перемешивали на шейкере в течение 20 мин, отделяли сорбент магнитом, отбирали надосадочную жидкость, упаривали ее на водяной бане, добавляли 4 мл ацетатно-аммиачного буферного раствора с pH 3.2 и измеряли интенсивность флуоресценции (λвозб = 282 нм, λфл = 450 нм). Количество ЭФ в ветеринарном препарате определяли с помощью градуировочной зависимости.
Определение левофлоксацина в препарате “Лексофлон”. Аликвотную часть ветеринарного препарата переносили в мерную колбу емк. 25 мл и разбавляли деионированной водой до метки. Концентрация левофлоксацина в растворе составляла ~0.01 М. Далее действовали аналогично методике определения ЭФ в препарате “Энронит”. Измеряли интенсивность флуоресценции (λвозб = 292 нм, λфл = 546 нм) и по уравнению градуировочной зависимости находили количество ЛФ, содержащееся в ветеринарном препарате.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В связи с низкой агрегативной устойчивостью наномагнетита и неэффективной сорбцией фторхинолонов поверхность МНЧ после синтеза модифицировали катионами ЦТАБ или ПЭИ.
Синтез наночастиц магнетита и их модификация полиэтиленимином и бромидом цетилтриметиламмония. Наночастицы магнетита получали методом химического cоосаждения из смешанного раствора солей железа(II, III) с мольным соотношением 1 : 2 в щелочной среде (рН 9−14) в атмосфере азота при 40°С и скорости перемешивания 1800 об./мин согласно [34, 35] по реакции:
Полученные наночастицы отделяли от надосадочной жидкости постоянным магнитом, два раза промывали дистиллированной водой и модифицировали смешиванием нестабилизированной магнитной жидкости с раствором ЦТАБ [34] или ПЭИ [35], получая структуру типа ядро–оболочка (рис. 1).
Рис. 1.
Модель наночастицы магнетита, модифицированной полиэтиленимином, с сорбированной молекулой фторхинолона.
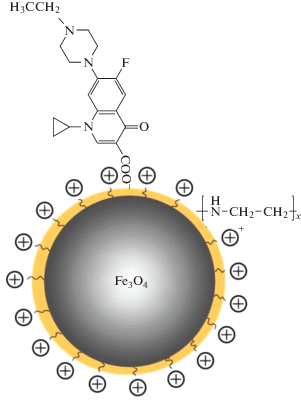
Выбор катионных модификаторов обусловлен двумя факторами. Во-первых, поверхность синтезированных наночастиц вследствие частичной диссоциации поверхностных ОН-групп имеет отрицательный заряд, поэтому может электростатически взаимодействовать с катионами ЦТАБ или поликатионом ПЭИ, образуя при избытке катионных центров положительно заряженную оболочку. Во-вторых, карбоксильная группа фторхинолонов в интервале рН 6 ± 1 ионизована, поэтому анион антибиотика сорбируется на положительно заряженной модифицированной поверхности оболочки МНЧ за счет электростатических, а также гидрофобных взаимодействий с неполярными частями ЦТАБ или ПЭИ.
Для модификации поверхности катионным полиэлектролитом нестабилизированные МНЧ магнетита массой ~450 мг помещали в коническую колбу емк. 250 мл, добавляли 13.5 мл раствора ПЭИ с концентрацией 20 мг/мл и перемешивали на шейкере 15 мин. Полученный черный осадок модифицированных наночастиц магнетита осаждали с помощью постоянного магнита и сливали надосадочную жидкость. К осадку при перемешивании добавляли 150 мл деионированной воды и снова перемешивали в течение 5–7 мин. Процедуру промывания повторяли три раза. Полученный материал модифицированных МНЧ помещали в пластиковую пробирку и сохраняли при комнатной температуре. Размеры наночастиц модифицированного магнетита оценивали методом просвечивающей электронной микроскопии. Из рис. 2 видно, что наночастицы магнетита, покрытые полиэтиленимином (Fe3O4@ПЭИ), имеют сферическую форму размером 10 ± 2 нм и агрегированы в более крупные структуры. Наблюдаемое на микрофотографиях светлое “гало” наночастиц свидетельствует о формировании на их поверхности оболочки ПЭИ толщиной 1.0 ± 0.1 нм.
Рис. 2.
Микрофотография модифицированных полиэтиленимином наночастиц магнетита, полученная методом просвечивающей электронной микроскопии (298 К, сПЭИ = 0.03 мМ).

Установлено, что ζ-потенциал покрытых ПЭИ наночастиц максимален при рН 3−4 и при рН 3.2 составляет +35 мВ (рис. 3). Полученный результат соответствует данным работы [39], в которой показано, что, несмотря на достаточно высокую основность аминогрупп, их протонирование в молекуле полиэлектролита продолжается и в кислой среде, когда при рН 3 еще около 18% аминогрупп ПЭИ остаются непротонированными из-за электростатического отталкивания образовавшихся ранее катионных центров –${\text{NH}}_{3}^{ + }.$
Рис. 3.
Влияние рН на ζ-потенциал наночастиц магнетита, модифицированного полиэтиленимином (tсорб = 20 мин, 298 K, cЭФ = 2.5 × 10-6 М, mсорбента = = 1.5 мг в 4 мл раствора).

При модификации наномагнетита катионным ПАВ полученную магнитную жидкость смешивали с раствором ЦТАБ (0.06 М), создавая в итоге концентрацию ПАВ 0.005 М [34] и получали частицы Fe3O4@ЦТАБ типа ядро−оболочка. Согласно данным просвечивающей электронной микроскопии, приведенным на рис. 4, наночастицы имеют сферическую форму со средним диаметром 8 ± 2 нм и толщиной оболочки 1.0 ± 0.1 нм и также агрегированы в более крупные структуры.
Рис. 4.
Микрофотография наночастиц магнетита, покрытых бромидом цетилтриметиламмония (25°C, сЦТАБ = 0.005 М).

Показано, что ζ-потенциал наночастиц Fe3O4@ЦТАБ также максимален в кислой среде и при рН 3.2 составляет +43 мВ [35]. Следовательно, эта величина pH должна обеспечивать наилучшую стабильность дисперсии магнетита и наибольшую сорбцию антибиотиков фторхинолонового ряда.
Сорбция на магнитных наночастицах, модифицированных полиэтиленимином. Вследствие близких кислотно-основных свойств фторхинолонов (см. табл. 1), условия сорбции оценивали на примере энрофлоксацина. При выборе условий сорбции ЭФ, в молекуле которого (табл. 1) имеется карбоксильная группа, варьировали pH, время перемешивания и массу модифицированного магнитного сорбента. Результаты влияния рН и времени сорбции представлены в табл. 2.
Таблица 1.
Перечень и некоторые физико-химические свойства фторхинолонов
| Соединение | Формула | Мол. масса | рКа1 | рКа2 |
|---|---|---|---|---|
| Энрофлоксацин (ЭФ) |  |
359.4 | 5.94 ± 0.091 | 8.70 ± 0.441 |
| Левофлоксацин (ЛФ) |  |
361.4 | 5.70−6.052 | 7.90−8.222 |
| Пефлоксацин |  |
333.4 | 6.21 ± 0.123 | 7.87 ± 0.103 |
Таблица 2.
Влияние рН раствора и времени контакта на степень извлечения (%) энрофлоксацина наночастицами магнетита, покрытыми полиэтиленимином (298 K, cЭФ = 2.5 × 10–6 М, mсорбента = 1.5 мг, общий объем 4 мл, n = 3, Р = 0.95)
| pH | Время, мин | ||||
|---|---|---|---|---|---|
| 2 | 5 | 10 | 15 | 20 | |
| 3.2 | 70 ± 1 | 81 ± 3 | 87 ± 3 | 90 ± 4 | 90 ± 3 |
| 4.1 | 69 ± 2 | 83 ± 2 | 84 ± 4 | 86 ± 5 | 86 ± 4 |
| 5.0 | 68 ± 1 | 70 ± 2 | 73 ± 5 | 78 ± 3 | 78 ± 4 |
| 6.1 | 63 ± 3 | 63 ± 2 | 67 ± 4 | 70 ± 4 | 71 ± 5 |
| 7.0 | 50 ± 1 | 56 ± 2 | 59 ± 1 | 60 ± 2 | 59 ± 3 |
| 8.2 | 48 ± 2 | 55 ± 1 | 57 ± 3 | 58 ± 1 | 57 ± 3 |
| 9.0 | 46 ± 1 | 52 ± 2 | 54 ± 2 | 57 ± 2 | 57 ± 3 |
| 10.3 | 45 ± 2 | 50 ± 4 | 52 ± 1 | 56 ± 1 | 57 ± 2 |
Влияние рН, на первый взгляд, несколько необычно, поскольку величина рКa карбоксильной группы, участвующей в образовании цикла с водородной связью, близка к 6 (см. табл. 1), а сорбция максимальна при рН 3−4. Этот факт можно объяснить, если принять во внимание, что заряженные макромолекулы полиэлектролитов, сорбированных на твердой поверхности, могут на несколько порядков увеличивать значение константы ионизации (уменьшать величину рК) кислотных групп взаимодействующих с ними реагентов [40–42]. В связи с этим карбоксильная группа ЭФ начинает диссоциировать, по-видимому, уже при рН 3−4. Отметим, что молекулы ЭФ при данной кислотности являются цвиттер-ионами, поскольку в условиях диссоциации карбоксильной группы атом азота фторхинолона протонирован, что, по-видимому, может объяснить применение авторами работ [2, 28, 30] полиэлектролитов с отрицательным зарядом для модификации поверхности наномагнетита.
Из рис. 3 также видно, что по мере увеличения рН и уменьшения положительного заряда поверхности Fe3O4@ПЭИ степень извлечения ЭФ закономерно уменьшается, оставаясь, однако, достаточно высокой. С одной стороны, это можно объяснить тем, что даже при рН 9 около 3% аминогрупп ПЭИ остаются протонированными [39] (а ζ-потенциал – положительным, см. рис. 3), а с другой, − участием в сорбции антибиотика водородной связи между его ОН-группами и аминогруппами ПЭИ, а также гидрофобным взаимодействием.
Из табл. 2 следует, что степень извлечения ЭФ во всем интервале рН быстро достигает 70%, затем медленно возрастает до 90% в течение 15 мин и далее практически не изменяется. Следовательно, оптимум для сорбции составляет 15 мин.
Влияние количества сорбента Fe3O4@ПЭИ на степень извлечения антибиотика изучали в диапазоне масс МНЧ в растворе магнитной жидкости 0.86–5.16 мг. Использовали 4 мл раствора ЭФ с концентрацией 2.5 × 10–6 М. Установлено, что уже при массе 1.5 мг сорбируется около 90%, 3 мг – 96%, а 5.2 мг – 98% ЭФ (рис. 5). Далее в экспериментах с общим объемом раствора 4 мл использовали 3 мг модифицированного сорбента.
Рис. 5.
Зависимость степени извлечения энрофлоксацина от массы сорбента Fe3O4@ПЭИ (298 K, рН 3.2, время сорбции 15 мин, cисх = 2.5 × 10–6 М в 4 мл раствора).

Удельную адсорбцию при построении изотермы адсорбции рассчитывали по формуле:
где a – удельная адсорбция, моль/г; с0 и с – соответственно исходная и равновесная концентрации соединений в растворе, М; V – объем анализируемого раствора, л; m – масса навески сорбента, г.Из рис. 6 видно, что зависимость количества адсорбата от его концентрации в растворе имеет вид изотермы Ленгмюра. Крутой восходящий фронт полученной изотермы свидетельствует о хемосорбционном и (или) ионообменном характере взаимодействия антибиотика с поверхностью модифицированного магнетита. Зависимость с/a(у) от с(х) прямопропорциональна и описывается уравнением y = 0.0921x + 0.015 (r = = 0.998). Изотерма сорбции свидетельствует о высоком сродстве наночастиц Fe3O4@ПЭИ к фтор-хинолону.
Рис. 6.
Изотерма сорбции энрофлоксацина на Fe3O4@ПЭИ (298 K, рН 3.2, время сорбции 15 мин, mсорбента = 3 мг в 4 мл раствора).

Сорбция на магнитных наночастицах, модифицированных бромидом цетилтриметиламмония. Энрофлоксацин сорбировали из ацетатно-аммиачного буферного раствора с pH 3.2, используя в качестве сорбента 3 мг Fe3O4@ЦТАБ в 4 мл раствора и осуществляя десорбцию смесями ацетон–уксусная кислота (9 : 1) и этанол–уксусная кислота (9 : 1). Эффективность извлечения антибиотика определяли флуориметрическим методом по его остаточной концентрации в растворе после отделения МНЧ. Установлено, что при десорбции в течение 15 мин 2 мл смесей ацетон–уксусная кислота (9 : 1) и этанол–уксусная кислота (9 : 1) степень десорбции составила 94 ± 3 и 70 ± 4%. Таким образом, 2 мл смеси ацетон–уксусная кислота (9 : 1) десорбирует антибиотик количественно, а смесь этанол–уксусная кислота (9 : 1) – только на 70%. Обе смеси оказались неэффективными для десорбции фторхинолонов с поверхности МНЧ Fe3O4@ПЭИ. В связи с этим при разработке методик определения фторхинолонов использовали МНЧ, модифицированные ЦТАБ.
Определение энрофлоксацина и левофлоксацина в воде р. Волга. Сорбцию и концентрирование антибиотиков выполняли, используя 18 мг сорбента Fe3O4@ЦТАБ. Степень извлечения каждого антибиотика из 50 мл при рН 3.2−3.3 составляла 97 ± 2%, а коэффициент концентрирования (2.5−2.7) × 103. Близкие условия сорбции и десорбции свидетельствуют о возможности определения суммы энро- и левофлоксацина. Из-за слабой собственной флуоресценции пефлоксацин определяли по сенсибилизированной флуоресценции тербия [43].
Метрологические характеристики определения антибиотиков без концентрирования и с концентрированием на МНЧ из 50 мл пробы представлены в табл. 3. Применение концентрирования, как это следует из табл. 3, позволяет в 50 раз уменьшить нижнюю границу определяемых содержаний и более чем в 20 раз снизить пределы обнаружения (cmin) энрофлоксацина и левофлоксацина. Таким образом, применение концентрирования на модифицированном ЦТАБ магнетите позволяет определять более чем на порядок меньшие количества антибиотиков.
Таблица 3.
Метрологические характеристики определения антибиотиков без концентрирования и при концентрировании на магнитных наночастицах (объем пробы 50 мл)
| Условия | Диапазон определяемых содержаний, М | R2 | Уравнение градуировочной зависимости | cmin × 108 М* |
|---|---|---|---|---|
| Энрофлоксацин | ||||
| Без концентрирования | 1 × 10–7−8 × 10–6 | 0.9987 | y = −(0.807 ± 0.006)x + (6.93 ± 0.08) | 3.9 |
| С концентрированием | 2 × 10–9−1 × 10–7 | 0.9970 | y = −(0.668 ± 0.009)x + (7.09 ± 0.05) | 0.16 |
| Левофлоксацин | ||||
| Без концентрирования | 1 × 10–7−8 × 10–6 | 0.9998 | y = −(0.873 ± 0.003)x + (7.30 ± 0.05) | 4.2 |
| С концентрированием | 2 × 10–9 −1 × 10–7 | 0.9962 | y = −(0.591 ± 0.008)x + (6.57 ± 0.07) | 0.17 |
В качестве модельных растворов для определения следовых количеств энрофлоксацина и левофлоксацина с применением сорбционного концентрирования использовали пробы воды р. Волга. Значения введенного и найденного количеств энрофлоксацина и левофлоксацина приведены в табл. 4.
Таблица 4.
Результаты (нг) определения энрофлоксацина и левофлоксацина в речной воде (сорбционное концентрирование на магнетите, объем 50 мл, 298 K, mсорбента = 18 мг, рН 3.2, n = 3, P = 0.95)
| Введено | Найдено ЭФ | Степень извлеченияЭФ, % | sr | Найдено ЛФ | Степень извлечения ЛФ, % | sr |
|---|---|---|---|---|---|---|
| 0 | 0 | – | – | 0 | – | – |
| 36 | 33 ± 4 | 92 | 0.06 | 34 ± 3 | 94 | 0.05 |
| 29 | 26 ± 5 | 90 | 0.07 | 27 ± 3 | 93 | 0.06 |
| 18 | 16 ± 3 | 89 | 0.08 | 16 ± 3 | 89 | 0.08 |
| 7.2 | 6.5 ± 0.8 | 90 | 0.09 | 6.7 ± 0.6 | 93 | 0.05 |
| 3.6 | 3.3 ± 0.4 | 92 | 0.04 | 3.2 ± 0.6 | 89 | 0.07 |
| 2.9 | 2.7 ± 0.4 | 93 | 0.06 | 2.6 ± 0.4 | 90 | 0.06 |
| 1.8 | 1.7 ± 0.2 | 94 | 0.06 | 1.6 ± 0.3 | 89 | 0.07 |
| 0.72 | 0.66 ± 0.08 | 92 | 0.08 | 0.65 ± 0.08 | 90 | 0.09 |
Из рассмотренного примера следует, что при использовании МНЧ, модифицированных ЦТАБ, возможно сорбционно-флуориметрическое определение нанограммовых количеств антибиотиков. Десорбция на уровне 89−94% может являться причиной небольшой систематической погрешности, что при анализе таких объектов некритично. Неполная десорбция может быть связана с частичным образованием на поверхности МНЧ комплексов ионов Fe(III) с фторхинолонами по карбоксихинонной группировке.
Определение энрофлоксацина в плазмозаменяющем средстве. В наибольшей степени востребовано определение фторхинолоновых антибиотиков в биологических объектах (плазма, кровь, биоткани, моча), содержащих белки, которые отделяют и в оставшейся плазме крови определяют аналит. Возможность концентрирования и сорбционно-флуориметрического определения энрофлоксацина в искусственной смеси сложного состава, так называемом “плазмозаменяющем средстве” “Геоплазма баланс”, иллюстрируют данные табл. 5. Степень извлечения энрофлоксацина в модельном плазмозаменяющем средстве 89−93% (табл. 5) может быть связана и с частичной потерей антибиотика за счет связывания в комплекс с Fe(III) на поверхности наномагнетита.
Таблица 5.
Результаты и контроль правильности определения антибиотиков в различных объектах (время сорбции 15 мин, m(Fe3O4@ЦТАБ) = 3 мг, объем пробы 4 мл рН 3.2, 298 K, n = 5, Р = 0.95)
| Введено, мкг |
Найдено, мкг |
Степень извлечения, % | sr |
|---|---|---|---|
| Энрофлоксацин в плазмозаменяющем средстве | |||
| 0 | 0 | – | – |
| 0.70 | 0.62 ± 0.09 | 89 | 0.1 |
| 0.90 | 0.83 ± 0.08 | 92 | 0.09 |
| 1.10 | 1.02 ± 0.09 | 93 | 0.08 |
| Энрофлоксацин в препарате “Энронит” | |||
| 0 | 94 ± 7 | 94 | 0.06 |
| 20 | 112 ± 10 | 93 | 0.07 |
| 40 | 132 ± 9 | 94 | 0.08 |
| 60 | 147 ± 15 | 92 | 0.09 |
| Левофлоксацин в препарате “Лексофлон OR” | |||
| 0 | 141 ± 12 | 94 | 0.06 |
| 20 | 158 ± 14 | 93 | 0.07 |
| 40 | 177 ± 16 | 93 | 0.08 |
| 60 | 193 ± 18 | 92 | 0.09 |
Определение энрофлоксацина в препарате “Энронит” и левофлоксацина в препарате “Лексофлон”. Ветеринарные препараты “Энронит” и “Лексофлон” (ООО “Нита-Фарм”, Саратов) выпускаются в форме раствора для перорального применения при лечении желудочно-кишечных и респираторных заболеваний сельскохозяйственных птиц и поросят [44]. Препарат “Энронит” в 1 мл дистиллированной воды содержит 199 мг энрофлоксацина и 1 000 000 MЕ колистина сульфата, а также вспомогательные компоненты – метабисульфит натрия и молочную кислоту [45]. При определении основного вещества в препарате правильность определения ЭФ контролировали методом “введено–найдено” (табл. 5).
Видно, что содержание энрофлоксацина составляет 94 ± 7 мг/мл при заявленном 100 мг/мл. Данные табл. 5 подтверждают пригодность предлагаемого сорбционно-флуориметрического метода для определения энрофлоксацина в этом препарате. При этом сопутствующие компоненты не оказывают мешающего действия на определение энрофлоксацина.
Ветеринарный препарат “Лексофлон ОR” в пероральной форме применяют для лечения сельскохозяйственных птиц (цыплят, уток, гусей) при колибактериозе, дизентерии, некротическом энтерите, псевдомонозе, кампилобактериозе, стафилококкозе, пастереллезе, а также свиней для лечения бактериальных заболеваний органов дыхания, пищеварительной и мочеполовой системы, инфекций кожи и мягких тканей, а также спирохетоза и микоплазменных инфекций [46]. В 1 мл препарата содержится 150 мг левофлоксацина, соляная кислота и ароматизатор “Вишня 667” [47]. Для определения ЛФ в лекарственном препарате использовали МТФЭ в сочетании с флуориметрическим методом. Результаты определения приведены в табл. 5. Найденное содержание ЛФ 141 ± ± 12 мг/мл согласуется с заявленными 150 мг/мл, что подтверждает правильность результатов, полученных по предложенной методике.
* * *
Таким образом, полученные результаты определения анитибиотиков в различных объектах свидетельствуют о том, что метод МТФЭ с применением наночастиц магнетита, модифицированных ЦТАБ, в сочетании с флуориметрическим окончанием позволяет проводить концентрирование и последующее определение фторхинолоновых антибиотиков на нанограммовом уровне. Максимальная сорбция антибиотиков на МНЧ магнетита наблюдается при рН 3.2−3.3, а степень извлечения составляет 90−98%. На примере энрофлоксацина установлено, что сорбция может быть описана моделью Ленгмюра. Найдено, что наибольшую десорбцию фторхинолонов (94%) обеспечивает применение смеси ацетон−уксусная кислота (9 : 1). Показано, что при извлечении антибиотиков из раствора объемом 50 мл магнетитом массой 18 мг коэффициент концентрирования изменяется в интервале (2.4–2.8) × 103, а при увеличении объема до 150−250 мл достигает величин (5.5−5.7) × 103. При сорбции при 60°С можно уменьшить массу сорбента, необходимую для концентрирования антибиотиков, в 2 раза. Методики сорбционно-флуориметрического определения энрофлоксацина и левофлоксацина после концентрирования методом МТФЭ по собственной флуоресценции, а пефлоксацина по сенсибилизированной флуоресценции тербия(III) достаточно эффективны, отличаются низкими пределами обнаружения, избирательностью и правильностью. Показано, что при использовании 18 мг МНЧ, модифицированных ЦТАБ, и объема анализируемого образца 50 мл, нижняя граница диапазона определяемых содержаний определения антибиотиков снижается с 1 × 10–7 до 2 × 10–9 М, а предел обнаружения, рассчитанный по 3s0-критерию, уменьшается более чем в 20 раз.
Работа выполнена при поддержке РФФИ, проект № 18-03-01029а.
Список литературы
Redgrave L.S., Sam B., Sutton S.B., Mark A., Webber M.A., Piddock L.J.V. Fluoroquinolone resistance: Mechanisms, impact on bacteria, and role in evolutionary success // Trends Microbiol. 2014. V. 22. № 8. P. 438.
Chen L., Zhang X., Xu Y., Du X., Sun X., Sun L., Wang H., Zhao Q., Yu A., Zhang H., Ding L. Determination of fluoroquinolone antibiotics in environmental water samples based on magnetic molecularly imprinted polymer extraction followed by liquid chromatography–tandem mass spectrometry // Anal. Chim. Acta. 2010. V. 662. № 1. P. 31.
Dorival-Garcia N., Zafra-Gomez A., Cantarero S., Navalon A., Vilchez J.L. Simultaneous determination of 13 quinolone antibiotic derivatives in wastewater samples using solid-phase extraction and ultra performance liquid chromatography−tandem mass spectrometry // Microchem. J. 2013. V. 106. P. 323.
Andreu V., Blasco C., Pico Y. Analytical strategies to determine quinolone residues in food and the environment // Trends Anal. Chem. 2007. V. 26. P. 534.
Амелин В.Г., Волкова Н.М., Тимофеев А.А., Третьяков А.В. Пробоподготовка QuEChERS при одновременном определении остаточных количеств хинолонов, сульфаниламидов и амфениколов в пищевых продуктах методом ВЭЖХ с детектированием с помощью диодной матрицы // Журн. аналит. химии. 2015. Т. 70. № 9. С. 948. (Amelin V.G., Volkova N.M., Timofeev A.A., Tret’yakov A.V. QuEChERS sample preparation in the simultaneous determination of residual amounts of quinolones, sulfanilamides, and amphenicols in food using HPLC with a diode_array detector // J. Analyt. Chem. 2015. V. 70. № 9. P. 1076.)
Mi T., Wang Zh., Eremin S.A., Shen J., Zhang S. Simultaneous determination of multiple fluoroquinolone antibiotics in food samples by a one-step fluorescence polarization immunoassay // J. Agric. Food Chem. 2013. V. 61. № 39. P. 9347.
Wispelwey B. Clinical implications of pharmacokinetics and pharmacodynamics of fluoroquinolones // Clin. Infect. Dis. 2005. V. 41. Suppl. P. 127.
Czyrski A. Analytical Methods for determining third and fourth generation fluoroquinolones: A review // Chromatographia. 2017. V. 80. № 2. P. 181.
Watabe S., Yokohama Y., Nakazawa K., Shinozaki K., Hiraoka R., Takeshita K., Suzuki Y. Simultaneous measurement of pazufloxacin, ciprofloxacin, and levofloxacin in human serum by high-performance liquid chromatography with fluorescence detection // J. Chromatogr. B. 2010. V. 878. № 19. P. 1555.
Herrera-Herrera A.V., Hernández-Borges J., Borges-Miquel T.M., Rodríguez-Delgado M.Á. Dispersive liquid-liquid microextraction combined with nonaqueous capillary electrophoresis for the determination of fluoroquinolone antibiotics in waters // Electrophoresis. 2010. V. 31. № 20. P. 3457.
Штыков С.Н., Смирнова Т.Д., Былинкин Ю.Г., Калашникова Н.В., Смирнова Т.Д., Жемеричкин Д.А. Определение ципрофлоксацина и энрофлоксацина методом сенсибилизированной флуоресценции европия в присутствии второго лиганда и мицелл анионных ПАВ // Журн. аналит. химии. 2007. Т. 62. № 2. С. 153. (Shtykov S.N., Smirnova T.D., Bylinkin Yu.G., Kalashnikova N.V., Zhemerichkin D.A. Determination of ciprofloxacin and enrofloxacin by the sensitized fluorescence of europium in the presence of the second ligand and micelles of anionic surfactants // J. Analyt. Chem. 2007. V. 62. № 2. P. 136.)
Смирнова Т.Д., Штыков С.Н., Неврюева Н.В., Жемеричкин Д.А., Паращенко И.И. Флуориметрическое определение флюмеквина с помощью сенсибилизированной флуоресценции тербия в организованных средах // Хим.-фарм. журн. 2010. Т. 44. № 11. С.13. (Smirnova T.D., Shtykov S.N., Nevryue-va N.V., Zhemerichkin D.A., Parashchenko I.I. Fluorimetric assay of flumequine using sensitized terbium fluorescence in organized media // Pharm. Chem. J. 2010. V. 44. № 11. P. 635.)
Егунова О.Р., Константинова Т.А., Штыков С.Н. Магнитные наночастицы магнетита в разделении и концентрировании // Изв. Саратовск. ун-та. Новая серия. Серия Химия. Биология. Экология. 2014. Т. 14. Вып. 4. С. 27. (Egunova O.R., Konstantinova T.A., Shtykov S.N. Magnetic nanoparticles in separation and preconcentration // Izv. Saratov Univ. (N.S.), Ser. Chemistry. Biology. Ecology. 2014. V. 14. № 2. P. 126 (in Russian).)
Толмачева В.В., Апяри В.В., Кочук Е.В., Дмитриен-ко С.Г. Магнитные сорбенты на основе наночастиц оксидов железа для выделения и концентрирования органических соединений // Журн. аналит. химии. 2016. Т. 71. № 4. С. 339. (Tolmacheva V.V., Apyari V.V., Kochuk T.V., Dmitrienko S.G. Magnetic adsorbents based on iron oxide nanoparticles for the extraction and preconcentration of organic compounds // J. Analyt. Chem. 2016. V. 71. № 4. P. 321.)
Толмачева В.В., Апяри В.В., Ибрагимова Б.Н., Кочук Е.В., Дмитриенко С.Г., Золотов Ю.А. Полимерный магнитный сорбент на основе наночастиц Fe3O4 и сверхсшитого полистирола для концентрирования антибиотиков тетрациклинового ряда // Журн. аналит. химии. 2015. Т. 70. № 11. С. 1149. (Tolmacheva V.V., Apyari V.V., Ibragimova B.N., Kochuk E.V., Dmitrienko S.G., Zolotov Y.A. A polymeric magnetic adsorbent based on Fe3O4 nanoparticles and hypercrosslinked polystyrene for the preconcentration of tetracycline antibiotics // J. Analyt. Chem. 2015. V. 70. № 11. P. 1313.)
Rodriguez J.A., Espinosa J., Aguilar-Arteaga K., Ibarra I.S., Miranda J.M. Determination of tetracyclines in milk samples by magnetic solid phase extraction flow injection analysis // Microchim Acta. 2010. V. 171. № 3. P. 407.
Толмачева В.В., Апяри В.В., Ярыкин Д.И., Дмитриенко С.Г. Спектрофотометрическое определение суммарного содержания сульфаниламидов в молоке после их сорбционного выделения с помощью магнитного сверхсшитого полистирола // Журн. аналит. химии. 2016. Т. 71. № 8. С. 867. (Tolmacheva V.V., Apyari V.V., Yarykin D.I., Dmitrienko S.G. Spectrophotometric determination of the total concentration of sulfonamides in milk after adsorption separation using magnetic hypercrosslinked polystyrene // J. Analyt. Chem. 2016. V. 71. № 8. P. 834.)
Tolmacheva V.V., Apyari V.V., Furletov A.A., Dmitrienko S.G., Zolotov Yu.A. Facile synthesis of magnetic hypercrosslinked polystyrene and its application in the magnetic solid-phase extraction of sulfonamides from water and milk samples before their HPLC determination // Talanta. 2016. V. 152. P. 203.
Пряжников Д.В., Киселев М.С., Кубракова И.В. Поверхностно-модифицированный магнитный наноразмерный сорбент для МТФЭ−ВЭЖХ−УФ определения 4-нонилфенола в природных водных объектах // Аналитика и контроль. 2015. Т. 19. № 3. С. 220. (Pryazhnikov D.V., Kiseleva M.S., Kubrakova I.V. Magnetic surface-modified nanosized sorbent for MSPE−HPLC−UV determination of 4-nonylphenol in natural waters // Analitika i kontrol’ [Analytics and Control]. 2015. V. 19. № 3. P. 220 (in Russian).)
Ma J., Wu G., Li S., Tan W., Wang X., Li J., Chen L. Magnetic solid-phase extraction of heterocyclic pesticides in environmental water samples using metal-organic frameworks coupled to high performance liquid chromatography determination // J. Chromatogr. A. 2018. V. 1553. № 1. P. 57.
Киселева М.С., Пряжников Д.В., Кубракова И.В. Магнитный сорбент с мезопористой оболочкой для одновременного концентрирования экотоксикантов различной природы // Журн. аналит. химии. 2018. Т. 73. № 1. С. 14. (Kiseleva M.S., Pryazhnikov D.V., Kubrakova I.V. Magnetic sorbent with mesoporous chell for simultaneous preconcentration of ecotoxicants with different nature // J. Analyt. Chem. 2018. V. 73. № 1. P. 10.)
Urusov A.E., Petrakova A.V., Vozniak M.V., Zherdev A.V., Dzantiev B.B. Rapid immunoenzyme assay of aflatoxin B1 using magnetic nanoparticles // Sensors. 2014. V. 14. P. 21843.
Козицина А.Н., Малышева H.H., Утепова И.А., Глазырина Ю.А., Матерн А.И., Брайнина Х.З., Чупахии О.Н. Бесферментный электрохимический метод определения Е. соlі с использованием нанокомпозитов Fe3O4 с оболочкой SiO2, модифицированной ферроценом // Журн. аналит. химии. 2015. Т. 70. № 5. С. 476. (Kozitsina A.N., Malysheva N.N., Utepo-va I.A., Glazyrina Y.A., Matern A.I., Brainina K.Z., Chupakhin O.N. An enzyme-free electrochemical method for the determination of E. coli using Fe3O4 nanocomposites with a SiO2 shell modified by ferrocene // J. Analyt. Chem. 2015. V. 70. № 5. P. 540.)
Kozitsina A., Svalova T., Malysheva N., Glazyrina Y., Matern A. A new enzyme-free electrochemical immunoassay for Escherichia Coli detection using magnetic nanoparticles // Anal. Lett. 2016. V. 49. № 2. P. 245.
Brainina Kh.Z., Kozitsina A.N., Glazyrina Y.A. Hybrid electrochemical magnetic assay for salmonella Typhimurium detection // IEEE Sensors J. 2010. V. 10. № 11. P. 1699.
Xie L., Jiang R., Zhu F., Liu H., Ouyang G. Application of functionalized magnetic nanoparticles in sample preparation // Anal. Bioanal. Chem. 2014. V. 406. № 2. P. 377.
Bliem R., McDermott E., Ferstl P., Setvin M., Gamba O., Pavelec J., Schneider M.A., Schmid M., Diebold U., Blaha P., Hammer L., Parkinson G.S. Subsurface cation vacancy stabilization of the magnetite (001) surface // Science. 2014. V. 346. № 6214. P. 1215.
Wang L., Yuan Q., Liang G., Shi L., Zhan Q. Magnetic mixed hemimicelles solid-phase extraction coupled with high-performance liquid chromatography for the extraction and rapid determination of six fluoroquinolones i n environmental water samples // J. Sep. Sci. 2015. V. 38. P. 996.
Castillo-García M.L., Aguilar-Caballos M.P., Gómez-Hens A. A europium- and terbium-coated magnetic nanocomposite as sorbent in dispersive solid phase extraction coupled with ultra-high performance liquid chromatography for antibiotic determination in meat samples // J. Chromatogr. A. 2015. V. 1425. № 1. P. 73.
Liu Ch., Liao Y., Huang X. Preparation of a boronic acid functionalized magnetic adsorbent for sensitive analysis of fluoroquinolones in environmental water samples // Anal. Methods. 2016. V. 8. № 23. P. 4744.
Xu S., Jiang C., Lin Y.X., Jia L. Magnetic nanoparticles modified with polydimethylsiloxane and multi-walled carbon nanotubes for solid-phase extraction of fluoroquinolones // Microchim. Acta. 2012. V. 179. № 3–4. P. 257.
He H.B., Dong C., Li B., Dong J.P., Bo T.Y., Wang T.L., Yu Q.W., Feng Y.Q. Fabrication of enrofloxacin imprinted organic-inorganic hybrid mesoporous sorbent from nanomagnetic polyhedral oligomeric silsesquioxanes for the selective extraction of fluoroquinolones in milk samples // J. Chromatogr. A. 2014. V. 1361. № 1. P. 23.
Zheng H.-B., Mo J.-Z., Zhang Yu., Gao Q., Ding J., Yu Q.-W., Feng Y.-Q. Facile synthesis of magnetic molecularly imprinted polymers and its application in magnetic solid phase extraction for fluoroquinolones in milk samples // J. Chromatogr. A. 2014. V. 1329. № 1. P. 17.
Егунова О.Р., Решетникова И.С., Штыков С.Н., Миргородская А.Б., Захарова Л.Я. Сорбционно-флуориметрическое определение энрофлоксацина с применением наночастиц магнетита, модифицированных моно- и дикатионными ПАВ // Сорбционные и хроматографические процессы. 2016. Т. 16. № 4. С. 430. (Egunova O.R., Reshetnikova I.S., Shtykov S.N., Mirgorodskaya A.B., Zakharova L.Ya. Sorption-fluorimetric determination of enrofloxacin with magnetite nanoparticles modified by mono and dicationic surfactants // Sorption Chromatogr. Processes. 2016. V. 16. № 4. P. 430 (in Russian).)
Егунова О.Р., Решетникова И.С., Герман С.В., Казимирова К.О., Хабибуллин В.Р., Желобицкая Е.А., Штыков С.Н. Сорбционно-флуориметрическое определение энрофлоксацина с применением наночастиц магнетита модифицированных полиэтиленимином // Изв. Сарат. ун-та. Нов. сер. Сер. Химия. Биология. Экология. 2016. Т. 16. № 1. С. 48. (Egunova O.R., Reshetnikova I.S., German S.V., Kazimirova K.O., Khabibullin V.R., Zhelobitskaya E.A., Shtykov S.N. Sorption-fluorimetric determination of enrofloxacin with magnetite nanoparticles modified by polyethylenimine // Izv. Saratov Univ. (N.S.). Ser. Chemistry. Biology. Ecology. 2016. V. 16. № 1. P. 48 (in Russian).)
Babić S., Horvat A.J.M., Pavlović D.M., Kaštelan-Macan M. Determination of pKa values of active pharmaceutical ingredients // Trends Anal. Chem. 2007. V. 27. № 11. P. 1043.
Qiang Z., Adams C. Potentiometric determination of acid dissociation constants (pKa) for human and veterinary antibiotics // Water Res. 2004. V. 38. № 12. P. 2874.
Anargiros I.D., Pinelopi C.I. Spectrofluorimetric study of the acid-base equilibria and complexation behavior of the fluoroquinolone antibiotics ofloxacin, noroflxacin, ciprofloxacin and pefloxacin in aqueous solution // Anal. Chim. Acta. 1997. V. 354. № 1–3. P. 197.
Suh J., Paik H-J., Hwang B.K. Ionization of poly(ethylenimine) and poly(allylamine) at various pH’s // Bioorg. Chem. 1994. V. 22. № 3. P. 318.
Штыков С.Н., Русанова Т.Ю. Пленки Ленгмюра−Блоджетт как матрицы чувствительных элементов оптических сенсоров кислотности растворов // Доклады РАН. 2003. Т. 388. № 5. С. 643. (Shtykov S.N., Rusanova T.Yu. Langmuir−Blodgett films as matrixes for sensitive elements of optical sensors to control the acidity of solutions // Dokl. Phys. Chem. 2003. V. 388. № 4−6. P. 60.)
Штыков С.Н., Русанова Т.Ю., Смирнова Т.Д., Горин Д.А. Чувствительный элемент оптического сенсора на основе бензопурпурина 4Б для определения кислотности травильных растворов // Журн. аналит. химии. 2004. Т. 59. № 2. С. 198. (Shtykov S.N., Rusanova T.Yu., Smirnova T.D., Gorin D.A. Sensing element of a benzopurpurin 4B based optical sensor for determining the acidity of etch solutions // J. Analyt. Chem. 2004. V. 59. № 2. P. 175.)
Zhang T., Brantley S.L., Verreault D., Dhankani R., Corcelli S.A., Allen H.C. Effect of pH and salt on surface-pKa of phosphatidic acid monolayers // Langmuir. 2018. V. 34. № 1. P. 530.
Смирнова Т.Д., Желобицкая Е.А., Данилина Т.Г. Флуориметрическое определение пефлоксацина в лекарственном препарате // Изв. Сарат. ун-та. Нов. сер. Сер. Химия. Биология. Экология. 2016. Т. 16. № 4. С. 372. (Smirnova T.D., Zhelobitskaya E.A., Danilina T.G. Fluorimetric determination of pefloxacine in drug // Izv. Saratov Univ. (N.S.). Ser. Chemistry. Biology. Ecology. 2016. V. 16. № 4. P. 372 (in Russian).)
Торопов А.А., Панфилова М.Н., Сафарова М.И. Профилактика инфекционных заболеваний препаратом Энронит ОР // Птицеводство. 2012. № 7. С. 35. (Toropov A.A., Panfilova M.N., Safarova M.I. Prevention of infectous diseases using Enronit OR // Ptitsevodstvo. 2012. № 7. P. 35 (in Russian).)
https://www.vidal.ru/veterinar/enronit-or-27701 (13.06. 2019).
Кашковская Л.М. Верное решение проблемы бактериальных инфекций // Птицеводство. 2016. № 12. С. 43–44. (Kashkovskaya L.M. A Proper Decision for the Problem of Bacterial Infections. Ptitsevodstvo. 2016. № 12. P. 43. (in russian).)
https://www.vidal.ru/veterinar/lexoflon-or-28386 (13.06. 2019).
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


