Журнал аналитической химии, 2020, T. 75, № 10, стр. 867-884
Дисперсионная жидкостно-жидкостная микроэкстракция органических соединений. Обзор обзоров
С. Г. Дмитриенко a, В. В. Апяри a, *, В. В. Толмачева a, М. В. Горбунова a
a Московский государственный университет имени М.В. Ломоносова, химический факультет
119991 Москва,
Ленинские горы, 1, стр. 3, ГСП-1, Россия
* E-mail: apyari@mail.ru
Поступила в редакцию 20.01.2020
После доработки 16.03.2020
Принята к публикации 23.04.2020
Аннотация
Дисперсионная жидкостно-жидкостная микроэкстракция (ДЖЖМЭ) относится к наиболее перспективным методам микроэкстракционного концентрирования органических соединений. Этот метод является экологичным, простым и универсальным, по сравнению с обычной экстракцией он снижает расход реагентов и растворителей, время экстракции и стоимость анализа. За короткое время с момента возникновения ДЖЖМЭ в 2006 г. разработано большое число вариантов, различающихся способом диспергирования и природой экстрагента, сочетанием с другими способами пробоподготовки и методами последующего определения сконцентрированных веществ. О популярности метода среди аналитиков свидетельствует большое число обзоров, которые мы обобщили в настоящей публикации.
В рамках концепции зеленой аналитической химии [1–3] развитие жидкостно-жидкостной экстракции на современном этапе направлено не только на поиск новых относительно безопасных экстрагентов, но и на миниатюризацию процедуры путем разработки различных вариантов жидкостно-жидкостной микроэкстракции (ЖЖМЭ) [4–10]. Под ЖЖМЭ подразумевают экстракцию из водного раствора в небольшое количество несмешивающегося с водой растворителя (до 100 мкл) [5]. Применение ЖЖМЭ позволяет значительно упростить пробоподготовку, уменьшить или полностью исключить применение токсичных растворителей, сократить продолжительность анализа, объединить в одну стадию процедуры экстракции и введения пробы в аналитический прибор. Преимущества методов ЖЖМЭ при подготовке проб по сравнению с классической жидкостной экстракцией заключаются не только в миниатюризации процесса и экономии растворителей, но и в повышении эффективности концентрирования органических соединений. Методы ЖЖМЭ органично сочетаются с рядом методов определения органических соединений – газовой хроматографией (ГХ), ВЭЖХ, капиллярным электрофорезом (КЭ).
Жидкостно-жидкостная микроэкстракция нашла практическое применение с середины 90-х годов прошлого столетия. В настоящее время известно несколько методов ЖЖМЭ органических соединений, различающихся по способу осуществления процесса: капельная микроэкстракция (single drop liquid-phase microextraction, 1996 г.) [11, 12], мембранная микроэкстракция в полое волокно (hollow fiber microextraction, 1999 г.) [13, 14] и дисперсионная жидкостно-жидкостная микроэкстракция (dispersive liquid–liquid мicroextraction, 2006 г.) [15]. Среди перечисленных методов наиболее востребованным и быстро развивающимся является дисперсионная жидкостно-жидкостная микроэкстракция (ДЖЖМЭ): с момента возникновения метода опубликовано более 2500 статей (рис. 1) и большое количество обзоров, в которых довольно сложно ориентироваться.
Рис. 1.
Общее число публикаций в Scopus, вышедших к концу указанного года, в названиях, аннотациях и ключевых словах которых присутствуют термины “dispersive liquid–liquid microextraction” или “DLLME”.

В настоящей публикации обобщены обзорные статьи, описывающие различные варианты ДЖ-ЖМЭ, способы их осуществления, особенности сочетания с другими методами пробоподготовки и методами последующего определения органических соединений в различных объектах. В первую очередь были проанализированы обзоры, опубликованные за период с 2009 по 2019 гг., в названии которых присутствовал термин “ДЖ-ЖМЭ” [16–51 ], они перечислены в табл. 1. Кроме того, проанализированы отдельные большие разделы, посвященные ДЖЖМЭ, в обзорах по общим вопросам ЖЖМЭ [4–10, 52–81 ]. Обзорные статьи, посвящённые применению ДЖЖМЭ для концентрирования неорганических соединений [82–89 ], в данной публикации не рассматривались. Кроме обзоров, которые перечислены в списке цитируемой литературы в хронологическом порядке, мы сочли необходимым привести ссылки на первые оригинальные работы, положившие начало развитию того или иного варианта ДЖЖМЭ. Мы надеемся, что систематизация информации по ДЖЖМЭ привлечет дополнительное внимание аналитиков к этому методу и будет полезной при разработке новых экологически безопасных методик определения органических соединений.
Таблица 1.
Обзоры, посвященные дисперсионной жидкостно-жидкостной микроэкстракции
| Год | Тематика обзора | Литература |
|---|---|---|
| 2009 | Основные принципы и ранние приложения | [16] |
| Общие аспекты ДЖЖМЭ | [17] | |
| 2010 | Достоинства, ограничения и тенденции развития | [18] |
| Общие аспекты ДЖЖМЭ | [19] | |
| 2011 | Основные принципы и приложения | [20] |
| Общие аспекты ДЖЖМЭ | [21] | |
| Связь ДЖЖМЭ с реакциями дериватизации, в основном для биологических образцов | [22] | |
| 2012 | ДЖЖМЭ в сочетании со спектрофотометрией | [23] |
| Легкие растворители в ДЖЖМЭ | [24] | |
| ДЖЖМЭ в анализе объектов окружающей среды | [25] | |
| 2013 | 5 лет ДЖЖМЭ, основные этапы и приложения | [26] |
| ДЖЖМЭ в анализе экологических, пищевых и биологических образцов | [27] | |
| Ионные жидкости в ДЖЖМЭ | [28] | |
| 2014 | Общие аспекты ДЖЖМЭ | [29] |
| Общие аспекты ДЖЖМЭ | [30] | |
| ДЖЖМЭ в анализе пищевых продуктов | [31] | |
| 2015 | Общие аспекты ДЖЖМЭ | [32] |
| ДЖЖМЭ для определения пестицидов | [33] | |
| ДЖЖМЭ в биологическом анализе (плазма, моча) | [34] | |
| 2016 | Классификация и терминология в ДЖЖМЭ | [35] |
| ДЖЖМЭ в анализе молока и молочных продуктов | [36] | |
| ДЖЖМЭ в судебной токсикологии | [37] | |
| ДЖЖМЭ в аналитической токсикологии | [38] | |
| 2017 | 10 лет ДЖЖМЭ (1594 ссылки) | [39] |
| ДЖЖМЭ с затвердевшей органической каплей | [40] | |
| Фармацевтические и биомедицинские применения | [41] | |
| Определение пестицидов в экологических объектах | [42] | |
| Автоматизация ДЖЖМЭ | [43] | |
| 2018 | ДЖЖМЭ с применением деэмульгирующих растворителей | [44] |
| ДЖЖМЭ в сочетании с пробоподготовкой в ВЭЖХ | [45] | |
| ДЖЖМЭ в сочетании с дериватизацией | [46] | |
| Растворители в ДЖЖМЭ | [47] | |
| Ионные жидкости в ДЖЖМЭ | [48] | |
| Дизайн эксперимента в ДЖЖМЭ | [49] | |
| 2019 | Современное состояние ДЖЖМЭ | [50] |
| Глубокие эвтектические растворители в ДЖЖМЭ | [51] |
ПРИНЦИП ДИСПЕРСИОННОЙ ЖИДКОСТНО-ЖИДКОСТНОЙ МИКРОЭКСТРАКЦИИ, ОБЩАЯ ХАРАКТЕРИСТИКА И КЛАССИФИКАЦИЯ
Дисперсионная жидкостно-жидкостная микроэкстракция основана на экстракции аналитов микроэмульсией экстрагента. Диспергирование экстрагента в фазе анализируемого раствора приводит к образованию очень мелких капель с размером частиц в десятые–сотые доли микрона и резкому увеличению поверхности массообмена (в 104–105 раз); равновесие при этом устанавливается за несколько минут. Первоначально в методе ДЖЖМЭ в качестве экстрагентов использовали более тяжелые, чем вода, растворители, а диспергирование экстрагента осуществляли путем его предварительного растворения в третьем компоненте-диспергенте, который полностью смешивается с анализируемым раствором, и последующего перемешивания (conventional or normal dispersive liquid–liquid microextraction). После экстракции мутный раствор центрифугируют и отбирают выделившуюся фазу экстракта для анализа. Принцип метода, его сочетание с методами определения и практическое применение обобщены в обзорах [16–20].
В обзоре “Пять лет дисперсионной жидкостно-жидкостной микроэкстракции” (2013 г.) обсуждено более 440 публикаций за период с 2006 по 2011 гг. [26]. Позже те же авторы опубликовали обзор “Десять лет дисперсионной жидкостно-жидкостной микроэкстракции”, в котором цитировались уже 1594 ссылки [39]. Эти обзоры, в которых большая часть информации представлена в виде таблиц, могут быть полезны при сравнении разработанных в аналитических лабораториях методов с опубликованными в литературе [10].
В дальнейшем ДЖЖМЭ развивалась по нескольким направлением. Прежде всего, усилия исследователей были направлены на поиск новых способов диспергирования экстрагента, позволивших полностью или частично отказаться от диспергирующего растворителя, таких как ультразвуковое [90] и вихревое [91] диспергирование, а также диспергирование пузырьками воздуха [92]. Позже работы такого плана были систематизированы в нескольких обзорах [50, 58, 76, 79, 80].
Второе, не менее важное направление связано с поиском и применением в ДЖЖМЭ менее токсичных экстрагентов и диспергентов. Появились работы, в которых вместо тяжелых растворителей с плотностью больше, чем у воды, в качестве экстрагентов использовали менее токсичные легкие растворители [93], ионные жидкости [94], глубокие эвтектические растворители [95]. Был предложен новый вариант ДЖЖМЭ, основанный на затвердевании экстракта [96]. Отдельное внимание уделялось интенсификации процесса за счет исключения стадии центрифугирования; для этой цели предложено использовать деэмульгирующие растворители [97]. Позже работы в этом направлении были обобщены в обзорах [24, 28, 40, 44, 47, 48, 51].
В ряде обзоров систематизированы работы по практическому применению ДЖЖМЭ для концентрирования органических соединений из вод [18, 19, 25, 27, 30, 33, 42], пищевых [27, 30, 31, 33, 36] и биологических объектов [27, 30, 34, 37, 38, 41]. При решении практических задач было установлено, что ДЖЖМЭ хорошо сочетается как с методами последующего определения, так и с другими способами пробоподготовки. С особенностями такого сочетания можно ознакомиться в обзорах [18, 21, 23, 30, 45]. Отдельные обзоры посвящены сочетанию ДЖЖМЭ с дериватизацией аналитов [22, 46], автоматизации ДЖЖМЭ [18, 43] и планированию эксперимента в ДЖЖМЭ [49].
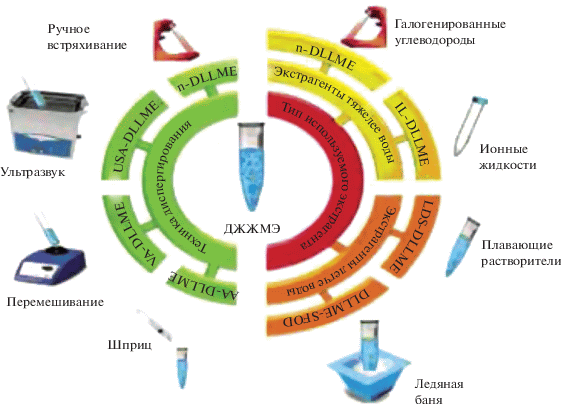
Появление большого числа вариантов и способов осуществления ДЖЖМЭ обусловило необходимость их классификации. Наиболее общее представление о существующих вариантах и способах осуществления ДЖЖМЭ дает классификация, в основу которой положено наличие или отсутствие диспергирующего растворителя в экстракционной системе [9, 10, 35]. Существующие варианты ДЖЖМЭ по этому принципу можно разделить на две группы: 1) ДЖЖМЭ с использованием смеси экстрагирующих и диспергирующих растворителей; 2) ДЖЖМЭ без диспергирующего растворителя. Существует также классификация, в основе которой лежит способ диспергирования и природа используемого экстрагента [29, 32, 41]. В настоящем обзоре мы будем придерживаться последнего варианта классификации. Классификация ДЖЖМЭ по способу диспергирования экстрагента приведена в табл. 2, а по плотности и природе используемого экстрагента – в табл. 3. При составлении таблиц мы использовали общепринятые в англоязычной литературе терминологию и аббревиатуры (подробно см. обзоры [9, 35]).
Таблица 2.
Классификация вариантов дисперсионной жидкостно-жидкостной микроэкстракции по способу диспергирования экстрагента
| Способ диспергирования |
Полное и сокращенное название варианта | Способ осуществления |
|---|---|---|
| Диспергирование полярным растворителем | Исходный вариант ДЖЖМЭ (conventional or normal dispersive liquid–liquid microextraction, n-DLLME) | Ручное перемешивание, встряхивание |
| Диспергирование под действием ультразвука | ДЖЖМЭ с ультразвуковым диспергированием, УЗ-ДЖЖМЭ (ultrasound-assisted DLLME, USA-DLLME) | Диспергирование и перемешивание в ультразвуковой ванне |
| Вихревое диспергирование экстрагента | ДЖЖМЭ с вихревым диспергированием, В-ДЖЖМЭ (vortex-assisted dispersive liquid–liquid microextraction, VA-DLLME) | Быстрое вращение емкости с исследуемой жидкостью в вихревом смесителе |
| Шприцевое диспергирование потоком воздуха | ДЖЖМЭ со шприцевым диспергированием потоком воздуха (air-assisted DLLME, AA-DLLME) | Многократное набирание и выдавливание шприцем анализируемой водной фазы с воздухом и экстрагентом |
Таблица 3.
Классификация вариантов дисперсионной жидкостно-жидкостной микроэкстракции в зависимости от природы экстрагента
| Тип экстрагента | Экстрагент | Полное и сокращенное название способа |
|---|---|---|
| Растворители с большей плотностью, чем у воды | Хлорированные углеводоахороды (хлороформ, хлорбензол, тетрaxлoрметан, тетрахлорэтилен) | Исходный вариант ДЖЖМЭ, (conventional or normal dispersive liquid–liquid microextraction, n-DLLME) |
| Растворители с меньшей плотностью, чем у воды | Легкие углеводороды (гексан, циклогексан, гексадекан, м-ксилол) | ДЖЖМЭ растворителями с низкой плотностью (low density solvent DLLME, LDS-DLLME) |
| Растворители с температурой затвердевания 10–25°C, такие как 1-ундеканол и 1-додеканол | ДЖЖМЭ с затвердевшей плавающей органической каплей (DLLME with solidified floating organic droplet, DLLME-SFOD) | |
| Ионные жидкости | Гидрофобные, гидрофильные или магнитные ионные жидкости | ДЖЖМЭ с ионными жидкостями, ИЖ- ДЖЖМЭ (ionic liquid-assisted DLLME, IL-DLLME) |
| Глубокие эвтектические растворители | Гидрофобные глубокие эвтектические растворители | ДЖЖМЭ с глубокими эвтектическими растворителями (deep eutectic solvents-assisted DLLME, DES-DLLME) |
Схемы осуществления различных способов ДЖЖМЭ приведены на рис. 2. Особенности отдельных вариантов и способов осуществления ДЖЖМЭ рассмотрены ниже.
Рис. 2.
Схемы осуществления различных способов дисперсионной жидкостно-жидкостной микроэкстракции [41].
ВАРИАНТЫ ДИСПЕРСИОННОЙ ЖИДКОСТНО-ЖИДКОСТНОЙ МИКРОЭКСТРАКЦИИ, РАЗЛИЧАЮЩИЕСЯ СПОСОБОМ ДИСПЕРГИРОВАНИЯ ЭКСТРАГЕНТА
Исходный вариант ДЖЖМЭ (conventional, or normal dispersive liquid–liquid microextraction, n-DLLME). В исходном варианте ДЖЖМЭ диспергирование экстрагента осуществляют полярными растворителями [15, 16, 18, 20, 41, 50]. Этот вариант ДЖЖМЭ отличается наиболее простой техникой выполнения и наименьшим числом задействованных единиц оборудования. В его основе лежит трехкомпонентная система растворителей, состоящая из анализируемого водного раствора, неполярного органического растворителя-экстрагента с плотностью большей, чем у воды, и полярного органического растворителя-диспергента, смешивающегося с водой и экстрагентом.
Схема осуществления ДЖЖМЭ с диспергированием экстрагента полярным растворителем приведена на рис. 3 [20]. Сначала при помощи шприца в анализируемую пробу быстро вводят смесь экстрагирующего и диспергирующего растворителей. При этом необходимо учитывать, что диспергирование проходит тем лучше, чем меньше диаметр отверстия иглы. При введении смеси в анализируемый раствор экстрагент выделяется в виде тонкодисперсной эмульсии с размером частиц десятые−сотые доли микрона. Образовавшийся мутный раствор вручную перемешивают в течение нескольких минут. В процессе экстракции гидрофобные аналиты переходят в органическую фазу, которая диспергирована в объеме водной фазы. После экстракции мутный раствор центрифугируют для разрушения эмульсии и с помощью микрошприца отбирают выделившуюся фазу экстракта, находящуюся на дне конической пробирки, для последующего анализа. Общее время экстракции, включая время центрифугирования, обычно составляет 5–10 мин.
Рис. 3.
Схема осуществления дисперсионной жидкостно-жидкостной микроэкстракции с диспергированием экстрагента полярным растворителем [20].

В этом варианте ДЖЖМЭ к экстрагенту и диспергирующему растворителю предъявляются определенные требования [18, 20, 25]. Прежде всего, экстрагент должен образовывать дисперсную систему в присутствии диспергирующего растворителя и иметь плотность большую, чем у воды, для эффективного разделения фаз после центрифугирования. Как и в классическом варианте жидкостной экстракции, экстрагент должен максимально полно извлекать целевой аналит, иметь низкую растворимость в водной фазе, достаточную степень чистоты и относительно высокую температуру кипения (>60°С), так как при использовании легколетучих экстрагентов часть растворителя испаряется, что ухудшает воспроизводимость результатов. Поскольку последующее определение аналитов чаще всего осуществляют хроматографическими методами, растворитель не должен способствовать размыванию хроматографических пиков, разрушать неподвижную фазу хроматографической колонки, вызывать коррозию элементов хроматографа, приводить к порче систем детектирования. При выборе полярного диспергирующего растворителя учитывают его смешиваемость как с экстрагентом, так и с водным раствором для образования мелкодисперсной эмульсии экстрагента. Не менее важным критерием является и чистота диспергента.
Согласно данным, приведенным в обзоре [41], в качестве экстрагентов в этом варианте ДЖЖМЭ чаще всего используют хлороформ (42%), дихлорэтан (18%), четыреххлористый углерод (15%), а в качестве диспергентов – ацетонитрил (56%) и метанол (28%). Другие диспергирующие растворители, например ацетон и этанол, применяют значительно реже.
На эффективность экстракции и соответственно на степень концентрирования аналитов влияют объемы экстрагента и диспергента. Критерием выбора объема экстрагента в ДЖЖМЭ служит минимальный объем аликвоты, которую можно отобрать после разделения фаз для последующего анализа. В большинстве случаев при объеме анализируемого раствора 5–10 мл объемы экстрагента и диспергирующего растворителя составляют 20–50 мкл [5, 41] (реже до 400 мкл [9]) и 200–800 мкл [9, 50] (реже до 2000 мкл [5]) соответственно.
За время экстракции в рассматриваемом варианте ДЖЖМЭ принимают время между впрыскиванием смеси растворителя и диспергента в анализируемый раствор и центрифугированием. Установлено, что за счет значительного увеличения поверхности массобмена аналиты переходят в мелкодисперсную эмульсию экстрагента очень быстро, экстракционное равновесие достигается не более чем за минуту. Стадией, лимитирующей время ДЖЖМЭ, является центрифугирование, продолжительность которого зависит от соотношения плотностей раствора и экстрагента. Время центрифугирования обычно не превышает 5–15 мин [18].
Известно, что добавка соли уменьшает растворимость аналитов в водной фазе и способствует их переходу в органический растворитель за счет эффекта высаливания. Однако в методе с диспергированием растворителя диффузионные затруднения при массопередаче не являются определяющими из-за резкого увеличения поверхности массообмена. Как отмечено в обзорах [14, 50], коэффициент концентрирования незначительно зависит от ионной силы раствора или даже имеет тенденцию к уменьшению. Значение рН анализируемого раствора оказывает влияние в случае экстракции органических соединений с выраженными кислотными или основными свойствами. Как правило, максимальные значения коэффициентов концентрирования достигаются в интервале рН, соответствующем нахождению соединений в молекулярной форме.
К достоинствам исходного варианта ДЖЖМЭ можно отнести высокую эффективность экстракционного концентрирования органических соединений, быстрое время установления равновесия, простоту осуществления, низкую стоимость. В большинстве случаев в этом методе органические соединения извлекаются количественно, а значения коэффициента концентрирования – отношения концентрации соединения в экстракте к его концентрации в исходном растворе [15] – в зависимости от соотношения объемов фаз изменяются в широких пределах от 10 до 1113 [18, 30].
К ограничениям метода относят применение так называемых “тяжелых” растворителей, которые, несмотря на использование даже в таком ничтожно малом количестве, представляют опасность для оператора и окружающей среды вследствие их токсичности. Другое ограничение связано с наличием в экстракционной системе еще одного органического растворителя-диспергента, способного увеличивать растворимость органических соединений в водной фазе и, следовательно, уменьшать коэффициент концентрирования. Возникают также проблемы, связанные с его чистотой. Наконец, среди недостатков метода указывают наличие стадии центрифугирования, увеличивающей продолжительность анализа и затрудняющей автоматизацию метода [43].
ДЖЖМЭ с ультразвуковым диспергированием (ultrasound-assisted dispersive liquid–liquid microextraction, US-DLLME). Для интенсификации процесса диспергирования экстрагента вместо ручного встряхивания в 2008 г. предложено использовать ультразвук. Работы в этом направлении получили развитие и позже были обобщены в отдельных разделах в ряде обзоров [8, 9, 29, 32, 41, 50, 53, 61, 67, 79].
Схема осуществления ДЖЖМЭ с ультразвуковым диспергированием экстрагента практически не отличается от описанной выше для исходного варианта ДЖЖМЭ. В анализируемую пробу объемом 5–10 мл микрошприцем вводят несколько микролитров экстрагента и диспергента, после чего образец подвергают ультразвуковому облучению (в ультразвуковой ванне или при помощи ультразвукового волновода) в течение определенного времени. По окончании ультразвукового воздействия экстракт отделяют центрифугированием и анализируют. Диспергирование экстрагента происходит за счет кавитации – образования в жидкости пульсирующих микропузырьков, заполненных паром, газом или их смесью. При распространении ультразвуковой волны в жидкости возникает переменное звуковое давление, амплитуда которого достигает порядка нескольких атмосфер. Под действием этого давления жидкость попеременно испытывает сжатие и растяжение. Кавитационные пузырьки в некоторой области жидкости возникают всякий раз, когда до этой области доходит фаза разрежения ультразвуковой волны. Как правило, кавитационные пузырьки долго не живут: уже следующая за разрежением фаза сжатия приводит к захлопыванию большей их части. В связи с этим кавитационные пузырьки исчезают практически сразу вслед за прекращением облучения жидкости ультразвуком. При захлопывании кавитационных пузырьков возникают большие локальные давления порядка тысяч атмосфер, в жидкости образуются интенсивные ударные волны, которые улучшают дисперсию капель экстрагирующего растворителя.
По сравнению с ручным встряхиванием ультразвуковое диспергирование обеспечивает образование более мелких капель экстрагента, позволяет значительно уменьшить количество диспергента, а в ряде случаев и полностью отказаться от него.
На эффективность ультразвукового диспергирования влияют интенсивность и продолжительность ультразвукового облучения. Частота ультразвукового облучения обычно составляет 40–45 кГц, а мощность порядка 60 Вт. В этих условиях не происходят нежелательные химические реакции между водой, экстрагентом и примесями. Время ультразвукового воздействия не должно превышать 2–5 мин. Помимо интенсивности и продолжительности ультразвукового облучения при выборе условий экстракции варьируют природу диспергирующего и экстрагирующего растворителей, их объемы, соотношения объемов водного образца и экстрагента. В качестве диспергентов чаще всего используют метанол, этанол, ацетонитрил, а в качестве экстрагентов – хлороформ, четыреххлористый углерод, а в последние годы и различные ионные жидкости.
Несмотря на ряд достоинств, присущих ультразвуковому диспергированию, оно не лишено недостатков. Под воздействием ультразвука происходит нагревание образца, вследствие чего органический растворитель может испаряться, а некоторые органические соединения – разрушаться. Образующаяся в процессе диспергирования эмульсия зачастую бывает очень устойчивой, что увеличивает время центрифугирования. Кроме того, для осуществления этого варианта ДЖЖМЭ в распоряжении химика-аналитика должно быть дополнительное оборудование – ультразвуковая ванна или ультразвуковой волновод, что приводит к увеличению стоимости анализа.
ДЖЖМЭ с вихревым диспергированием (vortex-assisted dispersive liquid–liquid microextraction, VA-DLLME). Дальнейшее развитие ДЖЖМЭ связано с возникновением в 2010 г. метода, получившего название ДЖЖМЭ с вихревым диспергированием экстрагента. К настоящему времени этот вариант освещен в ряде разделов в обзорах [8, 29, 53, 58, 66, 67, 76].
Вихревое диспергирование экстрагента осуществляют с помощью лабораторных вихревых смесителей, скорость вращения, как правило, составляет 2500–3200 об/мин [66]. При быстром вращении емкости с исследуемой жидкостью в среде развивается турбулентность – трехмерное нестационарное движение жидкости, в котором непрерывно возникают и распадаются элементы турбулентного потока – вихри. Беспорядочное перемещение вихрей приводит к интенсивному перемешиванию жидкости, относительно большие капли экстрагента разбиваются на более мелкие, в результате чего и образуется мелкодисперсная эмульсия экстрагента с образованием частиц субмикронного размера. Это резко увеличивает поверхность массообмена, равновесие в системе устанавливается не более чем за минуту.
По сравнению с исходным вариантом ДЖЖМЭ, микроэкстракция с вихревым диспергированием отличается большей эффективностью; как правило, в этом методе удается достичь более высоких коэффициентов концентрирования органических соединений, часто и в отсутствие диспергентов. В отличие от ультразвукового диспергирования, описанного выше, в процессе вихревого диспергирования раствор не подвергается воздействию ультразвукового облучения, способного вызывать разложение некоторых соединений. Кроме того, мелкодисперсная эмульсия экстрагента, образующаяся при вихревом перемешивании, термодинамически более нестабильна, чем в случае ультразвукового диспергирования, что облегчает заключительную стадию центрифугирования. Еще одним преимуществом ДЖЖМЭ с вихревым диспергированием является значительно меньшая стоимость вихревых смесителей по сравнению с ультразвуковыми ваннами или ультразвуковыми зондами, что положительно сказывается на стоимости анализа в целом.
ДЖЖМЭ со шприцевым диспергированием потоком воздуха (air-assisted dispersive liquid–liquid microextraction, AA-DLLME). В 2012 г. был предложен вариант ДЖЖМЭ, основанный на диспергировании экстрагента пузырьками воздуха. Для этого используют многократное засасывание смеси, содержащей анализируемый раствор и экстрагент, в стеклянный шприц и обратное ее возвращение в пробирку. При перемещении струи воздуха в жидкости создается значительное вихревое движение, в результате чего получается мутный раствор, содержащий экстракт, диспергированный в виде мелких капелек в водной фазе. После центрифугирования мутного раствора экстракт, который оседает на дне центрифужной пробирки или плавает на поверхности образца, собирают и используют для дальнейшего анализа. При работе с легкоплавкими органическими растворителями пробирку дополнительно охлаждают в ледяной бане, после чего для анализа отбирают затвердевшую каплю экстракта.
Метод отличается простотой, экспрессностью и позволяет проводить диспергирование экстрагента в отсутствие полярного органического растворителя – диспергента. В отличие от ультразвукового или вихревого диспергирования, в этом варианте ДЖЖМЭ отпадает необходимость использования дополнительного оборудования – ульразвуковых ванн/волноводов или вихревых смесителей. Более подробную информацию об этом варианте ДЖЖМЭ можно найти в обзорах [8, 29, 67, 80].
ВАРИАНТЫ ДИСПЕРСИОННОЙ ЖИДКОСТНО-ЖИДКОСТНОЙ МИКРОЭКСТРАКЦИИ, РАЗЛИЧАЮЩИЕСЯ ТИПОМ РАСТВОРИТЕЛЯ
ДЖЖМЭ растворителями с низкой плотностью (low density solvent DLLME, LDS-DLLME). В зависимости от плотности экстрагента различают два способа проведения ДЖЖМЭ: концентрирование “внизу” и концентрирование “наверху”. Большинство работ выполнено с применением концентрирования “внизу”. В качестве экстрагентов при концентрировании “внизу” используют растворители с плотностью большей, чем плотность воды, особенно хлорированные углеводороды – хлороформ, хлорбензол, тетрахлорметан и тетрахлорэтилен. Данный способ более удобен с точки зрения отбора экстрагента после центрифугирования раствора, он хорошо сочетается с газовой хроматографией. В 2009 г. опубликована первая работа, указывающая на возможность использования в ДЖЖМЭ растворителей с меньшей плотностью, чем у воды. Позже работы в этом направлении были систематизированы в обзоре [24] и в ряде разделов в обзорах [27, 29, 66].
В качестве экстрагентов в этом варианте ДЖЖМЭ применяют легкие углеводороды – гексан, циклогексан, гексадекан, м-ксилол, ундеканол, додеканол и др. Как правило, эти экстрагенты менее токсичны, они позволяют концентрировать полярные органические соединения и хорошо сочетаются с ВЭЖХ или КЭ. Однако после проведения ДЖЖМЭ микрообъемы “легких” растворителей распределяются по поверхности воды в виде тончайшей пленки, которую весьма непросто собрать. Один из способов обеспечить возможность применения таких растворителей – использование специальных экстракционных устройств [24, 27, 29]. Наиболее подходящими оказались экстракторы, изготовленные из стекла и имеющие суженную верхнюю часть или снабженные капиллярным сборником концентрата. После центрифугирования экстракт вытесняют в капиллярный сборник водой, которую вводят снизу или сверху через слой экстракта. Оптимальным аппаратурным решением для использования легких экстрагентов оказалось применение стеклянного экстрактора с припаянным капилляром, который также заполняется исходной анализируемой жидкостью. В этом варианте добавление жидкости после экстракции не требуется. При внутреннем диаметре капилляра 1.2–1.4 мм высота столбика выделенного центрифугированием экстракта составляет около 7–10 мм, что удобно для отбора его микрошприцем. Кроме стекла, для изготовления экстракторов используют одноразовые пластиковые пробирки с зауженной верхней частью. После проведения экстракции экстракт перемещают в узкую горловину путем сжатия пробирки или центрифугирования. Недостатком пластиковых экстракторов является эффект “памяти” полимерных материалов по отношению к органическим веществам.
ДЖЖМЭ с затвердевшей плавающей органической каплей (DLLME with solidified floating organic droplet, DLLME-SFOD) была предложена в 2008 г. на основе сочетания ДЖЖМЭ и капельной ЖЖМЭ, основанной на затвердевании плавающей капли [54]. Этот вариант ДЖЖМЭ подробно освещен в обзоре [40] и нескольких разделах других обзоров [27, 29, 61].
К органическим растворителям, пригодным для использования в качестве экстрагентов в этом варианте ДЖЖМЭ, предъявляют ряд требований, вытекающих из особенностей этого способа концентрирования. Они должны быть легче, чем вода, обладать температурой плавления, близкой к комнатной (10–25°С), затвердевать в ледяной бане, иметь низкую летучесть и растворимость в воде, эффективно извлекать органические соединения. В качестве экстрагентов чаще всего используют 1-ундеканол и 1-додеканол, реже – 2-додеканол, н‑гексадекан, 1-бромгексадекан, 1,10-дихлордекан и 1-хлороктадекан. При выборе диспергирующего растворителя учитывают его смешиваемость с экстрагентом и водным раствором для образования мелкодисперсной эмульсии экстрагента. В качестве диспергентов чаще всего используют метанол, реже – ацетон и ацетонитрил. Одно из достоинств метода – простота сбора экстракта, к ограничениям относят небольшой круг экстрагентов.
ДЖЖМЭ с ионными жидкостями (ionic liquid-assisted DLLME, IL-DLLME). В этом варианте ДЖЖМЭ в качестве экстрагентов, а иногда одновременно экстрагентов и диспергентов, используют ионные жидкости (ИЖ). С момента публикации в 2008 г. первой работы, указывающей на возможность такого применения ИЖ, этот вариант ДЖЖМЭ, пожалуй, развивался самыми быстрыми темпами. Разработано несколько разновидностей ДЖЖМЭ с ионными жидкостями: традиционная ДЖЖМЭ, ДЖЖМЭ с ультразвуковым (IL-based ultrasound-assisted DLLME) или вихревым диспергированием (IL-based vortex-assisted DLLME), терморегулируемая ДЖЖМЭ (temperature-assisted IL-DLLME) и ДЖЖМЭ в образующуюся in situ ионную жидкость (in-situ IL-DLLME). Работы в этом направлении систематизированы в отдельных обзорах [28, 48] и ряде больших разделов в обзорах [9, 27, 47, 50, 61, 68, 77, 81]. В этих обзорах можно найти информацию об ИЖ, нашедших применение в ДЖЖМЭ, об особенностях осуществления тех или иных вариантов с их участием. Там же приведены примеры практического применения ДЖЖМЭ для концентрирования органических соединений из различных объектов. Приведем несколько примеров.
В традиционном варианте ДЖЖМЭ 30–60 мкл гидрофобной ИЖ, выбранной в качестве экстрагента, смешивают с 200–500 мкл диспергента, в качестве которого чаще всего используют метанол, реже – ацетонитрил, ацетон, этанол или гидрофильную ИЖ. Затем смесь ИЖ и диспергента при помощи шприца быстро вводят в анализируемую пробу и перемешивают вручную в течение нескольких минут. После центрифугирования в течение 5–10 мин выделившуюся фазу экстракта, находящуюся на дне конической пробирки, отбирают при помощи микрошприца, разбавляют метанолом для снижения вязкости экстракта и используют для ВЭЖХ-определения сконцентрированных органических соединений. Ограничением этого варианта ДЖЖМЭ является невозможность определения сконцентрированных органических соединений методом ГХ (в газовой хроматографии ИЖ не используют ввиду их низкой летучести). Замена ручного перемешивания ультразвуковым или вихревым диспергированием позволяет не только облегчить диспергирование гидрофобной ИЖ в водном растворе, но и в ряде случаев отказаться от введения диспергента.
В терморегулируемой ДЖЖМЭ экстракцию проводят при повышенных температурах. Нагревание повышает растворимость ИЖ и улучшает ее диспергирование в водном растворе, а последующее охлаждение экстракционной смеси приводит к выделению микрокапель ИЖ с экстрагированными соединениями. В большинстве случаев в этом варианте ДЖЖМЭ не применяют диспергирующий растворитель.
В ДЖЖМЭ, основанной на образовании ионной жидкости in situ, в качестве экстрагента используют гидрофильную ИЖ. Схема процесса выглядит следующим образом. К 5–10 мл анализируемого раствора добавляют 30–40 мкл выбранной гидрофильной ИЖ и эквивалентное количество анионообменного реагента, содержащего крупный гидрофобный анион. При совместном присутствии катиона гидрофильной ИЖ и гидрофобного аниона образуется мутный раствор тонкодисперсной эмульсии, образованной in situ гидрофобной ИЖ. В возникающую таким образом новую фазу, которую диспергируют путем перемешивания, ультразвука или другими описанными выше способами, и переходят сконцентрированные органические соединения.
Новым типом ИЖ, нашедшим применение в ДЖЖМЭ, являются магнитные ионные жидкости (МИЖ), с особенностями применения которых можно ознакомится в обзорах [68, 81]. К МИЖ относят ионные жидкости, содержащие в своем составе парамагнитные компоненты, чаще всего анионы ${\text{FeCl}}_{{\text{4}}}^{ - }$ или ${\text{MnCl}}_{{\text{4}}}^{{{\text{2}} - }}$ в комбинации с катионами имидазолия, фосфония или аммония. Экстракционные растворители на основе МИЖ не только обладают уникальными свойствами, присущими ионным жидкостям, но и реагируют на внешнее магнитное поле, что значительно облегчает заключительный этап отделения экстракта. Замена стадии центрифугирования магнитной сепарацией позволяет значительно сократить общую продолжительность анализа и минимизировать потери экстракта.
ДЖЖМЭ, основанная на использовании глубоких эвтектических растворителей (deep eutectic solvents-assisted DLLME, DES-DLLME). В качестве близких родственников ионных жидкостей в 2003 г. были открыты глубокие эвтектические растворители (deep eutectic solvents, DES) – жидкости, образующиеся при смешивании двух соединений, одно из которых выступает в роли акцептора водородных связей, а второе является донором водородных связей. В результате специфических взаимодействий между этими соединениями, в основном образования водородных связей, получается эвтектическая смесь с гораздо более низкой температурой плавления, чем у любого из двух компонентов. Эти растворители обычно составляют из двух нетоксичных компонентов, один из которых (соли четвертичного аммония, тетралкиламмония или фосфония) является акцептором водородной связи, а второй (мочевина, карбоновые кислоты, многоатомные спирты и ряд других соединений) – донором водородной связи [51, 68, 70].
Физико-химические свойства ионных жидкостей и глубоких эвтектических растворителей близки. Они негорючи, обладают повышенной растворяющей способностью и низким давлением пара, высокими электропроводностью, вязкостью и поверхностным натяжением, легко регенерируются и, как правило, не представляют опасности для окружающей среды. По сравнению с ионными жидкостями этот новый класс растворителей обладает такими преимуществами, как простота получения, легкая доступность относительно недорогих и экологичных компонентов, биоразлагаемость. Благодаря уникальной растворяющей способности, нетоксичности, низкой стоимости, доступности и биоразлагаемости глубокие эвтектические растворители в ближайшем будущем могут составить достойную альтернативу ионным жидкостям [51].
В ДЖЖМЭ глубокие эвтектические растворители применяют с 2016 г. В большинстве случаев используют гидрофобные глубокие эвтектические растворители, состоящие из хлорида холина и 4-хлорфенола, метилтриоктиламмоний хлорида и октановой кислоты, тетрабутиламмоний хлорида и декановой или октановой кислот. Их используют не только в традиционном варианте ДЖЖМЭ, но и в ДЖЖМЭ с ультразвуковым или вихревым диспергированием, а также в ДЖЖМЭ с затвердевшей плавающей органической каплей [68].
ДЖЖМЭ с применением деэмульгирующих растворителей (solvent-terminated dispersive liquid–liquid microextraction, ST-DLLME). В большинстве вариантов ДЖЖМЭ, описанных выше, одной из необходимых стадий анализа является центрифугирование. Центрифугирование не только увеличивает продолжительность этапа пробоподготовки методом ДЖЖМЭ, но и затрудняет его автоматизацию. Для устранения стадии центрифугирования в 2010 г. был предложен вариант ДЖЖМЭ, получивший название дисперсионной жидкостно-жидкостной микроэкстракции с применением деэмульгирующих растворителей. В этом варианте стадия центрифугирования заменена простой и быстрой стадией деэмульгирования, которую осуществляют путем впрыскивания растворителя-деэмульгатора. В качестве деэмульгаторов, согласно данным обзора [44], посвященного этому варианту ДЖЖМЭ, чаще всего используют ацетонитрил; метанол, этанол, 1-бутанол и ацетон применяют реже.
Процесс деэмульгирования начинается с флокуляции диспергированных капель экстрагента, когда образуются более крупные капли. При использовании легких экстрагентов капли экстракта плавают на поверхности жидкости, а при использовании тяжелых растворителей – опускаются на дно пробирки. Как правило, объем вводимого деэмульгатора равен объему диспергатора, а продолжительность деэмульгирования, которую определяют как интервал между завершением введения деэмульгатора и началом сбора экстракта, не превышает нескольких минут.
СОЧЕТАНИЕ ДИСПЕРСИОННОЙ ЖИДКОСТНО-ЖИДКОСТНОЙ МИКРОЭКСТРАКЦИИ С ДРУГИМИ МЕТОДАМИ ПРОБОПОДГОТОВКИ, ОПРЕДЕЛЕНИЕМ И ДЕРИВАТИЗАЦИЕЙ
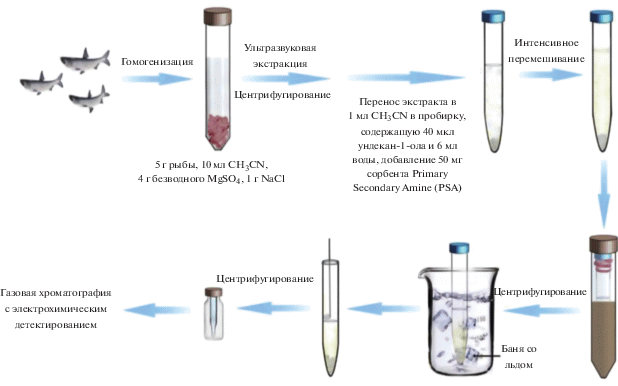
Сочетанию ДЖЖМЭ с другими методами пробоподготовки жидких и твердых образцов посвящен один из последних обзоров [45] и несколько разделов в обзорах [10, 27, 30, 51, 74]. Авторы обзора [45] предложили разделить такие сочетания на три группы. В первых двух группах ДЖЖМЭ применяют после проведения предварительной пробоподготовки образцов с применением традиционных (1 группа) или современных (2 группа) методов. Основная цель такого сочетания – повышение коэффициентов концентрирования. При анализе жидких образцов чаще всего сочетают твердофазную экстракцию (ТФЭ) или магнитную ТФЭ органических соединений из относительно больших объемов проб с последующим дополнительным концентрированием аналитов методом ДЖЖМЭ. Такое сочетание особенно актуально, если на стадии элюирования в ТФЭ используют большой объем элюента. При анализе твердых образцов на первом этапе проводят выделение аналитов методами ульразвукового, микроволнового или субкритического экстрагирования, а также такими современными способами, как дисперсия матрицы с твердым сорбентом, метод QuEChERS, метод ускоренной экстракции растворителями и другими, а затем полученный концентрат “сжимают” с помощью ДЖЖМЭ. В методах третьей группы, напротив, на первом этапе используют ДЖЖМЭ, а затем проводят дополнительное концентрирование при помощи капельной или твердофазной микроэкстракции. В качестве примера на рис. 4 схематически изображена комбинация метода QuEChERS с ДЖЖМЭ, основанная на затвердевании плавающей органической капли, которую использовали для концентрирования хлорорганических пестицидов из рыбы [98].
Рис. 4.
Комбинация метода QuEChERS с дисперсионной жидкостно-жидкостной микроэкстракцией, основанной на затвердевании плавающей органической капли, которую использовали для концентрирования хлорорганических пестицидов из рыбы [98].
Сочетанию ДЖЖМЭ с методами последующего определения уделено большое внимание в ранних обзорах [16–18, 21, 23]. Отмечено, что традиционный вариант ДЖЖМЭ летучих органических соединений органично сочетается с ГХ, а ДЖЖМЭ с применением легких растворителей – с ВЭЖХ: экстракты, полученные после концентрирования, можно непосредственно вводить в хроматограф. Многочисленные примеры определения органических соединений методом ГХ и ВЭЖХ с использованием различных систем детектирования после концентрирования различными вариантами ДЖЖМЭ приведены в обзорах [16–18, 21]. Отдельный обзор посвящен сочетанию ДЖЖМЭ с УФ-, цифровой и люминесцентной спектроскопией [23].
Сочетание ДЖЖМЭ с дериватизацией обсуждается в обзорах [22, 46]. При комбинации ДЖЖМЭ с ГХ дериватизацию проводят с целью превращения некоторых аналитов в их летучие производные или полярных соединений в более гидрофобные производные. При сочетании с ВЭЖХ в процессе дериватизации получают производные, которые можно детектировать с применением УФ- или флуоресцентного детектора. В зависимости от природы определяемых соединений, сложности матрицы, хроматографических условий разделения и определения выбирают различные режимы дериватизации: дериватизация до ДЖЖМЭ; одновременное проведение дериватизации и ДЖЖМЭ; дериватизация после ДЖЖМЭ и ряд других. Основным достоинством объединения ДЖЖМЭ и дериватизации является то, что для получения производных требуются очень небольшие объемы дериватизирующих реагентов и растворителей.
Важной, но все еще нерешенной проблемой является автоматизация как самой процедуры ДЖЖМЭ, так и всего анализа в целом. Работ в этом направлении выполнено немного, они обобщены в отдельных разделах в обзорах [8, 9, 29, 30, 49, 55, 99].
ПРИМЕНЕНИЕ ДИСПЕРСИОННОЙ ЖИДКОСТНО-ЖИДКОСТНОЙ МИКРОЭКСТРАКЦИИ В АНАЛИЗЕ КОНКРЕТНЫХ ОБЪЕКТОВ
Дисперсионная жидкостно-жидкостная микроэкстракция нашла широкое применение в химическом анализе в качестве эффективного способа пробоподготовки различных по составу и сложности объектов с последующим определением органических соединений хроматографическими методами. Результаты исследований обобщены в ряде обзоров, посвященных применению ДЖЖМЭ для выделения и концентрирования органических соединений из объектов окружающей среды [25–27, 30, 66, 75], пищевых продуктов [30, 31, 36, 52, 57, 72] и биологических объектов [22, 34, 37, 38, 41, 61]. Отдельные обзоры и большие разделы в обзорах посвящены применению ДЖЖМЭ для концентрирования пестицидов [33, 42, 63], триазольных фунгицидов [64], парабенов [60], алкилбензолов и бисфенола А [71], УФ-фильтров [74]. Кроме того, примеры применения различных вариантов ДЖЖМЭ можно найти в обзорах, упомянутых в предыдущих разделах.
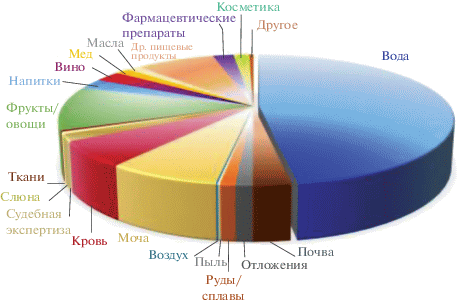
Согласно данным обзора [39], посвященного десятилетию возникновения ДЖЖМЭ, чаще всего (48, 27 и 17% опубликованных работ) этот метод применяют для концентрирования органических соединений из объектов окружающей среды, пищевых продуктов и биологических объектов соответственно, реже – при анализе фармацевтических и косметических препаратов, средств личной гигиены и ряда других объектов (рис. 5).
Рис. 5.
Основные типы объектов, в процессе пробоподготовки которых использовали дисперсионную жидкостно-жидкостную микроэкстракцию [39].
Объекты окружающей среды. Кроме указанных выше, примеры определения органических соединений в объектах окружающей среды можно найти в обзорах [19, 21, 26, 27, 30, 39]. В большинстве работ (43%) ДЖЖМЭ используют в процессе пробоподготовки природных вод различных типов. При анализе вод пробы предварительно фильтруют или центрифугируют, а затем проводят ДЖ-ЖМЭ. В случае почв сначала получают почвенные вытяжки, а затем проводят ДЖЖМЭ.
Большое число работ посвящено ДЖЖМЭ хлорсодержащих, фосфорорганических и карбаминатных пестицидов, полициклических ароматических углеводородов (ПАУ), полихлорированных бифенилов, в том числе ДДТ и его метаболитов, и лекарственных веществ. Для определения летучих и среднелетучих соединений предложено множество аналитических процедур, основанных на сочетании ДЖЖМЭ с газовой хроматографией. В качестве примера можно привести методику определения ПАУ в природных водах, описанную в первой публикации [15], посвященной этому методу. В пробу воды объемом 5 мл при помощи шприца вводили 1 мл ацетона (диспергирующий растворитель) и 18 мкл дихлорэтана (экстрагент), после чего смесь перемешивали в течение 1 мин. После центрифугирования отбирали 2 мкл экстракта и определяли содержание ПАУ методом газовой хроматографии. В указанных условиях ПАУ экстрагировались на 60.3–111.3%, а пределы обнаружения составили 0.007–0.03 мкг/л.
Нелетучие или высокополярные соединения, например фенолы, экстрагируют в виде их летучих производных после проведения реакции дериватизации. Так, например, при определении хлорфенолов к пробе речной воды объемом 5 мл добавляли 0.5 мл 5%-ного раствора K2CO3 (высаливающий агент), 500 мкл ацетона (диспергирующий растворитель), 10 мкл хлорбензола (экстрагент) и 50 мкл уксусного ангидрида (дериватизирующий агент). После перемешивания и центрифугирования образовавшиеся производные хлорфенолов определяли методом ГХ с детектором электронного захвата. Коэффициенты концентрирования хлорфенолов изменялись от 287 до 906, а пределы обнаружения – от 0.01 до 2 мкг/л [17].
При сочетании ДЖЖМЭ с ВЭЖХ важно, чтобы органический растворитель, выбранный в качестве экстрагента, был совместим с подвижной фазой. В противном случае после выделения аналитов проводят дополнительную стадию выпаривания полученного экстракта и перерастворения его в подвижной фазе. Дополнительной операции удается избежать при использовании “легких” экстрагентов. В качестве примера можно привести методику выделения октилфенола, нонилфенола и бисфенола А из 20 мл природных или сточных вод методом ДЖЖМЭ с вихревым диспергированием экстрагента, в качестве которого использовали 50 мкл октанола. Вихревое перемешивание (2500 об/мин) осуществляли в течение 2 мин. После центрифугирования октанольную фазу собирали в верхней части поверхности образца с помощью микрошприца и использовали для определения аналитов методом ВЭЖХ, пределы обнаружения составили 0.01–0.07 мкг/л, а коэффициенты концентрирования 150–690 [66].
Пищевые продукты. Кроме обзоров, указанных выше, примеры определения органических соединений в пищевых продуктах можно найти в обзорах [19, 21, 27, 30, 39, 49, 52, 72].
При анализе жидких пищевых продуктов, например напитков, анализируемую пробу в большинстве случаев разбавляют водой, центрифугируют и только затем проводят ДЖЖМЭ. Для определения фунгицидов в красном вине разработана простая и эффективная методика ультразвуковой ДЖЖМЭ. Пробу вина фильтровали, добавляли к ней 50 мкл экстрагента – ионной жидкости [C6MIm][PF6], а затем на 5 мин помещали в ультразвуковую ванну. После центрифугирования экстракт использовали для определения фунгицидов методом обращенно-фазовой ВЭЖХ с пределами обнаружения 2.8–16.8 мкг/л. Степени извлечения фунгицидов изменялись от 76 до 90%, а коэффициенты концентрирования от 287 до 906 [31].
Из молока аналиты выделяют после удаления белков. В качестве примера можно привести метод определения в молоке пяти триазолов. ДЖЖМЭ осуществляли после осаждения белков добавлением ацетонитрила и хлорида натрия. После центрифугирования отбирали 1 мл надосадочной жидкости, добавляли к ней 40 мкл хлороформа и при помощи шприца быстро вводили смесь в 5 мл деионизированной воды. После пятиминутного центрифугирования отбирали экстракт и определяли пенконазол, гексаконазол, тебуконазол, тритиконазол и дифенконазол методом ГХ–масс-спектрометрии (сmin = 4 мкг/л, коэффициенты конценрирования 156–387) [36].
При анализе твердых пищевых продуктов ДЖ-ЖМЭ проводят не только для концентрирования, но и для дополнительной очистки экстракта, полученного после извлечения искомых аналитов из этих объектов другими методами. В качестве примера приведем методику [19] выделения антибактериальных препаратов хинолонов из мяса. Сначала 5 г мяса гомогенизируют в присутствии 5 мл ацетонитрила и 50 мкл 70–72%-ной хлорной кислоты. После добавления 2 г безводного сульфата магния и 1 г хлорида натрия смесь встряхивают вручную в течение 1 мин, а затем центрифугируют в течение 4 мин (10 000 об/мин). Для проведения ДЖЖМЭ отбирают 1.5 мл верхнего ацетонитрильного слоя и добавляют к нему 300 мкл дихлорметана и быстро вводят в 7.5 мл деионизированной воды. Трехкомпонентную систему растворителей перемешивают вихревой мешалкой в течение 30 с. После центрифугирования в течение 4 мин при 3000 об/мин экстракт отбирают при помощи шприца, переносят в виалу, выпаривают растворители в потоке азота при 40°С, остаток растворяют в 500 мкл подвижной фазы и определяют хинолоны методом ВЭЖХ с диодно-матричным детектором. Хинолоны в указанных условиях экстрагируются на 93–103%, пределы обнаружения варьируют от 5.6 до 23.8 мкг/кг [19].
Биологические объекты. Основные достоинства ДЖЖМЭ, такие как малые объемы экстрагента и анализируемой пробы, способствовали широкому применению этого метода для пробоподготовки самых разнообразных биологических образцов: мочи, плазмы и сыворотки крови, слюны, тканей. ДЖЖМЭ используют для выделения из перечисленных объектов лекарственных веществ – анальгетиков, антибиотиков, нестероидных противовоспалительных средств, антидепрессантов, наркотиков и др. Кроме обзоров, указанных выше, примеры определения органических соединений в биологических объектах можно найти в обзорах [30, 34, 39]. В обзорах, посвященных применению ДЖЖМЭ в анализе биологических объектов, указывается на необходимость предварительной обработки образца перед экстракцией, например, путем простого разбавления, осаждения белков или ТФЭ.
При анализе мочи или слюны, образцов с низким содержанием белков ДЖЖМЭ проводят после разбавления и фильтрования анализируемых проб, в то время как при работе с плазмой или сывороткой крови требуется дополнительная процедура удаления белков путем добавления трихлоруксусной кислоты, ацетонитрила или метанола.
Дисперсионную жидкостно-жидкостную микроэкстракцию в сочетании с ВЭЖХ-УФ использовали для определения трех психотропных препаратов (амитриптилина, кломипрамина и тиоридазина) в образцах мочи с пределами обнаружения 3–8 мкг/л [38]. В качестве экстрагента использовали 20 мкл CCl4, в качестве диспергирующего растворителя – 0.5 мл ацетонитрила, экстракцию проводили при рН 10 в течение 3 мин. Степени извлечения соединений составили 96–101%.
Для определения в плазме крови человека шести антидепрессантов разработан метод ДЖЖМЭ с ультразвуковым диспергированием экстрагента [41]. К аликвоте плазмы (500 мкл) добавляют 2.5 мл ацетонитрила, после чего смесь центрифугируют в течение 5 мин для отделения белков. Супернатант помещают в стеклянную пробирку и добавляют 200 мкл экстрагента – хлороформа. Затем эту смесь при помощи шприца быстро вводят в коническую пробирку, содержащую 4.5 мл воды Milli-Q (pH 9), и помещают в ультразвуковую ванну на 3 мин. После центрифугирования экстракт отделяют, упаривают, растворяют в 100 мкл подвижной фазы и определяют соединения методом ультраэффективной ВЭЖХ с фотодиодным матричным детектором. Степени извлечения составили 92.5–110%, а пределы обнаружения 4–5 мкг/л.
Дисперсионную жидкостно-жидкостную микроэкстракцию в сочетании с ВЭЖХ-УФ использовали для определения морфина, кодеина, папаверина и носкапина в плазме крови человека [57]. 1-Ундеканол и ацетон использовали в качестве эктрагента и диспергента соответственно. Экстракцию проводили при рН 9 в присутствии 1% NaCl в течение 30 с. Степени извлечения составили 88–111%, коэффициенты концентрирования 110–165, пределы обнаружения 0.5–5 мг/л.
* * *
Дисперсионная жидкостно-жидкостная микроэкстракция представляет собой миниатюрную версию классической жидкостно-жидкостной экстракции и является в настоящее время наиболее востребованным и быстро развивающимся методом жидкофазного микроэкстракционного концентрирования органических соединений. За короткое время после возникновения ДЖЖМЭ разработано большое число вариантов осуществления этого метода, различающихся способом диспергирования экстрагента и типом используемых растворителей. В практику ДЖЖМЭ помимо диспергирования экстрагента полярными растворителями были введены ультразвуковое и вихревое диспергирование, а также диспергирование пузырьками воздуха, позволившие в ряде случаев отказаться от диспергирующего растворителя. Вместо традиционных “тяжелых” органических растворителей в качестве экстрагентов предложено использовать менее токсичные и экологически более безопасные так называемые “легкие” растворители, ионные жидкости, глубокие эвтектические растворители. ДЖЖМЭ нашла широкое применение для выделения и концентрирования органических соединений из объектов окружающей среды, пищевых продуктов и биологических объектов. За это время были опубликованы не только тысячи научных исследований, но и большое число обзоров, которые мы обобщили в настоящей публикации. Серия работ по ДЖЖМЭ выполнена в России [100–116], многие из них не вошли в цитируемые в этой публикации обзоры, поэтому мы считаем необходимым упомянуть их здесь. Принимая во внимание такие достоинства ДЖЖМЭ, как высокая эффективность экстракционного концентрирования органических соединений, быстрое установление равновесия, простота осуществления и низкая стоимость коммерчески доступного оборудования, следует надеяться, что в ближайшем будущем этот метод будет все чаще использоваться в практике аналитических лабораторий. Можно ожидать, что дальнейшее развитие метода будет связано с поиском экологически безопасных и биоразлагаемых экстрагентов, разработкой новых сочетаний ДЖЖМЭ с другими методами пробоподготовки и автоматизацией как самой процедуры ДЖЖМЭ, так и всего анализа в целом.
Работа выполнена в рамках темы по госзаданию АААА-А16-116111750033-9.
Список литературы
Gałuszka A., Migaszewski Z., Namieśnik J. The 12 principles of green analytical chemistry and the SIGNIFICANCE mnemonic of green analytical practices // Trends Anal. Chem. 2013. V. 50. P. 78.
Золотов Ю.А. “Зеленая” аналитическая химия // Журн. аналит. химии. 2013. Т. 68. С. 315.
Armenta S., Garrigues S., Esteve-Turrillas F.A., Guardia M. Green extraction techniques in green analytical chemistry // Trends Anal. Chem. 2019. V. 116. P. 248.
Kokosa J.M., Przyjazny A., Jeannot M.A. Solvent Microextraction: Theory and Practice. New Jersey: John Wiley & Sons, 2009. 323 p.
Kokosa J.M. Advances in solvent microextraction techniques // Trends Anal. Chem. 2013. V. 43. P. 2.
Крылов В.А., Крылов А.В., Мосягин П.В., Маткивская Ю.О. Жидкофазное микроэкстракционное концентрирование примесей // Журн. аналит. химии. 2011. Т. 66. С. 341. (Krylov V.A., Krylov A.V., Mosyagin P.V., Matkivskaya Yu.O. Liquid-phase microextraction preconcentration of impurities // J. Analyt. Chem. 2011. V. 66. P. 331.)
Крылов В.А, Крылов А.В. Микроэкстракционное концентрирование токсикантов. М.: LAP Lambert Academic Publishing, 2011. 140 с.
Yamini Y., Rezazadeh M., Seidi S. Liquid-phase microextraction – The different principles and configurations // Trends Anal. Chem. 2019. V. 112. P. 264.
Kokosa J.M. Selecting an extraction solvent for a greener liquid phase microextraction (LPME) mode-based analytical method // Trends Anal. Chem. 2019. V. 118. P. 238.
Rutkowska M., Płotka-Wasylka J., Sajid M., Andruch V. Liquid-phase microextraction: A review of reviews. // Microchem. J. 2019. V. 149. Article 103989. https://doi.org/10.1016/j.microc.2019.103989
Liu H.H., Dasgupta P.K. Analytical chemistry in a drop. Solvent extraction in a microdrop // Anal. Chem. 1996. V. 68. P. 1817.
Tang S., Qi T., Ansah P.D., Fouemina J.C.N., Shen W., Basheer C., Lee H.K. Single-drop microextraction // Trends Anal. Chem. 2018. V. 108. P. 306.
Pedersen-Bjergaard S., Rasmussen K.E. Liquid−liquid−liquid microextraction for sample preparation of biological fluids prior to capillary electrophoresis // Anal. Chem. 1999. V. 71. P. 2650.
Ghambarian M., Yamini Y., Esrafili A. Developments in hollow fiber based liquid-phase microextraction: principles and applications // Microchim Acta. 2012. V. 177. P. 271.
Razaee M., Assadi Y., Hosseini M.R.M., Aghaee E., Ahmadia F., Berijani S. Determination of organic compounds in water using dispersive liquid–liquid microextraction // J. Chromatogr. A. 2006. V. 1116. P. 1.
Zang X.H., Wu Q.H., Zhang M.Y., Xi G.H., Wang Z. Developments of dispersive liquid−liquid microextraction technique // Chin. J. Anal. Chem. 2009. V. 37. P. 161.
Ojeda C.B., Rojas F.S. Separation and preconcentration by dispersive liquid−liquid microextraction procedure: A review // Chromatographia. 2009. V. 69. P. 1149.
Rezaee M., Yamini Y., Faraji M. Evolution of dispersive liquid−liquid microextraction method // J. Chromatogr. A. 2010. V. 1217. P. 2342.
Herrera A.V.H., Ramos M.A., Borges J.H., Delgado M.A.R. Dispersive liquid−liquid microextraction for determination of organic analytes // Trends Anal. Chem. 2010. V. 29. P. 728.
Zgoła-Grzeskowiak A., Grzeskowiak T. Dispersive liquid−liquid microextraction // Trends Anal. Chem. 2011. V. 30. P. 1382.
Ojeda C.B., Rojas F.S. Separation and preconcentration by dispersive liquid−liquid microextraction procedure: Recent applications // Chromatographia. 2011. V. 74. P. 651.
Nuhu A.A., Basheer C., Saad B. Liquid-phase and dispersive liquid−liquid microextraction techniques with derivatization: recent applications in bioanalysis // J. Chromatogr. B. 2011. V. 879. P. 1180.
Andruch V., Kocúrová L., Balogh I.S., Skrlikova J. Recent advances in coupling single-drop and dispersive liquid−liquid microextraction with UV–vis spectrophotometry and related detection techniques // Microchem. J. 2012. V. 102. P. 1.
Kocúrova L., Balogh I.S., Sandrejova J., Andruch V. Recent advances in dispersive liquid−liquid microextraction using organic solvents lighter than water. A review // Microchem. J. 2012. V. 102. P. 11.
Ma J., Lu W., Chen L. Recent advances in dispersive liquid−liquid microextraction for organic compounds analysis in environmental water: A review // Curr. Anal. Chem. 2012. V. 8. P. 78.
Andruch V., Balogh I. S., Kocúrová L., Šandrejová J. Five years of dispersive liquid−liquid microextraction // Appl. Spectrosc. Rev. 2013. V. 48. P. 161.
Yan H., Wang H. Recent development and applications of dispersive liquid−liquid microextraction // J. Chromatogr. A. 2013. V. 1295. P. 1.
Rodríguez T.M.J., Bautista P.R., Pino V., Afonso A.M. Ionic liquids in dispersive liquid−liquid microextraction // Trends Anal. Chem. 2013. V. 51. P. 87.
Leong M.I., Fuh M.R., Huang S.D. Beyond dispersive liquid−liquid microextraction // J. Chromatogr. A. 2014. V. 1335. P. 2.
Saraji M., Boroujeni M.K. Recent developments in dispersive liquid−liquid microextraction // Anal. Bioanal. Chem. 2014. V. 406. P. 2027.
Viñas P. Campillo N., García I.L., Cordoba M.H. Dispersive liquid−liquid microextraction in food analysis. A critical review // Anal. Bioanal. Chem. 2014. V. 406. P. 2067.
Li M.J., Zhang H.Y., Liu X.Z., Chui C.Y., Shi Z.H. Progress of extraction solvent dispersion strategies for dispersive liquid−liquid microextraction // Chin. J. Anal. Chem. 2015. V. 43. P. 1231.
Ahmad W., Al-Sibaai A.A., Bashammakh A.S., Alwael H., El-Shahawi M.S. Recent advances in dispersive liquid−liquid microextraction for pesticide analysis // Trends Anal. Chem. 2015. V. 72. P. 181.
Zuloaga O., Olivares M., Navarro P., Vallejo A., Prieto A. Dispersive liquid−liquid microextraction: trends in the analysis of biological samples // Bioanalysis. 2015. V. 23. P. 2211.
Sandrejova J., Campillo N., Viňas P., Andruch V. Classification and terminology in dispersive liquid−liquid microextraction // Microchem. J. 2016. V. 127. P. 184.
Quigley A., Cummins W., Connolly D. Dispersive liquid−liquid microextraction in the analysis of milk and dairy products: A review // J. Chem. 2016. P. 1. https://doi.org/10.1155/2016/4040165
Jain R., Singh R. Applications of dispersive liquid−liquid micro-extraction in forensic toxicology // Trends Anal. Chem. 2016. V. 75. P. 227.
Sharifi V., Abbasi A, Nosrati A. Application of hollow fiber liquid phase microextraction and dispersive liquide−liquid microextraction techniques in analytical toxicology // J. Food Drug Anal. 2016. V. 24. P. 264.
Campillo N., Viňas P., Sandrejova J., Andruch V. Ten years of dispersive liquid−liquid microextraction and derived techniques // Appl. Spectrosc. Rev. 2017. V. 52. P. 267.
Mansour F.R., Danielson N.D. Solidification of floating organic droplet in dispersive liquid−liquid microextraction as a green analytical tool // Talanta. 2017. V. 170. P. 22.
Mansour F.R., Khairy M.A. Pharmaceutical and biomedical applications of dispersive liquid–liquid microextraction // J. Chromatogr. B. 2017. V. 1061-1062. P. 382.
Primel E.G., Caldas S.S., Marube L.C., Escarrone A.L.V. An overview of advances in dispersive liquid–liquid microextraction for the extraction of pesticides and emerging contaminants from environmental samples // Trends Environ. Anal. Chem. 2017. V. 14. P. 1.
Alexoviic M., Horstkotte B., Sriamkovia I., Solich P., Sabo J. Automation of dispersive liquid−liquid microextraction and related techniques. Approaches based on flow, batch, flow-batch and in syringe modes // Trends Anal. Chem. 2017. V. 86. P. 39.
Mansour F.R., Danielson N.D. Solvent-terminated dispersive liquid−liquid microextraction: a tutorial // Anal. Chim. Acta. 2018. V. 1016. P. 1.
Sajid M., Alhooshani K. Dispersive liquid−liquid microextraction based binary extraction techniques prior to chromatographic analysis: A review // Trends Anal. Chem. 2018. V. 108. P. 167.
Sajid M. Dispersive liquid−liquid microextraction coupled with derivatization: A review of different modes, applications, and green aspects // Trends Anal. Chem. 2018. V. 106. P. 169.
Tan Y.H., Chai M., Shing W.L. A review on extraction solvents in the dispersive liquid−liquid microextraction // Malays. J. Anal. Sci. 2018. V. 22. P. 166.
Rykowska I., Ziemblinska J., Nowak I. Modern approaches in dispersive liquid−liquid microextraction (DLLME) based on ionic liquids: A review // J. Mol. Liq. 2018. V. 259. P. 319.
Mousavi L., Tamiji Z., Khoshayand M.R. Applications and opportunities of experimental design for the dispersive liquid−liquid microextraction method – A review // Talanta. 2018. V. 190. P. 335.
Wang Q., Chen R., Shatner W., Cao Y., Bai Y. State-of-the-art on the technique of dispersive liquid−liquid microextraction // Ultrason. Sonochem. 2019. V. 51. P. 369.
Li G., Row K.H. Utilization of deep eutectic solvents in dispersive liquid−liquid microextraction // Trends Anal. Chem. 2019. V. 120. Article 115651. https://doi.org/10.1016/j.trac.2019.115651
Ramos M.A., Pérez L.M.R., Curbelo M.Á.G., Borges J.H. Liquid phase microextraction applications in food analysis // J. Chromatogr. A. 2011. V. 1218. P. 7415.
Andruch V., Burdel M., Kocurova L., Sandrejová J., Balogh I.S. Application of ultrasonic irradiation and vortex agitation in solvent microextraction // Trends. Anal. Chem. 2013. V. 49. P. 1.
Ghambarian M., Yamini Y., Esrafili A. Liquid-phase microextraction based on solidified floating drops of organic solvents // Microchim. Acta. 2013. V. 180. P. 519.
Kocúrová L., Balogh I.S., Andruch V. Solvent microextraction: A review of recent efforts at automation // Microchem. J. 2013. V. 110. P. 599.
He Y. Recent advances in application of liquid-based micro-extraction: A review // Chem. Pap. 2014. V. 68. P. 995.
Yan Y., Chen X., Hu S., Bai X. Applications of liquid-phase microextraction techniques in natural product analysis: A review // J. Chromatogr. A. 2014. V. 1368. P. 1.
Ojeda C.B., Rojas F.S. Vortex-assisted liquid–liquid microextraction (VALLME): applications // Chromatographia. 2014. V. 77. P. 745.
Moreda-Piñeiro J., Moreda-Piñeiro A. Recent advances in combining microextraction techniques for sample pre-treatment // Trends Anal. Chem. 2015. V. 71. P. 265.
Ocaña-González J.A., Villar-Navarro M., Ramos-Payán M., Fernández-Torres R., Bello-López M.A. New developments in the extraction and determination of parabens in cosmetics and environmental samples. A review // Anal. Chim. Acta. 2015. V. 858. P. 1.
Ocaña-González J.A., Fernandez-Torres R., Bello-Lόpez M.A, Ramos-Payán M. New developments in microextraction techniques in bioanalysis. A review // Anal. Chim. Acta. 2016. V. 905. P. 8.
Yilmaz E., Soylak M. Latest trends, green aspects, and innovations in Liquid phase based microextraction techniques: A review // Turk. J. Chem. 2016. V. 40. P. 868.
Lawal A., Tan G.H., Alsharif A.M.A. Recent advances in analysis of pesticides in food and drink samples using LPME techniques coupled to GC−MS and LC−MS: a review // J. AOAC Int. 2016. V. 99. P. 1383.
Bordagaray A., Millán E., Garcia-Arrona R. A review on microextraction techniques for selected triazole fungicides determination in water and food samples // J. Food Chem. Nanotechnol. 2016. V. 2. P. 128.
Clark K.D., Nacham O., Purslow J.A., Pierson S.A., Anderson J.L. Magnetic ionic liquids in analytical chemistry: A review // Anal. Chim. Acta. 2016. V. 934. P. 9.
Hashemi B., Zohrabi P., Kim K.-H., Shamsipur M., Deep A., Hong J. Recent advances in liquid-phase microextraction techniques for the analysis of environmental pollutants // Trends Anal. Chem. 2017. V. 97. P. 83.
Rutkowska P.M., Owczarek K. Guardia M., Płotka-Wasylka J., Namieśnik J. Application of additional factors supporting the microextraction // Trends Anal. Chem. 2017. V. 97. 104.
Ana J., Trujillo-Rodríguez M.J., Pino V., Anderson J.L. Non-conventional solvents in liquid phase microextraction and aqueous biphasic systems // J. Chromatogr. A. 2017. V. 1500. P. 1.
Plotka-Wasylka J., Rutkowska M., Owczarek K., Tobiszewski M., Namiesnik J. Extraction with environmentally friendly solvents // Trends Anal. Chem. 2017. V. 91. P. 12.
Shishov A., Bulatov A., Locatelli M., Carradori S., Andruch V. Application of deep eutectic solvents in analytical chemistry. A review // Microchem. J. 2017. V. 135. P. 33.
Salgueiro-Gonzalez N., Muniategui-Lorenzo S., Lopez-Mahía P., Prada-Rodríguez D. Trends in analytical methodologies for the determination of alkylphenols and bisphenol A in water samples // Anal. Chim. Acta. 2017. V. 962. P. 1.
Campillo N., García I.L., Cordoba M.H., Vinas P. Food and beverage applications of liquid-phase microextraction // Trends Anal. Chem. 2018. V. 109. P. 116.
Chisvert A., Bened J.L., Salvador A. Current trends on the determination of organic UV filters in environmental water samples based on microextraction techniques – A review // Anal. Chim. Acta. 2018. V.1034. P. 22.
Sajid M., Płotka-Wasylka J. Combined extraction and microextraction techniques: recent trends and future perspectives // Trends Anal. Chem. 2018. V. 103. P. 74.
Carasek E., Merib J., Mafra G., Spudeit D. A recent overview of the application of liquid-phase microextraction to the determination of organic micro-pollutants // Trends Anal. Chem. 2018. V. 108. P. 203.
Psillakis E. Vortex-assisted liquid−liquid microextraction revisited // Trends Anal. Chem. 2019. V. 113. P. 332.
Плетнев И.В., Смирнова С.В. Шведене Н.В. Новые направления применения ионных жидкостей в аналитической химии. 1. Жидкостная экстракция // Журн. аналит. химии. 2019. Т. 74. № 7. С. 483.
Sajid M. Magnetic ionic liquids in analytical sample preparation: A literature review // Trends Anal. Chem. 2019. V. 113. P. 210.
Albero B., Tadeo J.L., Perez R.A. Ultrasound-assisted extraction of organic contaminants // Trends Anal. Chem. 2019. V. 118. P. 739.
Farajzadeh M.A., Mohebbi A., Pazhohan A., Nemati M., Mogaddam M.R.A. Air-assisted liquid−liquid microextraction; principles and applications with analytical instruments // Trends Anal. Chem. 2020. V. 122. https://doi.org/10.1016/j.trac.2019.115734
Jalilia V., Barkhordarib A., Ghiasvandc A. New extraction media in microextraction techniques. A review of reviews // Microchem. J. 2020. V. 153. 104 386. https://doi.org/10.1016/j.microc.2019.104386
Anthemidis A.N., Ioannou K.I.G. Recent developments in homogeneous and dispersive liquid–liquid extraction for inorganic elements determination. A review // Talanta. 2009. V. 80. P. 413.
Dadfarnia S., Shabani A.M.H. Recent developments in liquid phase microextraction for determination of metals: A review // Anal. Chim. Acta. 2010. V. 658. P. 107.
Andruch V., Balogh I.S., Kocúrová L., Šandrejová J. The present state of coupling of dispersive liquid−liquid microextraction with atomic absorption spectrometry // J. Anal. At. Spectrom. 2013. V. 28 P. 19.
El-Shahawi M.S., Al-Saidi H.M. Dispersive liquid−liquid microextraction for chemical speciation and determination of ultratrace concentrations of metal ions // Trends Anal. Chem. 2013. V. 44 P. 12.
Saidi A.H.M., Emara. A.A.A. The recent developments in dispersive liquid−liquid microextraction for preconcentration and determination of inorganic analytes // J. Saudi. Chem. Soc. 2014. V. 18. P. 745.
Stanisz E., Werner J., Zgoła-Grześkowiak A. Liquid-phase microextraction techniques based on ionic liquids for preconcentration and determination of metals // Trends Anal. Chem. 2014. V. 61. P. 54.
Martinis E.M., Berton P., Wuilloud R.G. Ionic liquid-based microextraction techniques for trace-element analysis // Trends Anal. Chem. 2014. V. 60. P. 54.
Soledad N.L.C., Domini C.E., Marcovecchio J.E., Botte S.E. Latest approaches on green chemistry preconcentration methods for trace metal determination in seawater: A review // J. Environ. Manag. 2015. V. 151. P. 44.
Regueiro J., Llompart M., Garcia-Jares C., Garcia-Monteagudo J.C., Cela R. Ultrasound-assisted emulsification-microextraction of emergent contaminants and pesticides in environmental waters // J. Chromatogr. A. 2008. V. 1190. P. 27.
Yiantzi E., Psillakis E., Tyrovola K., Kalogerakis N. Vortex-assisted liquid−liquid microextraction of octylphenol, nonylphenol and bisphenol-A // Talanta. 2010. V. 80. P. 2057.
Farajzadeh M.A., Mogaddam M.R.A. Air-assisted liquid−liquid microextraction method as a novel microextraction technique; Application in extraction and preconcentration of phthalate esters in aqueous sample followed by gas chromatography flame ionization detection // Anal. Chim. Acta. 2012. V. 728. P. 31.
Farajzadeh M.A., Seyedi S.E., Shalamzari M.S., Bamorowat M. Dispersive liquid−liquid microextraction using extraction solvent lighter than water // J. Sep. Sci. 2009. V. 32. P. 3191.
Zhou Q., Bai H., Xie G., Xiao J. Trace determination of organophosphorus pesticides in environmental samples by temperature-controlled ionic liquid dispersive liquid-phase microextraction // J. Chromatogr. A. 2008. V. 1188. P. 148.
Farajzadeh M.A., Reza M., Mogaddam A., Aghanassab M. Deep eutectic solvent based dispersive liquid–liquid microextraction // Anal. Methods. 2016. V. 8. 2576.
Leong M.I., Huang S.D. Dispersive liquid–liquid microextraction method based on solidification of floating organic drop combined with gas chromatography with electron-capture or mass spectrometry detection // J. Chromatogr. A. 2008. V. 1211. P. 8.
Chen H., Chen R., Li S. Low-density extraction solvent-based solvent terminated dispersive liquid−liquid microextraction combined with gas chromatography-tandem mass spectrometry for the determination of carbamate pesticides in water samples // J. Chromatogr. A. 2010. V. 1217. P. 1244.
Wang X.C., Shu B., Li S., Yang Z.G., Qiu B. QuEChERS followed by dispersive liquid−liquid microextraction based on solidification of floating organic droplet method for organochlorine pesticides analysis in fish // Talanta. 2017. V. 162. P. 90.
Вах К.С., Тимофеева И.И., Булатов А.В. Автоматизация микроэкстракционного концентрирования на принципах циклического инжекционного анализа // Журн. аналит. химии. 2019. Т. 74. № 11. С. 846.
Крылов А.В., Крылов В.А., Бочкарева Л.В., Мосягин П.В., Маткивская Ю.О. Микроэкстракционное концентрирование примесей с диспергированием экстрагента и капиллярным сбором экстракта // Журн. аналит. химии. 2012. Т. 67. С. 245. (Krylov A.V., Krylov V.A., Bochkareva L.V., Mosyagin P.V., Matkivskaya Yu.O. Microextraction preconcentration of impurities with the dispersion of the extractant and capillary collection of the extract // J. Anal. Chem. 2012. Т. 67. № 3. С. 207.
Крылов В.А., Волкова В.В., Савельева О.А. Микроэкстракционное концентрирование примесей из воды с ультразвуковым диспергированием экстрагента // Аналитика и контроль. 2013. Т. 17. С. 81.
Крылов В.А., Волкова В.В., Мосягин П.В., Кирьянов К.В. Хромато-масс-спектрометрическое определение эфиров о-фталевой кислоты в бутилированной воде с дисперсионным микроэкстракционным концентрированием // Вода: химия и экология. 2013. Т. 60. № 6. С. 85.
Амелин В.Г., Королев Д.С., Третьяков А.В. Сочетание метода QUECHERS с дисперсионной жидкостно-жидкостной микроэкстракцией и получением производных при определении диэтилстильбэстрола и бисфенола А в продуктах питания методом газожидкостной хроматографии // Известия Саратовского университета. Новая серия. Серия: Химия. Биология. Экология. 2012. Т. 12. № 4. С. 17.
Амелин В.Г., Большаков Д.С., Третьяков А.В. Дисперсионная жидкостно-жидкостная микроэкстракция и твердофазная экстракция при извлечении полярных пестицидов из природных вод и определении их методом мицеллярной электрокинетической хроматографии // Журн. аналит. химии. 2013. Т. 68. № 5. С. 430.
Амелин В.Г., Лаврухин Д.К., Третьяков А.В. Дисперсионная жидкостно-жидкостная микроэкстракция при определении гербицидов – производных мочевины в природных водах методом ВЭЖХ // Журн. аналит. химии. 2013. Т. 68. С. 908.
Амелин В.Г., Лаврухин Д.К., Третьяков А.В. Сочетание метода QUECHERS и дисперсионной жидкостно-жидкостной микроэкстракции при идентификации и определении пестицидов различных классов в пищевых продуктах методами газожидкостной хроматографии // Журн. аналит. химии. 2013. Т. 68. С. 1007.
Амелин В.Г., Карасева Н.М., Третьяков А.В. Сочетание метода QUECHERS с дисперсионной жидкостно-жидкостной микроэкстракцией и получением производных при определении микотоксинов в зерне и комбикормах газожидкостной хроматографией с детектором по захвату электронов // Журн. аналит. химии. 2013. Т. 68. С. 612.
Королёв Д.С., Амелин В.Г., Третьяков А.В. Сочетание пробоподготовки QUECHERS и дисперсионной жидкостно-жидкостной микроэкстракции при определении в пищевых продуктах загрязнителей эстрогенного характера методом газожидкостной хроматографии // Вестн. Моск. ун-та. Сер. 2: Химия. 2013. Т. 54. С. 267.
Королёв Д.С., Амелин В.Г., Третьяков А.В. Газожидкостная хроматография и дисперсионная жидкостно-жидкостная микроэкстракция при определении бисфенола А и диэтилстильбэстрола в воде и напитках // Сорбционные и хроматографические процессы. 2013. Т. 13. С. 266.
Карасева Н.М., Амелин В.Г., Третьяков А.В. Сочетание QUECHERS и дисперсионной жидкостно-жидкостной микроэкстракции при определении афлатоксинов B1 и M1 в молоке и молочных продуктах методом ВЭЖХ // Журн. аналит. химии. 2014. Т. 69. С. 510.
Большаков Д.С., Амелин В.Г., Третьяков А.В. Определение гербицидов и их метаболитов в природных водах методом капиллярного зонного электрофореза в сочетании с дисперсионной жидкостно-жидкостной микроэкстракцией и on-line концентрированием // Журн. аналит. химии. 2014. Т. 69. С. 77.
Амелин В.Г., Лаврухин Д.К. Сочетание экстракции с микроволновым нагревом и дисперсионной жидкостно-жидкостной микроэкстракции при определении нитрозаминов в пищевых продуктах методом газожидкостной хроматографии с масс-спектрометрическим детектором // Журн. аналит. химии. 2016. Т. 71. № 4. С. 377.
Bulatov A., Medinskaia K., Aseeva D., Garmonov S., Moskvin L. Determination of antipyrine in saliva using the dispersive liquid−liquid microextraction based on a stepwise injection system // Talanta. 2015. V. 133. P. 66.
Medinskaia K., Vakh Ch., Aseeva D., Andruch V., Moskvin L., Bulatov A. A fully automated effervescence assisted dispersive liquid−liquid microextraction based on a stepwise injection system. Determination of antipyrine in saliva samples // Anal. Chim. Acta. 2016. V. 902. P. 129.
Timofeeva I., Timofeev S., Moskvin L., Bulatov A. A dispersive liquid−liquid microextraction using a switchable polarity dispersive solvent. Automated HPLC-FLD determination of ofloxacin in chicken meat // Anal. Chim. Acta. 2017. V. 949. P. 35.
Колобова Е.А., Карцова Л.А. Применение дисперсионной жидкостно-жидкостной микроэкстракции с использованием в качестве экстрагента 3‑метил-1-октил-имидазолий тетрафторбората для электрофоретического определения стероидных гормонов в образцах мочи // Аналитика и контроль. 2018. Т. 22. № 3. С. 284.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


