Журнал аналитической химии, 2021, T. 76, № 10, стр. 952-958
Использование смартфона для определения тетрациклинов в воде и молоке по сенсибилизированной твердофазной флуоресценции европия на его гидроксиде
В. Г. Амелин a, b, *, З. А. Ч. Шаока a, Д. С. Большаков b
a Владимирский государственный университет имени Александра Григорьевича и Николая Григорьевича Столетовых
600000 Владимир, ул. Горького, 87, Россия
b Федеральный центр охраны здоровья животных
600901 Владимир, мкр. Юрьевец, Россия
* E-mail: amelinvg@mail.ru
Поступила в редакцию 09.03.2021
После доработки 18.03.2021
Принята к публикации 18.03.2021
Аннотация
Изучена возможность определения антибактериальных препаратов тетрациклинового ряда (тетрациклин, доксициклин, окситетрациклин, демеклоциклин, метациклин и хлортетрациклин) в сточных, природных водах и молоке с использованием цифровой цветометрии (смартфона) по сенсибилизированной флуоресценции европия на его гидроксиде. Установлено, что европий(III) образует комплексы с тетрациклинами в щелочной среде и при образовании осадка гидроксида европия его флуоресцентные свойства не изменяются. Цветометрические параметры осадка после его центрифугирования измеряли с помощью смартфона. Пределы обнаружения и определения составили 0.001–0.004 и 0.005–0.01 мкг/мл соответственно для всех рассматриваемых аналитов. Диапазоны определяемых содержаний 0.005 (0.08)–0.1 (1) мкг/мл. Градуировочные зависимости линейны, R2 ≥ 0.98. Предложена методика определения суммарного содержания тетрациклинов в сточных, природных водах и молоке. Продолжительность анализа 20–30 мин, относительное стандартное отклонение результатов анализа не превышает 0.20.
Среди многообразия лекарственных средств антибиотики тетрациклиновой группы уже более полувека используют как препараты широкого спектра действия, в основе антибактериального действия которых лежит подавление синтеза белка. Для данной группы соединений характерно наличие четырехчленного нафтаценового ядра (схема 1 ).
Широкое использование тетрациклинов в ветеринарии приводит к появлению их в продуктах питания (мясо, молоко, рыба) и объектах окружающей среды. В водные объекты тетрациклины попадают со стоками животноводческих ферм, птицефабрик и фармацевтических предприятий. Внесение органических удобрений (навоза) на сельскохозяйственные поля приводит к загрязнению почвы и соответственно сельскохозяйственной продукции. Присутствие остаточных количеств тетрациклинов в воде и почве негативно воздействует на экологический баланс окружающей среды, вызывая устойчивость водных и почвенных микроорганизмов к антибиотикам. Употребление в пищу продуктов, содержащих остатки тетрациклинов, негативно сказывается и на здоровье человека.
В объектах окружающей среды тетрациклины, наряду с другими загрязнителями, чаще всего определяют методом высокоэффективной жидкостной хроматографии, в основном с масс-спектрометрическим детектированием [1, 2]. Определению предшествует этап пробоподготовки с концентрированием тетрациклинов, обычно с использованием метода твердофазной экстракции (ТФЭ). В работе [3] предложено применять сверхсшитый полистирол для ТФЭ тетрациклинов. Разработана методика определения тетрациклинов в водах в диапазоне 0.002–0.1 мкг/мл при концентрировании из 100 мл водного раствора методом ВЭЖХ с амперометрическим детектированием.
Для определения тетрациклинов в различных объектах получили развитие флуориметрические методы анализа. Молекулы тетрациклинов имеют плоское строение (схема 1 ), они способны флуоресцировать при облучении УФ-светом. Кроме того, тетрациклины образуют комплексы с ионами металлов, в частности с европием(III) и тербием(III). В последнем случае это приводит к сенсибилизированной тетрациклинами флуоресценции ионов европия и тербия [4–7].
Схема 1 . Структурные формулы тетрациклина (1), хлортетрациклина (2), демеклоциклина (3), окситетрациклина (4), доксициклина (5), метациклина (6).
Исследовано образование смешанолигандных комплексов европия(III) на поверхности химически модифицированного кремнезема с привитой группой иминодиуксусной кислоты и тетрациклином. Изученный комплекс предложен для люминесцентного определения тетрациклина в растворах. Минимальная определяемая концентрация при извлечении из 10 мл раствора составила 0.5 мкг/мл [8].
В работе [9] тетрациклин определяли в природной воде, молоке и мёде по сенсибилизированной флуоресценции европия на лапоните в присутствии лимонной кислоты в диапазоне 30 нМ–54 мкМ. Предложена индикаторная бумага для определения тетрациклина в молоке в диапазоне 1–100 мкМ при регистрации аналитического сигнала с помощью смартфона.
Предложена методика определения окситетрациклина в мышцах рыбы по сенсибилизированной флуоресценции европия в диапазоне 10–1000 нг/г с пределом обнаружения 3 нг/г [10]. Определение проводили в присутствии хлорида цетилтриметиламмония и ЭДТА в качестве второго лиганда в комплексе европия, что повышало чувствительность определения.
В работе [11] предложено измерять фосфоресценцию хелата европия при комнатной температуре для непосредственного скрининга тетрациклинов (тетрациклин, окситетрациклин, хлортетрациклин и доксициклин) в воде и коровьем молоке. Диапазоны определяемых содержаний тетрациклинов составили 0.2–11.6 пМ для воды и 165–238 пМ для молока.
Предложено определение тетрациклинов в молоке по сенсибилизированной флуоресценции европия на наноплатформе двойного гидроксида магния и алюминия [12]. Диапазон определяемых содержаний тетрациклинов составил 0.1–5.0 мкМ (0.04–2 мкг/мл), предел обнаружения – 7.6 нМ. На наноплатформе дисульфида молибдена предложена чувствительная и селективная методика определения тетрациклинов. Диапазон определяемых содержаний составил 0.1–50 мкМ с пределом обнаружения 0.032 мкМ [13].
Дисперсионную жидкостно-жидкостную микроэкстракцию дихлорметаном применили для извлечения окситетрациклина из мышц рыбы и последующего его определения по сенсибилизированной флуоресценции европия [14]. Диапазон определяемых содержаний составил 0.04–4 мкг/г.
Рассмотренные выше работы объединяет использование для определения тетрациклинов дорогостоящего оборудования (хромато-масс-спектрометров, хроматографов и спектрофлуориметров), что в свою очередь накладывает определенные ограничения на внедрение экспрессных методик в практику аналитических лабораторий, проводящих рутинные мониторинговые исследования. Перспективным направлением для решения подобных задач является применение цифровой цветометрии, которая сочетает доступность визуально-цветометрических тест-систем и хорошие метрологические характеристики инструментальных средств измерения [15]. Отличительной особенностью метода является простота аппаратурного оформления, возможность использования в качестве цветорегистрирующих устройств цифровой фото-, видео- и оптической офисной техники. Миниатюризации метода и повышению его мобильности способствует разработка современных смартфонов и специализированного программного обеспечения [16, 17]. Проведение специфических реакций получения флуоресцирующих производных обеспечивает избирательность и высокую чувствительность цифровой цветометрии, что делает ее конкурентоспособной по сравнению с другими традиционными методами.
Цель данной работы – изучение возможности определения антибактериальных препаратов тетрациклинового ряда в сточных, природных водах и молоке по сенсибилизированной флуоресценции европия на его гидроксиде с использованием смартфона в качестве цветорегистрирующего устройства.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Аппаратура. Для изучения оптических и цветометрических характеристик в качестве цветорегистрирующего устройства использовали смартфон iPhone X (Apple, США), оснащенный специализированным программным обеспечением RGBer. Возбуждение флуоресценции проводили с помощью источника монохроматического излучения Jialitte F114 5W 365NM UV (Shenzhen Jialite Technology Co., Китай), детектора банкнот Dors 60 SYS-033278/277 (DORS, Китай) и осветителя люминесцентного диагностического Лампа Вуда ОЛДД-01 (Россия), УФ с длиной волны 365 нм.
Применяли аналитические весы Pioneer PA 214С специального класса точности с пределом взвешивания 0.1 мг (Ohaus Corporation, USA); систему для упаривания растворителей RapidVap N2/48 (LabConco, США); дозаторы Proline Biohit одноканальные механические переменного объема 2–20 мкл, 100–1000 мкл, 1000–5000 мкл (Biohit, Финляндия); пробирки полипропиленовые емк. 15 мл (SPL Life Sciences Co., Корея); пробирки типа “Эппендорф” емк. 2.0 мл (GenFollower Biotech Co., Китай); политетрафторэтиленовые мембранные фильтры 25 мм с диаметром пор 0.20 мкм (Pall Corporation, США). Использовали центрифуги Elmi CM-50M (Латвия) и MPW-260R (MPW Med. Instruments, Польша).
Реактивы. Использовали стандартные образцы тетрациклина, доксициклина, окситетрациклина, демеклоциклина, метациклина и хлортетрациклина (98–100%, Sigma-Aldrich, США). Исходные стандартные растворы (1 мг/мл) готовили растворением точной навески препаратов в метаноле. Рабочие растворы готовили разбавлением исходных деионизированной водой (15–18 МОм · см, ОСТ 11 029.003-80).
Применяли метанол (Fisher Scientific UK, Великобритания), соляную кислоту (АО “БСК”, Россия), тетраборат натрия (Sigma-Aldrich, США), гексагидрат хлорида европия(III) EuCl3⋅6H2O (Sigma-Aldrich, США), ацетонитрил (Scharlab S.L., Испания), ЭДТА (этилендиаминтетраацетат натрия) (ХИММЕД, Россия), хлорид натрия (ХИММЕД, Россия).
Построение градуировочной зависимости. В пробирки типа “Эппендорф” емк. 2.0 мл вносили 5, 10, 20, 40, 60, 80 и 100 мкл стандартных растворов тетрациклинов с концентрацией 10 мкг/мл (первая серия) и 1 мкг/мл (вторая серия), добавляли 100 мкл 0.01 М раствора европия(III), 1 мл деионизированной воды, 100 мкл 2%-ного раствора тетрабората натрия. Пробирки закрывали, перемешивали 1–2 мин и центрифугировали в течение 1 мин при 15 000 об/мин. Пробирку облучали УФ-светом (365 нм) и с помощью смартфона измеряли цветометрические характеристики розовой флуоресценции. Аналитический сигнал (Ar) в системе RGB рассчитывали по формуле:
Определение тетрациклинов в воде. В пробирки типа “Эппендорф” емк. 2.0 мл вносили 1 мл профильтрованной через мембранный фильтр природной или сточной воды, добавляли 100 мкл стандартного раствора тетрациклина с концентрацией 1 мкг/мл (при использовании метода добавок), 100 мкл 0.01 М раствора европия(III) и 100 мкл 2%-ного раствора тетрабората натрия. Пробирки закрывали, перемешивали 1–2 мин и центрифугировали в течение 1 мин при 15 000 об/мин. Пробирку облучали УФ-светом (365 нм) и с помощью смартфона измеряли цветометрические характеристики розовой флуоресценции. Содержание тетрациклинов определяли по градуировочной зависимости. При использовании метода добавок содержание терациклинов рассчитывали по формуле: сx = сдоб/[(Аx + доб/Аx) – 1], где сдоб – концентрация добавки в пробе, мкг/мл; Аx, Аx + доб – аналитические сигналы в исследуемой пробе и в пробе с добавкой аналита (0.1 мкг/мл) соответственно.
Определение тетрациклинов в молоке. В центрифужную пробирку емк. 15 мл вносили 1.00 мл молока, добавляли 2.0 мл ацетонитрила, 0.5 г NaCl, 40.0 мг ЭДТА и перемешивали в течение 5 мин, центрифугировали в течение 5 мин при 2700 об/мин. Отбирали верхний ацетонитрильный слой во флакон и упаривали досуха при 40°С в токе азота с использованием устройства RapidVap N2/48. К сухому остатку добавляли 50 мкл ацетонитрила и 950 мкл деионизированной воды, перемешивали 5 мин и фильтровали через мембранный фильтр 0.20 мкм в пробирку типа “Эппендорф” емк. 2.0 мл. В полученный раствор вносили 100 мкл 0.01 М раствора европия(III) и 100 мкл 2%-ного раствора тетрабората натрия. Пробирки закрывали, перемешивали 1–2 мин и центрифугировали в течение 1 мин при 15 000 об/мин, облучали УФ-светом (365 нм) и с помощью смартфона измеряли цветометрические характеристики розовой флуоресценции. Содержание тетрациклинов определяли по градуировочной зависимости или расчетным способом по методу добавок.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Аналитические характеристики. В данной работе предложено использовать сенсибилизированную флуоресценцию тетрациклинами европия(III) на поверхности его гидроксида, образующегося в результате гидролиза в щелочной среде (добавление раствора тетрабората натрия) избытка его растворимой соли. Центрифугирование осадка позволило сконцентрировать его на дне пробирки (рис. 1). При облучении осадка ультрафиолетовым светом (365 нм) наблюдали розовую флуоресценцию, интенсивность которой измеряли с помощью смартфона. Высокая разрешающая способность современных смартфонов повышает локальность цифрового анализа, позволяя регистрировать базисные компоненты цветометрической системы RGB осадка небольшого объема.
На градуировочных зависимостях для всех тетрациклинов в диапазоне 0.005–1 мкг/мл имеются два линейных участка: в диапазонах 0.005–0.1 и 0.08–1 мкг/мл (табл. 1). Предел обнаружения (смин) и предел определения (сн) рассчитывали по формулам 3.3s/k и 10s/k соответственно (s – стандартное отклонение аналитического сигнала для холостого опыта, k – тангенс угла наклона градуировочной зависимости). Стандартное отклонение для Ar холостого опыта составило 0.50 (n = 15). В табл. 1 представлены аналитические характеристики методики определения тетрациклинов по сенсибилизированной флуоресценции европия(III) на его гидроксиде с использованием смартфона в качестве цветорегистрирующего устройства. Пределы обнаружения и определения составили 0.001–0.004 и 0.005–0.01 мкг/мл соответственно для всех рассматриваемых аналитов. Диапазоны определяемых содержаний (ДОС) – 0.005 (0.08)–0.1 (1) мкг/мл. Градуировочные зависимости линейны, R2 ≥ 0.98 (табл. 1).
Таблица 1.
Аналитические характеристики определения тетрациклинов для двух линейных диапазонов определяемых содержаний и матричный эффект при анализе природной воды (n = 3, P = 0.95)
| Аналит | смин, мкг/мл | сн, мкг/мл | ДОС, мкг/мл | Уравнение градуировочной зависимости | R2 | МЭ, % |
|---|---|---|---|---|---|---|
| Тетрациклин | 0.001 | 0.005 | 0.005–0.1 | Ar = 1313.7с | 0.9804 | 17 |
| 0.08–1 | Ar = 62.707с + 19.008 | 0.9990 | ||||
| Доксициклин | 0.002 | 0.007 | 0.007–0.1 | Ar = 745.76с | 0.9885 | –19 |
| 0.1–1 | Ar = 33.863с + 25.967 | 0.9969 | ||||
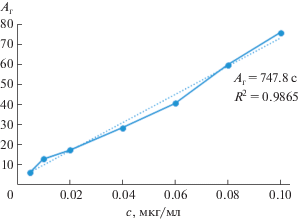
| Окситетрациклин | 0.002 | 0.007 | 0.007–0.1 | Ar = 747.8с | 0.9865 | 4.6 |
| 0.1–1 | Ar = 47.983с + 18.839 | 0.9983 | ||||
| Димеклоциклин | 0.002 | 0.006 | 0.006–0.1 | Ar = 882.49с | 0.9857 | 2.9 |
| 0.06–1 | Ar = 80.349с + 14.366 | 0.9999 | ||||
| Хлортетрациклин | 0.003 | 0.01 | 0.01–0.1 | Ar = 475.03с | 0.9803 | –19 |
| 0.08–1 | Ar = 59.912с + 18.133 | 0.9929 | ||||
| Метациклин | 0.003 | 0.009 | 0.009–0.1 | Ar = 594.35с | 0.9866 | –8.1 |
| 0.06–0.6 | Ar = 88.57с + 8.28 | 0.9869 |
В табл. 2 и на рис. 2 показаны пример расчета аналитического сигнала и градуировочная зависимость для определения окситетрациклина соответственно.
Таблица 2.
Цветометрические характеристики хелата окситетрациклина с европием(III)
| Концентрация, мкг/мл | Значения цветовых каналов/ то же с вычетом холостой пробы | Аналитический сигнал | ||
|---|---|---|---|---|
| Rх/R0 – Rx | Gх/G0 – Gx | Bх/B0 – Bx | ${{A}_{{\text{r}}}} = \sqrt {{{{({{{\text{R}}}_{0}} - {{{\text{R}}}_{x}})}}^{2}} + {{{({{{\text{G}}}_{0}} - {{{\text{G}}}_{x}})}}^{2}} + {{{({{{\text{B}}}_{0}} - {{{\text{B}}}_{x}})}}^{2}}} $ | |
| 0 | 121/0 | 115/0 | 125/0 | – |
| 0.005 | 126/–5 | 118/–3 | 129/–4 | 7 |
| 0.01 | 132/–11 | 121/–6 | 130/–5 | 13 |
| 0.02 | 136/–15 | 109/6 | 133/–8 | 18 |
| 0.04 | 149/–28 | 111/4 | 131/–6 | 29 |
| 0.06 | 160/–39 | 121/–6 | 136/–11 | 41 |
| 0.08 | 180/–59 | 104/11 | 127/–2 | 60 |
| 0.1 | 196/–75 | 116/–1 | 137/–12 | 76 |
Оценка матричного эффекта. Матричный эффект (МЭ) рассчитывали по формуле: МЭ (%) = = (C/D – 1) × 100, где С, D – значения наклонов градуировочных зависимостей, полученных на основе матрицы и деионизированной воды соответственно. Матричный эффект обусловлен влиянием присутствующих в воде соадсорбируемых на гидроксиде европия флуоресцирующих соединений и ионов металлов, способных образовывать с тетрациклинами комплексы. В данных условиях они могут как усиливать (+), так и понижать (–) интенсивность сигнала аналита. Согласно данным [18] МЭ можно пренебречь, когда его значения находятся в диапазоне ±20%. Как видно из табл. 1, МЭ для природной воды (вода р. Клязьма в черте г. Владимира) незначителен и не превышает 19%. При исследовании сточной воды птицефабрики обнаруживали значительный матричный эффект (30–40%). Для его нивелирования пробу воды разбавляли в два раза и использовали метод добавок для определения тетрациклинов.
Анализ природных, сточных вод и молока. Правильность и воспроизводимость результатов определения антибиотиков тетрациклинового ряда подтверждали методом “введено–найдено” на двух уровнях концентраций при использовании природной воды и на одном при использовании молока. Пробоподготовку для определения тетрациклинов в молоке проводили по методике, описанной в работе [19]. Результаты определения, представленные в табл. 3 и 4, свидетельствуют о правильности и хорошей воспроизводимости методики. Относительное стандартное отклонение результатов анализа не превышает 0.20.
Таблица 3.
Результаты определения терациклинов в сточных и природных водах; проверка правильности результатов анализа (n = 3, P = 0.95)
| Аналит | Введено, мкг/л | Найдено, мкг/л | sr |
|---|---|---|---|
| Тетрациклин | 0 | <смин | – |
| 5 | 6 ± 2 | 0.13 | |
| 50 | 60 ± 9 | 0.06 | |
| 0 | 98 ± 15* | 0.06 | |
| Доксициклин | 0 | <смин | – |
| 10 | 8 ± 3 | 0.15 | |
| 50 | 49 ± 9 | 0.07 | |
| Окситетрациклин | 0 | <смин | – |
| 10 | 11 ± 5 | 0.18 | |
| 50 | 56 ± 9 | 0.07 | |
| Димеклоциклин | 0 | <смин | – |
| 10 | 10 ± 4 | 0.16 | |
| 50 | 56 ± 8 | 0.07 | |
| Хлортетрациклин | 0 | <смин | – |
| 10 | 8 ± 4 | 0.20 | |
| 50 | 46 ± 8 | 0.07 | |
| Метациклин | 0 | <смин | – |
| 10 | 12 ± 3 | 0.10 | |
| 50 | 56 ± 7 | 0.07 |
Таблица 4.
Результаты определения терациклинов в молоке; проверка правильности результатов анализа (n = 3, P = 0.95)
| Аналит | Введено, мкг/л | Найдено, мкг/л | sr |
|---|---|---|---|
| Тетрациклин | 0 | <смин | – |
| 10 | 15 ± 3 | 0.12 | |
| Доксициклин | 0 | <смин | – |
| 10 | 9 ± 4 | 0.20 | |
| Окситетрациклин | 0 | 23 ± 9 (18*) | 0.16 |
| 10 | 38 ± 8 | 0.08 | |
| Димеклоциклин | 0 | < смин | – |
| 10 | 16 ± 8 | 0.20 | |
| Хлортетрациклин | 0 | < смин | – |
| 10 | 9 ± 4 | 0.20 | |
| Метациклин | 0 | < смин | – |
| 10 | 11 ± 3 | 0.11 |
* Результат анализа пробы молока, в которой обнаружен окситетрациклин методом хромато-масс-спектрометрии [19].
Список литературы
Hu X., Zhou Q., Luo Yi. Occurrence and source analysis of typical veterinary antibiotics in manure, soil, vegetables and groundwater from organic vegetable bases, northern China // Environ. Pollut. 2010. V. 158. P. 2992.
Kim H., Hong Y., Park J., Sharma V.K., Cho S. Sulfonamides and tetracyclines in livestock wastewater // Chemosphere. 2013. V. 91. P. 888.
Удалова А.Ю., Дмитриенко С.Г., Натчук С.В., Апяри В.В., Золотов Ю.А. Концентрирование антибиотиков тетрациклиновой группы на сверхсшитом полистироле и их определение в водах методом высокоэффективной хидкостной хроматографии // Журн. аналит. химии. 2015. Т. 70. № 3. С. 273.
Georges J. Lanthanide-sensitized luminescence and applications to the determination of organic analytes. A review // Analyst. 1993. V. 118. P. 1481.
Hirschy L.M., Dose E.V., Winefordner J.D. Lanthanidesensitized luminescence for the detection of tetracyclines // Anal. Chim. Acta. 1983. V. 147. P. 311.
Rodriguez-Diaz R.C., Aguilar-Caballos M.P., Gomez-Hens A. Simultaneous determination of ciprofloxacin and tetracycline in biological fluids based on dual-lanthanide sensitized luminescence using dry reagent chemical technology // Anal. Chim. Acta. 2003. V. 494. P. 55.
Паращенко И.И., Смирнова Т.Д., Штыков С.Н., Кочубей В.И., Жукова Н.Н. Твердофазная, сенсибилизированная доксициклином, флуоресценция европия на силикагеле в присутствии ПАВ // Журн. аналит. химии. 2013. Т. 68. № 2. С. 125.
Тихомирова Т.И., Смирнов В.С., Быстров В.Ю. Определение тетрациклина по сенсибилизированной люминесценции европия(III), сорбированного на кремнеземе, химически модифицированном группами иминодиуксусной кислоты // Вестн. Моск. ун-та. Сер. 2. Химия. 2008. Т. 49. № 5. С. 344.
Xu J., Guo S., Jia L., Zhu T., Chen X., Zhao T. A smartphone-integrated method for visual detection of tetracycline // Chem. Eng. 2020. Article 127741.
Chen G., Schneider M.J., Darwish A.M., Lehotay S.J., Freeman D.W. Europium-sensitized luminescence determination of oxytetracycline in catfish muscle // Talanta. 2004. V. 64. P. 252.
Li X., Fan K., Yang R., Du X., Qu B., Miao X., Lu L. A long lifetime ratiometrically luminescent tetracycline nanoprobe based on Ir(III) complex-doped and Eu3+-functionalized silicon nanoparticles // J. Hazard. Mater. 2020. V. 386. Article 121929.
Traviesa-Alvarez J.M., Costa-Fernandez J.M., Pereiro R., Sanz-Medel A. Direct screening of tetracyclines in water and bovine milk using room temperature phosphorescence detection // Anal. Chim. Acta. 2007. V. 589. P. 51.
Zhou Z., Li X., Gao J., Tang Y., Wang Q. Tetracycline generated red luminescence based on a novel lanthanide functionalized layered double hydroxide nanoplatform // J. Agric. Food Chem. 2019. V. 67. P. 3871.
Jia P., Bu T., Sun X., Liu Y., Liu J., Wang Q., Shui Y., Guo S., Wang L. A sensitive and selective approach for detection of tetracyclines using fluorescent molybdenum disulfide nanoplates // Food Chem. 2019. V. 297. P. 124969.
Моногарова О.В., Осколок К.В., Апяри В.В. Цветометрия в химическом анализе // Журн. аналит. химии. 2018. Т. 73. № 11. С. 857.
Lima M.J.A., Nascimento C.F., Rocha F.R.P. Feasible photometric measurements in liquid-liquid extraction by exploiting smartphone-based digital images // Anal. Methods. 2017. V. 9. № 14. P. 2220.
Acevedo M.S. F., Lima M.J.A., Nascimento C.F., Rocha F.R.P. A green and cost-effective procedure or determination of anionic surfactants in milk with liquid-liquid microextraction and smartphone-based photometric detection // Microchem. J. 2018. V. 143. P. 259.
Ferrer C., Lozano A., Aguera A., Giron A.J., Fernandez A.R. Overcoming matrix effects using the dilution approach in multiresidue methods for fruits and vegetables // J. Chromatogr. A. 2011. V. 1218. P. 7634.
Амелин В.Г., Большаков Д.С., Подколзин И.В. Быстрый скрининг и определение остаточных количеств β-лактамных антибиотиков в пищевых продуктах методом ультравысокоэффективной жидкостной хроматографии–квадруполь-времяпролетной масс- спектрометрии высокого разрешения // Журн. аналит. химии. 2020. Т. 75. № 9. С. 806.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии