Журнал аналитической химии, 2021, T. 76, № 11, стр. 989-996
Спектрометрия ионной подвижности имидазола и возможности его определения
Д. А. Александрова a, *, Т. Б. Меламед a, Е. П. Баберкина a, А. Е. Коваленко a, Вл. Вит. Кузнецов a, Вит. Вл. Кузнецов a, А. А. Фенин a, Ю. Р. Шалтаева b, В. В. Беляков b
a Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Миусская пл., 9, Россия
b Национальный исследовательский ядерный университет “МИФИ”
115230 Москва, Каширское шоссе, 31, Россия
* E-mail: dasha-25.2012@yandex.ru
Поступила в редакцию 01.04.2021
После доработки 06.05.2021
Принята к публикации 13.05.2021
Аннотация
Определены значения времени дрейфа и ионной подвижности имидазола. Разработана методика математической обработки спектров. Изучены особенности изменения характера спектра ионной подвижности в процессе измерения в определенный момент времени. Предложено строение генерируемых ионов в соответствии с интерпретацией сигналов спектра. Оценены энтальпии образования генерируемых ионов. Выявлен характеристический сигнал иона имидазола, протонированного по атому азота пиридинового типа. Определен предел обнаружения имидазола при регистрации детектором “Кербер”, составляющий 0.3 нг.
Современным экспресс-методом анализа химических соединений, в том числе в газовой фазе, является спектрометрия ионной подвижности [1, 2]. На предел обнаружения и разрешение метода влияют многие факторы, в том числе влажность и температура воздуха в процессе измерения. Их совместное воздействие пока недостаточно исследовано. Изменения характера сигнала во времени в процессе измерения практически не изучены, и возможные ион-молекулярные реакции, происходящие в дрейфовом пространстве, значительно усложняют достоверную интерпретацию спектров ионной подвижности. Однако быстродействие, высокая чувствительность, отсутствие необходимости применения вакуумных систем и радиоактивного источника ионизации, а также портативность прибора делают метод перспективным для решения широкого круга аналитических задач [3–6].
Современные спектрометры ионной подвижности настроены на обнаружение узкого круга соединений, чаще всего известных наркотических и взрывчатых веществ с хорошо изученным спектром ионной подвижности [3, 7]. В последнее время широкое распространение получили синтетические наркотики с видоизмененной химической формулой, в структуре молекул которых присутствуют фрагменты азотсодержащих гетероциклов [7–10]. Данные соединения сложно идентифицировать из-за их постоянной модификации. Чтобы упростить процедуру выявления средств, которые обладают биологической активностью, но не внесены в “Перечень наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации”, нами предложено применить ионно-дрейфовый детектор “Кербер”, который уже используют в МВД, ФСБ и ФТС России. В качестве объекта исследования целесообразно выбрать термически устойчивый имидазол, информация о ионизации которого в дрейфовой камере спектрометра ионной подвижности в литературе практически не представлена [11–13]. Установление характеристического сигнала имидазола позволит отслеживать вещества, имеющие в своей структуре фрагмент имидазола.
Известно, что имидазол и его производные оказывают возбуждающее действие на центральную нервную систему, угнетают кортикальные нейроны, облегчают нервно-мышечную передачу (увеличивает вероятность освобождения вещества-медиатора), усиливают действие анальгетиков и анестетиков, увеличивают силу сердечных сокращений и являются фрагментом синтетических каннабиноидов, например [1-(5-фторопентил)-1Н-бензимидазол-2-ил](нафтален-1-ил)метанона [13]. Исследование поведения имидазола и его производных в условиях спектрометрии ионной подвижности весьма актуально при разработке методик определения синтетических каннабиноидов, содержащих в своей структуре фрагменты азотсодержащих гетероциклов, в том числе имидазола. Расширение возможностей метода представляет большой теоретический и практический интерес.
Цель настоящей работы состояла в определении характерных сигналов имидазола в спектрах ионной подвижности, отнесении их к соответствующим структурам и в оценке возможности количественного определения имидазола.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование и реактивы. Использовали ионно-дрейфовый детектор (ИДД) “Кербер” [14], работающий по методу спектрометрии ионной подвижности (Южполиметалл-Холдинг, Россия). Параметры, определяющие возможности метода, приведены в табл. 1.
Таблица 1.
Технические характеристики ионно-дрейфового детектора “Кербер”
| Характеристика | Значение для ИДД “Кербер” | |
|---|---|---|
| Диапазон определяемых содержаний малолетучих органических веществ по 2,4,6-тринитротолуолу, г | От 1.0 × 10–11 до 2.0 × 10–7 | |
| Предел обнаружения малолетучих органических веществ по 2,4,6-тринитротолуолу | ||
| по твердым частицам, г | Не более 1.0 × 10–11 | |
| по парам, г/см3 | Не более 1.0 × 10–14 | |
| Способ ионизации | Импульсный коронный разряд | |
| Температура дрейфовой трубки, °С | 100 | |
| Время обнаружения и идентификации для всех обнаруживаемых веществ, с |
Не более 5 | |
| Вероятность ложного срабатывания, % | Не более 1 | |
| Время очистки детектора при загрязнении целевыми веществами в пределах диапазона детектирования, мин | Не более 3 | |
Программное обеспечение ИДД “Кербер” позволяет сохранять результаты измерений (факты обнаружения целевых веществ) в двух форматах. “Спектр” – текстовый файл, содержащий данные о параметрах системы, информацию об обнаруженных целевых веществах и отсчеты ионограммы. “Фильм” – двоичный файл, содержащий параметры градуировки и динамику изменения ионограммы за 20 с работы детектора.
В данной работе приведены спектры ионной подвижности ИДД “Кербер” серий “Classic” и “Next”. Ионно-дрейфовый детектор “Кербер” серии “Classic” получил широкое распространение на мировом рынке технических средств безопасности, при этом прибор ИДД “Кербер” серии “Next” отличатся быстродействием и наличием двуполярного режима детектирования ионов, что позволяет определять соединения разных классов при различных типах ионизации одновременно [15]. Это полезно в анализе объектов, которые могут содержать наркотические и взрывчатые вещества, поэтому исследования проводили на двух сериях приборов.
Использовали препарат имидазола ООО “Кемикал Лайн” (Россия) чистотой 99%.
В работе применяли весы марки A&D GR-120 с дискретностью 0.0001 г.
Для определения предела чувствительности использовали дозатор марки Ленпипет Лайт 1–10 мкл.
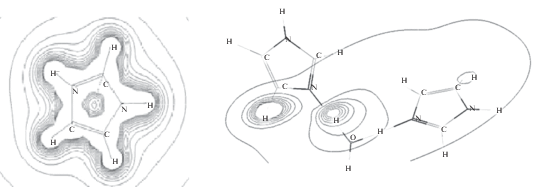
Распределение электростатического потенциала иона рассчитывали в программе HyperChem 7 полуэмпирическим методом расчета РМ3.
Специфика спектрометрии ионной подвижности. Метод спектрометрии ионной подвижности (СИП) основан на ионизации молекул исследуемого вещества при атмосферном давлении. Сначала в разрядной камере образуются реактант-ионы, концентрация которых существенно превышает концентрацию определяемых веществ. При попадании в прибор целевых веществ реактант-ионы передают молекулам заряд по механизму химической ионизации при атмосферном давлении.
Образование ионов в области положительной ионизации. Молекулы исследуемого вещества при столкновении с реактант-ионами образуют кластерные ионы, которые превращаются в более стабильные кластерные гидратированные ионы, отщепляя молекулы воды:
Образовавшийся в этом процессе продукт-ион называют “протонированным мономером”. Возможно образование протонированного димера MH+(H2O)n и других молекулярных ионов. Количество молекул воды в кластере варьируется от 1 до 3 в зависимости от природы соединения [2].
Ионизированные молекулы различных веществ имеют разную скорость движения в дрейфовой камере в зависимости от их заряда, массы и эффективного сечения образовавшегося иона. Молекулярные ионы разных соединений отличаются временем прибытия τd к коллектору, что позволяет определить их природу.
Это время пропорционально длине дрейфовой камеры L (см) и обратно пропорционально градиенту электрического поля Е:
где K – коэффициент подвижности, см2/(В c).Ионная подвижность зависит от температуры и колебаний давления. Для сравнения значений ионной подвижности, полученные в разных условиях, величины K приводят к нормальным условиям:
где T — температура (К) и P – давление (мм рт. ст.) в газовой атмосфере, в которой движутся ионы. K0 называют приведенной подвижностью (или приведенным коэффициентом подвижности) [2]. В данной работе оперировали значениями приведенной ионной подвижности. Результаты могут быть представлены в виде “спектра” ионной подвижности (ионограммы).Методика. Спектры ионной подвижности получали при атмосферном давлении, в качестве дрейфового газа использовали окружающий воздух.
Для выявления изменения характера спектра ионной подвижности его регистрировали каждую секунду после ввода пробы до исчезновения сигнала. Такой способ измерения позволяет увидеть, какой сигнал характеризует основной ион, количество возможных типов ионов, существует ли взаимопревращение ионов по мере прохождения дрейфовой камеры.
Отбор пробы проводили при комнатной температуре или при нагревании подложки до 80–120°С в течение 5 с. Установлено, что время дрейфа для имидазола не зависит от температуры, при которой происходит забор образца. В дальнейшем отбор пробы проводили при нагревании с целью получения более интенсивного сигнала.
В зарегистрированных спектрах необходимо отделять сигналы фоновых соединений, присутствующих в воздухе, от сигналов ионов аналита, поскольку измерение на ионно-дрейфовом детекторе проводится при атмосферном давлении. Для этой цели в ходе эксперимента дополнительно разработали специальный способ математической обработки спектров, позволяющий точно и надежно выявлять сигналы аналитов и анализировать изменение интенсивности собственно характеристических сигналов в спектрах. Данный прием реализован в пакете Microsoft Office Excel. При вычитании фонового сигнала по формуле
Функцию, соответствующую полученному в результате измерений набору точек, определить с достаточной точностью не удалось. В связи с этим использовали метод средних прямоугольников. Возможность использования этого метода обусловлена тем, что он разработан для графического расчета площади криволинейных трапеций, которыми с точки зрения математического анализа являются все пики на ионограмме. В качестве ширины каждого прямоугольника выбирали разность значений между двумя соседними точками на оси ионной подвижности. За высоту прямоугольника принимали 1/2 суммы значений между соответствующими точками по оси ионного тока. Для расчета площади каждого прямоугольника Si применили формулу вида (табл. 2):
Таблица 2.
Расчет площадей пиков
| А | B | C | D | |
|---|---|---|---|---|
| 1 | ионная подвижность | обработанные данные | площадь прямоугольника, Si | площадь выбранного участка, S |
| 2 | 1.589055 | 25 | 0.05654 | 0.1225 |
| 3 | 1.587072 | 32 | 0.06530 | |
| 4 | 1.585093 | 34 | 0.05724 | |
| 5 | 1.583119 | 24 |
Площади прямоугольников рассчитывали для всего диапазона значений, исключая последнее. Далее по спектру определяли границы по оси абсцисс, в пределах которых был зарегистрирован пик. Площадь пика находили суммированием площадей прямоугольников по формуле вида (Excel): S = СУММ(С3:С4). Таким образом определяли площади всех полученных сигналов, а по зависимости площади пика от времени оценивали изменение площадей пиков во времени. Количество значащих цифр при выполнении расчетов устанавливали, исходя из возможностей пакета Microsoft Office Excel.
В данной работе реализовали метод определения предела обнаружения с использованием минимального количества образца для получения сигнала амплитудой 20 ЕМЗР. При детектировании некоторых веществ спектрометром ионной подвижности массой порядка 1 мкг может наблюдаться перегрузка прибора. В связи с этим сначала приготовили раствор имидазола в диэтиловом эфире с концентрацией 0.3 г/л. Один микролитр раствора наносили дозатором на алюминиевую фольгу. После испарения растворителя на фольге оставалось 3 × 10–7 г остатка. Пробу отбирали при нагревании в течение 5 с. Получили спектр амплитудой 4000 ЕМЗР. Затем методом разбавления раствора понижали концентрацию раствора на один порядок, пока не получили сигнал 20 ЕМРЗ для 0.3 нг.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Была получена серия спектров образцов имидазола при различных концентрациях и проведена их математическая обработка с целью приблизительной оценки относительных количеств ионов.
На рис. 1 приведены ионограммы имидазола и пиридина. Как видно, в обоих спектрах ионной подвижности имеется сигнал в области 2.1 см2/(В c), отнесенный к протонированной форме мономера по пиридиновому атому азота, что согласуется с предварительными исследованиями других гетероциклических соединений [16–18]. В спектре имидазола (рис. 1) также регистрируется второй сигнал 1.7 см2/(В c), отнесенный к протонированной форме его димера.
Спектры ионной подвижности имидазола исследовали при различных концентрациях для установления иона, соответствующего второму регистрируемому пику (ионограммы приведены на рис. 2–5). Сначала выполняли измерения для проб имидазола массой 100 мг и 100 мкг на ионно-дрейфовом детекторе “Кербер” серии “Classic”. Как видно из рис. 2, происходит одновременный рост, а затем уменьшение интенсивности сигналов обоих пиков, причем пику с большей ионной подвижностью отвечает большее значение ионного тока. Изменение площадей пиков полностью коррелирует с интенсивностью сигналов, что свидетельствует об одновременном присутствии двух ионов. Один из них с меньшей ионной подвижностью соответствует иону димера имидазола.
Рис. 2.
(а) Зависимость площадей пиков от времени регистрации спектра имидазола массой 100 мкг (1 – мономер, 2 – димер). (б) Изменение во времени спектра имидазола массой 100 мкг; спектры ионной подвижности регистрировали через 1 (1), 2 (2), 3 (3), 4 (4) 5 (5) cекунд после начала измерения на ионно-дрейфовом детекторе “Кербер” серии “Clas-sic”.

Рис. 3.
(а) Зависимость площадей пиков от времени регистрации спектра имидазола массой 100 мг (1 – мономер, 2 – димер). (б) Изменение во времени спектра имидазола массой 100 мг; спектры ионной подвижности регистрировали через 1 (1), 2 (2), 3 (3), 4 (4) 5 (5) cекунд после начала измерения на ионно-дрейфовом детекторе “Кербер” серии “Clas-sic”.
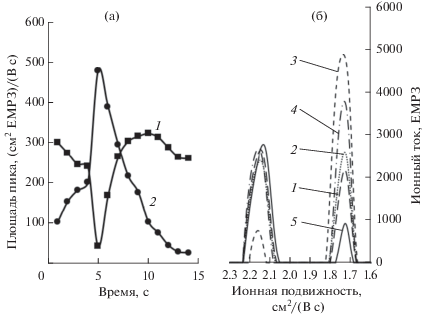
Рис. 4.
(а) Зависимость площадей пиков от времени регистрации спектра имидазоламассой 100 мкг (1 – мономер, 2 – димер). (б) Изменение во времени спектра имидазола массой 100 мкг; спектры ионной подвижности регистрировали через 1 (1), 2 (2), 3 (3), 4 (4) 5 (5) c после начала измерения на ионно-дрейфовом детекторе “Кербер” серии “Next”.

Рис. 5.
(а) Зависимость площадей пиков от времени регистрации спектра имидазола массой 100 мг (1 – мономер, 2 – димер). (б) Изменение во времени спектра имидазола массой 100 мг; спектры ионной подвижности регистрировали через 1 (1), 2 (2), 3 (3), 4 (4) 5 (5) c после начала измерения на ионно-дрейфовом детекторе “Кербер” серии “Next”.

При увеличении массы пробы в спектре происходят следующие изменения (рис. 3). Значения ионной подвижности для обоих сигналов остаются постоянными и соответствуют ионной подвижности образца имидазола массой 100 мкг (рис. 2). Однако интенсивности сигналов перераспределяются. Сигналы ионов димера и мономера имидазола появляются одновременно. Далее амплитуда сигнала иона димера увеличивается и достигает максимального значения на пятой секунде (ионограмма 3 рис. 3), что подтверждает анализ площадей пиков имидазола в высокой концентрации. При понижении концентрации имидазола в пробе в спектрометре ионной подвижности начинается разрушение димера за счет столкновения с молекулами окружающего газа. Как следствие, происходит увеличение количества мономера, что также отражается в спектре ионной подвижности.
Аналогичные исследования провели с использованием ионно-дрейфового детектора “Кербер” серии “Next” (рис. 4, 5). Установили, что сначала спектрометр регистрирует димерную форму имидазола с подвижностью 1.7 см2/(В c) (рис. 4). Далее при уменьшении количества имидазола наблюдается уменьшение площади пика димерной формы. Соответственно площадь пика мономера постепенно возрастает и становится основной в процессе измерения. Соотношение площадей пиков мономерной и димерной форм соответствует предыдущей серии исследований.
Отметим, что в начале измерений пробы имидазола массой 100 мг в момент предполагаемой максимальной концентрации введенной пробы в спектрометре регистрируется в основном сигнал димерной формы, сигнал мономера практически отсутствует, что иллюстрирует рис. 5. В дальнейшем сигнал мономерa возрастает, а сигнал димера уменьшается, и соотношение площадей пиков димерной и мономерной форм остается постоянным до конца измерения.
В ходе исследования спектров ионной подвижности незамещенного имидазола установлено, что при регистрации необходимо учитывать наличие сигналов двух форм. Точно установлено, что сигнал 2.1 см2/(В c) соответствует мономерной форме, а сигнал 1.7 см2/(В c) – димерной форме. С помощью программы Hypercube HyperChem 8.0 полуэмпирическим методом РМ3 определили распределения электростатического потенциала, оценили энтальпии образования ионов мономера и димера имидазола (рис. 6, табл. 3) [19]. Имидазол можно регистрировать по двум пикам одновременно или по каждому сигналу индивидуально.
* * *
На примере имидазола установлено, что два сигнала в спектрах ионной подвижности соответствуют мономерной и димерной формам ионов имидазола. Выявлено, что по мере прохождения ионами аналита дрейфовой камеры происходит перераспределение интенсивностей пиков. Димерная форма имидазола в начале измерения переходит в мономерную форму. Сигнал иона, протонированного по пиридиновому атому азота, возникает в достаточно узком интервале ионной подвижности 2.1 см2/(В c) (относительная погрешность 0.7%) и может служить характерным сигналом для идентификации пиридинового атома азота в молекуле. Определен предел обнаружения имидазола, равный 0.3 нг.
Список литературы
Буряков И.А. Российские публикации 1991–2010 годов, посвященные методу спектрометрии ионной подвижности // Журн. аналит. химии. 2011. Т. 66. № 11. С. 1210.
Eiceman G.A., Kapras Z., Hill H.H., Jr. Ion Mobility Spectrometry. 3rd Ed. Boca Raton, USA, FL: Taylor&Francis, CRC Press, 2014. 444 p.
Буряков И.А., Коломиец Ю.Н., Луппу В.Б. Обнаружение паров взрывчатых веществ в воздухе с помощью спектрометра нелинейности дрейфа ионов. // Журн. аналит. химии. 2001. Т. 56. С. 381.
Крисилова Е.В., Левина А.М., Макаренко В.А. Определение летучих компонентов растительных масел с помощью спектрометра ионной подвижности // Журн. аналит. химии. 2014. Т. 69. № 4. С. 414.
Hana Hai-yan, Wanga Hong-mei, Jiang Hai-he, Stanob Michal, Sabob Martin, Matejcikb Stefan, Chu Yan-nan. Corona discharge ion mobility spectrometry of ten alcohols // Chin. J. Chem. Phys. 2009. V. 22. № 6. P. 604.
Yang Liu Sihou, Huihui, Huang Xi, Zhan Lingpeng, Luo Peiqi, Xue Jinjuan, Chen Rui, Nie Zongxiu. The metabolism and distribution of imidazole alkaloids from Lepidium meyenii (Maca) in mouse by matrix-assisted laser desorption/ionization mass spectrometry imaging // Int. J. Mass spectrom. 2018. V. 434. P. 93.
Byungsuk Cho, Han Soo Cho, Junghyun Kim, Juhyun Sim, Ilung Seol, Seung Kyung Baeck, Sangwhan In, Dae Hwan Shin, Eunmi Kim. Simultaneous determination of synthetic cannabinoids and their metabolites in human hair using LC-MS/MS and application to human hair // Forensic Sci. Int. 2020. V. 306. Article 110058.
Liao S., Liang X. Rapid measurement of phthalic acid ester environmental hormones using ion mobility spectrometry // Int. J. Ion Mobil. Spectrom. 2020. V 23. P. 97.
Tose Lilian V., Santos Nayara A., Rodrigues Rayza R.T., Murgu Michael, Santos Alexandre F., Vasconcelos Gessica A., Souza Paulo T.C., Vaz Boniek G., Romao Wanderson. Isomeric separation of cannabinoids by UPLC combined with ionic mobility mass spectrometry (TWIM-MS) – Part I // Int. J. Mass Spectrom. 2016. V. 418. P. 112.
Zhou Z.G., Yang B.F., Wu G., Zhou X.J. Review of modern analytical techniques for determination and identification of synthetic cannabinoids // Chin. J. Forensic Med. 2015. V. 30. P. 594.
Charlton Andrew J.A., Jones Ainsley. Determination of imidazole and triazole fungicide residues in honeybees using gas chromatography–mass spectrometry // J. Chromatogr. A. 2007. V. 1141. № 1. P. 117.
Marques Lino, Anibal T. de Almeida. Application of Odor Sensors in Mobile Robotics. Autonomous Robotic Systems, London: Springer, 1998. P. 82.
Schofield K., Grim-mett M.R., Keene B.R.T. Heteroaromatic Nitrogen Compounds: The Azoles. Cambridge: Cambridge University Press, 1976. 437 p.
Южполиметалл-холдинг. Портативный ионно-дрейфовый детектор “Кербер-Т” URL: http://www.analizator.ru/production/ims/kerber-t/ (12.04.2021).
Громов Е.А. Система регистрации и управления спектрометрическим каналом двухполярного спектрометра ионной подвижности. Дис. … канд. техн. наук. Москва: Институт нанотехнологий в электронике, спинтронике и фотонике национального исследовательского ядерного университета “МИФИ”, 2018. 160 с.
Александрова Д.А., Бабёркина Е.П., Гришин С.С., Гущина А.А., Курбанова Д.М., Трефилова В.В., Коваленко А.Е., Шалтаева Ю.Р., Беляков В.В. Исследование спектров ионной подвижности азотсодержащих гетероциклов на ионно-дрейфовом детекторе “Кербер” / Тез. докл. ХХII Всероссийской конференции молодых ученых-химиков (с международным участием). Нижний Новгород, 2019. С. 277.
Александрова Д.А., Бабёркина, Е.П., Дубкина Е.А., Коваленко А.Е., Шалтаева Ю.Р., Беляков В.В. Исследование спектров ионной подвижности ароматических азотсодержащих гетероциклических соединений на ионно-дрейфовом детекторе “Кербер” / Тез. докл. Актуальных аспектов химической технологии биологически-активных веществ: сб. научных трудов. Москва, 2020. С. 34.
Grishin S.S., Negru K.I., Baberkina E.P., Kovalenko A.E., Gushchina A.A., Aleksandrova D.A., Shutova Y.E., Zharikov A.P., Dorskaya E.V., Shaltaeva Y.R., Belyakov V.V., Golovin A.V., Gromov E.A., Matusko M.A., Khamraev V.F. The influence of chemical structure of nitrogen-containing heterocyclic compounds on the character of ion mobility spectra // J. Phys.: Conf. Ser. 2019. V. 498. № 1. P. 1.
Gabelica Valérie, Marklund Erik. Fundamentals of ion mobility spectrometry. // Curr. Opin. Chem. Biol. 2018. V. 42. P. 51.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии