Журнал аналитической химии, 2021, T. 76, № 5, стр. 399-407
Концентрирование гидрофильных фосфорорганических веществ на сорбенте Hypercarb
Е. Н. Гончарова a, М. А. Статкус a, Г. И. Цизин a, *
a Московский государственный университет имени М.В. Ломоносова, химический факультет
119992 Москва, Ленинские горы, 1, стр. 3, Россия
* E-mail: tsisin@analyt.chem.msu.ru
Поступила в редакцию 14.12.2020
После доработки 21.12.2020
Принята к публикации 25.12.2020
Аннотация
Исследована сорбция и десорбция ряда гидрофильных фосфорорганических веществ (алкилфосфоновых и О-алкилалкилфосфоновых кислот, глифосата, глифосата и аминометилфосфоновой кислоты) из водной среды при использовании пористого графитированного углерода (сорбента Hypersep Hypercarb). Показано, что указанные аналиты количественно извлекаются на миниколонках размером 30 × 2.1 мм при скорости пропускания раствора 0.5–0.75 мл/мин. Для эффективной десорбции алкилфосфоновых кислот предложено использовать 0.5%-ный водный раствор формиата аммония, О-алкилалкилфосфоновых кислот – субкритическую воду при 200°С, глифосата, глифосата и аминометилфосфоновой кислоты – 1%-ный раствор аммиака в 80%-ном метаноле. В этих условиях могут быть достигнуты высокие коэффициенты концентрирования аналитов (90–150).
Фосфорорганические соединения, как правило, токсичны, либо являются продуктами разложения высокотоксичных веществ, поэтому необходима разработка простых, надежных и высокочувствительных методов их определения в объектах окружающей среды, пищевых продуктах, биомедицинских и других объектах. Так, например, алкилфосфоновые кислоты (АФК) и О‑алкилалкилфосфоновые кислоты (О-ААФК) являются маркерами применения химического оружия [1], а глифосат (N-(фосфометил)глицин) и глюфосинат (аммоний DL-гомоаланин-4-ил-(метил)фосфинат) – неселективными гербицидами [2]. В разных странах установлены различные нормативы по предельно допустимым содержаниям (ПДК) глифосата в объектах окружающей среды и пищевых продуктах, диапазон составляет от 0.05 до 500 мг/кг. Так, в России ПДК глифосата в водах составляет 0.1 мг/дм3, а для пищевых продуктов эти значения установлены в диапазоне от 0.02 до 5 мг/кг в зависимости от вида продукции [3]. Для алкилалкилфосфоновых и алкилфосфоновых кислот нет установленных ПДК. Однако увеличение чувствительности разрабатываемых методов их определения обеспечивает возможность получения информации о событиях большей давности, касающихся применения химического оружия.
Предложены многочисленные способы определения большинства указанных аналитов с применением газовой хромато-масс-спектрометрии (ГХ–МС) с электронной и химической ионизацией; их достоинством являются высокая чувствительность и возможность идентификации аналитов по библиотекам масс-спектров [4]. Однако из-за нелетучести этих аналитов перед ГХ-анализом необходимо провести их дериватизацию, а при анализе водных образцов необходима замена растворителя на органический. Эти шаги отнимают много времени и могут быть источником погрешностей при количественном определении, например, за счет неколичественной дериватизации аналитов в присутствии сопутствующих веществ.
Альтернативным методом определения АФК, О-ААФК и перечисленных выше пестицидов является ВЭЖХ [5, 6], которую применяли для решения таких задач в обращенно-фазовом, ионном и HILIC вариантах [2, 4, 5]. Метод, как правило, не требует дериватизации аналитов и замены воды на органический растворитель, тем самым сводя к минимуму вероятность потери определяемых веществ перед анализом, и позволяет проводить анализ без длительной пробоподготовки. Из-за низкого поглощения аналитов в УФ-области и отсутствия способности к флуоресценции, их можно надежно детектировать только с использованием масс-спектрометрии (МС), одновременно проводя идентификацию по молекулярной массе. Детектирование по светорассеянию, кондуктометрическое, непрямое УФ и пламенно-фотометрическое детектирование также применяют, но эти методы не позволяют надежно идентифицировать аналиты, поэтому они подходят только для быстрого скрининга [6].
АФК и О-ААФК в водной среде являются умеренно сильными кислотами (рKа = 2.0–2.5), что позволяет определять их методом ионной хроматографии. Ионохроматографическое определение предполагает проведение весьма трудоемкой процедуры пробоподготовки для уменьшения влияния сопутствующих ионов [7, 8].
Привлекательно использование обращенно-фазовой хроматографии, однако небольшие высокополярные молекулы, такие как АФК, без дериватизации слабо удерживаются на неполярных сорбентах [9]. В связи с этим актуален поиск новых неполярных неподвижных фаз и подбор условий разделения аналитов, в первую очередь состава подвижных фаз, для анализа смесей указанных гидрофильных фосфорорганических соединений.
Высокочувствительное определение токсичных фосфорорганических веществ, а также их метаболитов в сложных по составу объектах, не может ограничиваться выбором условий разделения этих веществ. В общем случае требуется разработка процедур, обеспечивающих сброс матричных компонентов образцов, а также повышение чувствительности определения аналитов. Для этого используют хроматографические системы с двумя колонками. На небольшой первой колонке аналиты концентрируют, не обращая внимание на их разделение [10]. Соответственно и требования к сорбенту для концентрирования иные, чем для сорбента для разделения. Часто используют сорбент с более крупными частицами, чем хроматографический. Однако появляются дополнительные требования к макросоставу концентрата: его компоненты не должны мешать последующему разделению аналитов на второй (хроматографической) колонке.
В многочисленных работах продемонстрирована эффективность извлечения гидрофильных веществ из водных растворов на углеродных сорбентах, прежде всего на пористом графитированном углероде [11]. Отмечено, что универсальность применения пористого графитированного углерода (ПГУ) для разделения и концентрирования обусловлена проявлением как дисперсионных взаимодействий, так и эффектами полярного удерживания ионизированных и полярных аналитов, а плоская поверхность графитовых лент обеспечивает сорбентам такого типа дополнительную селективность при разделении структурно родственных соединений (например, изомеров).
Целью настоящей работы являлась разработка способов концентрирования указанных гидрофильных фосфорорганических веществ на пористом графитированном углеродном сорбенте для повышения чувствительности их определения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Растворы и реагенты. Использовали деионизованную воду, которую получали на установке Millipore Simplicity (Millipore, США), удельное сопротивление воды составляло 18.2 МОм см. Применяли раствор муравьиной кислоты в воде (50% по массе) “for HPLC” (Sigma-Aldrich, США), формиат аммония (97%, Sigma-Aldrich), ацетат аммония с чистотой >98% (Roth, Германия), уксусную кислоту HPLC (Panreac, Испания), водный раствор аммиака (28–30% по массе), степень чистоты “for analysis” (Panreac, Испания), ацетонитрил Super Gradient (Panreac, Испания), метанол и изопропанол “HPLC gradient” (Panreac, Испания).
Исходные растворы метилфосфоновой кислоты (МФК), этилфосфоновой кислоты (ЭФК), н-пропилфосфоновой кислоты (н-ПФК), изопропилфосфоновой кислоты (иПФК), этилметилфосфоновой кислоты (ЭМФК), изопропилметилфосфоновой кислоты (иПМФК), пинаколил и изобутилметилфосфоновой кислоты (иБМФК) концентрацией 1 мг/мл готовили растворением точных навесок этих веществ (>99%, Epsilon Chimie, Франция) в ацетонитриле. Растворы гидрофильных пестицидов концентрацией 0.5 мг/мл готовили растворением точных навесок сухих стандартных образцов глифосата (99.5%, Sigma-Aldrich), аминометилфосфоновой кислоты (АмМФК) (99%, Sigma-Aldrich) и глюфосината аммония (97.9%, Sigma-Aldrich) в воде. Приготовленные растворы хранили в темноте при +4°С.
Сорбенты. Для концентрирования аналитов использовали стальные ВЭЖХ-колонки размером 30 × 2.1 мм с сорбентом Hypersep Hypercarb (пористый графитированный углерод), размер частиц 30 мкм, средний диаметр пор 25 нм, удельная поверхность 120 м2/г (Thermo Electron Corp., США). Сорбент помещали в корпус колонки в сухом виде, уплотняли механически. Колонки помещали в термостат жидкостного хроматографа.
Для разделения аналитов использовали хроматографические колонки с сорбентом Hypercarb двух размеров 30 × 2.1 мм и 100 × 2.1 мм. Сорбент в обеих колонках одинаковый: Hypercarb (Thermo Scientific, США), размер частиц – 5 мкм, средний размер пор – 25 нм, удельная поверхность – 120 м2/г.
Оборудование. Для определения аналитов использовали жидкостные хромато-масс-спектрометры с одинарным (Shimadzu, Япония) и тройным квадруполем Agilent Technologies (США) и AB Sciex (Канада).
Хромато-масс-спектрометр Shimadzu состоял из следующих модулей: квадрупольный масс-спектрометр LCMS-2020 c ионизацией аналитов электрораспылением (ЭРИ), химической ионизацией при атмосферном давлении (ХИАД) и приставкой DUIS для одновременной ионизации в режимах ЭРИ и ХИАД; два ВЭЖХ-насоса LC-20; дегазатор DGU-20A; термостат CTO-20A; автосамплер SIL-20AC. Для детектирования аналитов использовали следующие параметры МС-детектора и интерфейса: время накопления сигнала на выбранной массе (SIM event time) – 0.2 с; напряжение на детекторе (Detector Voltage) – 1.1 кВ; напряжение на интерфейсе (Interface Voltage) – ±4.5 кВ; напряжение на линии десольватации (DL Voltage) – 0 В; температура интерфейса (Interface temperature) – 350°C; температура линии десольватации (DL temperature) – 250°C; поток газа-распылителя (Nebulizing gas flow) – 1.5 л/мин; температура блока нагревателя (Heat Block) – 400°C; поток газа-осушителя (Drying gas flow) – 15 л/мин; режим ионизации (Ionisation mode) – ЭРИ. Эти параметры не оптимизировали, использовали рекомендованные производителем оборудования значения.
Хромато-масс-спектрометр Agilent Technologies (США) и AB Sciex (Канада) состоял из следующих модулей: жидкостной насос Agilent 1290; автосамплер Agilent 1290; термостат Agilent 1290; трехквадрупольный масс-спектрометр AB SCIEX QTRAP 5500. Для детектирования аналитов с помощью хромато-масс-спектрометра использовали следующие параметры МС-детектора и интерфейса: время накопления сигнала на выбранной массе (SIM event time) – 0.1 с; напряжение на детекторе (Detector Voltage) – 1.7 кВ; напряжение на интерфейсе (Interface Voltage) – –4.5 кВ; температура интерфейса (Interface temperature) – 500°C; давление газа-распылителя (GAS 1) – 45 pci; давление газа-осушителя (GAS 2) – 45 pci; давление газа завесы (CUR gas) – 20 pci; давление газа в ячейке соударений (CAD gas) – 5 mTorr; режим ионизации (Ionisation mode) – ЭРИ. Эти параметры также не оптимизировали, использовали значения, рекомендованные производителем оборудования.
Параметры регистрации ионов аналитов представлены в табл. 1 – величины m/z и Q1/Q2, потенциал декластеризации (ПД), энергия соударений (ЭС). Отрицательный режим регистрации ионов выбирали, исходя из строения определяемых веществ. Для аналитов, содержащих подвижные протоны выбирали режим регистрации отрицательных ионов после электрораспыления.
Таблица 1.
Параметры регистрации ионов алкилфосфоновых и О-алкилалкилфосфоновых кислот, глифосата, глюфосината и аминометилфосфоновой кислоты масс-спектрометром
| Аналит | Q1/Q3* | Потенциал декластеризации*, В | Энергия соударений*, В | m/z |
|---|---|---|---|---|
| МФК | 95/63, 95/79 | –90 | –60, –25 | 95 |
| ЭФК | 109/63, 109/79 | –85 | –60, –28 | 109 |
| н-ПФК | 123/63, 123/79 | –100 | –29, –65 | 123 |
| иПФК | 123/63, 123/79 | –100 | –29, –65 | 123 |
| ЭМФК | 123/95, 123/79, 123/63 | –30 | –16, –28, –65 | 123 |
| иПМФК | 137/95, 137/79, 137/63 | –50 | –19, –40, –75 | 137 |
| иБМФК | 151/63, 151/79, 151/95 | –70 | –67, –35, –19 | 151 |
| ПиМФК | – | – | – | 179 |
| АмМФК | 110/79, 110/63 | –90 | –24, –36 | 110 |
| Глифосат | 168/79, 168/63 | –110 | –26, –54 | 168 |
| Глюфосинат | 180/63, 180/95 | –90 | –66, –25 | 180 |
Для концентрирования аналитов с использованием субкритической воды использовали самостоятельно собранный комплекс оборудования для проточного сорбционно-ВЭЖХ-анализа, состоящий из узлов серийно выпускаемого оборудования (Аквилон, Россия), а также печи (внутренние размеры 22 × 25 × 17 см, объем 9 дм3) от газового хроматографа ЛХМ-80 (ЗАО “Хроматограф”, Россия), в который нами был установлен трубчатый электронагреватель (ТЭН) мощностью 1800 Вт [12]. Использовали ограничитель давления P-455 (Upchurch Scientific, США), номинальное создаваемое противодавление 70 атм (при пропускании воды со скоростью 1.0 мл/мин при температуре 20°C).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Сорбция аналитов. Все выбранные гидрофильные аналиты хорошо извлекаются на углеродном сорбенте, что выгодно отличает его от большинства обращено-фазных сорбентов [11].
Сорбция алкилфосфоновых кислот. Через колонку с помощью жидкостного насоса пропускали раствор смеси АФК в воде с концентрацией каждого аналита 0.1 мкг/мл. Кривую “проскока” регистрировали с помощью масс-спектрометрического детектора: для этого подключали колонку с сорбентом напрямую к детектору. Типичная кривая проскока представлена на рис. 1.
Рис. 1.
Кривые проскока алкилфосфоновых кислот. Колонка для концентрирования (30 × 2.1 мм) с сорбентом Hypersep Hypercarb для твердофазной экстракции (30 мкм). Концентрации аналитов: 0.1 мкг/мл. Скорость потока 0.5 мл/мин. Температура колонки 25°C. m/z: 95 – МФК (1), 109 – ЭФК (2), 123 – н-ПФК (3).

Изучали влияние скорости потока на сорбцию в интервале от 0.25 до 0.75 мл/мин. В табл. 2 представлены максимальные объемы аналитов до проскока в зависимости от скорости потока. Для дальнейших исследований выбрана скорость 0.5 мл/мин. При этой скорости объем пробы до проскока составил 27 мл, время концентрирования соответственно 54 мин.
Таблица 2.
Максимальные объемы (мл) пропускаемого раствора до проскока аналитов в зависимости от скорости потока
| Аналит | Скорость потока, мл/мин | |||
|---|---|---|---|---|
| 0.25 | 0.50 | 0.75 | 1.00 | |
| МФК | 23 | 27 | 26 | – |
| ЭФК | 25 | 27 | 26 | – |
| н-ПФК | 33 | 33 | 34 | – |
| ЭМФК | – | 85 | 75 | 60 |
| иПМФК | – | 85 | 75 | 60 |
| иБМФК | – | 94 | 83 | 65 |
| АмМФК | – | 28 | 23 | 22 |
| Глюфосинат | – | 75 | 60 | 60 |
| Глифосат | – | >115 | >172 | >110 |
Сорбция О-алкилметилфосфоновых кислот. Через колонку пропускали раствор смеси О-АМФК в воде с концентрацией аналитов 0.2 мкг/мл. Кривые “проскока” были аналогичны полученным при концентрировании АФК. По величине удерживания аналиты можно расположить в ряд: ЭМФК < иПМФК< иБМФК, для последнего величина коэффициента емкости (k') превышала 218.
Скорость потока варьировали в интервале от 0.25 до 1 мл/мин. Как видно из приведенных результатов (табл. 2), максимальный объем до проскока достигается при минимальной скорости потока, что достаточно очевидно. Однако, в связи с тем, что объем до проскока при увеличении скорости пропускания раствора меняется плавно, для снижения продолжительности анализа выбрали скорость 0.75 мл/мин. В этих условиях объем пропускаемой пробы до начала проскока составил 75 мл.
Сорбция глифосата, аминометилфосфоновой кислоты и глюфосината. Концентрация аналитов в этом случае составляла 0.2 мкг/мл. Кривые проскока выглядели так же, как и при концентрировании остальных аналитов. Слабее всех удерживалась АмМФК, значительно лучше – глюфосинат. Сильнее всех – глифосат, величина k' превышала 277. Максимальный объема “до проскока” (28 мл) достигается при скорости пропускания раствора 0.5 мл/мин (табл. 2).
Выбор условий десорбции аналитов. Десорбция аналитов после концентрирования на углеродных сорбентах, в том числе на сорбенте Hypercarb, часто затруднена [11], поэтому мы уделили этой стадии повышенное внимание. Для десорбции выбранных аналитов мы изучили возможность применения водных растворов муравьиной кислоты, формиата аммония, метанола, ацетонитрила и аммиака как при комнатной температуре, так и в нагретом состоянии (в том числе при использовании субкритической воды).
Десорбция алкилфосфоновых кислот. Десорбцию аналитов изучали после их извлечения из 5 мл раствора; десорбирующий раствор также пропускали со скоростью 0.5 мл/мин, собирали аликвоты по 300–500 мкл, АФК определяли в каждой аликвоте методом ВЭЖХ–МС. После завершения десорбции колонку промывали 2 мл (4.8 объемов колонки) метанола и 4 мл (9.5 объемов колонки) воды со скоростью 0.2 мл/мин.
Десорбция растворами муравьиной кислоты. Ранее при изучении разделения АФК на сорбенте Hypercarb показано, что при повышении концентрации муравьиной кислоты удерживание аналитов снижается [13, 14], однако при ее содержании 0.1% коэффициенты емкости еще достаточно велики (k' ≈ 5). Поэтому в качестве десорбирующего раствора выбрали более сильный элюент – водный раствор с добавкой 0.5% муравьиной кислоты (pH 2.1). Результаты (рис. 2) показали меньшую эффективность десорбции этил- и н-пропилфосфоновых кислот по сравнению с метилфосфоновой кислотой. Степень десорбции рассчитывали как отношение суммарного количества каждого аналита во всех аликвотах после десорбции к исходному сорбированному количеству. Она составила 94 ± 3% для МФК, 86 ± 2% для ЭФК и 89 ± 1% для н-ПФК (n = 3, P = 0.95).
Рис. 2.
Данные по десорбции алкилфосфоновых кислот водным раствором муравьиной кислоты. Столбцы черного цвета соответствуют МФК, белого – ЭФК, серого – н-ПФК. АФК сорбировали на Hypersep Hypercarb из 5 мл раствора концентрацией 0.25 мкг/мл и десорбировали 0.5%-ной муравьиной кислотой (pH 2.1). Температура колонки 25°C. Скорость потока 0.5 мл/мин.

Десорбция субкритической водой. Исследована возможность десорбции АФК субкритической водой. Этот способ перспективен из-за возможности реализации предложенной ранее в нашей группе двухколоночной on-line схемы, когда охлажденный концентрат целиком подают в хроматографическую колонку для повторного концентрирования и последующего разделения [12]. С использованием предложенной ранее установки [12] после 10-минутного прогрева печи (до 150 или 200°С) через колонку с сорбированными АФК пропускали поток нагретой воды со скоростью 0.2 мл/мин, раствор после десорбции охлаждали в потоке и собирали аликвотами по 0.3–1.0 мл. В каждой аликвоте АФК определяли методом ВЭЖХ–МС.
Установлено, что АФК десорбируются субкритической водой, но хуже, чем водным раствором муравьиной кислоты при комнатной температуре (табл. 3). В основном это касается ЭФК. Причины такого поведения ЭФК до конца неясны, однако при использовании углеродных сорбентов часто наблюдается нарушение привычных для обращенно-фазовой ВЭЖХ закономерностей удерживания аналитов, например зависимостей времен удерживания от длины алкильного радикала в молекуле или от гидрофобности [11]. Повышение температуры субкритической воды до 200°C снижало также степень десорбции н-ПФК. В конце каждого эксперимента через колонку пропускали 0.5%-ную муравьиную кислоту (pH 2.1) для удаления остатков АФК.
Таблица 3.
Степени извлечения (при сорбции и десорбции субкритической водой) алкилфосфоновых кислот (n = 3, P = 0.95)
| Определяемое вещество | Температура десорбирующего раствора | |
|---|---|---|
| 150°С | 200°С | |
| МФК | 101 ± 2 | 100 ± 1 |
| ЭФК | 65 ± 2 | 75 ± 1 |
| н-ПФК | 103 ± 4 | 74 ± 1 |
Несмотря на то, что субкритическая вода не обеспечивает количественную десорбцию всех АФК, потенциально возможна реализация двухколоночной on-line схемы с повторным концентрированием аналитов на хроматографической колонке [12] для высокочувствительного определения отдельных аналитов, например метилфосфоновой кислоты. Однако в настоящей работе такая задача не ставилась.
Десорбция формиатом аммония. Исследовали десорбцию аналитов 0.5%-ным водным раствором формиата аммония (pH 6.7) при комнатной температуре.
Результаты показали эффективную десорбцию всех аналитов раствором формиата аммония (рис. 3). Все пики десорбции АФК одинаково узкие и находятся в одной зоне объемов пропускаемых растворов. Установлено, что степень извлечения АФК в данных условиях 99 ± 2% для МФК и ЭФКи 99 ± 1% для н-ПФК (n = 3, P = = 0.95), что говорит о количественной десорбции АФК.
Рис. 3.
Данные по десорбции алкилфосфоновых кислот водным раствором формиата аммония. Столбцы черного цвета соответствуют МФК, белого – ЭФК, серого – н-ПФК. АФК сорбировали на Hypersep Hypercarb из 5 мл раствора концентрацией 0.5 мкг/мл и десорбировали 0.5%-ным раствором формиата аммония в воде. Температура колонки 25°C. Скорость потока 0.5 мл/мин.

При использовании формиата аммония АФК количественно десорбируется меньшим объемом (300 мкл), чем при использовании раствора муравьиной кислоты (600 мкл), что позволяет увеличить коэффициенты концентрирования аналитов.
Установлено, что добавка формиата аммония к субкритической воде (в концентрациях менее 0.5%) не обеспечивает количественную десорбцию всех АФК. При дальнейшем увеличении концентрации формиата аммония применение субкритической воды становится нецелесообразным, так как аналиты десорбируются и при комнатной температуре.
Десорбция водно-органическими смесями. Использовали смеси вода–органический растворитель (метанол или ацетонитрил). В этих условиях степень десорбции АФК не превышала 60%, и для достижения этой величины требовался большой объем растворителя (3 мл).
Таким образом, после извлечения на сорбенте Hypersep Hypercarb АФК лучше всего десорбировать 0.5%-ным раствором формиата аммония, при этом объем зоны концентрата в потоке составил 300 мкл. В выбранных условиях может быть достигнут коэффициент концентрирования АФК 90 (исходя из максимального объема “до проскока”).
Десорбция О-алкилметилфосфоновых кислот. Для изучения десорбции проводили аналогичные эксперименты: через колонку для концентрирования пропускали 5 мл раствора О-АМФК c концентрацией 0.1 мкг/мл при скорости потока 0.75 мл/мин. Затем пропускали десорбирующий раствор и анализировали его аликвоты.
Десорбция растворами формиата аммония. Поскольку для десорбции АФК наиболее эффективным оказался 0.5%-ный раствор формиата аммония, исследовали десорбцию О-АМФК таким же раствором. Полученные результаты (рис. 4) показали меньшую эффективность десорбции О-АМФК раствором формиата аммония по сравнению с АФК. Степень десорбции ЭМФК составила 97 ± 3%, иПМФК 93 ± 2% и иБМФК 31 ± 1% (n = 3, P = 0.95). Увеличение концентрации формиата аммония не привело к существенному улучшению десорбции.
Рис. 4.
Данные по десорбции алкилметилфосфоновых кислот водным раствором формиата аммония. Столбцы черного цвета соответствуют ЭМФК, белого – иПМФК, серого – иБМФК. Аналиты извлекали на сорбенте Hypersep Hypercarb из 5 мл раствора концентрацией 0.25 мкг/мл и десорбировали 0.5%ным раствором формиата аммония в воде. Температура колонки 25°C. Скорость потока 0.5 мл/мин.

Десорбция субкритической водой. Изучали десорбцию О-АМФК субкритической водой при температурах 150–250°C. Полученные результаты (рис. 5) показали, что субкритическая вода при 150°С не является эффективным элюентом для этих аналитов. Изобутилфосфоновая кислота в этих условиях не десорбируется, а степень десорбции ЭМФК и иПМФК не превышала 50%. Увеличение температуры до 200°С позволило количественно десорбировать все три О-АМФК, однако изобутилфосфоновая кислота десорбируется большим объемом, чем остальные аналиты. Так, для количественной десорбции ЭМФК и иПМФК необходимый объем субкритической воды составляет 1 мл, а для иБМФК – 1.5 мл. Степень десорбции аналитов составила 99 ± 2% (n = 3, P = 0.95).
Рис. 5.
Данные по десорбции О-алкилметилфосфоновых кислот субкритической водой. Столбцы черного цвета соответствуют ЭМФК, белого – иПМФК, серого – иБМФК. Аналиты сорбировали на Hypersep Hypercarb из 8 мл раствора концентрацией 0.1 мкг/мл и десорбировали субкритической водой при температуре 150°C (а), 200°C (б). Скорость потока 0.5 мл/мин.

Увеличение температуры еще на 10°С приводит к появлению следов метилфосфоновой кислоты в анализируемых аликвотах, что говорит о гидролизе выбранных эфиров. При 250°С наблюдали полный гидролиз всех трех эфиров метилфосфоновой кислоты.
Изучено влияние добавки формиата аммония (0.2–3.8%) в десорбирующий раствор (воду) в субкритических условиях. Колонку помещали в печь и нагревали до 190°С в течение 10 мин. Десорбирующий раствор пропускали со скоростью потока 0.5 мл/мин (рис. 6). Нагрев позволяет увеличить степень десорбции ЭМФК, иПМФК и иБМФК до 100%, при этом увеличение концентрации формиата аммония улучшало десорбцию аналитов. Однако объем раствора, необходимый для количественной десорбции достаточно велик – 2.2 мл.
Рис. 6.
Данные по десорбции О-алкилалкилфосфоновых кислот водным раствором формиата аммония при 190°C. Столбцы черного цвета соответствуют ЭМФК, белого – иПМФК, серого – иБМФК. Аналиты сорбировали из 5 мл раствора концентрацией 0.1 мкг/мл и десорбировали 0.5% водным раствором формиата аммония. Скорость потока 0.5 мл/мин, температура колонки 190°С.
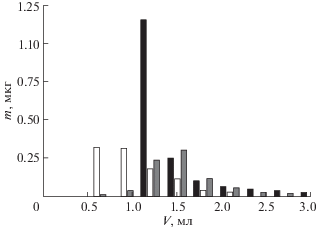
Также изучали влияние скорости потока на десорбцию О-АМФК при 200°С. Снижение скорости потока до 0.25 мл/мин приводило к увеличению объема концентрата. При увеличении скорости до 0.75 мл/мин вода не успевала прогреваться в капиллярах и аналиты не десорбировались. Оптимальная скорость составила 0.5 мл/мин.
Десорбция водой с добавкой аммиака. Исследовали десорбцию О-АМФК водным раствором аммиака (0.1 М раствор аммиака, pH 11.1) при комнатной температуре. Установлено, что в этих условиях количественно десорбируется ЭМФК, степень десорбции остальных аналитов не превышала 90%. Увеличение концентрации аммиака не улучшает десорбцию, а при концентрации выше 0.15 М (pH 11.2) наблюдали гидролиз эфиров до метилфосфоновой кислоты.
Десорбция водным раствором аммиака с добавкой формиата аммония. Предпринята попытка десорбции О-АМФК водным раствором, содержащим одновременно и формиат аммония и аммиак.
В этих условиях наблюдали количественную десорбцию всех трех аналитов 99 ± 3% (n = 3, P = = 0.95), но для десорбции изобутилметилфосфоновой кислоты необходим объем не менее 2.5 мл. Снижение или увеличение концентраций аммиака и/или формиата аммония не привели к снижению необходимого объема десорбирующего раствора.
Десорбция водным раствором метанола. Поскольку выбранные аналиты более гидрофобны, чем АФК, то справедливо предположить, что их можно десорбировать классическими элюентами, применяемыми в обращенно-фазовой хроматографии, например водными растворами метанола.
Эксперименты показали, однако, что этот элюент неэффективен для десорбции О-АМФК. Наилучший результат достигнут при использовании 80% метанола, ЭМФК и иПМФК в таких условиях десорбируются количественно, но необходимый объем раствора для десорбции составил 2.5 мл. иБМФК десорбируется этим же объемом неколичественно. Снижение концентрации метанола приводит к ухудшению десорбции – снижению степеней извлечения и увеличению объема десорбирующего раствора. Увеличение концентрации метанола приводит не только к увеличению объема концентрата, но и к размыванию пиков аналитов на хроматограмме при ВЭЖХ–МС-определении.
Таким образом, О-АМФК предпочтительнее десорбировать субкритической водой при 200°С, особенно в расчете на повторную фокусировку в хроматографической колонке в проточном варианте [12]. В off-line режиме максимально достигаемый коэффициент концентрирования О-АМФК составил 150 (исходя из объема “до проскока”).
Десорбция глифосата, аминометилфосфоновой кислоты и глюфосината. Как и в случае с АФК и О-АМФК, исследовали десорбцию пестицидов растворами муравьиной кислоты, формиата аммония и субкритической водой. Однако десорбция этими растворами оказалась неэффективной. Поэтому попытались увеличить pH десорбирующих растворов добавлением аммиака.
Десорбция водным раствором аммиака. Показано, что АмМФК, глюфосинат и глифосат количественно десорбируются 0.1 М раствором аммиака, однако объем, необходимый для десорбции, достаточно велик (3 мл). Увеличение концентрации аммиака существенного не улучшает вид кривых десорбции. Снижение концентрации приводит к снижению степеней десорбции всех трех аналитов. Нагрев и/или добавка формиата аммония также снижает степени извлечения всех трех аналитов.
Десорбция раствором аммиака в смеси вода–метанол. Поскольку выбранные нами пестициды менее гидрофильны, чем АФК, то для снижения объема десорбирующего раствора может быть эффективна добавка в элюент метанола. Исследовали десорбцию аналитов смесями вода–аммиак–метанол (рис. 7). Содержание метанола в смеси составляло 80%.
Рис. 7.
Данные по десорбции аминометилфосфоновой кислоты, глифосата и глюфосината раствором вода−метанол−аммиак. Столбцы черного цвета соответствуют АмМФК, белого – глифосату, серого – глюфосинату. Аналиты сорбировали из 5 мл раствора концентрацией 0.1 мкг/мл и десорбировали 0.5%-ным (а), 1.0%-ным (б) и 2.0%-ным (в) раствором аммиака в 80%-ном метаноле. Температура колонки 25°C. Скорость потока 0.5 мл/мин.

Как видно из приведенных результатов, наиболее эффективна десорбция смесью с содержанием аммиака 1%. Объем, необходимый для десорбции – 2.1 мл. Степень десорбции всех аналитов составила 99 ± 3% (n = 3, P = 0.95). При снижении концентрации аммиака увеличивается объем элюента, необходимый для количественной десорбции. И увеличение, и снижение концентрации аммиака, а также нагрев элюента приводит к снижению степени десорбции глифосата.
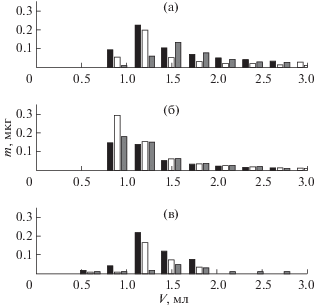
Также изучено влияние содержания метанола в десорбирующем растворе на степень десорбции аналитов (рис. 8). Уменьшение концентрации метанола в десорбируюшем растворе до 70% снижает степень десорбции глифосата до 79 ± 4%, а увеличение до 90% – до 35 ± 3% (n = 3, P = 0.95), в то время как на десорбцию глюфосината и аминометилфосфоновой кислоты концентрация метанола влияла слабо.
Рис. 8.
Данные по десорбции аминометилфосфоновой кислоты, глифосата и глюфосината раствором вода–метанол–аммиак. Столбцы черного цвета соответствуют АмМФК, белого – глифосату, серого – глюфосинату. Аналиты концентрировали из 5 мл раствора концентрацией 0.1 мкг/мл и десорбировали 1%-ным раствором аммиака в смеси метанол–вода. Концентрация метанола 70% (а), 80% (б), 90% (в). Температура колонки 25°C. Скорость потока 0.5 мл/мин.
С целью повышения эффективности десорбции аналитов (в первую очередь, для снижения объема, необходимого для десорбции) исследовали десорбцию и другими элюентами. Показано, что использование растворов муравьиной кислоты, формиата аммония при комнатной температуре и при нагреве до 200°С, а также субкритической воды, неэффективно, десорбция всех трех аналитов проходит неколичественно или не проходит совсем.
Таким образом, при десорбции пестицидов и аминометилфосфоновой кислоты следует использовать 1%-ный раствор аммиака в 80%-ном метаноле, максимальные коэффициенты концентрирования АмМФК, глюфосината и глифосата в этом случае составили 91 (исходя из объема “до проскока”).
* * *
Таким образом, выбраны условия концентрирования (сорбции и десорбции) ряда гидрофильных фосфорорганических веществ из водной среды при использовании пористого графитированного углерода Hypersep Hypercarb. Показана возможность достижения высоких коэффициентов концентрирования (90–150). Следует отметить, что для решения большинства задач достаточно концентрировать аналиты в существенно меньшей степени, и время, необходимое для концентрирования, может быть снижено.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (грант № 18-03-00289).
Список литературы
Munro B., Talmage S. The sources, fate, and toxicity of chemical warfare agent degradation products // Environm. Health Perspectives. 1999. V. 107. № 12. P. 933.
IARC Monographs. Volume 112: Evaluation of Five Organophosphate Insecticides and Herbicides. 20 March 2015.
Гигиенические нормативы содержания пестицидов в объектах окружающей среды (перечень) ГН 1.2.3111-13. Утверждены постановлением Главного государственного санитарного врача Российской Федерации от 21.10.2013. № 55.
Riches Morton I., Read R.W., Black R.M. The trace analysis of alkyl alkylphosphonic acids in urine using gas chromatography–ion trap negative ion tandem mass spectrometry // J. Chromatogr. B. 2005. V. 816. P. 251.
Байгильдиев Т.М., Родин И.А, Ставрианиди А.Н., Браун А.В., Ахмерова Д.И., Шпигун О.А., Рыбальченко И.В. Экспрессное определение низких содержаний метилфосфоновой кислоты методом ВЭЖХ-МС/МС // Заводск. лаборатория. 2016. Т. 82. С. 5.
Desoubries C., Chapuis-Hugon F., Bossee A., Pichon V. Three-phase hollow fiber liquid-phase microextraction of organophosphorous nerve agent degradation products from complex samples // J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. 2012. V. 900. P. 48.
Vermillion W.D., Crenshaw M.D. In-line respeciation: An ion-exchange ion chromatographic method applied to the separation of degradation products of chemical warfare nerve agents in soil // J. Chromatogr. A. 1997. V. 770. № 1–2. P. 253.
Piao H., Marx R.B., Schneider S., Irvine D.I., Staton J. Analysis of VX nerve agent hydrolysis products in wastewater effluents by ion chromatography with amperometric and conductivity detection // J. Chromatogr. A. 2005. V. 1089. № 1–2. P. 65.
Филиппов О.А., Тихомирова Т.И., Цизин Г.И., Золотов Ю.А. Динамическое концентрирование органических веществ на неполярных сорбентах // Журн. аналит. химии. 2003. Т. 58. № 5. С. 454.
Олиферова Л.А., Статкус М.А., Цизин Г.И., Ван Д., Золотов Ю.А. Проточные сорбционно-жидкостно-хроматографические методы анализа // Журн. аналит. химии. 2006. Т. 61. № 5. С. 454.
Гончарова Е.Н., Статкус М.А., Цизин Г.И., Золотов Ю.А. Пористый графитированный углерод для разделения и концентрирования гидрофильных веществ // Журн. аналит. химии. 2020. Т. 75. № 4. С. 291.
Борисова Д.Р., Гончарова Е.Н., Статкус М.А., Цизин Г.И. Проточное сорбционно-ВЭЖХ определение моноэфиров фталевой кислоты, включающее десорбцию субкритической водой // Вестник МГУ. Серия 2. Химия. 2015. Т. 56. № 5. С. 42.
Mercier J.P., Morin P., Dreux M., Tambute A. Liquid chromatography analysis of phosphonic acids on porous graphitic carbon stationary phase with evaporative light-scattering and mass spectrometry detection // J. Chromatogr. A. 1999. V. 849. № 1. P. 197.
Гончарова Е.Н., Семенова И.П., Статкус М.А., Цизин Г.И. Градиентное ВЭЖХ разделение алкилфосфоновых кислот на пористом графитированном сорбенте HYPERCARB с использованием водного раствора муравьиной кислоты в качестве подвижной фазы // Вестник МГУ. Серия 2: Химия. 2017. Т. 58. № 6. С. 275.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


