Журнал аналитической химии, 2022, T. 77, № 10, стр. 923-930
ВЭЖХ-разделение карбоновых кислот с использованием пористого графитированного углерода и градиентного элюирования растворами муравьиной кислоты
К. С. Гутенев a, М. А. Статкус a, Г. И. Цизин a, *
a Московский государственный университет имени М.В. Ломоносова, химический факультет
119992 Москва, Ленинские горы, 1, стр. 3, Россия
* E-mail: tsisin@analyt.chem.msu.ru
Поступила в редакцию 17.03.2022
После доработки 28.04.2022
Принята к публикации 11.05.2022
- EDN: IGVKBG
- DOI: 10.31857/S0044450222100061
Аннотация
Предложен способ ВЭЖХ-разделения смеси карбоновых кислот в условиях градиентного элюирования растворами муравьиной кислоты на пористом графитированном сорбенте Hypercarb. Аналиты детектировали с помощью моноквадрупольного масс-спектрометра. Ступенчатый градиент муравьиной кислоты без добавки органического растворителя позволил добиться хорошего разрешения пиков аналитов и снижения пределов обнаружения в 4.4–17.8 раз по сравнению с их разделением в изократических условиях 0.1%-ной муравьиной кислотой. Влияние метанола на разделение аналитов выражено в меньшей степени.
Карбоновые кислоты необходимо определять в пищевых продуктах и напитках в ходе контроля их качества. Соотношение концентраций различных карбоновых кислот позволяет судить о происхождении и возможной фальсификации пищевого продукта. Определение карбоновых кислот в природных водах проводят с целью изучения мобилизации микроэлементов почв. На ряде промышленных производств для их нормального функционирования необходимо контролировать содержание карбоновых кислот в технологических растворах.
Для определения карбоновых кислот предложен большой ассортимент методов: капиллярный электрофорез [1–4], газовая хроматография [5–7], ВЭЖХ в обращенно-фазовом (ОФ) варианте [8–12], ферментативные методы [13, 14]. Для выделения отдельных пиков веществ из перекрывающихся пар аналитов при ОФ ВЭЖХ-определении применяли хемометрические подходы [15]. Наиболее распространенным методом определения карбоновых кислот на сегодняшний день является ионная хроматография [16, 17] с кондуктометрическим, спектрофотометрическим или масс-спектрометрическим (МС) детектированием. Масс-спектрометрическое детектирование, в принципе, не требует полного хроматографического разделения аналитов, что облегчает выбор условий анализа. Однако использование МС-детектора невозможно при введении нелетучих добавок в подвижную фазу, таких как карбонат натрия, которые широко применяют при разделении аналитов на коммерчески доступных анионообменниках. Другой проблемой при использовании МС-детектора является недостаточная чувствительность и воспроизводимость при определении карбоновых кислот с малой молекулярной массой [18].
Коммерческие анионообменники не всегда обеспечивают полное разделение слабоудерживаемых органических кислот, а именно: гликолевой, уксусной, молочной и муравьиной. Более того, при использовании карбонат-селективных неподвижных фаз в изократических условиях наложения пиков карбоновых кислот более вероятны, поскольку их удерживание близко к удерживанию ряда неорганических кислот. Применение градиентных режимов также вызывает ряд проблем, таких как сильное удерживание неорганических анионов и недостаточное разрешение аналитов в сложных матрицах. Одновременное определение слабо- и сильноудерживаемых органических веществ может быть обеспечено использованием градиентного режима элюирования с гидроксидным элюентом на подходящей стационарной фазе [19].
Так называемые “гидроксид-селективные” стационарные фазы гораздо лучше подходят для разделения карбоновых кислот, поскольку их селективность оптимизирована для гидроксидных элюентов в градиентных условиях. Это не означает, что все карбоновые кислоты могут быть разделены путем однократного применения линейного или нелинейного градиента, но более высокая емкость сорбента позволяет одновременно разделять слабо- и сильноудерживаемые карбоновые кислоты. Наиболее популярным анионообменником для такого применения является Dionex IonPac AS11 с аммонийными функциональными группами. При этом даже в градиентных условиях разрешение между пиками фторида и муравьиной кислоты мало, а гидроксикарбоновые кислоты, такие как гликолевая и молочная, лишь частично разрешены от фторида и уксусной кислоты [19]. Более высокая емкость IonPac AS11-HC не улучшает эту ситуацию.
Карбоновые кислоты разделяли и с использованием других неподвижных фаз, таких как сульфированные фазы Supelcogel и Hamilton. Однако и при этом отмечали сложности при разделении карбоновых кислот [16, 17].
Основываясь на наших предыдущих работах по разделению гидрофильных веществ в водной среде, мы предложили способ разделения карбоновых кислот на пористом графитированном углеродном сорбенте Hypercarb. Уникальные свойства этого сорбента отмечены в работах [20, 21], в том числе в работах нашей группы [22–24].
Цель данной работы − оптимизация условий разделения карбоновых кислот на сорбенте Hypercarb при разных градиентных режимах с использованием водных растворов муравьиной кислоты в качестве элюента.
Градиентное элюирование обычно применяют для уменьшения продолжительности разделения аналитов. В этом случае инжектирование аналитов в слабый элюент приводит к их дополнительному фокусированию на начальном участке ВЭ-ЖХ-колонки. За счет уменьшения размытия пиков аналитов на стадии ввода образцов часто повышается селективность разделения. Подобный прием хроматофокусирования часто встречается в работах по ионной хроматографии [25].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты. Для приготовления растворов и элюентов использовали деионизованную воду (18.2 МОм см), полученную на установке Millipore Simplicity (Millipore, США), а также раствор муравьиной кислоты в воде (50 мас. %) чистоты “for HPLC” (Sigma-Aldrich, США) и метанол степени чистоты “for HPLC” (J.T. Baker, Нидерланды).
Исходные водные растворы молочной и яблочной (1 мг/мл); глюконовой, хинной, винной и янтарной (5 мг/мл) кислот х. ч. (Panreac, Испания) готовили по точным навескам. Рабочие растворы с концентрацией 10 мкг/мл готовили путем последовательного разбавления исходных растворов. Исходные растворы хранили в темноте при +4°С.
Аппаратура. Для определения использовали жидкостной хромато-масс-спектрометр производства Shimadzu (Япония), состоящий из следующих модулей: квадрупольный масс-спектрометр LCMS-2020 c ионизацией аналитов электрораспылением (ESI); два ВЭЖХ-насоса LC-20AD; дегазатор DGU-20A; контроллер CBM-20A; автосамплер SIL-20AC и термостат CTO-20AC. Ту же ВЭЖХ-систему использовали с диодно-матричным детектором SPD-M20A. Программное обеспечение для сбора данных и управления хроматографом – LabSolutions ver. 5.55. В режиме ионной хроматографии эксперименты проводили на ионном хроматографе Metrohm 850 Professional IC с кондуктометрическим детектором. Ионный подавитель был отключен из-за невозможности его использования с кислотными подвижными фазами.
Для ВЭЖХ-разделения использовали колонку с сорбентом Hypercarb (Thermo Scientific, США) (100 × 2.1 мм, 5 мкм).
Условия хроматографического разделения. В качестве элюентов использовали деионизованную воду и 0.1–0.5%-ный водный раствор муравьиной кислоты, а также 0.1%-ный водный раствор муравьиной кислоты с добавкой 1–5% метанола. Скорость потока составляла 0.2 мл/мин, температура колонки +30°С. Для детектирования аналитов использовали параметры МС-детектора и интерфейса Shimadzu LCMS-2020, рекомендованные производителем оборудования: время регистрации интенсивности на заданном m/z (SIM event time) 0.2 с; напряжение на детекторе (detector voltage) –1.55 кВ; напряжение на интерфейсе (interface voltage) 4.5 кВ; напряжение линии десольватации (DL voltage) 0 В; температура линии десольватации (DL temperature) +250°C; поток газа-распылителя (nebulizing gas flow) 1.5 л/мин; температура блока нагревателя (heat block) +400°C; поток газа-осушителя (drying gas flow) 15 л/мин. Аналиты определяли в режиме регистрации отрицательных ионов. Параметры m/z регистрации ионов аналитов для масс-спектрометра были следующие: молочная кислота 89 а.е.м., глюконовая 195 а.е.м., хинная 191 а.е.м., яблочная 133 а.е.м., винная 149 а.е.м., янтарная 117 а.е.м. Пределы обнаружения рассчитывали в программе LabSolutions.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Исследовали возможность улучшения параметров разделения некоторых карбоновых кислот на пористом графитированном углеродном сорбенте Hypercarb за счет градиентного элюирования на примере разделения смесей молочной, глюконовой, хинной, яблочной, винной и янтарной кислот. Выше показано, что при разделении этих аналитов часто возникают проблемы.
Смеси карбоновых кислот разделяли на колонке Hypercarb, используя три режима элюирования: изократический, линейный градиент и ступенчатый градиент (скачкообразное изменение концентрации муравьиной кислоты). Известно, что при разделении на Hypercarb сила водного элюента определяется концентрацией муравьиной кислоты [23, 24].
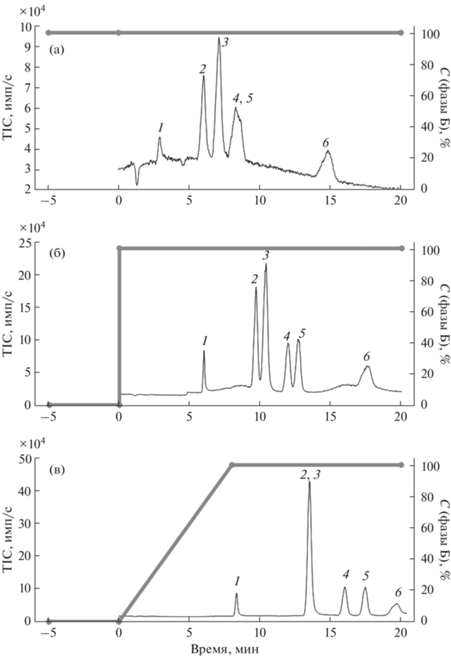
Так, модельную смесь аналитов разделяли в изократическом режиме 0.1%-ным раствором муравьиной кислоты в воде (рис. 1а). При этом не удалось достичь полного разделения яблочной и винной кислот. При использовании линейного градиента (рис. 1с), наблюдали неполное разделение глюконовой и хинной кислот. Наилучшего разделения аналитов удалось добиться в условиях ступенчатого градиентного элюирования раствором муравьиной кислоты (рис. 1б). Аналогичное наблюдение сделано нами ранее при разделении фосфорорганических аналитов [23, 24].
Рис. 1.
Хроматограммы, полученные при разделении карбоновых кислот на колонке с пористым графитированным углеродом. Разделяли молочную (1), глюконовую (2), хинную (3), яблочную (4), винную (5) и янтарную (6) кислоты. cаналитов = 10 мкг/мл; инжектировали 3 мкл раствора; фаза А – вода, фаза Б – 0.1%-ная НСООН. (а) – изократический режим, (б) – ступенчатый градиент, (в) – линейный градиент.
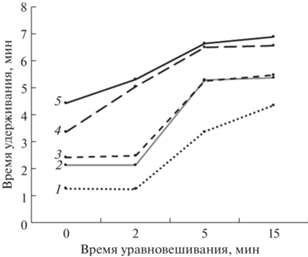
Ступенчатый градиент характеризуется в том числе длительностью первого и второго участков (100% фазы А и 100% фазы Б соответственно), а линейный – продолжительностью перехода от фазы А к фазе Б. Установлено, что в случае ступенчатого градиента минимально необходимая продолжительность первой стадии – так называемого “уравновешивания” колонки водой перед инжекцией – составила 5 мин (рис. 2). Дальнейшее увеличение продолжительности этой стадии мало влияло на времена удерживания аналитов. Для линейного градиента оптимизирована продолжительность перехода от фазы А (воды) к фазе Б (водному раствору муравьиной кислоты), оптимальная величина составила 8 мин. Время уравновешивания колонки до инжекции составило 5 мин.
Рис. 2.
Зависимость времени удерживания аналитов от длительности “уравновешивания” колонки фазой А. Разделяли молочную (1), глюконовую (2), хинную (3), винную (4) и янтарную кислоты (5). cаналитов = 10 мкг/мл, инжектировали 3 мкл раствора.
Увеличение концентрации муравьиной кислоты приводит к увеличению силы элюента и, как следствие, к сокращению продолжительности анализа [23]. Так, увеличение концентрации муравьиной кислоты от 0.1 до 0.5% привело к уменьшению времен удерживания аналитов, однако отрицательно сказалось на их разрешении во всех режимах элюирования. Кроме того, сильно возросли шумы, и ухудшилась форма пиков. В дальнейших экспериментах применяли 0.1%-ную муравьиную кислоту. При разделении карбоновых кислот на углеродном сорбенте этот прием может сократить продолжительность анализа и повысить интенсивность сигналов при МС-детектировании.
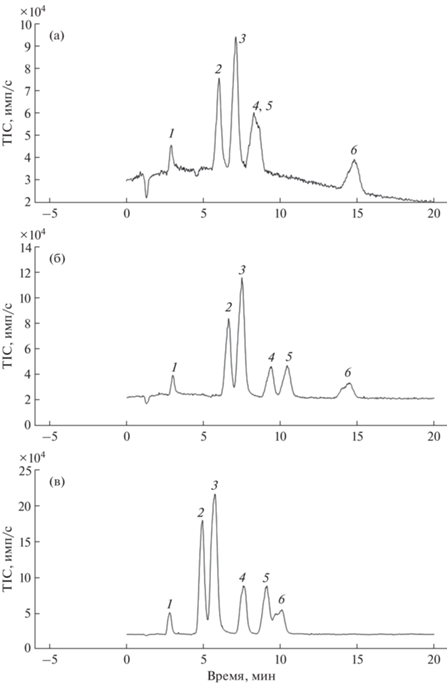
В ионной хроматографии в качестве добавки к подвижной фазе нередко используют органические растворители, например метанол [16, 26] или изопропанол [17]. В серии экспериментов по разделению карбоновых кислот с различными добавками метанола в подвижную фазу нами установлено, что добавка 1% (по объему) метанола незначительно влияет на времена удерживания большинства аналитов, однако улучшает разрешение между яблочной и винной кислотами в изократическом режиме (рис. 3б). При добавке 5% метанола возможно перекрывание пиков янтарной кислоты с пиками винной и яблочной кислот (рис. 3в). На разрешении остальных аналитов увеличение доли метанола до 5% сказывается слабо. При доле метанола выше 5% наблюдается сильное перекрывание пиков аналитов.
Рис. 3.
Влияние концентрации метанола в подвижной фазе на разрешение карбоновых кислот при разделении в изократическом режиме. Аналиты: 1 – молочная, 2 – глюконовая, 3 – хинная, 4 – яблочная, 5 – винная, 6 – янтарная кислоты. Концентрация аналитов 10 мкг/мл, инжектировали 3 мкл. Изократический режим элюирования; фаза А – вода; фаза Б – 0.1%-ная НСООН (а), 0.1%-ная НСООН + 1%-ный МеОН (б), 0.1%-ная НСООН + 5%-ный МеОН (в).
При градиентном элюировании аналитов раствором, содержащим одновременно муравьиную кислоту и метанол, сложно учесть отдельно влияние каждого из этих компонентов. В связи с этим проводили отдельные эксперименты, в ходе которых концентрацию одного из компонентов подвижной фазы фиксировали, а другого – меняли. Установлено, что градиент метанола при фиксированной концентрации муравьиной кислоты мало влияет на удерживание карбоновых кислот; основное влияние на времена выхода аналитов оказывает градиент муравьиной кислоты. Совместный градиент муравьиной кислоты и метанола ухудшает разрешение глюконовой и хинной кислот.
Таким образом, наилучшими условиями разделения карбоновых кислот является ступенчатый градиент муравьиной кислоты без добавки метанола (табл. 1). Значения Rs рассчитывали как среднее из двух повторов. Величина Rs равна отношению разности времен удерживания соседних хроматографических пиков к полусумме их ширин у основания.
Таблица 1.
Разрешение (Rs) некоторых пар карбоновых кислот в зависимости от выбранного режима элюирования (фаза А – Н2О)
| Пара кислот | 0.1% HCOOH | 0.5% HCOOH, изо. |
0.1% HCOOH + + 1% MeOH |
0.1% HCOOH + + 5% MeOH |
||||
|---|---|---|---|---|---|---|---|---|
| изо. | ступ. | лин. | изо. | ступ. | изо. | ступ. | ||
| Глюконовая\хинная | 1.66 | 1.26 | 0.09 | 1.75 | 1.16 | 1.00 | 1.23 | 1.26 |
| Янтарная\винная | 5.47 | 5.59 | 2.54 | 5.18 | 3.47 | 3.03 | 1.06 | 0.75 |
| Яблочная\винная | 0.49 | 1.22 | 2.27 | 0.12 | 1.15 | 2.11 | 1.90 | 2.01 |
В этих условиях наблюдали улучшение формы пиков на хроматограмме по сравнению с полученными в изократическим режиме без добавки метанола и снижение пределов обнаружения в 4.4–17.8 раз (табл. 2). Пределы обнаружения рассчитывали в программе LabSolutions (параметр Detection Limit) как среднее из двух повторов. В изократическом режиме добавка метанола к подвижной фазе также позволяет снизить пределы обнаружения карбоновых кислот, однако, как отмечено выше, параметры их разделения будут несколько хуже.
Таблица 2.
Пределы обнаружения (мкг/мл) аналитов при разных режимах элюирования*
| Аналит | 0.1% HCOOH изо. | 0.1% HCOOH ступ. | 0.1% HCOOH + + 1% MeOH изо. | 0.1% HCOOH + + 5% MeOH изо. |
|---|---|---|---|---|
| Молочная кислота | 0.89 | 0.05 | 0.29 | 0.08 |
| Глюконовая кислота | 0.57 | 0.07 | 0.39 | 0.13 |
| Хинная кислота | 2.78 | 0.47 | 1.27 | 0.49 |
| Яблочная кислота | 0.71 | 0.16 | 0.22 | 0.13 |
| Винная кислота | 1.16 | 0.12 | 0.35 | 0.12 |
| Янтарная кислота | 2.21 | 0.15 | 0.62 | 0.16 |
Поскольку при определении карбоновых кислот можно использовать не только МС-детекторы, оценили возможность применения спектрофотометрического и кондуктометрического детекторов. Из-за отсутствия возможности создания градиента подвижной фазы на ионном хроматографе выбрали наиболее подходящий состав элюента для изократических условий разделения, а именно 0.1%-ный раствор муравьиной кислоты в воде с добавлением 1% метанола. Такие же условия воспроизвели на приборе Shimadzu с диодно-матричным детектором.
При использовании хроматографа Shimadzu с диодно-матричным детектором в изократическом режиме на хроматограмме наблюдали лишь часть присутствующих в смеси кислот (рис. 4а): молочную, глюконовую, яблочную, винную. Поглощение остальных аналитов слишком мало, чтобы их можно было надежно детектировать спектрофотометрически даже при длине волны 210 нм. Детектировать пик янтарной кислоты не представляется возможным из-за низкой чувствительности детектора.
Рис. 4.
Хроматограммы разделения карбоновых кислот в изократическом режиме с использованием диодно-матричного при 210 нм (а) и кондуктометрического (б) детекторов. Аналиты: 1 – молочная, 2 – глюконовая, 3 – хинная, 4 – яблочная, 5 – винная кислоты. Концентрация аналитов 10 мкг/мл, инжектировали 3 мкл. Фаза А – вода; фаза Б – 0.1%-ная НСООН + 1%-ный МеОН.
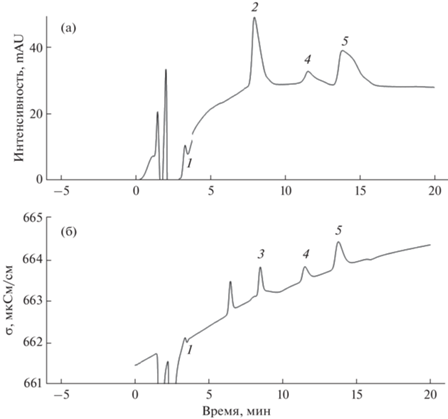
При работе на хроматографе Metrohm с кондуктометрическим детектированием (рис. 4б) удалось идентифицировать в смеси молочную, хинную, яблочную и винную кислоты. Существенной проблемой при использовании кондуктометрического детектора является необходимость отключать систему подавления фоновой электропроводности из-за ее несовместимости с кислотными подвижными фазами. Это приводит как к снижению чувствительности, так и к увеличению дрейфа базовой линии. В случае применения градиента концентрации муравьиной кислоты скачок базовой линии в несколько сотен раз превышает высоту пиков карбоновых кислот, что делает нецелесообразным использование этого приема разделения совместно с кондуктометрическим детектированием.
* * *
Таким образом, предложенный ранее нашей научной группой прием предварительного уравновешивания колонки водой с последующим ступенчатым градиентом концентрации муравьиной кислоты при разделении аналитов на пористом графитированном углеродном сорбенте оказался эффективным и при разделении карбоновых кислот. Этот прием позволил добиться хорошего разрешения пиков аналитов и снижения пределов обнаружения в 4.4–17.8 раз по сравнению с их разделением в изократических условиях 0.1%-ной муравьиной кислотой.
Список литературы
Wang M., Qu F., Shan X.-Q., Lin J.-M. Development and optimization of a method for the analysis of low-molecular-mass organic acids in plants by capillary electrophoresis with indirect UV detection // J. Chromatogr. A. 2003. V. 989. P. 285. https://doi.org/10.1016/s0021-9673(03)00026-8
Schulz M., Brugnerotto P., Seraglio S.K.T., Gonzaga L.V., Borges G.S.C., Costa A.C.O., Fett R. Aliphatic organic acids and sugars in seven edible ripening stages of juçara fruit (Euterpe edulis Martius) // J. Food Compost. Anal. 2021. V. 95. Article 103683. https://doi.org/10.1016/j.jfca.2020.103683
Soga T., Imaizumi M. Capillary electrophoresis method for the analysis of inorganic anions, organic acids, amino acids, nucleotides, carbohydrates and other anionic compounds // Electrophoresis. 2001 V. 22. P. 3418. https://doi.org/10.1002/1522-2683(200109)22:16< 3418::aid-elps3418>3.0.co;2-8
Peres R.G., Moraes E.P., Micke G.A., Tonin F.G., Tavares M.F.M., Rodriguez-Amaya D.B. Rapid method for the determination of organic acids in wine by capillary electrophoresis with indirect UV detection // Food Control. 2009. V. 20. P. 548. https://doi.org/10.1016/j.foodcont.2008.08.004
Adams M.A., Chen Z., Landman P., Colmer T.D. Simultaneous determination by capillary gas chromatography of organic acids, sugars, and sugar alcohols in plant tissue extracts as their trimethylsilyl derivatives // Anal. Biochem. 1999. V. 266. P. 77. https://doi.org/10.1006/abio.1998.2906
Jurado-Sánchez B., Ballesteros E., Gallego M. Gas chromatographic determination of 29 organic acids in foodstuffs after continuous solid-phase extraction // Talanta. 2011. V. 84. P. 924. https://doi.org/10.1016/j.talanta.2011.02.031
Balducci C., Cecinato A. Particulate organic acids in the atmosphere of Italian cities: Are they environmentally relevant? // Atmos. Environ. 2010. V. 44. P. 652. https://doi.org/10.1016/j.atmosenv.2009.11.015
Kemmei T., Kodama S., Yamamoto A., Inoue Y., Hayakawa K. Reversed phase liquid chromatographic determination of organic acids using on-line complexation with copper(II) ion // Anal. Chim. Acta. 2015. V. 886. P. 194. https://doi.org/10.1016/j.aca.2015.07.002
Flores P., Hellín P., Fenoll J. Determination of organic acids in fruits and vegetables by liquid chromatography with tandem-mass spectrometry // Food Chem. 2012. V. 132. P. 1049. https://doi.org/10.1016/j.foodchem.2011.10.064
Scherer R., Rybka A. C.P., Ballus C.A., Meinhart A.D., Filho J.T., Godoy H.T. Validation of a HPLC method for simultaneous determination of main organic acids in fruits and juices // Food Chem. 2012. V. 135. P. 150. https://doi.org/10.1016/j.foodchem.2012.03.111
Klupczynska A., Plewa S., Sytek N., Sawicki W., Dereziński P., Matysiak J., Kokot Z.J. A study of low-molecular-weight organic acid urinary profiles in prostate cancer by a new liquid chromatography-tandem mass spectrometry method // J. Pharm. Biomed. Anal. 2018. V. 159. P. 229. https://doi.org/10.1016/j.jpba.2018.06.059
Nour V., Trandafir I., Ionica M.E. HPLC organic acid analysis in different citrus juices under reversed phase conditions // Not. Bot. Hort. Agrobot. Cluj. 2010. V. 38. № 1. P. 44. https://doi.org/10.15835/nbha3814569
Rinken T. State of the Art in Biosensors - Environmental and Medical Applications. London: IntechOpen, 2013. P. 151. https://doi.org/10.5772/55617
Mato I., Suárez-Luque S., Huidobro J.F. A review of the analytical methods to determine organic acids in grape juices and wines // Food Res. Int. 2005. V. 38. P. 1175. https://doi.org/10.1016/j.foodres.2005.04.007
Mortera P., Zuljan F.A., Magni C., Bortolato S.A., Alarcón S.H. Multivariate analysis of organic acids in fermented food from reversed-phase high-performance liquid chromatography data // Talanta. 2018. V. 178. P. 15. https://doi.org/10.1016/j.talanta.2017.09.005
Bylund D., Norström S.H., Essén S.A., Lundström U.S. Analysis of low molecular mass organic acids in natural waters by ion exclusion chromatography tandem mass spectrometry // J. Chromatogr. A. 2007. V. 1176. P. 89. https://doi.org/10.1016/j.chroma.2007.10.064
Rellán-Álvarez R., López-Gomollón S., Abadía J., Álvarez-Fernández A. Development of a new high-performance liquid chromatography–electrospray ionization time-of-flight mass spectrometry method for the determination of low molecular mass organic acids in plant tissue extracts // J. Agric. Food Chem. 2011. V. 59. № 13. P. 6864. https://doi.org/10.1021/jf200482a
Hajós P., Nagy L. Retention behaviours and separation of carboxylic acids by ion-exchange chromatography // J. Chromatogr. B. 1998. V. 717. P. 27. https://doi.org/10.1016/s0378-4347(98)00247-3
Fritz J.S., Gjerde D.T. Handbook of Ion Chromatography. New Jersey: Wiley-VCH, 2009. V. 3. P. 227.
Pereira L. Porous graphitic carbon as a stationary phase in HPLC: Theory and application // J. Liq. Chromatogr. Relat. Technol. 2008. V. 31. P. 1687. https://doi.org/10.1080/10826070802126429
West C., Elfakir C., Lafosse M. Porous graphitic carbon: A versatile stationary phase for liquid chromatography // J. Chromatogr. A. 2010. V. 1217. № 19. P. 3201. https://doi.org/10.1016/j.chroma.2009.09.052
Гончарова Е.Н., Статкус М.А., Цизин Г.И., Золотов Ю.А. Пористый графитированный углерод для разделения и концентрирования гидрофильных веществ // Журн. аналит. химии. 2020. Т. 75. № 4. С. 291 (Goncharova E.N., Statkus M.A., Tsizin G.I., Zolotov Yu.A. Porous graphitized carbon for the separation and preconcentration of hydrophilic substances // J. Anal. Chem. 2020. V. 75. № 4. P. 423.) https://doi.org/10.1134/S1061934820040036
Goncharova E.N., Statkus M.A., Nesterenko P.N., Tsysin G.I., Zolotov Yu.A. Solid-phase extraction of alkylphosphonic and O-alkyl alkylphosphonic acids followed by HPLC separation using porous graphitic carbon sorbent // J. Chromatogr. A. 2021. V. 1653. Article 462420. https://doi.org/10.1016/j.chroma.2021.462420
Гончарова Е.Н., Семенова И.П., Статкус М.А., Цизин Г.И. Градиентное ВЭЖХ разделение алкилфосфоновых кислот на пористом графитированном сорбенте HYPERCARB с использованием водного раствора муравьиной кислоты в качестве подвижной фазы // Вестн. Моск. ун-та. Серия 2: Химия. 2017. Т. 58. № 6. С. 275. (Goncharova E.N., Semenova I.P., Statkus M.A., Tsysin G.I. Gradient HPLC separation of alkylphosphonic acids on a hypercarb porous graphitic carbon adsorbent with an aqueous formic acid solution as the mobile phase // Moscow Univ. Chem. Bull. 2017. V. 72. № 6. P. 255.) https://doi.org/10.3103/S0027131417060050
Rodriguez E.S., Poynter S., Curran M., Haddad P.R., Shellie R.A., Nesterenko P.N., Paull B. Capillary ion chromatography with on-column focusing for ultra-trace analysis of methanesulfonate and inorganic anions in limited volume Antarctic ice core samples // J. Chromatogr. A. 2015. V. 1409. P. 182. https://doi.org/10.1016/j.chroma.2015.07.034
Käkölä J., Alén R. A fast method for determining low-molecular-mass aliphatic carboxylic acids by high-performance liquid chromatography–atmospheric pressure chemical ionization mass spectrometry // J. Sep. Sci. 2006. V. 29. № 13. P. 1996. https://doi.org/10.1002/jssc.200600106
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


