Журнал аналитической химии, 2022, T. 77, № 10, стр. 947-955
Скрининг лекарственных соединений в крови методом масс-спектрометрии с ионизацией, индуцированной лазерной плазмой при атмосферном давлении
К. Ю. Кравец a, С. И. Тимакова a, А. А. Гречников a, *, А. С. Бородков a, П. К. Лаптинская b, В. С. Кузьмин c, Я. О. Симановский b
a Институт геохимии и аналитической химии им. В.И. Вернадского Российской академии наук
119991 Москва, ул. Косыгина, 19, Россия
b Институт общей физики им. А.М. Прохорова Российской академии наук
119991 Москва, ул. Вавилова, 38, Россия
c Московский государственный университет имени М.В. Ломоносова, биологический факультет
119234 Москва, ул. Ленинские горы, 1, стр. 12, Россия
* E-mail: grechnikov@geokhi.ru
Поступила в редакцию 08.12.2021
После доработки 24.02.2022
Принята к публикации 03.03.2022
- EDN: ZMUEQL
- DOI: 10.31857/S0044450222100085
Аннотация
Предложен способ скрининга лекарственных соединений методом масс-спектрометрии высокого разрешения с ионизацией, индуцированной лазерной плазмой при атмосферном давлении (APLPI). Аналитические характеристики метода изучены на примере пяти лекарственных соединений: лидокаина, бендазола, папаверина, хлоропирамина и карбамазепина. Получены градуировочные зависимости при анализе модельных растворов и образцов крови, определены коэффициенты чувствительности. Найдено, что величины относительного стандартного отклонения результатов анализа находятся в интервале 20−27%. Показано, что метод APLPI позволяет оперативно и надежно обнаружить факт присутствия в пробе исследованных лекарственных соединений с концентрациями на уровне 0.5–6 нг/мл. Установлено, что по чувствительности метод APLPI превосходит метод электрораспылительной ионизации при атмосферном давлении в 4–16 раз.
В середине 2000-х годов в практику масс-спектрометрии вошли и получили интенсивное развитие новые методы ионизации органических соединений при атмосферном давлении. К настоящему времени разработано большое число таких методов, которые принято обозначать как “ambient ionization mass spectrometry” [1–4]. Их отличительная особенность заключается в возможности анализа твердых, жидких и газообразных образцов сложного состава в естественных (лабораторных или полевых) условиях без или с минимальной предварительной пробоподготовкой. При проведении анализа проба находится вне масс-анализатора, генерация ионов определяемых соединений осуществляется обычно перед устройством ввода ионов в масс-спектрометр, а масс-спектры регистрируются в режиме реального времени. Процесс ионизации аналитов, как правило, является последовательностью ионно-молекулярных реакций, приводящих к образованию ионов определяемого соединения. Способ генерации первичных реагентов (ионов или возбужденных атомов и молекул) является одним из ключевых факторов, определяющих аналитические характеристики методов ионизации в атмосферном воздухе.
Ранее нами показано [5], что эффективным средством для создания высокой концентрации первичных реагентов в воздухе может служить лазерно-индуцированная плазма, образующаяся за счет воздействия наносекундными и субнаносекундными лазерными импульсами на поверхность металлической мишени. Оценка температуры плазмы, создаваемой с помощью Nd:YAG-лазера (длина волны 1.06 мкм, длительность импульса 0.5 нс с энергией в импульсе 0.25 мДж) в воздухе, показала, что в первые несколько наносекунд температура плазмы превышает 5.5 × 104 K [6]. Высокие значения начальной температуры, жесткое УФ-излучение плазмы, а также высокие значения концентрации электронов (до 1020 см–3) [7, 8] создают условия для эффективной генерации первичных ионов и возбужденных молекул, которые затем обеспечивают “мягкую” ионизацию широкого круга как полярных, так и неполярных органических соединений [5, 6, 9, 10]. В зависимости от химических свойств аналитов в масс-спектрах положительных ионов регистрируются протонированные молекулы, аддукты с катионами (обычно с ${\text{NH}}_{4}^{ + }$ и H3O+) и молекулярные ионы (катион-радикалы). В режиме регистрации отрицательных ионов наблюдаются депротонированные молекулы, аддукты с анионами и молекулярные ионы (анион-радикалы) [11]. Метод, основанный на использовании лазерно-индуцированной плазмы в качестве ионного источника для масс-спектрометрии с ионизацией на воздухе, получил название “atmospheric pressure laser plasma ionization” (APLPI) [12]. Такие отличительные особенности APLPI, как универсальность, простота и экспрессность анализа, совместимость с серийными масс-анализаторами, оборудованными ионным источником с ионизацией при атмосферном давлении, определяют высокий потенциал метода для решения широкого круга аналитических задач.
Цель данной статьи − изучение аналитических характеристик метода APLPI в сочетании с масс-спектрометрией высокого разрешения и исследование возможности применения метода для решения задачи скрининга лекарственных соединений в крови. Стандартный подход к масс-спектрометрическому определению физиологически активных веществ в биологических жидкостях базируется на использовании методов хромато-масс-спектрометрии, обеспечивающих высокую чувствительность и селективность анализа. Основным ограничением этих методов является длительная и трудоемкая процедура пробоподготовки, которая обычно включает в себя несколько последовательных стадий (например, гидролиз, экстракцию, концентрирование, дериватизацию, хроматографическое разделение) [13, 14]. В связи с этим традиционные методы анализа все чаще предваряются аналитическими скрининговыми методами, позволяющими в минимальный срок ответить на вопрос, необходим ли последующий полноценный количественный анализ пробы. Можно выделить следующие требования к скрининговым методам определения лекарственных соединений:
– минимальная пробоподготовка;
– высокая производительность анализа по сравнению с подтверждающим методом;
– простота интерпретации результатов, так как часто результат необходимо получить сразу после анализа;
– чувствительность определения, сравнимая с подтверждающим методом;
– возможность обнаружения многих компонентов одновременно в одной пробе.
В данной статье представлены результаты исследования соответствия метода APLPI этим требованиям на примере определения лекарственных соединений папаверина, хлоропирамина, дибазола, карбамазепина и лидокаина.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование. Использовали масс-спектрометр Exactive (Thermo Scientific, Германия), оборудованный орбитальной ионной ловушкой Orbitrap. В экспериментах с ионизацией на основе лазерно-индуцированной плазмы штатный ионный источник с ионизацией электрораспылением заменили на разработанный нами источник APLPI. Схема ионного источника APLPI приведена на рис. 1. Излучение импульсного лазера 1 с помощью поворотного зеркала 2 и линзы 3 с фокусным расстоянием 50 мм фокусировали на поверхности металлической мишени 4, помещенной вблизи входного отверстия атмосферного интерфейса масс-спектрометра 5. Фокусировка излучения приводит к образованию лазерной плазмы вблизи поверхности мишени. Для генерации плазмы использовали твердотельный Nd:YAG-лазер с диодной накачкой RL-03/355 (ООО “ЭЛС-94”, Россия) с длиной волны 1.06 мкм, длительностью импульса 0.5 нс, энергией в импульсе 400 мкДж и частотой повторения импульсов 100 Гц. Зеркало 2 и линза 3 установлены в держателях, обеспечивающих их перемещение таким образом, чтобы можно было менять положение фокального пятна на мишени относительно входного отверстия масс-спектрометра. Это расстояние в экспериментах составляло примерно 5 мм. Мишень 4 выполнена в виде диска из нержавеющей стали диаметром 12 мм и закреплена на валу электродвигателя 6, обеспечивающего ее вращение с частотой примерно 1 оборот/с. Вращение позволяет минимизировать влияние эрозии материала мишени на формирование плазмы.
Рис. 1.
Схема ионного источника APLPI: 1 – лазер, 2 – поворотное зеркало, 3 – фокусирующая линза, 4 – металлическая мишень, 5 – входное отверстие масс-спектрометра, 6 – электродвигатель, 7 – кювета с анализируемым образцом, 8 – индукционный нагреватель, 9 – склянка Дрекслера с бидистиллированной водой.
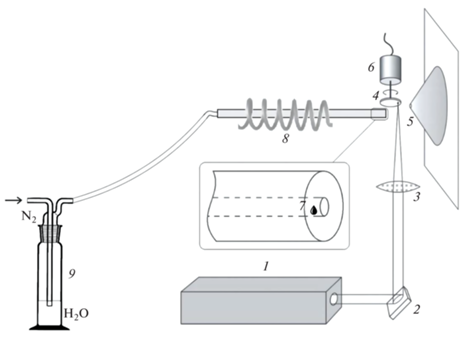
Для ввода аналита в зону ионизации использовали термодесорбционный способ. Анализируемые жидкие пробы объемом 2–10 мкл помещали в кювету из нержавеющей стали 7. После испарения растворителя кювету позиционировали на расстоянии примерно 1 см от входного отверстия масс-спектрометра 5. Положение испарительной кюветы существенным образом влияет на величину ионного сигнала, поэтому на предварительном этапе исследований нашли оптимальные геометрические параметры, при которых регистрируемый ионный ток аналитов принимал максимальные значения. Для быстрого нагрева испарительной кюветы использовали индукционный нагреватель 8, который позволял нагревать кювету до 270−280°С примерно за 20 с. Кювета представляет собой трубку из нержавеющей стали, сквозь которую можно подавать поток газа-носителя. Источником газа-носителя является азотная станция Genius NM32LA (Peak Scientific, Великобритания). Для насыщения парами воды азот пропускали через склянку Дрекслера с бидистиллированной водой.
Для анализа растворов методом электрораспыления использовали штатный ионный источник HESI-II. В экспериментах использовали следующие условия ионизации: напряжение распыления 3.8 кВ, температура капилляра 300°C, напряжение на капилляре 50.0 В, поток аналита 10 мкл/мин, давление азота 70 кПа. В анализируемые пробы добавляли муравьиную кислоту, концентрация которой составляла 0.1%.
Все исследования проводили в режиме регистрации положительных ионов. Масс-спектры записывали в диапазоне величин m/z 140−1000. Разрешающая способность масс-анализатора в экспериментах составляла 6 × 104 (для пика с m/z 195). Перед каждой серией экспериментов проводили калибровку прибора по четырем внешним стандартам в диапазоне масс 80–380 а.е.м., что обеспечивало точность определения m/z в этом диапазоне на уровне 1 ppm. Время инжекции ионов в C-trap выставляли равным 100 мс.
Реагенты. Использовали товарные лекарственные препараты: лидокаин (АО “Органика”, Россия), супрастин (Эгис, Венгрия), бендазол (Биосинтез, Россия), папаверин (Мосхимфарм препараты, Россия) в форме растворов для инъекций, а также карбамазепин (Финлепсин ретард, “Teva Operations Poland”, Польша), выделенный из твердой таблетированной формы. Растворы для инъекций растворяли в смеси метанол−вода (1 : 1) в необходимое число раз. Твердый препарат предварительно измельчали, помещали в дистиллированную воду, подщелачивали гидроксидом натрия до pH 14 и подвергали трехкратной экстракции диэтиловым эфиром. После расслоения фаз из раствора отбирали верхний эфирный слой с экстрагированным карбамазепином, растворитель выпаривали, после чего сухой остаток вновь растворяли в смеси метанол−вода (1 : 1) и готовили рабочий раствор.
Исследованные препараты широко используются в медицинской практике и могут служить хорошими индикаторами применимости метода APLPI для скрининга лекарственных соединений.
В качестве растворителей использовали метанол (Merck, Германия); хлороформ, диэтиловый эфир, ацетонитрил (Баум-Люкс, Россия); муравьиную кислоту (Arcos, Бельгия) и бидистиллированную воду. Чистота всех использованных в работе растворителей была не ниже х. ч. Модельные растворы лекарственных соединений готовили разбавлением в системе хлороформ−ацетонитрил (1 : 1) или метанол−вода (1 : 1). Использовали также хлорид аммония ч. д. а. и гидроксид натрия ч. д. а. (Баум-Люкс, Россия).
Пробоподготовка. Образцы венозной крови (5 мл) собирали асептически у ненаркотизированных кроликов из краевой вены уха с помощью инфузионной канюли G21 (Vacuette), предварительно заполненной раствором гепарина (100 U/кг) в охлажденные 5 мл гематологические стерилизованные пробирки с ЭДТА (К2/К3 2 мг) для цельной крови. После обора образцы немедленно замораживали в жидком азоте и хранили при –20°С. Все манипуляции выполняли в соответствии с актуальными требованиями руководств и этических норм по работе с лабораторными животными.
Перед проведением исследования в размороженную кровь вводили известное количество определяемого соединения. Параллельно анализировали пробы крови без дополнительного введения аналита. Для выделения лекарственных препаратов из крови использовали известную методику пробоподготовки, применяемую при хроматографическом определении аминов и других высокоосновных соединений, которая основана на жидкостной экстракции аналитов в систему хлороформ−ацетонитрил (1 : 1) с добавлением 10% по объему насыщенного раствора NH4Cl [15]. Методика состояла в следующем: к 45 мкл пробы плазмы крови добавляли 5 мкл раствора определяемых соединений в смеси метанол−вода и перемешивали на лабораторном встряхивателе в течение 2 мин. После этого в кровь добавляли 450 мкл приготовленной заранее экстрагирующей смеси. Затем образцы перемешивали на встряхивателе в течение 1 мин, центрифугировали при скорости 15 000 об/мин в течение 3 мин и отбирали органическую фракцию. Для концентрирования аналитов использовали ток сухого азота до полного испарения органического растворителя, после чего сухой остаток растворяли в 50 мкл смеси метанол–вода (1 : 1).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Аналитические характеристики метода APLPI при анализе модельных растворов. Оценка воспроизводимости при определении лекарственных соединений в лабораторном воздухе показала, что величины относительного стандартного отклонения ионного сигнала аналитов sr во всех экспериментах превышали 70% (для пяти последовательных анализов одного и того же раствора). Очевидная причина низкой воспроизводимости заключается в неконтролируемом влиянии присутствующих в воздухе мешающих соединений на процессы ионизации и последующего транспорта ионов аналитов к детектору. Относительно высокая эффективность и универсальность ионизации в условиях воздействия лазерно-индуцированной плазмы в воздухе обусловливают высокие значения фонового ионного сигнала, что влияет и на чувствительность анализа. При детектировании большого числа ионов масс-спектрометром Orbitrap лимитирующим фактором становится емкость ловушки С-trap, используемой для фокусировки и инжекции пакета ионов в орбитальную ионную ловушку [16]. Быстрое заполнение ловушки С-trap ионами мешающих соединений приводит к уменьшению времени накопления ионов аналита и, как следствие, к уменьшению его ионного сигнала [17, 18]. Негативно влияют на аналитические характеристики также матричные эффекты и главным образом эффект подавления ионизации молекул аналита.
В разработанном ионном источнике с термодесорбционным вводом пробы аналиты подаются в зону ионизации в потоке азота с насыщенными парами воды (рис. 1). Такое решение позволяет значительно снизить величину фонового сигнала и улучшить воспроизводимость результатов анализа по сравнению с ионизацией в лабораторном воздухе. Добавление паров воды в газ-носитель обусловлено тем, что молекулы воды играют ключевую роль в процессах образования ионов органических соединений в методе APLPI, являясь одним из основных источников протонов [5]. Как показали эксперименты, добавление насыщенных паров воды в чистый азот увеличивает ионный сигнал аналитов более чем на порядок величины. Величина ионного сигнала зависит также от скорости потока газа-носителя. Исследование зависимости чувствительности от расхода азота показало, что при увеличении расхода с 0 до 30 мл/мин ионный сигнал аналитов возрастает примерно в три раза, а в диапазоне величин расхода 30−100 мл/мин сигнал меняется незначительно. Дальнейшие эксперименты проводили при скорости потока азота 30 мл/мин.
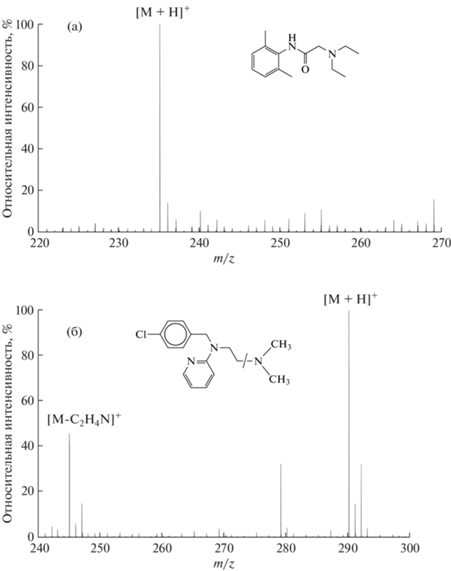
Основным каналом ионизации всех изученных в работе соединений является протонирование с образованием ионов состава [М + Н]+. Примером могут служить масс-спектры лидокаина и хлоропирамина (действующее вещество лекарственного препарата супрастин), приведенные на рис. 2. Несмотря на достаточно “жесткие” условия на начальных стадиях своего развития, лазерно-индуцированная плазма при атмосферном давлении обеспечивает “мягкую” ионизацию органических соединений с низкой степенью фрагментации ионов. Среди исследованных соединений фрагментные ионы наблюдались только в масс-спектрах хлоропирамина. Фрагментация протонированных молекул хлоропирамина обусловлена разрывом связи C–N с элиминированием амина C2H6NH (рис. 2б). При этом степень фрагментации много ниже по сравнению с такими методами, как электронная ионизация [19] и SALDI [20]. Сравнение APLPI с электрораспылительной ионизацией при атмосферном давлении (ЭРИАД) показало, что оба метода дают сходные масс-спектры.
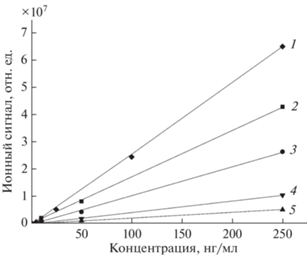
На рис. 3 представлены градуировочные зависимости ионного тока протонированых молекул аналита от его концентрации в модельном растворе. Каждая точка на приведенных зависимостях представляет собой среднее значение для трех последовательных измерений при анализе одного и того же раствора. Объем пробы, введенной в микрокювету, составлял 5 мкл. Видно, что полученные зависимости линейны в исследованном диапазоне концентраций. Коэффициенты чувствительности, определенные как тангенс угла наклона градуировочных графиков, различны для различных соединений. В ряду исследованных лекарственных веществ коэффициент чувствительности имеет максимальное значение при определении лидокаина и минимальное – при определении хлоропирамина.
Рис. 3.
Градуировочные зависимости для определения лидокаина (1), папаверина (2), дибазола (действующее вещество лекарственного препарата бендазол) (3), карбамазепина (4) и хлоропирамина (5) в модельных растворах.
Значения относительного стандартного отклонения ионного сигнала аналитов, рассчитанные на основе результатов трех последовательных анализов в различных сериях экспериментов, лежат в интервале 20−27%. Для скрининговых методов анализа одной из основных аналитических характеристик является пороговая концентрация сmin (cut-off concentration) – минимальная концентрация аналита в пробе, при определении которой вероятность получения ложноотрицательного результата не превышает заранее заданного значения, обычно 0.05 [21]. В табл. 1 приведены данные, полученные при оценке пороговой концентрации исследованных соединений, из которых следует, что величины сmin лежат в диапазоне 0.4−5 нг/мл.
Таблица 1.
Минимальные концентрации исследованных лекарственных соединений, при определении которых вероятность получения ложноотрицательного результата не превышает 0.05
| Лекарственное соединение | Брутто-формула | Характеристический ион, m/z | Минимальная (пороговая) концентрация, нг/мл | |
|---|---|---|---|---|
| в модельных растворах | в крови | |||
| Лидокаин | C14H22N2O | [М + Н]+ 235.1805 |
0.5 | 0.7 |
| Папаверин | C20H21NO4 | [М + Н]+ 340.1543 |
1 | 1.2 |
| Бендазол | C14H12N2 | [М + Н]+ 209.1073 |
0.7 | 1 |
| Карбамазепин | C15H12N2O | [М + Н]+ 237.1022 |
3 | 3.5 |
| Хлоропирамин | C16H20ClN3 | [М + Н]+ 290.1419 |
5 | 6 |
Скрининг лекарственных соединений в образцах крови. Предварительные исследования показали, что при прямом анализе крови чувствительность и воспроизводимость много ниже по сравнению с анализом модельных растворов, поэтому скрининг образцов крови без пробоподготовки методом APLPI целесообразно использовать только для относительно высоких концентраций лекарственных веществ (более 1 мкг/мл). Анализ проб с более низкими концентрациями требует применения процедуры пробоподготовки, в качестве которой в работе использовали известную методику, основанную на экстракции аналитов в систему хлороформ−ацетонитрил (1 : 1) с добавлением 10% по объему насыщенного раствора NH4Cl.
В результате экстракции происходит разбавление пробы, что соответственно увеличивает минимальную определяемую концентрацию аналита в крови. Чувствительность можно увеличить, добавив стадию концентрирования аналита путем испарения растворителя в потоке сухого азота и последующего растворения сухого остатка. В экспериментах объемы проб крови и конечного раствора были равны и составляли 50 мкл. Длительность процедуры пробоподготовки не превышала 20 мин.
В табл. 1 приведены данные по оценке пороговой концентрации при определении лекарственных соединений в крови после экстракции и концентрирования. Сравнение с результатами анализа модельных растворов показало, что пороговая концентрация при анализе образцов крови выше, однако не более чем в 1.5 раза. Оценка воспроизводимости результатов анализа крови показала, что относительные стандартные отклонения результатов анализа крови лежат примерно в том же диапазоне, что и для модельных растворов. Полученные данные свидетельствуют о том, что метод APLPI позволяет оперативно обнаружить факт присутствия в пробе исследованных лекарственных соединений с концентрациями на уровне 6 нг/мл и ниже.
В настоящее время одним из основных методов подтверждающего количественного анализа при определении лекарственных соединений в биологических жидкостях является метод хромато-масс-спектрометрии с электрораспылительной ионизацией при атмосферном давлении. Представляло интерес сравнение аналитических характеристик двух методов ионизации – APLPI и ЭРИАД − при анализе одних и тех же проб с использованием одного масс-спектрометра. На рис. 4 приведены зависимости ионного сигнала лидокаина от его концентрации в крови, зарегистрированные в экстрактах крови (без концентрирования) методами APLPI и ЭРИАД. Видно, что при одинаковых количествах введенного в прибор аналита ионный сигнал при использовании метода APLPI выше примерно в четыре раза. Однако относительное стандартное отклонение ионного сигнала в методе ЭРИАД не превышало 5%, что более чем в четыре раза ниже, чем в методе APLPI. Для других исследованных лекарственных соединений чувствительность метода APLPI была также выше – от 4 до 16 раз. Различие ионных сигналов аналитов максимально при определении бендазола (рис. 5).
Рис. 4.
Градуировочные зависимости для определения лидокаина в экстракте крови без концентрирования методами APLPI (1) и ЭРИАД (2).
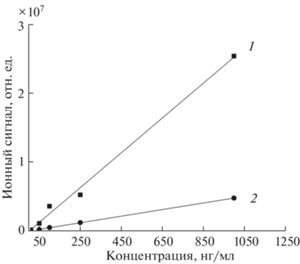
Рис. 5.
Масс-спектры бендазола в экстракте крови без концентрирования, зарегистрированные методами APLPI (а) и ЭРИАД (б). Количество введенного в прибор аналита одинаково. На вставке приведен участок масс-спектра APLPI в окрестности пика протонированных молекул бендазола.
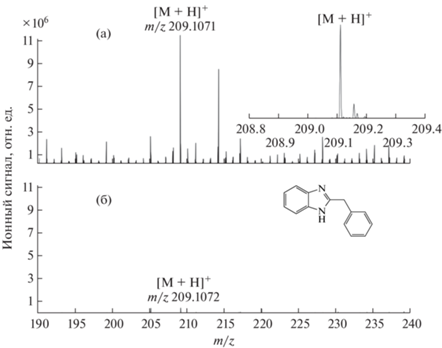
Дополнительным преимуществом метода APLPI по сравнению с ЭРИАД является малый объем пробы, необходимый для анализа, что может быть важно для решения многих задач медицины, фармацевтики и других дисциплин. Малый объем пробы предполагает также возможность концентрирования аналита на стадии пробоподготовки.
Следует отметить принципиально важную роль, которую играет высокая разрешающая способность масс-спектрометра при анализе проб сложного состава методом APLPI. На вставке к рис. 5 приведен участок масс-спектра в окрестности пика протонированных молекул бендазола. Видно, что наряду с аналитом на этом участке регистрируются восемь пиков индивидуальных соединений. Высокая разрешающая способность масс-спектрометра в сочетании с возможностью определения молекулярной массы ионов с высокой точностью позволяет избежать ошибочных ложноположительных результатов при анализе крови.
* * *
Метод ионизации органических соединений, основанный на использовании лазерно-индуцированной плазмы при атмосферном давлении, исследован в приложении к задаче скрининга лекарственных соединений. Инструментальная реализация метода основана на его сочетании с масс-спектрометрией высокого разрешения. Для подачи аналита в ионный источник реализован термодесорбционный ввод пробы в потоке азота с насыщенными парами воды. Аналитические характеристики, полученные на примере определения лидокаина, бендазола, папаверина, хлоропирамина и карбамазепина в модельных растворах и крови, показали, что масс-спектрометрия высокого разрешения с ионизацией, индуцированной лазерной плазмой при атмосферном давлении, является эффективным методом скрининга лекарственных препаратов. Метод характеризуется высокой производительностью анализа, простотой интерпретации результатов, возможностью обнаружения многих компонентов одновременно в одной пробе и высокой чувствительностью, превышающей чувствительность подтверждающего метода с ионизацией электрораспылением.
Список литературы
Harris G.A., Nyadong L., Fernandez F.M. Recent development in ambient ionization techniques for analytical mass spectrometry // Analyst. 2008. V. 133. № 10. P. 1297.
Domin M., Cody R. Ambient Ionization Mass Spectrometry. Cambridge: Royal Society of Chemistry. Cambridge, 2014. 508 p.
Лебедев А.Т. Масс-спектрометрия c ионизацией на воздухе // Успехи химии. 2015. Т. 84. № 7. С. 665. (Lebedev A.T. Ambient ionization mass spectrometry // Russ. Chem. Rev. 2015. V. 84. № 7. P. 665.)
Venter A.R., Douglass K.A., Shelley J.T., Hasman Jr G., Honarvar E. Mechanisms of real-time, proximal sample processing during ambient ionization mass spectrometry // Anal. Chem. 2014. V. 86. № 1. P. 233.
Пенто А.В., Никифоров С.М., Симановский Я.О., Гречников А.А., Алимпиев С.С. Лазерная абляция и ионизация излучением лазерной плазмы при атмосферном давлении в масс-спектрометрии органических соединений // Квантовая электроника. 2013. Т. 43. № 1. С. 55. (Pento A.V., Nikiforov S.M., Simanovsky Y.O., Grechnikov A.A., Alimpiev S.S. Laser ablation and ionisation by laser plasma radiation in the atmospheric-pressure mass spectrometry of organic compounds // Quantum Electron. 2013. V. 43. № 1. P. 55.)
Pento A.V., Bukharina A.B., Nikiforov S.M., Simanovsky Y.O., Sartakov B.G., Ablizen R.S., Fabelinsky V.I., Smirnov V.V., Grechnikov A.A. Laser-induced plasma on a metal surface for ionization of organic compounds at atmospheric pressure // Int. J. Mass Spectrom. 2021. V. 461. Article 116498.
Liu H.C., Mao X.L., Yoo J.H., Russo R.E. Early phase laser induced plasma diagnostics and mass removal during single-pulse laser ablation of silicon // Spectrochim. Acta B. 1999. V. 54. P. 1607.
Farid N., Harilal S.S., Ding H., Hassanein A. Emission features and expansion dynamics of nanosecond laser ablation plumes at different ambient pressure // J. Appl. Phys. 2014. V. 115. Article 033107.
Bierstedt A., Riedel J. Airborne laser-spark for ambient desorption/ionization // Eur. J. Mass Spectrom. 2016. V. 22. P. 105.
Bierstedt A., Kersten H., Glaus R., Gornushkin I., Panne U., Riedel J. Characterization of an airborne laser-spark ion source for ambient mass spectrometry // Anal. Chem. 2017. V. 89. P. 3437.
Кравец К.Ю., Гречников А.А., Симановский Я.О. Ионизация органических соединений в условиях воздействия излучением лазерной плазмы при атмосферном давлении // Масс-спектрометрия. 2020. Т. 17. № 4. С. 217. (Kravets K.Yu., Grechnikov A.A., Simanovsky Ya.O. Ionization of organic compounds af-fected by laser plasma radiation at atmospheric pressure // J. Anal. Chem. 2021. V. 76. № 14. P. 217.)
Алимпиев С.С., Гречников А.А., Никифоров С.М. Новые подходы в лазерной масс-спектрометрии органических объектов // Успехи физ. наук. 2015. Т. 185. № 2. С. 207. (Alimpiev S.S., Grechnikov A.A., Nikiforov S.M. New approaches to the laser mass spectrometry of organic samples // Physics-Uspekhi. 2015. V. 58. № 2. P. 191.)
Мелентьев А.Б. Практическое руководство по скринингу лекарственных, наркотических веществ и их метаболитов методом газовой хроматографии с масс-селективным детектором для целей судебной токсикологии. Челябинск: Челябинское областное бюро СМЭ, 2001. 62 с.
Maurer H.H. Perspectives of liquid chromatography coupled to low-and high-resolution mass spectrometry for screening, identification, and quantification of drugs in clinical and forensic toxicology // Ther. Drug Monit. 2010. V. 32. № 3. P. 324.
Hori T., Fujinaga T. Analytical use of solvent extraction with acetonitrile/water/chloroform and 1-propanol/water/cyclohexane mixtures // Talanta. 1985. V. 32. № 8 (2). P. 735.
Makarov A., Denisov E., Kholomeev A., Balschun W., Lange O., Strupat K., Horning S. Performance evaluation of a hybrid linear ion trap/orbitrap mass spectrometer // Anal. Chem. 2006. V. 78. № 7. P. 2113.
Makarov A., Denisov E., Lange O., Horning S. Dynamic range of mass accuracy in LTQ Orbitrap hybrid mass spectrometer // J. Am. Soc. Mass Spectrom. 2006. V. 17. № 7. P. 977.
Makarov A. Practical aspects of ion trap mass spectrometry. V. IV: Theory and Instrumentation. USA: CRC Press (Taylor & Francis), 2009. P. 922.
NIST. https://webbook.nist.gov/cgi/cbook.cgi? ID=C59325&Units=SI&Mask=200#Mass-Spec (07.12.2021).
Alimpiev S., Grechnikov A., Sunner J., Karavanskii V., Simanovsky Y., Nikiforov S., Surface-assisted laser desorption/ionization mass spectrometry with a rotating ball interface // Rapid Commun. Mass Spectrom. 2011. V.25. № 1. P. 140.
Bertil M., Örnemark U. The fitness for purpose of analytical methods: A laboratory guide to method validation and related topics Middlesex, UK: LGC, Teddington, 2014. P. 62.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии