Журнал аналитической химии, 2022, T. 77, № 10, стр. 899-910
Экстракция и определение синтетических пищевых красителей в двухфазной водной системе на основе бромида тетрабутиламмония
К. А. Лысковцева a, Г. Б. Эльдяева a, С. В. Смирнова a, *, И. В. Плетнев a
a Московский государственный университет имени М.В. Ломоносова, химический факультет
119991 Москва, Ленинские горы, 1, стр. 3, Россия
* E-mail: sv_v_smirnova@mail.ru
Поступила в редакцию 19.01.2022
После доработки 01.02.2022
Принята к публикации 01.02.2022
- EDN: BVNLSY
- DOI: 10.31857/S0044450222100103
Аннотация
Двухфазная водная система (ДФВС) на основе бромида тетрабутиламмония (TБABr) с сульфатом аммония в качестве высаливателя использована для извлечения синтетических пищевых красителей из водных растворов. Оптимизированы условия получения ДФВС TБABr–H2O–(NH4)2SO4 для микроэкстракционного концентрирования Красного очаровательного, Тартразина, Азорубина, Желтого “солнечный закат”, Зеленого прочного: 0.075 M бромид тетрабутиламмония и 33 мас. % сульфата аммония. Степень извлечения всех красителей составила не менее 97% при рН 2.3–9.5 за 1 мин. Для облегчения разделения фаз и отделения экстракта использовали фильтрование через нетканый полипропилен. Концентрат элюировали дистиллированной водой и проводили спектрофотометрическое определение красителей в элюате. Пределы обнаружения составили 0.02, 0.03, 0.03, 0.04 и 0.02 мг/л для Красного очаровательного, Азорубина, Тартразина, Желтого “солнечный закат” и Зеленого прочного соответственно. Методика применена для определения красителей в напитках, ополаскивателе для полости рта, пасхальном наборе для окрашивания яиц, лекарственном препарате “Ибупрофен”.
Синтетические красители широко применяют в пищевой промышленности для придания, усиления или восстановления цвета различных продуктов. Повсеместное использование и негативное влияние синтетических красителей на организм человека обусловливают необходимость контроля их содержания [1–3]. Основная сложность, с которой сталкиваются при определении красителей, – это неколичественное извлечение из сложных матриц и необходимость предварительного концентрирования. Для извлечения красителей из продуктов питания обычно применяют жидкостно-жидкостную экстракцию, экстракцию в точке помутнения, ультразвуковую [4–6], а также твердофазную экстракцию [4–8]. Большинство методов извлечения красителей требует использования органических растворителей [9–11], обладающих такими недостатками, как летучесть, воспламеняемость, токсичность, канцерогенность. В связи с этим востребованы экологически безопасные экстракционные системы, не содержащие органических растворителей, на основе ионных жидкостей [12–17], глубоких эвтектических растворителей [18–21] или двухфазные водные системы (ДФВС) [22].
Для экстракции гидрофильных и ионизирующихся соединений, в том числе и красителей, особенно перспективны двухфазные водные системы жидкость−жидкость с высоким содержанием воды в экстрагирующей фазе. Для образования ДФВС на основе водорастворимых полимеров, поверхностно-активных веществ, гидрофильных растворителей, ионных жидкостей и органических солей обычно необходимо введение высаливателя, изменение температуры или pH [12, 23–27]. Помимо низкой летучести очевидным достоинством ДФВС на основе органических солей является высокая полярность экстрагирующей фазы и способность к ионному обмену.
Синтетические сульфосодержащие красители присутствуют в водном растворе в виде многозарядных анионов, поэтому их обычно экстрагируют в органические растворители (хлороформ, толуол, н-бутанол, 1-гексанол/изооктан) в виде ионных ассоциатов с гидрофобными противоионами, используя четвертичные соли аммония: бромид и гидросульфат тетрабутиламмония, бромид октадецилтриметиламмония, хлориды триоктилметиламмония и цетилтриметиламмония [11, 28–31]. Межгосударственный стандарт ГОСТ 33457-2015 для анализа продуктов переработки фруктов и овощей включает метод качественного определения синтетических красителей (Амарант, Азорубин, Желтый “солнечный закат”, Тартразин, Красный очаровательный, Красный 2Ж и др.), основанный на ион-парной экстракции в хлороформ в присутствии бромида тетрабутиламмония [32]. Однако получить двухфазную систему жидкость–жидкость на основе соли четвертичного аммония можно и в отсутствие органического растворителя, смешивая соль с водой. Так, при контакте бромида тетрагексиламмония с водой образуются две несмешивающиеся жидкие фазы [33], причем для образования двухфазной системы не требуется введение высаливателя или каких-либо других воздействий. Количественная экстракция красителей (Красный очаровательный, Красный 2Ж, Азорубин, Зеленый прочный) достигается в ДФВС на основе бромида тетрагексиламмония за 1 мин [34].
Некоторые соли четвертичного аммония образуют ДФВС в присутствии высаливателей, в частности бромид тетрабутиламмония (TБABr). Эта органическая соль, хорошо растворимая в воде, с температурой плавления 99−100°C занимает пограничное положение между обычными солями и ионными жидкостями [33]. При добавлении к водному раствору TБABr достаточного количества высаливателя растворимость TБABr резко понижается, что приводит к отделению жидкой фазы, обогащенной TБABr. В качестве высаливателей можно применять (NH4)2SO4, Na2SO4, NaNO3, Na2CO3, K3C6H5O7 [35–37], а также NaH2PO4, Na2HPO4, Na3PO4 [36] и KH2PO4, K2HPO4, K3PO4 [38]. Двухфазные водные системы на основе TБABr с сульфатом аммония использовали для количественной экстракции ионов металлов [25, 35, 37]. В работе [39] показана возможность применения этой системы в микрофлюидном устройстве для экстракции метилового оранжевого (степень извлечения не более 55%). Описано применение подобных ДФВС на основе хлорида тетрабутиламмония с цитратом калия [40] или малатом натрия [41] в качестве высаливателей для экстракции кофеина, карбамазепина и нестероидных противовоспалительных препаратов.
Нами показано [25], что ДФВС на основе TБABr может быть получена в широком диапазоне концентраций фазообразующих компонентов. Оптимальный выбор соотношения концентраций компонентов и объемов образующихся фаз ДФВС может обеспечить возможность концентрирования красителей из большого объема анализируемой пробы в малый объем экстракта с высокими коэффициентами концентрирования. Высокое содержание воды в TБABr-обогащенной фазе, способность системы к ионному обмену создают условия для эффективного извлечения гидрофильных ионизирующихся соединений, таких как анионные красители.
Цель настоящей работы – изучение возможности применения ДФВС TБABr–H2O–(NH4)2SO4 для микроэкстракционного концентрирования синтетических пищевых красителей Тартразин (E102), Азорубин (E122), Красный очаровательный (E129), Желтый “солнечный закат” (E110), Зеленый прочный (E143) и их определения в напитках, жидких средах и других объектах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты, растворы, оборудование. Использовали Тартразин (85%, Sigma, США), Азорубин (50%, Aldrich, КНР), Красный очаровательный (80%, Sigma-Aldrich, Индия), Желтый “солнечный закат” (90%, Aldrich, Индия), Зеленый прочный FCF (≥85%, Sigma-Aldrich, Индия), бромид тетрабутиламмония (TБABr) (99+%, Acros Organics, Индия), сульфат аммония (97%, РусХим, Россия), соляную кислоту 37%-ную, Reag. USP (Panreac, Германия), гидроксид натрия (98%, Panreac, Германия). Структурные формулы синтетических пищевых красителей, используемых в работе, представлены на схеме 1 .
Исходные растворы красителей (5.0 × 10–2 M) готовили растворением точных навесок в дистиллированной воде. Все рабочие растворы готовили ежедневно, разбавляя исходный раствор дистиллированной водой. Растворы реагентов и красителей хранили при +4°C в недоступном для солнечного света месте. Для сбора и отделения экстракта использовали нетканый полипропилен (НПП) (протирочный материал, Kimberly-Clark Kimtech Pure W4, США).
Спектры поглощения получали на двухлучевом спектрофотометре U-2900 UV-VIS (Hitachi, Япония) с использованием кювет с длиной оптического пути l = 1 см. Значения рН измеряли на рН-метре модели 410 (Аквилон, Россия) с комбинированным стеклянным микроэлектродом ELSK-13.7. Использовали центрифугу Hettich EBA-20 (Tuttlingen, Германия). Для взвешивания веществ использовали аналитические весы ViBRA HT (Shinko Denshi, Япония). Механическое перемешивание растворов осуществляли на орбитальном шейкере ELMI S-3 (ELMI, Латвия). Содержание воды в экстрактах определяли титрованием по методу Карла Фишера с помощью титратора 870 KF Titrino plus (Metrohm, Швейцария).
Схема 1 . Структурные формулы синтетических пищевых красителей: Тартразин (I), Азорубин (II), Красный очаровательный (III), Желтый “солнечный закат” (IV), Зеленый прочный (V).
Для определения границы области фазового расслоения в системе TБABr–H2O–(NH4)2SO4 (21 ± 2°C) методом изотермического титрования готовили исходные растворы фазообразующих компонентов с концентрациями cTБABr, исх = 1.00 M и ${{c}_{{{{{({\text{N}}{{{\text{H}}}_{4}})}}_{2}}{\text{S}}{{{\text{O}}}_{4}},{\text{\;исх}}}}}$ = 3.93 M (44 мас. %) растворением точных навесок (±10-4 г) в дистиллированной воде. Двухфазные системы, полученные смешением исходных растворов TБABr и (NH4)2SO4 в объемных соотношениях VTБABr : ${{V}_{{{{{({\text{N}}{{{\text{H}}}_{4}})}}_{2}}{\text{S}}{{{\text{O}}}_{4}}}}}$ от 3 : 1 до 1 : 99, общий объем 10.0 мл, титровали дистиллированной водой при постоянном перемешивании магнитной мешалкой до исчезновения опалесценции. Точку однофазности системы (прозрачный раствор) фиксировали визуально [42]. Отмечали объем воды (${{V}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$), потраченный на титрование, и рассчитывали концентрации ${{c}_{{{{{({\text{N}}{{{\text{H}}}_{4}})}}_{2}}{\text{S}}{{{\text{O}}}_{4}},{\text{ктт\;}}}}}$ и cTБABr, ктт в конечной точке титрования по следующим формулам:
Содержание компонентов в рассчитанных точках отвечает соответствующим точкам на бинодальной кривой.
Получение двухфазных водных систем и экстракция красителей. Для получения ДФВС и изучения экстракции красителей в пластиковую пробирку вносили 3.0 мл раствора сульфата аммония с концентрацией от 30 до 47 мас. %, добавляли 0.4 мл 5.0 × 10−4 M раствора красителя (1.0 × × 10–4 M для Зеленого прочного), 0.4 мл дистиллированной воды или растворов HCl или NaOH для создания нужного значения рН, 0.2 мл 1.5 M раствора бромида тетрабутиламмония. Пробирки встряхивали в течение 1 мин. Для разделения фаз содержимое пробирки фильтровали через стеклянную воронку, горлышко которой заполняли нетканым полипропиленом. При этом водная фаза свободно проходила через НПП, а фаза, обогащенная бромидом тетрабутиламмония с извлеченным красителем, удерживалась на фильтре. Измеряли равновесное значение рН водной фазы и использовали ее для спектрофотометрического определения остаточного содержания красителей по собственному поглощению при длине волны максимального поглощения 503, 516, 426, 481, 624 нм для Красного очаровательного, Тартразина, Азорубина, Желтого “солнечный закат”, Зеленого прочного соответственно. При определении красителей в объектах экстракт смывали с НПП 2.0 мл дистиллированной воды и проводили спектрофотометрическое определение красителей в элюате.
Степень извлечения красителей (R, %) рассчитывали по формуле:
Экстракционно-фотометрическое определение красителей в напитках, жидких средах и других объектах. Красители Красный очаровательный, Желтый “солнечный закат” и Зеленый прочный определяли в напитках “Lifeline”, “Mirinda” и ополаскивателе “Listerine” без предварительной пробоподготовки, объемы аликвот составили 1.0, 1.0 и 0.5 мл соответственно. Для определения Азорубина и Тартразина в пасхальном наборе растворяли 100 мг образца, содержащего Азорубин (или Тартразин) в 100.0 мл дистиллированной воды, объем аликвоты – 10.0 мл.
Для определения красителя в пластиковую пробирку емк. 15 мл вводили аликвоту анализируемого образца (1.0–10.0 мл), дистиллированную воду до суммарного объема 10.0 мл. Добавляли 4.5 г сульфата аммония и 0.5 мл 1.5 M раствора ТБАBr. Пробирки встряхивали в течение 1 мин, разделяли фазы фильтрованием через воронку, наполненную НПП. Экстракт, удерживаемый на полипропиленовом фильтре, элюировали 2.0 мл дистиллированной воды. Регистрировали спектры поглощения элюата и измеряли оптическую плотность в максимуме поглощения. Содержание красителя рассчитывали по градуировочным зависимостям.
При определении Азорубина в оболочке лекарственного препарата “Ибупрофен” объем водной фазы уменьшили до 4.0 мл из-за низкого содержания красителя. Концентрации фазообразующих компонентов соответствовали оптимальным для получения ДФВС и количественной экстракции (сТВАВr = 0.075 М, ${{c}_{{{{{({\text{N}}{{{\text{H}}}_{4}})}}_{2}}{\text{S}}{{{\text{O}}}_{4}}}}}$ = 33 мас. %). К одной таблетке препарата добавляли 4.0 мл дистиллированной воды, после растворения оболочки водный раствор отделяли декантацией. После центрифугирования в течение 5 мин при 4000 об/мин и отделения нерастворимого остатка отбирали аликвоту 2.0 мл и вносили навеску 1.2 г сульфата аммония, 0.5 мл раствора 1.5 M ТБАBr, доводили дистиллированной водой до объема 4.0 мл. Экстракцию красителей проводили аналогично процедуре, описанной выше.
Подготовка полосок нетканого полипропилена. Нетканый полипропилен промывали дистиллированной водой, а затем сушили при комнатной температуре. Лист НПП разрезали на полоски одинакового размера (20 × 30 мм) и массы (50 ± 1 мг). Затем скручивали полоску НПП и помещали в горлышко стеклянной воронки.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Условия образования двухфазной водной системы. Двухфазная водная система на основе бромида тетрабутиламмония и неорганической соли образуется вследствие высаливающего эффекта при смешении в определенных соотношениях фазообразующих компонентов. Для высаливания эффективны соли с многозарядными анионами. Способность натриевых солей к высаливанию бромида тетрабутиламмония соответствует ряду Гофмейстера: ${\text{PO}}_{4}^{{3 - }} \gg {\text{ HPO}}_{4}^{{2 - }}$ > ${\text{СO}}_{3}^{{2 - }}$ > ${\text{SO}}_{4}^{{2 - }}$ > H2PO4 [36], наиболее эффективны ионы с высокой плотностью заряда, например фосфат-ион. Следует отметить, что в результате применения разных высаливателей значения рН в сосуществующих фазах двухфазной системы оказываются различными. При использовании фосфатов и карбонатов расслоение происходит в щелочной области. При уменьшении рН способность системы к расслоению снижается, что связано с протонированием анионов и уменьшением заряда и, как следствие, снижением высаливающего действия [43]. В кислой среде возможно осаждение солей (высаливателей) за счет снижения растворимости.
В качестве агента, вызывающего расслаивание фаз, использовали сульфат аммония, позволяющий высаливать TБABr в широкой области рН. Растворимость сульфата аммония почти в три раза выше растворимости сульфата натрия [44], что может способствовать высаливанию бромида тетрабутиламмония из его водных растворов с меньшими концентрациями.
Образование ДФВС TБABr–H2O–(NH4)2SO4 происходит в широком диапазоне концентраций фазообразующих компонентов. Объемное соотношение сосуществующих фаз зависит от состава системы. Варьирование концентраций TБABr и (NH4)2SO4 позволяет менять соотношение объемов фаз ДФВС. При уменьшении концентрации TБABr и увеличении содержания высаливателя в системе уменьшается объем экстрагирующей фазы.
Для исследования возможности применения ДФВС для микроэкстракционного концентрирования определили границу области фазового расслоения при высоких концентрациях сульфата аммония (до 3.5 М или 38 мас. %). Границы области фазового расслоения при (21 ± 2)°C представлены на рис. 1. Бинодальная кривая отделяет область концентраций компонентов, образующих две несмешивающиеся водные фазы L1 + L2 (выше кривой), от однофазной области L (на кривой и ниже). Расслаивание в системе происходит самопроизвольно и быстро после смешения компонентов. Образующиеся фазы являются прозрачными, легкоподвижными жидкостями.
Рис. 1.
Границы области фазового расслоения в системе бромид тетрабутиламмония–H2O–(NH4)2SO4 (21°C).
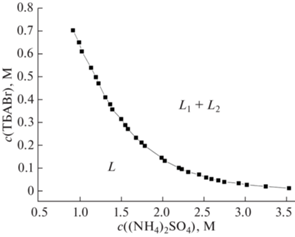
Из сравнения полученной бинодали с данными работы [36] следует, что количество сульфата натрия, необходимое для высаливания бромида тетрабутиламмония, несколько меньше по сравнению с количеством сульфата аммония. Например, для высаливания ТВАВr из 0.55 М водного раствора требуется 0.89 М раствор Na2SO4 или 1.15 М раствор (NH4)2SO4. Тем не менее граница области расслоения расширяется при использовании сульфата аммония в части диаграммы, соответствующей высокому содержанию неорганической соли. Применение сульфата аммония в качестве компонента, вызывающего расслаивание фаз, позволяет высаливать бромид тетрабутиламмония из его водных растворов с концентрацией до 0.009 М (при содержании сульфата аммония 3.5 М или 38 мас. %, рис. 1). В работе [36] бромид тетрабутиламмония высаливали из его водных растворов с содержанием не ниже 0.119 М (или 0.1226 моль/кг) при содержании сульфата натрия до 20 мас. % (1.56 М или 1.7762 моль/кг), что близко к растворимости сульфата натрия в воде [44].
Для выбора условий экстракционного концентрирования изучали влияние содержания сульфата аммония и бромида тетрабутиламмония на соотношение объемов разделяющихся фаз и на эффективность экстракции красителей.
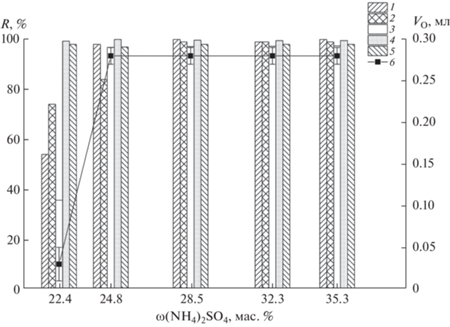
Для извлечения красителей из небольших объемов водных растворов (до 10 мл) выбирали условия получения ДФВС, варьируя концентрации фазообразующих компонентов. Установили, что при концентрации TБABr 0.188 М образование ДФВС TБABr–H2O–(NH4)2SO4 происходит при содержании сульфата аммония > 22 мас. % (рис. 2). Количественная экстракция всех исследуемых красителей достигается при содержании (NH4)2SO4 ≥ 29 мас. %. В этих условиях степень извлечения составила более 97% для всех красителей (рис. 2). При содержании сульфата аммония более 29 мас. % объем TБABr-обогащенной фазы оставался постоянным и составлял 0.28 ± ± 0.02 мл. При уменьшении содержания сульфата аммония в системе до 25 мас. % и ниже объем экстракта уменьшался, а при концентрации высаливателя ниже 20 мас. % разделения системы на две фазы не происходило. В дальнейших исследованиях ДФВС получали при содержании сульфата аммония 33 мас. % (2.97 моль/л).
Рис. 2.
Зависимость степени извлечения красителей и объема отделившейся фазы, обогащенной бромидом тетрабутиламмония, от содержания сульфата аммония в двухфазной водной системе; сTБABr = 0.188 М, рН 5.2–5.9. 1 – Красный очаровательный, 2 – Азорубин, 3 – Тартразин, 4 – Желтый “солнечный закат”, 5 – Зеленый прочный, 6 – объем отделяющейся фазы, обогащенной бромидом тетрабутиламмония.
Концентрацию TБABr, оптимальную для образования ДФВС и обеспечивающую количественную экстракцию красителей, варьировали в диапазоне 0.019–0.188 М, добавляя 0.05–0.5 мл 1.5 M раствора TБABr. Общий объем ДФВС составлял 4.0 мл, содержание (NH4)2SO4 – 33 мас. %. Установили, что при содержании 0.019 М TБABr система остаётся однофазной, однако уже при концентрации 0.038 М TБABr происходит образование микрокапель новой фазы, а при увеличении концентрации TБABr до 0.056 М экстракция красителей протекает количественно; однако объем экстракта слишком мал для точного измерения и получения воспроизводимых результатов (рис. 3).
Рис. 3.
Зависимость степени извлечения красителей и объема отделившейся фазы, обогащенной бромидом тетрабутиламмония, от концентрации бромида тетрабутиламмония в двухфазной водной системе; ${{c}_{{{{{({\text{N}}{{{\text{H}}}_{4}})}}_{2}}{\text{S}}{{{\text{O}}}_{4}}}}}$ = 33 мас. %, рН 5.2–5.9. 1 – Красный очаровательный, 2 – Азорубин, 3 – Тартразин, 4 – Желтый “солнечный закат”, 5 – Зеленый прочный, 6 – объем отделяющейся фазы, обогащенной бромидом тетрабутиламмония.
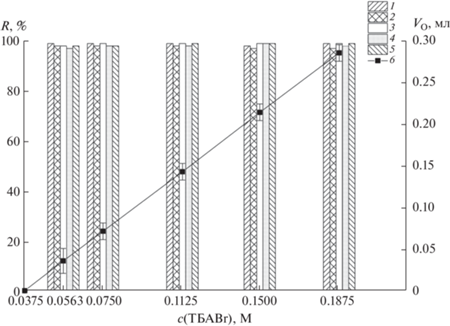
Для работы в режиме микроэкстракции использовали минимально возможное содержание TБABr в системе 0.075 М, обеспечивающее количественную экстракцию красителей и удовлетворительную воспроизводимость результатов; при этом объем верхней отделившейся TБABr-обогащенной фазы составил 70 ± 5 мкл, а объем фазы, обогащенной сульфатом аммония, – 3.93 ± 0.01 мл. Таким образом, соотношение объемов водной и органической фаз составило 56 : 1, что значительно выше, чем в ряде работ по экстракции в ДФВС на основе бромида тетрабутиламмония [35, 37, 39].
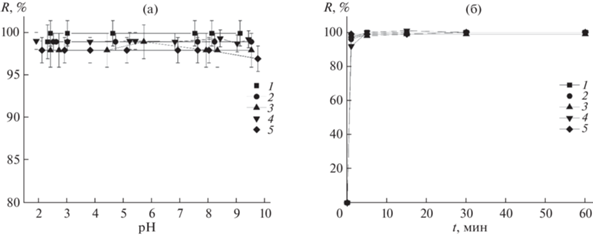
Выбор условий экстракции красителей в двухфазной водной системе. Азорубин, Красный очаровательный, Тартразин, Желтый “солнечный закат”, Зеленый прочный являются водорастворимыми сульфосоединениями, ионное состояние которых зависит от рН. Установлено, что красители экстрагируются количественно в ДФВС TБABr–H2O–(NH4)2SO4 в широком диапазоне рН от 2.3 до 9.5 (рис. 4а), где они существуют в виде разно- и многозарядных анионов, т.е. ионное состояние не влияет на степень извлечения красителей: трех- и четырехзарядные анионы извлекаются так же эффективно, как и однозарядные. Экстракция многозарядных ионов несвойственна традиционным экстракционным системам с молекулярными растворителями. Уменьшение степени извлечения с увеличением заряда ионов красителей отмечали и в системах на основе оксиэтилированных неионных поверхностно-активных веществ [26].
Рис. 4.
Зависимость степени извлечения красителей от pH (а) и времени контакта фаз (б). сTБABr = 7.5 × 10–2 М, ${{c}_{{{{{({\text{N}}{{{\text{H}}}_{4}})}}_{2}}{\text{S}}{{{\text{O}}}_{4}}}}}$ = 33 мас. %, Vв/Vо = 56. 1 – Красный очаровательный, 2 – Азорубин, 3 – Тартразин, 4 – Желтый “солнечный закат”, 5 – Зеленый прочный.
Поскольку в исследуемой области рН красители существуют в виде многозарядных анионов, логично предположить анионообменный механизм экстракции в системе TБABr–H2O–(NH4)2SO4: обмен аниона красителя на бромид-ионы в результате конкуренции за катион тетрабутиламмония TБA+. Экстрагирующая фаза ДФВС содержит в качестве основного фазообразующего компонента гидрофобный катион тетрабутиламмония, который может выполнять функцию противоиона при экстракции анионных форм красителя. Кроме того, на эффективности экстракции красителя в системе TБABr–H2O–(NH4)2SO4 положительно сказывается, по-видимому, высокое содержание воды в экстрагирующей TБABr-обогащенной фазе: 36.7 мас. % или 0.91 м.д. (при концентрации 0.075 М TБABr в исходном растворе и 33 мас. % (NH4)2SO4, установлено титрованием по Карлу Фишеру). Содержание воды в этой фазе практически не изменяется в диапазоне pH от 3 до 8. Вероятно, перенос высокогидрофильных/гидратированных соединений из водной в экстрагирующую фазу с высоким содержанием воды в этом случае не требует существенной дегидратации экстрагируемых соединений.
Независимость степени извлечения от состояния ионизации растворенного вещества в водной фазе наблюдали ранее для двухфазной системы бромид тетрагексиламмония–вода [34], а также в системах на основе гидрофильно-гидрофобных ионных жидкостей [45]. Для всех этих систем характерно высокое содержание воды (не ниже 68 мол. %) в экстрагирующей фазе [34, 45] и количественная экстракция гидрофильных соединений.
Установлено, что красители Красный очаровательный, Азорубин, Тартразин, Желтый “солнечный закат”, Зеленый прочный экстрагируются количественно в диапазоне концентраций от 1 × 10–5 М до 1 × 10–2 М; степень извлечения не ниже 98% при pH 5.2–5.9. Как видно из рис. 4б, извлечение 99% и более достигается через 5 мин. Довольно высокие степени извлечения 92–98% наблюдали для всех красителей при времени контакта фаз 1 мин. Высокая скорость экстракции выгодно отличает систему TБABr–H2O–(NH4)2SO4 от экстракционных систем, в которых количественная экстракция достигается при более длительном контакте фаз или при более высокой температуре [26, 28, 46].
Высокое объемное соотношение водной и органической фаз позволяет реализовать высокий коэффициент концентрирования. Однако существенной проблемой является отделение экстракта малого объема, обладающего низкой вязкостью и плотностью ниже, чем у воды, от водной фазы для дальнейшего анализа. Для отделения и сбора экстракта малого объема проводили фильтрование пробы через стеклянную воронку, горлышко которой плотно заполняли нетканым полипропиленом [25], который пропускал воду, но удерживал “органическую” фазу. Процедура фильтрования занимала не более 30 с и позволила избежать стадии центрифугирования. Высокая пористость, обусловленная наличием пустот между волокнами материала, олеофильные и гидрофобные свойства материала обеспечивают удерживание экстракта, в то время как водная фаза свободно (не требуется давление или вакуум) проходит через фильтр из НПП.
Поскольку экстракт хорошо растворяется в воде, не содержащей высаливателя, после разделения фаз его смывали с полипропиленового фильтра 2.0 мл дистиллированной воды. Такой объем элюента обеспечивал количественное извлечение красителей с полипропиленового фильтра и являлся оптимальным для последующего спектрофотометрического определения.
Определение красителей в напитках, жидких средах и в оболочке лекарственного препарата. Выбранные условия экстракции красителей в ДФВС TБABr–H2O–(NH4)2SO4 (сTБABr = 7.5 × 10–2 М, ${{c}_{{{{{({\text{N}}{{{\text{H}}}_{4}})}}_{2}}{\text{S}}{{{\text{O}}}_{4}}}}}$ = 33 мас. %) использовали для их экстракционно-фотометрического определения. Поскольку для создания ДФВС требуется добавление значительного объема концентрированного раствора высаливателя (NH4)2SO4, при определении красителей в объектах сульфат аммония добавляли в твердом виде (точную навеску) в количестве, соответствующем условию образования ДФВС и обеспечивающем количественную экстракцию.
Для построения градуировочных зависимостей и определения красителей в пластиковые пробирки емк. 15 мл помещали аликвоту 1.0 мл стандартного раствора красителя (или 1.0–10.0 мл анализируемого образца), добавляли дистиллированную воду. Суммарный объем составлял 10.0 мл. Добавляли 4.5 г сульфата аммония и 0.5 мл 1.5 M раствора TBABr. Пробирки встряхивали в течение 1 мин, затем разделяли фазы фильтрованием через воронку, наполненную НПП. Экстракт, удерживаемый на полипропиленовом фильтре, элюировали 2.0 мл дистиллированной воды. Регистрировали спектры поглощения элюата и измеряли оптическую плотность в максимуме поглощения. Аналогичную процедуру выполняли для холостых растворов.
Характеристики методики экстракционно-фотометрического определения красителей (уравнение градуировочных зависимостей, диапазон линейности, предел обнаружения cмин) представлены в табл. 1. Градуировочные зависимости для каждого красителя строили как зависимости оптической плотности органической фазы (экстракта, разбавленного водой, или элюата) от концентрации красителя (мг/л) при 503, 519, 426, 481 и 609 нм для Красного очаровательного, Азорубина, Тартразина, Желтого “солнечный закат” и Зеленого прочного соответственно. Пределы обнаружения рассчитывали по 3s-критерию. Относительное стандартное отклонение, полученное для трех повторных экспериментов (n = 3, P = 0.95), при концентрации красителей 1.0 мг/л составило 0.03, 0.04, 0.05, 0.04, 0.05 для Красного очаровательного, Азорубина, Тартразина, Желтого “солнечный закат” и Зеленого прочного соответственно.
Таблица 1.
Аналитические характеристики спектрофотометрического определения красителей после экстракции в двухфазной водной системе бромид тетрабутиламмония–H2O–(NH4)2SO4 (n = 3, P = 0.95)
| Краситель | Уравнение градуировочной зависимости A = ac (мг/л) + b | λ, нм | Диапазон линейности, мг/л | Коэффициент корреляции (r) | смин, мг/л |
|---|---|---|---|---|---|
| Красный очаровательный | A = (157 ± 4) × 10–3c + (0.02 ± 0.01) | 496 | 0.05–7.5 | 0.9976 | 0.02 |
| Азорубин | A = (124 ± 3) × 10–3c + (0.03 ± 0.01) | 519 | 0.05–7.5 | 0.9967 | 0.03 |
| Тартразин | A = (197 ± 3) × 10–3c + (0.03 ± 0.01) | 426 | 0.05–8.0 | 0.9991 | 0.03 |
| Желтый “солнечный закат” | A = (221 ± 6) × 10–3c + (0.05 ± 0.02) | 481 | 0.02–4.5 | 0.9973 | 0.04 |
| Зеленый прочный | A = (507 ± 6) × 10–3c + (0.03 ± 0.01) | 609 | 0.01–2.0 | 0.9995 | 0.02 |
Красители Красный очаровательный, Желтый “солнечный закат”, Зеленый прочный, Азорубин и Тартразин определяли в напитках “Lifeline” и “Mirinda”, ополаскивателе “Listerine”, пасхальном наборе, лекарственном препарате “Ибупрофен” (составы исследуемых объектов, заявленные производителем, представлены в табл. 2). Условия пробоподготовки всех исследуемых объектов описаны в “Экспериментальной части” и в табл. 2.
Таблица 2.
Состав исследуемых объектов и предварительная подготовка образцов
| Объект анализа | Состав | Пробоподготовка/объем аликвоты или навеска образца |
|---|---|---|
| Безалкогольный негазированный витаминизированный напиток клубника-ваниль “Lifeline” (ООО “Фонте Аква”, Россия) | Подготовленная артезианская вода, сахар, регулятор кислотности лимонная кислота, ароматизаторы, консервант сорбат калия, краситель Красный очаровательный, премикс витаминный | Без пробоподготовки/1.0 мл |
| Безалкогольный газированный напиток “Mirinda” (ООО “ПепсиКо Холдингс”, Россия) | Вода, сахар, лимонная кислота, цитрат натрия, сульфит натрия, краситель Желтый “солнечный закат”, аскорбиновая кислота, ароматизатор “Апельсин” | Без пробоподготовки/1.0 мл |
| Ополаскиватель для полости рта “Listerine” (“Джонсон и Джонсон С.п.А.”, Италия) | Полипропиленгликоль, лаурилсульфат натрия, цинеол, бензойная кислота, бензоат натрия, метилсалицилат, тимол, сахаринат натрия, фторид натрия, ментол, сукралоза, CI 42053a | Без пробоподготовки/0.5 мл |
| Пасхальный набор сухих красителей “Пищевые красители для окрашивания яиц” (“РОКОС”, Сергиев Посад) | Сольb, красители пищевые (E102, E122, E133) | 100 мг образца, содержащего Азорубин (или Тартразин) растворяли в 100.0 мл дистиллированной воды/10.0 мл |
| Таблетированная форма лекарственного препарата “Ибупрофен” (Белмедпрепараты РУП, Беларусь) | Гидроксипропилметилцеллюлоза (HPMC) 6cP 1.25 мг, коповидон 1.125 мг, полидекстроза 0.75 мг, макрогол-3350 (полиэтиленгликоль 3350) 0.475 мг, каприлик/каприк триглицериды (триглицериды средней цепи) 0.15 мг, титана диоксид 1.219 мг, краситель Азорубин (кармуазин Лейк) (E122) 0.005 мгc | К одной таблетке препарата добавляли 4.0 мл дистиллированной воды, после растворения оболочки водный раствор отделяли декантацией. После центрифугирования в течение 5 мин при 4000 об/мин и отделения нерастворимого остатка отбирали аликвоту 2.0 мл |
Исследовали мешающее влияние сахарозы, аскорбиновой и лимонной кислот, обычно содержащихся в различных пищевых продуктах и напитках в больших количествах, на экстракцию красителей при соотношении молярных концентраций красителя и мешающего компонента от 1 : 1 до 1 : 1000. Установили, что даже при 1000-кратном избытке мешающего компонента по отношению к красителю степень извлечения красителей в системе TБABr–H2O–(NH4)2SO4 составила не менее 92%.
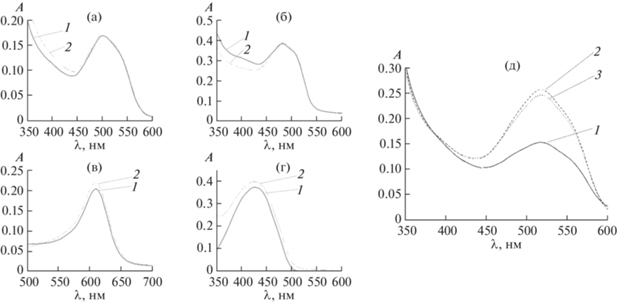
Правильность методики экстракционно-фотометрического определения проверяли методом введено−найдено (табл. 3). Идентификацию красителей проводили сравнением молекулярных спектров поглощения экстрактов, полученных после экстракции красителя из стандартного раствора и из анализируемого объекта. Как видно из рис. 5, форма спектров и максимумы поглощения экстрактов совпадают.
Таблица 3.
Результаты* экстракционно-фотометрического определения красителей в различных объектах (n = 3, P = 0.95)
| Объект анализа |
Краситель | Введено | Найдено | sr | R**, % |
|---|---|---|---|---|---|
| Напиток “Lifeline” | Красный очаровательный | 0 | 1.00 ± 0.05 | 0.05 | – |
| 1.0 | 2.0 ± 0.1 | 0.05 | 100 | ||
| 2.0 | 3.0 ± 0.1 | 0.03 | 100 | ||
| Напиток “Mirinda” | Желтый “солнечный закат” | 0 | 3.1 ± 0.1 | 0.03 | – |
| 2.2 | 5.2 ± 0.2 | 0.04 | 95 | ||
| 4.6 | 7.6 ± 0.2 | 0.03 | 98 | ||
| Ополаскиватель “Listerine” | Зеленый прочный | 0 | 3.6 ± 0.1 | 0.03 | – |
| 6.1 | 9.4 ± 0.2 | 0.02 | 95 | ||
| 12.1 | 15.5 ± 0.3 | 0.02 | 98 | ||
| Пасхальный набор | Азорубин | 0 | 32 ± 1 | 0.03 | – |
| 20 | 53 ± 1 | 0.01 | 105 | ||
| 40 | 73 ± 1 | 0.01 | 102 | ||
| Тартразин | 0 | 34.6 ± 0.6 | 0.02 | – | |
| 21 | 55 ± 1 | 0.01 | 97 | ||
| 43 | 78 ± 1 | 0.01 | 101 | ||
| Ибупрофен | Азорубин | 0 | 5.3 ± 0.4 | 0.07 | – |
| 5.0 | 10.8 ± 0.5 | 0.05 | 109 | ||
| 10.0 | 14.8 ± 0.5 | 0.03 | 95 |
* Результаты анализа напитков “Lifeline” и “Mirinda”, а также ополаскивателя “Listerine” приведены в мг/л; пасхального набора – в мг/г; Ибупрофена – в мкг. ** Рассчитано как (снайдено – $с_{{{\text{найдено}}}}^{0}$)/свведено × 100%, где снайдено, $с_{{{\text{найдено}}}}^{0}$ – найденная концентрация красителя с добавкой и без добавки соответственно; свведено – введенная концентрация красителя.
Рис. 5.
Молекулярные спектры поглощения экстрактов: (а) – Красный очаровательный, (б) – Желтый “солнечный закат”, (в) – Зеленый прочный, (г) – Тартразин, (д) – Азорубин. 1 – после извлечения из стандартного раствора красителя; 2, 3 – после извлечения красителя из анализируемого объекта; (д): 2 – Пасхальный набор, 3 – Ибупрофен.
Результаты определения красителей в объектах методом введено–найдено, представленные в табл. 3, свидетельствуют о правильности и хорошей воспроизводимости методики. Найденное с помощью предложенной экстракционно-фотометрической методики содержание Азорубина в оболочке одной таблетки “Ибупрофен” составило 5.3 ± 0.4 мкг (n = 3, P = 0.95), что соответствует в пределах доверительного интервала данным, заявленным производителем (табл. 2).
* * *
Таким образом, двухфазная водная система TБABr–H2O–(NH4)2SO4 обеспечивает количественную экстракцию красителей Красный очаровательный, Азорубин, Тартразин, Желтый “солнечный закат”, Зеленый прочный из водных растворов, отличается легкостью получения, доступностью реагентов, позволяет избежать применения токсичных органических растворителей. Предложенная методика экстракционно-фотометрического определения красителей характеризуется простотой, экспрессностью, доступностью используемого оборудования и легкостью реализации в лабораторных условиях.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (грант № 20-03-00354).
Список литературы
Amin K.A., Abdel Hameid H., Abd Elsttar A.H. Effect of food azo dyes tartrazine and carmoisine on biochemical parameters related to renal, hepatic function and oxidative stress biomarkers in young male rats // Food Chem. Toxicol. 2010. V. 48. № 10. P. 2994.
Bateman B. The effects of a double blind, placebo controlled, artificial food colourings and benzoate preservative challenge on hyperactivity in a general population sample of preschool children // Arch. Dis. Child. 2004. V. 89. № 6. P. 506.
McCann D., Barrett A., Cooper A., Crumpler D., Dalen L., Grimshaw K., Kitchin E., Lok K., Porteous L., Prince E., Sonuga-Barke E., Warner J.O, Stevenson J. Food additives and hyperactive behaviour in 3-year-old and 8/9-year-old children in the community: A randomised, double-blinded, placebo-controlled trial // The Lancet. 2007. V. 370. № 9598. P. 1560.
Siddiquee S., Shafwanah A.M.S. Toxicology and analytical methods for the analysis of allura red (E129) in food and beverage products: A current perspective / Safety Issues in Beverage Production. Elsevier, 2020. P. 335.
Yamjala K., Nainar M.S., Ramisetti N.R. Methods for the analysis of azo dyes employed in food industry – A review // Food Chem. 2016. V. 192. P. 813.
Rovina K., Siddiquee S., Shaarani S.M. Extraction, analytical and advanced methods for detection of Allura Red AC (E129) in food and beverages products // Front. Microbiol. 2016. V. 7. № 798. P. 1.
Tikhomirova T.I., Ramazanova G.R., Apyari V.V. Effect of nature and structure of synthetic anionic food dyes on their sorption onto different sorbents: Peculiarities and prospects // Microchem. J. 2018. V. 143. P. 305.
Rukosueva E.A., Aliyarova G.R., Tikhomirova T.I., Apyari V.V., Nesterenko P.N. Simultaneous determination of synthetic food dyes using a single cartridge for preconcentration and separation followed by photometric detction // Int. J. Anal. Chem. 2020. V. 2020. P. 1.
Soylak M., Unsal Y.E., Tuzen M. Spectrophotometric determination of trace levels of allura red in water samples after separation and preconcentration // Food Chem. Toxicol. 2011. V. 49. № 5. P. 1183.
Tang B, Xi C., Zou Y., Wang G. Simultaneous determination of 16 synthetic colorants in hotpot condiment by high performance liquid chromatography // J. Chromatogr. B. 2014. V. 960. P. 87.
Faraji M., Nasiri Sahneh B., Javanshir R. An ion-pair dispersive liquid-liquid microextraction for simultaneous determination of synthetic dyes in ice cream samples by HPLC // Anal. Bioanal. Chem. Res. 2017. V. 4. № 2. P. 213.
Sha O., Zhu X., Feng Y., Ma W. Aqueous two-phase based on ionic liquid liquid–liquid microextraction for simultaneous determination of five synthetic food colourants in different food samples by high-performance liquid chromatography // Food Chem. 2015. V. 174. P. 380.
Wu H., Guo J., Du L., Tian H., Hao C., Wang Z., Wang J. A rapid shaking-based ionic liquid dispersive liquid phase microextraction for the simultaneous determination of six synthetic food colourants in soft drinks, sugar- and gelatin-based confectionery by high-performance liquid chromatography // Food Chem. 2013. V. 141. № 1. P. 182.
Liu J., Wang L., Zhu W., Jia C., Deng Q., Yao S. Temperature-assisted removal of triphenylmethane dyes from water with novel hydrophobic benzothiazolium ionic liquids // Sep. Sci. Technol. 2014. V. 49. № 1. P. 146.
Lin J., Teng Y., Lu Y., Lu S., Hao X., Cheng D. Usage of hydrophobic ionic liquid [BMIM][PF6] for recovery of acid dye from wastewater and sequential application in tussah silk dyeing: Recovery of acid dye from wastewater // CLEAN – Soil, Air, Water. 2014. V. 42. № 6. P. 799.
Li Q., Liu W., Zhu X. Green choline amino acid ionic liquid aqueous two-phase extraction coupled with HPLC for analysis sunset yellow in beverages // Food Anal. Methods. 2019. V. 12. № 11. P. 2527.
Sha O., Zhu X., Feng Y., Ma W. Determination of Sunset Yellow and Tartrazine in food samples by combining ionic liquid-based aqueous two-phase system with high performance liquid chromatography // J. Anal. Methods Chem. 2014. V. 2014. P. 1.
Faraji M. Determination of some red dyes in food samples using a hydrophobic deep eutectic solvent-based vortex assisted dispersive liquid-liquid microextraction coupled with high performance liquid chromatography // J. Chromatogr. A. 2019. V. 1591. P. 15.
Kanberoglu G.S., Yilmaz E., Soylak M. Developing a new and simple ultrasound-assisted emulsification liquid phase microextraction method built upon deep eutectic solvents for Patent Blue V in syrup and water samples // Microchem. J. 2019. V. 145. P. 813.
Ghorbani Ravandi M., Fat’hi M.R. Green effervescence assisted dispersive liquid–liquid microextraction based on a hydrophobic deep eutectic solvent for determination of Sunset Yellow and Brilliant Blue FCF in food samples // New J. Chem. 2018. V. 42. № 18. P. 14901.
Zhu S, Zhou J., Jia H., Zhang H. Liquid–liquid microextraction of synthetic pigments in beverages using a hydrophobic deep eutectic solvent // Food Chem. 2018. V. 243. P. 351.
Плетнев И.В., Смирнова С.В., Шаров А.В., Золотов Ю.А. Экстракционные растворители нового поколения: от ионных жидкостей и двухфазных водных систем к легкоплавким комбинированным растворителям // Успехи химии. 2021. Т. 90. № 9. С. 1109. (Pletnev I.V., Smirnova S.V., Sharov A.V., Zolotov Yu.A. Next-generation extraction solvents: From ionic liquids to aqueous biphasic systems to low-melting combined solvents // Russ. Chem. Rev. 2021. V. 90. № 9. P. 1109.)
Penido J.A., Mageste A.B., Martins P.L., Ferreira G.M.D. Surfactant as selective modulator in the partitioning of dyes in aqueous two-phase systems: A strategy for separation // J. Mol. Liq. 2019. V. 293. Article 111501.
Коренман Я.И., Суханов П.Т., Санникова Н.Ю. Извлечение моноазокрасителей гидрофильными экстрагентами из водных растворов // Вестник Воронежского гос. ун-та инженерных технологий. 2012. Т. 3. С. 115.
Smirnova S.V., Ilin D.V., Pletnev I.V. Extraction and ICP-OES determination of heavy metals using tetrabutylammonium bromide aqueous biphasic system and oleophilic collector // Talanta. 2021. V. 221. Article 121485.
Шестопалова Н.Б. Системы НПАВ – Н2О – электролиты в мицеллярной экстракции и фотометрическом определении синтетических пищевых красителей. Дис. … канд. хим. наук. Саратов: СГУ, 2014. 203 с.
Исаева Ю.И., Елохов А.М., Денисова С.А., Кудряшова О.С., Леснов А.Е. Растворимость и экстракция ионов металлов в системах неорганическая кислота–хлорид алкилбезилдиметиламмония–вода // Журн. физ. химии. 2019. Т. 3. № 2. С. 220.
Pourreza N., Elhami S. Cloud point extraction and spectrophotometric determination of amaranth in food samples using nonionic surfactant Triton X-100 and tetrabutylammonium hydrogen sulfate // J. Iran. Chem. Soc. 2009. V. 6. № 4. P. 784.
López-de-Alba P.L. Michelini-Rodriguez L.I., Wróbel K., Amador-Hernández J. Extraction of Sunset Yellow and Tartrazine by ion-pair formation with Adogen-464 and their simultaneous determination by bivariate calibration and derivative spectrophotometry // The Analyst. 1997. V. 122. № 12. P. 1575.
Lau O.-W., Poon M.M.K., Mok S.-C., Wong F.M.Y., Luk S.-F. Spectrophotometric determination of single synthetic food colour in soft drinks using ion-pair formation and extraction // Int. J. Food Sci. Technol. 1995. V. 30. P. 793.
Kinugasa T., Ohta A., Nishii Y. Removal and recovery of acid azo dyes by solvent extraction using cetyltrimethylammonium chloride // Sep. Sci. Technol. 2015. V. 50. № 9. P. 1369.
ГОСТ 33457-2015. Продукты переработки фруктов и овощей. Метод качественного определения синтетических красителей с применением ион-парного экстрагирования. М.: Стандартинформ, 2019. 8 с.
Nakayama H. Solid-liquid and liquid-liquid phase equilibria in the symmetrical tetraalkylammonium halide–water systems // Bull. Chem. Soc. Jpn. 1981. V. 54. № 12. P. 3717.
Smirnova S.V., Lyskovtseva K.A., Pletnev I.V. Extraction and determination of synthetic food dyes using tetraalkylammonium based liquid-liquid extraction // Microchem. J. 2021. V. 162. Article 105833.
Akama Y. Selective separation of cadmium from cobalt, copper, iron(III) and zinc by water-based two-phase system of tetrabutylammonium bromide // Talanta. 2000. V. 53. № 3. P. 645.
Hooshyar H., Sadeghi R. Aqueous biphasic formation, volumetric and compressibility behaviour in tetrabutylammonium bromide-inorganic salts aqueous systems // J. Chem. Thermodyn. 2013. V. 67. P. 120.
Akama Y. Extraction mechanism of Cr(VI) on the aqueous two-phase system of tetrabutylammonium bromide and (NH4)2SO4 mixture // Talanta. 2002. V. 57. № 4. P. 681.
Zawadzki M., e Silva F.A., Domańska U., Coutinho J.A.P. Recovery of an antidepressant from pharmaceutical wastes using ionic liquid-based aqueous biphasic systems // Green Chem. 2016. V. 18. № 12. P. 3527.
Song Y.S., Choi Y.H., Kim D.H. Microextraction in a tetrabutylammonium bromide/ammonium sulfate aqueous two-phase system and electrohydrodynamic generation of a micro-droplet // J. Chromatogr. A. 2007. V. 1162. № 2. P. 180.
Dinis T.B.V., Passos H., Lima D. L., Sousa A.C.A., Coutinho J., Esteves V., Freire M. Simultaneous extraction and concentration of water pollution tracers using ionic-liquid-based systems // J. Chromatogr. A. 2018. V. 1559. P. 69.
Li W., Zheng X., Tu G., Zhang S., Zhang P. Novel aqueous biphasic system based on ionic liquid for the simultaneous extraction of seven active pharmaceutical ingredients in aquatic environment // Environ. Sci. Pollut. Res. 2021. V. 28. № 14. P. 17853.
Hatti-Kaul R. Aqueous Two-Phase Systems. New Jersey: Humana Press, 2000. V. 11. 440 p.
Sintra T.E., Cruz R., Ventura S.P.M., Coutinho J.A.P. Phase diagrams of ionic liquids-based aqueous biphasic systems as a platform for extraction processes // J. Chem. Thermodyn. 2014. V. 77. P. 206.
Haynes W.M. Handbook of Chemistry and Physics. Boca Raton: CRC Press LLC, 2014–2015. P. 5.
Smirnova S.V., Samarina T.O., Pletnev I.V. Hydrophobic-hydrophilic ionic liquids for the extraction and determination of metal ions with water-soluble reagents // Anal. Methods. 2015. V. 7. P. 9629.
Avazpour M., Shiri S., Delpisheh A., Abbasi A. Simultaneous determination of Brilliant Blue FCF and Carmoisine in food samples by aqueous two-phase system and spectrophometric detection // J. Basic Res. Med. Sci. 2014. V. 1. P. 56.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии