Журнал аналитической химии, 2022, T. 77, № 12, стр. 1073-1079
Определение стероидных гормонов в слюне человека методом высокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием
Е. В. Дмитриева a, *, А. З. Темердашев a
a Кубанский государственный университет
350040 Краснодар, ул. Ставропольская, 149, Россия
* E-mail: catherine_dmitrieva@outlook.com
Поступила в редакцию 10.02.2022
После доработки 21.02.2022
Принята к публикации 21.02.2022
- EDN: HGXWBW
- DOI: 10.31857/S0044450222120027
Аннотация
Разработан способ одновременного определения стероидных гормонов различных классов (андрогенов, прогестинов и глюкокортикоидов) в слюне человека с использованием жидкостно-жидкостной экстракции и детектированием методом ультравысокоэффективной жидкостной хроматографии–тандемной масс-спектрометрии. Установлено, что наиболее подходящим растворителем для извлечения целевых аналитов является метил-трет-бутиловый эфир. Объем экстрагента и другие факторы, влияющие на извлечение аналитов из анализируемой матрицы, оптимизировали с применением многофакторного анализа (план Бокса–Бенкена). В оптимальных условиях степени извлечения аналитов составили более 90%, а пределы обнаружения лежали в диапазоне 50–250 пг/мл, что указывает на высокую чувствительность предложенной методики.
Содержание стероидных гормонов в биологических жидкостях человека является важным показателем состояния его здоровья. В случае если наблюдается изменение их концентраций, можно предполагать развитие различных заболеваний, поэтому определение стероидных гормонов имеет важную диагностическую ценность.
Стероидные гормоны традиционно определяют в моче и плазме человека. При анализе мочи получают усредненные концентрации стероидных гормонов за несколько часов – сутки, а состав плазмы отражает концентрации данных соединений в реальном времени. Недостатком анализа плазмы является инвазивность отбора проб и наличие болевых ощущений, поэтому в настоящее время в качестве альтернативной матрицы для определения стероидных гормонов все чаще рассматривается слюна. Ее основными преимуществами являются неинвазивность [1] и простота процедуры пробоотбора, стабильность образцов при комнатной температуре, а также отсутствие необходимости привлечения квалифицированного персонала для отбора проб [2].
Проведенные к настоящему времени исследования показывают возможность применения слюны для определения стероидных гормонов. Так, изменение содержания кортизола в слюне позволяет диагностировать синдром Кушинга [3], определение прогестерона позволяет определить фолликулярную и лютеиновую фазы цикла у женщин [2], изменение уровней тестостерона может указать на развитие андрогензависимых заболеваний как у мужчин (дефицит андрогенов, гипогонадизм) [2, 4], так и у женщин (гирсутизм, поликистоз яичников) [3, 5].
Возможность применения слюны в качестве альтернативной матрицы обусловлена высокими корреляциями между концентрациями ряда стероидных гормонов в плазме и слюне [3, 6], что связано с механизмом попадания стероидных гормонов в слюну человека. Установлено [7], что неконъюгированные стероидные гормоны попадают в слюну путем диффузии через клетки слюнных желез ввиду их липофильной природы, и их концентрация не зависит от скорости секреции слюны, а следовательно, может отражать содержание свободных (не связанных с белками) стероидов в плазме [2, 3, 8–10].
Основным недостатком слюны в качестве объекта исследования является необходимость применения высокочувствительных методов для определения данных соединений, поскольку их содержание в слюне значительно ниже по сравнению с плазмой [11]. Наиболее простым способом анализа слюны является иммуноферментный анализ, однако он недостаточно селективен, что может приводить к получению завышенных результатов, особенно на низких уровнях концентраций. Кроме того, данный способ позволяет определять лишь один показатель за анализ, что является его ограничением при определении стероидного профиля. Альтернативный способ − использование хроматографических методов с масс-спектрометрическим детектированием, обладающих высокими чувствительностью и селективностью, особенно с тандемным масс-спектрометрическим детектированием в режиме мониторинга выбранных реакций (MRM).
Учитывая крайне низкие концентрации стероидных гормонов в слюне человека, для их надежного определения необходимо применение концентрирования. Наиболее часто для этого используют жидкостно-жидкостную экстракцию [3]. При этом большинство исследований направлено на определение ограниченного перечня соединений [3, 4, 8, 10, 12, 13] и не дает полного представления о стероидном профиле человека, применение которого наиболее эффективно при диагностировании заболеваний. Одновременное определение стероидных гормонов различных классов дает более точную информацию о гормональном статусе по сравнению с единичным показателем [14].
Цель данной работы – разработка унифицированной методики определения стероидных гормонов различных классов (андрогенов, прогестинов, глюкокортикоидов) в слюне человека методом ультравысокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием (УВЭЖХ-МС/МС).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
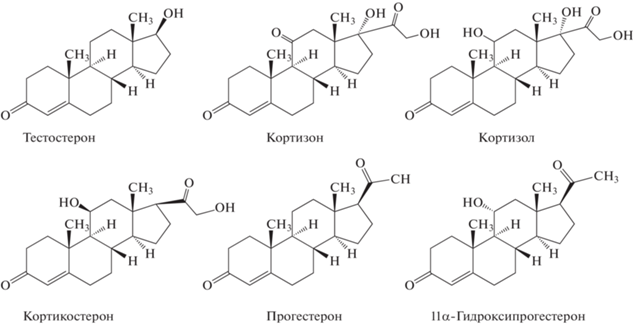
Материалы и методы. Стандартные образцы тестостерона, кортизона, гидрокортизона (кортизола), кортикостерона, прогестерона, 11α-гидроксипрогестерона (схема 1 ) и метилтестостерона (внутренний стандарт) приобретали у Sigma-Aldrich (США).
Cхема. 1. Структурные формулы определяемых соединений.
Метил-трет-бутиловый эфир (для ВЭЖХ-ИК-УФ, 99.9%) и метанол (для ВЭЖХ) приобретали у PanReac (Испания) и J.T. Baker (Великобритания) соответственно. Использовали дихлорметан, трихлорметан и тетрахлорметан, этилацетат, гексан (99%) (ЭКОС-1, Россия), а также дигидрофосфат калия, гидрофосфат натрия, тетрагидроборат натрия и гидроксид натрия (99%) для приготовления буферных растворов (Вектон, Россия).
Приборы и оборудование. Для УВЭЖХ-МС/МС-анализа использовали систему, состоящую из ультравысокоэффективного жидкостного хроматографа Dionex Ultimate-3000 и тройного квадрупольного масс-спектрометра Thermo TSQ Access Max (San-Jose, USA). Для разделения аналитов применяли аналитическую колонку Phenomenex Kinetex С18 (100 × 2.1 мм, 1.7 мкм), оснащенную соответствующей предохранительной колонкой в режиме градиентного элюирования при температуре термостатирования 40°C (табл. 1).
Таблица 1.
Условия градиентного элюирования аналитов (скорость потока подвижной фазы 0.4 мл/мин)
| Время, мин | 0.1%-ная муравьиная кислота в воде (элюент А) | 0.1%-ная муравьиная кислота в метаноле (элюент Б) |
|---|---|---|
| 0.0 | 90 | 10 |
| 1.0 | 90 | 10 |
| 2.0 | 50 | 50 |
| 3.2 | 50 | 50 |
| 5.0 | 10 | 90 |
| 7.9 | 10 | 90 |
| 8.0 | 90 | 10 |
| 9.5 | 90 | 10 |
Для ионизации исследуемых соединений использовали нагреваемый источник ионизации электрораспылением в режиме регистрации положительных ионов (табл. 2). Аналиты детектировали в режиме мониторинга выбранных реакций посредством соударительной диссоциации иона-предшественника (газ-мишень аргон, давление 1.5 мТорр) и определения ионов-продуктов (табл. 3). Условия детектирования в режиме мониторинга выбранных реакций оптимизировали путем напуска определяемых веществ в камеру источника ионизации с использованием шприцевого ввода.
Таблица 2.
Параметры ионизации аналитов в нагреваемом электрораспылительном источнике ионизации
| Параметр | Значение |
|---|---|
| Температура испарителя, °C | 400 |
| Температура трансферного капилляра, °C | 320 |
| Напряжение на источнике ионизации, кВ | 4 |
| Расход газа распылителя (азот), усл. ед. | 60 |
| Расход вспомогательного газа (азот), усл. ед | 10 |
Таблица 3.
Условия масс-спектрометрического детектирования в режиме мониторинга выбранных реакций
| Аналит | Ион-предшествен-ник, m/z | Ион-продукт, m/z | Энергия соударений, эВ | Напряжение на экстрагирующей линзе, В | tR, мин |
|---|---|---|---|---|---|
| Тестостерон | 289.2 | 79.2 | 38 | 82 | 4.98 |
| 97.2a | 22 | ||||
| 109.2 | 25 | ||||
| Кортизон | 361.2 | 105.2 | 38 | 79 | 3.59 |
| 121.1 | 27 | ||||
| 163.1a | 22 | ||||
| Кортизол | 363.2 | 121.1a | 24 | 86 | 3.81 |
| 267.1 | 17 | ||||
| 309.1 | 15 | ||||
| Кортикостерон | 347.2 | 91.2 | 48 | 68 | 4.47 |
| 121.1a | 24 | ||||
| 293.2 | 15 | ||||
| Прогестерон | 315.2 | 79.2 | 39 | 76 | 5.35 |
| 97.2a | 21 | ||||
| 109.2 | 26 | ||||
| 11α-Гидроксипрогестерон | 331.2 | 105.2 | 38 | 74 | 4.65 |
| 121.1a | 25 | ||||
| 271.2 | 16 | ||||
| Метилтестостеронб | 303.2 | 79.2 | 40 | 83 | 5.14 |
| 97.2 | 25 | ||||
| 109.2a | 27 |
Приготовление стандартных растворов. Стандартные растворы стероидных гормонов с концентрацией 1 мг/мл готовили в метаноле и хранили при 4°C в течение месяца. Градуировочные растворы с концентрациями 0.5, 1.0, 2.5, 5, 10, 25, 50, 100, 250, 500 нг/мл готовили последовательным разбавлением стандартных растворов в метаноле и хранили при 4°C в течение месяца. Растворы контроля качества с концентрациями 10, 50 и 250 нг/мл готовили отдельно от градуировочных растворов в метаноле. Рабочий раствор внутреннего стандарта метилтестостерона с концентрацией 200 нг/мл в метаноле хранили в холодильной камере при 4°C.
Фосфатный буферный раствор (pH 8) готовили с использованием 0.067 М растворов дигидрофосфата калия и гидрофосфата натрия. Для приготовления боратного буферного раствора (pH 10) применяли 0.05 М раствор тетрагидробората натрия и 0.1 М раствора гидроксида натрия.
Отбор проб слюны. Образцы смешанной слюны получали естественной секрецией. Перед отбором проб добровольцы (мужчины и женщины в возрасте 20–45 лет) не употребляли еду и воздерживались от курения в течение часа, а за 10 мин ополаскивали рот водой. Анализ образцов проводили сразу после отбора проб. Образцы слюны хранили при −20°C.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Выбор условий отбора проб слюны для анализа. Поскольку результаты анализа зависят от условий отбора проб слюны, предварительно рассмотрели влияние различных факторов на концентрации стероидных гормонов.
Коммерчески доступные контейнеры, такие как Salivette®, являются одними из наиболее широко используемых для получения образцов слюны. Тем не менее исследования показали, что содержащийся в них тампон, пропитываемый слюной при жевании, может влиять на результаты определения гормонов. Так, применение синтетического тампона существенно не влияет на результаты определения кортизола, в то время как концентрации других стероидных гормонов, в частности тестостерона, изменяются при его использовании [1]. Применение хлопкового тампона приводит к сорбции аналитов и, соответственно, к искажению результатов, поэтому оптимальным является прямой отбор проб слюны [2].
Прямой отбор проб можно проводить со стимулированием секреции слюны (например, лимонной кислотой, жвачкой без сахара, парафином) или без него. При использовании жвачки наблюдали увеличение концентрации тестостерона и кортизола, что затрудняет ее использование. Стимулирование слюноотделения различными методами приводило к изменению концентрации кортизона, поэтому при определении стероидного профиля оптимальным является отбор нестимулированной слюны в обычные полипропиленовые пробирки [1].
Другим важным требованием является отсутствие крови в слюне из-за механических повреждений в полости рта, например, при чистке зубов. Поскольку концентрации стероидных гормонов в слюне значительно ниже по сравнению с содержанием в крови, в случае ее попадания в слюну получаемые результаты будут значительно завышены. В случае присутствия в образце слюны 0.1–0.2% крови она приобретает розовый оттенок, что позволяет визуально оценить загрязнение анализируемого образца [6].
Кроме того, при определении глюкокротикоидов необходимо учитывать влияние фермента 11β-гидроксистероиддегидрогеназы II, под действием которого в слюнных железах происходит конверсия кортизола в неактивную кетоформу (кортизон) [2]. Это приводит к расхождениям в получаемых результатах, поэтому необходимо определять не только активную форму (кортизол), но и его неактивную кетоформу.
Оптимизация условий жидкостно-жидкостной экстракции. При оптимизации типа экстрагента рассматривали следующие растворители: ди-, три- и тетрахлорметан, этилацетат, гексан и метил-трет-бутиловый эфир. К 1 мл модельного образца (дистиллированная вода), содержащего исследуемые соединения с концентрацией 50 нг/мл, добавляли 1 мл экстрагента, перемешивали в течение 30 с на вортексе, центрифугировали образец 10 мин при 4000 об/мин, шприцем отбирали фазу экстрагента, упаривали ее досуха и вновь растворяли в 150 мкл смеси метанол–вода (1 : 1, по объему).
Этилацетат, хлороформ и метил-трет-бутиловый эфир обеспечивали количественное извлечение всех аналитов (>70%). Для дальнейших исследований выбрали метил-трет-бутиловый эфир ввиду его невысокой температуры кипения (55°C), а также меньшей токсичности по сравнению с хлорированными растворителями.
Оптимальный объем экстрагента, pH и время перемешивания на вортексе устанавливали с применением многофакторного анализа (план Бокса–Бенкена). Для обработки полученных результатов использовали ПО STATISTICA 10 (Statsoft). Уровни факторов представлены в табл. 4.
Таблица 4.
Уровни оптимизируемых факторов (план Бокса–Бенкена)
| Фактор | Уровень | ||
|---|---|---|---|
| −1 | 0 | +1 | |
| Объем экстрагента, мл | 500 | 1000 | 1500 |
| pH | 6 | 8 | 10 |
| Время перемешивания, с | 15 | 30 | 45 |
Для нахождения оптимальных уровней исследуемых факторов в модельный образец (1 мл, концентрация аналитов 50 нг/мл) добавляли 0.3 мл буферного раствора (pH 8 и 10) или 0.3 мл дистиллированной воды (pH 6). Затем в образец добавляли метил-трет-бутиловый эфир и перемешивали его на вортексе в течение 30 с. После этого водный слой вымораживали при −35°C и переносили эфир, содержащий аналиты, в пробирку для упаривания на твердотельном нагревателе при 60°C с последующим растворением сухого остатка в 150 мкл смеси метанол–вода (1 : 1, по объему) для анализа.
Все полученные модели оказались значимыми, поскольку скорректированные коэффициенты детерминации ($R_{{{\text{adj}}}}^{2}$) превышали 0.9. Поскольку свойства определяемых соединений отличаются, оптимальные уровни факторов также имели разные значения для исследуемых аналитов. Объем метил-трет-бутилового эфира оказывал наибольшее влияние на степени извлечения аналитов: с увеличением объема экстрагента степень извлечения возрастала, поэтому для дальнейших исследований выбрали объем 1.5 мл, который в совокупности с другими факторами обеспечивал высокие степени извлечения аналитов. Время перемешивания также влияет на степени извлечения аналитов, при этом значение 30 с оптимально для всех аналитов. Увеличение pH среды не приводило к получению более высоких степеней извлечения аналитов, поэтому в последующих экспериментах буферный раствор не добавляли.
Таким образом, пробоподготовку проводили в следующих условиях: к 1 мл образца слюны добавляли внутренний стандарт (метилтестостерон с конечной концентрацией 20 нг/мл). Затем вносили 1.5 мл метил-трет-бутилового эфира, перемешивали на вортексе в течение 30 с, центрифугировали 10 мин при 4000 об/мин, вымораживали водную фазу при −35°C с последующим переносом органической фазы в другую пробирку и ее упариванием досуха при 60°C с растворением сухого остатка в 150 мкл смеси метанол–вода (1 : 1, по объему). В этих условиях степени извлечения аналитов составляли 91–98%. Степени извлечения рассчитывали как отношение площади пика соединения в растворе, прошедшем через все стадии пробоподготовки, к площади пика этого соединения в модельном растворе.
Валидация разработанного способа. Стероидные гормоны являются эндогенными соединениями, для них отсутствуют матрицы, не содержащие целевых аналитов, поэтому валидацию методики проводили на модельных растворах (дистиллированная вода), а также с использованием метода введено–найдено на реальных образцах с учетом критериев Food and Drug Administration (США) по валидации биоаналитических методик [15].
Градуировочные зависимости строили в диапазоне концентраций 0.05–50 нг/мл (0.05, 0.10, 0.25, 0.5, 1.0, 2.5, 5, 10, 25, 50 нг/мл). Предел обнаружения соответствовал концентрации, обнаруживаемой при соотношении сигнал/шум, равном 3, в то время как пределу определения соответствовала концентрация аналита, устанавливаемая с погрешностью 15%. Полученные результаты представлены в табл. 5.
Таблица 5.
Аналитические характеристики методики
| Аналит | Предел обнаружения, нг/мл | Предел определения, нг/мл | Линейный диапазон, нг/мл | R2 |
|---|---|---|---|---|
| Тестостерон | 0.05 | 0.1 | 0.1–50 | 0.999 |
| Кортизон | 0.25 | 0.5 | 0.5–50 | 0.995 |
| Гидрокортизон | 0.25 | 0.5 | 0.5–50 | 0.999 |
| Кортикостерон | 0.25 | 0.5 | 0.5–50 | 0.996 |
| Прогестерон | 0.05 | 0.1 | 0.1–50 | 0.999 |
| 11α-Гидроксипрогестерон | 0.05 | 0.1 | 0.1–50 | 0.999 |
Правильность и воспроизводимость контролировали путем анализа растворов контроля качества на трех уровнях концентраций: низком (1 нг/мл), среднем (5 нг/мл) и высоком (25 нг/мл) в течение одного и нескольких дней. Воспроизводимость оценивали с помощью относительного стандартного отклонения (sr), а правильность с применением уравнения (1):
(1)
${{e}_{{\text{r}}}} = {\text{ }}(({{c}_{{{\text{опр}}}}}--{{c}_{{{\text{теор}}}}}){\text{/}}{{c}_{{{\text{теор}}}}}) \times 100,$Таблица 6.
Результаты оценки правильности и воспроизводимости методики способом введено–найдено (n = 15, P = 0.95)
| Аналит | Концентрация раствора контроля качества, нг/мл | В один день | В разные дни | ||
|---|---|---|---|---|---|
| er, % | sr, % | er, % | sr, % | ||
| Тестостерон | 1 | 8.5 | 8.3 | 11.2 | 12.5 |
| 5 | 6.1 | 4.0 | 7.8 | 8.6 | |
| 25 | 5.7 | 3.7 | 7.2 | 9.0 | |
| Кортизон | 1 | –10.6 | 11.8 | –12.6 | 14.1 |
| 5 | –5.7 | 6.7 | –7.4 | 12.3 | |
| 25 | 3.1 | 6.0 | 3.9 | 8.8 | |
| Гидрокортизон | 1 | –13.8 | 11.9 | –14.7 | 12.4 |
| 5 | –9.0 | 7.3 | –8.5 | 9.6 | |
| 25 | 5.5 | 6.0 | 4.3 | 7.5 | |
| Кортикостерон | 1 | –13.1 | 11.4 | –12.2 | 14.8 |
| 5 | –3.0 | 5.9 | 3.4 | 8.6 | |
| 25 | 2.4 | 2.8 | 2.6 | 5.0 | |
| Прогестерон | 1 | –10.9 | 11.0 | –9.7 | 11.3 |
| 5 | –5.7 | 8.1 | –4.2 | 10.8 | |
| 25 | 1.1 | 1.7 | 3.9 | 5.4 | |
| 11α-Гидроксипрогестерон | 1 | 9.5 | 11.4 | 10.3 | 11.8 |
| 5 | 4.0 | 7.5 | 5.2 | 8.7 | |
| 25 | 1.3 | 3.9 | 2.6 | 4.4 | |
Стабильность реальных образцов слюны, содержащих исследуемые аналиты, оценивали в течение месяца с проведением двух циклов заморозки (–20°C) и разморозки до комнатной температуры. Аналиты сохраняли стабильность в течение этого времени, поскольку полученные результаты отличались менее чем на 15% от первоначальных, что согласуется с результатами [10].
Стабильность растворов в автосамплере оценивали в течение 36 ч при 5°C. Результаты показали, что образцы остаются стабильными в данном временном диапазоне.
Возможность перекрестного загрязнения оценивали путем анализа холостого раствора после анализа образца с концентрацией стероидных гормонов 50 нг/мл. Установили, что на хроматограмме холостого образца отсутствуют пики с MRM-переходами, аналогичными целевым соединениям.
Анализ реальных образцов. Предложенный способ использовали для анализа реальных образцов, полученных от добровольцев. Перед проведением анализа образцы центрифугировали в течение 10 мин при 10000 об/мин. Анализ проводили методом введено–найдено путем добавления растворов контроля качества низкой (1 нг/мл), средней (5 нг/мл) и высокой (25 нг/мл) концентраций. Установили, что матричные компоненты существенно не влияют на получаемые результаты, поскольку погрешность определения составила <15%.
* * *
Таким образом, разработан и валидирован простой и чувствительный (пределы обнаружения в диапазоне 0.05–0.25 нг/мл) способ определения стероидных гормонов методом ультравысокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием в слюне человека. Возможность одновременного чувствительного определения стероидных гормонов различных классов делает слюну перспективной матрицей для диагностических целей, обладающей большим количеством преимуществ по сравнению с кровью.
Инновационный проект выполнен при финансовой поддержке Кубанского научного фонда в рамках Конкурса научно-инновационных проектов, ориентированных на коммерциализацию № НИП-20.1/4.
Список литературы
Büttler R.M., Bagci E., Brand H.S., den Heijer M., Blankenstein M.A., Heijboer A.C. Testosterone, androstenedione, cortisol and cortisone levels in human unstimulated, stimulated and parotid saliva // Steroids. 2018. V. 138. P. 26. https://doi.org/10.1016/j.steroids.2018.05.013
Gröschl M. Current status of salivary hormone analysis // Clin. Chem. 2008. V. 54. № 11. P. 1759. https://doi.org/10.1373/clinchem.2008.108910
Turpeinen U., Hämäläinen E., Haanpää M., Dunkel L. Determination of salivary testosterone and androstendione by liquid chromatography–tandem mass spectrometry // Clin. Chim. Acta. 2012. V. 413. № 5–6. P. 594. https://doi.org/10.1016/j.cca.2011.11.029
Shibayama Y., Higashi T., Shimada K., Odani A., Mizokami A., Konaka H., Koh E., Namiki M. Simultaneous determination of salivary testosterone and dehydroepiandrosterone using LC-MS/MS: Method development and evaluation of applicability for diagnosis and medication for late-onset hypogonadism // J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. 2009. V. 877. № 25. P. 2615. https://doi.org/10.1016/j.jchromb.2008.10.051
Baxendale P.M., Jacobs H.S., James V.H. Plasma and salivary androstenedione and dihydrotestosterone in women with hyperandrogenism // Clin. Endocrinol. (Oxf). 1983. V. 18. № 5. P. 447. https://doi.org/10.1111/j.1365-2265.1983.tb02874.x
Wood P. Salivary steroid assays – Research or routine? // Ann. Clin. Biochem. 2009. V. 46. P. 183. https://doi.org/10.1258/acb.2008.008208
Vining R.F., McGinley R.A., Symons R.G. Hormones in saliva: mode of entry and consequent implications for clinical interpretation // Clin. Chem. 1983. V. 29. № 10. P. 1752.
Macdonald P.R., Owen L.J., Wu F.C., Macdowall W., Keevil B.G. A liquid chromatography–tandem mass spectrometry method for salivary testosterone with adult male reference interval determination // Clin. Chem. 2011. V. 57. № 5. P. 774. https://doi.org/10.1373/clinchem.2010.154484
Hofman L.F. Human saliva as a diagnostic specimen // J. Nutr. 2001. V. 131. № 5. P. 1621S. https://doi.org/10.1093/jn/131.5.1621S
Matsui F., Koh E., Yamamoto K., Sugimoto K., Sin H.-S., Maeda Y., Honma S., Namiki M. Liquid chromatography-tandem mass spectrometry (LC-MS/MS) assay for simultaneous measurement of salivary testosterone and cortisol in healthy men for utilization in the diagnosis of late-onset hypogonadism in males // Endocr. J. 2009. V. 56. № 9. P. 1083. https://doi.org/10.1507/endocrj.k09e-186
Ellison P. Human salivary steroids: Methodological considerations and applications in physical anthropology // Am. J. Phys. Anthropol. 1988. V. 31. P. 115. https://doi.org/10.1002/AJPA.1330310507
Jensen M.A., Hansen A.M., Abrahamsson P., Nørgaard A.W. Development and evaluation of a liquid chromatography tandem mass spectrometry method for simultaneous determination of salivary melatonin, cortisol and testosterone // J. Chromatogr. B: Anal. Technol. Biomed. Life. Sci. 2011. V. 879. № 25. P. 2527. https://doi.org/10.1016/j.jchromb.2011.07.005
Ney L.J., Felmingham K.L., Bruno R., Matthews A., Nichols D.S. Simultaneous quantification of endocannabinoids, oleoylethanolamide and steroid hormones in human plasma and saliva // J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. 2020. V. 1152. Article 122252. https://doi.org/10.1016/j.jchromb.2020.122252
Gomez-Gomez A., Miranda J., Feixas G., Betegon A.A., Crispi F., Gratacós E., Pozo O.J. Determination of the steroid profile in alternative matrices by liquid chromatography tandem mass spectrometry // J. Steroid Biochem. Mol. 2020. V. 197. Article 105520. https://doi.org/10.1016/j.jsbmb.2019.105520
Food and Drug Administration Gguidance. Bioanalytical Method Validation. Guidance for Industry. 2018. https://www.fda.gov/files/drugs/published/Bioanalytical-Method-Validation-Guidance-for-Industry.pdf (02.02.2022).
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии