Журнал аналитической химии, 2022, T. 77, № 3, стр. 255-262
Микроэкстракционное выделение тетрациклинов из молока в глубокие эвтектические растворители для последующего определения методом высокоэффективной жидкостной хроматографии-тандемной масс-спектрометрии
К. Д. Черкашина a, *, А. С. Почивалов a, Ф. М. Шакирова a, А. Ю. Шишов a, А. В. Булатов a
a Санкт-Петербургский государственный университет, Институт химии
198504 Санкт-Петербург, Университетский просп., 26, Петергоф, Россия
* E-mail: ksenya_cherkashina@list.ru
Поступила в редакцию 31.05.2021
После доработки 13.08.2021
Принята к публикации 14.08.2021
- EDN: OACITZ
- DOI: 10.31857/S0044450222030045
Аннотация
Для выделения и концентрирования антибиотиков тетрациклинового ряда из молока предложен способ жидкостной микроэкстракции, предполагающий извлечение аналитов в гидрофобный глубокий эвтектический растворитель (ГЭР) на основе терпеноида и карбоновой кислоты с последующей реэкстракцией в водную фазу. При микроэкстракции тетрациклинов в фазу ГЭР на основе тимола и октановой кислоты (мольное соотношение прекурсоров 0.35 : 0.65) обнаружен синергетический эффект: более высокие коэффициенты распределения по сравнению с рассчитанными по аддитивной схеме. Возможности разработанного способа показаны на примере определения тетрациклина, хлортетрациклина и доксициклина в пробах молока методом ВЭЖХ-МС/МС. Пределы обнаружения (3σ) для тетрациклина и доксициклина составили 5 нг/кг, для хлортетрациклина – 50 нг/кг.
Тетрациклины относятся к антибиотикам, широко используемым в ветеринарии для лечения инфекционных заболеваний [1]. Нарушение режимов дозирования лекарственных средств в ветеринарии и несоблюдение интервалов между дозами, требуемых для элиминации антибиотиков, а также применение тетрациклинов в составе кормов неизбежно приводят к их попаданию в пищевые продукты животного происхождения. Длительное малодозированное воздействие тетрациклинов, поступающих в организм человека из пищевых продуктов, приводит к эндокринным нарушениям, хронической токсичности и развитию устойчивых к антибиотикам микроорганизмов [2]. Таким образом, определение содержания тетрациклинов в пищевых продуктах животного происхождения играет важную роль для обеспечения потребителей безопасной продукцией.
В большинстве случаев химический анализ пищевых продуктов включает стадии выделения и концентрирования целевых аналитов с целью устранения мешающего влияния матриц образца и достижения требуемой чувствительности [3]. Одним из актуальных направлений современной аналитической химии является разработка миниатюризованных, экспрессных, избирательных и экологически безопасных методов пробоподготовки, включающих процедуры разделения и концентрирования.
Новые возможности для анализа проб сложного состава открывают методы жидкостной микроэкстракции, обеспечивающие быстрый массоперенос, высокую скорость установления межфазного равновесия и эффективное концентрирование при минимальных расходах экстрагентов и проб [4, 5]. В последнее время особое внимание уделяют поиску новых эффективных экстракционных систем.
Глубокие эвтектические растворители (ГЭР) рассматривают как экологически безопасные и эффективные экстрагенты [6]. Такие “дизайнерские” растворители получают непосредственно в лаборатории при нагревании смеси двух или более прекурсоров – доноров и акцепторов водородной связи [7]. Используемые для приготовления ГЭР прекурсоры являются доступными, и, как правило, нетоксичными и биоразлагаемыми [8]. В зависимости от природы выделяют гидрофильные, квазигидрофобные и гидрофобные ГЭР. Для микроэкстракции полярных аналитов из твердофазных проб пищевых продуктов и растительных масел применяют гидрофильные ГЭР [9]. Квазигидрофобные [10, 11] и гидрофобные [12] ГЭР нашли применение для микроэкстракции из водных растворов. Показана возможность выделения тетрациклинов из проб молока в гидрофобные ГЭР для их последующего ВЭЖХ-УФ-определения [13, 14], однако этими способами (пределы обнаружения 1.5–28.4 мкг/л [13] и 5–15 мкг/кг [14]) не всегда удается определить содержание тетрациклинов на уровне ниже предельно допустимых концентраций (10 мкг/кг [15]). Актуальной задачей является разработка новых эффективных способов пробоподготовки молока, включающих концентрирование тетрациклинов в ГЭР, и их комбинирования с высокочувствительными инструментальными методами анализа.
Цель настоящей работы состояла в изучении экстракционных свойств ГЭР на основе терпеноидов (ментол, тимол, ванилин) и высших карбоновых кислот (гексановая, октановая, нонановая, олеиновая, тетрадекановая, октадекановая) для выделения и концентрирования тетрациклинов из проб молока для их последующего определения методом ВЭЖХ-МС/МС.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Растворы окситетрациклина (10 г/л), тетрациклина (10 г/л) и доксициклина (1 г/л) готовили путем растворения навесок антибиотиков в метаноле. Приготовленные растворы тетрациклинов хранили при температуре +4°C в темном месте. Рабочие растворы тетрациклинов готовили непосредственно перед экспериментом путем разбавления исходного раствора деионизованной водой. В работе использовали тетрациклин, окситетрациклин, доксициклин, гексановую, октановую, нонановую, олеиновую, тетрадекановую, октадекановую, муравьиную, трихлоруксусную и трифторуксусную кислоты, ацетонитрил, дихлорметан, о-ксилол, четыреххлористый углерод и декан производства “Sigma-Aldrich” (Германия). Также использовали ментол, тимол и ванилин производства “J&K Scientific” (Китай). Для приготовления подвижных фаз применяли метанол производства “J.T. Baker Chemical Company” (США).
Для приготовления ГЭР навески прекурсоров, которые рассчитывали на основании их мольных соотношений, помещали в стеклянный стакан и нагревали смесь до температуры, при которой плавился компонент с наибольшей температурой плавления. При перемешивании образовывались гомогенные вязкие растворы, которые охлаждали до комнатной температуры (25°С) и хранили в эксикаторе.
Для определения тетрациклинов использовали систему ВЭЖХ LC-30 (Shimadzu, Япония) с тройным квадрупольным масс-селективным детектором LCMS-8030. Разделение аналитов выполняли на хроматографической колонке Luna C18 (150 × 4.6 мм, размер частиц – 5 мкм) при 30°С в градиентном режиме элюирования. В качестве подвижной фазы использовали смесь растворителей А (0.1%-ный водный раствор муравьиной кислоты) и Б (метанол). Объемная доля растворителя А линейно уменьшалась в течение 11 мин с 95 до 70% и далее не изменялась в течение 3 мин. Затем снижали объемную долю растворителя А в течение 2 мин с 70 до 60% и далее она не изменялась в течение 30 с. Затем в течение 1 мин происходило уменьшение объемной доли растворителя А с 60 до 10%, и в течение 6.5 мин объемная доля растворителя А составляла 10%, после чего возрастала до 95% в течение 1 мин и оставалась постоянной 1 мин. Для устранения попадания тимола в детектор на выходе из колонки был установлен кран-переключатель, с помощью которого элюат направляли на сброс с 18 по 30 мин. Условия масс-спектрометрического детектирования тетрациклина, хлортетрациклина и доксициклина в реэкстракте представлены в табл. 1.
Таблица 1.
Условия масс-спектрометрического детектирования тетрациклинов
| Аналит | Молекулярный ион, m/z | Фрагментный ион, m/z | Напряжение на квадруполе 1, мВ | Энергия соударения, мВ | Напряжение на квадруполе 2, мВ |
|---|---|---|---|---|---|
| Тетрациклин | 445.05 | 410.15 | –14 | –18 | –28 |
| 445.05 | 154.15 | –14 | –26 | –15 | |
| Хлортетрациклин | 479.20 | 461.95 | –16 | –20 | –22 |
| 479.20 | 444.10 | –30 | –22 | –21 | |
| Доксициклин | 445.05 | 428.15 | –27 | –17 | –29 |
| 445.05 | 154.05 | –25 | –29 | –26 |
Молоко приобретали в супермаркете (Санкт-Петербург, Россия) и хранили в холодильнике при температуре +4°C. Для введения добавок к 1 мл пробы молока добавляли 50 мкл водного раствора аналитов с массовой концентрацией 1 и 1.5 мг/л. Пробы тщательно перемешивали и оставляли на 1 ч. Перед микроэкстракцией разрушали хелатные комплексы тетрациклина с ионами кальция(II) и осаждали белки: 1 мл пробы молока, 5 мл цитратно-фосфатного буферного раствора (рН 4.1), содержащего 0.08 М Na2HPO4, 0.06 М лимонную кислоту и 100 мМ трилон Б, и 1 мл ацетонитрила помещали в полимерную пробирку и интенсивно перемешивали в течение 3 мин. После центрифугирования (8000 об./мин в течение 5 мин) супернатант использовали для микроэкстракции.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
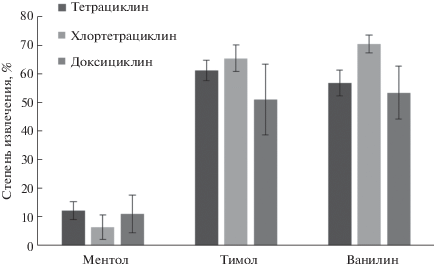
Предварительно изучили извлечение тетрациклинов в различные терпеноиды (ментол, тимол и ванилин). Тетрациклины содержат гидроксильные группы, поэтому они могут выступать в качестве доноров и акцепторов водородной связи при взаимодействии с терпеноидами. Известно, что терпеноиды являются твердыми веществами при 20–25°С, поэтому экстракцию выполняли при температурах выше температур плавления экстрагентов (40°С для ментола, 52°С для тимола и 83°С для ванилина). 1 мл раствора аналитов (20 мкг/л) и 100 мкл расплавленного терпеноида помещали в полимерную пробирку и перемешивали смесь в течение 5 мин при температуре на 5°С выше температуры плавления терпеноида. После центрифугирования (10 000 об./мин в течение 5 мин) анализировали образующиеся фазы.
Как видно из рис. 1, наличие ароматического кольца в структуре терпеноида существенно влияет на эффективность извлечения тетрациклинов. Эту закономерность можно объяснить неспецифическими взаимодействиями между ароматическими кольцами терпеноидов и тетрациклинов. Наибольшие степени извлечения аналитов наблюдались при экстракции в фазу тимола и ванилина. Ванилин имеет более высокую температуру плавления, поэтому в качестве акцептора водородной связи был выбран тимол.
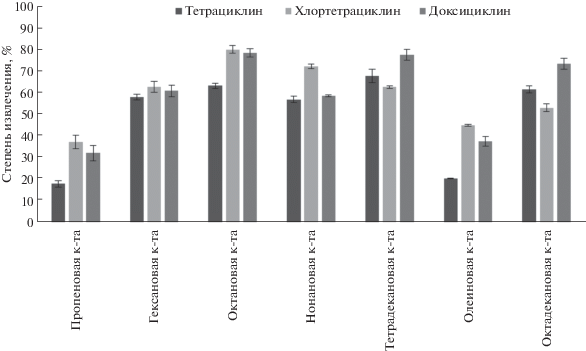
На следующем этапе изучали экстрагирующую способность ГЭР на основе смесей тимола и различных карбоновых кислот (гексановая, октановая, нонановая, олеиновая, тетрадекановая, октадекановая кислоты) в мольном соотношении 1 : 1. Максимальные степени извлечения тетрациклинов обеспечил ГЭР на основе тимола и октановой кислоты (рис. 2).
Рис. 2.
Влияние природы карбоновой кислоты на эффективность извлечения тетрациклинов (cTЦов = 25 мкг/л, n = 3).
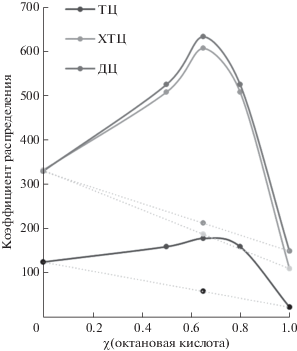
Для ГЭР на основе тимола и октановой кислоты с различными мольными соотношениями прекурсоров установили экспериментальные значения коэффициентов распределения Pэксп и рассчитали аддитивные коэффициенты распределения Радд (Pадд = P1χ1 + P2χ2, где P1 – коэффициент распределения в системе вода–тимол; P2 – коэффициент распределения в системе вода–октановая кислота; χ1 – мольная доля тимола; χ2 – мольная доля октановой кислоты) (табл. 2). На основании установленных коэффициентов распределения рассчитали коэффициенты синергизма (k = lg(Pэксп/Pадд)) [16]. Для всех аналитов зависимости коэффициентов распределения от состава смеси (изотермы экстракции) представляли собой выпуклые кривые (рис. 3), что свидетельствует о наличии синергетического эффекта. Состав ГЭР с мольным отношением прекурсоров 0.35 : 0.65 обеспечивал наибольший синергетический эффект (k от 0.47 до 0.51), и поэтому его выбрали в качестве оптимального. Кроме того, данный состав отвечает точке эвтектики на диаграмме плавкости, представленной в работе [17].
Таблица 2.
Значения экспериментальных и аддитивных коэффициентов распределения и коэффициент синергизма для глубоких эвтектических растворителей на основе тимола и октановой кислоты
| χ (октановая кислота) | Рэксп | Радд | k | ||||||
|---|---|---|---|---|---|---|---|---|---|
| ТЦ | ХТЦ | ДЦ | ТЦ | ХТЦ | ДЦ | ТЦ | ХТЦ | ДЦ | |
| 0 | 126 | 332 | 330 | 126 | 332 | 330 | – | – | – |
| 0.50 | 160 | 507 | 524 | 75 | 221 | 240 | 0.33 | 0.36 | 0.34 |
| 0.65 | 179 | 606 | 632 | 60 | 188 | 213 | 0.48 | 0.51 | 0.47 |
| 0.80 | 160 | 507 | 524 | 44 | 155 | 186 | 0.56 | 0.52 | 0.45 |
| 1.00 | 24 | 110 | 150 | 24 | 110 | 150 | – | – | – |
Соотношение между объемами пробы и экстрагента – важный параметр, определяющий достигаемые коэффициенты концентрирования. Для воспроизводимого отбора фазы экстракта выбрали объем экстрагента 100 мкл. Объем пробы варьировали в диапазоне от 1 до 10 мл. Установили, что оптимальным является объем пробы, равный 6 мл (рис. 4а). При больших объемах пробы уменьшаются степени извлечения и соответственно коэффициенты концентрирования.
Рис. 4.
Влияние объема пробы (а), рН (б) и времени (в) на эффективность извлечения тетрациклинов (cTЦов = = 25 мкг/л, n = 3).
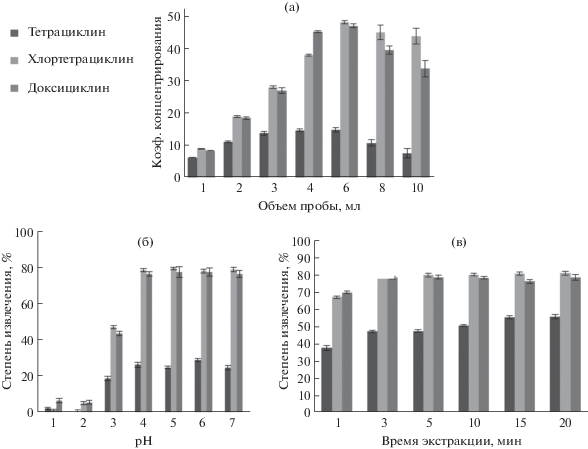
Тетрациклины содержат кислотно-основные группы, обеспечивающие их амфотерные свойства, поэтому эффективность их экстракции зависит от кислотности раствора. Влияние рН водной фазы на степень извлечения изучали в интервале от 1 до 7. В щелочной среде происходит растворение тимола и октановой кислоты. Значения pKa составляют 3.3, 7.8, 9.6 для тетрациклина; 3.3, 7.5, 9.3 для хлортетрациклина и 3.0, 7.9, 9.1 для доксициклина [18]. В сильнокислой среде аналиты протонируются и их извлечение в органическую фазу протекает незначительно (рис. 4б). Наиболее эффективно экстрагируются цвиттер-ионные формы, преобладающие в пробе c рН 5–7.
Изучение влияния времени перемешивания фаз на эффективность извлечения показало, что максимальные степени извлечения (47% для тетрациклина, 80% для хлортетрациклина и 79% для доксициклина) достигаются при перемешивании фаз в течение 3 мин (рис. 4в).
При анализе экстрактов методом ВЭЖ-МС/МС компоненты ГЭР загрязняли ионную оптическую систему тройного квадрупольного масс-спектрометра. Для устранения этой проблемы в схему пробоподготовки включили дополнительную стадию реэкстракции аналитов в водную фазу. Тетрациклины ионизируются в кислой среде, поэтому для их массопереноса в водную фазу вводили водорастворимые органические кислоты. Для этой цели опробовали 0.5 М растворы муравьиной, трихлоруксусной и трифторуксусной кислот, совместимые с детектором. После выполнения микроэкстракции 80 мкл фазы экстракта смешивали с 80 мкл раствора соответствующей кислоты и центрифугировали в течение 5 мин при 12 000 об./мин. Отбирали водную фазу, к которой добавляли 8 мкл 6, 12.5 или 14%-ного водного раствора аммиака для нейтрализации муравьиной, трифторуксусной или трихлоруксусной кислоты соответственно. Приготовленные растворы анализировали методом ВЭЖХ-МС/МС. Раствор муравьиной кислоты обеспечивал максимальную эффективность реэкстракции (рис. 5а).
Рис. 5.
Влияние природы кислоты (а), природы (б) и объема неполярного растворителя (в) на эффективность реэкстракции тетрациклинов (cTЦов = 25 мкг/л, n = 3).
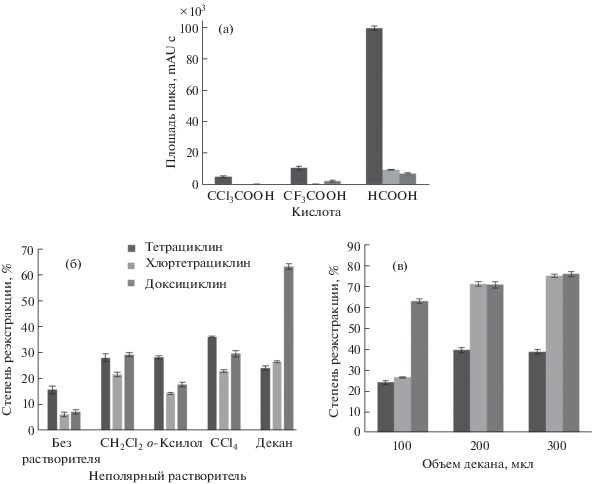
Для повышения эффективности реэкстракции изучили возможность введения неполярного растворителя (дихлорметан, о-ксилол, четыреххлористый углерод и декан) в фазу экстракта. Неполярные растворители снижают энергию сольватации тетрациклинов. Максимальные степени реэкстракции достигнуты при введении в экстракт 200 мкл декана (рис. 5б, 5в). Кроме того, показали, что тетрациклины не извлекаются в фазу декана из водного раствора.
На основании полученных результатов разработан способ выделения тетрациклина, хлортетрациклина и доксициклина из проб молока для их определения методом ВЭЖХ-МС/МС. К 1 мл пробы молока добавляют 5 мл цитратно-фосфатного буферного раствора (рН 4.1), содержащего 0.08 М Na2HPO4, 0.06 М лимонную кислоту и 100 мМ трилон Б и 1 мл ацетонитрила. Смесь интенсивно перемешивают в течение 3 мин. После центрифугирования (8000 об./мин в течение 5 мин) отбирают 6 мл супернантанта, к которому добавляют 100 мкл ГЭР на основе тимола и октановой кислоты (0.35 : 0.65). Смесь перемешивают в течение 3 мин и центрифугируют (5 мин, 12 000 об./мин). К 80 мкл экстракта добавляют 80 мкл 0.5 М раствора муравьиной кислоты и 200 мкл декана. Смесь перемешивают в течение 1 мин и центрифугируют (5 мин, 12 000 об./мин). Отбирают водную фазу, добавляют 8 мкл 12%-ного раствора аммиака, тщательно перемешивают и анализируют раствор методом ВЭЖХ-МС/МС. Концентрации тетрациклинов (мкг/кг) рассчитывают с учетом плотности пробы.
Для построения градуировочных зависимостей использовали смешанные водные растворы аналитов, которые проводили через все стадии пробоподготовки. Диапазон определяемых концентраций составил от 0.15 до 100 мкг/кг для хлортетрациклина и от 0.015 до 100 мкг/кг для тетрациклина и доксициклина. Пределы обнаружены (3σ) составили 50 нг/кг для хлортетрациклина, 5 нг/кг для тетрациклина и доксициклина. Основные аналитические характеристики разработанного способа представлены в табл. 3.
Таблица 3.
Аналитические характеристики разработанного способа определения тетрациклинов в молоке
| Параметр | Аналит | ||
|---|---|---|---|
| ТЦ | ХТЦ | ДЦ | |
| Диапазон определяемых концентраций, мкг/кг | 0.015–100 | 0.15–100 | 0.015–100 |
| Предел обнаружения (3σ), нг/кг | 5 | 50 | 5 |
| Предел количественного определения, нг/кг | 15 | 150 | 15 |
| sr, (50 нг/кг, n = 5), % | 13 | 11 | 13 |
| Коэффициент концентрирования | 15 | 48 | 47 |
| Время пробоподготовки, мин | 25 | ||
| Время хроматографического анализа, мин | 30 | ||
Разработанный способ микроэкстракции применили для определения тетрациклинов в пробах молока. Правильность результатов подтверждали методом введено–найдено (табл. 4). Результаты предложенного способа сравнили с данными референтного метода [19] в пределах его диапазона определяемых концентраций с помощью F- и t-тестов (табл. 4). Полученные значения F ≤ 19.00 говорят о незначительном различии в величинах стандартных отклонений, а полученные значения t ≤ 2.78 указывают на отсутствие статистически значимого различия между полученными результатами.
Таблица 4.
Результаты (мкг/кг) ВЭЖХ-МС/МС-определения тетрациклинов в молоке (n = 3, P = 0.95, Fкр = = 19.00, tкр = 2.78)
| Проба | Введено | Разработанный способ | Референтный метод [19] | F-тест | t-тест | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ТЦ | ХТЦ | ДЦ | ТЦ | ХТЦ | ДЦ | ТЦ | ХТЦ | ДЦ | ТЦ | ХТЦ | ДЦ | ТЦ | ХТЦ | ДЦ | |
| 1 | 0 | 0 | 0 | <ПО | <ПО | <ПО | <ПО | <ПО | <ПО | − | − | − | − | − | − |
| 50 | 50 | 50 | 49 ± 4 | 47 ± 5 | 42 ± 5 | 47 ± 4 | 46 ± 6 | 41 ± 7 | 1.22 | 1.44 | 1.96 | 2.14 | 0.66 | 0.25 | |
| 75 | 75 | 75 | 75 ± 4 | 74 ± 5 | 70 ± 3 | 74 ± 4 | 72 ± 6 | 70 ± 6 | 1.08 | 1.44 | 4 | 1.8 | 0.83 | 0.32 | |
| 2 | 0 | 0 | 0 | <ПО | <ПО | <ПО | <ПО | <ПО | <ПО | − | − | − | − | − | − |
| 50 | 50 | 50 | 48.1 ± 2.1 | 50 ± 3 | 49 ± 5 | 46 ± 3 | 48 ± 5 | 48 ± 6 | 2.25 | 2.78 | 1.44 | 2.09 | 1.11 | 0.55 | |
| 75 | 75 | 75 | 74 ± 4 | 75 ± 4 | 73 ± 5 | 72 ± 6 | 76.3 ± 2.2 | 74 ± 4 | 2.25 | 3.31 | 1.56 | 1.19 | 0.94 | 0.67 | |
| 3 | 0 | 0 | 0 | <ПО | <ПО | <ПО | <ПО | <ПО | <ПО | − | − | − | − | − | − |
| 0.015 | 0.15 | 0.015 | 0.0162 ± 0.0022 | 0.152 ± 0.017 | 0.0146 ± 0.0017 | <ПО | <ПО | <ПО | − | − | − | − | − | − | |
| 10 | 10 | 10 | 9.2 ± 1.2 | 10.2 ± 1.1 | 10.1 ± 1.3 | <ПО | <ПО | <ПО | − | − | − | − | − | − | |
* * *
Таким образом, показана возможность микроэкстракционного выделения и концентрирования тетрациклинов из проб молока в различные ГЭР на основе терпеноидов и высших карбоновых кислот для их последующего ВЭЖХ-МС/МС-определения. Максимальные степени извлечения тетрациклинов достигнуты в фазу ГЭР на основе тимола и октановой кислоты (мольное соотношение прекурсоров 0.35 : 0.65). Показано, что при микроэкстракции тетрациклинов в фазу ГЭР на основе тимола и октановой кислоты наблюдается синергетический эффект. Мешающее влияние компонентов ГЭР на ВЭЖХ-МС/МС-определение тетрациклинов потребовало включения в схему анализа дополнительной стадии реэкстракции. Достигнуты более низкие пределы обнаружения по сравнению с существующими аналогами [13, 14]. Способ обеспечивает возможность определения содержания тетрациклинов на уровне ниже ПДК (10 мкг/кг [15]).
Исследование выполнено за счет гранта Российского научного фонда № 21-13-00020 (https://rscf.ru/project/21-13-00020/), а также за счет гранта Российского фонда фундаментальных исследований № 19-33-90007.
Авторы выражают благодарность сотрудникам Научного парка СПбГУ (Методы анализа состава вещества).
Список литературы
Grayson M.L., Crowe S.M., McCarthy J.S., Mills J., Mouton J.W., Norrby S.R., Pfaller M.A. Kucers’ The Use of Antibiotics Sixth Edition: A Clinical Review of Antibacterial CRC Press, 2010. 3078 p.
Michalova E. Tetracyclines in veterinary medicine and bacterial resistance to them // Vet. Med. Praha: 2004. V. 49. № 3. P. 79.
Companyó R. Antibiotics in food : Legislation and validation of analytical methodologies // Anal. Bioanal. Chem. 2009. V. 395. № 4. P. 877.
Дмитриенко С.Г., Апяри В.В., Толмачева В.В., Горбунова М.В. Дисперсионная жидкостно-жидкостная микроэкстракция органических соединений. обзор обзоров // Журн. аналит. химии. 2020. V. 75. № 10. P. 867.
Дмитриенко С.Г. Апяри В.В., Горбунова М.В., Толмачева В.В., Золотов Ю.А. Гомогенная жидкостная микроэкстракция органических соединений // Журн. аналит. химии. 2020. V. 75. № 11. P. 963.
Shishov A., Shishov A., Pochivalov A., Nugbienyo L., Andruch V., Bulatov A. Deep eutectic solvents are not only effective extractants // Trends Anal. Chem. 2020. V. 129. P. 115956.
Smith E.L., Abbott A.P., Ryder K.S. Deep eutectic solvents (DESs) and their applications // Chem. Rev. 2014. V. 114. № 21. P. 11060.
Kudłak B., Owczarek K., Namieśnik J. Selected issues related to the toxicity of ionic liquids and deep eutectic solvents – A review // Environ. Sci. Pollut. Res. 2015. V. 22. № 16. P. 11975.
Ozturk B., Esteban J., Gonzalez-Miquel M. Deterpenation of citrus essential oils using glycerol-based deep eutectic solvents // J. Chem. Eng. Data. 2018. V. 63. № 7. P. 2384.
Shishov A., Terno P., Moskvin L., Bulatov A. A. In-syringe dispersive liquid-liquid microextraction using deep eutectic solvent as disperser: Determination of chromium (VI) in beverages // Talanta. 2020. V. 206. P. 120209.
Shishov A., Volodina N., Nechaeva D., Gagarinova S., Bulatov A. Deep eutectic solvents as a new kind of dispersive solvent for dispersive liquid–liquid microextraction // RSC. Adv. 2018. V. 67. P. 38146.
Nedaei M., Zarei A.R., Ghorbanian S.A. Development of a new emulsification microextraction method based on solidification of settled organic drop: application of a novel ultra-hydrophobic tailor-made deep eutectic solvent // New J. Chem. 2018. V. 42. № 15. P. 12520.
Sereshti H., Jazani S. S., Nouri N., Shams G. Dispersive liquid–liquid microextraction based on hydrophobic deep eutectic solvents: Application for tetracyclines monitoring in milk // Microchem. J. 2020. V. 158. P. 105269.
Cherkashina K., Abdolhosseini G., Soltani S., Jamshidi F., Nouri N. Synergistic effect of hydrophobic deep eutectic solvent based on terpenoids and carboxylic acids for tetracyclines microextraction// Analyst. 2021. T. 146. №. 11. C. 3449.
Совет ЕЭК. Технический регламент Таможенного союза ТР ТС 021/2011. 263 с.
Коренман И.М. Экстракция в анализе органических веществ. М.: Химия, 1977. 200 с.
Martins M.A.R., Crespo E.A., Pontes P.V., Silva L.P., Bülow M., Maximo G.J., Coutinho J.A. Tunable hydrophobic eutectic solvents based on terpenes and monocarboxylic acids // ACS Sustain. Chem. Eng. 2018. V. 6. № 7. P. 8836.
Colaizzi J.L., Klink P.R. pH-partition behavior of tetracyclines// J. Pharm. Sci. 1969. V. 58. № 10. P. 1184.
Abbasi M.M., Babaei H., Ansarin M. Simultaneous determination of tetracyclines residues in bovine milk samples by solid phase extraction and HPLC-FL method // Adv. Pharm. Bull. 2011.V. 1. № 1. P. 34.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии