Журнал аналитической химии, 2022, T. 77, № 4, стр. 298-311
Пределы обнаружения иммуноаналитических систем: лимитирующие факторы и способы снижения
А. В. Жердев a, Б. Б. Дзантиев a, *
a Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Ленинский просп., 33, Россия
* E-mail: dzantiev@inbi.ras.ru
Поступила в редакцию 10.09.2021
После доработки 06.10.2021
Принята к публикации 06.10.2021
- EDN: LGZIZH
- DOI: 10.31857/S0044450222040156
Аннотация
Одним из приоритетных направлений развития современных иммуноаналитичеcких систем стало обеспечение достоверного выявления и определения все более низких концентраций аналитов. В этой связи востребована оценка факторов, влияющих на предел обнаружения и лимитирующих дальнейшее снижение этой величины. В мини-обзоре рассмотрено разнообразие иммуноаналитических систем, теоретические оценки их пределов обнаружения. Охарактеризованы возможности снижения предела обнаружения, предоставляемые изменением состава определяемых иммунных комплексов, использованием новых маркеров, включаемых в эти комплексы, различными способами их регистрации и усиления регистрируемого сигнала. Обсуждаются подходы, предлагаемые для выявления в тестируемых пробах единичных молекул целевых соединений.
Иммунохимические методы выявления и определения содержания различных соединений, основанные на применении антител, нашли широкое применение в современной практике – в медицинской и ветеринарной диагностике, контроле качества и безопасности потребительской продукции (прежде всего, продуктов питания), экологическом мониторинге [1, 2]. Все иммунохимические методы основаны на образовании комплекса антител с определяемым антигеном (аналитом), который регистрируется инструментально или визуально. Разнообразные наборы реагентов и методики определения отличаются как по схемам формирования иммунных комплексов и способам их регистрации, так и по используемым препаратам антител, которые могут связывать целевые соединения с разной аффинностью и специфичностью [3]. В этой связи востребовано сравнение доступных пользователю вариантов, при выборе из которых крайне важную роль играет предел обнаружения – минимальная выявляемая концентрация целевого соединения. Для обоснованного сравнения данная величина должна быть корректно установлена; особенности решения этой задачи неоднократно обсуждались применительно к биоаналитическим системам [4–6].
Чтобы аналитическая методика имела практическую ценность, предел обнаружения должен быть ниже или равен концентрации, являющейся пороговой для принятия решения на основании результатов анализа пробы (например, предельно допустимой концентрации в пище опасного для здоровья вещества или концентрации биомаркера в крови, разграничивающей здоровых и больных пациентов). Это требование необходимо, но не достаточно. На сегодняшний день для большинства значимых биологически активных веществ уже предложены аналитические методики с пределами обнаружения, достигшими эти пороговые уровни. Однако поиск методик с еще меньшими пределами обнаружения продолжается [7–11]. В чем состоят преимущества таких разработок? Во-первых, информация о присутствии контролируемого соединения даже в концентрации ниже пороговой также позволяет сделать значимые выводы. Например, концентрация биомаркера некоторой патологии еще недостаточно высока, чтобы говорить о заболевании, но свидетельствует о возможных угрозах для здоровья в будущем и целесообразности профилактических мер. Во-вторых, снижение предела обнаружения, как правило, сопровождается ростом точности определения концентраций аналита, близких к пороговым. В-третьих, низкий предел обнаружения обеспечивает запас при работе с многокомпонентными пробами биологического происхождения, матрица которых может влиять на формирование специфических комплексов и генерацию регистрируемого сигнала. В таких ситуациях простое разбавление пробы значительно снижает влияние матрицы на получаемые результаты.
Существуют и исключения, когда для аналитической методики оптимален строго определенный предел обнаружения. Как правило, это присуще унифицированным методикам с фиксированным разведением пробы (автоматические анализаторы) или без разведения (полевые обследования), когда информация о достижении пороговой концентрации достаточна для дальнейших действий, например, для отбраковки коммерческих продуктов с превышением нормативных требований по уровню контаминант. Однако в большинстве случаев предельно низкий уровень выявляемых концентраций все же востребован.
Стремление ко все более низким пределам обнаружения влияет и на научные разработки. В ведущих журналах, специализирующихся в области биоаналитических методов, доминируют статьи, описывающие установление рекордно низких пределов обнаружения применительно к тому или иному практически востребованному аналиту. Такая гонка иногда негативно сказывается на качестве и значимости результатов разработок. Встречаются статьи, в которых предложенные изменения аналитической методики не сопровождаются значительными изменениями регистрируемого параметра и не должны были бы вызвать столь существенный сдвиг предела обнаружения, который, тем не менее, декларируется авторами без объяснения причин и не подтверждается в последующих публикациях.
В этой ситуации важно понимать, какие пределы обнаружения в принципе могут быть достигнуты при известных характеристиках компонентов иммуноаналитической системы – константах взаимодействия реагентов, соотношении между концентрацией образующегося иммунного комплекса и величиной генерируемого им сигнала. Эта информация позволяет научно обоснованно относиться к достигаемым пределам обнаружения, подразделяя их на потенциально возможные и нереалистичные. Более того, знания о том, какие факторы лимитируют снижение предела обнаружения, служат основой при выборе наиболее перспективных подходов к дальнейшему совершенствованию аналитических систем и корректного планирования их разработок.
Данный мини-обзор посвящен рассмотрению факторов, лимитирующих пределы обнаружения иммуноаналитических систем, и путей преодоления существующих ограничений.
ОСОБЕННОСТИ РАЗЛИЧНЫХ ФОРМАТОВ ИММУНОАНАЛИЗА
Иммуноаналитические методы основаны на применении антител или их производных в качестве рецепторных молекул. Способность антител связываться с высокой аффинностью с самыми различными соединениями (антигенами) обеспечивается генетической вариабельностью определенных участков этих молекул и осуществляемом в организмах животных отборе клонов продуцирующих антитела клеток при контакте с соответствующим антигеном (клонально-селекционная теория) [12], а также дополнительными процессами диверсификации антител в организме [13]. Разработан ряд протоколов, позволяющих получать in vivo или in vitro высокоспецифичные антитела [14–16]. Количество вариантов антител разной специфичности, которые могут быть наработаны этими методами, оценивается в десятки миллионов, а последующая генно-инженерная модификация антигенсвязывающих сайтов антител еще больше увеличивает их разнообразие. При этом, если ранние методики позволяли получать антитела лишь к биополимерам, то на сегодняшний день имеется множество антител, связывающихся с различными низкомолекулярными соединениями и даже с ионами металлов [17, 18], селективно распознающих близкие по структуре молекулы. В каталогах ведущих фирм представлены десятки тысяч препаратов антител к различным соединениям.
Иммуноаналитические разработки начинались с методик, в которых комплексообразование антиген–антитело регистрировалось без дополнительных реагентов, например, по формированию в растворе мутного преципитата или осаждению иммунного комплекса в виде наблюдаемого невооруженным глазом осадка. Однако величины пределов обнаружения для таких методик были весьма высокими, и их применение было оправдано лишь для немногих соединений с высоким содержанием в биопробах [19]. Для преодоления этого ограничения было предложено мечение иммунореагентов соединениями, выявляемыми в низких концентрациях. В качестве таких маркеров в разных разработках применяют изотопы, ферменты, флуорофоры [20]. Чтобы измерить количество образовавшихся иммунных комплексов, успешно используется иммобилизация реагентов на носитель и его отмывка после проведения иммунной реакции, удаляющая несвязавшиеся реагенты и компоненты пробы (гетерогенные схемы анализа). Существуют и безразделительные (гомогенные) схемы анализа, однако они требуют существенных изменений свойств маркера при включении в иммунный комплекс и, как правило, более чувствительны к влиянию матрицы тестируемых проб [21]. При этом, если в начале разработок гомогенных методов иммуноанализа в основном предлагалось использовать модуляцию активности ферментного маркера в комплексе с антителами [22], то разрабатываемые сейчас методические решения преимущественно основаны на процессах переноса энергии между донором и акцептором, объединяемых в результате реакции антиген–антитело [23–25].
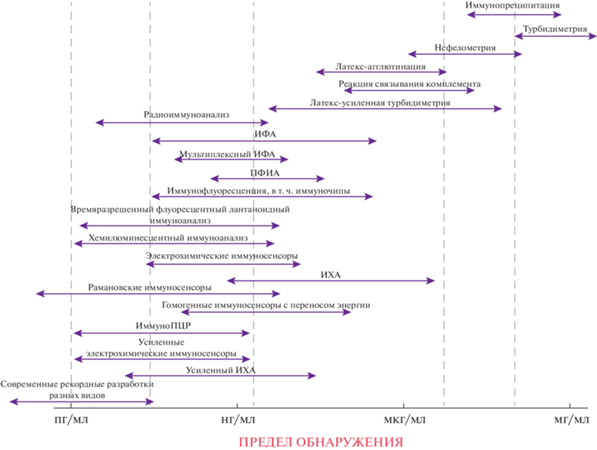
Рис. 1 схематично демонстрирует разнообразие иммуноаналитических методов и смещение новых разработок в область более низких определяемых концентраций. Отметим, что на сегодняшний день массовое практическое применение нашли лишь немногие из этих методов – иммуноферментный анализ с колориметрическим и люминесцентным детектированием, иммунохроматография и, для ряда низкомолекулярных аналитов, поляризационный флуоресцентный иммуноанализ. Для соединений, контролируемых в высоких концентрациях, по-прежнему применяют агглютинационные методы из-за их методической простоты. Радиоиммунные методы анализа, пережившие бум во второй половине прошлого века, сейчас используют все реже. Учитывая эту консервативность, следует понимать, что успех какой-то новой разработки по снижению предела обнаружения сам по себе не гарантирует ее последующей популярности как средства массовой диагностики. Для такого перевооружения аналитических лабораторий должно совпасть много факторов как научно-организационного (применимость для многих аналитов, создание приборной базы), так и социального характера.
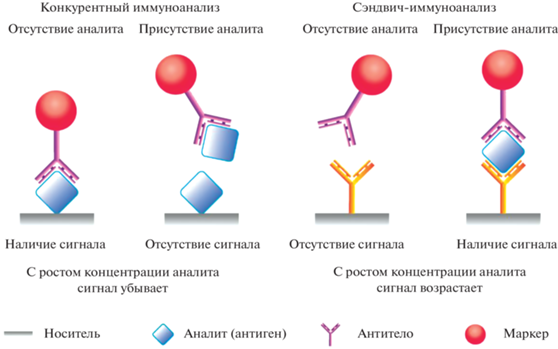
Предложено большое число классификаций форматов иммунохимического анализа, основанных на отличиях по типу используемых маркеров, составу определяемых иммунных комплексов и последовательности их формирования [28, 29]. При рассмотрении вопросов о пределах обнаружения, достигаемых в разных форматах иммуноанализа, первоочередное значение имеет их разделение на односайтные (конкурентные) форматы, используемые при определении низкомолекулярных антигенов с единственной антигенной детерминантой (сайтом связывания антител), и двухсайтные (сэндвич) форматы, применяемые для более крупных антигенов с несколькими детерминантами. Рис. 2 демонстрирует принципиальное отличие этих форматов, приводящее к разному ходу концентрационной зависимости аналитического сигнала (обеспечиваемого связыванием маркера с носителем).
В последние годы активно развиваются неконкурентные форматы иммуноанализа низкомолекулярных соединений. В таких системах преодолевается ряд ограничений конкурентных схем, однако их реализация требует наличия особых реагентов и далеко не для всех аналитов возможна [30, 31].
ТЕОРЕТИЧЕСКИЕ ОЦЕНКИ ПРЕДЕЛОВ ОБНАРУЖЕНИЯ В ИММУНОАНАЛИЗЕ
В зависимости от способов введения метки и последовательности формирования детектируемых комплексов сэндвич- и конкурентные форматы анализа разделяются на множество подгрупп. Тем не менее можно рассмотреть простейшие взаимодействия, исключив из рассмотрения диффузионные ограничения и различия индивидуальных молекул в препаратах антигенов и антител. Для таких систем возможны общие алгебраические решения, определяющие зависимость регистрируемого сигнала от концентрации выявляемого соединения в пробе. Анализ этих математических описаний, проведенный Джексоном и Экинсом [32], позволил охарактеризовать градуировочные зависимости неконкурентного и конкурентного иммуноанализа, связь их параметров со свойствами антител. Развивая этот подход, Тейлор и соавт. [33] включили в рассмотрение реальные особенности вариации фонового сигнала и показали соответствие теоретических прогнозов экспериментальным данным. В соответствии с проведенными расчетами предел обнаружения иммуноанализа для конкурентных форматов определяется аффинностью антител и воспроизводимостью сигнала в отсутствие аналита (уравнение (1)), а для неконкурентных форматов – этими двумя параметрами, а также аффинностью взаимодействий реагентов и компонентов пробы в аналитической системе, приводящих к неспецифическому связыванию маркера (уравнение (2)):
(1)
${{\sigma }_{{{\text{min, 0}}}}} = {\text{ }}{{{\text{C}}{{{\text{V}}}_{0}}} \mathord{\left/ {\vphantom {{{\text{C}}{{{\text{V}}}_{0}}} {{{K}_{{\text{a}}}}}}} \right. \kern-0em} {{{K}_{{\text{a}}}}}},$(2)
${{\sigma }_{{{\text{min, 0}}}}} = {{{{K}_{n}}{\text{C}}{{{\text{V}}}_{{\text{0}}}}} \mathord{\left/ {\vphantom {{{{K}_{n}}{\text{C}}{{{\text{V}}}_{{\text{0}}}}} {{{K}_{{\text{a}}}}}}} \right. \kern-0em} {{{K}_{{\text{a}}}}}},$Учитывая, что хорошие для аналитического применения антитела характеризуются константами связывания с антигеном порядка 108–1010 М–1, а рекордные антитела – до 1012 М–1, предел обнаружения в конкурентном анализе низкомолекулярных (до 1 кДа) соединений может достигать пикомолярных концентраций, а фемтомолярные уровни должны подтверждаться крайне высокой аффинностью антител.
В случае сэндвич-анализа теоретические расчеты не устанавливают категорических запретов для чрезвычайно низких пределов обнаружения, однако неспецифические взаимодействия и чувствительность детектирования маркера лимитируют это снижение [34].
На сегодняшний день разработан теоретический аппарат, описывающий особенности взаимодействий реагентов в разных более сложных иммуноаналитических системах со своими особенностями локализации реагентов в пространстве, порядка их добавления и перемещения. Такие модели предложены, в частности, для радиоиммунного [35, 36], иммуноферментного [37–39] и иммунохроматографического [40–44] анализа, а также для других иммуноаналитических систем [45–53]. Недавние обзоры [29, 54] суммируют разнообразие используемых в этих моделях подходов. Хотя в ряде систем возникают дополнительные средства усиления сигнала, общие закономерности, сформулированные Джексоном и Экинсом, продолжают для них выполняться, но могут сопровождаться более сложными математическими описаниями требований к минимально возможным пределам обнаружения. Именно эти особенности и имеются в виду, когда в некоторых работах декларируется преодоление порога Джексона−Экинса [55, 56]. Радикальное изменение критериев для предела обнаружения становится возможным лишь при переходе от обычных концентрационных зависимостей аналитического сигнала к регистрации единичных иммунных взаимодействий (см. ниже).
ВОЗМОЖНОСТИ ВОЗДЕЙСТВИЯ НА ФАКТОРЫ, ЛИМИТИРУЮЩИЕ ВЕЛИЧИНЫ ПРЕДЕЛОВ ОБНАРУЖЕНИЯ
С учетом изложенных выше общих закономерностей рассмотрим инструментарий, который может быть использован при разработке высокочувствительных иммуноаналитических систем. Детальное обсуждение крайне разнообразных конкретных работ значительно увеличило бы объем текста, нарушив концепцию мини-обзора. Мы ограничимся перечислением принципиальных методических решений, адресуя читателей к их детализации в указываемых публикациях, преимущественно обзорных.
Прежде всего, предлагаемая методика должна быть оптимизирована: определено сочетание ее параметров – концентраций реагентов, продолжительностей стадий, характеристик реакционной среды и др., которое обеспечивает минимальный предел обнаружения аналита при сохранении приемлемой точности количественного определения его концентрации [57, 58]. Большая часть публикуемых разработок по иммуноанализу включает такую оптимизацию как серию последовательных экспериментов с варьированием каждого из параметров. Однако влияние этих параметров на предел обнаружения может быть зависимым друг от друга, и корректный выбор оптимума требует более детальной многофакторной оптимизации. Соответствующий инструментарий аналитической химии успешно адаптирован и апробирован для иммуноанализа [59–61] и несомненно эффективен, несмотря на некоторую трудоемкость и сложность обработки данных. Отметим, что часть параметров (например, рН, ионная сила реакционной среды, концентрации детергентов) может быть выбрана в монопараметрических экспериментах, так как их оптимальные значения не зависят от других параметров. С учетом этого выбора многофакторную оптимизацию можно ограничить влияющими друг на друга концентрационными и временными параметрами.
Качество используемых в иммуноанализе антител, несомненно, имеет важное значение. Помимо скрининга коммерчески доступных и получаемых в лаборатории препаратов антител, изменение их связывающих свойств может быть достигнуто генетическим дизайном антиген-связывающих сайтов [62–64], а также методами клик-химии [65], с помощью которых можно ковалентно связывать молекулы в комплексах иммунореагентов [66]. Однако, как следует из рассмотренных выше закономерностей, далеко не всегда аффинность иммунного взаимодействия является фактором, лимитирующим снижение предела обнаружения. К тому же кинетическая константа ассоциации у разных антител к одному и тому же соединению близка, будучи обусловленной диффузионной подвижностью в растворе и площадями участков связывания на поверхностях реагирующих молекул. Отличия разных производных антител (Fab-фрагментов, наноантител) в этом отношении невелики, хотя такие производные востребованы в новых разработках благодаря другим своим преимуществам – меньшему размеру, стабильности, простоте модификации и пр. [67, 68]. Рост аффинности в таких ситуациях определяется, прежде всего, кинетическими константами диссоциации, а их вклад в количество иммунных комплексов проявляется лишь при продолжительных инкубациях. Большое значение имеет также соотношение аффинностей у нативных и модифицированных молекул. В частности, в конкурентном формате иммуноанализа с мечением антигена более низкая аффинность меченого препарата по сравнению с нативным сдвигает рабочий диапазон и предел обнаружения в сторону более низких концентраций [69]. Еще один значимый фактор – би- и поливалентность молекул иммуноглобулинов, которая обеспечивает возможность образования множественных связей с поливалентным антигеном, но становится негативным фактором, когда моновалентный аналит конкурирует с поливалентным антигенным препаратом за связывание с антителами [70]. В таких ситуациях может быть оправдана замена полномерных молекул антител на их моновалентные фрагменты.
Критичным для обеспечения низкого предела обнаружения является достижение реакцией антиген–антитело химического равновесия, особенно в ситуациях, когда из-за тех или иных практических потребностей тестирование должно быть проведено за несколько минут. Диффузионно-обусловленные ограничения взаимодействий между иммобилизованным и находящимся в растворе иммунореагентом могут быть преодолены с использованием так называемых гомогенно-гетерогенных форматов анализа, в которых носитель с антителами вначале диспергирован в объеме, а после быстрой гомогенной реакции с антигеном осаждается и таким образом отделяется от непрореагировавших компонентов реакционной смеси. В качестве таких носителей могут использоваться водорастворимые полиэлектролиты (отделяемые добавлением противоионов), другие полимеры, а также магнитные частицы [71–73]. Дополнительный выигрыш при этом можно получить, если осажденные иммунные комплексы ресуспендируются в меньшем объеме по сравнению с исходным объемом тестируемой пробы. Помимо этого, для ускорения иммунной реакции предложено использовать ультразвук [74, 75], повышение мобильности молекул в растворе с помощью наномоторов [76–79]. Ряд перспективных результатов получен для микрофлюидных систем с концентрированием выявляемых иммунных комплексов в микроканалах [80, 81], в том числе в сочетании с центрифугированием [82].
Важно проведение аналитических реакций в условиях, когда используемые антитела сохраняют реакционную способность. Их химическая модификация и иммобилизация часто приводят к инактивации, что снижает степень связывания маркера и препятствует высокочувствительному определению образующихся иммунных комплексов. Для преодоления этого ограничения используют различные способы ориентированной иммобилизации, в том числе посредством взаимодействия антител с реагентами, распознающими удаленные от антиген-связывающих сайтов участки молекулы и тем самым максимально сохраняющие доступность этих сайтов для иммунного взаимодействия [83–85].
Еще один важный ресурс – использование в иммуноанализе маркеров, достоверно выявляемых в низких концентрациях. Разные варианты маркеров рассматривались на ранних этапах развития иммуноферментного анализа, но сейчас существующие разработки ограничены небольшим числом ферментов, наиболее широко используемыми из которых являются пероксидаза и щелочная фосфатаза. Однако продолжаются активные исследования по поиску наиболее эффективных субстратных растворов, прежде всего, для систем с люминесцентной регистрацией продукта, показавших существенные выигрыши в пределах обнаружения по сравнению с колориметрическими системами [86, 87]. В иммуноаналитических системах с электрохимической регистрацией сигнала активно применяются и другие ферменты – глюкозооксидаза, ацетилхолинэстераза и др.
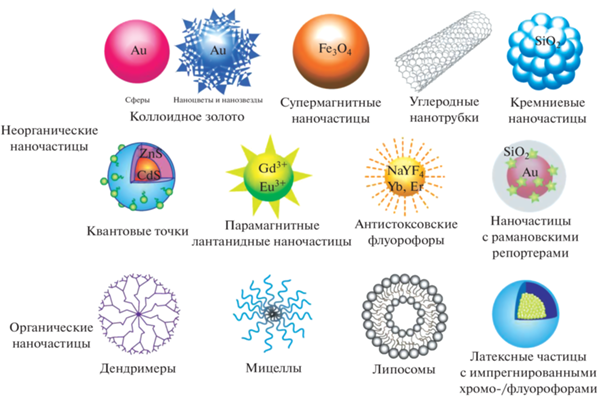
Активно рассматриваются новые наночастицы – маркеры для различных иммуноаналитических систем (рис. 3). Варьирование химического состава (и соответственно спектральных характеристик), размеров, формы наночастиц позволяет значительно изменить величину сигнала, регистрируемого от единичного иммунного комплекса. Разнообразие разработок в этом направлении представлено в ряде обзоров [88–93]. Отметим, что возможности новой кандидатной наночастицы могут быть оценены ее простой и быстрой “паспортизацией” по физико-химическим параметрам, т.е. не требуют полного цикла экспериментов по разработке и характеристике иммуноаналитической системы [94].
Эффекты гигантского комбинационного рассеяния на поверхности наночастиц также обладают значительным потенциалом для снижения предела обнаружения [95–97]. Хотя реализованные на практике разработки часто уступают теоретическим ожиданиям, на сегодняшний день большая часть рекордных по пределам обнаружения иммуноаналитических систем с использованием наночастиц относится именно к таким маркерам. При снижении стоимости приборного обеспечения можно ожидать дальнейшего роста их конкурентного потенциала [98, 99].
Особый интерес представляют неоптические варианты регистрации наномаркеров – термометрия, магнитометрия и др. [100–103]. В таких системах можно обеспечить крайне низкий фоновый сигнал и, в полном соответствии с теоретическими предсказаниями, достоверно определять низкие концентрации аналитов. Отдельно отметим методики иммуноанализа с масс-спектрометрической регистрацией маркера, характеризующиеся весьма низкими пределами обнаружения, но требующие сложного и дорогостоящего приборного обеспечения [104].
Достоинством флуоресцентных маркеров – как органических, так и нанодисперсных – также является возможность выбора препаратов с длинами волн возбуждения и эмиссии, исключающими влияние компонентов пробы на регистрируемый сигнал. Низкий фон позволяет, увеличивая интенсивность возбуждающего света, наращивать отклик аналитической системы и достоверно определять низкие концентрации аналитов. Возможности флуоресцентных маркеров в иммуноанализе представлены в недавних обзорах [105–108].
Следующий класс перспективных направлений для снижения предела обнаружения в иммуноанализе – амплификационные методы, когда исходно связавшийся с иммунным комплексом единичный маркер генерирует или связывает значительное число регистрируемых молекул или частиц. Описан ряд вариантов такой амплификации [109–116]:
• высвобождение молекул маркера из общего носителя (например, липосомы);
• высвобождение с поверхности частицы многих независимо регистрируемых молекул-зондов;
• образование на основании одной связанной наночастицы агрегатов из десятков и сотен взаимодействующих с ней функционализированных наночастиц;
• наращивание наночастиц-маркеров восстановлением солей металлов на их поверхности;
• использование наночастиц-нанозимов, катализирующих трансформацию субстратов в определяемые продукты, и др.
Применение в качестве маркеров нанозимов – наночастиц металлов, обладающих каталитическими свойствами, – позволяет использовать их высокую толерантность к условиям среды, инактивируя каталитическую активность компонентов пробы и после этого регистрируя активность нанозима с крайне низким фоновым сигналом [117, 118].
В ряде разработок иммунохимические взаимодействия интегрируются с широко известными методами амплификации, используемыми в молекулярно-генетических разработках. Так, принцип полимеразной цепной реакции (ПЦР), позволяющей многократно удваивать выявляемую олигонуклеотидную цепочку посредством циклов ферментативного синтеза комплементарных последовательностей и их высвобождения при высокотемпературной обработке, может служить заключительным этапом иммунохимического анализа с включением в иммунный комплекс олигонуклеотидного маркера [119–122].
К сожалению, разработки, непосредственно направленные на минимизацию фонового связывания маркера в иммуноанализе, крайне разрознены и решения, предлагаемые для одних систем, часто оказываются непригодными для других. Поэтому универсальный используемый разработчиками методический аппарат сводится к немногим давно известным подходам, таким как применение детергентов. Учитывая критерий Джексона–Экинса, новые общие решения по снижению неспецифического сигнала могут внести существенный вклад в борьбу за низкие пределы обнаружения иммуноаналитических си-стем.
Как уже отмечалось, в последние годы наблюдается рост количества публикаций, описывающих новые методические решения в иммуноанализе и достигаемые с их помощью рекордно низкие пределы обнаружения. Полезно, по мнению авторов, сформулировать критерии, позволяющие оценить перспективы предлагаемого подхода, шансы получить сходные выигрыши при работе с другими аналитами и иммунореагентами. Соответствующие признаки суммированы в табл. 1. Надеемся, что эти критерии могут быть полезными и при планировании собственных экспериментов, способствовать усилению доказательной базы при представлении результатов исследований.
Таблица 1.
Критерии оценки описаний иммуноаналитических систем
| Разработка иммуноаналитической системы с низким пределом обнаружения имеет следующие шансы воспроизведения и дальнейшего применения: | |
|---|---|
| высокие, если: | низкие, если: |
| Ее преимущества подтверждены сравнением с серийным иммуноанализом, реализованным с использованием тех же иммунореагентов | Сравнение ограничивается ссылкой на публикацию предшественников |
| Количественные отличия нового подхода к генерации аналитического сигнала сопоставимы с отличиями физических свойств компонентов, используемых для этой генерации | Преимущества нового подхода обосновываются только качественным комментарием об отличии свойств используемых компонентов |
| Ожидаемые концентрации иммунореагентов в реакционной среде и константы их взаимодействия (ограниченные свойствами антител) позволяют ожидать формирование иммунных комплексов в количествах, достаточных для воспроизводимого отклика системы | При заявленном пределе обнаружения на объем проведения реакции приходятся единичные иммунные комплексы |
| Представлены экспериментальные данные по определению аналитов в концентрациях, близких к пределу обнаружения | Достижение предела обнаружения обосновывается исключительно расчетом по 3σ-критерию |
| Относительные стандартные отклонения на градуировочной кривой сопоставимы с погрешностями пипетирования (инжектирования) реагентов и резко не различаются для высоких и низких концентраций аналита | Заявленный предел обнаружения достигается благодаря резкому снижению относительных стандартных отклонений сигнала в области низких концентраций |
| Показано отсутствие влияния на специфическое взаимодействие основных компонентов проб для их реальных концентраций в биоматрицах | Изучение селективности взаимодействий сводится к тестированию чистых растворов аналита и других веществ в сопоставимых концентрациях |
| Подтверждена возможность тестирования неразбавленных или разбавленных в несколько раз биопроб | Апробация в биоматрицах ограничивается определением аналита при добавлении к пробе, разбавленной в десятки-сотни раз (что означает пропорционально худший предел обнаружения в расчете на исходный объем биопробы) |
| Для биопроб, используемых в качестве отрицательного контроля, отсутствие аналита в концентрациях вплоть до предела обнаружения разрабатываемого метода подтверждено альтернативным высокочувствительным методом | Отсутствие аналита в отрицательном контроле постулируется без данных об использованном для проверки методе и его пределе обнаружения |
АЛЬТЕРНАТИВНЫЕ РЕШЕНИЯ В ИММУНОАНАЛИЗЕ, ДЕТЕКТИРОВАНИЕ ЕДИНИЧНЫХ МОЛЕКУЛ
Детектирование единичных молекул можно рассматривать как крайний вариант амплификации сигнала, когда результатом одного взаимодействия становится существенное изменение свойств в макрообъеме. В принципе, решение таких задач хорошо известно физикам, на протяжении десятилетий успешно регистрирующим единичные заряженные частицы в камере Вильсона или пузырьковой камере – детекторе, заполненном переохлажденным перенасыщенным паром, в котором заряженная частица инициирует конденсацию водяных капель и треков из этих капель вдоль своего движения.
Данное сравнение наглядно демонстрирует два основных требования к детектору единичных молекул – трансформация единичного события на наноразмерном уровне в детектируемый сигнал и крайне низкая вероятность инициации такого же сигнала любыми другими компонентами пробы или реакционной среды. В биохимическом анализе нельзя достоверно говорить о выявлении единственной молекулы, так как наблюдаемый сигнал может быть вызван не ее связыванием, а каким-то из многих возможных неспецифических взаимодействий. Однако статистически достоверное отличие между интенсивностью сигнала при тестировании пробы и при эксперименте с объектом, в котором гарантировано отсутствие целевого аналита, дает основу для вывода об обнаружении целевого соединения (реально речь может идти как минимум о нескольких десятках молекул в охарактеризованном объеме пробы).
Существующее разнообразие разработок по детектированию методами иммуноанализа единичных молекул охарактеризовано в недавних обзорах [9, 123–130]. Отметим следующие основные направления таких разработок:
• генерация сигнала на сенсорной поверхности с множеством микроячеек, при котором связывания единичного маркера в ячейке достаточно для генерации в ней сигнала, регистрируемого обычно методом флуоресцентной микроскопии;
• изменение проницаемости мембраны с микропорами, которые блокируются рецепторными молекулами и открываются при их связывании с молекулами аналита;
• комплексообразование флуоресцентных наночастиц за счет иммунных взаимодействий, регистрируемое в капиллярных ячейках;
• изменение проводимости полевых транзисторов, вызываемое связыванием с единичными чувствительными участками нанометровых размеров;
• атомно-силовая регистрация единичных иммунных комплексов на поверхности, сканируемой с помощью микрощупов-кантеливеров, выявляющих перепады уровня на наноразмерном уровне, которые трансформируются в сдвиг луча в детекторе и таким образом регистрируются;
• фишинг единичных молекул антигенов на поверхности посредством ее сканирования кантеливерами с иммобилизованными рецепторными молекулами.
Некоторые методические решения для регистрации единичных молекул уже реализованы в серийно производимых приборах и их реагентном обеспечении – Single Molecule Array (Simoa™) фирмы “Quanterix”, Single Molecule Counting (SMC™) Erenna® фирмы “Millipore Merck”, Ion Torrent™ от “Thermo Fisher” и др.
ОЦЕНКА ПЕРСПЕКТИВ РАЗВИТИЯ ИММУНОАНАЛИТИЧЕСКИХ МЕТОДОВ
Поскольку приведенное выше изложение было ориентировано в основном на демонстрацию разнообразия подходов к снижению пределов обнаружения в иммуноанализе, имеет смысл в заключение выделить наиболее активно развивающиеся разработки и практические задачи, для решения которых наиболее востребовано их применение.
Наибольшее число публикаций в ведущих журналах, рассматривающих иммуноаналитические разработки, посвящено: 1) новым маркерам, 2) новым схемам усиления сигнала с участием нескольких реагентов, 3) новым вариантам геометрии тест-систем и расположения последовательно взаимодействующих реагентов. Все эти направления предоставляют много возможностей предложить новую аналитическую систему и, при убедительной демонстрации ее преимуществ, расширить арсенал биометодов.
Какая практически значимая информация может быть получена с помощью новых высокочувствительных разработок в области иммуноанализа? Не претендуя на полноту перечня, отметим несколько таких задач в разных областях применения:
– совершенствование клинических методов диагностики заболеваний, требующих выявления маркеров в ультранизких концентрациях;
– простой внелабораторный контроль состояния здоровья с неинвазивным отбором биопроб. Тут наиболее востребованы быстрые тест-методы иммуноанализа;
– мониторинг воздуха и воды для оперативного выявления опасных соединений;
– быстрое одновременное определение многих аналитов в одной пробе малого объема.
Эффективное решение этих задач возможно лишь в сочетания с форматами иммунодиагностики, позволяющими определять низкие концентрации аналитов, поэтому рассмотренные в обзоре разработки представляются крайне востребованными.
Работа выполнена при финансовой поддержке Российского научного фонда (грант 19-14-00370).
Авторы благодарят Н.А. Таранову за подготовку иллюстративного материала.
Список литературы
Wild D. The Immunoassay Handbook. Theory and Applications of Ligand Binding, ELISA and Related Techniques. 4th Ed. Amsterdam, the Netherlands: Elsevier Science, 2013. 1036 p.
O’Kennedy R., Murphy C. Immunoassays: Development, Applications and Future Trends. Singapore, Singapore: Jenny Stanford Publishing, 2017. 470 p.
Vashist S.K., Luong J.H.T. Handbook of Immunoassay Technologies: Approaches, Performances, and Applications. Amsterdam, the Netherlands: Academic Press, 2018. 478 p.
Loock H.P., Wentzell P.D. Detection limits of chemical sensors: Applications and misapplications // Sens. Actuators B: Chem. 2012. V. 173. P. 157.
Masson J.F. Consideration of sample matrix effects and “biological” noise in optimizing the limit of detection of biosensors // ACS Sensors. 2020. V. 5. № 11. P. 3290.
Molina-Fernandez I., Leuermann J., Ortega-Monux A., Wanguemert-Perez J.G., Halir R. Fundamental limit of detection of photonic biosensors with coherent phase read-out // Optics Express. 2019. V. 27. № 9. P. 12616.
Ju H. Signal amplification for highly sensitive immunosensing // J. Anal. Test. 2017. V. 1. № 1. P. 7.
Wu Y.F., Tilley R.D., Gooding J.J. Challenges and solutions in developing ultrasensitive biosensors // J. Am. Chem. Soc. 2019. V. 141. № 3. P. 1162.
Momenbeitollahi N., Cloet T., Li H.Y. Pushing the detection limits: strategies towards highly sensitive optical-based protein detection // Anal. Bioanal. Chem. 2021. V. 413. № 24. P. 5995.
Shirshahi V., Liu G. Enhancing the analytical performance of paper lateral flow assays: From chemistry to engineering // Trends Anal. Chem. 2021. V. 136. Article 116200.
Van-Thuan N., Song S., Park S., Joo C. Recent advances in high-sensitivity detection methods for paper-based lateral-flow assay // Biosens. Bioelectron. 2020. V. 152. Article 112015.
Ribatti D. Sir Frank Macfarlane Burnet and the clonal selection theory of antibody formation // Clin. Exper. Med. 2009. V. 9. № 4. P. 253.
Kanyavuz A., Marey-Jarossay A., Lacroix-Desmazes S., Dimitrov J.D. Breaking the law: Unconventional strategies for antibody diversification // Nature Rev. Immunol. 2019. V. 19. № 6. P. 355.
Leenaars M., Hendriksen C.F.M. Critical steps in the production of polyclonal and monoclonal antibodies evaluation and recommendations // ILAR J. 2005. V. 46. № 3. P. 269.
Howard G.C., Kaser M.R. Making and Using Antibodies: A Practical Handbook. 2nd Ed. Boca Raton, USA: Press-Taylor & Francis Group, 2014. 427 p.
Lee Y.J., Jeong K.J. Challenges to production of antibodies in bacteria and yeast // J. Biosci. Bioeng. 2015. V. 120. № 5. P. 483.
Li P.W., Zhang W., Zhang Z.W., Zhang Q., Chen Z.Y. Fundamentals of hapten-protein conjugate synthesis to obtain high-quality antibodies for analysis of food and environmental contaminants // Curr. Org. Chem. 2017. V. 21. № 26. P. 2606.
Wang Y., Zhang C., Liu F. Antibody developments for metal ions and their applications // Food Agric. Immunol. 2020. V. 31. № 1. P. 1079.
Firestone G.L., Winguth S.D. Immunoprecipitation of proteins // Methods Enzymol. 1990. V. 182. P. 688.
Дзантиев Б.Б., Жердев А.В. Иммуноаналитические методы / Биохимические методы анализа / Под ред. Дзантиева Б.Б. М.: Наука, 2010. С. 303.
Dinis-Oliveira R.J. Heterogeneous and homogeneous immunoassays for drug analysis // Bioanalysis. 2014. V. 6. № 21. P. 2877.
Wu A.H.B. A selected history and future of immuno-assay development and applications in clinical chemistry // Clin. Chim. Acta. 2006. V. 369. № 2. P. 119.
Takkinen K., Zvirbliene A. Recent advances in homogenous immunoassays based on resonance energy transfer // Curr. Opin. Biotechnol. 2019. V. 55. P. 16.
Dong J., Ueda H. Recent advances in Quenchbody, a fluorescent immunosensor // Sensors. 2021. V. 21. № 4. Article 1223.
Eangoor P., Das S., Pucc V. Evaluation of homogeneous proximity immunoassays for preclinical bioanalysis // Bioanalysis. 2020. V. 12. № 14. P. 1757.
Immunoassays ELISA & CLIA. Antrim, UK: Fortress Diagnostics. 2020. https://www.fortressdiagnostics.com/news/2020/march/extensive-range-of-high-quality-immunoassays (21.11.2021).
Dzantiev B.B., Urusov A.E., Zherdev A.V. Modern techniques of immunochemical analysis: Integration of sensitivity and rapidity // Biotechnol. Acta. 2013. V. 6. № 4. P. 94.
Miyai K. Classification of immunoassay / Principles and Practice of Immunoassay / Eds. Price C.P., Newman D.J. London: Palgrave Macmillan, 1991. P. 246.
Сотников Д.В., Жердев А.В., Дзантиев Б.Б. Математическое моделирование биоаналитических систем // Успехи биол. химии. 2017. Т. 57. С. 385. (Sotnikov D.V., Zherdev A.V., Dzantiev B.B. Mathematical modeling of bioassays // Biochemistry (Moscow). 2017. V. 82. № 13. P. 1744.)
Liu A.P., Anfossi L., Shen L. Li C, Wang X.H. Non-competitive immunoassay for low-molecular-weight contaminant detection in food, feed and agricultural products: A mini-review // Trends Food Sci. Technol. 2018. V. 71. P. 181.
Li Y., Zhang G., Mao X., Yang S.P., De Ruyck K., Wu Y.N. High sensitivity immunoassays for small molecule compounds detection – Novel noncompetitive immunoassay designs // Trends Anal. Chem. 2018. V. 103. P. 198.
Jackson T.M., Ekins R.P. Theoretical limitations on immunoassay sensitivity: Current practice and potential advantages of fluorescent Eu3+ chelates as non-r dioisotopic tracers // J. Immunol. Methods. 1986. V. 87. P. 13.
Taylor J., Picelli G., Harrison D.J. An evaluation of the detection limits possible for competitive capillary electrophoretic immunoassays // Electrophoresis. 2001. V. 22. P. 3699.
Woolley C.F., Hayes M.A., Mahanti P., Gilman S.D., Taylor T. Theoretical limitations of quantification for noncompetitive sandwich immunoassays // Anal. Bioanal. Chem. 2015. V. 407. № 28. P. 8605.
Rodbard D., Feldman Y. Kinetics of 2-site immunoradiometric (sandwich) assays. 1. Mathematical models for simulation, optimization, and curve fitting // Immunochemistry. 1978. V. 15. № 2. P. 71.
Rodbard D., Feldman Y., Jaffe M.L., Miles L.E. Kinetics of two-site immunoradiometric (“sandwich”) assays. II. Studies on the nature of the “high-dose hook effect” // Immunochemistry. 1978. V. 15. № 2. P. 77.
Merrill S.J. Computational models in immunological methods: An historical review // J. Immunol. Methods. 1998. V. 216. № 1–2. P. 69.
Hayashi Y., Matsuda R., Maitani T., Imai, K., Nishimura W., Ito K., Maeda M. Precision, limit of detection and range of quantitation in competitive ELISA // Anal. Chem. 2004. V. 76. № 5. P. 1295.
Choi D. H., Katakura Y., Matsuda R., Hayashi Y., Hirobe M., Goda Y., Ninomiya K., Shioya S. Validation of a method for predicting the precision, limit of detection and range of quantitation in competitive ELISA // Anal. Sci. 2007. V. 23. № 2. P. 215.
Qian S.Z., Bau H.H. A mathematical model of lateral flow bioreactions applied to sandwich assays // Anal. Biochem. 2003. V. 322. № 1. P. 89.
Qian S.Z, Bau H.H. Analysis of lateral flow biodetectors: Competitive format // Anal. Biochem. 2004. V. 326. № 2. P. 211.
Liu Z., He X., Li A., Qu Z., Xu F. A two-dimensional mathematical model for analyzing the effects of capture probe properties on the performance of lateral flow assays // Analyst. 2019. V. 144. № 18. P. 5394.
Sotnikov D.V., Zherdev A.V., Byzova N.A., Zvereva E.A., Bartosh A.V., Dzantiev B.B. Mathematical modeling of immunochromatographic test systems in a competitive format: Analytical and numerical approaches // Biochem. Eng. J. 2020. V. 164. Article 107763.
Sotnikov D.V., Zherdev A.V., Dzantiev B.B. Mathematical model of serodiagnostic immunochromatographic assay // Anal. Chem. 2017. V. 89. № 8. P. 4419.
Worsfold P.J., Hughes A. A model immunoassay using automated flow-injection analysis // Analyst. 1984. V. 109. P. 339.
Pribyl M., Snita D., Hasal P., Marek M. Modeling of electric-field driven transport processes in microdevices for immunoassay // Chem. Eng. J. 2004. V. 101. № 1–3. P. 303.
Zuber E., Rosso L., Darbouret B., Socquet F., Mathis G., Flandrois J.P. A descriptive model for the kinetics of a homogeneous fluorometric immunoassay // J. Immunoassay. 1997. V. 18. № 1. P. 21.
Naruse M., Morishita M., Onodera T., Toko K., Hayashi Y. Modeling of detection limit for competitive immunoassay using surface plasmon resonance sensor // Sensors Materials. 2016. V. 28. № 3. P. 219.
Taylor J., Picelli G., Harrison D.J. An evaluation of the detection limits possible for competitive capillary electrophoretic immunoassays // Electrophoresis. 2001. V. 22. № 17. P. 3699.
Roy P., Cherng-Wen D. Microfluidic competition assay via equilibrium binding // Sens. Actuators B: Chem. 2009. V. 139. № 2. P. 682.
Wu D., Voldman J. An integrated model for bead-based immunoassays // Biosens. Bioelectron. 2020. V. 154. Article 112070.
Yanagisawa N., Dutta D. Microfluidic enzyme-linked immunosorbent assay in a region of finite length // Anal. Chim. Acta. 2014. V. 817. P. 28.
Rafat N., Satoh P., Barton S.C., Worden R.M. Integrated experimental and theoretical studies on an electrochemical immunosensor // Biosensors. 2020. V. 10. № 10. Article 144.
Gasperino D., Baughman T., Hsieh H.V., Bell D., Weigl B.H. Improving lateral flow assay performance using computational modeling // Ann. Rev. Anal. Chem. 2018. V. 11. № 11. P. 219.
Brown E.N., McDermott T.J., Bloch K.J., McCollom A.D. Defining the smallest analyte concentration an immunoassay can measure // Clin. Chem. 1996. V. 42. P. 893.
Ekins R., Kelso D. Single- molecule ELISA // Clin. Chem. 2011. V. 57. № 3. P. 372.
Hsieh H.V., Dantzler J.L., Weigl B.H. / Analytical tools to improve optimization procedures for lateral flow assays // Diagnostics. 2017. V. 7. № 2. Article 29.
Bishop J.D., Hsieh H.V., Gasperino D.J., Weigl B.H. Sensitivity enhancement in lateral flow assays: A systems perspective // Lab Chip. 2019. V. 19. № 15. P. 2486.
Jeney C., Dobay O., Lengyel A., Adam E., Nasz I. Taguchi optimisation of ELISA procedures // J. Immunol. Methods. 1999. V. 223. № 2. P. 137.
Luo W., Pla-Roca M., Juncker D. Taguchi design-based optimization of sandwich immunoassay microarrays for detecting breast cancer biomarkers // Anal. Chem. 2011. V. 83. № 14. P. 5767.
Joelsson D., Moravec P., Troutman M., Pigeon J., DePhillips P. Optimizing ELISAs for precision and robustness using laboratory automation and statistical design of experiments // J. Immunol. Methods. 2018. V. 337. P. 35.
Zhao J., Nussinov R., Wu W.-J., Ma B.Y. In silico methods in antibody design // Antibodies. 2018. V. 7. № 3. Article 22.
Peltomaa R., Barderas R., Benito-Pena E., Moreno-Bondi M.C. Recombinant antibodies and their use for food immunoanalysis // Anal. Bioanal. Chem. 2021 (online publication). https://doi.org/10.1007/s00216-021-03619-7
Tiller K.E., Tessier P.M. Advances in antibody design // Ann. Rev. Biomed. Eng. 2015. V. 17. P. 191.
Wang P., Xue T.X., Sheng A.Z., Cheng L.F., Zhang J. Application of chemoselective ligation in biosensing // Crit. Rev. Anal. Chem. (online publication). https://doi.org/10.1080/10408347.2020.1791044
Sadiki A., Kercher E.M., Lu H., Lang R.T., Spring B.Q., Zhou Z.S. Site-specific bioconjugation and convergent click chemistry enhances antibody-chromophore conjugate binding efficiency(dagger) // Photochem. Photobiol. 2020. V. 96. № 3. P. 596.
Bastos-Soares E.A., Sousa R.M.O., Gomez A.F., Alfonso J., Kayano A.M., Zanchi F.B., Funes-Huacca M.E., Stabeli R.G., Soares A.M., Pereira S.S., Fernandes C.F.C. Single domain antibodies in the development of immunosensors for diagnostics // Int. J. Biol. Macromol. 2020. V. 165. P. 2244.
Bever C.S., Dong J.-X., Vasylieva N., Barnych B., Cui Y.L., Xu Z.L., Hammock B.D., Gee S.J. VHH antibodies: Emerging reagents for the analysis of environmental chemicals // Anal. Bioanal. Chem. 2016. V. 408. № 22. P. 5985.
Xu Z.L., Shen Y.D., Beier R.C., Yang J.Y., Lei H.T., Wang H., Sun Y.M. Application of computer-assisted molecular modeling for immunoassay of low molecular weight food contaminants // Anal. Chim. Acta. 2009. V. 647. P. 125.
Winzor D.J. Allowance for antibody bivalence in the characterization of interactions by ELISA // J. Mol. Recogn. 2011. V. 24. № 2. P. 139.
Dzantiev B.B., Zherdev A.V., Yazynina E.V. Application of water-soluble polymers and their complexes for immunoanalytical purposes / Smart Polymers for Bioseparation and Bioprocessing / Eds. Mattiasson B., Galaev I.Yu. London–N.Y.: Taylor & Francis, 2002. P. 207.
Rocha-Santos T.A.P. Sensors and biosensors based on magnetic nanoparticles // Trends Anal. Chem. 2014. V. 62. P. 28.
Урусов А.Е., Петракова А.В., Жердев А.В., Дзантиев Б.Б. Применение магнитных наночастиц в иммуноанализе // Российские нанотехнологии. 2017. Т. 12. № 9–10. С. 3. (Urusov A.E., Petrakova A.V., Zherdev A.V., Dzantiev B.B. Application of magnetic nanoparticles in immunoassay // Nanotechnologies in Russia. 2017. V. 12. № 9–10. P. 471.)
Kuznetsova L.A., Coakley W. Applications of ultrasound streaming and radiation force in biosensors // Biosens. Bioelectron. 2007. V. 22. № 8. P. 1567.
Wiklund M., Hertz H.M. Ultrasonic enhancement of bead-based bioaffinity assays // Lab. Chip. 2006. V. 6. № 10. P. 1279.
Pacheco M., Angel Lopez M., Jurado-Sanchez B., Escarpa A. Self-propelled micromachines for analytical sensing: A critical review // Anal. Bioanal. Chem. 2019. V. 411. № 25. P. 6561.
Jurado-Sanchez B. Nanoscale biosensors based on self-propelled objects // Biosensors. 2018. V. 8. № 3. Article 59.
Wang J. Self-propelled affinity biosensors: Moving the receptor around the sample // Biosens. Bioelectron. 2016. V. 76. P. 234.
Ye H., Wang Y., Xu D.D., Liu X.J., Liu S.M., Ma X. Design and fabrication of micro/nano-motors for environmental and sensing applications // Appl. Mater. Today. 2021. V. 23. Article 101007.
Al Mughairy B., Al-Lawati H.A.J. Recent analytical advancements in microfluidics using chemiluminescence detection systems for food analysis // Trends Anal. Chem. 2020. V. 124. Article 115802.
Shi Y.X., Ye P., Yang K.J., Meng J., Guo J.C., Pan Z.X., Bayin Q.G., Zhao W.H. Application of microfluidics in immunoassay: Recent advancements // J. Healthc. Eng. 2021. V. 2021. Article 2959843.
Shi Y.X., Ye P., Yang K.J., Meng J., Guo J.C., Pan Z.X., Zhao W.H., Guo J.H. Application of centrifugal microfluidics in immunoassay, biochemical analysis and molecular diagnosis // Analyst. 2021. V. 146. № 19. P. 5800.
Lu B., Smyth M.R., O’Kennedy R. Oriented immobilization of antibodies and its applications in immunoassays and immunosensors // Analyst. 1996. V. 121. № 3. P. R29.
Crivianu-Gaita V., Thompson M. Immobilization of Fab' fragments onto substrate surfaces: A survey of methods and applications // Biosens. Bioelectron. 2015. V. 70. P. 167.
Iijima M., Kuroda S. Scaffolds for oriented and close-packed immobilization of immunoglobulins // Biosens. Bioelectron. 2017. V. 89. № 2. P. 810.
Zhao L., Sun L., Chu X. Chemiluminescence immunoassay // Trends Anal. Chem. 2009. V. 28. № 4. P. 404.
Xiao Q., Xu C. Research progress on chemiluminescence immunoassay combined with novel technologies // Trends Anal. Chem. 2020. V. 124. Article 115780.
Gao Y., Zhou Y., Chandrawati R. Metal and metal oxide nanoparticles to enhance the performance of enzyme-linked immunosorbent assay (ELISA) // ACS Appl. Nano Mater. 2020. V. 3. № 1. P. 1.
Huang Y., Xu T.L., Wang W.O., Wen Y.Q., Li K., Qian L.S., Zhang X.J., Liu G.D. Lateral flow biosensors based on the use of micro- and nanomaterials: A review on recent developments // Microchim. Acta. 2020. V. 187. № 1. Article 70.
Quesada-Gonzalez D., Merkoci A. Nanoparticle-based lateral flow biosensors // Biosens. Bioelectron. 2015. V. 73. P. 47.
Mohamad A., Teo H., Keasberry N.A., Ahmed M.U. Recent developments in colorimetric immunoassays using nanozymes and plasmonic nanoparticles // Crit. Rev. Biotechnol. 2019. V. 39. № 1. P. 50.
Welch E.C., Powell J.M., Clevinger T.B., Fairman A.E., Shukla A. Advances in biosensors and diagnostic technologies using nanostructures and nanomaterials // Adv. Funct. Mater. 2021. V. 31. № 44. Article 2104126.
Pirsaheb M., Mohammadi S., Salimi A. Current advances of carbon dots based biosensors for tumor marker detection, cancer cells analysis and bioimaging // Trends Anal. Chem. 2019. V. 115. P. 83.
Zherdev A.V., Dzantiev B.B. Ways to reach lower detection limits in lateral flow immunoassays. Ch. 2 / Rapid Test – Advances in Design, Format and Diagnostic Applications / Ed. Anfossi L. London: InTechOpen, 2018. P. 9.
Smolsky J., Kaur S., Hayashi C., Batra S.K., Krasnoslobodtsev A.V. Surface-enhanced Raman scattering-based immunoassay technologies for detection of disease biomarkers // Biosensors. 2017. V. 7. № 1. Article 7.
Wang Z.Y., Zong S.F., Wu L., Zhu D., Cui Y.P. SERS-activated platforms for immunoassay: Probes, encoding methods, and applications // Chem. Rev. 2017. V. 117. № 12. P. 7910.
Khlebtsov B., Khlebtsov N. Surface-enhanced Raman scattering-based lateral-flow immunoassay // Nanomaterials. 2020. V. 10. № 11. Article 2228.
Wang C., Liu M., Wang Z.F., Li S., Deng Y., He N.Y. Point-of-care diagnostics for infectious diseases: From methods to devices // Nano Today. 2021. V. 37. Article 101092.
Chen H., Das A., Bi L., Choi N., Moon J.I., Wu Y., Park S., Choo J. Recent advances in surface-enhanced Raman scattering-based microdevices for point-of-care diagnosis of viruses and bacteria // Nanoscale. 2020. V. 12. № 42. P. 21560.
Kavetskyy T., Alipour M., Smutok O., Mushynska O., Kiv A., Fink D., Farshchi F., Ahmadian E., Hasanzadeh M. Magneto-immunoassay of cancer biomarkers: Recent progress and challenges in biomedical analysis // Microchem. J. 2021. V. 167. Article 106320.
Gloag L., Mehdipour M., Chen D.F., Tilley R.D., Gooding J.J. Advances in the application of magnetic nanoparticles for sensing // Adv. Mater. 2019. V. 31. № 48. P. 4819.
Qie Z.W., Ning B.A., Liu M., Bai J.L., Peng Y., Song N., Lv Z.Q., Wang Y., Sun S.M., Su X., Zhang Y.H., Gao Z.X. Fast detection of atrazine in corn using thermometric biosensors // Analyst. 2013. V. 138. № 17. P. 5151.
Zhang Y., Yang H., Zhou Z.G., Huang K., Yang S.P., Han G. Recent advances on magnetic relaxation switching assay-based nanosensors // Bioconjug. Chem. 2017. V. 28. № 4. P. 869.
Stevens K.G., Pukala T.L. Conjugating immunoassays to mass spectrometry: Solutions to contemporary challenges in clinical diagnostics // Trends Anal. Chem. 2020. V. 132. Article 116064.
Aranda P.R., Messina G.A., Bertolino F.A., Pereira S.V., Baldo M.A.F., Raba J. Nanomaterials in fluorescent laser-based immunosensors: Review and applications // Microchem. J. 2018. V. 141. P. 308.
Chang X.-H., Zhang J., Wu L.-H., Peng Y.K., Yang X.Y., Li X.L., Ma A.J., Ma J.C., Chen G.Q. Research progress of near-infrared fluorescence immunoassay // Micromachines. 2019. V. 10. № 6. Article 422.
Gong X.Q., Cai J., Zhang B., Zhao Q., Piao J.F., Peng W.P., Gao W.C., Zhou D.M., Zhao M., Chang J. A review of fluorescent signal-based lateral flow immunochromatographic strips // J. Mater. Chem. 2017. V. 5. № 26. P. 5079.
Абрамова А.М., Горячева О.А., Дрозд Д.Д., Новикова А.С., Пономарева Т.С., Строкин П.Д., Горячева И.Ю. Люминесцентные полупроводниковые квантовые точки в химическом анализе // Журн. аналит. хим. 2021. Т. 76. № 3. С. 195. (Abramova A.M., Goryacheva O.A., Drozd D.D., Novikova A.S., Ponomareva T.S., Strokin P.D., Goryacheva I.Y. Luminescence semiconductor quantum dots in chemical analysis // J. Anal. Chem. 2021. V. 76. № 3. P. 273.)
Fenzl C., Hirsch T., Baeumner A.J. Nanomaterials as versatile tools for signal amplification in (bio)analytical applications // Trends Anal. Chem. 2016. V. 79. P. 306.
Edwards K.A., Bolduc O.R., Baeumner A.J. Miniaturized bioanalytical systems: Enhanced performance through liposomes // Curr. Opin. Chem. Biol. 2012. V. 16. № 3–4. P. 444.
Панфёров В.Г., Сафенкова И.В., Жердев А.В., Дзантиев Б.Б. Способы повышения чувствительности иммунохроматографических тест-систем с колориметрической детекцией (обзор) // Прикладная биохимия и микробиология. 2021. Т. 57. № 2. С. 107. (Panferov V.G., Safenkova I.V., Zherdev A.V., Dzantiev B.B. Methods for increasing sensitivity of immunochromatographic test systems with colorimetric detection (review) // Appl. Biochem. Microbiol. 2021. V. 57. № 2. P. 143.)
Wang Y.S., Jin M.J., Chen G., Cui X.Y., Zhang Y.D., Li M.J., Liao Y., Zhang X.Y., Qin G.X., Yan F.Y., Abd El-Aty A.M., Wang J. Bio-barcode detection technology and its research applications: A review // J. Adv. Res. 2019. V. 20. P. 23.
Di Nardo F., Chiarello M., Cavalera S., Baggiani C., Anfossi L. Ten years of lateral flow immunoassay technique applications: Trends, challenges and future perspectives // Sensors. 2021. V. 21. № 15. Article 5185.
Yang H., Xu W., Zhou Y. Signal amplification in immunoassays by using noble metal nanoparticles: A review // Microchim. Acta. 2019. V. 186. № 12. Article 859.
Xiong Y., Leng Y.K., Li X.M., Huang X.L., Xiong Y.H, Emerging strategies to enhance the sensitivity of competitive ELISA for detection of chemical contaminants in food samples // Trends Anal. Chem. 2020. V. 126. Article 115861.
Calabria D., Calabretta M.M., Zangheri M., Marchegiani E., Trozzi I., Guardigli M., Michelini E., Di Nardo F., Anfossi L., Baggiani C., Mirasoli M. Recent advancements in enzyme-based lateral flow immunoassays // Sensors. 2021. V. 21. № 10. Article 3358.
Niu X.H., Cheng N., Ruan X.F., Du D., Lin Y.H. Review-nanozyme-based immunosensors and immunoassays: Recent developments and future trends // J. Electrochem. Soc. 2019. V. 167. № 1. Article 037508.
Wang Q.Q., Wei H., Zhang Z.Q., Wang E.K., Dong S.J. Nanozyme: An emerging alternative to natural enzyme for biosensing and immunoassay // Trends Anal. Chem. 2018. V. 105. P. 218.
Spengler M., Adler M., Niemeyer C.M. Highly sensitive ligand-binding assays in pre-clinical and clinical applications: Immuno-PCR and other emerging techniques // Analyst. 2015. V. 140. № 18. P. 6175.
Рязанцев Д.Ю., Воронина Д.В., Завриев С.К. Иммуно-ПЦР: достижения и перспективы // Успехи биол. химии. 2016. Т. 56. С. 377. (Ryazantsev D.Y., Voronina D.V., Zavriev S.K. Immuno-PCR: Achievements and perspectives // Biochemistry (Moscow). 2016. V. 81. № 13. P. 1754.)
Dahiya B., Mehta P.K. Detection of potential biomarkers associated with outrageous diseases and environmental pollutants by nanoparticle-based immuno-PCR assays // Anal. Biochem. 2019. V. 587. Article 113444.
Sang P.T., Hu Z.G., Cheng Y.L., Yu H., Xie Y.F., Yao W.R., Guo Y.H., Qian H. Nucleic acid amplification techniques in immunoassay: An integrated approach with hybrid performance // J. Agric. Food Chem. 2021. V. 69. № 21. P. 5783.
Gooding J.J., Gaus K.A. Single-molecule sensors: Challenges and opportunities for quantitative analysis // Angewandte Chemie – Int. Ed. 2016. V. 55. № 38. P. 11354.
Wang J.J., Yang J., Ying Y.L., Long Y.T. Nanopore-based confined spaces for single-molecular analysis // Chem. Asian J. 2019. V. 14. № 3. P. 389.
Pleshakova T.O., Bukharina N.S., Archakov A.I., Ivanov Y.D. Atomic force microscopy for protein detection and their physicochemical characterization // Int. J. Mol. Sci. 2018. V. 19. № 4. Article 1142.
Li M., Xi N., Wang Y., Liu L. Advances in atomic force microscopy for single-cell analysis // Nano Res. 2019. V. 12. № 4. P. 703.
Farka Z., Mickert M.J., Pastucha M., Mikusova Z., Skladal P., Gorris H.H. Advances in optical single-molecule detection: En route to supersensitive bioaffinity assays // Angewandte Chemie – Int. Ed. 2020. V. 59. № 27. P. 10746.
Armstrong R.E., Horacek M.Z. Plasmonic assemblies for real-time single-molecule biosensing // Small. 2020. V. 16. № 52. Article 2003934.
Wu Y., Bennett D., Tilley R.D., Gooding J.J. How nanoparticles transform single molecule measurements into quantitative sensors // Adv. Mater. 2020. V. 32. № 18. Article 1904339.
Macchia E., Manoli K., Di Franco C., Scamarcio G., Torsi L. New trends in single-molecule bioanalytical detection // Anal. Bioanal. Chem. 2020. V. 412. P. 5005.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии