Журнал аналитической химии, 2022, T. 77, № 6, стр. 569-575
Управление селективностью разделения дикофеоилхинных кислот в обращенно-фазовой хроматографии
В. И. Дейнека a, *, Е. Ю. Олейниц a, А. Н. Чулков b, Л. А. Дейнека a
a Белгородский государственный национальный исследовательский университет,
Институт фармации, химии и биологии
308015 Белгород, ул. Победы, 85, Россия
b Федеральный центр оценки безопасности и качества зерна и продуктов его переработки,
филиал по г. Белгороду
308015 Белгород, ул. Щорса, 8, Россия
* E-mail: deineka@bsu.edu.ru
Поступила в редакцию 09.09.2021
После доработки 26.09.2021
Принята к публикации 27.09.2021
- EDN: OIUFCB
- DOI: 10.31857/S0044450222060068
Аннотация
Показано, что хроматографическое поведение (изменение логарифма фактора удерживания при изменении состава подвижной фазы) дикофеоилхинных (ДКХ) кислот определяется хроматографическим поведением монокофеоилхинных кислот. При этом наиболее эффективна традиционная стационарная фаза С18 (марки Kromasil) и экологически безвредные подвижные фазы, в которых ацетонитрил заменен на пропанол-2, при подкислении подвижной фазы добавкой 0.25 об. % ортофосфорной кислоты для стабилизации зарядовой формы кислот. Удерживание дикофеоилхинных кислот можно объяснить одновременной сорбцией двумя ароматическими кольцами радикалов кофейной кислоты для обоих исследованных органических модификаторов подвижной фазы. Замена С18-фазы на фенилгексильную фазу не привела к существенным изменениям селективности разделения изомерных ДКХ-кислот. При этом не все изомеры разделяются при использовании подвижных фаз на основе обоих органических модификаторов – ацетонитрила и пропанола-2. Разработанные условия разделения ДКХ (градиентный режим с “зелеными” элюентами А – 10 об. % изопропанола и 0.25 об. % фосфорной кислоты в воде, Б – 20 об. % изопропанола и 0.25 об. % фосфорной кислоты в воде) использованы для определения видового состава кофеоилхинных кислот в кофе, напитке мате и в артишоковом чае.
Дикофеоилхинные (ДКХ) кислоты наряду с монокофеоилхинными (МКХ) кислотами синтезируются во многих растениях [1]. Эти соединения благодаря наличию орто-гидроксильных групп в ароматических кольцах заместителей обладают высокой антиоксидантной активностью [1, 2] и связанными с ней проявлениями биологической активности [1–3]. При этом в работе [4] установлено, что при совместном присутствии МКХ- и ДКХ-кислот в соотношении 12 : 2 в готовом напитке кофе в плазме крови это соотношение уменьшается до 0.6–2.9, что указывает на бóльшую биодоступность именно ДКХ-кислот.
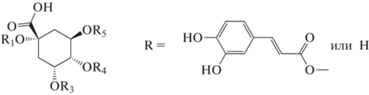
Вследствие наличия четырех гидроксильных групп в молекуле хинной кислоты (схема 1 ) возможно существование четырех изомерных МКХ-кислот, из которых в кофе (как и в “чае” мате) обнаруживают три изомера: 3CQA, 4CQA и 5CQA [4, 5]. Соответственно набор ДКХ-кислот включает также три изомера 3,4diCQA, 3,5diCQA и 4,5diCQA. Если в образце осуществляются пути биосинтеза, включающие этерификацию гидроксильной группы в положении 1, то возможно образование еще трех изомеров ДКХ-кислот: 1,3diCQA, 1,4diCQA и 1,5diCQA.
Схема 1 . Положения ацилирования кофейной кислотой молекулы хинной кислоты.
Для разделения ДКХ высокую эффективность показала обращенно-фазовая ВЭЖХ. Так, в работе [6] на колонке SynergiTM Polar-RP (привитая по эфирной связи фенильная фаза с гидрофильным эндкеппингом) в условиях градиентного элюирования определен следующий порядок элюирования изомеров:
(1)
${{t}_{{\text{R}}}}\left( {3,4{\text{diCQA}}} \right) < {{t}_{{\text{R}}}}\left( {3,5{\text{diCQA}}} \right) < {{t}_{{\text{R}}}}\left( {4,5{\text{diCQA}}} \right).$Такой же порядок, но уже на обычной С18 обращенной фазе в градиентных условиях с использованием метанола и подкисленной муравьиной кислотой воды получен в работе [7], а также в других элюентах на фазах С18 в работах [8–12]. Применение другого варианта стационарной фазы, фенилгексильной фазы, также привело к аналогичному порядку элюирования [13], перечень diCQAs в экстракте Gynara procumbens дополнен еще двумя изомерами:
(2)
$\begin{gathered} {{t}_{{\text{R}}}}\left( {1,3diCQA} \right) < {{t}_{{\text{R}}}}\left( {{\text{3,4diCQA}}} \right) < {{t}_{{\text{R}}}}\left( {{\text{1,5diCQA}}} \right) < \\ < \,\,{{t}_{{\text{R}}}}\left( {{\text{3,5diCQA}}} \right) < {{t}_{{\text{R}}}}\left( {{\text{4,5diCQA}}} \right). \\ \end{gathered} $Для дифференциации изомеров обычно используют полный комплект стандартных веществ, но, учитывая их высокую стоимость, возникает вопрос о возможности дифференциации diCQAs в сложных смесях по характерным электронным спектрам поглощения (при применении диодно-матричных детекторов) и по масс-спектрам. Сюда следует добавить и характерное хроматографическое поведение, которое обычно не используют при дифференциации diCQAs.
Цель настоящей работы – определение селективности разделения изомерных ДКХ-кислот в условиях обращенно-фазовой хроматографии на традиционной С18 и на набирающей популярность фенилгексильной фазе, включая оценку эффективности замены экологически неблагоприятного ацетонитрила на пропанол-2 (изопропанол, ИП) в рамках задач “зеленой” хроматографии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использовали кофе молотый (марка “Петр Великий”), кофе растворимый (марка “Ambassador”), кофе зеленый (арабика, Бразилия), чай мате (Pajarito, Парагвай), чай мате (Pipore, Аргентина), чаи из артишока (Lado Actiso, Вьетнам) и (Lado Herbal, Вьетнам), артишок консервированный (Santolino, Италия), Артишока экстракт (ЗАО “Эвалар”, Россия), приобретенные на рынке г. Белгорода и/или через сеть Интернет. Для градуировки отклика детектора использовали 5CQA (chlorogenic acid hemihydrate, Aldrich, США).
Для приготовления водных настоев сухие навески материала массой 0.50 ± 0.10 г заливали кипятком (50 мл) и выдерживали в течение 10 мин. Настой отделяли от твердого остатка фильтрованием через бумажный фильтр. Аликвотную порцию 10 мл (20 мл для напитка из артишока) очищали методом твердофазной экстракции на патронах ДИАПАК С18 (БиоХимМак СТ, Россия) после подкисления 1 М водным раствором HCl (10 об. %). Кислоты реэкстрагировали с патрона 2 мл смеси 30 об. % ацетонитрила и 30 об. % муравьиной кислоты в воде. Полученный раствор разбавляли водой в соотношении 1 : 2. Для экстракции кислот из артишока консервированный растительный материал обезжиривали н-гексаном, измельчали и навеску 1.00 ± 0.10 г переносили в 50 мл 0.1 М HCl и настаивали сутки. После фильтрования экстракт очищали твердофазной экстракцией, как указано выше.
Кофеоилхинные кислоты разделяли на хроматографе Agilent 1260 Infinity с диодно-матричным детектором с записью электронных спектров поглощения в диапазоне 250–450 нм. Хроматограммы записывали, хранили и обрабатывали, используя программное обеспечение Agilent ChemStation.
Для разделения использовали хроматографические колонки 4.6 × 250 мм Kromasil 100-5-C18 и 4.6 × 250 мм Gemini® 5 мкм С6-Phenyl 110 Å.
Для определения кофеоилхинных кислот использовали колонку Kromasil 100-5-C18 и градиентный режим элюирования с подвижными фазами А (10 об. % ИП и 0.25 об. % фосфорной кислоты в воде) и Б (20 об. % ИП и 0.25 об. % фосфорной кислоты в воде), 1 мл/мин. Режим: 0–10 мин – 40% Б; 20 мин – 100% Б; 21–30 мин – 40% Б. Для градуировки отклика детектора использовали растворы 5CQA. Температура термостата колонки 30°С.
Для регистрации масс-спектров использовали жидкостной тандемный хроматомасс-спектрометр Shimadzu LCMS-8060 в отрицательном режиме сканирования в диапазоне масс 150–750.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При выборе состава подвижных фаз учитывали необходимость подкисления для стабилизации состояния ионизации кофеоилхинных кислот. Создавали рН ~ 1.9–2 добавлением ортофосфорной кислоты (0.25 об. %), что обеспечивает подавление диссоциации карбоксильной группы хинной кислоты [14] и не сильно выходит за рамки устойчивости к гидролизу традиционных обращенных фаз [15].
Разделение дикофеоилхинных кислот на фазе С18. В качестве стационарной фазы данного типа использовали хорошо зарекомендовавшую себя в наших исследованиях фазу Kromasil 110-5-C18, имеющую большую удельную поверхность (349 м2/г) и высокую степень покрытия поверхности силикагеля модификатором (3.45 мкмоль/м2) [16].
Подвижные фазы системы ацетонитрил–0.25 об. % H3PO4–вода. Карта разделения ДКХ-кислот в указанной элюентной системе представлена на рис. 1, а в табл. 1 приведены параметры уравнений относительного удерживания, в которых в качестве реперного соединения использована 5CQA:
Рис. 1.
Карта разделения ДКХ-кислот в элюентной системе ацетонитрил–0.25 об. % фосфорной кислоты–вода для стационарной фазы Kromasil 110-5-C18 при 30°С. Вещества: 1 – 1,3diCQA; 2 – 1,5diCQA; 3 – 3,4diCQA; 4 – 3,5diCQA; 5 – 4,5diCQA.
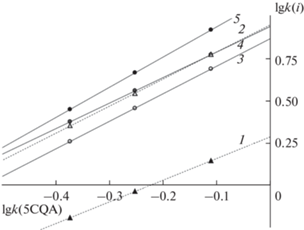
Таблица 1.
Параметры уравнений относительного удерживания изомерных дикофеоилхинных кислот на стационарной фазе Kromasil 110-5-C18 в элюентах органический модификатор–0.25 об. % H3PO4–вода
| Органический модификатор | Аналит | Параметры уравнения (3) | |
|---|---|---|---|
| а1 | а2 | ||
| Ацетонитрил | 1,3-Дикофеоилхинная кислота, 1,3diCQA | 1.281 | 0.301 |
| 1,5-Дикофеоилхинная кислота, 1,5diCQA | 1.601 | 0.963 | |
| 3,4-Дикофеоилхинная кислота, 3,4diCQA | 1.628 | 0.881 | |
| 3,5-Дикофеоилхинная кислота, 3,5diCQA | 1.509 | 0.953 | |
| 4,5-Дикофеоилхинная кислота, 4,5diCQA | 1.786 | 1.130 | |
| Изопропанол | 1,3-Дикофеоилхинная кислота, 1,3diCQA | 1.263 | 0.165 |
| 1,5-Дикофеоилхинная кислота, 1,5diCQA | 1.803 | 0.942 | |
| 3,4-Дикофеоилхинная кислота, 3,4diCQA | 1.746 | 1.768 | |
| 3,5-Дикофеоилхинная кислота, 3,5diCQA | 1.555 | 0.836 | |
| 4,5-Дикофеоилхинная кислота, 4,5diCQA | 2.060 | 1.213 | |
В этом уравнении параметр а1 соответствует соотношению числа молей ацетонитрила, высвобождающегося при сорбции соответствующей дикофеоилхинной кислоты, к аналогичному числу молей при сорбции 5CQA. Действительно, по модели Мураками [17] при сорбции аналита А на стационарной фазе высвобождается n(A) моль органического модификатора М с концентрацией с (моль/л):
Аналогичное выражение может быть записано для вещества B, принятого в качестве вещества сравнения:
Исключая органический модификатор из уравнений (4) и (5), получаем:
Из представленных данных следует, что при сорбции четырех из пяти дикофеоилхинных кислот параметр а1 > 1.5, что может свидетельствовать об одновременном участии обоих радикалов кофейной кислоты при сорбции молекулы дикофеоилхинной кислоты на поверхности обращенной фазы. Это согласуется с ранее высказанным предположением о том, что сорбция на поверхности привитой фазы является основным механизмом удерживания монокофеоилхинных кислот в условиях обращенно-фазовой ВЭЖХ [18]. Сорбционный механизм подтверждается и разделением изомерных ДКХ-кислот, что нехарактерно для распределительного механизма.
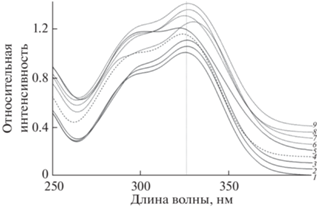
Неожиданно низкое относительное удерживание 1,3diCQA связано с особенностями строения этой кислоты, для которой по крайней мере в одной из конформаций наблюдается внутримолекулярная ассоциация с параллельным выстраиванием ароматических колец двух радикалов кофейной кислоты, приводящая вследствие π-взаимодействий к существенному отличию этого изомера от других по УФ-спектру (рис. 2).
Рис. 2.
УФ-спектры веществ, записанные в кювете детектора. Вещества: 1 – 3CQA; 2 – 4CQA; 3 – 5CQA; 4 – кофейная кислота; 5 – 1,3diCQA; 6 – 1,5diCQA; 7 – 3,4diCQA; 8 – 3,5diCQA; 9 – 4,5diCQA. Растворитель: 20 об. % пропанола-2, 0.25 об. % ортофосфорной кислоты в воде.
Рассматриваемая хроматографическая система удобна для определения ДКХ-кислот в кофе и мате, в которых отсутствуют изомеры, содержащие кофеоильный радикал в положении 1. Однако присутствие изомера 1,5diCQA делает эту систему не очень удобной из-за проблем в разделении 1,5diCQA и 3,5diCQA.
В настоящей работе отнесение ДКХ-кислот выполняли по порядку их удерживания (после подтверждения их состава методами УФ-спектроскопии и масс-спектроскопии) в соответствии с литературными данными (см. выше). При этом такое отнесение подтверждается хроматографическим методом – соотношением параметров а1, согласующимся с параметрами а1 линий трендов для МКХ-кислот, найденных в этой же системе:
При сохранении аддитивности параметр а1 должен возрастать именно в ряду (табл. 1):
В таком случае при составах подвижных фаз, при которых фактор удерживания лежит в диапазоне от 2 до 10, порядок элюирования для соответствующих ДКХ-кислот остается неизменным и соответствует порядку (1). Тем не менее из-за разности наклонов линий трендов при уменьшении концентрации ацетонитрила в “медленных” элюентах произойдет инверсия времен удерживания в одной из пар diCQA:
(9)
${{t}_{{\text{R}}}}\left( {3,5{\text{diCQA}}} \right) < {{t}_{{\text{R}}}}\left( {3,4diCQA} \right) < {{t}_{{\text{R}}}}\left( {{\text{4,5diCQA}}} \right).$И, наоборот, в подвижных фазах с большей элюирующей силой (с большей концентрацией ацетонитрила) возможна другая инверсия:
(10)
$\begin{gathered} {{t}_{{\text{R}}}}\left( {3,4{\text{diCQA}}} \right) < {{t}_{{\text{R}}}}\left( {4,5{\text{diCQA}}} \right) < \\ < \,\,{{t}_{{\text{R}}}}\left( {3,5{\text{diCQA}}} \right). \\ \end{gathered} $Иными словами наклон линий относительного удерживания является более информативным параметром по сравнению с порядком элюирования. При этом даже в указанных выше удобных подвижных фазах порядок элюирования пары 1,5diCQA и 3,5diCQA может изменяться, так как наклон линии тренда для 1,5diCQA больше, чем для 3,5diCQA.
Подвижные фазы системы изопропанол–0.25 об. % H3PO4–вода. В поисках “зеленых” растворителей для отказа от экологически неблагоприятного ацетонитрила заменили его на пропанол-2. Карта разделения, в которой указаны также две линии тренда из предыдущего рисунка, представлена на рис. 3, а параметры линий трендов – в табл. 1.
Рис. 3.
Карта разделения ДКХ-кислот в элюентной системе изопропанол–0.25 об. % фосфорной кислоты–вода для стационарной фазы Kromasil 110-5-C18 при 30°С. Вещества: 1 – 1,3diCQA; 2 – 1,5diCQA; 3 – 3,4diCQA; 4 – 3,5diCQA; 5 – 4,5diCQA. Звездочкой отмечены линии трендов с рис. 1.
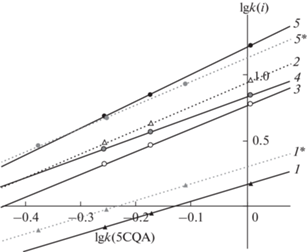
Из полученных данных следует, что диапазон времен удерживания пяти изомерных ДКХ расширен по сравнению с предыдущей элюентной системой, а параметры а1 оказались немногим больше, чем для элюентов на основе ацетонитрила, что также соответствует одновременной сорбции обеими заместителями кофейной кислоты. При этом заметно изменилась и селективность разделения изомерных ДКХ-кислот. Так, существуют диапазоны составов подвижной фазы, в которых полностью разделяются все пять изомеров за время, не превышающее 20 мин, т.е. такая замена ацетонитрила на ИП не только целесообразна с точки зрения экологии, но и улучшает селективность разделения пяти изомеров дикофеоилхинных кислот. Отметим, что 1,4diCQA по имеющимся у нас данным в природных объектах встречается очень редко, а в фундаментальной работе [19] по дифференциации всех шести синтетических ДКХ-кислот по данным масс-спектров высокого порядка хроматографическое поведение изомеров не рассматривали.
Гексилфенильная фаза (Geminy C6Phenyl, С6Ph). Как и в случае фазы С18, для фазы С6Ph вначале исследовали разделение изомеров в элюентах с ацетонитрилом в качестве органического модификатора, а затем ацетонитрил заменили пропанолом-2. Параметры линий трендов для обоих органических модификаторов подвижной фазы представлены в табл. 2.
Таблица 2.
Параметры уравнений относительного удерживания изомерных дикофеоилхинных кислот для стационарной фазы Gemini® 5 мкм С6-Phenyl 110 Å в элюентах органический модификатор–0.25 об. % H3PO4–вода
| Органический модификатор | Аналит | Параметры уравнения (3) | |
|---|---|---|---|
| а1 | а1 | ||
| Ацетонитрил | 1,3-Дикофеоилхинная кислота, 1,3diCQA | 1.119 | 0.358 |
| 1,5-Дикофеоилхинная кислота, 1,5diCQA | 1.242 | 1.029 | |
| 3,4-Дикофеоилхинная кислота, 3,4diCQA | 1.268 | 0.923 | |
| 3,5-Дикофеоилхинная кислота, 3,5diCQA | 1.195 | 1.007 | |
| 4,5-Дикофеоилхинная кислота, 4,5diCQA | 1.371 | 1.175 | |
| Изопропанол | 1,3-Дикофеоилхинная кислота, 1,3diCQA | 1.153 | 0.252 |
| 1,5-Дикофеоилхинная кислота, 1,5diCQA | 1.309 | 0.858 | |
| 3,4-Дикофеоилхинная кислота, 3,4diCQA | 1.334 | 0.839 | |
| 3,5-Дикофеоилхинная кислота, 3,5diCQA | 1.214 | 0.924 | |
| 4,5-Дикофеоилхинная кислота, 4,5diCQA | 1.460 | 1.221 | |
Замена стационарных фаз представляла интерес, поскольку предполагалось, что π-взаимодействия фенильных групп привитой фазы с ароматическими кольцами радикалов коричной кислоты могут изменить селективность разделения изомерных ДКХ-кислот. Экспериментально установлено, что при одинаковой концентрации ацетонитрила в подвижной фазе удерживание изомерных ДКХ-кислот, действительно, несколько увеличивается при переходе от фазы С18 к фазе С6Ph. Однако значения параметров а1 линий трендов при этом заметно меньше, поэтому в “медленных” элюентах и в элюентах, в которых ацетонитрил отсутствует, порядок удерживания обращается. Следовательно, суммарно прочность связи ДКХ-кислот с фазой С6Ph меньше, чем с фазой С18. Однако порядок удерживания 3,4-diCQA, 3,5-diCQA и 4.5-diCQA остается таким же, как и для стационарной фазы С18 при концентрации ацетонитрила в диапазоне 20–25 об. %, а пара изомеров 1,5-diCQA и 3,5-diCQA также остается проблемной для разделения. Все это указывает на отсутствие изменения селективности разделения при рассмотренных условиях.
Замена ацетонитрила как компонента, который может обеспечивать π–π-взаимодействие сорбатов с компонентом подвижной фазы, на алифатический спирт (ИП) должна была бы исключить такие взаимодействия и усилить роль в суммарном удерживании π–π-взаимодействий сорбатов в сорбированном на фенилгексильной фазе состоянии. Однако эта замена привела только к небольшому увеличению параметров а1 (табл. 2), хотя и для всех изомерных ДКХ кислот. Следовательно, дисперсионные взаимодействия остаются главным типом взаимодействий сорбатов со стационарной фазой, определяющих их удерживание, поэтому и порядок элюирования изомерных ДКХ-кислот мало изменился при замене растворителей – только относительное удерживание 1,5diCQA существенно снизилось, создавая новую проблемную пару, но уже с 3,4diCQA.
Таким образом, наилучший вариант хроматографической системы – это традиционная фаза С18 с элюентами на основе ИП. Именно такой вариант использовали в дальнейшем для определения содержания МКХ- и ДКХ-кислот в настоях кофе, мате и артишока (последний напиток разработан во Вьетнаме и в настоящее время импортируется в Россию).
Определение МКХ- и ДКХ-кислот в напитках. Использовали градиентный режим, обеспечивающий хорошее отделения ДКХ-кислот от сопутствующих примесей (флавониодов) и сокращающий время полного анализа образца. Хроматограммы, полученные в таком режиме, представлены на рис. 4, а результаты определения кислот приведены в табл. 3.
Рис. 4.
Хроматограммы разделения кофеоилхинных кислот четырех напитков. Напитки из: А – зеленого кофе, Б – мате, В – экстракта консервированного артишока, Г – экстракта из препарата “Артишока экстракт” (ЗАО “Эвалар”, Россия). Колонка Kromasil 110-5-C18, градиентное элюирование (см. “Экспериментальную часть”). Вещества; 1 – 3CQA; 2 – 4CQA; 3 – 5CQA; 4 – 1,3diCQA; 5 – 3,4diCQA; 6 – 3,5diCQA; 7 – 1,5diCQA; 8 – 4,5diCQA.

Таблица 3.
Результаты определения доли кофеоилхинных кислот и их суммы в образцах настоев (напитков)
| Тип раститель-ного материала | Вид материала | Доля кислот в пересчете на 5CQA (по площадям пиков) | Концент-рация в напитке, мг/мл* | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| МКХ | ДКХ | ƩМКХ | ƩДКХ | |||||||
| 3CQA | 5+4CQA | 3,4diCQA | 3,5diCQA | 1,5diCQA | 4,5diCQA | mCQAc | diCQAs | |||
| Мате | Pipore | 26.3–27.6 | 29.7–32.6 | 5.0–5.6 | 22.9–25.9 | Нет | 12.2–13.3 | 56.0–59.2 | 40.8–43.9 | 0.75–0.87 |
| Pajarito | 23.1–26.8 | 33.6–34.0 | 5.0–7.6 | 23.2–23.5 | Нет | 10.7–12.0 | 57.2–60.8 | 39.2–42.8 | 0.76–0.78 | |
| Кофе | Молотый | 17.6–19.1 | 69.2–73.2 | 1.6–4.1 | 2.5–4.0 | Нет | 3.5–4.3 | 88.3–90.9 | 9.1–11.7 | 0.26–0.31 |
| Растворимый | 16.8–17.0 | 73.2–73.4 | 2.7–2.8 | 3.7–3.8 | Нет | 3.3–3.4 | 90.0–90.1 | 9.9–10.0 | 0.12–0.13 | |
| Зеленый | 18.0–18.7 | 72.1–72.5 | 2.7–2.8 | 2.7–3.9 | Нет | 3.2–3.3 | 90.2–91.2 | 8.8–9.8 | 0.45–0.46 | |
| Артишок | Herbal | 7.5–7.7 | 51.4–51.8 | 4.8–4.9 | 11.2–11.6 | 12.2–12.4 | 12.5–12.6 | 58.8–60.0 | 40.0–41.2 | 0.16–0.18 |
| Actisco | 4.9–5.7 | 45.1–48.6 | 4.0–4.2 | 11.5–12.9 | 21.4–22.7 | 8.7–10.2 | 50.0–54.4 | 45.6–50.0 | 0.16–0.17 | |
| Консервированный | 1.1–2.5 | 13.7–19.7 | 4.0–4.3 | 34.2–41.9 | 27.7–30.0 | 9.3–11.7 | 14.8–22.2 | 77.8–85.2 | 0.12–0.13 | |
Анализ показал, что во всех настоях кофе доля ДКХ-кислот от общего содержания кофеоилхинных кислот составила ~10% (по площадям пиков), а максимальное суммарное содержание кислот приходится на настой зеленого кофе. В случае мате доля ДКХ-кислот существенно больше – превышает 40%, что обеспечивает ценность этого напитка в связи с более высокой биодоступностью именно ДКХ-кислот. В обоих типах напитков основные дикофеоилхинные кислоты представлены набором 3,4diCQA, 3,5diCQA и 4,5diCQA. В напитке из артишока к основным ДКХ-кислотам присоединилась 1,5diCQA, но практически отсутствовал изомер 1,3diCQA, считающийся ценным биологически активным веществом, – единственная ДКХ-кислота, получившая специальное название – цинарин [20].
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 20-33-90031.
Список литературы
Clifford M.N., Jaganath I.B., Ludwig I.A., Crozier A. Chlorogenic acids and the acyl-quinic acids: Discovery, biosynthesis, bioavailability and bioactivity // Nat. Prod. Rep. 2017. V. 34. P. 1391.
Kim H.G., Oh M.S. Natural products as potential anticonvulsants: Caffeoylquinic acids // Arch. Pharm. Res. 2012. V. 35. № 3. P. 389.
Farah A., de Paula Lima J. Consumption of chlorogenic acids through coffee and health implications // Beverages. 2019. V. 5. P. 11.
Monteiro M., Farah A., Perrone D., Trugo L.C., Donangelo C. Chlorogenic acid compounds from coffee are differentially absorbed and metabolized in humans // J. Nutr. 2007. V. 137. P. 2196.
Mateos R., Baeza G., Sarriá B., Bravo L. Improved LC-MSn characterization of hydroxycinnamic acid derivatives and flavonols in different commercial mate (Ilex paraguariensis) brands. Quantification of polyphenols, methylxanthines, and antioxidant activity // Food Chem. 2018. V. 241. P. 232.
Stalmach A., Mullen W., Nagai C., Crozier F. On-line HPLC analysis of the antioxidant activity of phenolic compounds in brewed, paper-filtered coffee // Braz. J. Plant Physiol. 2006. V. 18. P. 253.
Meinhart A.D., da Silveira T.F.F., Silva R.A., Damin F.M., Bruns R.E., Godoy H.T. Multivariate optimization of chlorogenic acid extraction from brazilian coffee // Food Anal. Methods. 2017. V. 10. P. 2943.
Shan Y., Jin X., Cheng Y., Yan W. Simultaneous determination of chlorogenic acids in green coffee bean extracts with effective relative response factors // Int. J. Food Prop. 2017. V. 20. P. 2028.
Schrader K., Kiehne A., Engelhardt U.H., Maier H.G. Determination of chlorogenic acids with lactones in roasted coffee // J. Sci. Food Agric. 1996. V. 71. P. 392.
Ky C.-L., Noirot M., Hamon S. Comparison of five purification methods for chlorogenic acids in green coffee beans (Cofea sp.) // J. Agric. Food Chem. 1997. V. 45. P. 786.
Guerrero G., Suárez M. Chlorogenic acids as a potential criterion in coffee genotype selections // J. Agric. Food Chem. 2001. V. 49. P. 2454.
Craig A.P., Fields C., Liang N., Kitts D., Erickson A. Performance review of a fast HPLC-UV method for the quantification of chlorogenic acids in green coffee bean extracts // Talanta. 2016. V. 154. P. 481.
Murugesu K., Saghir S.A.M., Sadikun A., Khaw K.-Y., Murugainyan V. Exploiting column chemistry for chromatographic separation and quantification of caffeoylquinic acids in Gynura procumbens // Acta Chromatogr. 2021. V. 33. P. 170.
Šeruga M., Tomac I. Electrochemical behaviour of some chlorogenic acids and their characterization in coffee by square-wave voltammetry // Int. J. Electrochem. Sci. 2014. V. 9. P. 6134.
Lippert J.A., Johnson T.M., Lloyd J.B., Smith J.P., Johnson B.T., Furlow J., Proctor A., Marin S.J. Effects of elevated temperature and mobile phase composition on a novel C18 silica column // J. Sep. Sci. 2007. V. 30. P. 1141.
Kaliszan R., van Straten M.A., Markuszewski M., Cramers C. A., Claessens H.A. Molecular mechanism of retention in reversed-phase high-performance liquid chromatography and classification of modern stationary phases by using quantitative structure–retention relationships // J. Chromatogr. A. 1999. V. 855. P. 455.
Murakami F. Retention behavior of benzene derivatives on bonded reversed-phase columns // J. Chromatogr. 1979. V. 178. P. 393.
Дейнека В.И., Олейниц Е.Ю., Блинова И.П., Дейнека Л.А. // Селективность разделения изомерных хлорогеновых кислот в условиях обращенно-фазовой ВЭЖХ // Журн. аналит. химии. 2019. Т. 74. № 8. С. 588.
Clifford M.N., Knight S., Kuhnert N. Discriminating between the six isomers of dicaffeoylquinic acid by LC-MSn // J. Agric. Food Chem. 2005. V. 53. P. 3821.
Lattancio V., Kroon P.A., Linsalata V., Cardiali A. Globe artichoke: A functional food and source of nutraceutical ingredients // J. Funct. Foods. 2009. V. 1. P. 131.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии