Журнал аналитической химии, 2022, T. 77, № 7, стр. 585-615
Летучие органические соединения в выдыхаемом воздухе как биомаркеры рака легких. Достижения и возможные проблемы
Э. М. Гашимова a, *, А. З. Темердашев a, В. А. Порханов b, И. С. Поляков b, Д. В. Перунов b
a Кубанский государственный университет
350040 Краснодар, ул. Ставропольская, 149, Россия
b Научно-исследовательский институт – Краевая клиническая больница № 1 им. С.В. Очаповского
350086 Краснодар, ул. 1 Мая, 167, Россия
* E-mail: elina.gashimova@yandex.ru
Поступила в редакцию 27.12.2021
После доработки 21.01.2022
Принята к публикации 24.01.2022
- EDN: WKWEGA
- DOI: 10.31857/S0044450222070052
Аннотация
Представлен обзор основных результатов, достигнутых различными исследовательскими группами в ходе работ по выявлению биомаркеров рака легких среди летучих органических соединений (ЛОС) в выдыхаемом воздухе. Рассмотрены известные способы определения ЛОС в выдыхаемом воздухе, способы отбора и хранения образцов, концентрирования ЛОС, статистической обработки полученных данных, оценены их преимущества и недостатки. Обобщен перечень основных биомаркеров рака легких. Обсуждены основные проблемы, препятствующие внедрению анализа выдыхаемого воздуха в клиническую практику.
Среди приоритетных направлений развития современной медицины разработка эффективных, экспрессных и неинвазивных способов диагностики социально-значимых заболеваний является особенно актуальной. Одним из наиболее труднодиагностируемых, но в то же время быстро и бессимптомно развивающихся агрессивных заболеваний с наибольшим количеством летальных исходов является рак легких [1, 2], эффективность диагностики которого остается низкой, так как симптомы данного заболевания зачастую трудно опознать и легко спутать с признаками старения или курения. В современной клинической практике основными способами диагностики рака легких являются биопсия [3, 4] и компьютерная томография (КТ) [5]. При исследовании методом КТ возможно обнаружить образование в легких, однако для определения характера образования и, в случае обнаружении злокачественного образования, надежной диагностики гистологического типа опухоли и TNM (опухоль, узел, метастазы) стадии необходима биопсия, инвазивная и длительная процедура, сопряженная со стрессом и в некоторых случаях с необходимостью госпитализации пациента. В связи с этим разработка альтернативных способов диагностики рака легких по специфическим биомаркерам в различных биологических объектах активно развивается в последние годы. Особенно интересным представляются объекты, предполагающие неинвазивный отбор проб, такие как выдыхаемый воздух, конденсат выдыхаемого воздуха, моча [6–10]. В первую очередь, это обусловлено простотой процедуры отбора проб, не сопряженной с дискомфортом для пациента, что впоследствии позволит существенно повысить диагностический охват процедуры при успешном прохождении этапа научно-исследовательских работ. Выдыхаемый воздух является одним из наиболее распространенных объектов исследования для идентификации биомаркеров рака легких [11–13].
Профиль летучих органических соединений (ЛОС), содержащихся в выдыхаемом воздухе здорового человека, содержит более 1000 компонентов как эндогенного, так и экзогенного происхождения [14]. На сегодняшний день биохимические процессы, продуктом которых являются ЛОС, выделяющиеся через дыхательные пути, известны лишь для некоторых обнаруживаемых в выдыхаемом воздухе компонентов. Например, ацетон образуется при декарбоксилировании фермента ацетил-КоА, а изопрен является одним из побочных продуктов при синтезе холестерина в цитозольной фракции. Присутствие предельных углеводородов в выдыхаемом воздухе обусловлено пероксидным окислением полиненасыщенных жирных кислот в результате воздействия свободных радикалов, которые могут в дальнейшем окисляться до спиртов, альдегидов и кетонов [15, 16].
Нарушения пролиферации и апоптоза клеток при злокачественных образованиях легких могут существенно искажать профиль ЛОС, содержащихся в выдыхаемом воздухе [17]. Обнаружение изменений в количественном и качественном составе выдыхаемого воздуха, характерных для рака легких, является основой создания неинвазивного, экспрессного и простого способа диагностики, который позволит проводить массовые обследования в комфортном для пациентов режиме.
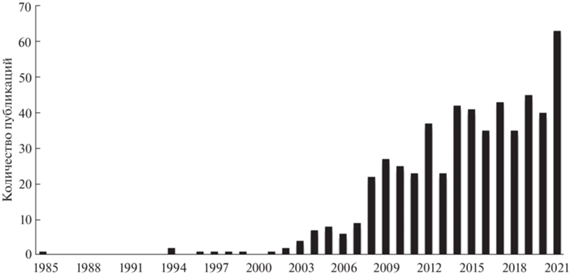
Исследования по выявлению специфичных для рака легких биомаркеров в выдыхаемом воздухе начали проводить еще в конце прошлого столетия [18, 19]. Количество опубликованных статей, посвященных анализу выдыхаемого воздуха для диагностики рака легких (рис. 1), ежегодно растет, начиная с 2000 года. Интерес научного сообщества к данному направлению обусловлен активным развитием как приборостроения, так и совершенствованием способов подготовки и концентрирования проб, а также разработкой новых сорбционных материалов.
Рис. 1.
Динамика публикационной активности в области анализа выдыхаемого воздуха для диагностики рака легких в базе данных Elsevier Scopus по ключевым словам “рак легких, выдыхаемый воздух”.
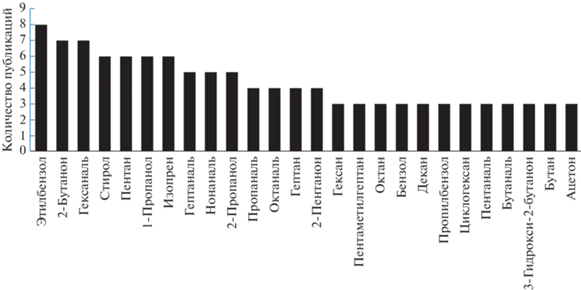
Несмотря на то, что целый ряд научных групп активно работает в данном направлении, диагностика рака легких на основе анализа выдыхаемого воздуха по-прежнему находится на уровне исследований и не используются в клинической практике. На сегодняшний день еще не выявлен исчерпывающий перечень биомаркеров, по которым можно было бы судить о статусе заболевания. Однако данные по идентификации биомаркеров в выдыхаемом воздухе, рассмотренные в данном обзоре, позволяют выделить ряд ЛОС, которые относят к перечню биомаркеров наиболее часто (в трех и более исследованиях). Это − производные бензола, спирты, альдегиды, кетоны и некоторые другие (рис. 2).
Рис. 2.
Летучие органические соединения, наиболее часто отмеченные исследователями как потенциальные биомаркеры.
Далеко не во всех публикациях отображена информация о содержании предполагаемых биомаркеров в выдыхаемом воздухе. В табл. 1 представлены концентрации некоторых предполагаемых биомаркеров в пробах пациентов с раком легких и здоровых людей. Концентрации компонентов весьма низкие (на уровне ppb и ниже), что требует применения аналитических методов, способных одновременно определять широкий круг ЛОС в данных диапазонах концентраций.
Таблица 1.
Содержание некоторых потенциальных биомаркеров в выдыхаемом воздухе пациентов с раком легких и здоровых людей
| Биомаркер | Диапазон концентраций, медиана, ppb (если не указано другое) | Литература | |
|---|---|---|---|
| здоровые добровольцы | пациенты с раком легких | ||
| Этилбензол | 3–16, 3 | 3–9, 4 | [20] |
| 8.6–14.0, 10.4 | 4.6–89.3, 19.6 | [21] | |
| 10.8– 15.1, 13.6 pM | 13.6–32.6, 24.0 pM | [22] | |
| 1.45–3.16, – | 2.22–18.38, – | [23] | |
| 2-Бутанон | 5–50, 7 | 7–14, 9 | [20] |
| 1.35–3.18, – | 1.35–2.86, – | [23] | |
| 3.8–8.8, 5.1 | 3.8–38.8, 8.8 | [21] | |
| Гексаналь | 2–8, 3 | 2–14, 4 | [20] |
| 0 | 3.8–5.3, 4.5 | [21] | |
| 0 nmol/L | 0.010 nmol/L | [24] | |
| 7.0–13.8, 10.3 pM | 26.6–57.7, 38.1 pM | [25] | |
| Стирол | 5.3–21.8, 12.3 pM | 8.5–37.2, 17.9 pM | [22] |
| Пентан | 3–664, 111 | 3–223, 11 | [20] |
| 6.8–14.3, – | 0.7–17.5, – | [26] | |
| 7.0–412.4, 104.8 | 3.7–116.7, 39.8 | [21] | |
| 107.7–462.7, 268.0 pM | 361.3–1112.5, 647.5 pM | [22] | |
| 6.84–94.36, – | 0.73–17.50, – | [23] | |
| 1-Пропанол | 29–116, 61 | 29–424, 99 | [20] |
| 0 | 4.37–13.15, – | [26] | |
| 6.6, 6.6 | 5.4–473.3, 54.8 | [21] | |
| 0 | 4.37–93.15, – | [23] | |
| Изопрен | 27–812, 190 | 66–870, 280 | [20] |
| 19.5–200.5, 70.8 | 19.2–295.5, 100.3 | [21] | |
| 1399–6589, 3789 pM | 3130–8863, 6041 pM | [22] | |
| 1.30–498.01, – | [27] | ||
| 37–234, – | [28] | ||
| Гептаналь | –, 0.003 nmol/L | –, 0.011 nmol/L | [24] |
| 3.8–10.1, 6.9 pM | 9.3–21.3, 16.1 pM | [25] | |
| Нонаналь | –, 0.033 nmol/L | –, 0.239 nmol/L | [24] |
| 7.2–22.7, 13.3 pM | 31.6–62.5, 48.2 pM | [25] | |
| 2-Пропанол | 19–725, 169 | 20–1007, 498 | [20] |
| 3.21–4.17, – | 3.32–7.19, – | [26] | |
| 13.3, 13.3 | 8.7–989.2, 149.5 | [21] | |
| 3.21–14.17, – | 3.32–19.19, – | [23] | |
| Пропаналь | 1–12, 5 | 1–82, 19 | [20] |
| 1.56–3.44, – | 1.56–3.74, – | [26] | |
| 5.6–9, 6.9 | 5.5–33.8 7.8 | [21] | |
| 0 nmol/L | –, 0.009 nmol/L | [24] | |
| 42.4–72.6, 52.4 pM | 17.1–46.9, 24.4 pM | [25] | |
| 0.56–3.44, – | 0.66–3.74, – | [23] | |
| Октаналь | 0.011 nmol/L | 0.052 nmol/L | [24] |
| 7.2–16.2, 11.6 pM | 17.7–33.2, 23.6 pM | [25] | |
| Гептан | 3–9, 5 | 2–4, 3 | [20] |
| 3.6–13.5, 5.2 | 3.1–4.3, 3.4 | [21] | |
| 5.0 –15.3, 8.4 | 1.5 – 34.0, 13.5 | [22] | |
| 2-Пентанон | 5–10, 6 | 5–39, 9 | [20] |
| 1.80–4.11 | 3.25–8.77 | [26] | |
| 4.6–5.1, 4.8 | 4.4–53.2, 7.5 | [21] | |
| Гексан | 3–145, 18 | 3–16, 10 | [20] |
| 1.75–6.31, – | 1.44–1.88, – | [26] | |
| 4.8–46.3, 20.3 | 2.5–76.1, 33.6 | [21] | |
| 1.75–6.31, – | 0.82–1.88, – | [23] | |
| Октан | 4.0–50.8, 20.2 pM | 22.4–112.9, 61.0 pM | [22] |
| Бензол | 3–23, 7 | 3–10, 5 | [20] |
| 1.38–14.97, – | 1.29–3.82, – | [26] | |
| 4.3–12.2, 6.3 | 4.3–10.5, 5.4 | [21] | |
| 27.7–68.6, 44.7 pM | 62.2–132.2, 94.5 pM | [22] | |
| 1.15–14.97, – | 0.88–3.82, – | [23] | |
| Декан | 4–72, 11 | 3–35, 9 | [20] |
| 14.3–405.5, 208.7 pM | 277.9–1321.6, 568.0 pM | [22] | |
| Циклогексан | 1–96, 20 | 3,1, 3,1 | [20] |
| Пентаналь | 5–11, 7 | 4–7, 5 | [20] |
| 0 | 4.8–7.2, 5.9 | [21] | |
| 4.4–14.7, 8.2 pM | 12.7–42.6, 17.7 pM | [25] | |
| 0.002 nmol/L | 0.019 nmol/L | [24] | |
| Бутаналь | 1.35–1.87, – | 1.32–2.55, – | [26] |
| 6.9–18.6), 10.8 pM | 18.7–41.0, 26.2 pM | [25] | |
| 0.52–1.87, – | 0.78–2.55, – | [23] | |
| 3-Гидрокси-2-бутанон | Менее 6.21 ng/L, 1.29 ng/L | 1.95–50.30 ng/L, 8.28 ng/L | [29] |
| Бутан | 5.2–165.7, 56.2 | 6.1–421.3, 90.3 | [20] |
| 0.46–16.63, – | 0.58–2.71, – | [23] | |
| Ацетон | 135–3167, 580 | 83–7769, 1000 | [20] |
| 41.6–753.4, 225.7 | 112.3–2653.7, 358.6 | [21] | |
| 44.20–531.45 , – | 34.57–390.60, – | [26] | |
| 14.44–531.45, – | 34.57–390.60, – | [23] | |
| 48.20–1159.13, – | [27] | ||
| 60–689.4, – | [28] | ||
В данном обзоре рассмотрены все этапы анализа выдыхаемого воздуха, включая отбор проб, концентрирование и определение ЛОС с применением различных аналитических методов. Кроме этого, систематизированы и обобщены основные результаты, достигнутые различными исследовательскими группами, касающиеся разработки способа диагностики рака легких по выдыхаемому воздуху, и обсуждены возможные проблемы, препятствующие внедрению подобных технологий в клиническую практику.
АНАЛИЗ ВЫДЫХАЕМОГО ВОЗДУХА
На сегодняшний день не установлено единого способа анализа проб выдыхаемого воздуха для целей диагностики рака легких. Профиль ЛОС образца можно анализировать различными аналитическими методами, некоторые из них предполагают стадии отбора проб и концентрирования ЛОС пробы, которые также можно проводить по-разному. В данном разделе описаны особенности, достоинства и недостатки различных вариантов процедур отбора проб, концентрирования ЛОС из пробы и методов анализа проб выдыхаемого воздуха.
Отбор проб выдыхаемого воздуха. С точки зрения отбора проб выдыхаемый воздух можно условно разделить на две группы, отличные по количественному и качественному составу: воздух мертвого пространства и альвеолярный воздух. Альвеолярный воздух содержит преимущественно эндогенные компоненты, попадающие в легочные альвеолы в результате газообмена с кровью [30, 31], а воздух мертвого пространства – это воздух, заполняющий дыхательные пути и не участвующий в газообмене с кровью, вследствие чего в его состав входит много экзогенных компонентов. На сегодняшний день единый подход к отбору проб выдыхаемого воздуха отсутствует, поэтому можно наблюдать значительную вариативность способов отбора проб в различных исследованиях, что может отражаться на результатах.
Проба может содержать компоненты, отобранные за один или несколько выдохов. Зачастую при отборе проб за один выдох участнику исследования необходимо сделать маневр форсированной жизненной емкости легких (глубокий вдох и выдох), что обеспечивает получение наиболее информативных результатов [32], однако выполнение маневра при патологии может вызвать затруднения вплоть до болевых ощущений и невозможности полноценно осуществить процедуру. Это обстоятельство может вносить существенную погрешность в результаты исследований. Более надежные и воспроизводимые результаты получаются при отборе усредненной пробы, полученной за несколько выдохов [33].
Использование химически инертных пакетов из таких материалов как тедлар или майлар для отбора проб (рис. 3а) – наиболее простой и распространенный способ отбора проб выдыхаемого воздуха, однако применение пакетов для отбора проб имеет ряд недостатков. В большинстве исследований пробы, отобранные в пробоотборные пакеты, хранят не более 6–8 ч. В работе [34] отмечается, что потери пробы при ее хранении в пакете тедлар в течение 52 ч не превышают 10%, в исследовании [35] показано, что в течение 20 ч пробы остаются стабильными при хранении в пакете как из майлара, так и из тедлара. Другим немаловажным фактором, который необходимо учитывать при хранении образца в пакете тедлар, является неустойчивость мембраны для твердофазной микроэкстракции (ТФМЭ) к внешним загрязнителям, за счет чего возможна контаминация пробы компонентами окружающего воздуха при длительном хранении [36]. Источниками загрязнения пробы фенолом при хранении являются и сами пробоотборные пакеты, а при использовании пакета из тедлара пробы дополнительно загрязняются N,N-диметилацетамидом [34, 35]. Стоит отметить, что степень контаминации тедларовых пакетов варьируется в зависимости от производителя [37]. Данные факторы необходимо принимать во внимание во избежание ложной интерпретации результатов. Следует учитывать, что при отборе выдыхаемого воздуха в пробоотборный пакет в пробу попадает воздух мертвого пространства, что сопряжено с наличием в пробе экзогенных компонентов, которые могут быть ошибочно интерпретированы как биомаркеры.
Рис. 3.
Варианты отбора проб: (а) – пробоотборный пакет; (б) – система из двух пакетов, соединенных трехклапанным краном; (в) – пробоотборник BioVOC; (г) – система из пластиковой трубки и шприца, подсоединенной к капнографу

Для получения более информативной картины относительно эндогенных компонентов, входящих в состав выдыхаемого воздуха, применяют пробоотборники, позволяющие снижать долю воздуха мертвого пространства в пробе путем отброса фиксированного количества пробы в начале выдоха. Отброс неинформативной части пробы может осуществляться за счет использования системы из двух пакетов, соединенных трехклапанным краном (рис. 3б), [38, 39] либо путем применения расходомера с клапаном, который открывается после пропускания фиксированного количества пробы [40]. Подобный принцип работы лежит в основе коммерчески доступного и широко используемого пробоотборника BioVOC (рис. 3в) [22, 25, 41–43], позволяющего отбросить всю пробу, кроме последних 150 мл. Применение подобных устройств для отбора проб позволяет снизить количество экзогенных компонентов в образце, однако доля альвеолярного воздуха в пробе может быть различной у разных людей в зависимости от объема легких, что может вносить дополнительную погрешность в результаты.
Наиболее надежным способом получения пробы альвеолярного воздуха является использование пробоотборников, в которых разделение выдыхаемого и альвеолярного воздуха основано на отличии концентрации углекислого газа в альвеолярном и выдыхаемом воздухе, которую определяют с помощью капнографа. Существуют различные виды подобных пробоотборников: от самых простых, собранных вручную (рис. 3г), которые состоят из пластиковой трубки, подсоединенной к капнографу [24, 30], до коммерчески реализуемых более усовершенствованных приборов, позволяющих в автоматическом режиме направлять поток альвеолярного воздуха в пробоотборный пакет [21, 24, 44, 45] либо в сорбционную трубку [46]. Концентрации эндогенных соединений значительно выше в пробах альвеолярного воздуха, поэтому данный подход является наиболее предпочтительным для применения в клинических исследованиях, однако необходимость использования дополнительного оборудования может ограничить мобильность отбора проб и отразиться на пропускной способности при проведении массовых обследований.
Стоит отметить, что при хранении пробы при комнатной температуре возможна конденсация водяного пара в пакете для отбора проб и во всех соединяющих линиях пробоотборников, что влечет за собой частичную абсорбцию полярных компонентов пробы и возможные искажения результатов анализа. Для предотвращения конденсации водяного пара в некоторых пробоотборниках предусмотрен нагрев соединяющих линий и пакетов до 37−40°С [47, 48], однако в работе [29] отмечается, что при температуре более 30°С ацетоин, в некоторых публикациях отмеченный как биомаркер рака легких, окисляется до диацетила. В связи с этим при использовании проботборников, предусматривающих нагрев пробы, отнесение данных компонентов к биомаркерам может привести к ошибочным выводам.
Концентрирование летучих органических соединений пробы. Поскольку концентрации многих ЛОС в выдыхаемом воздухе малы, применение ряда аналитических методов требует стадии предварительного многократного концентрирования, которое, как правило, осуществляется с использованием сорбционных трубок или волокон для ТФМЭ. Основные характеристики данных способов концентрирования представлены в табл. 2.
Таблица 2.
Аналитические характеристики способов концентрирования в сорбционных трубках и на волокне для твердофазной микроэкстракции
| Сорбционные трубки | ТФМЭ | ||||
|---|---|---|---|---|---|
| сорбент; Tmax, °C | удерживаемые ЛОС | литература | НЖФ*; Tmax, °C | удерживаемые ЛОС | литература |
| Tenax TA 60/80 mesh (поли(2,6-дифенил-p-фениленоксид); 350 | Ароматические неполярные ЛОС (с температурой кипения более 100°С) и менее летучие полярные ЛОС (с температурой кипения более 150°С) | [18, 41, 47, 49] | PDMS (полидиметилсилоксан); 300 | Низкомолекулярные неполярные ЛОС | [47, 50] |
| Carbopack B 60/80 mesh (графитированный уголь); 400 | Алкилбензолы и алифатические ЛОС (С8 до С16) | [51–53] | CAR/PDMS (карбоксен/ полидиметилсилоксан); 320 | Следовые количества летучих органических соединений | [23, 26, 29, 54] |
| Carbotrap 20/40 mesh (графитированный уголь); 400 | Кетоны, спирты, альдегиды, все неполярные соединения (с температурой кипения более 75°), перфторуглеродные газы | [19, 48] | CAR/PDMS/DVB (карбоксен/ полидиметилсилоксан/дивинилбензол); 270 | Следовые количества ЛОС в диапазоне С3−С20 | [41, 55, 56] |
| Carbosieve SIII 60/80 mesh (углеродное молекулярное сито); 400 | Сверхлетучие соединения (углеводороды С3, С4, летучие галогенсодержащие соединения и фреоны) | [19, 50] | DVB/PDMS (дивинилбензол/полидиметилсилоксан); 270 | Полярные соединения, летучие органические амины и нитроароматические соединения, спирты | [57] |
Выдыхаемый воздух содержит широкий спектр ЛОС разных классов, что обусловливает применение комбинированных сорбционных материалов. В случае сорбционных трубок довольно часто используют сочетание тенакса и углеродных молекулярных сит [50, 58], сорбентов на основе графитированного углерода [36, 43, 48], а также полимерный сорбент тенакс [41, 47, 49]. При концентрировании с применением ТФМЭ в основном применяют биполярную фазу карбоксен/полидиметилсилоксан [20, 28, 29, 54], позволяющую концентрировать широкий спектр ЛОС в следовых количествах, также нередко используют полидиметилсилоксан [47, 50].
Метод концентрирования ЛОС из выдыхаемого воздуха в сорбционных трубках позволяет извлекать все ЛОС из пробы и является относительно простыми в реализации, однако к недостаткам можно отнести необходимость приобретения дополнительного оборудования. Преимуществами ТФМЭ являются простота и отсутствие необходимости применения дополнительного оборудования, однако при длительном экспонировании волокна в пробе его емкости может оказаться недостаточно, вследствие чего может возникнуть значительная дискриминация пробы. Другим недостатком является сложность практического применения, обусловленная хрупкостью волокна.
Для концентрирования некоторых компонентов выдыхаемого воздуха, таких как альдегиды и кетоны, содержание которых выдыхаемом воздухе может быть ниже пределов обнаружения, целесообразно применять дериватизацию. Один из способов − дериватизация альдегидов на волокне для ТФМЭ с пентафторбензол гидрогсиламин гидрохлоридом в качестве дериватизирующего агента [59], который неоднократно применяли для определения альдегидов в выдыхаемом воздухе пациентов с раком легких и здоровых людей [24, 25].
Описан [60] другой способ дериватизации альдегидов и кетонов в выдыхаемом воздухе с применением микрореактора, представляющего собой кремниевую пластинку, покрытую слоем аминоокси-функционализированной соли четвертичного аммония, которая селективно взаимодействует с альдегидами и кетонами с образованием оксимового эфира, впоследствии определяемого на масс-спектрометре с преобразованием Фурье. Этот способ впоследствии применен для идентификации биомаркеров рака легких в выдыхаемом воздухе в США [61].
Разрабатываются альтернативные сорбционные материалы для концентрирования ЛОС из выдыхаемого воздуха [62], а также применяются нетрадиционные способы концентрирования, например концентрирование компонентов пробы из выдыхаемого воздуха в ацетон [51].
Детектирование летучих органических соединений. Газовая хроматография. Методы газовой хроматографии широко применяют для исследования профиля ЛОС в выдыхаемом воздухе, так как они позволяют определять большое количество соединений в достаточно низком концентрационном диапазоне (от ppb до ppt) [63]. Ввиду вариативности состава проб в достаточно широких пределах разделить все ЛОС, используя одну газохроматографическую колонку, практически невозможно, поэтому в некоторых работах для разделения применяют различные типы газохроматографических колонок: диметилполисилоксан [22, 40, 43], фенил-диметилполисилоксан [41, 49, 55, 57, 64] цианопропилфенил-метилполисилоксан [54, 65], полиэтиленгликоль [18], колонки с пористым слоем на стенках (PLOT) [21, 26, 28, 66] либо для разделения наиболее широкого круга ЛОС используют системы из двух последовательно соединенных колонок [36]. Наиболее распространенным методом анализа выдыхаемого воздуха является газовая хромато-масс-спектрометрия (ГХ-МС), поскольку данный метод позволяет одновременного идентифицировать большое число соединений и получать наиболее полную информацию о качественном и количественном составе пробы с достаточно высокой чувствительностью. Однако метод ГХ-МС не лишен недостатков, существенно осложняющих внедрение подобных методик анализа в клиническую практику. Чувствительности данного метода недостаточно для прямого анализа образцов, что требует предварительного многократного концентрирования аналитов. Метод ГХ-МС не позволяет анализировать пробы в режиме онлайн; процедура анализа, включающая отбор проб, концентрирование и анализ, зачастую весьма длительна, а сложность как самого оборудования, так и интерпретации результатов требует высокой квалификации персонала, тем не менее, учитывая возможность автоматизации ГХ-МС-анализа и возможности хранения проб в отобранном или концентрированном виде, данный подход вполне пригоден для массовых обследований. Для проведения рутинных работ возможно использование более простого в эксплуатации и при интерпретации результатов пламенно-ионизационного детектора [35, 51], однако данный подход применим только при наличии списка необходимых биомаркеров, для определения которых чувствительность данного прибора будет достаточной.
Масс-спектрометрия. В методе спектрометрии ионной подвижности с детектированием ионов в масс-спектрометре (СИП МС) молекулы образца сначала ионизируются, затем их разделение осуществляется за счет различной подвижности в потоке нейтрального газа, которая зависит как от состава дрейфующего газа, так и от электрического поля. С использованием метода СИП МС можно определять ЛОС в концентрациях в диапазоне от ppbv до pptv, вследствие чего анализ выдыхаемого воздуха данным методом не требует предварительного концентрирования. В исследованиях, посвященных анализу выдыхаемого воздуха, зачастую применяют сочетание метода СИП МС с мультикапиллярной колонкой (МКК) для получения более информативных результатов. Несмотря на отсутствие необходимости концентрирования и достаточно высокую экспрессность анализа, которая зачастую составляет менее 8 мин, метод СИП МС не относится к методам онлайн анализа. К недостаткам относится низкая селективность, не позволяющая идентифицировать ЛОС [67].
Метод масс-спектрометрии с реакцией переноса протона (МС РПП) основан на протонировании аналита ионами Н3О+, предварительно сформированными в парах воды в разряде низкого давления с применением полого катода [68]. Метод масс-спектрометрии выбранных ионов в потоке (МС ВИП) основан на химической ионизации аналитов ионами-реактантами H3O+, ${\text{O}}_{2}^{ + }$, или NO+, предварительно выделенными из смеси компонентов, возбуждаемых в радиочастотном разряде с помощью квадрупольного масс-фильтра [69]. Принципы работы МС РПП и МС ВИП схожи и отличаются только предварительным выделением ионов-реактантов.
К достоинствам методов можно отнести высокую чувствительность и специфичность, а также высокую производительность за счет проведения анализа в онлайн режиме без стадии предварительного концентрировании. Однако данные методы пригодны для анализа ограниченного круга соединений, для которых сродство к протону больше, чем в молекуле иона-реактанта. К недостаткам также относится невозможность различить летучие вещества с одинаковым отношением массы к заряду, что сказывается на качестве идентификации. Кроме того, влажность образца существенно влияет на чувствительность.
Сенсорные системы типа “электронный нос”. В последние годы интенсивно развивается альтернативный подход к решению задачи диагностики онкологии легких на основе анализа выдыхаемого воздуха, основанный на применении сенсорных систем типа “электронный нос” [70–72]. Чувствительные элементы матриц химических сенсоров абсорбируют ЛОС или связываются с ними, что приводит к изменению свойств чувствительных элементов, которое можно измерить. Контролируемые свойства зависят от типа используемого датчика; это может быть, например, изменение проводимости, массы, вибрации или цвета чувствительного элемента. Датчики, как правило, перекрестно реагируют на множество ЛОС одновременно, в результате чего можно получить некий общий отклик на профиль ЛОС в выдыхаемом воздухе. Чувствительность сенсорных систем изменяется в зависимости от применяемых сенсорных технологий: некоторые датчики способны анализировать выдыхаемый воздух без предварительного концентрирования.
Анализ выдыхаемого воздуха для диагностики рака легких проводят с применением различных типов химических сенсоров. Широкое распространение получили полупроводниковые сенсоры на основе оксидов металлов. Принцип действия таких сенсоров основан на реакции ЛОС с адсорбированным поверхностным кислородом, в результате чего изменяется преобразовательная способность полупроводников, что является аналитическим сигналом. Датчики такого типа легли в основу коммерчески реализуемого прибора Aeonose [73, 74], одним из направлений применения которого является диагностика рака легких, однако не менее интересной представляется разработка новых уникальных сенсорных систем [75, 76].
Привлекают внимание также хеморезистивные сенсорные системы на базе различных типов наноматериалов, как правило, сферических наночастиц металлов либо одностенных углеродных нанотрубок, покрытых различными органически функционализированными группами [55, 77]. Механизм работы таких сенсорных систем основан на реакции аналитов с органически функционализированными группами, что приводит к изменению связей между проводящими наноматериалами и, как следствие, к изменению проводимости.
В литературе представлены результаты работ различных исследовательских групп, посвященных диагностике рака легких с использованием коммерческого газоанализатора Cyranose 320, состоящего из 32 сенсоров на основе проводящих полимеров [78–80]. Аналитическим сигналом является изменение сопротивления в результате абсорбции ЛОС на поверхности сенсора, которую покрывают сорбционными материалами, селективными к различным ЛОС.
Отличия в профиле ЛОС в выдыхаемом воздухе пациентов с раком легких и здоровых людей можно фиксировать с применением сенсорных систем типа “электронный нос” на основе пьезосенсоров, модифицированных различными типами сорбционных материалов, как правило, металлопорфиринов [39, 81, 82]. При взаимодействии с пробой ЛОС адсорбируются на поверхности покрытия, изменяя частоту колебания пьезокварцевого резонатора, что является аналитическим сигналом.
Интересной альтернативой к перечисленным выше сенсорным системам является колориметрический “электронный нос” на основе химически чувствительных сенсоров, меняющих цвет при взаимодействии с ЛОС [83, 84]. Ввиду большого числа химических индикаторов такие сенсорные системы способны реагировать на довольно широкий круг ЛОС в выдыхаемом воздухе. Результат может быть оценен как визуально, так и с применением спектрометра.
Преимущества и недостатки наиболее распространенных типов сенсорных систем представлены в табл. 3.
Таблица 3.
Преимущества и недостатки сенсорных систем, применяемых для анализа выдыхаемого воздуха
| Сенсорная система | Преимущества | Недостатки |
|---|---|---|
| Полупроводниковые сенсоры на основе оксидов металлов | Высокая чувствительность и селективность; возможность проведения анализа в режиме реального времени без предварительного концентрирования и хранения образцов | Необходимо контролировать температуру и влажность образца |
| Хеморезистивные сенсоры на базе различных типов наноматериалов | Чувствительность; высокая скорость отклика и восстановления обеспечивают экспрессность анализа, однако на результат в большинстве случаев влияет влажность образца | Необходимо контролировать влажность образца |
| Проводящие полимеры | Высокая скорость отклика и восстановления, анализ проб при комнатной температуре, широкий спектр сорбционных материалов | Необходимо контролировать температуру и влажность образца |
| Пьезокварцкевые микровесы | Высокая чувствительность, возможность проведения анализа в режиме реального времени без предварительного концентрирования и хранения образцов, широкий спектр сорбционных материалов | Необходимо контролировать влажность, температуру, давление, вибрации и наличие агрессивных сред |
| Колориметрические сенсоры | Простота эксплуатации, менее подвержены влиянию влажности и температуры | Нечувствительны к углеводородам, низкая чувствительность, сложно подобрать детектирующие элементы и фазы |
Выдыхаемый воздух содержит множество компонентов различной природы, ввиду чего некоторые исследователи применяют комбинированные сенсорные системы, сочетающие в себе различные типы датчиков [85, 86]. Сочетания различных типов сенсоров в одном устройстве может обеспечить большую информативность анализа, однако необходимо учитывать особенности работы каждого из типов сенсоров.
Использование сенсорных систем в качестве инструмента обнаружения рака легких в выдыхаемом воздухе − весьма перспективный подход ввиду высокой производительности, в некоторых случаях отсутствия необходимости подготовки проб, простоты в использовании и невысоких требований к квалификации персонала. Однако сенсорные системы в большинстве случаев перекрестно реагируют на множество ЛОС пробы, что существенно затрудняет идентификацию и может привести к ошибочной интерпретации данных.
Результаты исследований по идентификации биомаркеров рака легких. Газовая хромато-масс-спектрометрия. Наибольшее количество исследований по идентификации биомаркеров рака легких в выдыхаемом воздухе выполнено с применением метода ГХ-МС.
Одна из основных исследовательских групп, работающих в данном направлении, − группа ученых из США под руководством М. Филлипса. Для анализа проб выдыхаемого воздуха применяли ГХ-МС с предварительным концентрированием аналитов в сорбционной трубке. Публикационная активность данной исследовательской группы наблюдалась с 1997 по 2015 гг. [19, 48, 54, 64, 84]. За этот период было разработано специальное устройство для отбора проб альвеолярного воздуха, оптимизированы параметры отбора и концентрирования проб [46], после чего оптимизированные условия применили для анализа двух достаточно больших групп больных и здоровых людей. Для обработки полученных данных применяли различные методы статистической обработки, в том числе был создан новый метод статистической обработки (взвешенный цифровой анализ) [64]. В последней работе группы, посвященной анализу выдыхаемого воздуха для диагностики рака легких, выполнены слепое тестирование и оценка эффективности применения разработанного подхода в качестве дополнения к КТ органов грудной клетки [48]. Нетрудно заметить, что от статьи к статье значительно варьируются как параметры, рассматриваемые в качестве биомаркеров (соединения или ионы, находящиеся во временном интервале хроматограммы), так и перечень рассматриваемых биомаркеров (табл. 4). Также наблюдается снижение производительности диагностических моделей по мере развития работы, т.е. по мере увеличения числа участников исследования, которая на последнем этапе составила 68–70%.
Таблица 4.
Результаты анализа выдыхаемого воздуха методом газовой хромато-масс-спектрометрии различными исследовательскими группами в целях идентификации биомаркеров рака легких
| Биомаркер | Метод | Количество участников исследования (возраст) | Статистическая обработка данных (производительность, %) | Литература | |
|---|---|---|---|---|---|
| РЛ | здоровые (другие патологии) | ||||
| О-толуидин; анилин | ТД (Tenax) ГХ-МС (CP Wax-57 CB) | 14 (59 –70) | 17 (25 –70) | Тест Манна–Уитни | [18] |
| Стирол; 2-метилгептан; 2,2,4,6,6-пентаметилгептан; декан; пропилбензол; ундекан; метилциклопентан; 1-метил-2-пентилциклопентан; трихлорфторметан; бензол; 1,2,4-триметилбензол; изопрен; 3-метилоктан; 1-гексен; 3-метилнонан; 1-гептен; 1,4-диметилбензол; 2,4-диметилгептан; гексаналь; циклогексан; 1-метилэтенилбензол; гептаналь | ТД (Carbotrap C, Carbotrap, Carbosieve SIII) ГХ-МС (HP5MS) | 60 (68.0) | 48 (61.0) | ДА (чувствительность – 71.7, специфичность – 66.7) | [19] |
| Бутан; 3-метилтридекан; 7-метилтридекан; 4-метилоктан; 3-метилгексан; гептан; 2-метилгексан; пентан; 5-метилдекан | ТД (Carbotrap C, Carbopack B) ГХ-МС (HP5MS) | 67 (66.0) | 41(69.0) | ДА (чувствительность – 89.6, специфичность – 82.9) | [52] |
| Изопрен; 2-метилпентан; пентан; этилбензол; 1,2,4-триметилбензол; толуол; бензол; гептан; декан; стирол; октан; пентаметилгептан | ТФМЭ (Carboxen/PDMS) ГХ-МС (EquityTM-1) | 36 | 50 | Мультиноминальная логистическая регрессия (чувствительность – 72.2, специфичность – 87.8) | [22] |
| 1,5,9-Триметилциклододекатриен; 2,2,4-триметилпентан-1,3-диилдиизобутират; 4-этоксиэтилбензоат; 2-метил-1-(1,1-диметилэтил)-2-метил-1,3-пропандииловый эфир пропановой к-ты; 10,11-дигидро-5H-дибенз-(B, F)-азепин; 1,4-дион, 2,6-бис(1,1-диметилэтил)-2,5-циклогексадиен; 1,1-оксибисбензол; 2,5-диметилфуран; 2,2-диэтил-1,1-бифенил; 2,4-диметил-3-пентанон; транс-кариофиллен; 2,3-дигидро-1,1,3-триметил-3-фенил-1H-инден; 1-пропанол; 4-метилдекан; 1,2- диэтиловый эфир бензолдикарбоновой кислоты; 2,5-диметил-2,4-гексадиен | ТД (Carbotrap C, Carbopack B) ГХ-МС (HP5MS) | 193 (66.0) | 211 (67.0) | Нечетная логика (чувствительность – 84.6, специфичность – 80.0) | [57] |
| 2-Пропанол; 4-пентен-2-ол; 1,1,2-трихлор-1,2,2-трифторэтан; 2-метокси-2-метилпропан; 1-(метилтио)-(E)-1-пропен; 2,3-гексадион; 5,5-диметил-1,3-гексадиен; 2,3-дигидро-4-метил-1H-индиен; камфора; 1,7,7-диметил-(1S)-бицикло [2, 2, 1 ]гептан-2-он; 4-триметил-3-циклогексен-1-метанол; 5-изопропенил-2-метил-7-оксабицикло[4,1,0]гептан-2-ол; изометиловый ионон; 2,2,7,7-тетраметилцикло[6.2.10(1.6)]ундек-4-ен-3-он; 2,2,4-триметил-1,3-пентандиол диизобурат; 4-этоксиэтилбензоат; 5-этиловый эфир бицикло[3.2.2]нонан-1,5-дикарбоновой кислоты; 2,2,4-триметил-3-карбоксиизопропил, изобутиловый эфир пентановой кислоты; 2-метил-1-(1,1-диметилэтил)-2-метил-1,3-пропандииловый эфир пропановой кислоты; 3,3,6,6-тетрафенил-1,2,4,5,-тетроксан; бензофенон; 2,6-бис(1,1-диметилэтил)-4-этилдиен; 2-[(2-этокси-3,4-диметил-2-циклогексен-1-илиден)метил]-фуран; 1,1-(1,2-циклобутандиил)бис-цис-бензол; 1,1-[1-(этилтио)пропилдиен]бисбензол; 1,2,3,4-тетрагидро-9-пропилантрацен; 2-этил-9,10-антрацендиол; 1,1-этилиден-бис(4-этилбензол | ТД (Carbotrap C, Carbopack B) ГХ-МС (HP5MS) | 193 (66.0) | 211 (67.0) | 1. Взвешенный цифровой анализ. (чувствительность – 84.5 специфичность – 81.0) 2. Множественная регрессия. (чувствительность – 68.4 специфичность – 73.5) | [64] |
| 1-Пропанол; 2-бутанон; 3-бутин-2-ол; бензальдегид; 2-метилпентан; 3-метилпентан; н-пентан; н-гексан | ТФМЭ (CAR-PDMS) ГХ-МС (CP-Porabond-Q) | 65 (63.0) | 31 (38.0) | Метод Алана Агрести и Брайана Каффо | [87] |
| А: 2-бутанон; бензальдегид; 2,3-бутандион; 1-пропанол; В: 3-гидрокси-2-бутанон; 3-бутин-2-ол; 2-метилбутан; 2-метил-2-бутен; ацетофенон; 1-циклопентен; метилпропилсульфид; тетраметилмочевина; пентан; 1-метил-1,3-циклопентадиен; 2,3-диметил-2-бутанол; С: 1,2,3,4-тетрагидроизохинолин; 3,7-диметилундекан; циклобутилбензол; бутилацетат; этиленамин; ундекан |
А: соединения найдены только у больных РЛ В, С: соединения присутствуют в выдыхаемом воздухе здоровых людей, их конц. не более чем на 15% больше, чем в окр. воздухе (чувствительность А,В,С – 52.0,71.0, 80.0; специфичность А,В,С – 100.0) |
[66] | |||
| Пентаналь; гексаналь; октаналь; нонаналь | (ТФМЭ − дериватизация на волокне PDMS/DVB) ГХ-МС (MDN-5S) | 12 (55 –81) | 12 (22 –42) | Критерий Краскела–Уоллиса | [24] |
| Нонаналь; гексаналь; октаналь; гептаналь; бутаналь; пентаналь; пропаналь | (ТФМЭ − дериватизация на волокне PDMS/DVB) ГХ-МС (HP-5MS) | 40 (67.0) | 38 (49.0) | ДА, (чувствительность– 90.0, специфичность – 92.1) | [25] |
| 1-Бутанол; ацетоин | ТФМЭ (CAR-PDMS) ГХ-МС (RxiTM –5MS) | 43 (58.0) | 41 (48.0) | Критерий суммы рангов Уилкоксона | [29] |
| Пропан; 2-пропеналь; сероуглерод; 2-пропанол; этилбензол; стирол; | ТФМЭ (CAR-PDMS) ГХ-МС (CP-Porabond-Q) | 23 (51 –78) | 31 (20 –58) | Тест Манна–Уитни, факторный анализ анализ | [23] |
| Этанол; ацетон; бутан; диметилсульфид; изопрен; пропаналь; 1-пропанол; 2-пентанон; фуран; o-ксилол; этилбензол; пентаналь; гексаналь; нонан | ТФМЭ (CAR-PDMS) ГХ-МС (CP-Porabond-Q) | 137 (38 –86) | 86 (21 –52) | ДА, дерево решений | [21] |
| Бутаналь; 2-бутанон; этилацетат; этилбензол; 2-пентанон; пропанол-1; 2-пропанол | ТФМЭ (CAR-PDMS) ГХ-МС (CP-Porabond-Q) | 29 | 44 | Критерий Краскела–Уоллиса | [26] |
| 1-Октен | ТФМЭ (DVB/CAR/PDMS) ГХ-МС (SLC-5MS) | Критерий суммы рангов Уилкоксона | [88] | ||
| Гексадеканаль; эикозан; 5-(2-метил)пропилнонан; 7-метилгексадекан; 8-метилпентадекан; 2,6-ди-трет-бутил-4-метилфенол; 2,6,11-триметилдодекан; 3,7-диметилпентадекан; нонадекан; 8-гексилпентадекан; 4-метилтетрадекан; 2,6,10-триметилтетрадекан; 5-(1-метил)пропилннан; 2-метилнафталин; 2-метилгендеканаль; нонадеканол; 2-пентадеканон; тридеканон; 5-пропилтридекан; 2,6-диметилнафиалин; тридекан; 3,8-диметилгендекан; 5-бутинонан | ТФМЭ (PDMS) ГХ-МС (Rtx-1) | 85 (62.0) | 88 (45.0) | ДА (чувствительность – 96.5, специфичность – 97.5) | [40] |
| 2-Бутанон; 2-гидрокси-2-бутанон; 2-гидроксиацетальдегид; 4-гидроксигексеналь; | Силиконовый микрореактор, ИЦР-МС | 107 (65.0) | 88 (42.0) | Критерий суммы рангов Уилкоксона | [89] |
| 2-Метил-1-пентен; 2-гексанон; 3-гептанон; стирол, 2,2,4-триметилгексан – уменьшились после операции | ТФМЭ (DVB/CAR/PDMS) ГХ-МС (SLB-5ms) | Критерий суммы рангов Уилкоксона, критерий Краскела–Уоллиса | [55] | ||
| 2-Бутанон; 2-гидроксиацетальдегид; 3-гидрокси-2-бутанон; 4-гидроксигексеналь | Силиконовый микрореактор ИЦР-МС | 97 | 88 | Критерий суммы рангов Уилкоксона | [90] |
| Этанол; 2-бутанон; 2,3-бутандиол; 9-тетрадекен-1-ол; октен производные; циклогептан производные; циклононан производные; | ТФМЭ (DVB/PDMS) ГХ-МС (VF-5 ms) | 11 | 10 | – | [57] |
| н-Октан; нонан; 2,3-бутандион | ТД (Tenax TA, Carboxen 569, Carboxen 1000) ГХ-МС (PoraBond Q) | 36 (42 –79) | 28 (22 –87) | Критерий Краскела–Уоллиса | [58] |
| Диметилсульфид; 1,4-пентадиен; этилацетат; метилциклопентан; 2-пропанол-2; изобутан; 2,4-диметилпентан | ТФМЭ (CAR/PDMS) ГХ-МС (P-Porabond-Q ) | 108 (38 –87) | 121 (20 –73) | Дерево решений, ИНС (чувствительность – 74.0, специфичность – 73.0) | [20] |
| 5-(2-Метил-)пропилнонан; 2,6-ди-трет-бутил-4-метилфенол; 2,6,11-триметилдодекан; гексадеканаль; 8-гексилпентадекан | ТФМЭ (PDMS)/ГХ-МС; ТД (Tenax TA, Carbosieve S-III) ГХ-МС (Rtx-5) | 79 (63.0) | 38 (52.0) | МГК (производительность для каждого ЛОС: 84.5, 72.4, 84.6, 100.0, 67.6) | [50] |
| Выдыхаемый воздух: пентан; 2-метилпентан; гексан; этилбензол; гептаналь; транс-2-ноненаль; кондненсант выдыхаемого воздуха: пероксид водорода | ТФМЭ (CAR/PDMS)/ГХ-МС (HP-5 MS) | 71 (68.0) | 67 (64.0) [доброкачественные опухоли] | Тест Кроскелла–Уоллеса, логистическая регрессия | [88] |
| Бутан; 2-метилбутан; 4-метилоктан; пропан; 2-пентанон; пропаналь; 2,4-диметилгептан; пропен | ТФМЭ (CAR/PDMS) ГХ-МС (CP-Porabond-Q) | 123 (36 –87) | 217 (20 –55) | ИНС (5 моделей) (чувствительность – 0.79, 0.79, 0.54, 0.45, 0.59, специфичность – 0.52, 0.52, 0.79, 0.81, 0.83) | [28] |
| 500 ионов в диапазоне времени от 1500 до 2500 с | ТД (Carbotrap C, Carbopack B) ГХ-МС (HP5MS) | Построение модели 100 (67.0) | Построение модели 35 (44.0) | С-статистика, взвешенный цифровой анализ, тестирование в 1 лаборатории: (чувствительность – 68.0 специфичность – 68.4) тестирование во 2 лаборатории (чувствительность – 70.1, специфичность – 68.0) | [48] |
| Проверка в другой лаборатории 75 (66.0) | Проверка в другой лаборатории 19 (49.0) | ||||
| н-Пентан; н-гексан; н-гептан; н-октан; н-додекан; 3-метилпентан; циклогексан; бензол; этилбензол; н-пропилбензол; пропаналь; н-бутаналь; н-гексаналь; н-октаналь; н-нонаналь; н-деканаль; 1-бутанол; 2-бутанон; 2-пентанон | ТФМЭ (CAR/PDMS)/ГХ-МС (VF-624ms) | 37 (66.0) | 23 (61.0) | Тест Манна–Уитни, ДА (чувствительность – 84.0, специфичность – 78.0) | [54] |
| Нонановая кислота | ТД (Tenax TA+ Graphitized Carbon Black + Carbonized Molecular Sieve) ГХ-МС (DB1) |
81 (68.0) | 89 (49.0) | Тест Манна–Уитни, (чувствительность – 32.0, cпецифичность – 88.0) | [43] |
| Синильная кислота; метанол; ацетонитрил; изопрен; 1-пропанол | ТД ГХ-МС | 107 | 27 +78 искусственно созданных | Метод опорных векторов (чувствительность – 92.5, специфичность – 76.0) | [91] |
| 3-Ээтилтолуол; 1,2,3-триметилбензол, н-пропилбензол; пропилциклогексан; индан; 1-метил-3-пропилбензол; о-ксилол; 4-метил-2-гептанон; метилциклогексан | ТД (Tenax TA)/ГХ-МС (Rtx-5) | 58 (51.0) | 125 (61.0) [доброкачественная опухоль] | ROC анализ, ИНС (чувствительность – 80.8, специфичность – 84.0) | [47] |
| Генейкозан; нонадекан; н-пентадекан; гидроксибензол; додекан; аконитил ангидрид; тиазолин; 8-метилгептадекан; n-тетракозан | ТФМЭ (PDMS)/ГХ-МС (Rtx-5) | 108 (61.0) | 82 (51.0) [доброкачественная опухоль] |
ROC анализ, ИНС по РЛ и лоброкач опухоли (чувствительность – 75.6, специфичность – 78.9) | |
| Гексаналь; гептаналь; октаналь; нонаналь | ТФМЭ (металорганическая каркасная структура ZIF-7) ГХ-МС (KB-5) | 6 | 6 | Сравнение средних значений: у пациентов с РЛ средние выше выше | [62] |
| Для отбора значимых биомаркеров 2 подхода, всего 37 соединений, из них 7 определенных обоими подходами: фурфураль; уксусная кислота; фениловый эфир; гептадекан, 2-метил-; 1-метил-2-метиленциклогексан; 7-оксабицикло[4.1.0]гептан, 2-метилен-; 4-ундекен, 5-метил-, (E)-, анетол | ТД (Tenax GR, Carbopack B) ГХ×ГХ ВПМС (Rxi-5Sil + BPX-50) | 15 (62.0) | 14 (58.0) | 1 подход: Критерий Фишера, МГК, кластерный анализ; 2 подход: случайный лес, МГК |
[36] |
| Ацетон; метилацетат; изопрен; метилвинилкетон; циклогексан; 2-метилгептан, циклогексанон | ТФМЭ (CAR/PDMS) ГХ-МС (CP-Porabond-Q) | 108 (38–57) | 121 (20–73) | Тест Манна–Уитни, факторный анализ, ДА, ИНС (чувствительность– 86.0, специфичность – 86.0) |
[44] |
| 1-Пропанол; 2-пропанол; толуол; этилбензол; стирол | ТФМЭ (CAR/PDMS)/ГХ-МС (DB-624) | 51 (71.0) | 53 (67.0) | Тест Манна–Уитни, наивный байесовский классификатор: (производительность – 65.4), логистическая регрессия: (производительность – 78.8), случайный лес: (производительность – 78.8) | [65] |
| 2-Изопрпил-5-метил-1-гептанол; пентановая кислота; N-[4-бром-н-бутил]-2-пиперидион; 5,5-диметилундекан | ТД (Tenax), ТФМЭ (DVB/CAR/PDMS) ГХ-ВПМС (HP-5MSI) | 32 (58–60) | 12 (31) | Полярные диаграммы | [41] |
| 3-Метилгексан; 2,5-диметилфуран; пропилацетат; 2,4-диметилгептан; 1,3,5,7-циклооктатетраен; изопропилбензол; стирол; β-пинен; 2,2,4,6,6-пентаметилгептан; 1,2,3-триметилбензол; октаналь; 1,3-дихлорбензол; 1-этил-3-метилбензол; 2,2,4,4,6,8,8-гептаметилнонан; 3,7-диметилдекан; декан; фенилпропин; 2-этилгексен; 1-этил-2,3-диметилбензол; 15,19-диметилтритриаконтан; изоамилацетат; гексаметилдисилоксан | ТД (Tenax TA) ГХ-МС (Rtx-5) | 60 (62.0) | 176 (64.0) | Градиентный бустинг деревьев решений (чувствительность – 83.0, специфичность – 85.0) | [51] |
| Пики с m/z меньше 500 (32 500 в каждом образце) | ФИПАД-ВПМС | 139 (60.1) | 289 (55.5) | Метод опорных векторов (тестовые данные (чувствительность – 93.0, специфичность –
96.7). Валидация на новых даннных: (чувствительность – 100.0, специфичность – 92.9) |
[92] |
Обозначения: РЛ – рак легких, ТД – концентрирование в сорбционных трубках с последующей термодесорбцией, ДА – дискриминантный анализ, ИЦР-МС – масс-спектрометр ионно-циклотронного резонанса с преобразованием Фурье, ВПМС – времяпролетный масс-спектрометр, ИНС – искусственные нейронные сети, МГК – метод главных компонент, ФИПАД – фотонная ионизация при атмосферном давлении.
Исследовательская группа польских ученых также внесла значительный вклад в развитие данного направления [21, 26, 28, 66, 87]. Работа выполнена на двух различных масс-анализаторах: квадрупольном и времяпролетном. Исследовали как альвеолярный, так и выдыхаемый воздух. Можно заметить изменение температурных режимов, изменение условий подготовки проб, в исследованиях принимали участие разные группы добровольцев, кроме того, перечень предполагаемых биомаркеров необнороден. Несомненно, стоит отметить большой объем работы с точки зрения не только качественного, но и количественного анализа: во многих из представленных публикаций приведены данные определения многих ЛОС в выдыхаемом воздухе, чем отличаются далеко не все работы. К предполагаемым биомаркерам относят спирты, альдегиды, кетоны, ароматические соединения, предельные углеводороды и др.
Несколько публикаций представлено итальянской группой исследователей из Пармы [22, 25, 88]. В качестве биомаркеров рассматривали как весь профиль ЛОС, так и профиль альдегидов. Среди повторяющихся биомаркеров можно выделить 2-метилпентан, гексан, этилбензол и гептаналь. В качестве потенциальных биомаркеров альдегиды неоднократно рассматривали и другие исследовательские группы [24, 62]. Во всех трех работах [22, 25, 88] гексаналь, октаналь и нонаналь относят к биомаркерам рака легких, в двух из трех работ отмечают пентаналь, гептаналь, октаналь и нонаналь.
Результаты работ большинства остальных исследовательских групп представлены в единичных публикациях (табл. 4). В целом можно отметить значительную вариативность исследований как с точки зрения перечня биомаркеров, так и относительно применяемых условий анализа, количества задействованных в исследовании людей, подходов к обработке данных и общего дизайна эксперимента.
Масс-спектрометрия. Другие методы масс-спектрометрии не нашли широкого применения для целей диагностики рака легких по выдыхаемому воздуху, однако в литературе представлены некоторые работы (табл. 5). В случае СИП МС применяют сочетание данного метода с мультикапиллярной колонкой. В двух из трех представленных [93, 94] работ пики не идентифицировали, а в работе [67] ЛОС идентифицировали с помощью базы данных МС ВИП. В одной из ранних публикаций [93] авторам удалось построить модель, классифицирующую образцы выдыхаемого воздуха пациентов с раком легких и здоровых людей без ошибок, однако в более поздних работах чувствительность и специфичность моделей гораздо ниже.
Таблица 5.
Результаты анализа выдыхаемого воздуха в целях идентификации биомаркеров рака легких с применением МКК СИП МС, МС РПП и МС ВИП*
| Биомаркер | Метод | Количество участников исследования (возраст) | Статистическая обработка данных (производительность, %) | Литература | |
|---|---|---|---|---|---|
| РЛ | здоровые | ||||
| 23 пика | МКК СИП МС | 32 (65.1) | 54 (46.0) | ДА (производительность – 100.0) | [93] |
| Додекан; 2-гексанол/2-метилбутилацетат; этилбензол; н-нональ/циклогексанон; гексаналь; гептаналь; 3-метил-1-бутанол; 3-метил-1-бутанол; изопропиламин | МКК СИП МС | 50 (32.0) | 39 (68.0) | Критерий суммы рангов Уилкоксона, дерево решений (чувствительность – 100.0, специфичность – 76.0) | [67] |
| 20 пиков | МКК СИП МС | 56 (69.9) | 52 (51.2) | Логистическая регрессия по методу Лассо (чувствительность – 76.8, специфичность – 65.4) | [94] |
| Формальдегид; 2-пропанол | МС РПП | 17 (62.4) | 170 (41.0) | Критерий суммы рангов Уилкоксона | [95] |
| Изопрен; ацетон; метанол | МС РПП | 220 (64.4) | 441 (54.0) | Критерий Краскела−Уоллиса | [66] |
| Ионы с m/z 43; 45; 46; 59; 60, 61 | МС РПП | 30 (54.7) | 30 (34.3) | Тест Манна−Уитни, ДА (чувствительность – 70.0, специфичность – 90.0) | [96] |
| 50 ЛОС | МС ВИП | 148 (64.5) | 168 (31.4) | Критерий суммы рангов Уилкоксона, бустинг деревьев решений (чувствительность – 96.0, специфичность – 88.0) | [38] |
Среди работ с применением масс-спектрометрии с реакцией переноса протона диагностическая модель построена только в работе [96] на основе анализа выдыхаемого воздуха 30 пациентов с раком легких и 30 здоровых людей, где в качестве параметров рассматривали неидентифицированные ионы; производительность составила 80%. В двух других работах [66, 95] представлены перечни биомаркеров, содержания которых статистически значимо отличаются в пробах исследуемых групп участников: перечни биомаркеров, представленные в разных работах не пересекаются (табл. 5). Несмотря на рост числа публикаций с применением метода МС ВИП в различных областях и активное обсуждение перспектив применения данного метода для диагностики рака легких по выдыхаемому воздуху, конкретная работа по применению данного метода в диагностике рака легких опубликована лишь в 2021 г. [38]. Диагностическая модель построена на основе анализа относительно большой группы людей (148 пациентов с раком легких и 168 здоровых добровольцев), чувствительность и специфичность составили 96.0 и 88.0% соответственно.
Сенсорные системы. Среди сенсорных систем наиболее широкое применение в исследованиях, посвященных диагностике рака легких по выдыхаемому воздуху, нашел коммерческий электронный нос на основе нанокомпозитной матрицы с 32 полимерными датчиками Cyranose 320. В одной из наиболее ранних работ [32] применение данного электронного носа оказалось эффективным для классификации людей на больных и здоровых, что подтверждено на одной и той же выборке дважды при повторении эксперимента с 10-дневным временным интервалом; это доказывает стабильность результатов и отсутствие влияния внешних факторов. Однако в другом исследовании [79] специфичность оказалась очень низкой (менее 50%). Исследовательская группа из Латвии также опубликовала результаты работ с электронным носом Cyranose 320 [80, 97]. При рассмотрении относительно небольшой выборки пациентов с раком легких и здоровых людей достичь высокой специфичности не удалось, однако на более обширной выборке и при рассмотрении в качестве альтернативной онкологическим больным группы не только добровольцев без легочных заболеваний, но и пациентов с доброкачественными опухолями и другими легочными заболеваниями, производительность модели составила более 90% как при рассмотрении только курящих больных и здоровых, так и некурящих, однако стоит отметить, что в данном исследовании модель построена на всем наборе данных без разделения на обучающую и тестовую выборки.
Среди металлооксидных полупроводниковых сенсоров наиболее распространено применение коммерческого электронного носа Aeonose. Ученые из Медицинского центра университета Маастрихта, используя данный “электронный нос”, построили диагностическую модель с применением нейронных сетей и показали на тестовой выборке, что с применением Aeonose удается правильно классифицировать 87% образцов. Однако в исследовании [70], где в эксперименте принимала участие более обширная группа людей, специфичность оказалась низкой (44.1%), а при добавлении в модель клинических параметров удалось повысить специфичность лишь до 55.9%. Что касается исследований с применением некоммерческих электронных носов на основе металлооксидных полупроводниковых сенсоров, можно наблюдать разные результаты с общей производительностью от 75.5 [98] до 97.5% [75].
Во многих исследованиях, включающих применение сенсорной системы на основе кварцевых микровесов для диагностики рака легких, наблюдается высокая производительность построенных диагностических моделей, однако в исследовании [99] показано, что влажность образца и условия окружающей среды (температура, влажность, наличие экзогенных соединений в окружающем воздухе в высоких концентрациях) могут существенно влиять на аналитический сигнал, вследствие чего изменения содержаний эндогенных компонентов не могут быть распознаны данным устройством. Конструкция прибора должна быть существенно усовершенствована для определения следовых количеств ЛОС при высокой влажности, а условия окружающей среды должны быть стационарными при работе с приборами подобного типа.
Не менее успешно показали себя различные типы электронных носов на основе наночастиц (табл. 6), тем не менее во всех исследованиях принимали участие небольшие группы добровольцев. Для подтверждения полученных ранее результатов требуется значительное расширение выборки.
Таблица 6.
Результаты анализа выдыхаемого воздуха в целях идентификации биомаркеров рака легких с применением различных типов “электронного носа”
| Тип сенсорной системы | Количество участников исследования (возраст) | Статистическая обработка данных (производительность, %) | Литература | |
|---|---|---|---|---|
| РЛ | здоровые [другие патологии] | |||
| Cyranose 320 | 10 (45–80) | 10 (45–80) | МГК, ДА, (образцы собраны 2 раза через 10 дней, производительность: 1 раз – 90.0, 2 раз – 80.0) | [32] |
| Cyranose 320 | 38 (64.2) | 39 (62.5) [ХОБЛ] | МГК, (чувствительность – 94.0, специфичность – 13.0) | [79] |
| Cyranose 320 | 165 (63.8) | 79 (37.1) | Метод опорных векторов (чувствительность – 97.8, специфичность – 68.8) | [97] |
| Cyranose 320 | 252 (68.7) | 223 (53.8) | Логистическая регрессия: РЛ и здоровые некурящие (чувствительность – 91.4, специфичность – 96.0); РЛ и здоровые курящие (чувствительность – 94.2, специфичность – 94.3) | [80] |
| Aeonose | 60 (65.0) | 107 (63.0) | ИНС (чувствительность – 88.0, специфичность – 86.0) | [74] |
| Aeonose | 138 (67.1) | 143 (62.1) | ИНС (чувствительность – 94.2, специфичность – 44.1); многомерный регрессионный анализ (+клинические параметры) (чувствительность – 95.7, специфичность – 59.7) | [73] |
| Металлооксидные полупроводниковые сенсоры | 37 (63.3) | 48 (38.7) | ИНС (чувствительность – 79.0, специфичность – 72.0) | [98] |
| Металлооксидные полупроводниковые сенсоры | 65 (65.0) | 53 (56.0) | Логистическая регрессия, метод ближайших соседей, метод опорных векторов (чувствительность – 95.0, специфичность – 100.0), случайный лес (чувствительность – 90.0, специфичность – 100.0), линейный ДА (чувствительность – 95.0, специфичность – 81.2) | [75] |
| Кварцевые микровеса, покрытые молекулярными пленками металлопорфиринов | 35 | 18 | ДА на основе частичных наименьших квадратов (чувствительность – 100.0, специфичность – 94.4) | [81] |
| Кварцевые микровеса с сенсорами, покрытыми молекулярными пленками металлопорфиринов | 28 (62.0) | 36 (63.0) | ДА, (чувствительность – 85.7, специфичность – 100.0) | [82] |
| Кварцевые микровеса, покрытые молекулярными пленками металлопорфиринов | 70 (67.0) | 76 (61.0) | ДА на основе частичных наименьших квадратов (чувствительность – 81.0, специфичность – 91.0) | [39] |
| Кварцевые микровеса с золотыми электродами, покрытыми антоцианом | 23 (62.0) | 77 (62.0) | МГК, ДА на основе частичных наименьших квадратов (чувствительность – 86.0, специфичность – 95.0) | [100] |
| Органически функционализированные наночастицы золота | 30 (30−75) | 59 (20−75) | МГК | [101] |
| Органически функционализированные сферические наночастицы золота и платины | 24 | 10 [доброкачественная опухоль] | ДА (чувствительность – 100.0, специфичность – 80.0) | [55] |
| 4 хеморезистора на основе одностенных углеродных нанотрубок, покрытых ПАУ и 16 хеморезисторов на основе органически активных сферических наночастиц золота | 50 (64.9) | 19 (60.8) [доброкачественная опухоль] | ДА (чувствительность – 86.0, специфичность – 96.0) | [56] |
| Чистые и легированные металлом нанопроволоки WO3, во время измерения облучаемые УФ-излучением | 32 (59.6) | 12 (31.3) | ДА (точность: перекрестная проверка – 99.2, бутстрэп – 98.6) | [41] |
| 36 красителей с разными химическими свойствами | 49 (65.0) | 94 (56.0) | Случайный лес (чувствительность – 73.3, специфичность – 72.4) | [102] |
| 24 красителя трех типов: металлохромные, кислотно-основные и сольватохромные | 92 (68.9) | 137 (58.9) | С-статистика (производительность – 81.1) | [84] |
| 32 красителя трех типов: металлохромные, кислотно-основные и сольватохромные | 97 (66.1) | 182 (63.0) | С-статистика (производительность – 79.4–86.1) | [45] |
| 4 электрохимических сенсора, 1 сенсор с нагретой проволокой, 1 каталитический сенсор горючих газов и 8 металлооксидных полупроводниковых сенсоров | 24 (63.6) | 28 (48.2) | Нечеткий ДА (чувствительность – 91.6, специфичность – 91.7) | [85] |
| 5 электрохимических сенсоров, 1 сенсор с нагретой проволокой и 12 металлоксидных полупроводниковых сенсоров | 46 (58.8) | 41 (34.5) | Метод опорных векторов (чувствительность – 97.8, специфичность – 90.2); метод ближайших соседей (чувствительность – 100.0, специфичность – 75.0); метод логитбуст (чувствительность – 87.0, специфичность – 82.9) | [86] |
Наибольший вклад в развитие исследований с применением колориметрического электронного носа внесли Маззоне и соавт. [45, 84]. В наиболее позднем исследовании [45] проанализирован выдыхаемый воздух 97 пациентов с раком легких и 182 здоровых людей. Производительность модели составила 79%. Авторы показали, что дополнительное использование клинических параметров в качестве предикторов способно значительно повысить производительность.
Применение комбинированных сенсоров хорошо показало себя на относительно небольших выборках [85, 86], однако полученные результаты необходимо подтвердить на большем массиве данных.
Таким образом, исходя из представленных выше результатов анализа выдыхаемого воздуха различными методами для разработки способа диагностики рака легких видно, что на сегодняшний день не обнаружены уникальные биомаркеры, по наличию или отсутствию которых можно было бы надежно ставить диагноз. Интерес исследователей сосредоточен на выявлении комбинации компонентов, содержания которых статистически значимо отличается у пациентов с раком легких и у здоровых людей. Из всех рассмотренных методов анализа выдыхаемого воздуха ГХ-МС остается наиболее подходящим для решения поставленной задачи, так как позволяет идентифицировать все компоненты пробы, что особенно необходимо для выявления исчерпывающего перечня биомаркеров среди множества аналитов. Тем не менее оборудование для этого метода является громоздким, анализ зачастую длителен, а для обработки результатов необходим высококвалифицированный персонал. Однако применение ГХ-МС в клинической практике могло бы быть реализовано за счет возможности длительного хранения проб после отбора и концентрирования, что позволит создать единые центры анализа проб, куда будут поступать образцы, полученные в различных отдаленных учреждениях. Другим недостатком ГХ-МС является необходимость стадий отбора, концентрирования и хранения образцов, при выполнении которых возможна контаминация пробы и ее частичная потеря.
Устройства типа “электронный нос” значительно проще внедрить в клиническую практику, однако, несмотря на впечатляющую производительность подобных устройств в некоторых исследованиях (табл. 6), они реагируют на “образ” выдыхаемого воздуха, в котором содержится большое количество экзогенных компонентов, что зачастую трудно учесть. Чувствительность “электронного носа” может быть настроена на определенные ЛОС, однако ввиду отсутствия согласованности исследований с точки зрения идентификации компонентов – предполагаемых биомаркеров, в основе работы подавляющего большинства подобных устройств лежат неселективные сенсоры, реагирующие на множество компонентов одновременно, что, с одной стороны, позволяет получить общее представление об отличиях профилей ЛОС в выдыхаемом воздухе пациентов с раком легких и здоровых людей, а с другой стороны, не дает ответа на вопрос: чем обусловлены эти изменения, что сопряжено с ложной интерпретацией полученных результатов. Оптимальный вариант применения таких устройств может быть достигнут только после установления четкого перечня биомаркеров и настройки чувствительности сенсоров на определенные соединения.
ВОЗМОЖНЫЕ ПРИЧИНЫ НЕОДНОЗНАЧНОСТИ РЕЗУЛЬТАТОВ, ПОЛУЧЕННЫХ РАЗЛИЧНЫМИ ИССЛЕДОВАТЕЛЬСКИМИ ГРУППАМИ
Дифференцирование гистологического типа и стадии заболевания по составу выдыхаемого воздуха. Вариативность результатов, полученных различными исследовательскими группами, может быть обусловлена не только количеством участников исследования и различием групп больных и здоровых людей, но и отличиями внутри групп. Многие исследователи строят классификационные модели по показателю “норма−патология”, однако состав группы “патология” значительно различается в разных исследованиях по количеству пациентов с разными гистологическими типами и стадией заболевания. Метаболизм и метаболическая активность различных гистологических типов опухоли могут существенно отличаться, а некроз и скорость распространения опухоли на разных стадиях существенно варьируются, что может отражаться на составе выдыхаемого воздуха.
Некоторые исследователи изучали отличия состава выдыхаемого воздуха и содержаний некоторых ЛОС в зависимости от гистологического типа и стадии опухоли.
Повышенное содержание 1-бутанола и ацетоина в группе пациентов с аденокарциномой по сравнению с плоскоклеточным раком наблюдали в исследовании [29] при рассмотрении профиля ЛОС в выдыхаемом воздухе в зависимости от гистологического типа заболевания. В работе [90] показано, что содержание 4-гидрогексеналя отличается у пациентов с плоскоклеточным раком и аденокарциномой, а 4-гидроксиноненаля и пентаналя – в группах с мелкоклеточным раком легких (МРЛ) и немелкоклеточным раком легких (НМРЛ). В исследовании [41] пациентов с МРЛ и НМРЛ можно классифицировать с применением электронного носа с точностью 88.4%, а пациентов с аденокарциномой и плоскоклеточным раком – с точностью 77.5%. При сопоставлении пациентов с различными типами рака легких и здоровых людей Маззоне и соавт. [45] добились точности модели от 70 до 81% при сравнении НМРЛ и здоровых, от 76 до 89% при сравнении МРЛ и здоровых и от 58 до 88% при сравнении плоскоклеточного рака легких (ПРЛ) и аденокарциномы. Корт и соавт. [103] сравнивали чувствительность классификации результатов анализа выдыхаемого воздуха пациентов с разными гистологическими типами и здоровых людей с подтвержденным отсутствием заболевания. Лучше всего удается классифицировать МРЛ и здоровых людей (чувствительность – 88.9, специфичность – 80%), при сравнении здоровых людей с пациентами с аденокарциномой и ПРЛ чувствительность и специфичность составили 81.5, 80.8 и 53.2, 72.5%. В работе [104] значения соотношений некоторых ЛОС (1-метилтиопропан/диметилдисульфид, диметилдисульфид/1-метилтиопропен, ундекан/аллилметилсульфид) статистически значимо отличались в группах пациентов с ПРЛ, МРЛ и аденокарциномой. Однако в исследовании [28] отличий в профилях ЛОС в выдыхаемом воздухе пациентов с различными гистологическими типами не обнаружено.
В работе [64] Филипс и соавт. показали, что стадия заболевания не зависит от параметров, включенных в диагностическую модель. Отсутствие взаимосвязи стадии заболевания с профилем ЛОС в выдыхаемом воздухе также продемонстрировано в исследованиях [28, 29, 40]. В работе [90] отмечается, что концентрация 2-бутанона значительно выше в группах онкобольных со 2‑ой и 4-ой стадиями НМРЛ, чем с 1-ой. В исследовании [56] с применением метода ГХ-МС не удалось выявить отличий между ранней и поздней стадиями рака легких, однако, используя “электронный нос” на основе наноматериалов удается классифицировать раннюю и позднюю стадии с чувствительностью 86% и специфичностью 88%. В работе [45] c применением колориметрического сенсора 1-ую и 4-ую стадии заболевания удалось классифицировать с точностью 93.7%.
В единичных работах авторы сопоставляют пробы пациентов с раком легких в зависимости от таких альтернативных параметров, как локализация опухоли и мутация в гене EGFR. В работе [67] наблюдали повышенное содержание додекана в выдыхаемом воздухе пациентов, у которых обнаружена мутация в гене EGFR. В исследовании [104] площади пиков 1-пентанола и значения соотношений площадей пиков 2-бутанон/2-пентанон, диметилдисульфид/2,3-бутандион, 1-пентанол/2,3-бутандион, бутаналь/2,3-бутандион статистически значимо отличались в группах пациентов с центральной и периферической локализацией опухоли. Данные показатели также могут обусловливать вариативность внутри группы с раком легких, что необходимо принимать во внимание.
Исходя из представленных результатов, можно отметить следующее: если в одном исследовании отличия состава проб выдыхаемого воздуха в зависимости от гистологического типа или стадии заболевания видны достаточно четко, то в других исследованиях отмечают, что не наблюдали никаких отличий. Данная проблема может быть решена только при проведении масштабного исследования с исчерпывающим количеством образцов для каждой из рассматриваемых групп.
Биомаркеры рака легких в тканях и клеточных линиях. Другой проблемой, которая может частично объяснить неоднородность результатов, полученных различными исследовательскими группами, является недостаточная на сегодняшний день изученность метаболических путей происхождения биомаркеров, вследствие чего некоторые экзогенные компоненты могут быть ошибочно отнесены к перечню биомаркеров. Косвенным подтверждением эндогенной природы компонентов, присутствующих в выдыхаемом воздухе, может быть исследование профилей ЛОС над опухолевыми тканями и клеточными линиями. В работе [105] сопоставляли профили ЛОС, содержащихся в выдыхаемом воздухе и в клеточных линиях. В клеточных линиях обнаружили четыре компонента, характерных для опухолевых клеточных линий, из которых два были идентифицированы как изопрен и ундекан, тогда как в выдыхаемом воздухе содержания 11 ЛОС были характерны для рака легких, среди которых также присутствовали изопрен и ундекан. Профили ЛОС в выдыхаемом воздухe, тканях и клеточных линиях сопоставлены в работе [40], где 2-пентадеканон, нонадекан и эикозан присутствовали во всех трех исследуемых матрицах, а тридекан присутствовал как в выдыхаемом воздухе, так и в опухолевых тканях. Подобное исследование проводил Филипак и соавт. [58]. Обнаружено, что концентрации октана в выдыхаемом воздухе, тканях и клеточных линиях повышены в случае рака легких в сравнении с соответствующими здоровыми образцами. Также наблюдалось повышенное содержание 2-метилпентана и гексана в случае рака легких во всех матрицах, однако статистически значимое повышение наблюдалось только в выдыхаемом воздухе.
В работе [106] сопоставляли профили ЛОС 28 образцов опухолевых тканей и 24 образцов доброкачественных тканей. Диагностическая модель, построенная c применением дискриминантного анализа на основе толуола, 1-пенанола, гексаналя, гептаналя, стирола, 2,3-октандиона и одного неидентифицированного пика, была способна классифицировать образцы опухолевой и доброкачественной тканей с точностью 98%.
В работе [35] сопоставляли профили ЛОС в выдыхаемом воздухе и опухолевых тканях. Многие из компонентов, присутствующих в выдыхаемом воздухе, также были обнаружены в образцах опухолевых тканей, однако процент образцов тканей, где присутствовали многие из ЛОС, был значительно ниже, чем в случае выдыхаемого воздуха, а площади пиков большинства из компонентов в образцах опухолевых тканей были существенно ниже, чем в выдыхаемом воздухе. В исследовании [107] изучали клеточные линии с использованием метода ГХ-МС. Модель, построенная на 12 ЛОС с максимальным вкладом деканаля, ацетофенона и 3-бис(1,1-диметилэтил)бензола, была способна классифицировать НМРЛ и МРЛ со 100%-ной чувствительностью и 75%-ной специфичностью, а модель на основе 9 ЛОС с максимальным вкладом с дискриминирующую способность 2-этил-1-гексанола, 1,3-диметилбензола и 1,3-бис(1,1-диметилэтил)бензола – аденокарциному и ПРЛ со 100%-ной чувствительностью и 67%-ной специфичностью. При использовании сенсорной системы на основе наночастиц анализировали те же образцы, за исключением одного образца клеточных линий ПРЛ. Удалось классифицировать НМРЛ и МРЛ со 100%-ной чувствительностью и 75%-ной специфичностью, а аденокарциному и ПРЛ – с 86%-ной чувствительностью и 100%-ной специфичностью. Сопоставление профилей ЛОС в выдыхаемом воздухе и клеточных линиях проведено в работе [96] с применением метода МС РПП. Среди ионов, статистически значимо отличающихся в образцах выдыхаемого воздуха больных и здоровых людей, только содержание иона с m/z = 45 было повышено.
Результаты исследований профилей ЛОС, содержащихся в тканях и клеточных линиях, как и в случае с выдыхаемым воздухом весьма неоднозначны. Причины получения таких результатов могут быть связаны как с вариативностью самих проб, анализируемых в различных исследованиях, так и с упущением некоторых важных моментов. Так, например, в публикациях отсутствует описание учета влияния окружающего воздуха, что может привести к рассмотрению экзогенных компонентов как компонентов, выделяющихся из образца. Еще одним недостатком уже выполненных на сегодняшний день исследований является их относительная ненадежность ввиду весьма небольшого объема выборки.
Биомаркеры оценки эффективности лечения рака легких. Во многих исследованиях при сопоставлении групп пациентов с раком легких и здоровых людей указывается, что пациенты еще не проходили лечение, тем не менее имеются работы, где статус лечения не указан либо отмечено, что пациенты уже получили лечение. С другой стороны, помимо решения задачи диагностики рака легких не менее важной задачей является мониторинг эффективности применяемых методов лечения. Исследование проб выдыхаемого воздуха до и после лечения может служить дополнительным подтверждением того, что изменения содержаний ЛОС действительно обусловлены заболеванием. Некоторые исследовательские группы уже опубликовали результаты работ в данном направлении. В работе [22] наблюдали статистически значимое снижение концентраций изопрена и декана после операции на основе обследования 26 пациентов с НМРЛ. В работе [89] описано статистически значимое снижение концентраций 2-бутанона, 2-гидроксиацетальдегида и 4-гидроксигексеналя после резекции на основе анализа выдыхаемого воздуха 20 пациентов. В работе [55] анализировали выдыхаемый воздух 10 пациентов с раком легких до и после операции с использованием ГХ-МС и электронного носа. В случае ГХ-МС концентрации стирола, 2-метил-1-пентена, 2-гексанона, 3-гептанона, 2,2,4-триметилгексана статистически значимо уменьшились после резекции, а на основе результатов анализа с использованием электронного носа построена классификационная модель, где образцы были правильно классифицированы с точностью 80%.
В работе [77], используя сенсоры на основе массива наноматериалов, исследовали изменения в профиле ЛОС в выдыхаемом воздухе в зависимости от реакции на лечение. Группы до и после лечения с положительной реакцией на лечение можно классифицировать с чувствительностью – 93% и специфичностью – 85%, а группы с отрицательной и положительной реакциями на лечение – со 100%-ной специфичностью и 28%-ной чувствительностью. В этом же исследовании образцы выдыхаемого воздуха проанализировали методом ГХ-МС. После лечения наблюдается изменения концентраций стирола, α-фелландрена, додекана и 4-метилдодекана. В исследовании [76] анализировали образцы выдыхаемого воздуха пациентов с раком легких, полученные до резекции и в первое и второе посещения клиники после резекции. Также отбирали образцы выдыхаемого воздуха здоровых людей с такими же временными интервалами. Показано, что образцы выдыхаемого воздуха здоровых людей остаются стабильными, а у 45.2% пациентов с раком легких наблюдались значительные изменения.
Селективность биомаркеров рака легких к другим заболеваниям. Для выявления биомаркеров рака легких большинство исследователей сравнивают профили ЛОС в выдыхаемом воздухе пациентов с раком легких и здоровых людей без каких-либо легочных заболеваний, а наличие других легочных патологий зачастую является исключающим фактором участия в эксперименте. Однако другие легочные заболевания также могут изменять профиль ЛОС, что не учитывается при сравнении больного раком легких и здорового, вследствие чего другие легочные заболевания могут быть ошибочно интерпретированы как рак легких. Другой проблемой является возможность параллельного присутствия у пациента с раком легких других заболеваний, что дополнительно может искажать профиль ЛОС, поэтому при разработке способа диагностики рака легких необходимо учитывать как селективность заболевания относительно других патологий, так и возможную изменчивость пробы при наличии нескольких патологий одновременно.
Доброкачественные опухоли – это образования, которые невозможно отличить от рака легких при диагностике с помощью КТ, поэтому для установления диагноза в большинстве случаев требуется хирургическое вмешательство. Представляет интерес селективность биомаркеров рака легких по отношению к доброкачественным опухолям. В исследовании [56] сравнивали пациентов со злокачественной и доброкачественной опухолями. На основании ГХ-МС-анализа выявлено, что содержание 1-октена статистически значимо отличается в исследуемых группах пациентов, а с применением электронного носа удалось различить группы с чувствительностью 86% и специфичностью 96%. В работе [55] на основе анализа 10 пациентов с доброкачественной опухолью и 24 пациентов с раком легких построена диагностическая модель со 100%-ной чувствительностью и 80%-ной специфичностью. При сопоставлении групп здоровых людей, пациентов с доброкачественными опухолями и с раком легких 96% пациентов с раком легких были идентифицированы правильно [40], в то время как 34% пациентов с доброкачественной опухолью были отнесены в группу здоровых добровольцев, что показывает селективность алгоритма к раку легких. В исследовании [90] наблюдали повышенные концентрации 2-бутанона, 2-гидроксиацетальдегида, 3-гидрокси-2-бутанона и 4-гидроксигексеналя у пациентов с раком легких по сравнению со здоровыми людьми и с пациентами с доброкачественной опухолью, а в работе [49] такая зависимость наблюдалась для 5-(2-метил)пропил-нонана, 2,6-ди-трет-бутил-4-метил-фенола, 2,6,11-триметилдодекана, гексадеканаля, 8-гексилпентадекана. Построенная Corradi и соавт. [88] классификационная модель позволила отличить пациентов с раком легких и пациентов с доброкачественной опухолью с относительно невысокой точностью (чувствительность – 60.6%, специфичность – 67.2%). При сравнении групп со злокачественными опухолями, доброкачественными опухолями и здоровыми людьми не удалось выявить значительных отличий между группами с доброкачественными и злокачественными опухолями, однако группу здоровых людей можно отличить от группы с легочными заболеваниями с чувствительностью 75.6–80.8% и специфичностью 78.9–84% [47]. В работе [65] сравнивали пациентов с раком легких со здоровыми людьми и с пациентами с образованием по данным КТ, но отрицательной биопсией. Наилучшая производительность при классификации пациентов на больных раком легких и здоровых людей составила 78.8%, однако при сопоставлении пациентов с раком легких и пациентов с отрицательной биопсией производительность оказалась значительно ниже и составила 52.8%. В исследовании [94] при сопоставлении пациентов с раком легких со здоровыми людьми чувствительность и специфичность составили 76.8 и 65.4% соответственно, а при сравнении пациентов с раком легких и с доброкачественными опухолями – 64.3 и 77.1%.
Поли и соавт. [22] сравнили профили ЛОС пациентов с раком легких, пациентов с хронической обструктивной болезнью легких (ХОБЛ), здоровых курильщиков и здоровых некурящих людей: чувствительность модели к каждой из сравниваемых групп находилась в диапазоне 72.2–87.8%. В исследовании [32] профили ЛОС в выдыхаемом воздухе пациентов с ХОБЛ и НМРЛ удалось классифицировать с точностью 85%. В работе [34] содержание нонановой кислоты статистически значимо отличалось в группе пациентов с раком легких по сравнению как со здоровыми людьми, так и с пациентами с ХОБЛ. При классификации пациентов с раком легких и ХОБЛ наблюдали [79] достаточно высокую чувствительность 94.0% при низкой специфичности (13%). При сравнении групп пациентов с раком легких, с раком легких и ХОБЛ, с ХОБЛ и здоровых людей почти половина пациентов с раком легких и 2/3 пациентов с ХОБЛ были отнесены к группе пациентов с раком легких и ХОБЛ, в то время как 80% здоровых людей были классифицированы правильно [97]. Те же авторы в своей следующей работе [108] в группу “не рак легких” включили как здоровых, так и пациентов с различными другими легочными патологиями (доброкачественные образования, астма, ХОБЛ, туберкулез и др.), производительность модели при этом составила более 90% как для курильщиков, так и для некурящих. В работе [70] пациенты с ХОБЛ присутствовали как в группе больных раком легких, так и в группе здоровых людей. Производительность построенных моделей увеличилась при добавлении ХОБЛ вместе с другими клиническими показателями в перечень входных параметров диагностической модели. В исследовании [78] при сравнении результатов анализа выдыхаемого воздуха пациентов с раком легких, раком молочной железы, ХОБЛ и здоровыми людьми с применением электронного носа Cyranose 320 удалось правильно классифицировать группы со 100%-ной точностью.
В сравнительно небольшом количестве исследований принимаются во внимание другие заболевания, которые также могут влиять на состав выдыхаемого воздуха, тем не менее в последние годы наблюдается значительный рост числа публикаций, где в качестве группы сравнения используют не здоровых людей, а пациентов с другими легочными заболеваниями, что в будущем может позволить выявить биомаркеры, обеспечивающие меньшее количество ложноположительных результатов. При этом немаловажными факторами являются не только селективность найденных биомаркеров по отношению к легочным заболеваниям, но и отсутствие влияния сопутствующих заболеваний, таких как сахарный диабет или хроническая сердечная недостаточность, которые распространены среди пожилых людей.
Другие факторы, влияющие на профиль летучих органических соединений в выдыхаемом воздухе. На профиль ЛОС в выдыхаемом воздухе могут влиять различные факторы, которые необходимо принимать во внимание при постановке задачи выявления биомаркеров рака легких. К подобным факторам относятся наличие статуса курения, режим питания, влияние окружающей среды, возраст и др.
Курение является одной из основных причин возникновения рака легких, которая значительно изменяет состав выдыхаемого воздуха. Многие из пациентов с раком легких – активные или бывшие курильщики, вследствие чего при сопоставлении профилей ЛОС в выдыхаемом воздухе пациентов с раком легких и здоровых людей компоненты, появляющиеся в выдыхаемом воздухе вследствие курения, могут быть ошибочно интерпретированы как биомаркеры рака легких. В некоторых работах исследовали профили выдыхаемого воздуха курильщиков и некурящих среди здоровых людей. В работе [109] сопоставляли профили ЛОС в выдыхаемом воздухе активных и пассивных курильщиков и здоровых людей. Ацетонитрил, фуран, 3-метилфуран, 2,5-диметилфуран, 2-бутанон, октан и декан присутствовали только в пробах активных и пассивных курильшиков. В работе [110] выявлено более 80 ЛОС (преимущественно диены, алкены и алкины), содержание которых зависит от курения. На основании обследования 122 человек показано, что профиль ЛОС в выдыхаемом воздухе зависит не только от наличия статуса курения, но от стажа курения. Наличие в выдыхаемом воздухе 2,5-диметилфурана и 1,3,5-гексатриена свидетельствует о наличии статуса курения. Выявлены положительные корреляции уровней концентраций 2,4-диметил-1-гептена, бутилацетата, 2,3-диметилгептана и 4-метилоктана со стажем курения [111]. Повышенное содержание фурана, толуола и 2-бутанона у курильщиков отмечают в работе [112].
Изменения концентраций ЛОС в зависимости от режима питания рассматривают с нескольких сторон: в зависимости от диеты или относительно индекса массы тела. В исследовании [113] отмечается, что с повышением индекса массы тела возрастают концентрации 2-гексанона, o-, м-, п-ксилолов, 7-метил-3-метилен-1,6-октадиена, 2-ацетилпиролла, фенилацетата в выдыхаемом воздухе и убывают концентрации диметилсульфида, 3-формилтиофена, 1,2,4-триметилбензола, 3-пиридинметанола, 1-метокси-4-(1-пропенил)бензола. В работе [114] рассматривали изменения концентрации ацетона в зависимости от диеты. Показано, что при употреблении богатой жиром пищи концентрация ацетона возрастает в пять раз в течение 6 ч после употребления пищи, а низкоуглеводная диета сопровождается повышением концентрации ацетона в 6−9 раз во время применения диеты. Концентрация ацетона увеличивается также при голодании [15]. В исследовании [115] рассматривали изменения ЛОС после употребления в пищу продуктов, богатых клетчаткой. Выявлено, что концентрации этанола, 2-пропанола, ацетоина повышались, в то время как концентрации ацетона, бутанола, диацетила и фенола уменьшались.
Изменения профиля ЛОС с возрастом связывают с кумулятивным окислительным разрушением полиненасыщенных жирных кислот, белков и ДНК, вызванным активными формами кислорода, в результате которого в выдыхаемом воздухе могут появляться алканы и монометилалканы [116]. В исследовании [117] анализ альвеолярного воздуха 102 человек разных возрастов показал, что концентрации некоторых предельных улеводородов, начиная от гексана и заканчивая ундеканом, и их метилированных производных повышаются с возрастом. В работе [113] при анализе выдыхаемого воздуха представительной группы людей (1417 человек) отмечено, что с возрастом наблюдается повышение концентраций диметилсульфида, 1,2,4-триметилциклогексана, 1-метокси-4-(2-пропенил)бензола и понижение концентраций изопрена, пиридина, 2-метил-5-изопрофенил-2-циклогексен-1-она и додеканаля. При анализе выдыхаемого воздуха 126 людей выявлено, что концентрации изопрена повышены у пожилых людей [118].
При исследовании влияния гендерной принадлежности на состав ЛОС в выдыхаемом воздухе [113] отмечены повышенные концентрации пиридина и толуола у мужчин и повышенные концентрации дисульфида углерода, 2,3-диметил-4-пентенола у женщин. В работе [118] наблюдали повышенные концентрации изопрена у мужчин, однако теоретического обоснования причин этого явления пока нет.
Исследователи, занимающиеся разработкой способа диагностики рака легких по выдыхаемому воздуху, по-разному учитывают влияние перечисленных выше факторов. Из табл. 3−6 видно, что информация о возрасте участников исследования в основном представлена медианами, однако в некоторых исследованиях обозначены лишь возрастные диапазоны. Можно заметить, что в доминирующем количестве исследований возрастная категория пациентов с раком легких и здоровых людей была одинакова и разница в медианных значениях возрастов среди публикаций не превышала 10 лет. Однако имеются публикации, где здоровые добровольцы значительно моложе, чем пациенты с раком легких. С одной стороны, значительные вариации в возрастных группах могут привести к ошибочным данным, а с другой, – на сегодняшний день увеличивается заболеваемость раком среди молодых людей, что также необходимо учитывать. Влияние возраста на изменения профиля ЛОС в выдыхаемом воздухе изучено недостаточно хорошо для того чтобы четко идентифицировать перечень компонентов, чувствительных к возрасту, поэтому, для исключения потенциальных ошибок оптимальным вариантом является исследование больных и здоровых людей одинакового возраста.
Для учета влияния курения некоторые исследователи выделяют курильщиков в отдельную группу при создании классификационных моделей [21, 22, 24, 49, 87]. Другие исследователи исключают курильщиков из исследования и рассматривают только некурящих людей или бывших курильщиков, которые не курили минимум год [29, 58]. В исследовании [80] проблему учета влияния курения решили следующим образом: строили две диагностические модели − для больных и здоровых курильщиков и для больных и здоровых некурящих людей. В работе [84] диагностическую модель проверяли на курильщиках и на некурящих людях; показано, что статус курения не отражается на производительности модели. В исследовании [119] рассматривали влияние курения и гендерной принадлежности на значения площадей пиков и их соотношений, статистически значимо отличающихся в группах пациентов с раком легких и здоровых людей. Исключение параметров, коррелирующих с другими факторами, не отразилось на специфичности диагностических моделей, однако повысило чувствительность. В большинстве других работ влияние курения учитывают за счет установления определенного периода времени, которое должно пройти после последнего курения. Этот период в различных исследованиях устанавливают по-разному: например, в работах [40, 41, 47] перед отбором проб курильщики не курили минимум 12 ч либо ночь перед отбором проб [39], в других исследованиях время после последнего курения ограничивалось 2.5 [35]–2 [77] ч или 1 ч [22, 55, 75]. Имеются также работы, в которых условия отбора проб относительно курения не описаны [20, 26, 36, 42, 44].
Учет влияния употребления пищи в основном ограничивается установлением периода времени, которое должно пройти после последнего приема пищи. Некоторые исследователи ограничивают время после употребления пищи 1–2 ч [28, 58, 75, 77], в других источниках условия не описаны [21, 22, 24], однако в основном пробы отбирают натощак [29, 39–41, 47, 49, 64], что является предпочтительным как с точки зрения качества анализа, так и с позиции простоты введения такого режима в клиническую практику (отбор проб для многих лабораторных исследований проводят натощак).
Наиболее надежным способом учета влияния экзогенных компонентов, попадающих в пробу из окружающего воздуха, является параллельный отбор пробы окружающего воздуха, что и осуществляли в ряде работ [28, 40, 64, 87]. Некоторые исследователи отбирали одну пробу окружающего воздуха в день отбора проб [35, 55]. В других публикациях указано количество проб окружающего воздуха, отобранных во время исследования [22, 29]. В большинстве работ указывается факт отбора проб окружающего воздуха, однако периодичность его отбора не представлена [24, 44, 49, 77, 91]. Вариативность учета влияния окружающего воздуха не ограничивается только периодичностью отбора проб окружающего воздуха; по-разному также осуществляют вычитание фоновых содержаний компонентов. Например, в работе [26] учитывали только те компоненты, содержания которых были на 10% больше, чем в окружающем воздухе, в исследованиях [87, 119] – на 15%, однако в большинстве работ, учитывают те компоненты, содержание которых в образце выдыхаемого воздуха было выше, чем в пробе окружающего воздуха.
* * *
Анализируя имеющиеся на сегодняшний день результаты исследований по данной тематике, можно сформулировать основные проблемы, препятствующие разработке способа диагностики, достаточно надежного для внедрения в клиническую практику:
1. Недостаточно исчерпывающие знания о метаболических путях появления ЛОС в выдыхаемом воздухе, что не позволяет однозначно относить те или иные ЛОС, обнаруженные в выдыхаемом воздухе, к биомаркерам рака легких.
2. Вариативность условий подготовки проб и анализа, в большинстве случаев не позволяющая сопоставлять результаты, полученные различными исследовательскими группами.
3. Существенная вариативность исследуемых групп добровольцев в разных исследованиях как с точки зрения объема выборки, так и относительно факторов, которые могут влиять на состав выдыхаемого воздуха: а) гистологический тип, стадия заболевания и статус лечения в группе пациентов с раком легких; б) возраст, пол, статус курения добровольцев; в) вариативность условий отбора проб: время после последнего курения и после последнего употребления пищи, время пребывания в помещении, где проводится отбор проб.
4. Вариативность учета влияния окружающего воздуха либо отсутствие данного пункта в большинстве исследований.
Для создания надежного диагностического теста ключевым вопросом остается идентификация исчерпывающего перечня биомаркеров, которые бы четко и надежно диагностировали заболевание, и определение диапазона их содержаний, что на сегодняшний день еще не решено. Проведенные исследования тканей и клеточных линий не дают четкого ответа на данный вопрос, поэтому в первую очередь необходимо искать альтернативные подходы доказательства появления ЛОС в выдыхаемом воздухе вследствие активности опухолевых тканей. С другой стороны, необходимо учитывать влияние всех факторов и обеспечивать максимально возможную идентичность сравниваемых групп по всем параметрам, не относящимся к заболеванию, а также учитывать возможную вариативность, обусловленную различными формами патологии.
Несмотря на множество вопросов, которые так и остаются открытыми, анализ выдыхаемого воздуха – это перспективный и весьма многообещающий способ неинвазивной диагностики рака легких, который может быть внедрен в клиническую практику для массовых обследований и выявления пациентов, которым необходимо дальнейшее детальное обследование, однако предстоит провести еще много работы для того чтобы создать диагностический тест и определить все граничные условия, в которых возможно получение надежных и точных результатов.
Исследования проводились в рамках выполнения проекта № FZEN-2020-0022 Минобрнауки РФ и при финансовой поддержке РФФИ, проект № 20-33-90033, с использованием научного оборудования ЦКП “Эколого-аналитический центр” Кубанского госуниверситета.
Список литературы
Sung H., Ferlay J., Siegel R. L., Laversanne M., Soerjomataram I., Jemal, A., Bray, F. Global cancer statistics 2020 // CA Cancer J. Clin. 2021. V. 71. № 3. P. 209.
Siegel R.L., Miller K.D., Jemal A. Cancer statistics, 2020 // CA Cancer J. Clin. 2021. V. 71. № 1. P. 7.
Black W.C., Gareen I. F., Soneji S.S., Sicks J.D., Keeler E.B., Aberle D.R., Naeim A., Church T.R., Silvestri G.A., Gorelick J., Gatsonis C. Cost-effectiveness of CT screening in the National Lung Screening Trial // N. Engl. J. Med. 2014. V. 371. № 19. P. 1793.
Borczuk A.C., Shah L., Pearson G.D. N., Walter K.L., Wang L., Austin J.H.M., Friedman R.A., Powell C.A. Molecular signatures in biopsy specimens of lung cancer // Am. J. Respir. Crit. Care Med. 2004. V. 170. № 2. P. 167.
Mazzone P., Jain P., Arroliga A.C., Matthay R.A. Bronchoscopy and needle biopsy techniques for diagnosis and staging of lung cancer // Clin. Chest Med. 2002. V. 23. № 1. P. 137.
Zhang C., Leng W., Sun C., Lu T., Chen Z., Men X., Wang Y., Wang G., Zhen B., Qin J. Urine proteome profiling predicts lung cancer from control cases and other tumors // EBioMedicine. 2018. V. 30. P. 120.
Janssens E., Meerbeeck J. P., Lamote K. Volatile organic compounds in human matrices as lung cancer biomarkers: A systematic review // Crit. Rev. Oncol. Hematol. 2020. V. 153. Article 103037.
Hayes S.A., Haefliger S., Harris B., Pavlakis N., Clarke S.J., Molloy M.P., Howell V.M. Exhaled breath condensate for lung cancer protein analysis: A review of methods and biomarkers // J. Breath Res. 2016. V. 10. № 3. Article 034001.
Nardi-Agmon I., Abud-Hawa M., Liran O., Gai-Mor N., Ilouze M., Onn A., Bar J., Shlomi D., Haick H., Peled N. Exhaled breath analysis for monitoring response to treatment in advanced lung cancer // J. Thorac. Oncol. 2016. V. 11. № 6. P. 827.
Antoniou S.X., Gaude E., Ruparel M., Schee M.P., Janes S.M., Rintoul R.C. The potential of breath analysis to improve outcome for patients with lung cancer // J. Breath Res. 2019. V. 13. № 3. Article 034002.
Dent A.G., Sutedja T.G., Zimmerman P.V. Exhaled breath analysis for lung cancer // J. Thorac. Dis. 2013. V. 5. № 11. P. 2072.
Marzorati D., Mainardi L., Sedda G., Gasparri R., Spaggiari L., Cerveri P. A review of exhaled breath key role in lung cancer diagnosis // J. Breath Res. 2019. V. 13. № 3. Article 034001.
Ratiu I.A., Ligor T., Bocos-Bintintan V., Mayhew C.A., Buszewski B. Volatile organic compounds in exhaled breath as fingerprints of lung cancer, asthma and COPD // J. Clin. Med. 2020. V. 10. № 1. P. 32.
Costello B.L., Amann A., Al-Kateb H., Flynn C., Filipiak W., Khalid T., Osborne D., Ratcliffe N.M. A review of the volatiles from the healthy human body // J. Breath Res. 2014. V. 8. № 1. Article 014001.
Buszewski B., Kesy M., Ligor T., Amann A. Human exhaled air analytics: Biomarkers of diseases // Biomed. Chromatogr. 2007. V. 21. № 6. P. 553.
Tang Y., Li Z., Lazar L., Fang Z., Tang C., Zhao J. Metabolomics workflow for lung cancer: Discovery of biomarkers // Clin. Chim. Acta. 2019. V. 495. P. 436.
Hakim M., Broza Y. Y., Barash O., Peled N., Phillips M., Amann A., Haick H. Volatile organic compounds of lung cancer and possible biochemical pathways // Chem. Rev. 2012. V. 112. № 11. P. 5949.
Preti G., Labows J.N., Kostelc J.G., Aldinger S. Daniele R. Analysis of lung air from patients with bronchogenic carcinoma and controls using gas chromatography-mass spectrometry // J. Chromatogr. B: Biomed. Sci. App. 1988. V. 432. P. 1.
Phillips M., Gleeson K., Hughes J.M.B., Greenberg J., Cataneo R.N., Baker L., McVay W.P. Volatile organic compounds in breath as markers of lung cancer: A cross-sectional study // Early Report. 1999. V. 353. № 9168. P. 1930.
Rudnicka J., Walczak M., Kowalkowski T., Jezierski T., Buszewski B. Determination of volatile organic compounds as potential markers of lung cancer by gas chromatography-mass spectrometry versus trained dogs // Sens. Actuator B. 2014. V. 202. P. 615.
Ulanowska A., Kowalkowski T., Trawińska E., Buszewski B. The application of statistical methods using VOCs to identify patients with lung cancer // J. Breath Res. 2011. V. 5. № 4. Article 046008.
Poli D., Carbognani P., Corradi M., Goldoni M., Acampa O., Balbi B., Bianchi L., Rusca M., Mutti A. Exhaled volatile organic compounds in patients with non-small cell lung cancer: Cross sectional and nested short-term follow-up study // Respir. Res. 2005. V. 6. № 1. P. 71.
Rudnicka J., Kowalkowski T., Ligor T., Buszewski B. Determination of volatile organic compounds as biomarkers of lung cancer by SPME–GC–TOF/MS and chemometrics // J. Chromatogr. B. 2011. V. 879. № 30. P. 3360.
Fuchs P., Loeseken C., Schubert J.K., Miekisch W. Breath gas aldehydes as biomarkers of lung cancer // Int. J. Cancer. 2009. V. 126. P. 2663.
Poli D., Goldoni M., Corradi M., Acampa O., Carbognani P., Internullo E., Casalini A., Mutti A. Determination of aldehydes in exhaled breath of patients with lung cancer by means of on-fiber-derivatisation SPME-GH/MS // J. Chromatogr. B. 2010. V. 878. № 27. P. 2643.
Buszewski B., Ligor T., Jezierski T., Wenda-Piesik A., Walczak M., Rudnicka J. Identification of volatile lung cancer markers by gas chromatography–mass spectrometry: Comparison with discrimination by canines // Anal. Bioanal. Chem. 2012. V. 404. № 1. P. 141.
Ligor T., Ligor M., Amann A., Ager C., Bachler M., Dzien A., Buszewski B. The analysis of healthy volunteers’ exhaled breath by the use of solid-phase microextraction and GC-MS // J. Breath Res. 2008. V. 2. № 4. Article 046006.
Ligor T., Pater L., Buszewski B. Application of an artificial neural network model for selection of potential lung cancer biomarkers // J. Breath Res. 2015. V. 9. № 2. Article 027106.
Song G., Qin T., Liu H., Xu G.B., Pan Y.Y., Xiong F.X., Gu K.S., Sun G.P., Chen Z.D. Quantitative breath analysis of volatile organic compounds of lung cancer patients // Lung Cancer. 2010. V. 67. № 2. P. 227.
Miekisch W., Kischkel S., Sawacki A., Liebau T., Mieth M., Schubert J. K. Impact of sampling procedures on the results of breath analysis // J. Breath Res. 2008. V. 2. № 2. Article 026007.
Velde S., Quirynen M., Hee P., Steenberghe D. Differences between alveolar air and mouth air // Anal. Chem. 2007. V. 79. № 9. P. 3425.
Dragonieri S., Annema J.T., Schot R., Schee M.P.C., Spanevello A., Carratu P., Resta O., Rabe K.F., Sterk P.J. An Electronic nose in the discrimination of patients with non-small cell lung cancer and COPD // Lung Cancer. 2009. V. 64. № 2. P. 166.
O’Hara M.E., O’Hehir S., Green S., Mayhew C.A. Development of a protocol to measure volatile organic compounds in human breath: A comparison of rebreathing and on-line single exhalations using proton transfer reaction mass spectrometry // Physiol. Meas. 2008. V. 29. № 3. P. 309.
Steeghs M.M.L., Cristescu S.M., Harren F.J.M. The suitability of tedlar bags for breath sampling in medical diagnostic research // Physiol. Meas. 2007. V. 28. № 1. P. 73.
Gashimova E., Temerdashev A., Porkhanov V., Polyakov I., Perunov D., Azaryan A., Dmitrieva E. Investigation of different approaches for exhaled breath and tumor tissue analyses to identify lung cancer biomarkers // Helyion. 2020. V. 6. № 6. Article e04224.
Pesesse R., Stefanuto P.H., Schleich F., Louis R., Focant J.F. Multimodal chemometric approach for the analysis of human exhaled breath in lung cancer patients by TD-GC × GC-TOFMS // J. Chromatogr. B. 2019. V. 1114–1115. P. 146.
Горбунов И.С., Губаль А.Р., Ганеев А.А., Родинков О.В., Карцова Л.А., Бессонова Е.А., Арсеньев А.И., Нефедов А.О., Краева Л.А. Оптимизация условий анализа выдыхаемого воздуха методом газовой хроматографии–масс-спектрометрии для целей неинвазивной диагностики рака легких // Журн. аналит. химии. 2019. Т. 74. № 11. С. 870.
Tsou P.H., Lin Z.L., Pan Y.C., Yang H.C., Chang C.J., Liang S.K., Wen Y.F., Chang C.H., Chang L.Y., Yu K.L., Liu C.J., Keng L.T., Lee M. R., Ko J.C., Huang G.H., Li Y.K. Exploring volatile organic compounds in breath for high-accuracy prediction of lung cancer // Cancers. 2021. V. 13. № 6. P. 1431.
Gasparri R., Santonico M., Valentini C., Sedda G., Borri A., Petrella F., Maisonneuve P., Pennazza G., D’Amico A., Natale C.D., Paolesse R., Spaggiari L. Volatile signature for the early diagnosis of lung cancer // J. Breath Res. 2016. V. 10. № 1. Article 016007.
Wang Y., Hu Y., Wang D., Yu K., Wang L., Zou Y., Zhao C., Zhang X., Wang P., Ying K. The analysis of volatile organic compounds biomarkers for lung cancer in exhaled breath, tissues and cell lines // Cancer Biomark. 2012. V. 11. № 4. P. 129.
Saidi T., Moufid M., Beleño-Saenz K.J., Welearegay T.G., Bari N.E., Jaimes-Mogollon A.L., Ionescu R., Bourkadi J.E., Benamor J., Ftouh M.E., Bouchikhi B. Non-invasive prediction of lung cancer histological types through exhaled breath analysis by UV-irradiated electronic nose and GC/QTOF/MS // Sens. Actuators B: Chem. 2020. V. 311. Article 127932.
Wang C., Long Y., Li W., Dai W., Xie S., Liu Y., Zhang Y., Liu M., Tian Y., Li Q., Duan Y. Exploratory study on classification of lung cancer subtypes through a combined k-nearest neighbor classifier in breathomics // Sci. Rep. 2020. V. 10. № 1. P. 5880.
Callol-Sanchez L., Munoz-Lucas M. A., Gomez-Martin O., Maldonado-Sanz J.A., Civera-Tejuca C., Gutierrez-Ortega C., Rodriguez-Trigo G., Jareno-Esteban J. Observation of nonanoic acid and aldehydes in exhaled breath of patients with lung cancer // J. Breath Res. 2017. V. 11. № 2. Article 026004.
Rudnickaa J., Kowalkowskia T., Buszewski B. Searching for selected VOCs in human breath samples as potential markers of lung cancer // Lung Cancer. 2019. V. 135. P. 123.
Mazzone P.J., Wang X.F., Lim S., Jett J., Choi H., Zhang Q., Beukemann M., Seeley M., Martino R., Rhodes P. Progress in the development of volatile exhaled breath signatures of lung cancer // Ann. Am. Thorac. Soc. 2015. V. 12. № 5. P. 752.
Phillips M. Method for the collection and assay of volatile organic compounds in breath // Anal. Biochem. 1997. V. 247. № 2. P. 272.
Wang M., Sheng J., Wu Q., Zou Y., Hu Y., Ying K., Wan H., Wang P. Confounding effect of benign pulmonary diseases in selecting volatile organic compounds as markers of lung cancer // J. Breath Res. 2018. V. 12. № 4. Article 046013.
Phillips M., Bauer T.L., Cataneo R.N., Lebauer C., Mundada M., Pass H.I., Ramakrishna N., Rom W.N., Vallieres E. Blinded validation of breath biomarkers of lung cancer, a potential ancillary to chest ct screening // PLoS One. 2015. V. 10. № 12. Article e0142484.
Zou Y., Wang Y., Jiang Z., Zhou Y., Chen Y., Hu Y., Jiang G., Xie D. Breath profile as composite biomarkers for lung cancer diagnosis // Lung Cancer. 2021. V. 154. P. 206.
Zou Y., Zhang X., Chen X., Hu Y., Ying K., Wang P. Optimization of volatile markers of lung cancer to exclude interferences of non-malignant disease // Cancer Biomark. 2014. V. 14. № 5. P. 371.
Jouyban A., Djozan D., Mohammadandashti P., Alizadeh-Nabil A., Ghorbanpour H., Khoubnasabjafari M., Mohammadzadeh M. Co-liquefaction with acetone and GC analysis of volatile compounds in exhaled breath as lung cancer biomarkers // BioImpacts. 2017. V. 7. № 2. P. 99.
Phillips M., Cataneo R.N., Cummin A.R.C., Gagliardi A.J., Gleeson K., Greenberg J., Maxfield R.A., Rom W.N. Detection of lung cancer with volatile markers in the breath // Chest. 2003. V. 123. № 6. P. 2115.
Phillips M., Altorki N., Austin J.H., Cameron R.B., Cataneo R.N., Greenberg J., Kloss R., Maxfield R.A., Munawar M.I., Pass H.I., Rashid A., Rom W.N., Schmitt P. Prediction of lung cancer using volatile biomarkers in breath // Cancer Biomark. 2007. V. 3. № 2. P. 95.
Schallschmidt K., Becker R., Jung C., Bremser W., Walles T., Neudecker J., Leschber G., Frese S., Nehls I. Comparison of volatile organic compounds from lung cancer patients and healthy controls—Challenges and limitations of an observational study // J. Breath Res. 2016. V. 10. № 4. Article 046007.
Broza Y.Y., Kremer R., Tisch U., Gevorkyan A., Shiban A., Best L.A., Haick H.A. Nanomaterial-based breath test for short-term follow-up after lung tumor resection // Nanomedicine: Nanotechnol. Biol. Med. 2013. V. 9. № 1. P. 15.
Peled N., Hakim M., Bunn P.A., Miller Y.E., Kennedy T.C., Mattei J., Mitchell J.D., Hirsch F.R., Haick H. Non-invasive breath analysis of pulmonary nodules // J. Thorac. Oncol. 2012. V. 7. № 10. P. 1528.
Garcia R.A., Morales V., Martin S., Vilches E., Toledano A. Volatile organic compounds analysis in breath air in healthy volunteers and patients suffering epidermoid laryngeal carcinomas // Chromatographia. 2014. V. 77. № 5-6. P. 501.
Filipiak W., Filipiak A., Sponring A., Schmid T., Zelger B., Ager C., Klodzinska E., Denz H., Pizzini A., Lucciarini P., Jamnig H., Troppmair J., Amann A. Comparative analyses of volatile organic compounds (VOCs) from patients, tumors and transformed cell lines for the validation of lung cancer-derived breath markers // J. Breath Res. 2014. V. 8. № 2. Article 027111.
Svensson S., Larstad M., Broo K., Olin A. Determination of aldehydes in human breath by on-fibre derivatization, solid-phase microextraction and GC–MS // J. Chromatogr. B. 2007. V. 860. № 1. P. 86.
Fu X., Li M., Biswas S., Nantz M.H., Higashi R.M. A Novel microreactor approach for analysis of ketones and aldehydes in breath // The Analyst. 2011. V. 136. № 22. P. 4662.
Fu X., Li M., Knipp R.J., Nantz M.H., Bousamra M. Noninvasive detection of lung cancer using exhaled breath // Cancer Med. 2014 V. 3. № 1. P. 174. https://doi.org/10.1002/cam4.162
Yu L.Q., Wang L.Y., Su F.H., Hao P.Y., Wang H., Lv Y.K. A gate-opening controlled metal-organic framework for selective solid-phase microextraction of aldehydes from exhaled breath of lung cancer patients // Microchim. Acta. 2018. V. 185. № 6. P. 307.
Wang W., Yu Y, Zhang X., Tong X. Laboratory analytical methods applied in the early detection of cancers by tumor biomarker // Anal. Methods. 2017. V. 9. № 21. P. 3085.
Phillips M., Altorki N., Austin J.H.M., Cameron R.B., Cataneo R.N., Kloss R., Maxfield R.A., Munawar M.I., Pass H.I., Rashid A., Romi W.N., Schmitt P., Wai J. Detection of lung cancer using weighted digital analysis of breath biomarkers // Clin. Chim Acta. 2008. V. 393 № 2. P. 76.
Koureas M., Kirgou P., Amoutzias G., Hadjichristodoulou C., Gourgoulianis K., Tsakalof A. Target analysis of volatile organic compounds in exhaled breath for lung cancer discrimination from other pulmonary diseases and healthy persons // Metabolites. 2020. V. 10. № 8. P. 317.
Bajtarevic A., Ager C., Pienz M., Klieber M., Schwar K., Ligor M., Ligor T., Filipiak W., Denz H., Fieg M., Hilbe W., Weiss W., Lukas P., Jamnig H., Hack M., Haidenberger A., Buszewski B., Miekisch W., Schubert J., Amann A. Noninvasive detection of lung cancer by analysis of exhaled breath // BMC Cancer. 2009. V. 9. Article 348.
Handa H., Usuba A., Maddula S., Baumbach J.I., Mineshita M., Miyazawa T. Exhaled breath analysis for lung cancer detection using ion mobility spectrometry // PLoS One. 2014. V. 9. № 12. Article e114555.
Pleil J.D., Hansel A., Beauchamp J. Advances in proton transfer reaction mass spectrometry (PTR-MS): Applications in exhaled breath analysis, food science, and atmospheric chemistry // J. Breath Res. 2019. V. 13. № 3. Article 039002.
Spanel P., Smith D. Progress in SIFT-MS: Breath analysis and other applications // Mass Spectrom. Rev. 2011. V. 30. № 2. P. 236.
Hashoul D., Haick H. Sensors for detecting pulmonary diseases from exhaled breath // Eur. Respir. Rev. 2019. V. 28. № 152. Articles 190011.
Khanmohammadi A., Aghaie A., Vahedi E., Qazvini A., Ghanei M., Afkhami A., Hajian A., Bagheri H. Electrochemical biosensors for the detection of lung cancer biomarkers: A Review Talanta // 2020. V. 206. Article 120251.
Shirasu M., Touhara K. Every breath you take: The value of the electronic nose (e-nose) technology in the early detection of lung cancer // J. Thorac. Cardiovasc. Surg. 2018. V. 155. № 6. P. 2622.
Kort S., Brusse-Keizer M., Gerritsen J. W., Schouwink H., Citgez E., Jongh F. Maten J., Samii S., Bogart M., Palen J. Improving lung cancer diagnosis by combining exhaled-breath data and clinical parameters // ERJ Open Res. 2020. V. 6. № 1. P. 00221.
Goor R., Hooren M., Dingemans A.M., Kremer B., Kross K. Training and validating a portable electronic nose for lung cancer screening // J. Thorac. Oncol. 2018. V. 13. № 5. P. 676.
Kononov A., Korotetsky B., Jahatspanian I., Gubal A., Vasiliev A., Arsenjev A., Nefedov A., Barchuk A., Gorbunov I., Kozyrev K., Rassadina A., Iakovleva E., Sillanpaa M., Safaei Z., Ivanenko N., Stolyarova N., Chuchina V., Ganeev A. Online breath analysis using metal oxide semiconductor sensors (electronic nose) for diagnosis of lung cancer // J. Breath Res. 2019. V. 14. № 1. Article 016004.
Chang J., Lee D., Ban S., Oh J., Jung M.Y., Kim S., Park S., Persaud K., Jheon S. Analysis of volatile organic compounds in exhaled breath for lung cancer diagnosis using a sensor system // Sens. Actuators B: Chem. 2018. V. 255. № 1. P. 800.
Nardi-Agmon I., Abud-Hawa M., Liran O., Gai-Mor N., Ilouze M., Onn A., Bar J., Shlomi D., Haick H., Peled N. Exhaled breath analysis for monitoring response to treatment in advanced lung cancer // J. Thorac. Oncol. 2016. V. 11. № 6. P. 827.
Rodriguez-Aguilar M., Diaz de Leon-Martinez L., Gorocica-Rosete P., Perez-Padilla R., Dominguez-Reyes C.A., Tenorio-Torres J.A., Ornelas-Rebolledo O., Mehta G., Zamora-Mendoza B.N., Flores-Ramirez R. Application of chemoresistive gas sensors and chemometric analysis to differentiate the fingerprints of global volatile organic compounds from diseases. Preliminary results of COPD, lung cancer and breast cancer // Clin. Chim. Acta. 2021. V. 518. P. 83.
Hubers A.J., Brinkman P., Boksem R.J., Rhodius R.J., Witte B.I., Zwinderman A.H., Heideman D.A.M., Duin S., Koning R., Steenbergen R.D.M., Snijders P.J.F., Smit E.F., Sterk P.J., Thunnissen E. Combined sputum hypermethylation and enose analysis for lung cancer diagnosis // J. Clin. Pathol. 2014. V. 67. № 8. P. 707.
Tirzite M., Bukovskis M., Strazda G., Jurka N., Taivans I. Detection of lung cancer with electronic nose and logistic regression analysis // J. Breath Res. 2018. V. 13. № 1. Article 016006.
Natale C., Macagnano A., Martinelli E., Paolesse R., D’Arcangelo G., Roscioni C., Finazzi-Agro A., D’Amico A. Lung cancer identification by the analysis of breath by means of an array of non-selective gas sensors // Biosens. Bioelectron. 2003. V. 18. № 10. P. 1209.
D’Amicoa A., Pennazzab G., Santonicoa M., Martinellia E., Roscionic C., Galluccioc G., Paolessed R., Natalea C.D. An investigation on electronic nose diagnosis of lung cancer // Lung Cancer. 2010. V. 68. № 2. P. 170.
Zhong X., Li D.; Du, W., Yan M., Wang Y., Huo D., Hou C. Rapid recognition of volatile organic compounds with colorimetric sensor arrays for lung cancer screening // Anal. Bioanal. Chem. 2018. V. 410. № 16. P. 3671.
Mazzone P.J., Wang X.F., Xu Y., Mekhail T., Beukemann M.C., Na J., Kemling J.W., Suslick K.S., Sasid-har M. Exhaled breath analysis with a colorimetric sensor array for the identification and characterization of lung cancer // J. Thorac. Oncol. 2012. V. 7. № 1. P. 137.
Li W., Liu H., Xie D., He Z., Pi X. Lung cancer screening based on type-different sensor arrays // Sci. Rep. 2017. V. 7. № 1. Article 1969.
Liu B., Yu H., Zeng X., Zhang D., Gong J., Tian L., Qian J., Zhao L., Zhang S., Liu R. Lung cancer detection via breath by electronic nose enhanced with a sparse group feature selection approach // Sens. Actuators B: Chem. 2021. V. 339. Article 129896.
Ligor M., Ligor T., Bajtarevic A., Ager C., Pienz M., Klieber M., Denz H., Fiegl M., Hilbe W., Weiss W., Lukas P., Jamnig H., Hackl M., Buszewski B., Miekisch W., Schubert J., Amann A. Determination of volatile organic compounds in exhaled breath of patients with lung cancer using solid phase microextraction and gas chromatography mass spectrometry // J. Clin. Chem. Lab. Med. 2009. V. 47. № 5. P. 550.
Corradi M., Poli D., Banda I., Bonini S., Mozzoni P., Pinelli S., Alinovi R., Andreoli R., Ampollini L., Casalini A., Carbognani P., Goldoni M., Mutti A. Exhaled breath analysis in suspected cases of non-small-cell lung cancer: A cross-sectional study // J. Breath Res. 2015. V. 9. № 2. Article 027101.
Bousamra M., Schumer E., Li M., Knipp R.J., Nantz M.H., Berkel V., Fu X.A. Quantitative analysis of exhaled carbonyl compounds distinguishes benign from malignant pulmonary disease // J. Thorac. Cardiovasc. Surg. 2014. V. 148. № 3. P. 1074.
Fu X., Li M., Knipp R.J., Nantz M.H., Bousamra M. Noninvasive detection of lung cancer using exhaled breath // Cancer Med. 2014. V. 3. № 1. P. 174.
Sakumura Y., Koyama Y., Tokutake H., Hida T., Sato K., Itoh T., Akamatsu T., Shin W. Diagnosis by volatile organic compounds in exhaled breath from lung cancer patients using support vector machine algorithm // Sensors. 2017. V. 17. № 287. Article 287.
Meng S., Li Q., Zhou Z., Li H., Liu X., Pan S., Li M., Wang L., Guo Y., Qiu M., Wang J. Assessment of an exhaled breath test using high-pressure photon ionization time-of-flight mass spectrometry to detect lung cancer // JAMA Netw. Open. 2021. V. 4. № 3. Article e213486.
Westhoff M., Litterst P., Freitag L., Urfer W., Bader S., Baumbach J.I. Ion mobility spectrometry for the detection of volatile organic compounds in exhaled breath of patients with lung cancer: Results of a pilot study // Thorax. 2009. V. 64. № 9. P. 744.
Lamote K., Vynck M., Thas O., Cleemput J., Nackaerts K., Meerbeeck J.P. Exhaled breath to screen for malignant pleural mesothelioma: A validation study // Eur. Respir. J. 2017. V. 50. № 6. Article 1700919.
Wehinger A., Schmid A., Mechtcheriakov S., Ledochowski M., Grabmer C., Gastl G.A., Amann A. Lung cancer detection by proton transfer reaction mass-spectrometric analysis of human breath gas // Int. J. Mass Spectrom. 2007. V. 265. P. 49.
Sun Y., Chen Y., Sun C., Liu H., Wang Y., Jiang X. Analysis of volatile organic compounds from patients and cell lines for the validation of lung cancer biomarkers by proton-transfer-reaction mass spectrometry // Anal. Methods. 2019. V. 11. P. 3188.
Tirzite M., Bukovskis M., Strazda G., Jurka N., Taivans I. Detection of lung cancer in exhaled breath with an electronic nose using support vector machine analysis // J. Breath Res. 2017. V. 11. № 3. Article 036009.
Chang J.E., Lee D.S., Ban S.W., Oh J., Jung M.Y., Kim S.H., Park S.J., Persaud K., Jheon S. Analysis of volatile organic compounds in exhaled breath for lung cancer diagnosis using a sensor system // Sens. Actuators B: Chem. 2018. V. 255. P. 800.
Gashimova E., Osipova A., Temerdashev A., Porkhanov V., Polyakov I., Perunov D., Dmitrieva E. Exhaled breath analysis using GC-MS and an electronic nose for lung cancer diagnostics // Anal Methods. 2021. V. 13. P. 4793.
Rocco R., Incalzi R.A., Pennazza G., Santonico M., Pedone C., Bartoli I.R., Vernile C, Mangiameli G., La Rocca A., De Luca G., Rocco G., Crucitti P. BIONOTE E-nose technology may reduce false positives in lung cancer screening programmes // Eur. J. Cardiothorac. Surg. 2016. V. 49. № 4. P. 1112.
Peng G., Hakim M., Broza Y.Y., Billan S., Abdah-Bortnyak R., Kuten A., Tisch U., Haick H. Detection of lung, breast, colorectal, and prostate cancers from exhaled breath using a single array of nanosensors // Br. J. Cancer 2010. V. 103. № 4. P. 542.
Mazzone P. J., Hammel J., Dweik R., Na J., Czich C., Laskowski D., Mekhail T. Diagnosis of lung cancer by the analysis of exhaled breath with a colorimetric sensor array // Thorax. 2007. V. 62. № 7. P. 565.
Kort S., Tiggeloven M.M., Brusse-Keizer M., Gerritsen J.W., Schouwink J.H., Citgez E., Jongh F.H.C., Samii S., Maten J., Bogart M., Palen J. Multi-centre prospective study on diagnosing subtypes of lung cancer by exhaled-breath analysis // Lung Cancer. 2018. V. 125. P. 223.
Gashimova E., Temerdashev A., Porkhanov V., Polyakov I., Perunov D., Osipova A., Dmitrieva E. Assessment of a possibility to differentiate the tumor histological type and localization in patients with lung cancer by the composition of exhaled air // J. Anal. Chem. 2021. V. 76. № 8. P. 975.
Chen X., Xu F., Wang Y., Pan Y., Lu D., Wang P., Ying K., Chen E., Zhang W. A study of the volatile organic compounds exhaled by lung cancer cells in vitro for breath diagnosis // Cancer. 2007. V. 110. № 4. P. 835.
Bianchi F., Riboni N., Carbognani P., Gnetti L., Dalcanale E., Ampollini L., Careri M. Solid-phase microextraction coupled to gas chromatography–mass spectrometry followed by multivariate data analysis for the identification of volatile organic compounds as possible biomarkers in lung cancer tissues // J. Pharm. Biomed. Anal. 2017. V. 146. P. 329.
Barash J., Peled N., Tisch U., Bunn P.A. Jr, Hirsch F.R., Haick H. Classification of lung cancer histology by gold nanoparticle sensors // Nanomedicine. 2012. V. 8. № 5. P. 580.
Lamote K., Vynck M., Thas O., Cleemput J., Nackaerts, K., Meerbeeck J.P. Exhaled breath to screen for malignant pleural mesothelioma: A validation study // Eur. Respir. J. 2017. V. 50. № 6. Article 1700919.
Buszewski B., Ulanowska A., Ligor T., Denderza N., Amann A. Analysis of exhaled breath from smokers, passive smokers and non-smokers by solid phase mi-croextraction gas chromatography mass spectrometry // Biomed. Chromatogr. 2008. V. 23. P. 551.
Filipiak W., Ruzsanyi V., Mochalski P., Filipiak A., Bajtarevic A., Ager C., Denz H., Hilbe W., Jamnig H., Hack M., Dzien A., Amann A. Dependence of exhaled breath composition on exogenous factors smoking habits and exposure to air pollutants // J. Breath Res. 2012. V. 6. № 3. Article 036008.
Chen X., Wang F., Lin L., Dong H., Huang F., Muhammad K.G., Chen L., Gorlova O.Y. Association of smoking with metabolic volatile organic compounds in exhaled breath // Int. J. Mol. Sci. 2017. V. 18. № 11. P. 2235.
Papaefstathiou E., Stylianou M., Andreou C., Agapiou A. Breath analysis of smokers, non-smokers, and e-cigarette users // J. Chromatogr. B. 2020. V. 1160. Article 122349.
Blanchet L.; Smolinska A., Baranska A., Tigchelaar E., Swertz M., Zhernakova A., Dallinga J. W., Wijmenga C., Schooten F.J. Factors that influence the volatile organic compound content in human breath // J. Breath Res. 2017. V. 11. № 1. Article 016013.
Spanel P., Dryahina K., Rejskova A., Chippendale T.W.E., Smith D. Breath acetone concentration; biological variability and the influence of diet // Physiol. Meas. 2011. V. 32. № 8. P. N23.
Raninen K.J., Lappi J.E., Mukkala M.L., Tuomainen T., Mykkanen H.M., Poutanen K.S., Raatikainen O.J. Fiber content of diet affects exhaled breath volatiles in fasting and postprandial state in a pilot crossover study // Nutr. Res. 2016. V. 36. № 6. P. 612.
Aghdassi E., Allard J.P. Breath alkanes as a marker of oxidative stress in different clinical conditions // Free Radic. Biol. Med. 2000. V. 36. № 6. P. 612.
Phillips M., Cataneo R.N., Greenberg J., Gunawardena R., Naidu A., Rahbari-Oskoui F. Effect of age on the breath methylated alkane contour, a display of apparent new markers of oxidative stress // J. Lab. Clin. Med. 2000. V. 136. № 3. P. 243.
Lechner M., Moser B., Niederseer D., Karlseder A., Holzknecht B., Fuchs M., Colvin S., Tilg H., Rieder J. Gender and age specific differences in exhaled isoprene levels // Respir. Physiol. Neurobiol. 2006. V. 154. № 3. P. 478.
Gashimova E., Osipova A., Temerdashev A., Porkhanov V., Polyakov I., Perunov D., Dmitrieva E. Study of confounding factors influence on lung cancer diagnostics effectiveness using gas chromatography–mass spectrometry analysis of exhaled breath // Biomark. Med. 2021. V. 15. № 11. P. 821.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


