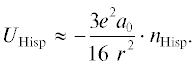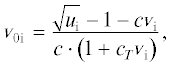Журнал аналитической химии, 2022, T. 77, № 7, стр. 658-667
Карта селективности неподвижных фаз – графический метод систематизации и поиска условий для газохроматографического разделения полярных веществ
Е. А. Зайцева a, *, А. М. Долгоносов a
a Институт геохимии и аналитической химии им. В.И. Вернадского Российской академии наук
119991 Москва, ул. Косыгина, 19, Россия
* E-mail: lil-dante@mail.ru
Поступила в редакцию 22.06.2021
После доработки 24.09.2021
Принята к публикации 24.09.2021
- EDN: IWZNBU
- DOI: 10.31857/S0044450222070131
Аннотация
На основании теоретического описания селективности жидких фаз методом трехпараметрической характеристики предложен графический способ классификации фаз в газовой хроматографии в виде карты селективности, представляющей собой двумерную диаграмму в координатах полярность−гидрофильность. В методе трехпараметрической характеристики используется выражение энергии межмолекулярного взаимодействия через вклады неполярных, полярных и водородных связей в асимптотическом приближении, полученном с помощью теории обобщенных зарядов и нового квантовомеханического представления об энергии и вероятности образования водородной связи. Достоинством способа является то, что параметры, используемые в математических выражениях, имеют физический смысл, переносимы и могут быть найдены без проведения экспериментов. Выявлены связи между характеристиками неподвижных фаз и их структурой. Карта селективности как способ классификации позволяет рассматривать газохроматографические жидкие неподвижные фазы в диапазоне от низкополярных/низкогидрофильных до высокополярных/высокогидрофильных фаз. С другой стороны, применение принципа подобия свойств в сочетании с картой селективности позволяет выбрать наиболее селективную фазу к заданным аналитам. Этот выбор может быть сделан априори – без проведения экспериментов. Дан пример выбора селективной неподвижной фазы для разделения близких по свойствам веществ с помощью карты селективности.
С каждым новым этапом развития газовая хроматография (ГХ) сталкивается со все более сложными случаями анализа трудноразделимых смесей. Например, современный метод хромато-масс-спектрометрии испытывает серьезные трудности при анализе смесей изомеров [1, 2]. Эффективной мерой в решении подобных задач является улучшение разделения за счет повышения селективности неподвижной фазы (НФ), используемой в разделяющей колонке.
В настоящее время существует множество НФ, синтезированных под различные аналитические задачи. В связи с этим на первый план выходит выбор НФ из уже имеющихся, а трудоемкий синтез новых фаз становится менее актуальным. При этом возникает необходимость точной классификации существующих фаз.
Широко известны и активно применяются многопараметрические методы Роршнайдера, МакРейнольдса [3–6] и Абрахама [7, 8] для классификации фаз по индексам Ковача, получаемым с помощью специальных хроматографических экспериментов; в противоположность им существуют одномерные схемы гидрофобно-гидрофильного баланса [9], где единственный параметр гидрофобности фазы определяется в экспериментальной системе октанол–вода. Однако статистический анализ большого массива данных, проведенный в работе [10], показал, что для сравнения селективности полярных фаз необходимо и достаточно двух независимых параметров; отмечена избыточность многопараметрических схем и недостаточность одномерных схем классификации. Недостатками существующих методов классификации НФ являются их эмпиричность и трудоемкость, а также слабая предсказательная способность, невозможность предсказания характеристик фаз по строению. Избежать указанных недостатков, очевидно, возможно с помощью теории межмолекулярных взаимодействий (ММВ). Отсутствие такого подхода объясняется сложностью задачи для существующих неэмпирических методов и грубостью применяемых полуэмпирических методов.
Авторы настоящей статьи развивают теоретические представления о ММВ общего типа, которые положены в основу метода трехпараметрической характеристики (ТПХ) [11–17]. Модель базируется на теории обобщенных зарядов (ТОЗ) [18], которая представляет собой квантово-статистический неэмпирический подход для описания межатомных взаимодействий; в частности, ТОЗ была успешно применена для расчета адсорбции неполярных веществ [19, 20]. В качестве следствия метода ТПХ в настоящей статье представлен новый графический способ классификации НФ – карта селективности.
Цели статьи − расчет положения на карте селективности множества НФ, принадлежащих к различным группам, и применение карты селективности для повышения селективности газовой хроматографии, в частности, при разделении изомеров полярных веществ.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Основные положения модели межмолекулярных взаимодействий и метода трехпараметрической характеристики. Выражение общего вида для полной энергии сорбции молекулы на НФ, содержащее три независимых вклада энергии [11–14]:
(1)
$U = {{U}_{{{\text{np}}}}}({{Q}_{{\text{i}}}},{{Q}_{{{\text{sp}}}}},r) + {{U}_{{{\text{dp}}}}}(\mu _{{\text{i}}}^{2},\mu _{{{\text{sp}}}}^{2},r) + {{n}_{{\text{H}}}}{{E}_{{\text{H}}}}(r),$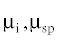 – дипольные моменты аналита i и НФ, r – расстояние между центрами молекул аналита и поверхности неподвижной фазы.
– дипольные моменты аналита i и НФ, r – расстояние между центрами молекул аналита и поверхности неподвижной фазы.
Компоненты выражения (1) для полной энергии межмолекулярного взаимодействия:
1. Энергия неполярного взаимодействия, выведенная в ТОЗ в виде потенциала типа Леннарда– Джонса с теоретическими коэффициентами [18]:
(2)
$\begin{gathered} {{U}_{{{\text{np}}}}}\left( r \right) = {{Q}_{{\text{i}}}}{{Q}_{{{\text{sp}}}}}{{u}_{b}}\left( r \right); \\ {{u}_{b}}\left( r \right) = \frac{{{{e}^{2}}}}{{{{a}_{0}}}}\left[ {1.938 \times {{{10}}^{5}}{{{\left( {{r \mathord{\left/ {\vphantom {r {{{a}_{0}}}}} \right. \kern-0em} {{{a}_{0}}}}} \right)}}^{{ - 12}}} - 5.115{{{\left( {{r \mathord{\left/ {\vphantom {r {{{a}_{0}}}}} \right. \kern-0em} {{{a}_{0}}}}} \right)}}^{{ - 6}}}} \right], \\ \end{gathered} $2. Энергия полярного взаимодействия, которая для случая аморфной среды выражается как сумма ориентационного взаимодействия Рейнганума–Кеезома [21, 22] и индукционного взаимодействия Дебая–Фалькенхагена [23, 24]:
(3)
${{U}_{{{\text{dp}}}}} = {{U}_{{{\text{or}}}}} + {{U}_{{{\text{ind}}}}} = - \,\left( {\frac{{2{{\mu }}_{{\text{1}}}^{{\text{2}}}{{\mu }}_{{\text{2}}}^{{\text{2}}}}}{{3{{k}_{b}}T}} + {{{{\alpha }}}_{{{\text{sp}}}}}{{\mu }}_{{\text{i}}}^{{\text{2}}} + {{{{\alpha }}}_{{\text{i}}}}{{\mu }}_{{{\text{sp}}}}^{{\text{2}}}} \right)\,{{r}_{{}}}^{{ - 6}},$3. Энергия водородной связи в виде произведения квантовомеханической оценки нижнего предела энергии Н-связи и вероятности ее образования [21–26]:
Вероятностный характер процесса образования Н-связи обусловлен узкой направленностью связи, что отражается на потенциальной функции ММВ в виде узкого “колодца”. Искомая вероятность выражается через отношение размеров колодца и связываемых молекул. При оценке геометрических величин учтена пропорциональность ОЗ площади проекции молекулярного фрагмента на плоскость, разделяющую молекулы [27].
(5)
${{n}_{{{\text{Hisp}}}}} = \frac{{\sqrt {{{Q}_{{{\text{(a)i}}}}}\,{{Q}_{{{\text{(d)sp}}}}}} + \sqrt {{{Q}_{{{\text{(d)sp}}}}}\,{{Q}_{{{\text{(a)sp}}}}}} }}{{2{{{\left( {{{Q}_{{{\text{(a)i}}}}}\,{{Q}_{{{\text{(d)i}}}}}} \right)}}^{{{1 \mathord{\left/ {\vphantom {1 4}} \right. \kern-0em} 4}}}}\sqrt {{{Q}_{{({\text{mol)sp}}}}}} }},$Из формулы (5) следует, что если у молекулы аналита акцепторная группа является одновременно донорной группой для Н-связи, т.е. при ${{Q}_{{{\text{(a)i}}}}} = {{Q}_{{{\text{(d)i}}}}}$, то выражение (5) принимает вид:
(6)
${{n}_{{{\text{H}}\,}}} = \frac{{\sqrt {\,{{Q}_{{{\text{(d)sp}}}}}} + \sqrt {\,{{Q}_{{{\text{(a)sp}}}}}} }}{{2\sqrt {{{Q}_{{{\text{(mol)sp}}}}}} }}.$Приравнивание производной функции (1) к нулю дает уравнение для равновесного расстояния:
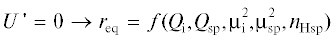 , подставляя его в исходное выражение, получаем равновесную энергию ${{U}_{{\min }}}$. Отношение равновесной энергии ${{U}_{{\min }}}$ к вкладу неполярного взаимодействия ${{U}_{{{\text{np}}}}}$ дает величину приведенной энергии:
, подставляя его в исходное выражение, получаем равновесную энергию ${{U}_{{\min }}}$. Отношение равновесной энергии ${{U}_{{\min }}}$ к вкладу неполярного взаимодействия ${{U}_{{{\text{np}}}}}$ дает величину приведенной энергии:
(7)
$u = 1 + \frac{{{{U}_{{{\text{dp}}}}}}}{{{{U}_{{{\text{np}}}}}}} + \frac{{{{E}_{{\text{H}}}}}}{{{{U}_{{{\text{np}}}}}}} = {{A}^{2}} + B \cdot {{A}^{{{\raise0.7ex\hbox{$1$} \!\mathord{\left/ {\vphantom {1 3}}\right.\kern-0em} \!\lower0.7ex\hbox{$3$}}}}},$Согласно своему определению приведенная энергия имеет две особенности: она обратно пропорциональна обобщенному заряду молекулы, входящему в член неполярной энергии (2), и равна 1 для неполярных объектов. Подставляя в соотношение с указанными свойствами связь ОЗ н-алкана с индексом Ковача ($Q_{n}^{{}} = {{\left( {6n + 2} \right)}^{{{3 \mathord{\left/ {\vphantom {3 4}} \right. \kern-0em} 4}}}} \equiv {{\left( {0.06{{I}_{n}} + 2} \right)}^{{{3 \mathord{\left/ {\vphantom {3 4}} \right. \kern-0em} 4}}}}$, где n – углеродное число), получим удобное приближение для приведенной энергии адсорбции молекулы i в общем случае [28]:
(8)
${{u}_{{\text{i}}}} \approx Q_{{\text{i}}}^{{ - {\text{1}}}}{{\left( {0.06{{I}_{{\text{i}}}} + 2} \right)}^{{{3 \mathord{\left/ {\vphantom {3 4}} \right. \kern-0em} 4}}}},$Итак, согласно (7) и (8) приведенная энергия связывает параметры аналита и НФ с параметрами хроматографического удерживания.
Метод трехпараметрической характеристики. В выражения для величин А и В входят характеристики неподвижной фазы в виде следующих отношений:
полярность НФ – отношение квадрата дипольного момента НФ к ее ОЗ:
(9)
${{v}_{{{\text{sp}}}}} = \frac{{{{\mu }}_{{{\text{sp}}}}^{{\text{2}}}}}{{{{Q}_{{{\text{sp}}}}}}},$гидрофильность НФ – отношение вероятности образования Н-связи фазой к ее ОЗ:
В приведенной формуле (10) вероятность образования Н-связи рассматривается как характеристика НФ. Это связано с тем, что, имея достаточное количество степеней свободы, молекула аналита подходит к поверхности НФ так, что всегда способна образовать с ней Н-связь. Поэтому вероятностный характер возникает из-за того, что молекула НФ должна принять правильное положение, вопреки мешающему влиянию соседних молекул.
Полярность и гидрофильность отвечают за разные свойства НФ, выражения (9) и (10) являются математическими определениями искомых характеристик НФ.
Прямая задача моделирования. Характеристики полярности и гидрофильности могут быть определены из структурных формул молекул путем расчета ОЗ, дипольных моментов и условных вероятностей участия в образовании Н-связи. Такой теоретический, или априорный, расчет рассматривает прямая задача моделирования. Решение прямой задачи – нахождение характеристик НФ из структурной формулы – сводится к нескольким этапам:
1. Определение средней энергии электрона ковалентной связи Е1 и радиуса экранирования rs. Энергия Е1 определяется как энергия образования молекулы, деленная на число ее валентных электронов. Радиус экранирования определяется по формуле
(11)
${{r}_{s}} = 1.710e\sqrt {{{{{a}_{0}}} \mathord{\left/ {\vphantom {{{{a}_{0}}} {{{E}_{1}}}}} \right. \kern-0em} {{{E}_{1}}}}} ,$Выбирается фрагмент приповерхностного слоя НФ, занимающий объем полусферы экранирования и содержащий в себе функциональные группы. Участок НФ в полусфере экранирования отражает свойства всей НФ при взаимодействии с малой молекулой газовой фазы;
2. Расчет ОЗ по формуле [25]:
(12)
${{Q}_{{{\text{sp}}}}} = \frac{\kappa }{{0.177}}\,\,{{\left( {\frac{{{{e}^{2}}}}{{{{a}_{0}}{{E}_{1}}}}} \right)}^{{{3 \mathord{\left/ {\vphantom {3 2}} \right. \kern-0em} 2}}}},$3. Определение дипольного момента ${{{{\mu }}}_{{{\text{sp}}}}}$ фрагмента. Для расчета используется программа математического моделирования Chem3D [29] или справочные данные для функциональных групп, входящих в выбранный фрагмент;
4. Расчет показателя Н-связи nH по формуле (6);
5. Расчет полярности НФ ${{v}_{{{\text{sp}}}}}$ по формуле (9);
6. Расчет гидрофильности НФ ${{w}_{{{\text{sp}}}}}$ по формуле (10).
Таким образом, по структурной формуле макромолекулы НФ можно найти полярность и гидрофильность, т.е. определить координаты НФ на диаграмме, названной картой селективности. Наличие двух координат совпадает с выводами статистического анализа в работе [10], указывающего на необходимость и достаточность двух независимых параметров для описания селективности полярной НФ.
Обратная задача моделирования. Часто неподвижная фаза представлена полимерами, структура которых не раскрывается производителями. В этом случае, чтобы определить характеристики НФ, необходимо решить обратную задачу моделирования по получению характеристик селективности из данных хроматографического эксперимента по индексам удерживания молекул на изучаемой неподвижной фазе.
Этапы решения обратной задачи:
1) Получение экспериментальных данных по удерживанию различных аналитов (индекс i-го аналита) на исследуемой НФ. Индекс Ковача для i-го аналита рассчитывается относительно соседних н-алканов с числом углеродных атомов m и m+1 по известной формуле:
(44)
${{I}_{{\text{i}}}} = 100 \times \left( {m + {{\ln \tfrac{{{{k}_{{\text{i}}}}}}{{{{k}_{m}}}}} \mathord{\left/ {\vphantom {{\ln \tfrac{{{{k}_{{\text{i}}}}}}{{{{k}_{m}}}}} {\ln \tfrac{{{{k}_{{m + {\text{1}}}}}}}{{{{k}_{m}}}}}}} \right. \kern-0em} {\ln \tfrac{{{{k}_{{m + {\text{1}}}}}}}{{{{k}_{m}}}}}}} \right),$Существуют обширные литературные данные по индексам удерживания, которые могут быть взяты для расчета [30]. При обработке сложных экспериментов с переменной температурой для нахождения индексов Ковача удобна программа INKOVERTI [31];
2) Определение ОЗ аналита (формулы и примеры применения специальных программ для расчета GEOMOL и THENRY можно найти, например, в работе [32]) и дипольного момента аналита (справочные данные или стандартные программы математического моделирования) по структурной формуле.
3) Расчет полярности аналита: ${{v}_{{\text{i}}}} = \frac{{{{\mu }}_{{\text{i}}}^{{\text{2}}}}}{{{{Q}_{{\text{i}}}}}}$;
4) Расчет характеристик  и ${{S}_{{\text{i}}}}$ по формулам, следующим из выражения (5) [15]:
и ${{S}_{{\text{i}}}}$ по формулам, следующим из выражения (5) [15]:
(14)
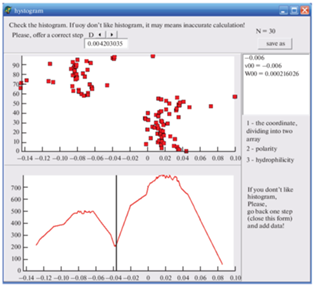
${{S}_{{\text{i}}}} = 7.62 \times {{10}^{{ - 3}}}\frac{{{{u}_{{\text{i}}}} - {{{\left[ {1 + c \cdot \left( {{{v}_{{\text{i}}}} + {{v}_{{{\text{sp}}}}} + {{c}_{T}}{{v}_{{\text{i}}}}{{v}_{{{\text{sp}}}}}} \right)} \right]}}^{2}}}}{{{{{\left[ {1 + c \cdot \left( {{{v}_{{\text{i}}}} + {{v}_{{{\text{sp}}}}} + {{c}_{T}}{{v}_{{\text{i}}}}{{v}_{{{\text{sp}}}}}} \right)} \right]}}^{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}}}},$5) Разделение множества аналитов на классы ${{M}_{0}}$ и ${{M}_{1}}$. Если гистограмма имеет два максимума, то в соответствии с пиками точки разбиваются на два множества: точки левой части относятся к множеству ${{M}_{0}}$, а правой — к множеству ${{M}_{1}}$. Если максимум на гистограмме один – процедура завершается с результатом по полярности НФ ${{v}_{{{\text{sp}}}}}$ (усредненным в соответствии с выражением (15)) и нулевой гидрофильностью. На рис. 1 представлен скриншот программы STAPHMAP [33], разработанной специально для решения обратной задачи с распределением молекул аналитов по множествам и гистограммой этого распределения; вертикальная линия на нижнем графике отделяет множества друг от друга.
6) Расчет полярности НФ для множества молекул М0 по формуле:
(15)
${{v}_{{{\text{sp}}}}} = \frac{{\sum {{{v}_{{{\text{0i}}}}}{{v}_{{\text{i}}}}} }}{{\sum {{{v}_{{\text{i}}}}} }}.$7) Расчет гидрофильности НФ для множества молекул М1 по формуле:
Методика расчета позволяет определить характеристики НФ по данным всего двух полярных молекул – по одной из множеств ${{M}_{0}}$ и ${{M}_{1}}$.
Таким образом, характеристики селективности можно рассчитать из индексов Ковача и определить координаты НФ на карте селективности.
В работе [16] показано, что результаты расчета по прямой и обратной задаче согласуются между собой, что подтверждает внутреннюю непротиворечивость применяемой модели ММВ. Ниже это соответствие демонстрируется на классе широко используемых в ГХ фазах на основе полиэтиленгликоля (ПЭГ) с различными молекулярными массами.
Карта селективности – это двумерная диаграмма в координатах полярность–гидрофильность (${{v}_{{{\text{sp}}}}} - {{w}_{{{\text{sp}}}}}$) с нанесенными на нее характеристиками селективности неподвижных фаз.
На рис. 2 представлена карта селективности НФ, составленная по результатам расчета характеристик селективности для каждой фазы из экспериментальных данных – индексов Ковача для двух молекул (пентанон-2 и бутанол-1), принадлежащих к разным классам гидрофильности.
Рис. 2.
Карта селективности хроматографических фаз. 1 – Скавалан, 2 – Apiezon L, 3 – Versilube F-50, 4 – OV-7, 5 – DC-710, 6 – OV-25, 7 – Ucon 50 HB-280X, 8 – OV-225, 9 – XE-60, 10 – Silar-5CP, 11 – XF-1150, 12 – Reoplex 400, 13 – Silar-7CP, 14 – Diglycerol, 15 – THEED, 16 – TCEP, 17 – Cyanoethylsucrose, 18 – PEG 20M, 19 – PEG 20M-TPA, 20 – PEG 6000, 21 – PEG 4000, 22 – PEG 1000.
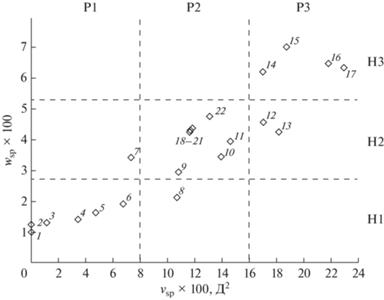
Карту селективности можно разделить условно на девять областей (см. рис. 2): 3 – по абсциссе (P1: слабо-, P2: средне-, P3: высокополярные) и 3 – по ординате (H1: слабо-, H2: средне- и H3: сильногидрофильные). Это удобный и наглядный способ классификации НФ.
В область Р1Н1 попадают фазы №№ 1–6, в область Р1Н2 – фаза № 7, Р2Н1 – фаза № 8, в область Р2Н2 – фазы №№ 9–11, №№ 18–22, в область – Р3Н2 фазы №№ 12–13, в область – Р3Н3 фазы №№ 14–17, в области Р1Н3, Р2Н3 и Р3Н1 из рассмотренных фаз не попала ни одна.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Зависимости характеристик от структуры фазы на карте селективности. Неполярные неподвижные фазы. При рассмотрении карты селективности стоит отметить ненулевую гидрофильность у НФ № 1 – Сквалана. Сквалан постулируется абсолютно неполярной эталонной НФ в методе Роршнайдера, но при расчете с помощью метода ТПХ имеет небольшую гидрофильность. Это связано с тем, что реальная НФ под названием Сквалан – в отличие от чистого вещества – имеет в себе примеси детергента, который использовался при приготовлении хроматографической колонки, который и придает ей небольшую гидрофильность [30]. То же самое можно сказать про НФ Apiezon L (№ 2 на карте селективности) – это смесь углеводородов, неполярная фаза, но имеет примесь детергента, придающего ей ненулевую гидрофильность [30]. Это относится не только к перечисленным фазам, а ко всем низко- и малополярным НФ, попадающим в область Р1Н1, эмпирические способы классификации фаз этот тонкий момент не учитывают, что является их недостатком.
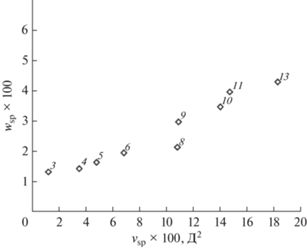
Неподвижные фазы на основе полиэтиленгликоля. На рис. 3 представлена карта селективности для ПЭГ-НФ с различной молекулярной массой. Эти фазы селективны к кислородсодержащим соединениям; по нашей классификации они все относятся к области P2H2 на рис. 2, т.е. обладают средней полярностью и средней гидрофильностью. На карту нанесены характеристики ПЭГ-НФ с величинами полярности и гидрофильности, рассчитанными априори и из экспериментальных данных в виде констант Роршнайдера–МакРейнольдса (РМР) для молекул, принадлежащих к разным классам гидрофильности: полярность рассчитана по пентанону-2, гидрофильность – по бутанолу-1. Расчет по прямой задаче дает зависимость полярности (9) и гидрофильности (10) ПЭГ от их массы, что представлено на графике в виде дискретной кривой. Результаты расчета из констант РМР по обратной задаче даны в виде крестиков [16].
Рис. 3.
Карта селективности для неподвижных фаз на основе полиэтиленгликоля с различными массами. Обозначения: (+) – данные, рассчитанные по константам РМР, дискретная кривая – теоретически рассчитанные характеристики ПЭГ с разными молекулярными массами, шаг равен молекулярной массе мономера. Заштрихована область погрешностей.
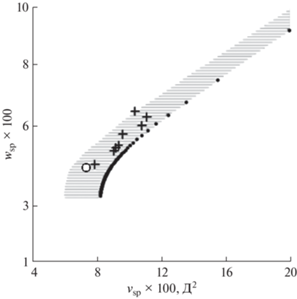
Серой штриховкой указан коридор систематической погрешности, в который попадают все экспериментальные точки, связанные с занижением величины полярности на постоянную величину при расчете ее из констант РМР [14].
Поведение большинства экспериментальных точек на графике соответствует теоретической зависимости величин полярности и гидрофильности от массы ПЭГ, однако точки для некоторых НФ выпадают из правильной последовательности, хотя принадлежат той же кривой. Это может быть объяснено возможной ошибкой в указании производителем молекулярной массы полимера.
Результаты сравнения показывают хорошее соответствие между положениями точек теоретических и экспериментальных характеристик ПЭГ, определяющих их селективность в качестве НФ. Используемая модель для проведения расчетов по прямой и обратной задаче является внутренне непротиворечивой.
Отметим, что НФ Ucon 50-HB-280X (ей на рис. 3 соответствует кружок) по составу подобна фазам на основе полиэтиленгликоля с большой молекулярной массой – это эфир поли(оксиэтиленоксипропилен)гликоля. Поэтому ее положение на карте приблизительно соответствует теоретической зависимости характеристик селективности от массы полимера, обнаруженной для ПЭГ.
Фазы на основе полисилоксана. Рассмотрим НФ с различными заместителями в полисилоксане (ПСО НФ), это фазы №№ 2, 3, 4, 5, 6, 8, 9, 10, 11, 13. На рис. 4 приведен фрагмент карты селективности (см. рис. 2) для ПСО НФ, в табл. 1 − составы фаз [34].
Таблица 1.
Состав полисилоксановых неподвижных фаз [34]
| № на рис. 2 | Название НФ | Состав |
|---|---|---|
| 3 | Versilube F-50 | Метил 10% трихлорфенилсилоксан |
| 4 | OV-7 | 20% фенилметилсилоксан |
| 5 | DC-710 | 50% фенилметилсилоксан |
| 6 | OV-25 | 75% фенилметилсилоксан |
| 8 | OV-225 | 25% цианпропилметилсилоксан |
| 9 | XE-60 | 25% цианэтилметилсилоксан |
| 10 | Silar-5CP | 50% цианпропилфенилсилоксан |
| 11 | XF-1150 | 50% цианэтилметилсилоксан |
| 13 | Silar-7CP | 78% цианпропилфенилсилоксан |
Наблюдается зависимость характеристик полярности и гидрофильности от состава для этих НФ – они возрастают при увеличении количества и степени электроотрицательности функциональных групп. Отметим, что в парах фаз №№ 8 и 9, 10 и 11 гидрофильность цианопропильных групп ниже, чем гидрофильность цианоэтильных групп в полисилоксане. По-видимому, это связано с тенденцией к убыванию таутомерных эффектов переноса протона в ряду HCN, CH3CN, …, RCnH2nCN, обеспечивающих донорные свойства нитрильных групп при водородном связывании.
Высокополярные и высокогидрофильные неподвижные фазы. Фазы на карте селективности (см. рис. 2) №№ 12, 14, 15, 16 и 17 имеют составы, представленные в табл. 2 [34]. Приведенные в табл. 2 фазы относятся к областям Р3Н2 и Р3Н3 на карте селективности. Большое количество полярных функциональных групп обеспечивает их высокую полярность и гидрофильность.
Таблица 2.
Составы неподвижных фаз (нумерация фаз соответствует подписи к рис. 2)
| № | Название НФ | Состав | |
|---|---|---|---|
| 12 | Reoplex 400 | Полинеопентилгликоль себацинат | 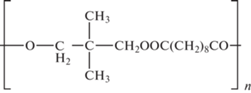 |
| 14 | Diglycerol | Диглицерин | 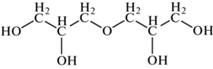 |
| 15 | THEED | Тетрагидроксиэтил-этилендиамин | 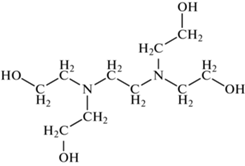 |
| 16 | TCEP | 1,2,3-Трис(2-цианоэтокси)пропан |  |
| 17 | Cyanoethylsucrose | Цианоэтилсахароза |  |
Выбор селективной неподвижной фазы. Метод ТПХ способен не только классифицировать НФ, но и решать конкретные аналитические задачи по выбору фазы, наиболее селективной к целевым аналитам. Выбор НФ осуществляется в соответствии с принципом близости свойств – чем больше НФ похожа по свойствам на целевые аналиты, тем сильнее ее селективность реагирует на изменение этих свойств. Это важно в случае разделения веществ, у которых разница в индексах Ковача незначительна – порядка 10 единиц. Воспользовавшись картой селективности и нанеся на нее характеристики аналитов, можно выбрать селективную НФ. Логику принципа подобия свойств стоит пояснить.
Из опыта известно, что сродство отдельных молекул к собственной жидкой фазе максимально. Если нанести на карту характеристики жидкой фазы целевых аналитов, то наиболее селективная НФ будет иметь максимально близкие координаты.
На рис. 5 представлен фрагмент карты селективности (см. рис. 2) с нанесенными на нее характеристиками пары аналитов. В качестве трудноразделяемых молекул выбраны изомеры сложных эфиров – пропилацетат и этилпропионат, разница в индексах Ковача которых на большинстве НФ меньше 10 единиц. Характеристики аналитов рассчитывают из структурной формулы как характеристики их жидкой фазы, а не отдельной молекулы (см. табл. 3) с использованием формул (6), (9)–(11).
Рис. 5.
Карта селективности неподвижных фаз с нанесенными характеристиками целевых аналитов, обозначенными символом +. Нумерация неподвижных фаз соответствует подписи к рис. 2.
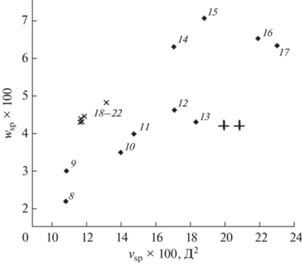
Таблица 3.
Характеристики изомеров сложных эфиров
| Характеристика | Пропилацетат | Этилпропионат |
|---|---|---|
| Q | 15.22 | 15.22 |
| μ, Д | 1.78 | 1.74 |
| nH | 0.64 | 0.64 |
| ${{v}_{{\text{i}}}}$, Д2 | 0.208 | 0.199 |
| ${{w}_{{\text{i}}}}$ | 0.042 | 0.042 |
Наиболее селективной к заданному аналиту, является та НФ, которая на карте расположена максимально близко к его координатам. На карте селективности, представленной на рис. 5, это будет НФ № 13, что подтверждается данными [35].
В особо сложных случаях, когда изомеры не различаются по полярности и гидрофильности, например, при разделении геометрических изомеров, описанное применение карты селективности для выбора НФ необходимо дополнить условием для критерия, отвечающего за селективность НФ к геометрическим изомерам. Эта задача подробно рассмотрена в работе [17].
* * *
Разработан подход к описанию сорбционных свойств жидких неподвижных фаз для газовой хроматографии по их структуре. Найдено, что относительную хроматографическую селективность фаз удобно характеризовать двумя математически определенными параметрами – полярностью и гидрофильностью. Следствием развиваемой модели является графический способ классификации жидких фаз по свойствам полярности и гидрофильности. Карта селективности позволила не только выявить неидеальности в существующих методах классификации фаз, но и открыть закономерности в свойствах гомологов полиэтиленгликолей и цианзамещенных полисилоксанов. Применение карты селективности в сочетании с принципом подобия свойств дает возможность выбора неподвижных фаз, наиболее селективных к заданным аналитам, причем этот выбор может быть сделан чисто теоретически, по структуре, без проведения экспериментов.
Настоящее исследование выполнено при поддержке Проекта Государственного задания (Институт геохимии и аналитической химии им. В.И. Вернадского Российской академии наук, № FMUS-2019-24).
Список литературы
Обухова Е.Н., Буряк А.К. Хромато-масс-спектрометрическое определение изомеров в допинговом контроле // Журн. аналит. химии. 2019. Т. 74. № 9. С. 652.
Kupriyanova O.V., Milyukov V.A., Shevyrin V.A., Shafran Y.M., Rusinov V.L., Lebedev A.T. Synthesis and determination of analytical characteristics and differentiation of positional isomers in the series of n-(2-methoxybenzyl)-2-(dimethoxyphenyl)ethanamine using chromatography–mass spectrometry // Drug Testing and Analysis. 2020. V. 12. № 8. P. 1157.
Rohrschneider L. Die vorausberechnung von gaschromatographischen retentionszeiten aus statistisch ermittelten “polaritäten” // J. Chromatogr. A. 1965. V. 17. P. 1.
Rohrschneider L. Eine Methode zur Chrakterisierung von gaschromatographischen Trennflüssigkeiten // J. Chromatogr. A. 1966. V. 22. P. 6.
Rohrschneider L. Eine Methode zur Charakterisierung von gaschromatographischen Trennflüssigkeiten : II. Die Berechnung von Retentionsverhältnissen // J. Chromatogr. 1969. V. 39. P. 383.
McReynolds W.O. Characterization of some liquid phases // J. Chromatogr. Sci. 1970. V. 8. P. 685.
Abraham M.H., Ibrahim A., Zissimos A.M. Determination of sets of solute descriptors from chromatographic measurements // J. Chromatogr. A. 2004. V. 1037. P. 29.
Abraham M.H. Scales of solute hydrogen-bonding: Their construction and application to physicochemical and biochemical processes // Chem. Soc. Rev. 1993. V. 22. P. 73.
Долгоносов А.М., Рудаков О.Б., Суровцев И.С., Прудковский А.Г. Колоночная аналитическая хроматография как объект математического моделирования. Воронеж: ГЕОХИ РАН – Воронежский ГАСУ, 2013. С. 400.
Juvancz Z., Cserhaiti T., Markides K.E., Bradshaw J.S., Lee M.L. Characterization of some new polysiloxane stationary phases by principal component analysis // Chromatographia. 1994. V. 38. P. 227.
Долгоносов А.М., Зайцева Е.А. Характеристика полярности неподвижной фазы в газовой хроматографии на основе теоретического описания межмолекулярных взаимодействий. I. Случай отсутствия водородных связей // Сорбционные и хроматографические процессы. 2014. Т. 14. № 4. С. 578.
Долгоносов А.М., Зайцева Е.А. Характеристика полярности неподвижной фазы в газовой хроматографии на основе теоретического описания межмолекулярных взаимодействий. II. Случай водородных связей // Сорбционные и хроматографические процессы. 2015. Т. 15. № 3. С. 321.
Зайцева Е.А., Долгоносов А.М. Теоретическая оценка характеристик селективности газохроматографических неподвижных фаз // Сорбционные и хроматографические процессы. 2018. Т. 18. № 5. С. 676.
Зайцева Е.А., Долгоносов А.М. Трехпараметрическая модель межмолекулярных взаимодействий как основа для классификации и выбора неподвижных фаз для газовой хроматографии // Сорбционные и хроматографические процессы. 2019. Т. 19. № 5. С. 525.
Долгоносов А.М. Полярность и гидрофильность — фундаментальные независимые характеристики хроматографических неподвижных фаз // Сорбционные и хроматографические процессы. 2015. Т. 15. № 3. С. 312.
Долгоносов А.М., Зайцева Е.А. Модель межмолекулярного взаимодействия с образованием водородной связи и ее применение для характеристики селективности хроматографических фаз на примере полиэтиленгликолей // Журн. структ. химии. 2020. Т. 61. № 8. С. 1300.
Долгоносов А.М., Зайцева Е.А. Факторы, определяющие селективность неподвижных фаз к геометрическим изомерам жирных кислот в анализе методом ГЖХ // Журн. аналит. химии. 2020. Т. 75. № 12. С. 1119.
Долгоносов А.М. Модель электронного газа и теория обобщенных зарядов для описания межатомных взаимодействий и адсорбции. М., ЛИБРОКОМ, 2009. 167 с.
Долгоносов А.М. Обобщенный заряд в описании адсорбции в области Генри // Журн. физ. химии. 2002. Т. 76. № 6. С. 1107.
Долгоносов А.М. Теория обобщенных зарядов для межатомных взаимодействий // Журн. физ. химии. 2001. Т. 75. № 10. С. 1813.
Reinganum M. Kräfte elektrischer Doppelpunkte nach der statistischen Mechanik und Anwendung auf molekulare und Ionenwirkungen // Annalen der Physik. 1912. Bd. 343. № 8. S. 649.
Keesom W.H. Die van der Waalsschen Kohäsionskräfte // Phys. Zeit. 1921. V. 22. P. 129–141.
Debye P. Van der Waals cohesion forces // Phys. Zeit. 1920. V. 21. P. 178.
Falkenhagen H. Kohäsion und Zustandsgleichung bei Dipolgasen // Phys. Zeit. 1922. V. 23. P. 87.
Долгоносов А.М. Модель образования водородной связи между молекулами пара и жидкости // Журн. структ. химии. 2020. Т. 61. № 7. С. 1107.
Долгоносов А.М. Представление о водородной связи, следующее из теории обобщенных зарядов // Журн. структ. химии. 2019. Т. 60. № 11. С. 1765.
Dolgonosov A.M. Calculation of adsorption energy and Henry law constant for nonpolar molecules on a nonpolar uniform adsorbent // J. Phys. Chem. B. 1998. V. 102. P. 4715.
Долгоносов А.М. Связь энергии адсорбции с индексом Ковача, вытекающая из теории обобщенных зарядов // Сорбционные и хроматографические процессы. 2015. Т. 15. № 2. С. 168.
http://www.cambridgesoft.com (электронный сайт ПО Сambridgesoft) (07.06.2021 г.).
McReynolds W.O. Gas Chromatographic Retention Data. Preston. Technical Abstracts Co. Niles. 1966. P. 335.
Прудковский А.Г., Долгоносов А.М. Инструмент для оценки индекса Ковача по времени удерживания вещества в газовой хроматографии // Журн. аналит. химии. 2008. Т. 63, №. 9. С. 935.
Долгоносов А.М., Прудковский А.Г. Барьеры внутримолекулярного вращения по температурной зависимости константы Генри в области нарушения жесткости адсорбированной молекулы // Журн. физ. химии. 2008. Т. 82. № 5. С. 931.
Зайцева Е.А. Дис. … канд. хим. наук. Москва: Институт геохимии и аналитической химии им. В.И. Вернадского РАН, 2021. 123 с. http://www.geokhi.ru/Thesis/2021/Кандидатские/Зайцева/Диссертация_Зайцева_ЕА.pdf (21.06.2021 г.)
Пецев Н., Коцев Н. Справочник по газовой хроматографии. М.: Мир, 1987.
Lu C., Guo W., Yin C. Quantitative structure-retention relationship study of the gas chromatographic retention indices of saturated esters on different stationary phases using novel topological indices // Anal. Chim. Acta. 2006. V. 561. P. 96.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии