Журнал аналитической химии, 2023, T. 78, № 4, стр. 291-316
Современные методы и направления развития аналитической химии флаванонов
Э. Н. Якупова a, Г. К. Зиятдинова a, *
a Химический институт им. А.М. Бутлерова, Казанский федеральный университет
420008 Казань, ул. Кремлевская, 18, Россия
* E-mail: Ziyatdinovag@mail.ru
Поступила в редакцию 24.10.2022
После доработки 24.11.2022
Принята к публикации 25.11.2022
- EDN: KZZMSL
- DOI: 10.31857/S0044450223040163
Аннотация
Рассмотрены особенности строения флаванонов, сделан критический обзор и обобщены способы их определения в различных объектах. Данные систематизированы по методам анализа – хроматографическим, электрофоретическим, спектральным и электрохимическим. Обсуждены аналитические возможности, преимущества и недостатки каждой группы методов. Уделено внимание применению химически модифицированных электродов на основе углеродных наноматериалов, трехмерных нанопористых металлических структур, композитов наночастиц оксидов и сульфидов металлов или красителей с углеродными наноматериалами, а также комбинации модификаторов различных типов в вольтамперометрии флаванонов.
Природные фенольные антиоксиданты являются одной из активно исследуемых групп биологически активных соединений в современной химии, что обусловлено как многообразием этих соединений, так и широким спектром проявляемой биологической активности [1]. Среди этих соединений следует выделить флаваноны – основные флавоноиды растений рода цитрусовых семейства рутовые (Rutaceae). Отдельные представители флаванонов идентифицированы в экстрактах растений семейства Lamiaceae, Amaranthaceae и др., однако их содержание крайне мало [2]. Флаваноны ингибируют пролиферацию клеток и ангиогенез, снижают уровень холестерина и триглицеридов, выступают в качестве ловушек свободных радикалов, проявляют эстрогенную активность, модулируют уровень оксида азота и уменьшают агрегацию тромбоцитов и иммобилизацию лимфоцитов [3]. Это обусловливает их применение в медицине в составе различных лекарственных средств. С другой стороны, цитрусовые фрукты и продукты на их основе являются частью пищевого рациона человека, что также обеспечивает положительное воздействие на здоровье. Флаваноны, в частности нарингин, оказывают влияние на фармакокинетику ряда лекарственных средств, поскольку ингибируют некоторые ферменты группы цитохрома P450 [4]. Кроме того, флаваноны при высоких концентрациях способны проявлять прооксидантные свойства [1, 5]. Очевидно, что необходим контроль содержания соединений этой группы в реальных объектах. Тем не менее определение флаванонов не привлекало до недавнего времени достаточного внимания аналитиков по сравнению с другими классами природных фенольных соединений. Частично это связано с тем, что идентификация отдельных флаванонов стала возможной лишь с развитием хромато-масс-спектрометрии.
В настоящем обзоре рассмотрены особенности строения флаванонов и их основные представители, обобщены и критически проанализированы данные по способам их определения. В рамках каждой группы методов обсуждены подходы, обеспечивающие наилучшие аналитические характеристики определения флаванонов, а также достоинства и недостатки. Особое внимание уделено аналитическим возможностям химически модифицированных электродов при определении флаванонов в качестве эффективной альтернативы хроматографическим методам.
СТРУКТУРА ФЛАВАНОНОВ, ИХ ОСНОВНЫЕ ПРЕДСТАВИТЕЛИ И ИСТОЧНИКИ
Флаваноны или дигидрофлавоны состоят из двух ароматических колец А и В, соединенных друг с другом трехуглеродной цепью, которая формирует закрытый пирановый цикл (кольцо С) с одним из ароматических колец (схема 1 ).
Схема 1 . Общая структура флаванонов.
Отсутствие двойной связи C2–C3, присутствие хирального атома углерода в положении C2 и отсутствие заместителя в положении C3 кольца C являются основными структурными особенностями, позволяющими рассматривать флаваноны как отдельный класс флавоноидов [6]. Флаваноны представлены широким спектром соединений с О- (гидрокси-, метокси-, метилендиокси-) и/или С-заместителями (метил-, бензил-, гидроксиметил-, формил-) в кольцах А и/или В [7] (схема 2 ).
Схема 2 . Агликоны флаванонов.
Как и другие флавоноиды, в природе флаваноны существуют в виде агликонов и гликозидов [1, 6, 8]. Гликозилирование агликонов протекает последовательно под действием флаванон-7-O-бета-глюкозилтрансферазы и флаванон-7-O-глюкозид-2''-O-рамнозилтрансферазы с образованием 7-O-β-D-глюкозидов и рамноглюкозидов [8] (табл. 1). При этом содержание агликонов в растительных объектах незначительно по сравнению с гликозидами.
Таблица 1.
Гликозидные формы флаванонов
| Сахарид | Агликон | Гликозид |
|---|---|---|
Глюкоза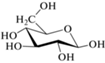 |
Нарингенин | Прунин |
Рутиноза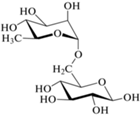 |
Нарингенин | Нарирутин |
| Изосакуранетин | Дидимин (неопонцирин) |
|
| Эриодиктиол | Эриоцитрин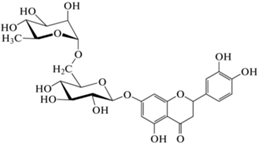 |
|
| Гесперетин | Гесперидин |
|
Неогесперидоза |
Нарингенин | Нарингин |
| Изосакуранетин | Понцирин |
|
| Эриодиктиол | Неоэриоцитрин |
|
| Гесперетин | Неогесперидин |
Как отмечалось выше, основными источниками флаванонов для человека являются продукты питания (овощи (томаты и картофель), специи (розмарин и мята), фрукты (широкий круг цитрусовых, слива, малина и виктория)) [9]. Максимальное содержание флаванонов характерно для цитрусовых фруктов (апельсин, померанец, грейпфрут, лайм, мандарин, бергамот, кумкват, лимон, чинотто и танжерин) [3]. При этом основными флаванонами апельсинов, мандаринов, лайма и лимонов является гесперидин, а померанца, бергамота и чинотто – неогесперидин, неоэриоцитрин и нарингин. Для грейпфрута характерно высокое содержание нарингина и минорные количества понцирина, неогесперидина и дидимина. Танжело содержит главным образом неогесперидин, а также меньшие количества нарингина, гесперидина и нарирутина, а кумкват – гесперидин и нарингин [3]. Кроме того, флаваноны, в частности гесперидин, входят в состав лекарственных средств и биологически активных добавок [10], а также средств традиционной китайской медицины [11]. В связи с этим основными объектами анализа являются цитрусовые фрукты и продукты питания на их основе, лекарственные средства, биологически активные добавки и лекарственное растительное сырье, а также биологические жидкости.
СПОСОБЫ ОПРЕДЕЛЕНИЯ ФЛАВАНОНОВ
В настоящее время для определения флаванонов в различных объектах применяют инструментальные методы анализа, в частности хроматографию, капиллярный электрофорез, спектральные и электрохимические методы, отличающиеся по чувствительности, селективности, экспрессности и экономичности. Немаловажным фактором при разработке способов определения флаванонов является также возможность проведения прямого анализа образцов с минимальной пробоподготовкой или вовсе без нее.
Хроматография. Растительные материалы, которые являются источниками флаванонов и объектами анализа, характеризуются сложным химическим составом, причем эти компоненты относятся к различным классам органических соединений, в том числе и структурно родственным. Для идентификации флаванонов и их определения традиционно используют хроматографические методы. При этом зачастую необходимо предварительное извлечение аналитов и их концентрирование. Для этих целей применяют различные варианты жидкостной [12] и твердофазной экстракции [13–15] или их сочетание [16], что значительно увеличивает трудоемкость анализа и его стоимость.
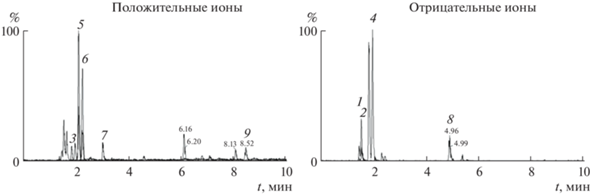
Для идентификации флаванонов чаще всего используют жидкостную хроматографию с масс-спектрометрическим детектированием, причем в тандемном варианте [15–20]. Ионизацию молекул флаванонов проводят с помощью электрораспыления [15–20], а детектирование – в режиме как положительно [15, 17–19], так и отрицательно заряженных ионов [14, 16–18, 20] (рис. 1).
Рис. 1.
Хроматограммы по полному ионному току 70%-ного метанольного раствора лиофилизированного образца водного отвара Gungha-tang, полученные методом ЖХ-МС/МС с мониторингом множественных реакций в режимах детектирования положительных и отрицательных ионов. Ликвиритина апиозид (1), неоэриоцитрин (2), нарирутин (3), нарингин (4), гесперидин (5), неогесперидин (6), ликвиритигенин (7), глицирризин (8) и 6-шогаол (9). Адаптировано из [17].
Флаваноны количественно определяют обычно в условиях обращенно-фазовой высокоэффективной жидкостной хроматографии (ВЭЖХ) с УФ- и диодно-матричным детектированием при 280 или 282 нм [12, 21–24], а также c электрохимическими детекторами (кулонометрическим [25] и амперометрическим [26]). В последнее время уделяют внимание масс-спектрометрическому детектированию, в том числе тандемному и высокого разрешения, что обеспечивает повышение селективности и чувствительности определения [14–17, 20, 27, 28]. Аналитические возможности ВЭЖХ-определения флаванонов в различных объектах охарактеризованы в табл. 2. Разделение достигается на колонках С18 (стандартных 3.0–4.6 × 250 мм, 5 мкм [21–24] или коротких 4 × 55 мм, 3 мкм [12] и 2.1 × 50 мм, 2.6 мкм [27]) с использованием в качестве подвижной фазы смесей ацетонитрила или метанола с водой или водными растворами уксусной, трифторуксусной, муравьиной кислот, фосфатным или ацетатным буферными растворами с рН 2.4–6.2 в режиме изократического или градиентного элюирования.
Таблица 2.
Аналитические характеристики обращенно-фазового ВЭЖХ-определения флаванонов
| Параметры детектора | Подвижная фаза, режим элюирования | Аналит | Диапазон определяемых концентраций | Предел обнаружения | Объект анализа |
Литера-тура |
|---|---|---|---|---|---|---|
| Диодно-матричное детектирование | ||||||
| λ = 280 нм | CH3OH–H2O (1% CH3COOH), градиентный | Гесперидин | 60–300 мг/100 г | 1.87 мг/100 г | Апельсиновые соки | [12] |
| Нарингин | 0.01–0.09 мг/100 г | 0.0037 мг/100 г | ||||
| Нарингенин | 0.05–0.25 мг/100 г | 0.0066 мг/100 г | ||||
| Понцирин | 0.05–0.30 мг/100 г | 0.0147 мг/100 г | ||||
| CH3CN–H2O, градиентный | Нарингин | 55–95 мкг/мл | 8.57 мкг/мл | Цитрусовые соки | [21] | |
| Нарингенин | 10–60 мкг/мл | 3.37 мкг/мл | ||||
| УФ-детектирование | ||||||
| λ = 280 нм | CH3CN–H2O, градиентный | Нарингин | 6.25–250 мкг/мл | 22.5 нг/мл | Цитрусовые соки | [22] |
| Прунин | 6.25–250 мкг/мл | 11.7 нг/мл | ||||
| Нарингенин | 2.50–100 мкг/мл | 11.7 нг/мл | ||||
| λ = 282 нм | CH3CN–фосфатный буферный раствор с рН 3.5 (25 : 75), изократический | Нарингин | 0.1–20.0 мкг/мл | 17.0 нг/мл | Лекарственные средства | [23] |
| λ = 280 нм | CH3CN–H2O–HCOOH (21 : 78.8 : 0.2), изократический | Нарингин | 5–200 мг/л | 2.5 мг/л | Цитрусовые соки | [24] |
| Гесперидин | 5–200 мг/л | 2.5 мг/л | ||||
| Электрохимическое детектирование | ||||||
| Кулонометрия Е = 0.5 и 0.7 В |
40% CH3CN в 70 мМ фосфатном буферном растворе с pH 2.4, изократический | Нарингенин | 0.11–3.67 мкМ (плазма) 0.27–276 мкМ (моча) |
74 нМ (плазма) | Плазма крови и моча | [25] |
| Е = 0.35 и 0.55 В | 58% CH3OH в 70 мМ фосфатном буферном растворе с pH 2.4, изократический | Гесперетин | 0.03– 4.97 мкМ (плазма) 0.06–248 мкМ (моча) |
33 нМ (плазма) | ||
| Амперометрия Е = 0.9 В |
20 мМ ацетатный буферный раствор с pH 6.2–30% CH3CN–5% CH3OH, изократический | Нарингенин | 0–200 нг/мл | 1 нг/мл | Плазма крови крыс | [26] |
| Масс-спектрометрическое детектирование | ||||||
| m/z 579.1 | CH3CN–2 мМ CH3COONH4 (75 : 25), изократический | Нарингин | 63–6300 нг/мл | — | Цитрусовые соки | [27] |
| Тандемная масс-спектрометрия | ||||||
| m/z 121.3, 65.1 | H2O–CH3OH, градиентный | Флаванон | 15–5000 нг/мл | — | Растительное сырье | [15] |
| m/z 153.0, 147.0 | Нарингенин | 5.0–5000 нг/мл | — | |||
| m/z 177.0, 153.0 | Гесперетин | 5.0–5000 нг/мл | — | |||
| m/z 153.0, 162.9 | Эриодиктиол | 5.0–5000 нг/мл | — | |||
| m/z 137.0, 147.0 | Ликвиритигенин | 5.0–5000 нг/мл | — | |||
| m/z 167.0, 130.9 | Пиностробин | 5.0–5000 нг/мл | — | |||
| m/z 255.0 | H2O (5 мМ HCOONH4 и 1% (по объему) HCOOH)–CH3CN, градиентный | Ликвиритина апиозид | 25.00–400.00 нг/мл | 8.33 нг/мл | Китайский растительный препарат Gungha-tang | [17] |
| m/z 151.0 | Неоэриоцитрин | 50.00–800.00 нг/мл | 0.83 нг/мл | |||
| m/z 273.0 | Нарирутин | 50.00–800.00 нг/мл | 3.33 нг/мл | |||
| m/z 271.0 | Нарингин | 50.00–800.00 нг/мл | 8.33 нг/мл | |||
| m/z 303.2 | Гесперидин | 50.00–800.00 нг/мл | 1.67 нг/мл | |||
| m/z 303.0 | Неогесперидин | 100.00–1600.00 нг/мл | 0.33 нг/мл | |||
| m/z 137.0 | Ликвиритигенин | 0.10–1.60 нг/мл | 0.02 нг/мл | |||
| m/z 286.8 | 0.1% HCOOH–СH3CN, градиентный | Эриоцитрин | 0.01–2.5 мг/л | 0.003 мг/л | Экстракты морфогрупп Zanthoxylum zanthoxyloides | [20] |
| m/z 301.0 | Неогесперидин | 0.10–1.0 мг/л | 0.03 мг/л | |||
| m/z 301.0 | Гесперидин | 0.25–2.5 мг/л | 0.075 мг/л | |||
| m/z 151.0 | 0.5% CH3COOH–0.5% CH3COOH в СH3CN, градиентный | Нарингин | 0.500–50 мкг/мл | 0.059 нг/мл | Листья сои, апельсины и лайм | [28] |
| m/z 151.0 | Нарингенин | 0.500–50 мкг/мл | 0.045 нг/мл | |||
| m/z 301.0 | Гесперидин | 0.500–50 мкг/мл | 0.070 нг/мл | |||
Представляет практический интерес определение оптических изомеров флаванонов. Так, достигнуто хиральное разделение шести пар изомеров (флаванона, нарингенина, гесперетина, эриодиктиола, ликвиритигенина и пиностромбина) на колонке Chiralpak AD-3R (2.1 × 150 мм, 3 мкм) с тройным квадрупольным тандемным масс-спектрометрическим детектированием в режиме мониторинга множественных реакций [15].
Развитие и внедрение ультра-ВЭЖХ в аналитическую практику нашло отражение и в хроматографии флаванонов [29]. Так, показана возможность одновременного определения нарирутина, нарингина, гесперидина, неогесперидина, и их агликонов нарингенина и гесперетина в растительном сырье в условиях ультра-ВЭЖХ с УФ-детектированием при 280 нм [13]. Диапазоны определяемых содержаний составляют 2.50–20.0 мкг/мл для нарирутина, нарингина, гесперидина, неогесперидина, 1.25–10.0 мкг/мл для нарингенина и 5.00–40.0 мкг/мл для гесперетина.
Для определения флаванонов в цитрусовых фруктах успешно использовано матричное твердофазное диспергирование образца с последующим ультра-ВЭЖХ-определением. Детектирование осуществляют на квадруполь-времяпролетном масс-спектрометре высокого разрешения с технологией разделения по ионной подвижности, что обеспечивает упрощение масс-спектров за счет лучшего разрешения пиков и нивелирования влияния фона. Метод позволяет определять нарирутин, нарингин, гесперидин и неогесперидин в диапазоне 0.01–5 мкг/мл с пределами обнаружения 3.70, 5.36, 6.52 и 5.77 нг/мл соответственно [14].
Ультра-ВЭЖХс тандемным масс-спектрометрическим детектированием в режиме выбранных реакций обеспечивает одновременное определение 11 флаванонов. Диапазоны определяемых содержаний равны 0.4–1000 нг/мл для эриоцитрина, гесперидина, неогесперидина и эриодиктиола, 0.4–300 нг/мл для ликвиритина, 0.8–1000 нг/мл для нарирутина и нарингина, 0.4–100 нг/мл для ликвиритигенина, 0.4–700 нг/мл для нарингенина и пиноцембрина, 0.8–700 нг/мл для гесперетина. Метод успешно апробирован на образцах растительного сырья (люцерне, золотарнике, фацелии, гречихе, лакрице, лаванде) [16].
Ряд работ [30–34] посвящен определению флаванонов (главным образом нарингина, гесперидина и их агликонов) в плазме крови человека и животных в рамках фармакокинетических исследований с помощью ультра-ВЭЖХ с тандемным масс-спектрометрическим детектированием.
Во всех рассмотренных примерах ультра-ВЭЖХ-определения в качестве подвижной фазы используют те же элюенты, что и в случае ВЭЖХ, а для детектирования чаще всего выбирают тандемную масс-спектрометрию [14, 16, 30–34], в том числе высокого разрешения [14, 30]. Метод обеспечивает лучшее разрешение хроматографических пиков флаванонов за счет уменьшения длины колонки и размера частиц сорбента (≤2 мкм). Ультра-ВЭЖХ характеризуется более высокой чувствительностью по сравнению с ВЭЖХ, позволяет снизить расход элюента и сократить продолжительность разделения, а следовательно, и анализа в целом.
Другое направление в хроматографии флаванонов – использование высокоэффективной тонкослойной хроматография (ВЭТСХ), считающейся универсальным методом исследования растительного сырья [35, 36]. ВЭТСХ позволяет проводить селективное определение отдельных флаванонов. Например, предложен нормально-фазовый ВЭТСХ-способ определения гесперидина в метанольных экстрактах кожуры цитрусовых фруктов на силикагеле 60 F254 с УФ-детектированием при 286 нм. В качестве подвижной фазы использовали смесь этилацетата, метанола и воды (15 : 3 : 2, по объему). Диапазон определяемых содержаний гесперидина составляет 100–800 нг/пятно с пределом обнаружения 8.87 нг/пятно [37]. Сходный подход позволяет оп-ределять нарингин в экстрактах щавеля пузырчатого с применением смеси этилацетата, ледяной уксусной кислоты, метанола и воды (30 : 10 : 5 : 1, по объему) в качестве элюента и денситометрического детектирования при 275 нм в режиме отражения [38]. Интервал определяемых содержаний нарингина составляет 100–1000 нг/полосу, а предел обнаружения – 36.9 нг/полосу.
Двумерная ВЭТСХ в сочетании с поверхностно-усиленной рамановской спектроскопией обеспечивает успешное разделение и определение 14 флаваноидов, характерных для цитрусовых, в том числе флаванонов (нарингина, гесперидина, нарингенина и гесперетина) [39]. Разделение компонентов достигается в течение 5 мин элюированием последовательно смесью дихлорметана с метанолом (20 : 1), содержащей 1% уксусной кислоты, а затем смесью петролейного эфира с ацетоном (6 : 4) (рис. 2). Градуировочные зависимости линейны в диапазонах 30–300 мкМ для нарингенина, нарингина и гесперидина и 30–250 мкМ для гесперетина, а пределы обнаружения составляют 10 мкМ для всех флаванонов. Практическая применимость метода продемонстрирована на образцах апельсинового сока и цедре свежего апельсина. ВЭТСХ-способ характеризуется в 4.5 раза меньшей продолжительностью анализа по сравнению с ВЭЖХ (10 и 45 мин соответственно) и сопоставимой точностью, что делает его привлекательным для рутинного лабораторного анализа.
Рис. 2.
ТСХ-разделение 14 флавоноидов при (а) элюировании смесью дихлорметана (ДХМ) с метанолом (МТ) (20 : 1), содержащей 1% уксусной кислоты; (б) элюировании смесью петролейного эфира (ПЭ) с ацетоном (АТ) (6 : 4); (в) двумерное разделение при последовательном элюировании смесями ДХМ–МТ (20 : 1) и ПЭ–АТ (6 : 4). Флавоноиды: 1–10 – полиметоксифлавоны, 11 – нарингенин, 12 – гесперетин, 13 – нарингин, 14 – гесперидин). Цитировано по [39] с разрешения Elsevier.

Одним из недостатков вышеупомянутых ВЭТСХ-подходов является использование в составе элюентов токсичных органических растворителей. Эта проблема успешно решена в условиях обращенно-фазовой ВЭТСХ на пластинах с С18 модифицированным силикагелем 60 F254S с подвижной фазой этанол–вода (50 : 50, по объему) [40]. Линейность денситометрического отклика гесперидина при 287 нм наблюдается в интервале 20–2000 нг/полосу с пределом обнаружения 7.02 ± 0.28 нг/полосу. Способ применен для определения гесперидина в различных экстрактах кожуры цитрусовых фруктов и лекарственных средствах.
Капиллярный электрофорез. Метод капиллярного электрофореза активно развивается и успешно применяется в анализе растительного сырья [41]. Способность флаванонов к ионизации успешно используется для их электрофоретического определения. Зонный капиллярный электрофорез с различными типами детектирования позволяет проводить одновременное определение флаванонов в объектах растительного происхождения, в том числе в присутствии фенольных соединений других классов [42–48]. Достижения в этом направлении обобщены в табл. 3. Для разделения аналитов чаще всего используют капилляры из плавленого кварца и боратный буферный раствор с рН 8.45–9.5 в качестве фонового электролита. Время разделения составляет от 8 до 25 мин в зависимости от накладываемого напряжения, параметров капилляра и природы аналитов. Электрохимическое детектирование [46–49] обеспечивает более широкие диапазоны определяемых содержаний и низкие пределы обнаружения флаванонов по сравнению с диодно-матричным и масс-спектрометрическим, что подтверждает высокую чувствительность электрохимического отклика детекторов на аналиты. Кроме того, использование электрохимического детектирования дает возможность миниатюризации системы, а также снижения объемов вводимой пробы и электролита.
Таблица 3.
Электрофоретические способы определения флаванонов и их аналитические возможности
| U, кВ | lкап, см | Электролит | t, мин | Детектор | Флаванон | Диапазон определяемых концентраций | Предел обнаружения | Объект анализа |
Литера-тура |
|---|---|---|---|---|---|---|---|---|---|
| Диодно-матричное детектирование | |||||||||
| 25 | 50 | 10 мМ боратный буферный раствор с рН 8.5 | 10 | λ = 214 нм | Нарингин | 3.12–200 мкг/мл | 0.406 мкг/мл | Цитрусовые соки, слива | [42] |
| Нарингенин | 3.12–200 мкг/мл | 0.313 мкг/мл | |||||||
| 24 | 45 | 40 мМ боратный буферный раствор с рН 8.9 | 11 | λ = 210 нм | Нарингин | 2.5–100 мкМ | 0.143 мкМ | Растительное сырье | [43] |
| Нарингенин | 2.5–100 мкМ | 0.098 мкМ | |||||||
| 17 | 50 | 25 мМ боратный буферный раствор с рН 9.0 + + 17.5 мМ BMIM-PF6 | 8 | λ = 214 нм | Гесперидин | 1–200 мкг/мл | 0.444 мкг/мл | Апельсиновый и лимонный соки | [44] |
| Тандемная масс-спектрометрия | |||||||||
| 25 | 100 | Боратный буферный раствор с рН 9.5 | — | m/z 459.1 | Нарингин | 5–50 мг/л | 0.99 мг/л | Цедра апельсина и померанца | [45] |
| m/z 301.0 и 489.1 | Неогесперидин | 5–50 мг/л | 0.23 мг/л | ||||||
| m/z 271.0 | Нарирутин | 25–80 мг/л | 0.38 мг/л | ||||||
| m/z 301.0 | Гесперидин | 25–80 мг/л | 1.15 мг/л | ||||||
| Электрохимическое детектирование | |||||||||
| 12 | 75 | 60 мМ боратный буферный раствор с рН 9.0 | 25 | Угольный
дисковый
электрод Е=0.95 В |
Гесперидин | 1–100 мкг/мл | 0.5 мкг/мл | Кожура и сок грейпфрута | [46] |
| Нарингин | 1–100 мкг/мл | 0.35 мкг/мл | |||||||
| Гесперетин | 1–100 мкг/мл | 0.14 мкг/мл | |||||||
| Нарингенин | 1–100 мкг/мл | 0.16 мкг/мл | |||||||
| 12 | 75 | 80 мМ боратный буферный раствор с рН 8.45 | 20 | Угольный дисковый электрод Е = 0.85 В |
Нарингин | 1–1000 мкг/мл | 0.05 мкг/мл | Сушеные плоды померанца | [47] |
| Гесперидин | 0.05–100 мкг/мл | 0.01 мкг/мл | |||||||
| Нарингенин | 0.5–500 мкг/мл | 0.1 мкг/мл | |||||||
| 12 | 40 | 50 мМ боратный буферный раствор с рН 9.2 | 12 | МУНТ–полиуретан композитный электрод Е = 0.8 В |
Гесперидин | 1–1000 мкМ | 0.22 мкМ | Цедра помело | [48] |
| Нарингин | 1–1000 мкМ | 0.28 мкМ | |||||||
| Гесперетин | 1–1000 мкМ | 0.24 мкМ | |||||||
| Нарингенин | 1–1000 мкМ | 0.31 мкМ | |||||||
| 9 | 40 | 50 мМ боратный буферный раствор с рН 9.2 | 8 | МУНТ–фенол-формальдегидная смола композитный электрод Е = 0.8 В |
Гесперидин | 1–1000 мкМ | 0.78 мкМ | Citrus reticulata Blanco | [49] |
Оригинальный подход к электрофоретическому определению гесперетина и нарингенина в присутствии 6-гидроксифлавона и биоханина А основан на использовании бесконтактного детектора проводимости [50]. Разделение аналитов достигается в течение 6 мин на модифицированном полиимидом капилляре с эффективной длиной 58 см при напряжении 30 кВ в среде 1.0 мМ хромата натрия с рН 9.5. Диапазон определяемых содержаний гесперетина и нарингенина составляет 1–10 мкг/мл в пределами обнаружения 0.15 и 0.17 мкг/мл соответственно. К преимуществам бесконтактного детектора проводимости следует отнести высокую чувствительность (пределы обнаружения в 8 и 6 раз ниже, чем для УФ-детектора в аналогичных условиях разделения), а также низкий уровень шумов. Подход использован для определения нарингина в лекарственном средстве Синупрет®.
Дальнейшее развитие в области электрофоретического определения флаванонов может быть направлено на миниатюризацию с помощью микрофлюидных электрофоретических устройств, а также расширение числа одновременно детектируемых аналитов.
Спектральные методы характеризуются простотой и доступностью, достаточной экспрессностью и поэтому привлекательны для рутинного использования. Флаваноны характеризуются достаточно интенсивным поглощением в областях 300–330 нм и 277–295 нм, связанным с присутствием колец В и А в структуре флаванонов соответственно. Такие полосы поглощения характерны для различных классов природных фенольных соединений. Появление заместителей в кольцах А и/или В, как правило, приводит к гипсо- или батохромным сдвигам полос [51].
Возможно определение флаванонов с помощью УФ-спектроскопии и флуориметрии. В качестве аналита выступает обычно гесперидин [52–55], реже нарингенин [56, 57]. Аналитические возможности УФ-спектроскопического определения флаванонов иллюстрирует табл. 4. Представляет интерес подход к определению гесперидина в апельсиновых соках, основанный на обработке образца специфичным ферментом гесперидин 6-O-α-L-рамнозил-β-D-глюкозидазой из грибов Acremonium sp. DSM 24697 и последующем УФ-детектировании образующегося гесперетина при 323 нм [52]. Ферментативная реакция проводится непосредственно в кювете в течение 10 мин при 60°С при перемешивании. Подход исключает необходимость предварительной пробоподготовки образца, что является преимуществом по сравнению с хроматографическими способами.
Таблица 4.
УФ-спектроскопические способы определения флаванонов и их аналитические возможности
| Аналит | λ, нм | Растворитель | Диапазон определяемых концентраций | Предел обнаружения | Объект анализа | Литера-тура |
|---|---|---|---|---|---|---|
| Гесперидин | 323 | 50 мМ фосфатный буферный раствор с рН 8.0 | 0–9 мкМ | 1.8 мкМ | Апельсиновые соки | [52] |
| 283 | 60% метанол (pH 6.4) | 1.83–24.5 мкг/мл | 0.9 мкг/мл | Лекарственные средства | [53] | |
| 269 | 0.2 М NaOH | 3–25 мкг/мл | — | [54] | ||
| 285 | 0.2 М NaOH | 5–50 мкг/мл | 0.139 мкг/мл | [55] | ||
| Нарингенин | 288 | Метанол | 2–12 мкг/мл | 0.52 мкг/мл | Твердые дисперсии нарингенина | [56] |
| 283.49 | Метанол | 0–25 мкг/мл | 0.1137 мкг/мл | Твердые липидные наночастицы с инкапсулированным нарингенином | [57] |
Как видно из табл. 4, основными объектами анализа являются лекарственные средства на основе гесперидина. При этом особое внимание уделяется возможности одновременного определения гесперидина и диосмина [54, 55], что обусловлено составом лекарственных средств. Одним из подходов к решению этой задачи является использование производной спектрофотометрии при пересечении нулевой линии [54]. Определение нарингенина проводится для оценки его высвобождения из твердых дисперсий [56] и липидных наночастиц [57] в рамках исследований по поиску новых лекарственных форм на его основе.
Разработан простой и чувствительный флуориметрический способ определения гесперидина в лекарственных формах и плазме крови с внесенным гесперидином [58], основанный на тушении флуоресценции (λвозб = 248 нм, λэмиссии = 494 нм) Tb3+ в среде Трис-HCl буферного раствора с рН 8.5 за счет образования комплекса Tb3+ с гесперидином состава 1 : 3. Диапазон определяемых содержаний составляет 3.28–16.4 мкмоль, а предел обнаружения – 0.14 мкмоль. По аналогичному принципу можно определять диосмин, для которого длина волны возбуждения и эмиссии флуоресценции составляют 275 и 549 нм соответственно.
Основным недостатком спектроскопических способов является низкая селективность определения флаванонов, что ограничивает их практическую применимость для анализа объектов растительного происхождения (лекарственного растительного сырья, фруктов и продукции на их основе), содержащих широкий круг фенольных соединений различных классов и являющихся основным источником флаванонов. С другой стороны, в этом случае флаваноны могут использоваться в качестве стандарта при определении общего содержания фенольных соединений. Например, в работе [53] при анализе лекарственного средства “Витамин С с цитрусовыми биофлавоноидами и шиповником” для этих целей использован гесперидин. В настоящее время спектроскопические методы практически не применяют для определения индивидуальных флаванонов.
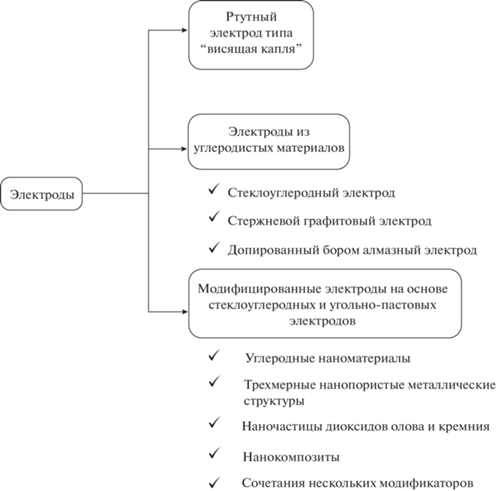
Электрохимические методы. Присутствие фенольных фрагментов в структуре флаванонов обусловливает их электрохимическую активность и возможность использования методов электроанализа для их определения. Однако до недавнего времени число работ в этой области было невелико. Рост внимания исследователей к флаванонам как объектам электроанализа возрос в последнее пятилетие, однако этот класс флавоноидов является наименее изученным по сравнению с остальными. В качестве аналитов рассматривали лишь гесперидин, нарингин, эриодиктиол и их агликоны. Для их определения предложены различные типы электродов (рис. 3).
Полярография. Первые работы по электрохимическому определению флаванонов основаны на использовании ртутного электрода типа “висящая капля” в условиях инверсионной полярографии [59–61]. Гесперидин и нарингин образуют комплексы со ртутью, которые восстанавливаются при –0.2 и –0.4 В [59] и –0.25 и –0.42 В [60] соответственно в среде фосфатный буферный раствор (рН 11)–ацетонитрил (1 : 1). Для определения использовали оба пика восстановления после предварительного накопления, условия которого варьируются для каждого аналита в зависимости от потенциала пика восстановления. Для гесперидина диапазоны определяемых содержаний составляют 0.164–3.28 мкМ с пределом обнаружения 0.137 мкМ для пика при –0.2 В и 8.19–41 мкМ с пределом обнаружения 0.101 мкМ для пика при –0.4 В после накопления при –0.15 В в течение 60 с [59]. Для нарингина линейные зависимости токов восстановления наблюдаются в диапазонах 0.172–3.44 мкМ с пределом обнаружения 0.055 мкМ после накопления при –0.05 В в течение 10 с для пика при –0.25 В и 17.2–69 мкМ с пределом обнаружения 10 мкМ после накопления при –0.2 В в течение 30 с для пика при ‒0.42 В [60]. Аналогичный подход основан на адсорбционном концентрировании гесперидина или его комплекса с медью(II) на ртутном электроде типа “висящая капля” [61]. В последнем случае в режиме квадратно-волновой инверсионной полярографии удается определять следовые количества гесперидина в диапазоне 9.0–184 нМ с пределом обнаружения 4.89 нМ. Тем не менее рассмотренные полярографические способы характеризуются значимыми недостатками, которые ограничивают их практическую применимость. Во-первых, это низкая селективность отклика флаванонов в присутствии ионов металлов, других флавоноидов, органических соединений (щавелевой, глутаровой и аскорбиновой кислот, аланина) и поверхностно-активных веществ, которые существенно влияют на пики восстановления вплоть до их полного исчезновения [59–61]. Во-вторых, это необходимость использования двух пиков восстановления при различных потенциалах, отличающихся условиями проведения измерений, в зависимости от концентрации флаванона. Это осложняет анализ реальных объектов, содержание аналитов в которых неизвестно. В-третьих, использование ртутных электродов в настоящее время запрещено в большинстве стран мира вследствие токсичности паров ртути.
Электроды из углеродистых материалов. Упомянутые выше ограничения частично снимаются при использовании стеклоуглеродного электрода (СУЭ) [62], одноразового стержневого графитового электрода [63], в том числе электрохимически активированного [64–66], и допированного бором алмазного электрода [67]. Рассмотрено электроокисление эриодиктиола на СУЭ в водной среде и показано, что пик окисления по первой ступени связан с обратимым окислением пирокатехинового фрагмента [62].
Представляет интерес одноразовый стержневой графитовый электрод – относительно новый тип электродов в электроанализе, одним из преимуществ которого является отсутствие стадии очистки электродной поверхности перед каждым измерением и высокая воспроизводимость электродной поверхности. Такие электроды ранее не применялись для определения флаванонов. Показана возможность определения гесперидина на одноразовом стержневом графитовом электроде в среде буферного раствора Бриттона–Робинсона с рН 1.81 в условиях дифференциально-импульсной вольтамперометрии (ДИВ) [63]. Градуировочная зависимость линейна в диапазоне 0.10–12 мкМ, а предел обнаружения составляет 0.0858 мкМ. Для улучшения этих параметров предложен инверсионный вариант с предварительным накоплением продукта окисления гесперидина при потенциале 1.000 В в течение 60 с, что обеспечивает линейный диапазон 0.050–1.00 мкМ с пределом обнаружения 0.019 мкМ гесперидина. Установлено, что в режиме ДИВ нарингин и галловая кислота не мешают определению гесперидина, тогда как пик окисления диосмина полностью перекрывается с пиком гесперидина. Подход апробирован при анализе пищевых добавок [63].
Разработаны способы вольтамперометрического определения гесперидина [64], нарингенина [65] и нарингина [66] на электрохимически активированных одноразовых стержневых графитовых электродах. Для электроактивации поверхности можно использовать потенциодинамический [64] и потенциостатический режимы [65, 66]. Показано, что активация пятикратным сканированием потенциала от –0.6 до 2.0 В со скоростью 50 мВ/с в среде фосфатного буферного раствора с рН 7.0 обеспечивает восьмикратное увеличение токов окисления гесперидина [64]. Потенциостатическая активация при 2.000 В в течение 60 с в той же среде приводит к 5- и 1.3-кратному увеличению токов окисления нарингенина [65] и нарингина [66] соответственно. Эти эффекты обусловлены увеличением площади поверхности электрода, что подтверждено экспериментально, а также образованием кислородсодержащих функциональных групп. В условиях ДИВ в среде ацетатного буферного раствора с рН 5.0 отклик гесперидина линеен в диапазоне 0.5–10 мкМ, а предел обнаружения составляет 0.2 мкМ [64]. Подход использован в анализе монокомпонентного лекарственного средства на основе гесперидина, содержащего в качестве вспомогательных компонентов диоксид кремния и крахмал. Мещающее влияние других типов соединений не рассматривается. Для определения нарингенина рассмотрены ДИВ и квадратно-волновая вольтамперометрия (КВВ) на фоне 0.05 М гидрофталата натрия при рН 4.0 [65]. Оба метода характеризуются близкими аналитическими характеристиками и позволяют определять нарингенин в диапазонах 0.0786–0.762 и 0.762–95.4 мкМ с пределом обнаружения 0.0306 мкМ для ДИВ и 0.0750–7.50 и 7.50–100 мкМ с пределом обнаружения 0.0440 мкМ для КВВ. Определение нарингина в режиме адсорбционной ДИВ возможно в диапазоне концентраций 0.6–8.0 мкМ с пределом обнаружения 0.135 мкМ после предварительного накопления в течение 240 с при потенциале 0.0 В [66]. Определение нарингенина и нарингина неселективно, поэтому подходы [65, 66] использованы для определения антиоксидантной емкости соков и кожуры грейпфрутов, обусловленной присутствием фенольных антиоксидантов.
Адсорбционная инверсионная КВВ на допированном бором алмазном электроде в среде 0.1 М хлорной кислоты предложена для определения гесперидина в пищевых добавках [67]. Электрохимическое концентрирование при 0.4 В в течение 30 с обеспечивает диапазон определяемых концентраций 4.09–115 мкМ, а предел обнаружения 1.2 мкМ. Эти характеристики существенно уступают полученным на упомянутых выше электродах. Однако допированный бором алмазный электрод менее подвержен загрязнению поверхности продуктами реакции, удобен в эксплуатации и применим для решения задач фармацевтического анализа. Мешающее влияние аскорбиновой кислоты не позволяет проводить прямое определение гесперидина в некоторых лекарственных формах, апельсинах и продуктах на их основе, являющихся основными источниками гесперидина. В этом случае требуется предварительная обработка образца аскорбатоксидазой, что повышает трудоемкость и снижает экономичность анализа.
Главный недостаток всех упомянутых выше подходов к определению флаванонов – исключение в ряде случаев из рассмотрения мешающего влияния неорганических и органических соединений различных классов либо низкая селективность отклика флаванонов в присутствии структурно родственных соединений. Кроме того, имеются резервы для улучшения аналитических и операционных характеристик. Перечисленные проблемы удается преодолеть в той или иной степени с помощью химически модифицированных электродов.
Модифицированные электроды. К различным типам модификаторов можно отнести углеродные наноматериалы [68–73], трехмерные нанопористые металлические структуры [74, 75], наночастицы диоксидов олова [76] и кремния [77], а также различные нанокомпозиты [78–82] и сочетания нескольких модификаторов с послойным нанесением [83–90]. Аналитические возможности модификаторов обобщены в табл. 5. Следует отметить, что практически все модифицированные электроды характеризуются селективностью отклика на флаваноны в присутствии типичных мешающих компонентов, таких как неорганические ионы (Na+, K+, Mg2+, Ca2+, Al3+, Zn2+, Cl–, ${\text{NO}}_{3}^{ - },$ ${\text{SO}}_{4}^{{2 - }},$ ${\text{PO}}_{4}^{{3 - }}$ и т.д.), аскорбиновая кислота, сахариды (глюкоза, фруктоза, сахароза, рамноза). Представляет интерес оценка мешающего влияния других фенольных соединений, в первую очередь, структурно родственных.
Таблица 5.
Аналитические характеристики определения флаванонов на химически модифицированных электродах
| Электрод | Режим | Аналит | Фоновый электролит | ПрО, мкМ | Диапазон определяемых содержаний, мкМ | Объект анализа | Литера-тура |
|---|---|---|---|---|---|---|---|
| Углеродные наноматериалы | |||||||
| МУНТ/СУЭ | АдДИВ | Эриодиктиол | 0.1 М ацетатный буферный раствор с рН 4.7 | 0.0011 | 0.0035–3.5 | Скорлупа арахиса | [68] |
| МУНТ/СУЭ | ВА | Нарингин Гесперидин |
0.2 М фосфатный буферный раствор с рН 7.0 | — — |
0–30 0–20 |
Экстракт сока грейпфрута | [69] |
| МУНТ/УПЭ печатный | АдИКВВ | Гесперидин | Буферный раствор Бриттона–Робинсона с рН 1.0 | 0.0073 | 0–30 | Апельсиновый сок | [70] |
| ОУНТ/СУЭ | ВА | Нарингенин | 0.1 М фосфатный буферный раствор с рН 2.0 | 0.020 | 0.080–5.0 и 5.0–12 | Fructus Aurantii Immaturus | [71] |
| Электровосстано-вленный ОГ/СУЭ | АдДИВ | Эриоцитрин | 0.1 М ацетатный буферный раствор с рН 4.8 | 0.00084 | 0.017–0.59 | Лимоны | [72] |
| Электровосстано-вленный ОГ/ОУНТ-СООН/СУЭ | АдВА | Гесперетин | 0.1 М фосфатный буферный раствор с рН 2.0 | 0.020 | 0.050–3.0 | Моча и китайское лекарственное средство Flos buddlejae | [73] |
| Пористые трехмерные наноструктуры металлов | |||||||
| 3D нанопористый Ni/УПЭ печатный | ДИВ | Нарирутин | Этанол + 0.1 М цитратный буферный раствор рН 4.0 (40:60) | 0.039 | 0.10–10 | Yellow water | [74] |
| 3D нанопористая Pt/УПЭ печатный | ВА | Гесперидин Нарирутин |
0.1 М H2SO4 | 6.61 0.21 |
10–400 10–500 |
[75] | |
| Наночастицы оксидов металлов и неметаллов | |||||||
| SnO2–ЦПБ/СУЭ | АдДИВ | Гесперидин | 0.1 М фосфатный буферный раствор с рН 7.0 | 0.077 | 0.10–10 и 10–75 | Апельсиновые соки | [76] |
| Мезопористый SiO2–УПЭ | АдДИВ | Гесперидин | 0.1 М фосфатный буферный раствор с рН 8.0 | 0.25 | 0.5–25 | Традиционные препараты китайской медицины | [77] |
| Композитные наноматериалы | |||||||
| Наночастицы CeO2– ПДДА-функционализированный графен/СУЭ | АдДИВ | Эриоцитрин | 0.1 М фосфатный буферный раствор с рН 2.0 | 0.0007 | 0.010–1.0 | Лимон | [78] |
| Наночастицы CoS2–нанолисты MoS2–ПДДА-функционализированный графен/СУЭ | ДИВ | Эриоцитрин | 0.1 М фосфатный буферный раствор с рН 2.0 | 0.00067 | 0.002–1.0 | Лимон | [79] |
| Наногетерострукту-ры SnS2–наноленты восстановленного ОГ/СУЭ | АдДИВ | Нарингенин | 0.1 М фосфатный буферный раствор с рН 3.0 | 0.313 | 0.49–56.6 | Плазма крови и моча с внесенным аналитом | [80] |
| Нильский синий–МУНТ-COOH/УПЭ | ДИВ | Нарингенин | 0.1 М фосфатный буферный раствор с рН 7.0 | 0.30 | 0.9–10 и 10–50 | Виноградный, томатный и апельсиновый соки с внесенным аналитом | [81] |
| Бриллиантовый зеленый–нанопластины графена/УПЭ | ДИВ | Гесперидин | 0.1 М фосфатный буферный раствор рН 7.5 | 0.050 | 0.10–7.0 и 7.0–100 | Лимонный сок, экстракты цедры апельсина и листьев мяты | [82] |
| Послойная комбинация модификаторов различных типов | |||||||
| In situ ДДС/МУНТ-COOH/СУЭ | ДВА | Нарингин | Буферный раствор Бриттона–Робинсона с рН 8.0 | 0.14 | 0.75–25 и 25–100 | Грейпфрутовые соки | [83] |
| Наночастицы Au/Электровосстановленный ОГ/СУЭ | А | Гесперидин | 0.1 М ацетатный буферный раствор с рН 3.6 | 0.0082 | 0.050–8.0 | Pericarpium Citri Reticulatae | [84] |
| Поли(эллаговая
кислота)/МУНТ/ СУЭ |
ДИВ | Нарингин | 0.1 М фосфатный буферный раствор с рН 6.5 | 0.014 | 0.050–1.0 и 1.0–100 | Грейпфрутовые соки | [85] |
| Полиалюминон/ ОУНТф/СУЭ |
ДИВ | Гесперидин Нарингин |
0.1 М фосфатный буферный раствор с рН 5.0 | 0.029 0.020 |
0.10–2.5 и 2.5–25 0.10–2.5 и 2.5–25 |
Апельсиновые и грейпфрутовые соки | [86] |
| Полимеры с молекулярными отпечатками | |||||||
| Поли(о-амино-фенол)/ГЭ | А | Нарингин | 0.1 М ацетатный буферный раствор с рН 3.3 | 16 | 60–140 | Апельсиновые соки | [87] |
| Поли (о-аминотио-фенол)/Наночасти-цы Au/Ультрадис-персный активиро-ванный уголь/СУЭ | ДИВ | Гесперидин | 0.1 М фосфатный буферный раствор с рН 2.0 | 0.045 | 0.085–30 | Препарат китайской медицины chenpi | [88] |
| ДНК-сенсоры | |||||||
| Двунитевая ДНК/ПДДА–МУНТ-СООН/ГЭс | ДИВ | Нарингин | 0.50 М ацетатный буферный раствор рН 4.8 + 20 мМ NaCl | 0.017 | 0.10–1000 | Грейпфрутовый, апельсиновый и лимонный соки | [89] |
| Двунитевая ДНК/ Поли(2,6-пиридин-дикарбоновая кислота)/восстановленный ОГ/СУЭ | ДИВ | Гесперидин | 0.50 М ацетатный буферный раствор рН 4.8 + 20 мМ NaCl | 0.24 | 0.82–82 | Плазма крови | [90] |
Обозначения: ПрО – предел обнаружения, МУНТ – многостенные углеродные нанотрубки, АдДИВ – адсорбционная дифференциально-импульсная вольтамперометрия, ВА – вольтамперометрия с линейной разверткой потенциала, УПЭ – угольно-пастовый электрод, АдИКВВ – адсорбционная инверсионная квадратно-волновая вольтамперометрия, ОУНТ – одностенные углеродные нанотрубки, ОГ – оксид графена, ОУНТ-COOH – карбоксилированные одностенные углеродные нанотрубки, АдВА – адсорбционная вольтамперометрия с линейной разверткой потенциала, ДИВ – дифференциально-импульсная вольтамперометрия, ЦПБ – цеитилпиридиний бромид, ПДДА – поли(диаллилдиметиламмоний хлорид), МУНТ-COOH – карбоксилированные многостенные углеродные нанотрубки, ДДС – додецилсульфат натрия, ДВА – дифференциальная вольтамперометрия, А – амперометрия, ОУНТф – функционализированные полиаминобензолсульфоновой кислотой одностенные углеродные нанотрубки, ГЭ – графитовый электрод, ГЭс – стержневой графитовый электрод.
Электроды, модифицированные углеродными наноматериалами. Одним из наиболее широко применяемых типов модификаторов электродной поверхности являются углеродные наноматериалы. Много- (МУНТ) [68–70] и одностенные [71] углеродные нанотрубки, электровосстановленный оксид графена [72, 73] показали электрокаталитические свойства по отношению к окислению гесперидина, нарингина, эриоцитрина и их агликонов. Варьирование типов углеродных наноматериалов и условий получения их суспензий позволяет управлять откликом флаванонов. Так, сопоставление вольт-амперных характеристик гесперидина и нарингина на СУЭ, модифицированных 1D (МУНТ), 2D (оксидом графена) и 3D (углеродной сажей Ketjen black EC300J) структурированными материалами, диспергированными в нафионе показало, что наилучший отклик наблюдается для электрода на основе многостенных углеродных нанотрубок [69]. Это обусловлено большим числом структурных дефектов, sp2-гибридизованных атомов углерода и меньшим количеством кислородсодержащих функциональных групп, чем у оксида графена. Углеродная чернь Ketjen black EC300J обладает высокой электропроводимостью и дает высокие фоновые токи, что приводит к менее выраженным откликам флаванонов.
Оксид графена характеризуется низкой проводимостью; для ее повышения проводят его электровосстановление [72, 73]. Этот способ характеризуется экспрессностью по сравнению с химическими методами, не требует использования восстановителей, многие из которых токсичны, а также легко контролируется и позволяет получать воспроизводимые покрытия. Сочетание электровосстановленного оксида графена с одностенными углеродными нанотрубками обеспечивает синергетический эффект двух модификаторов [73].
Аналитические характеристики определения флаванонов на электродах, модифицированных углеродными наноматериалами, значительно улучшаются по сравнению с таковыми на электродах из традиционных углеродных материалов [68–73]. Кроме того, преимуществом модифицированных углеродными наноматериалами электродов является селективность отклика флаванонов в присутствии широкого круга неорганических ионов и органических соединений, в том числе аскорбиновой кислоты, глюкозы, рибофлавина, витамина B1, а также структурно близких соединений. Например, определению эриоцитрина не мешают 100-кратные избытки гесперидина, нарингина, нарирутина и дидимина [72]. С другой стороны, ионы меди(II) при низких концентрациях оказывают мешающее влияние при определении нарингенина на электроде, модифицированном одностенными углеродными нанотрубками [71], что хорошо согласуется с данными [61]. В работе [70] селективность оклика гесперидина не рассматривается.
Электроды на основе трехмерных нанопористых металлических структур стали активно использоваться в органическом электроанализе. Для определения флаванонов предложены печатные углеродные электроды, модифицированные трехмерными пористыми наноструктурами никеля [74] и платины [75]. Такие структуры имеют губчатоподобную морфологию (рис. 4), что обеспечивает большую площадь поверхности, меньшую плотность и большее число активных центров не только на поверхности модификатора, но и в порах. Кроме того, создание трехмерной нанопористой структуры может улучшить электрохимические характеристики электрода, облегчая процесс диффузии целевого аналита, уменьшая забивание пор и повышая чувствительность отклика электрода [91]. Покрытие на основе пористого никеля (рис. 4а) получали путем электроосаждения при плотности тока –0.6 А/см2 в течение 40 с в присутствии пузырьков водорода как динамического темплата [74]. В случае трехмерных наноструктур пористой платины использовали 15-кратное циклирование потенциала от 1.2 до –0.6 В со скоростью 100 мВ/с в растворе, содержащем 1.0 мМ H2PtCl6 и 1.0 мМ CuSO4 в 0.5 М H2SO4. На каждом катодном скане происходит электроосаждение сплава Pt–Cu, а на анодном – растворение меди, что приводит к формированию трехмерной пористой структуры платины (рис. 4б) [75].
Рис. 4.
(а) СЭМ-изображение 3D наноструктурированного пористого Ni/УПЭ, полученного при плотности тока ‒0.6 А/см2. Цитировано по [74] с разрешения Elsevier. (б) СЭМ-изображение 3D наноструктурированного пористого Pt/УПЭ. Цитировано по [75] с разрешения Elsevier. 50 000x увеличение. УПЭ – печатный угольно-пастовый электрод.

Оба электрода обеспечивают статистически достоверное увеличение токов окисления флаванонов по сравнению с немодифицированным электродом и характеризуются селективностью отклика в присутствии других флаванонов, что позволяет использовать их в анализе “yellow water” (жидких остатков, образующихся после мытья апельсиновых плодов, дистилляции и производства эфирного масла) [74, 75]. Для проведения измерения достаточно 50 мкл разбавленного в 20 [74] или 2.5 раза [75] образца. Электрод на основе трехмерных наноструктур пористой платины позволяет одновременно определять нарирутин и гесперидин.
Электроды, модифицированные наночастицами оксидов металлов и неметаллов, не получили широкого применения в качестве модификаторов электродной поверхности для определения флаванонов. Так, разработан СУЭ, модифицированный наночастицами диоксида олова(IV), диспергированными в 0.50 мМ катионном поверхностно-активном веществе (ПАВ) цетилпиридиний бромиде, для определения гесперидина в апельсиновых соках [76]. При этом ПАВ выполняет двойную роль: выступает в качестве стабилизатора дисперсии наночастиц диоксида олова(IV) вследствие электростатического взаимодействия (наночастицы несут поверхностный отрицательный заряд) и обеспечивает концентрирование гесперидина на электродной поверхности за счет гидрофобных взаимодействий, в частности π–π стэкинга, что подтверждается данными для катионных ПАВ, не содержащих в структуре ароматические фрагменты. Поверхностная концентрация гесперидина составляет 69 ± 1 пмоль/см2 [76]. Предложенный модификатор обеспечивает 7.4-кратный рост токов окисления по сравнению с СУЭ без использования предварительного адсорбционного накопления.
Электрод на основе мезопористого диоксида кремния также обеспечивает значимый рост токов окисления гесперидина, обусловленный увеличением эффективной площади поверхности электрода вследствие присутствия пор и каналов в структуре модификатора, а также адсорбцией аналита [77].
Аналитические характеристики методик определения гесперидина на этих электродах сопоставимы с таковыми для других модифицированных электродов и позволяют определять его в реальных объектах. Достоинством электродов на основе наночастиц диоксидов олова и кремния является селективность их отклика в присутствии других природных фенольных соединений (нарингина, кверцетина, рутина, морина, кофейной и хлорогеновой кислот [76], танжеретина, цитромитина и нобилетина [77]).
Электроды, модифицированные композитными наноматериалами. В настоящее время нанокомпозиты активно используют в качестве модифицирующих покрытий электродов. Применительно к определению флаванонов описаны композиты наночастиц оксидов [78] и сульфидов [79, 80] металлов, а также красителей [81, 82] с углеродными наноматериалами. Композиты на основе наночастиц [78–80] получают химическим путем в несколько стадий с использованием большого числа вспомогательных реагентов (рис. 5). Конечный композит получают в автоклавах при 120–200°С в течение 8–12 ч, а затем центрифугируют, тщательно отмывают этанолом и водой и высушивают под вакуумом в течение 8–10 ч. Затем ультразвуковым диспергированием в течение 1–3 ч получают суспензии наноматериала в воде [78, 79] или водно-этанольной смеси [80]. Таким образом, процедура является трудоемкой и требует контроля структуры получающихся нанокомпозитов. Способы получения композитов на основе красителей проще в исполнении. В суспензию соответствующего наноматериала в подходящем растворителе (этаноле [81] или диметилформамиде [82]), полученную ультразвуковым диспергированием, добавляют необходимое количество красителя и снова подвергают ультразвуковой обработке в течение 30 [81] или 15 мин [82]. Электродную поверхность модифицируют рассматриваемыми нанокомпозитами методом капельного испарения.
Рис. 5.
Схематическое представление нанокомпозита из восстановленного оксида графена (ОГ), функционализированного ПДДА, наночастиц CoS2 и нанолистов MoS2 как модификатора электродной поверхности для вольтамперометрического определения эриоцитрина. Цитировано по [79] с разрешения Elsevier. ПДДА – поли(диаллилдиметиламмоний хлорид).
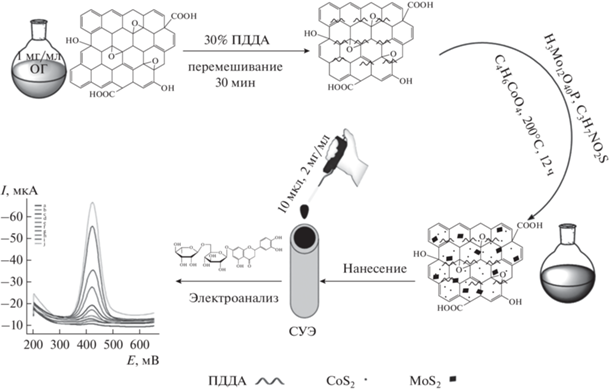
Электроды на основе композитов наночастиц оксидов и сульфидов металлов дают чувствительный отклик на эриоцитрин [78, 79] и нарингенин [80]. Аналитические характеристики, достигнутые при определении эриоцитрина, существенно превосходят таковые для СУЭ, модифицированного электровосстановленным оксидом графена [81]. Кроме того, показана селективность отклика эриоцитрина в присутствии 10-кратных избытков других флаванонов (гесперетина, нарингенина, нарирутина), а также флавоноидов (10-кратного избытка диосмина и 3-кратного избытка рутина). Для нарингенина мешающее влияние структурно родственных соединений не рассматривали, поскольку в качестве объектов анализа выбрали биологические жидкости. Показано, что компоненты нарингинсодержащих лекарственных средств и биологических жидкостей (аскорбиновая и мочевая кислоты, глюкоза, лактоза, сахароза, крахмал и целлюлоза) не мешают его определению [80].
Композиты на основе красителей [81, 82] дают менее чувствительный отклик на флаваноны, но достигнутые аналитические характеристики позволяют успешно их использовать для анализа реальных объектов. Кроме того, электроды просты в изготовлении, определение проводится при физиологических значениях рН и не требуется предварительное накопление аналитов, что значительно уменьшает продолжительность измерения, а также исключает возможность адсорбции других электроактивных компонентов из анализируемого объекта.
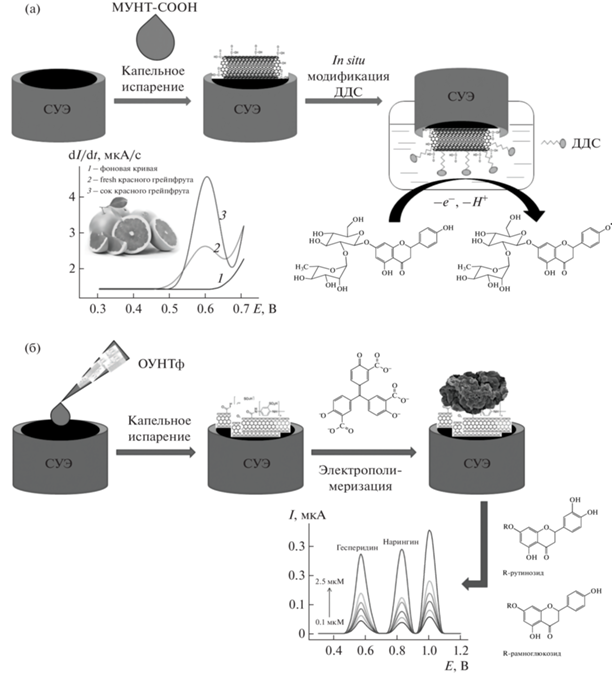
Комбинации модификаторов различных типов. Другой подход к модификации электродной поверхности заключается в послойном нанесении нескольких типов модификаторов. Так, электроды, модифицированные углеродными наноматериалами [83–86], применяют в качестве платформы для последующего нанесения модификаторов различного типа. Для этого можно использовать подход in situ (рис. 6а), который реализован, например, для нанесения додецилсульфата натрия на электрод, модифицированный карбоксилированными многостенными углеродными нанотрубками методом капельного испарения [83]. Такой подход к модификации обеспечивает чувствительный отклик нарингина за счет гидрофобных взаимодействий с молекулами ПАВ, адсорбированными на электродной поверхности. Однако при получении покрытия in situ необходимо строго соблюдать время контакта электрода со средой, чтобы обеспечить воспроизводимость электродной поверхности. Преимуществами описанного подхода являются простота изготовления электрода, экспрессность, достаточная чувствительность и высокая селективность определения нарингина в присутствии фенольных кислот (галловой, кофейной и п-кумаровой) и флавоноидов (катехина, кверцетина и рутина).
Рис. 6.
Схематическое изображение (а) СУЭ, модифицированного карбоксилированными многостенными углеродными нанотрубками (МУНТ-COOH) и in situ додецилсульфатом натрия (ДДС) для вольтамперометрического определения нарингина; (б) СУЭ, послойно модифицированного функционализированными полиаминобензолсульфоновой кислотой одностенными углеродными нанотрубками (ОУНТф) и электрополимеризованным алюминоном для одновременного вольтамперометрического определения гесперидина и нарингина.
Применение электрохимической модификации позволяет получать покрытия различных типов. Так, электроосаждение наночастиц золота на поверхности модифицированного электровосстановленным оксидом графена СУЭ [84] обеспечивает узкое и равномерное распределение наночастиц по размеру (30–40 нм) с формированием трехмерного покрытия, что приводит к росту площади поверхности электрода и обеспечивает эффективную адсорбцию гесперидина и высокую чувствительность его определения.
Представляет интерес формирование полимерных покрытий на поверхности модифицированных углеродными нанотрубками СУЭ в условиях потенциодинамического электролиза [85, 86]. В качестве мономеров использовали эллаговую кислоту (димер галловой кислоты лактонового типа) [85] и алюминон [86]. Присутствие фенольных фрагментов в их структуре приводит к формированию непроводящих полимерных покрытий, что характерно для электрополимеризации фенольных соединений [92]. Использование углеродных нанотрубок в качестве подложки обеспечивает достаточную проводимость электрода, а также большую площадь поверхности и, следовательно, более равномерное распределение полимерного покрытия, увеличение его количества на электроде и стабилизацию [92]. Поскольку свойства получаемого полимерного покрытия зависят от концентрации мономера, фонового электролита и условий электрополимеризации, необходима оптимизация этих параметров. Как показано на природных фенольных антиоксидантах [93–95], параметры электрополимеризации следует оптимизировать по отклику целевых аналитов. Применительно к флаванонам установлено, что электрополимеризацию эллаговой кислоты следует проводить из 10 мкМ раствора мономера семикратным циклированием потенциала от 0.0 до 1.0 В со скоростью 100 мВ/с в фосфатном буферном растворе с рН 7.0 [85], а для получения полиалюминона необходимо использовать 100 мкМ раствор мономера и десятикратное сканирование потенциала от 0.1 до 0.8 В со скоростью 100 мВ/с в 0.1 М растворе NaOH [86]. Оба электрода демонстрируют чувствительный и селективный отклик на флаваноны в присутствии структурно подобных соединений. Модифицированный полиалюминоном электрод впервые предложен для одновременного определения нарингина и гесперидина [86] (рис. 6б). Позже для решения этой задачи разработан электрод на основе многостенных углеродных нанотрубок, диспергированных в нафионе [69], однако отсутствуют данные по пределам обнаружения флаванонов и селективности определения.
Полимеры с молекулярными отпечатками как модификаторы электродной поверхности. Одним из современных подходов к повышению селективности определения аналитов является создание полимеров с молекулярными отпечатками. Этот подход успешно реализован при определении нарингина и гесперидина, для которых созданы электроды, модифицированные электрохимически полученными полимерами с молекулярными отпечатками. Поли(о-аминофенол) с молекулярными отпечатками нарингина получен в условиях циклической вольтамперометрии на графитовом электроде [87]. Оригинальный электрод на основе полимера с молекулярными отпечатками предложен для определения гесперидина в препаратах традиционной китайской медицины [88]. Для этого использована послойная модификация СУЭ ультрадисперным активированным углем с высокой проводимостью с последующим электроосаждением наночастиц золота. Затем электрод помещали на 12 ч в раствор, содержащий о-аминотиофенол и гесперидин, при этом происходила самоорганизация мономера на электродной поверхности за счет взаимодействия тиольных групп с наночастицами золота. Электрополимеризацию проводили методом циклической вольтамперометрии (13 циклов от –1.0 до 1.0 В со скоростью 50 мВ/с). Темплат удаляли выдерживанием электрода при перемешивании в 0.1 M растворе Na2HPO4 в течение 40 мин. Электрод характеризуется высокой селективностью отклика на гесперидин в присутствии гесперетина, рутина, кверцетина, пуэрарина, нарингенина, что позволяет использовать его в анализе растительных объектов со сложным фенольным составом. На одном электроде можно выполнить три измерения, после которых необходимо заново получать модифицирующее покрытие.
ДНК-сенсоры. При определении природных фенольных соединений чаще всего используют ферментные биосенсоры, позволяющие находить их суммарное содержание в образце [96]. В биосенсорах другого типа в качестве чувствительного слоя используют ДНК. Показана возможность определения нарингина и гесперидина с помощью электрохимических ДНК-сенсоров по уменьшению токов окисления гуанина и/или аденина [89, 90]. Для иммобилизации двунитевой ДНК из молок сельди использовали стержневой графитовый электрод, модифицированный кар-боксилироваными многостенными углеродными нанотрубками, диспергированными в поли(диаллилдиметиламмоний хлориде) [89], или СУЭ, модифицированный послойно электровосстановленным оксидом графена и электрополимеризованной 2,6-пиридиндикарбоновой кислотой [90]. Применение таких подложек обеспечивает закрепление большего количества ДНК на электродной поверхности за счет увеличения площади электрода. Кроме того, присутствие катионного поли(диаллилдиметиламмоний хлорида) обеспечивает электростатическое взаимодействие с отрицательно заряженными молекулами ДНК [89]. В случае полимерного покрытия происходит сорбция ДНК, зависящая от времени, которое составило 20 мин [90]. Оба сенсора показали не лучшие аналитические характеристики. Более того, для ДНК-сенсора на гесперидин отсутствуют данные по селективности отклика [90], хотя приведены результаты анализа плазмы крови с внесенным гесперидином. ДНК-сенсор на нарингин селективен в присутствии 200-кратных избытков рутина, икариина, нарингенина и гесперидина, 100-кратных избытков неорганических ионов, никотинамида, аскорбиновой и лимонной кислот, фруктозы и глюкозы, что позволило использовать его в анализе свежевыжатых и коммерческих грейпфрутовых, апельсиновых и лимонных соков [89].
Фотоэлектрохимический сенсор для определения нарингина основан на использовании допированного фтором SnO2-электрода, модифицированного электроосажденным CdS и композитом на основе TiO2 и комплекса хлоропротопорфирина IX с железом(III) [97]. В среде фосфатного буферного раствора с рН 7.0 фототок регистрируется в условиях амперометрии при потенциале 0.0 В. Диапазон определяемых содержаний нарингина составил 1–332 мкМ, а предел обнаружения – 0.03 мкМ. Аналитический сигнал характеризуется высокой воспроизводимостью и стабильностью. Определению нарингина не мешают аскорбиновая, галловая и лимонная кислоты, гесперидин, нарингенин, флавон и кверцетин, что позволяет использовать такой подход в анализе цитрусовых соков.
* * *
Анализ литературы показал, что флаваноны представляют интерес как объекты анализа, для идентификации и определения которых обычно используют хроматографические и электрофоретические методы с различными типами детектирования, среди которых все больше внимания уделяют ультра-ВЭЖХ с масс-спектрометрическим детектированием, в том числе в тандемном варианте, а также зонному капиллярному электрофорезу с электрохимическим детектированием. Дальнейшее развитие хроматографических подходов связано с идентификацией новых флаванонов, извлекаемых из растительного сырья, с применением масс-спектрометрии высокого разрешения и разработкой способов их определения. При этом представляет практический интерес использование “зеленых растворителей” в качестве подвижных фаз, особенно в ВЭТСХ. Для зонного капиллярного электрофореза актуально увеличение числа одновременно детектируемых флаванонов и миниатюризация систем, что может быть достигнуто за счет применения модифицированных капилляров и электрохимического детектирования соответственно.
Аналитические возможности спектральных методов при определении флаванонов крайне ограничены вследствие недостаточной селективности УФ-спектроскопии и флуориметрии. Объектами анализа могут быть лишь однокомпонентные лекарственные средства, число которых невелико. Для объектов сложного состава (лекарственного растительного сырья, фруктов, продуктов питания) возможно определение суммарного содержания флаванонов. Для повышения селективности определения индивидуальных флаванонов необходимо разрабатывать способы селективной экстракции целевого аналита либо синтезировать специфические фотометрические или флуоресцентные реагенты.
Проблема селективности отклика флаванонов является актуальной и для электрохимических методов анализа. Для решения этой задачи используют химически модифицированные электроды, обеспечивающие в ряде случаев высокую селективность отклика флаванонов в присутствии структурно родственных соединений, в том числе того же класса. В качестве модификаторов электродной поверхности чаще всего используют углеродные наноматериалы, их композиты с оксидами и сульфидами металлов, красителями, а также комбинации с послойно нанесенными полимерными покрытиями, наночастицами золота, ПАВ, ДНК. Композитные материалы характеризуются многоступенчатой и длительной процедурой синтеза и очистки, но аналитические характеристики определения флаванонов сопоставимы с таковыми для других модификаторов. Модификаторы, получаемые электрохимически, обеспечивают более широкие диапазоны определяемых содержаний флаванонов, низкие пределы обнаружения и селективность отклика, высокую воспроизводимость электродной поверхности и при этом характеризуются простотой синтеза. Высокая селективность отклика характерна для электродов, модифицированных полимерами с молекулярными отпечатками флаванонов, однако исследования в этом направлении практически не ведутся.
В целом флаваноны как объекты электроанализа – один из наименее изученных классов флавоноидов. В качестве объектов анализа рассмотрены лишь гесперидин, нарингин, эриодиктиол и их агликоны. Представляет интерес расширение круга аналитов, тем более что они специфичны для отдельных видов растительного сырья. Другое перспективное направление исследований связано с разработкой способов одновременного определения нескольких флаванонов. Для решения этой проблемы необходимы новые модификаторы электродной поверхности, сочетающие высокую чувствительность и селективность отклика на целевые флаваноны. Структура поверхности модификатора, в частности присутствие пор определенного размера, может обеспечить эффективное разделение агликонов и гликозидов флаванонов. Актуальное направление исследований флаванонов – миниатюризация электрохимических систем, в том числе уже существующих, представляет практический интерес, но пока остается не реализованной. Таким образом, разработка простых и экспрессных способов определения флаванонов, характеризующихся надежностью получаемых результатов и применимых в рутинной практике, остается востребованной.
Список литературы
Зиятдинова Г.К., Будников Г.К. Природные фенольные антиоксиданты в биоаналитической химии: состояние проблемы и перспективы развития // Успехи химии. 2015. Т. 84. № 2. С. 194. (Ziyatdinova G.K., Budnikov H.C. Natural phenolic antioxidants in bioanalytical chemistry: State of the art and prospects of development // Russ. Chem. Rev. 2015. V. 84. № 2. P. 194. )https://doi.org/10.1070/RCR4436
Veitch N.C., Grayer R.J. Flavonoids and their glycosides, including anthocyanins // Nat. Prod. Rep. 2008. V. 25. № 3. P. 555. https://doi.org/10.1039/B718040N
Barreca D., Gattuso G., Bellocco E., Calderaro A., Trombetta D., Smeriglio A., Lagan G., Daglia M., Meneghini S., Nabavi S.M. Flavanones: Citrus phytochemical with health-promoting properties // Biofactors. 2017. V. 43. № 4. P. 495. https://doi.org/10.1002/biof.1363
Ghosal A., Satoh H., Thomas P.E., Bush F., Moore D. Inhibition and kinetics of cytochrome P4503A activity in microsomes from rat, human, and cDNA-expressed human cytochrome P450 // Drug. Metab. Dispos. 1996. V. 24. № 9. P. 940.
Constantin R.P., do Nascimento G.S., Constantin R.P., Salgueiro C.L., Bracht A., Ishii-Iwamoto E.L., Yamamoto N.S., Constantin J. Citrus flavanones affect hepatic fatty acid oxidation in rats by acting as prooxidant agents // BioMed Res. Int. 2013. V. 2013. Article 342973. https://doi.org/10.1155/2013/342973
Shen N., Wang T., Gan Q., Liu S., Wang L., Lin B. Plant flavonoids: Classification, distribution, biosynthesis, and antioxidant activity // Food Chem. 2022. V. 383. Article 132531. https://doi.org/10.1016/j.foodchem.2022.132531
Veitch N.C., Grayer R.J. Chalcones, dihydrochalcones, and aurones / Flavonoids: Chemistry, Biochemistry and Applications / Eds. Andersen O.M., Markham K.R. Boca Raton: CRC Press LLC, 2006. P. 1003.
Khan M.K., Zill-E-Huma, Dangles O. A comprehensive review on flavanones, the major citrus polyphenols // J. Food Compos. Anal. 2014. V. 33. № 1. P. 85. https://doi.org/10.1016/j.jfca.2013.11.004
Durazzo A., Lucarini M., Souto E.B., Cicala C., Caiazzo E., Izzo A.A., Novellino E., Santini A. Polyphenols: A concise overview on the chemistry, occurrence, and human health // Phytother. Res. 2019. V. 33. № 9. P. 2221. https://doi.org/10.1002/ptr.6419
Регистр лекарственных средств России: Энциклопедия лекарств. Вып. 30 / Под ред. Вышковского Г.Л. M.: ВЕДАНТА, 2021. 1536 с.
Zhang C., Bucheli P., Liang X., Lu Y. Citrus flavonoids as functional ingredients and their role in traditional Chinese medicine // Food. 2007. V. 1. № 2. P. 287.
e Silva L.C.R.C., David J.M., Borges R. dos S.Q., Ferreira S.L.C., David J.P., dos Reis P.S., Bruns R.E. Determination of flavanones in orange juices obtained from different sources by HPLC/DAD // J. Anal. Methods Chem. 2014. V. 2014. Article 296838. https://doi.org/10.1155/2014/296838
Hejniak J., Baranowska I., Stencel S., Bajkacz S. Separation and determination of selected polyphenols from medicinal plants // J. Chromatogr. Sci. 2019. V. 57. № 1. P. 17. https://doi.org/10.1093/chromsci/bmy075
Zheng H., Zhen X.-T., Chena Y., Zhua S.-C., Ye L.-H., Yang S.-W., Wang Q.-Y., Cao J. In situ antioxidation-assisted matrix solid-phase dispersion microextraction and discrimination of chiral flavonoids from citrus fruit via ion mobility quadrupole time-of-flight high-resolution mass spectrometry // Food Chem. 2021. V. 343. Article 128422. https://doi.org/10.1016/j.foodchem.2020.128422
Baranowska I., Hejniak J., Magiera S. LC-ESI-MS/MS method for the enantioseparation of six flavanones // Anal. Methods. 2017. V. 9. № 6. P. 1018. https://doi.org/10.1039/C6AY02952C
Bajkacz S., Baranowska I., Buszewski B., Kowalski B., Ligor M. Determination of flavonoids and phenolic acids in plant materials using SLE-SPE-UHPLC-MS/MS method // Food Anal. Methods. 2018. V. 11. № 12. P. 35. https://doi.org/10.1007/s12161-018-1332-9
Seo C.-S., Shin H.-K. Simultaneous analysis for quality control of traditional herbal medicine, gungha-tang, using liquid chromatography–tandem mass spectrometry // Molecules. 2022. V. 27. № 4. Article 1223. https://doi.org/10.3390/molecules27041223
Zeng X., Su W., Zheng Y., Liu H., Li P., Zhang W., Liang Y., Bai Y., Peng W., Yao H. UFLC-Q-TOF-MS/MS-based screening and identification of flavonoids and derived metabolites in human urine after oral administration of Exocarpium Citri Grandis extract // Molecules. 2018. V. 23. № 4. Article 895. https://doi.org/10.3390/molecules23040895
Aziz N., Khan M.N., Ali A., Khadim A., Muhsinah A.B., Uddin J., Musharraf S.G. Rapid analysis of flavonoids based on spectral library development in positive ionization mode using LC-HR-ESI-MS/MS // Arab. J. Chem. 2022. V. 15. № 4. Article 103734. https://doi.org/10.1016/j.arabjc.2022.103734
Tine Y., Yang Y., Renucci F., Costa J., Wélé A., Paolini J. LC-MS/MS analysis of flavonoid compounds from Zanthoxylum zanthoxyloides extracts and their antioxidant activities // Nat. Prod. Commun. 2017. V. 12. № 12. P. 1865. https://doi.org/10.1177/1934578X1701201213
Ribeiro I.A., Ribeiro M.H.L. Naringin and naringenin determination and control in grapefruit juice by a validated HPLC method // Food Control. 2008. V. 19. № 4. P. 432. https://doi.org/10.1016/j.foodcont.2007.05.007
Ni H., Zhang S.F., Gao Q.F., Hu Y., Jiang Z.D., Chen F. Development and evaluation of simultaneous quantification of naringin, prunin, naringenin, and limonin in citrus juice // Food Sci. Biotechnol. 2015. V. 24. № 4. P. 1234. https://doi.org/10.1007/s10068-015-0159-z
Musmade K.P., Trilok M., Dengale S.J., Bhat K., Reddy M.S., Musmade P.B., Udupa N. Development and validation of liquid chromatographic method for estimation of naringin in nanoformulation // J. Pharm. 2014. V. 2014. Article 864901. https://doi.org/10.1155/2014/864901
Büyüktuncel E. Fast determination of naringin and hesperidin in natural and commercial citrus juices by HPLC method // Asian J. Chem. 2017. V. 29. № 11. P. 2384. https://doi.org/10.14233/ajchem.2017.20675
Erlund I., Meririnne E., Alfthan G., Aro A. Plasma kinetics and urinary excretion of the flavanones naringenin and hesperetin in humans after ingestion of orange juice and grapefruit juice // J. Nutr. 2001. V. 131. № 2. P. 235. https://doi.org/10.1093/jn/131.2.235
Xie F., Wulster-Radcliffe M., Hilt R., Kissinger C.B., Kissinger P.T. Determination of naringenin in rat plasma with the Culex® automated blood sampler coupled with liquid chromatography/electrochemistry // Asian J. Drug Metab. Pharmacokinet. 2004. V. 4. № 1. P. 29.
Diaconu C., Vlase L., Cuciureanu M., Filip L. Assessment of flavonoids content in citrus juices using a LC/MS method // Farmacia. 2017. V. 65. № 1. P. 92.
Perlatti B., Fernandes J.B., Silva M.F.G.F., Ardila J.A., Carneiro R.L., Souza B.H.S., Costa E.N., Eduardo W.I., Boiça Junior A.L., Forim M.R. Application of a quantitative HPLC-ESI-MS/MS method for flavonoids in different vegetables matrices // J. Braz. Chem. Soc. 2016. V. 27. № 3. P. 475. https://doi.org/10.5935/0103-5053.20150273
Csuti A., Sik B., Ajtony Z. Measurement of naringin from citrus fruits by high-performance liquid chromatography – A review // Crit. Rev. Anal. Chem. 2022. https://doi.org/10.1080/10408347.2022.2082241
Baira E., Dagla I., Siapi E., Zoumpoulakis P., Tsarbopoulos A., Simitzis P., Goliomytis M., Deligeorgis S.G., Skaltsounis A.-L., Gikas E. Development of a validated UHPLC-ESI (-)-HRMS methodology for the simultaneous quantitative determination of hesperidin, hesperetin, naringin, and naringenin in chicken plasma // Food Anal. Methods. 2019. V. 12. № 5. P. 1187. https://doi.org/10.1007/s12161-018-01420-4
Ma Y., Zhang Y., Zhai Y., Zhu Z., Pan Y., Qian D., Su S., Fan X., Duan J. Development of a UPLC-TQ/MS approach for the determination of eleven bioactive components in Haizao Yuhu decoction plus-minus Haizao and Gancao drug combination after oral administration in a rat model of hypothyroidism // Molecules. 2017. V. 22. № 1. Article 7. https://doi.org/10.3390/molecules22010007
Yuan J., Wei F., Luo X., Zhang M., Qiao R., Zhong M., Chen H., Yang W. Multi-component comparative pharmacokinetics in rats after oral administration of Fructus aurantia Extract, naringin, neohesperidin, and naringin-neohesperidin // Front. Pharmacol. 2020. V. 11. Article 933. https://doi.org/10.3389/FPHAR.2020.00933
Chen T., Wu H., He Y., Pan W., Yan Z., Liao Y., Peng W., Gan L., Zhang Y., Su W., Yao H. Simultaneously quantitative analysis of naringin and its major human gut microbial metabolites naringenin and 3-(4'-hydroxyphenyl) propanoic acid via stable isotope deuterium-labeling coupled with RRLC-MS/MS Method // Molecules. 2019. V. 24. № 23. Article 4287. https://doi.org/10.3390/molecules24234287
Zeng X., Su W., Liu H., Zheng Y., Chen T., Zhang W., Yan Z., Bai Y., Yao H. Simultaneous determination of rosuvastatin, naringin and naringenin in rat plasma by RRLC–MS/MS and its application to a pharmacokinetic drug interaction study // J. Chromatogr. Sci. 2018. V. 56. № 7. P. 611. https://doi.org/10.1093/chromsci/bmy034
Meier B., Sprian D. Modern HPTLC – A perfect tool for quality control of herbals and their preparations // J. AOAC Int. 2010. V. 93. № 5. P. 1399. https://doi.org/10.1093/jaoac/93.5.1399
Mikropoulou E.V., Petrakis E.A., Argyropoulou A., Mitakou S., Halabalaki M., Skaltsounis L.A. Quantification of bioactive lignans in sesame seeds using HPTLC densitometry: Comparative evaluation by HPLC-PDA // Food Chem. 2019. V. 288. P. 1. https://doi.org/10.1016/j.foodchem.2019.02.109
Alam P., Alam A., Anwer Md.K., Alqasoumi S.I. Quantitative estimation of hesperidin by HPTLC in different varieties of citrus peels // Asian Pac. J. Trop. Biomed. 2014. V. 4. № 4. P. 262. https://doi.org/10.12980/APJTB.4.2014C1007
Alam P., Siddiqui N.A., Al-Rehaily A.J., Alajmi M.F., Basudan O.A., Khan T.H. Stability-indicating densitometric high-performance thin-layer chromatographic method for the quantitative analysis of biomarker naringin in the leaves and stems of Rumex vesicarius L. // JPC – J. Planar Chromatogr. 2014. V. 27. № 3. P. 204. https://doi.org/10.1556/JPC.27.2014.3.10
Li Y., Zhao C., Lu C., Zhou S., Tian G., He L., Bao Y., Fauconnier M.-L., Xiao H., Zheng J. Simultaneous determination of 14 bioactive citrus flavonoids using thin-layer chromatography combined with surface enhanced Raman spectroscopy // Food Chem. 2021. V. 338. Article 128115. https://doi.org/10.1016/j.foodchem.2020.128115
Foudah A.I., Shakeel F., Alam P., Alqarni M.H., Abdel-Kader M.S., Alshehri S. A sustainable reversed-phase HPTLC method for the quantitative estimation of hesperidin in traditional and ultrasound-assisted extracts of different varieties of citrus fruit peels and commercial tablets // Agronomy. 2021. V. 11. № 9. Article 1744. https://doi.org/10.3390/agronomy11091744
Przybylska A., Gackowski M., Koba M. Application of capillary electrophoresis to the analysis of bioactive compounds in herbal raw materials // Molecules. 2021. V. 26. № 8. Article 2135. https://doi.org/10.3390/molecules26082135
Memon A.F., Solangi A.R., Memon S.Q., Mallah A., Memon N., Memon A.A. Simultaneous determination of quercetin, rutin, naringin, and naringenin in different fruits by capillary zone electrophoresis // Food. Anal. Methods. 2017. V. 10. № 1. P. 83. https://doi.org/10.1007/s12161-016-0552-0
Şanlı S., Lunte C. Determination of eleven flavonoids in chamomile and linden extracts by capillary electrophoresis // Anal. Methods. 2014. V. 6. № 11. P. 3858. https://doi.org/10.1039/C3AY41878B
Memon A.F., Solangi A.R., Memon S.Q., Mallah A., Memon N. Quantitative separation of hesperidin, chrysin, epicatechin, epigallocatechin gallate, and morin using ionic liquid as a buffer additive in capillary electrophoresis // Electrophoresis. 2018. V. 39. № 13. P. 1606. https://doi.org/10.1002/elps.201700421
Sawalha S.M.S., Arráez-Román D., Segura-Carretero A., Fernández-Gutiérrez A. Quantification of main phenolic compounds in sweet and bitter orange peel using CE–MS/MS // Food Chem. 2009. V. 116. № 2. P. 567. https://doi.org/10.1016/j.foodchem.2009.03.003
Wu T., Guan Y., Ye J. Determination of flavonoids and ascorbic acid in grapefruit peel and juice by capillary electrophoresis with electrochemical detection // Food Chem. 2007. V. 100. № 4. P. 1573. https://doi.org/10.1016/j.foodchem.2005.12.042
Peng Y., Liu F., Ye J. Quantitative and qualitative analysis of flavonoid markers in Frucus aurantii of different geographical origin by capillary electrophoresis with electrochemical detection // J. Chromatogr. B. 2006. V. 830. № 2. P. 224. https://doi.org/10.1016/j.jchromb.2005.10.043
Ma F., Zhang W., Wang J., Zhang L., Chen G. Fabrication of a carbon nanotube-polyurethane composite electrode by in situ polyaddition for use in amperometric detection in capillary electrophoresis // Microchim. Acta. 2016. V. 183. № 9. P. 2579. https://doi.org/10.1007/s00604-016-1900-x
Wang X., Wang J., Zhang L., Chen G. Carbon nanotube-phenolic resin composite electrode fabricated by far infrared-assisted crosslinking for enhanced amperometric detection // Electroanalysis. 2019. V. 31. № 4. P. 756. https://doi.org/10.1002/elan.201800604
Bachmann S., Huck C.W., Bakry R., Bonn G.K. Analysis of flavonoids by CE using capacitively coupled contactless conductivity detection // Electrophoresis. 2007. V. 28. № 13. P. 799. https://doi.org/10.1002/elps.200600228
Tsimogiannis D., Samiotaki M., Panayotou G., Oreopoulou V. Characterization of flavonoid subgroups and hydroxy substitution by HPLC-MS/MS // Molecules. 2007. V. 12. № 3. P. 593. https://doi.org/10.3390/12030593
Mazzaferro L.S., Breccia J.D. Quantification of hesperidin in citrus-based foods using a fungal diglycosidase // Food Chem. 2012. V. 134. № 4. P. 2338. https://doi.org/10.1016/j.foodchem.2012.03.107
Kuntić V., Pejić N., Mićić S. Direct spectrophotometric determination of hesperidin in pharmaceutical preparations // Acta Chim. Slov. 2012. V. 59. № 2. P. 436.
Bennani I., Chentoufi M.A., El Otmani I.S., Cheikh A., Bamou N., El Karbane M., Bouatia M. Development and validation of two spectrophotometric methods for simultaneous determination of diosmine and hesperidin in mixture and their applications // J. App. Pharm. Sci. 2020. V. 10. № 7. P. 100.
Srilatha D., Nasare M., Nagasandhya B., Prasad V., Diwan P. Development and validation of UV spectrophotometric method for simultaneous estimation of hesperidin and diosmin in the pharmaceutical dosage form // ISRN Spectroscopy. 2013. V. 2013. Article 534830. https://doi.org/10.1155/2013/534830
Jha D.K., Shah D.S., Talele S.R., Amin P.D. Correlation of two validated methods for the quantification of naringenin in its solid dispersion: HPLC and UV spectrophotometric methods // SN Appl. Sci. 2020. V. 2. № 4. Article 698. https://doi.org/10.1007/s42452-020-2536-3
Sahu A.K., Jain V. Quantification of naringenin encapsulated in solid lipid nanoparticles by validated UV-spectroscopy method // Planta Med. 2015. V. 81. № 5. P. 13. https://doi.org/10.1055/s-0035-1545230
Mohamed D., Tawakkol S.M. Fluorimetric determination of diosmin and hesperidin in combined dosage forms and in plasma through complex formation with terbium // Bull. Fac. Pharm. Cairo Univ. 2013. V. 51. № 1. P. 81. https://doi.org/10.1016/j.bfopcu.2012.12.001
Obendorf D., Reichart E. Determination of hesperidin by cathodic stripping voltammetry in orange juice and helopyrin, a phytopharmaceutical preparation // Electroanalysis. 1995. V. 7. № 11. P. 1075. https://doi.org/10.1002/elan.1140071115
Reichart E., Obendorf D. Determination of naringin in grapefruit juice by cathodic stripping differential pulse voltammetry at the hanging mercury drop electrode // Anal. Chim. Acta. 1998. V. 360. № 1–3. P. 179. https://doi.org/10.1016/S0003-2670(97)00704-6
Temerk Y.M., Ibrahim M.S., Kotb M. Square-wave cathodic adsorptive stripping voltammetric determination of 3-hydroxyflavone, morin and hesperidin in bulk form and biological fluids in absence and presence of Cu(II) // J. Braz. Chem. Soc. 2011. V. 22. № 11. P. 2056. https://doi.org/10.1590/S0103-50532011001100006
de Souza Gil E., Enache A.T., Oliveira-Brett A.M. Anodic behaviour of flavonoids orientin, eriodictyol and robinin at a glassy carbon electrode // Electroanalysis. 2012. V. 24. № 7. P. 1576. https://doi.org/10.1002/elan.201200211
David I.G., Numan N., Buleandră M., Popa D.-E., Lițescu S.C., Riga S., Ciobanu A.M. Rapid voltammetric screening method for the assessment of bioflavonoid content using the disposable bare pencil graphite electrode // Chemosensors. 2021. V. 9. № 11. Article 323. https://doi.org/10.3390/chemosensors9110323
Šafranko S., Stanković A., Asserghine A., Jakovljević M., Hajra S., Nundy S., Medvidović-Kosanović M., Jokić S. Electroactivated disposable pencil graphite electrode – new, cost-effective, and sensitive electrochemical detection of bioflavonoid hesperidin // Electroanalysis. 2021. V. 33. № 4. P. 1063. https://doi.org/10.1002/elan.202060511
David I.G., Lițescu S.C., Popa D.E., Buleandra M., Iordache L., Albu C., Alecu A., Penu R.L. Voltammetric analysis of naringenin at a disposable pencil graphite electrode – Application to polyphenol content determination in citrus juice // Anal. Methods. 2018. V. 10. № 48. P. 5763. https://doi.org/10.1039/C8AY02281J
David I.G., Lițescu S.C., Moraru R., Albu C., Buleandra M., Popa D.E., Riga S., Ciobanu A.M., Noor H. Electroanalysis of naringin at electroactivated pencil graphite electrode for the assessment of polyphenolics with intermediate antioxidant power // Antioxidants. 2022. V. 11. № 12. Article 2306. https://doi.org/10.3390/antiox11122306
Yiğit A., Yardım Y., Şentürk Z. Square-wave adsorptive stripping voltammetric determination of hesperidin using a boron-doped diamond electrode // J. Anal. Chem. 2020. V. 75. № 5. P. 653. https://doi.org/10.1134/S1061934820050184
Cai W.-L., Liu L., Liao X.-Q., Tao K.-L., Feng F., Yang G.-J. Determination of eriodictyol by a modified multiwalled carbon nanotube glassy carbon electrode // Anal. Lett. 2016. V. 49. № 10. P. 1502. https://doi.org/10.1080/00032719.2015.1113423
Xia H.-Q., Gu T., Fan R., Zeng J. Comparative investigation of bioflavonoid electrocatalysis in 1D, 2D, and 3D carbon nanomaterials for simultaneous detection of naringin and hesperidin in fruits // RSC Adv. 2022. V. 12. № 11. P. 6409. https://doi.org/10.1039/D1RA07217J
Sims M.J., Li Q., Kachoosangi R.T., Wildgoose G.G., Compton R.G. Using multiwalled carbon nanotube modified electrodes for the adsorptive striping voltammetric determination of hesperidin // Electrochim. Acta. 2009. V. 54. № 22. P. 5030. https://doi.org/10.1016/j.electacta.2008.10.056
Wang W., Gao J., Wang L., Ye B. Electrochemical behavior of naringenin and its sensitive determination based on a single-walled carbon nanotube modified electrode // Anal. Methods. 2015. V. 7. № 20. P. 8847. https://doi.org/10.1039/C5AY01782C
Yao S., Cai W., Liu L., Liao X., Tao K., Feng F., Yang G. Electrochemical behavior of eriocitrin and highly sensitive determination based on an electrochemically re-duced graphene oxide modified glassy carbon electrode // Anal. Methods. 2016. V. 8. № 18. P. 3722. https://doi.org/10.1039/C6AY00064A
Wu J., Wang L., Wang Q., Zou L., Ye B. The novel voltammetric method for determination of hesperetin based on a sensitive electrochemical sensor // Talanta. 2016. V. 150. P. 61. https://doi.org/10.1016/j.talanta.2015.12.026
Beluomini M.A., Stradiotto N.R., Boldrin M.V. Electrosynthesis of three-dimensional nanoporous nickel on screen-printed electrode used for the determination of narirutin in citrus wastewater // Food Chem. 2021. V. 353. Article 129427. https://doi.org/10.1016/j.foodchem.2021.129427
Beluomini M.A., Stradiotto N.R., Zanoni M.V.B. Simultaneous detection of hesperidin and narirutin in residual water using nanoporous platinum electrosynthesized by alloying-dealloying mechanism // J. Electroanal. Chem. 2022. V. 904. Article 115866. https://doi.org/10.1016/j.jelechem.2021.115866
Ziyatdinova G., Yakupova E., Davletshin R. Voltammetric determination of hesperidin on the electrode modified with SnO2 nanoparticles and surfactants // Electroanalysis. 2021. V. 33. № 12. P. 2417. https://doi.org/10.1002/elan.202100405
Sun D., Wang F., Wu K., Chen J., Zhou Y. Electrochemical determination of hesperidin using mesoporous SiO2 modified electrode // Microchim. Acta. 2009. V. 167. № 1. P. 35. https://doi.org/10.1007/s00604-009-0200-0
Wang L., Wang Q., Sheng K., Li G., Ye B. A new graphene nanocomposite modified electrode as efficient voltammetric sensor for determination of eriocitrin // J. Electroanal. Chem. 2017. V. 785. P. 96. https://doi.org/10.1016/j.jelechem.2016.11.061
Zhang Y., Liu Z., Zou L., Ye B. A new voltammetry sensor platform for eriocitrin based on CoS2-MoS2-P-DDA-GR nanocomposite // Talanta. 2018. V. 189. P. 345. https://doi.org/10.1016/j.talanta.2018.07.004
Teradal N.L., Satpati A.K., Seetharamappa J. A facile one-pot hydrothermal synthesis of tin sulfide-decorated reduced graphene oxide nanoribbons and its sensing application for a flavanone naringenin // J. Electroanal. Chem. 2017. V. 797. P. 89. https://doi.org/10.1016/j.jelechem.2017.05.022
Manasa G., Mascarenhas R.J., Bhakta A.K., Mekhalif Z. MWCNT/Nileblue heterostructured composite electrode for flavanone naringenin quantification in fruit juices // Electroanalysis. 2020. V. 32. № 5. P. 939. https://doi.org/10.1002/elan.201900573
Manasa G., Mascarenhas R.J., Bhakta A.K., Mekhalif Z. Nano-graphene-platelet/Brilliant-green composite coated carbon paste electrode interface for electrocatalytic oxidation of flavanone hesperidin // Microchem. J. 2021. V. 160. Article 105768. https://doi.org/10.1016/j.microc.2020.105768
Ziyatdinova G., Yakupova E., Ziganshina E., Budnikov H. First order derivative voltammetry on the in situ surfactant modified electrode for naringin quantification // Electroanalysis. 2019. V. 31. № 11. P. 2130. https://doi.org/10.1002/elan.201900257
Gao Y., Wu X., Wang H., Lu W., Guo M. Highly sensitive detection of hesperidin using AuNPs/rGO modified glassy carbon electrode // Analyst. 2018. V. 143. № 1. P. 297. https://doi.org/10.1039/C7AN01706E
Ziyatdinova G., Yakupova E., Guss E., Budnikov H. The selective electrochemical sensing of naringin using electropolymerized ellagic acid film // J. Electrochem. Soc. 2020. V. 167. № 10. Article 107502. https://doi.org/10.1149/1945-7111/ab9280
Zhupanova A., Guss E., Ziyatdinova G., Budnikov H. Simultaneous voltammetric determination of flavanones using an electrode based on functionalized single-walled carbon nanotubes and polyaluminon // Anal. Lett. 2020. V. 53. № 13. P. 2170. https://doi.org/10.1080/00032719.2020.1732402
Ma X.-L., Chen R.-Y., Zheng X., Chen X., Chen Z. Preparation and application of naringin sensor based on molecularly imprinting technique // Chinese J. Anal. Chem. 2010. V. 38. № 1. P. 100. https://doi.org/10.3724/SP.J.1096.2010.00100
Sun B., Hou X., Li D., Gou Y., Hu F., Li W., Shi X. Electrochemical sensing and high selective detection of hesperidin with molecularly imprinted polymer based on ultrafine activated carbon // J. Electrochem. Soc. 2019. V. 166. № 15. P. B1644. https://doi.org/10.1149/2.1141915jes
Ensafi A.A., Karbalaei S., Heydari–Bafrooei E., Rezaei B. Biosensing of naringin in marketed fruits and juices based on its interaction with DNA // J. Iran. Chem. Soc. 2016. V. 13. № 1. P. 19. https://doi.org/10.1007/s13738-015-0707-8
Tığ G.A., Bolat E.Ö., Zeybek B., Pekyardımcı Ş. Hesperidin-dsDNA interaction based on electrochemically reduced graphene oxide and poly-(2,6-pyridinedicarboxylic acid) modified glassy carbon electrode // Hacettepe J. Biol. Chem. 2016. V. 44. № 4. P. 487. https://doi.org/10.15671/HJBC.2016.129
Park S., Song Y.J., Han J.-H., Boo H., Chung T.D. Structural and electrochemical features of 3D nanoporous platinum electrodes // Electrochim. Acta. 2010. V. 55. № 6. P. 2029. https://doi.org/10.1016/j.electacta.2009.11.026
Ziyatdinova G., Guss E., Yakupova E. Electrochemical sensors based on the electropolymerized natural phenolic antioxidants and their analytical application // Sensors. 2021. V. 21. № 24. Article 8385. https://doi.org/10.3390/s21248385
Ziyatdinova G., Kozlova E., Budnikov H. Polyquercetin/MWNT-modified electrode for the determination of natural phenolic antioxidants // Electroanalysis. 2017. V. 29. № 11. P. 2610. https://doi.org/10.1002/elan.201700440
Ziyatdinova G., Kozlova E., Budnikov H. Poly(gallic acid)/MWNT-modified electrode for the selective and sensitive voltammetric determination of quercetin in medicinal herbs // J. Electroanal. Chem. 2018. V. 821. P. 73. https://doi.org/10.1016/j.jelechem.2017.12.071
Ziyatdinova G., Zhupanova A., Davletshin R. Simultaneous determination of ferulic acid and vanillin in vanilla extracts using voltammetric sensor based on electropolymerized bromocresol purple // Sensors. 2022. V. 22. № 1. Article 288. https://doi.org/10.3390/s22010288
Forzato C., Vida V., Berti F. Biosensors and sensing systems for rapid analysis of phenolic compounds from plants: a comprehensive review // Biosensors. 2020. V. 10. № 9. Article 105. https://doi.org/10.3390/bios10090105
Sousa C.S., Lima K.C.M.S., Botelho C.N., Pereira N.M., Fernandes R.N., Silva G.G., Damos F.S., Luz R.C.S. Photoelectrochemical sensor for determination of naringin at low oxidation potential using a modified FTO electrode with cadmium sulfide and titanium dioxide sensitized with chloroprotoporphyrin IX iron(III) // J. Solid State Electrochem. 2020. V. 24. № 8. P. 1715. https://doi.org/10.1007/s10008-020-04568-4
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии