Астрономический журнал, 2023, T. 100, № 1, стр. 81-88
О лабораторном моделировании фотосинтеза в широком диапазоне параметров электромагнитного и радиационного окружения
М. А. Гринберг 1, 2, В. А. Воденеев 1, 2, Н. В. Ильин 1, 2, Е. А. Мареев 1, 2, *
1 Нижегородский государственный университет им. Н.И. Лобачевского
Нижний Новгород, Россия
2 Институт прикладной физики РАН
Нижний Новгород, Россия
* E-mail: mareev@ipfran.ru
Поступила в редакцию 03.11.2022
После доработки 11.11.2022
Принята к публикации 11.11.2022
- EDN: NPNBXC
- DOI: 10.31857/S0004629923010024
Аннотация
Дан краткий анализ проблемы исследования пределов устойчивости и механизмов адаптации живых систем к параметрам окружающей среды, изменяющимся в широком диапазоне. Основное внимание уделено анализу электромагнитного окружения и радиационного фона. Эти факторы относительно слабо меняются на современной Земле, что обусловливает их недостаточную изученность. В то же время они представляют серьезные вызовы для будущих космических миссий. Одним из основных методов исследования влияния таких факторов на живые организмы является лабораторное моделирование. Предшествующие эксперименты продемонстрировали необходимость разработки новой лабораторной установки, требования к параметрам которой представлены в настоящей работе. В целом планируемая установка будет иметь высокий потенциал для решения задач моделирования действия астро-геофизических факторов на физиологический статус живых организмов, и, в частности, активность фотосинтеза у высших растений. Реализация предлагаемой программы экспериментов по лабораторному моделированию позволит продвинуться в понимании проблем эволюции жизни, механизмов возможного влияния солнечной активности на биосферу, исследований роли биосферы в глобальных изменениях климата планет на разных временных горизонтах.
1. ВВЕДЕНИЕ
В связи с ростом интереса к освоению ближнего космоса, в частности, c активной разработкой проекта Российской орбитальной станции (РОС), возобновлением российской лунной программы, пристальным вниманием международного сообщества к освоению Марса, первостепенное значение приобретает исследование пределов устойчивости и механизмов адаптации живых систем к изменяющимся в широком диапазоне параметрам окружающей среды. В настоящей работе основное внимание уделено анализу электромагнитного окружения и радиационного фона. Эти факторы относительно слабо меняются на современной Земле, что обусловливает их недостаточную изученность. В то же время они представляют серьезные вызовы для будущих космических миссий.
Одним из основных подходов к такому исследованию является лабораторное моделирование. Возможность контроля условий эксперимента в широком диапазоне изменения внешних параметров, а также использование разнообразных диагностических средств делают этот метод практически незаменимым. Заметим, что в ряде случаев в ходе лабораторного моделирования имеет смысл рассматривать интенсивности факторов, выходящие за пределы существующих в ближнем космосе, так как это может помочь более детально понять механизм и результаты действия этих стрессоров.
Изучение эффектов комбинации различных параметров магнитного поля (МП) и ионизирующего излучения (ИИ) представляет особый интерес, поскольку в природных условиях они тесно связаны между собой. Анализ этой взаимосвязи представляется наиболее удобным на примере относительно более изученного объекта – палео-Земли с учетом динамики и интенсивности факторов в разные геологические эпохи. Согласно палеогеологическим данным и моделям, основанным на динамике внутреннего ядра Земли, величина магнитного дипольного момента нашей планеты ранее в среднем была меньше, чем в настоящую эпоху. При этом интенсивность переменного магнитного поля на отдельных резонансных частотах (шумановские резонансы, ШР) в какие-то исторические периоды могла быть выше. Это связано с природой возникновения резонансов – молниевой активностью. Есть отдельные свидетельства, что МП ШР могут влиять на живые организмы, причем такое влияние может быть частотно-специфичным и связанным именно с частотами ШР [1].
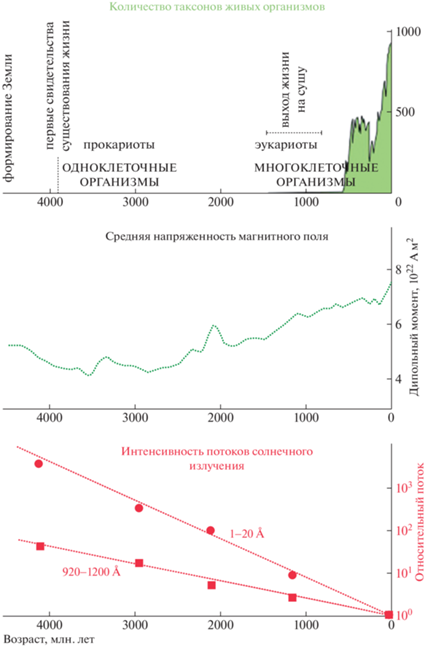
В качестве замечательного примера связи МП и ИИ, а также проявления совместного влияния этих факторов на эволюцию биосферы Земли можно отметить гипотезу, детально проанализированную в работе [2]. На протяжении большей части истории Земли жизнь была ограничена, оставаясь на примитивной стадии и в основном в море. Примерно 0.55 млрд. лет назад жизнь в конечном итоге “взорвалась” и колонизировала континентальное царство. Почему был такой долгий период замедленной эволюции жизни? В ранней жизни преобладали археи и бактерии, которые лучше других организмов переносят ионизирующее излучение. Магнитное поле защищает атмосферу, которая является основным щитом от УФ-излучения. Авторы статьи [2] исследовали гипотезу о том, что кембрийский взрыв жизни мог быть вызван увеличением напряженности диполя магнитного поля из-за затвердевания внутреннего ядра, вызванного охлаждением Земли, и сопутствующим уменьшением со временем потока солнечной энергии с момента зарождения Солнечной системы (см. рис. 1). Следовательно, эти два явления могут быть ответственны за рост и уплотнение атмосферы и развитие жизни на поверхности Земли.
Рис. 1.
(сверху вниз) Многообразие жизни (количество таксонов живых организмов); эволюция среднего магнитного поля; потоки энергичного солнечного излучения (нормированные на современное значение потока) [2].
2. ВЛИЯНИЕ ПАРАМЕТРОВ ЭЛЕКТРОМАГНИТНОГО ОКРУЖЕНИЯ И РАДИАЦИОННОГО ФОНА НА РАСТЕНИЯ
Подчеркнем, что изучение влияния параметров электромагнитного и радиационного окружения на растения особенно значимо, поскольку они являются ключевыми продуцентами и составляют основу экосистем – как природных, так и искусственных в рамках систем жизнеобеспечения [3, 4]. К настоящему времени накоплен достаточно большой объем данных о влиянии этих факторов на общее состояние растений и некоторые ключевые процессы, в первую очередь фотосинтез [5–8]. Известно, что высокие интенсивности факторов вызывают угнетение роста и развития, а низкие могут приводить к стимулированию отдельных процессов [9, 10]. При этом до сих пор имеют место существенные пробелы в понимании механизмов рецепции этих факторов живыми организмами, особенностей их воздействия на физиологию и путей формирования адаптации к ним [7, 11].
Важной проблемой при изучении влияния электромагнитного и радиационного окружения на растения в лабораторных условиях является режим этих факторов: краткосрочное острое или длительное хроническое воздействие [6, 7]. В подавляющем большинстве экспериментов используется кратковременное воздействие высокой интенсивности, эффекты которого оцениваются через различные временные интервалы после воздействия. Практически неисследованными остаются реакции растений, которые возникают непосредственно с момента изменения интенсивности физического фактора. Указанные ограничения обусловлены во многом отсутствием соответствующих лабораторных стендов и установок. Известно также, что биологические ответы, включая ответ фотосинтеза, на один и тот же фактор, действующий в разных режимах (остром и хроническом), существенно различаются [12–14]. Таким образом, для изучения роли электромагнитного и радиационного окружения в рамках задач космической и эволюционной биологии наиболее корректным представляется использование установок, способных обеспечивать хроническое действие этих факторов и регистрировать динамику отклика на них растений.
3. ЛАБОРАТОРНЫЕ УСТАНОВКИ ДЛЯ МОДЕЛИРОВАНИЯ ПАРАМЕТРОВ ЭЛЕКТРОМАГНИТНОГО ОКРУЖЕНИЯ И РАДИАЦИОННОГО ФОНА
В нашем распоряжении в настоящее время имеются лабораторные установки, способные моделировать изменение электромагнитного окружения и радиационного фона (рис. 2) и поддерживать такие условия на протяжении длительного времени, что обеспечивает возможность изучения влияния этих факторов на растения в хроническом режиме.
Рис. 2.
Установки для моделирования повышенного уровня магнитного поля (слева) и радиационного фона (справа).

Установки для создания низкочастотных электромагнитных полей представляют собой кольца Гельмгольца, выполненные в двух размерах. Первая установка (для исследования хронического действия электромагнитного поля, до 1 мес) имеет зону однородного магнитного поля объемом 30 × 30 × 30 см3 и радиус колец 0.5 м (130 витков на каждом из колец, входное сопротивление 50 Ом). Вторая установка (для исследования кратковременного действия электромагнитного поля от минут до часов) имеет зону однородного магнитного поля объемом 20 × 20 × 20 см3 и радиус колец 0.3 м (100 витков на каждом из колец, входное сопротивление 50 Ом). Для работы на выбранной частоте поля используется генератор RIGOL DG1032 (RIGOL Technology Co., Ltd., Китай). Использование двух вариантов установки позволяет осуществлять независимое исследование обоих типов воздействий (кратковременное и хроническое), механизмы влияния которых на живые системы могут существенно различаться.
Установка обеспечивает работу в диапазоне частот от 7 до 30 Гц с точностью установки параметра не хуже 0.1 Гц. Выбранные частоты включают в себя первые 4 гармоники резонанса Шумана в земной атмосфере. Индукция магнитного компонента электромагнитного поля в индукторе может задаваться в диапазоне 0–10 мкТл с относительной точностью 1% (на малой установке с усилением до 200 мкТл). Такой выбор амплитуды магнитного поля определяется необходимостью изучения влияния магнитного поля с частотами, соответствующими резонансу Шумана, как в “микротесловом” (используемом в большинстве исследований влияния магнитных полей на живые системы), так и в “нанотесловом” диапазоне.
Установки дополнительно оборудованы источниками освещения для обеспечения длительного выращивания растений в измененных условиях электромагнитного окружения.
Ключевым элементом установки для создания повышенного радиационного фона является точечный закрытый источник β-излучения на основе солей 90Sr и 90Y. Источник излучения располагается над зоной выращивания растений. Объем зоны с относительно однородной мощностью дозы составляет 25 × 25 × 25 см3. В установке используются источники с активностью 0.1–1 МБк, мощность дозы в зоне эксперимента в зависимости от активности используемого источника составляет 30–300 мкГр/час. Зона проведения эксперимента экранирована оргстеклом толщиной 6 мм. Установка дополнительно оборудована источниками освещения для обеспечения длительного выращивания растений в измененных условиях радиационного окружения.
При помощи описанных установок был выполнен ряд экспериментов по хроническому влиянию низкочастотных магнитных полей (7.8, 14.3, 20.8 Гц; 3–180 мкТл) и ионизирующего излучения низкой интенсивности (30 мкГр/час) на состояние растений и активность их физиологических процессов. Обнаружено, что само по себе изменение электромагнитного и радиационного окружения в указанных диапазонах достаточно слабо влияет на растения, однако их эффект становится значимым при одновременном действии на растения других неблагоприятных факторов среды, таких как тепловой и световой стресс, а также водный дефицит [15–18]. Предположена, а для некоторых стрессовых факторов напрямую показана, большая роль модификации сигнальных систем в ответных реакциях растений под воздействием магнитного поля и ионизирующего излучения. В норме сигнальные системы определяют ответ физиологических процессов, в том числе фотосинтеза, на стрессор и отвечают за формирование адаптации.
Полученные результаты и обнаруженные закономерности обусловливают необходимость модернизации установки, моделирующей условия электромагнитного и радиационного окружения, с целью расширения рабочих диапазонов и снабжения ее модулями создания дополнительных стрессовых условий. Разработанная установка должна также обеспечивать возможность проведения мониторинга развития функционального ответа растений с использованием наиболее эффективных диагностических методик, имеющихся в распоряжении наших лабораторий.
4. МЕТОДЫ ДИАГНОСТИКИ СОСТОЯНИЯ РАСТЕНИЙ ПРИ ДЕЙСТВИИ ФАКТОРОВ СРЕДЫ
Для оценки действия факторов на состояние растений используются разнообразные методы и подходы [19–21]. Интегральное состояние организма оценивают по морфометрическим показателям – длине побегов и корней, площади листьев, сырому и сухому весу. В настоящее время создано программное обеспечение для анализа большинства этих показателей по изображениям с RGB-камер и разработаны 3Д-сканеры, способные строить объемные модели растений для детального изучения их динамики ответа на внешнее воздействие.
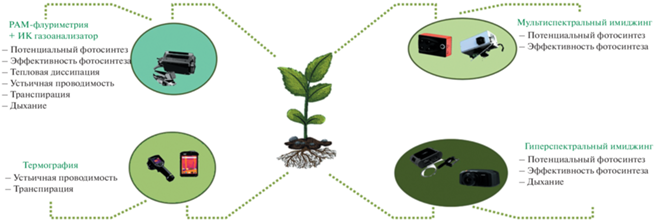
В растительном организме ключевым процессом, который во многом отвечает за итоговый ответ на факторы среды, является фотосинтез [19]. В настоящее время разработаны и используются разнообразные методы изучения структурной целостности и активности работы фотосинтетического аппарата при действии факторов. Методы различаются полнотой получаемой информации (что важно для анализа механизмов действия фактора на фотосинтез), скоростью проведения измерений (важно для изучения временной динамики развития ответа) и возможностью интеграции с другими измерительными приборами и установками для моделирования стрессоров. Наиболее развитыми на сегодня методами для неинвазивного изучения активности фотосинтеза на уровне целого растения являются РАМ-флуориметрия, гипер- и мультиспектральный имиджинг и термография (рис. 3).
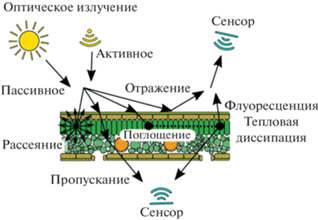
Гипер- и мультиспектральный имиджинг. Метод основан на регистрации спектральных характеристик света, отраженного от листьев растений (рис. 4). В силу процессов, происходящих внутри листа под действием факторов (изменение содержания воды, соотношения пигментов и т.д.), отражение на определенных длинах волн может существенно меняться при постоянстве других областей спектра [21]. Разработано большое количество индексов (NDVI, PRI, ARI, WBI и др.), которые учитывают изменения соотношения отражений на “изменяющейся” и “опорной” длинах волн и тем самым демонстрируют состояние организма при действии внешних факторов. Гиперспектральные камеры позволяют регистрировать спектр с малым шагом (2–3 нм), они хорошо подходят для поиска новых отражательных индексов, но получаемые наборы данных имеют большой размер и сложны в обработке; получение данных занимает относительно много времени. Мультиспектральные камеры регистрируют ограниченное количество спектральных полос, которые были определены как наиболее значимые для детектирования стрессовых состояний у растений. Такой метод считается достаточно информативным, скорость получения данных высокая. Как гипер-, так и мультиспектральные камеры могут использоваться совместно с установками для моделирования действия факторов на растения.
РАМ-флуориметрия. Метод основан на регистрации флуоресценции хлорофилла при воздействии на растение вспышек света заданной интенсивности [22]. В зависимости от предшествующей темновой или световой адаптации позволяет регистрировать различные показатели световой стадии фотосинтеза: степень поврежденности фотосистем, их квантовый выход, скорость транспорта электронов по электрон-транспортной цепи, количество диссипированной в виде тепла энергии и др. Интеграция с инфракрасным газоанализатором позволяет параллельно регистрировать скорость ассимиляции СО2 и оценивать активность темновой стадии фотосинтеза. Наиболее информативный метод, однако для измерений предъявляются высокие требования к предшествующему световому режиму; получение индивидуальных результатов занимает длительное время; возможно ограниченное использование совместно с установками для моделирования действия факторов.
Термография. Метод основан на регистрации температуры поверхности листьев при помощи ИК-камеры [21]. Температура листьев растений определяется интенсивностью транспирации воды через устьица. Устьичная проводимость обладает высокой чувствительностью к внешним воздействиям, что делает ее полезным объектом для изучения влияния низкоинтенсивных факторов. Помимо водного баланса от устьичной проводимости также зависит диффузия СО2 из атмосферы к клеткам листа, что влияет на активность темновой стадии фотосинтеза. Метод термографии дает узкоспециализированную информацию об отдельных стадиях процесса фотосинтеза, но при этом он достаточно прост в использовании, позволяет быстро получать данные и может быть использован совместно с установками для моделирования действия факторов на растения. В то же время необходимо отметить, что различия в температуре листьев могут иметь место в контрольных условиях, без действия неблагоприятных факторов, в частности между листьями различного яруса, что осложняет интерпретацию результатов.
Активность фотосинтеза при действии факторов регулируется большим количеством сигнальных систем различной природы: химическими, электрическими, гидравлическими [23, 24]. Несмотря на развитый инструментарий для регистрации статуса сигнальных систем, в настоящий момент практически не существует подходов, позволяющих проводить анализ “в реальном времени”, и приборов, совместимых с установками для моделирования действия факторов среды.
Одним из немногих исключений является метод регистрации экстраклеточных биопотенциалов. Разность потенциалов на клеточной мембране, достигающая у высших растений –150 мВ и более, выполняет ряд важных функций, включая регуляторную и информационную. При действии на растение фактора относительно высокой интенсивности разность потенциалов на клеточных мембранах меняется, генерируется местная электрическая реакция или способный к распространению электрический сигнал. Суммарная электрическая активность клеток может быть зарегистрирована при помощи электродов, расположенных на поверхности листа. Метод позволяет получать данные непосредственно во время действия фактора или их комбинации; прибор совместим с установками для моделирования различных факторов среды.
Внутриклеточная регистрация биопотенциалов. Метод позволяет производить измерения электрической активности на уровне отдельных клеток или ионных каналов, за счет которых происходит изменение разности потенциалов. Высокоинформативный метод для изучения механизмов действия факторов на растения, но очень низкая скорость получения индивидуальных результатов; практически отсутствует возможность производить измерения непосредственно во время действия большей части факторов.
Флуоресцентный имиджинг. Метод основан на регистрации флуоресценции сенсоров, чувствительных к изменению концентрации молекул, выполняющих сигнальные функции (Са2+, Н2О2, Н+ и т.д.). В настоящее время создано большое количество зондов на компоненты разных сигнальных путей, а также генетически модифицированные линии растений, которые на постоянной основе синтезируют флуоресцентные белковые сенсоры. Регистрация концентрации и динамики сигнальных молекул возможна как на уровне целого организма, так и на уровне отдельных клеток. Очень информативный метод, высокая скорость получения данных, но во время работы требуется подсветка на определенной длине волны (или нескольких), необходимой для возбуждения флуоресценции сенсора; возможно ограниченное использование совместно с установками для моделирования действия факторов.
Хромато-масс-спектрометрия. Метод позволяет с высокой точностью регистрировать в образце наличие и количество молекул с определенной химической структурой. В стрессовом сигналинге растений наибольшую информативность хромато-масс-спектрометрия имеет при анализе концентрации и динамики фитогормонов – одного из важнейших компонентов химической регуляции физиологических процессов. Для изучения динамики требуется подготовка большого количества образцов, каждый из которых представляет собой индивидуальное растение или совокупность растений. Низкая скорость получения данных; невозможно исследовать временную динамику показателя на одном и том же растении; невозможно использование совместно с установками для моделирования действия факторов.
RT-ПЦР. Метод используется для регистрации уровня экспрессии генов и определения генетических механизмов влияния фактора на физиологические и сигнальные процессы. Подобно хромато-масс-спектрометрии, метод имеет ограниченную применимость для изучения динамики ответа на внешние факторы и их комбинацию, поскольку для него также требуются отдельные образцы для каждой временной точки. Низкая скорость получения данных; невозможно исследовать временную динамику показателя на одном и том же растении; невозможно использование совместно с установками для моделирования действия факторов.
Работы с использованием других методов, которые включают, в первую очередь, работу с большими объемами интегральных данных (транскриптомика, протеомика, метаболомика и т.д.), могут быть выполнены на базе ЦКП или с привлечением других научных групп.
5. ОПИСАНИЕ СОЗДАВАЕМОЙ УСТАНОВКИ
Анализ параметров действия астро-геофизических факторов и специфики методов регистрации физиологического состояния растений позволяет разработать требования к усовершенствованию имеющихся в нашем распоряжении исследовательских установок.
Требования, предъявляемые к модернизированной установке для моделирования различных параметров электромагнитного и радиационного окружения, могут быть сформулированы следующим образом:
– установка на основе колец Гельмгольца с возможностью изменения частоты поля и модулирования амплитуды в широком диапазоне – диапазон изменения индукции статического поля от нуля до 1 мТл (10 Гс); частота переменного поля от нуля до 1 кГц; амплитуда изменения индукции переменного поля от нуля до 1 мТл (10 Гс);
– возможность моделирования гипомагнитных условий за счет компенсации статического магнитного поля Земли и обеспечение экранирования объектов от переменного электромагнитного поля промышленных частот при помощи клетки Фарадея;
– возможность функционирования установки совместно с точечными закрытыми источниками β-излучения на основе солей 90Sr и 90Y; наличие защитных экранов, ограничивающих действие излучения за пределами зоны эксперимента;
– рабочие размеры установки должны позволять проводить работу как на стадии семян, так и с вегетирующими формами растений (арабидопсис, пшеница, горох, табак, картофель, томат), а также обеспечивать возможность воздействия на кюветы с растворами биомолекул;
– наличие светодиодного источника белого света с возможностью регулировки интенсивности освещения от нуля до 500 μмоль м–2 с–1 для обеспечения длительного выращивания растений в измененных условиях электромагнитного и радиационного окружения;
– наличие дополнительных источников освещения высокой интенсивности (до 2000 μмоль м–2 с–1) и ультрафиолетовых ламп с максимумом излучения в области УФ-Б (290–320 нм) для параллельного моделирования светового стресса; должно быть предусмотрено независимое включение отдельных источников для задания освещения различной интенсивности, а также экранирование экспериментальных групп и зоны за пределами установки от УФ-Б светопропускающим материалом;
– установка должна располагаться в помещении с возможностью регулирования температуры в пределах +20…+50°С (в отдельных боксах должна быть реализована возможность задавать низкие положительные температуры) и влажности в пределах 10–90% для параллельного моделирования теплового и водного стресса;
– возможность использования установки совместно с системами детектирования функционального состояния растений с целью мониторинга развития ответа на астро-геофизические факторы и их комбинации; основу системы детектирования должны составлять мультиспектральная и RGB-камеры, а также макроэлектродная техника для регистрации биопотенциалов.
6. ЗАКЛЮЧЕНИЕ
В настоящее время первостепенное значение приобретает исследование пределов устойчивости и механизмов адаптации живых систем к изменяющимся в широком диапазоне параметрам окружающей среды. Одним из основных методов такого исследования является лабораторное моделирование с помощью установки, требования к созданию которой представлены в настоящей работе.
В целом планируемая установка будет иметь высокий потенциал для решения задач моделирования астро-геофизических факторов. Ее исполнение в модульном варианте – модули освещения, температуры, источники физических факторов и модуль регистрации параметров растений – позволит выполнять исследования не только на территории лаборатории, но также и в исследовательских центрах, имеющих в своей структуре уникальные системы имитации астро-геофизических явлений.
Реализация предлагаемой программы экспериментов по лабораторному моделированию, на наш взгляд, позволит продвинуться в понимании проблем эволюции жизни, механизмов возможного влияния солнечной активности на биосферу, исследований роли биосферы в глобальных изменениях климата планет на разных временных горизонтах.
Список литературы
G. Elhalel, C. Price, D. Fixier, A. Shainberg, Nature. Scientific Reports 9, 1645 (2019).
C. Doglioni, J. Pignatti, M. Coleman, Geosc. Front. 7, 865–873 (2016).
Y. Berkovich, I. Konovalova, S. O. Smolyanina, A. N. Erokhin, O. V. Avercheva, E. M. Bassarskaya, G. V. Kochetova, T. V. Zhigalova, O. S. Yakovleva, I. G. Tarakanov, REACH 6, 11–24 (2017).
E. N. Baranova, M. A. Levinskikh, A. A. Gulevich, Life 9, 81 (2019).
V. De Micco, C. Arena, D. Pignalosa, M. Durante, Radiat. Environ. Biophys. 50, 1–19 (2011).
M. E. Maffei, Front. Plant Sci. 5, 445 (2014).
S. V. Gudkov, M. A. Grinberg, V. S. Sukhov, V. A. Vodeneev, J. Environ Radioact. 202, 8–24 (2019).
M. Sarraf, S. Kataria, H. Taimourya, L. O. Santos, R. D. Menegatti, M. Jain, M. Ihtisham, S. Liu, Plants 9, 1139 (2020).
A. De Souza-Torres, L. Sueiro-Pelegrín, M. Zambrano-Reyes, I. Macías-Socarras, M. González-Posada, D. Gar-cía-Fernández, Int. J. Rad. Biol. 96, 951–957 (2020).
P. Y. Volkova, E. V. Bondarenko, E. Kazakova, Curr. Opin. Toxicol. 30, 100334 (2022).
V. N. Binhi, A. B. Rubin, Cells 11, 274 (2022).
I. Kovalchuk, J. Molinier, Y. Yao, A. Arkhipov, O. Kovalchuk, Mutat. Res. 624, 101–113 (2007).
E. J. Goh, J. B. Kim, W. J. Kim, B. K. Ha, S. H. Kim, S. Y. Kang, Y. W. Seo, D. S. Kim, Radiat. Environ. Biophys. 53, 677–693 (2014).
M. V. Kryvokhyzha, K. V. Krutovsky, N. M. Rashydov, Int. J. Rad. Biol. 95, 626–634 (2019).
M. Grinberg, S. V. Gudkov, I. V. Balalaeva, E. Gromova, Y. V. Sinitsyna, V. S. Sukhov, V. A. Vodeneev, Environ. Exp. Bot. 184, 104378 (2021).
V. Sukhov, E. Sukhova, Y. Sinitsyna, E. Gromova, N. Mshenskaya, A. Ryabkova, N. Ilin, V. Vodeneev, E. Mareev, C. Price. Cells. 10, 149 (2021).
E. Sukhova, E. Gromova, L. Yudina, A. Kior, Y. Vetrova, N. Ilin, E. Mareev, V. Vodeneev, V. Sukhov, Plants 10, 2207 (2021).
M. Grinberg, M. Mudrilov, E. Kozlova, V. Sukhov, F. Sa-rafanov, A. Evtushenko, N. Ilin, V. Vodeneev, C. Price, E. Mareev, Plant Signal. Behav. 17, 2021664 (2022).
J. L. Araus, S. C. Kefauver, O. Vergara-Díaz, A. Gracia-Romero, F. Z. Rezzouk, J. Segarra, M. L. Buchaillot, M. Chang-Espino, T. Vatter, R. Sanchez-Bragado, J. A. Fernandez-Gallego, M. D. Serret, J. Bort, J. Integr. Plant. Biol. 64, 592–618 (2022).
D. Sun, K. Robbins, N. Morales, Q. Shu, H. Cen, Trends Plant. Sci. 27, 191–208 (2022).
F. Tanner, S. Tonn, J. de Wit, G. Van den Ackerveken, B. Berger, D. Plett, Plant Methods 18, 35 (2022).
K. Maxwell, G. N. Johnson, J. Exp. Bot. 51, 659–68 (2000).
A. E. Huber, T. L. Bauerle, J. Exp. Bot. 67, 2063–2079 (2016).
S. K. Chatterjee, O. Malik, S. Gupta, Biosensors (Basel) 8, 83 (2018).
Дополнительные материалы отсутствуют.
Инструменты
Астрономический журнал