Астрономический вестник, 2021, T. 55, № 5, стр. 387-392
Устойчивость ферментов к воздействию ионизирующей радиации в модельных условиях реголита Марса
В. С. Чепцов a, b, *, А. А. Белов a, Е. А. Воробьева a, А. К. Павлов c, Д. А. Цурков c, d, Д. А. Фролов c, d, В. Н. Ломасов d, А. Е. Чумиков b
a Московский государственный университет им. М.В. Ломоносова
Москва, Россия
b Институт космических исследований РАН
Москва, Россия
c Физико-технический институт имени А.Ф. Иоффе РАН
Санкт-Петербург, Россия
d Санкт-Петербургский политехнический университет Петра Великого
Санкт-Петербург, Россия
* E-mail: cheptcov.vladimir@gmail.com
Поступила в редакцию 30.12.2020
После доработки 24.03.2021
Принята к публикации 06.04.2021
Аннотация
Одним из основных факторов, разрушающих биомолекулы во внеземных условиях, является ионизирующее излучение. Эффекты воздействия радиации зависят от условий (давление, температура, присутствие различных химических веществ) облучения. Нами исследована устойчивость ферментов (каталазы и дегидрогеназ) в почве при облучении ускоренными электронами в дозах до 100 кГр при низком давлении (0.01 торр) и низкой температуре (–130°С). После воздействия дозы 100 кГр каталазная активность сохранилась на контрольном уровне, дегидрогеназная активность снизилась в 5 раз. Результаты исследования позволяют предполагать возможность длительного сохранения активных ферментов в марсианском реголите до их инактивации вследствие накопления радиационных повреждений. Принимая во внимание интенсивность ионизирующего излучения в поверхностном слое реголита Марса, мы считаем, что снижение дегидрогеназной активности в 10, 100 и 1000 раз от исходного уровня могло бы произойти в течение 1.9, 3.8 и 5.7 млн лет соответственно, каталаза же могла бы сохранять активность в течение еще более длительных периодов. Полученные данные свидетельствуют в пользу возможности детектирования ферментативной активности посадочными аппаратами в рамках планируемых космических миссий.
ВВЕДЕНИЕ
Исследование устойчивости различных биомолекул (многие из которых рассматриваются в качестве биомаркеров) к воздействию экстремальных факторов внеземного пространства имеет большое значение для планирования и подготовки космических миссий. Такие исследования позволяютвыявить типы молекул, наиболее устойчивых в космических условиях, оценить длительность их сохранения, обнаружить трансформации, которые они претерпевают под действием тех или иных факторов (Blanco и др., 2018; deVera, 2020). Это способствует определению перспективных для изучения космические тел мест посадки, геологических структур и типов отложений, созданию необходимого инструментария и адаптации аналитических методик, а также корректной интерпретации данных, полученных в ходе космических миссий (Blanco и др., 2018; Röling и др., 2015; deVera, 2020; Poch и др., 2014).
В качестве основных факторов, разрушающих биомолекулы в условиях космоса, рассматриваются ионизирующая радиация и ультрафиолетовое излучение (Blanco и др., 2018; Fornaro и др., 2018; Poch и др., 2014). Однако ультрафиолетовое излучение поглощается, как правило, несколькими миллиметрами твердого вещества (Mancinelli, Klovstad, 2000; Cockell и др., 2005; Schuerger и др., 2012). Потому главным фактором, лимитирующим сохранение биомаркеров внутри метеоритов, в реголите и льду ряда планет и спутников на глубинах более нескольких миллиметров, является ионизирующее излучение (Pavlov и др., 2002; 2012; Kminek, Bada, 2006).
При исследовании устойчивости биомолекул к воздействию ионизирующей радиации изучаются, как правило, чистые химические вещества при облучении в условиях нормального атмосферного давления и температур, близких к комнатным (Blanco и др., 2018; Cherubini, Ursini, 2015; Iglesias-Groth и др., 2011; Lopez-Islas и др., 2019). В то же время известно, что подвижность свободных радикалов, являющихся основной причиной радиационных повреждений, существенно зависит от температуры при облучении (Dartnell и др., 2010). На устойчивость биомолекул также может влиять химический состав окружающей среды, так как, с одной стороны, газообразный кислород, вода, соли и минералы являются источниками свободных радикалов (Dartnell и др., 2010; Zakharov, Nevostruev, 1968; Wang и др., 2020) и, с другой стороны, возможны взаимодействия биомолекул (или их остатков) с какими-либо веществами окружающей среды (Bonner и др., 1985; Materese и др., 2020; Röling и др., 2015). Следовательно, для корректной оценки устойчивости биомаркеров на каких-либо космических объектах требуется воспроизведение наиболее полного комплекса факторов.
Среди биомаркеров, которые могут быть обнаружены посадочными космическими миссиями, рассматриваются биомолекулы, входящие в состав клеток микроорганизмов – пептиды, липиды, углеводы, нуклеиновые кислоты, пигменты (Blanco и др., 2018; Georgiou, Deamer, 2014; Dartnell и др., 2012; deVera, 2020). Одними из перспективных биомаркеров считаются ферменты (как неотъемлемый компонент всех живых клеток), а также продукты процессов, катализируемых ферментами (McLaren, 1969; Yamagishi и др., 2010; Thomas, Schimel, 1991; McKay и др., 2013; Blake и др., 2001), однако в сравнении с низкомолекулярными соединениями им уделяется мало внимания.
Влияние высоких доз радиации на чистые ферменты довольно хорошо изучено в ходе разработки методов стерилизации фармацевтических препаратов. Установлено, что устойчивость многих ферментов может резко меняться в зависимости от условий облучения, таких как присутствие воды, рН раствора, наличие примесей, а также от конформации молекул (Dale, 1966; Jacobs, 1995; Saha и др., 1995). В частности, при облучении в водных растворах многие ферменты инактивируются дозами порядка сотен Гр (Dale, 1966; Morimoto и др., 1980), в сухом же виде их устойчивость возрастает, и для полной инактивации некоторых ферментов требуется облучение дозами свыше 100 кГр (Smith, 1954; Wilson, 1959; Ueno и др., 1976; Morimoto и др., 1980; Libický и др., 1992).
С астробиологической точки зрения наибольший интерес представляют исследования по облучению ферментов высокими дозами излучения на минеральных носителях, в том числе в породах и почвах, которые могут рассматриваться как аналоги реголита различных космических тел, и, в частности, Марса (Preston, Dartnell, 2014; Marlow и др., 2008; Cheptsov и др., 2018). Известно, что почвенные ферменты в целом обладают очень высокой устойчивостью к ионизирующей радиации, однако величины инактивирующих доз могут отличаться на порядки для разных ферментов и для различных почв. Так, показано сохранение 100% активности сахараз, уреаз, фосфатаз и протеаз и 60–80% активности каталазы, дегидрогеназ, инвертазы и β-глюкозидазы после воздействия доз до 25 кГр (Voets и др., 1965; Lensi и др., 1991; Denisova и др., 2007). После гамма-облучения дозой 40 кГр выявлено почти полное ингибирование сульфат-редуцирующей активности, сохранение до 20% активности α-D-глюкозидазы и β-D-галактозидазы и более 30% активности β-D-глюкозидазы, дегидрогеназ и ряда других ферментов (Brown, 1981). При воздействии 75 кГр гамма-излучения обнаружено сохранение исходной уреазной активности, снижение фосфатазной активности до 70% от контрольного уровня и уменьшение активности декарбоксилаз до 0.5% (Shih, Souza, 1978). Продемонстрировано сохранение 40% уреазной активности в почвах, облученных дозой 200 кГр (Pettit и др., 1976) и 3.1–7.5% фосфатазной активности после воздействия доз до 500 кГр (Burns и др., 1978).
Высокая устойчивость ферментов позволяет предполагать их длительное сохранение во внеземной среде. Однако их устойчивость, как указано выше, зависит от условий облучения. Тем не менее исследования активности ферментов при комплексном воздействии факторов внеземного пространства ранее не проводились. Нами проведено облучение дерново-подзолистой почвы ускоренными электронами (1 МэВ) при низком давлении (0.01 торр) и низкой температуре (–130°С) дозами 10 и 100 кГр и оценены изменения ферментативной (каталазной и дегидрогеназной) активности in situ.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования являлась дерново-подзолистая почва, отобранная в Московской области (56°1′32″ N, 37°11′27″ E) с глубины 5–10 см. Химические характеристики образца были описаны ранее (Cheptsov и др., 2019). Выбор образца для исследования был обусловлен довольно высокой ферментативной активностью, выявленной в ходе предварительных анализов. Воздушно-сухой образец был очищен от корней и просеян через сито с диаметром отверстий 0.25 мм. Далее навески образца массой 0.15 г были герметично упакованы в стерильные полиэтиленовые пакеты диаметром около 20 мм, при этом толщина образца не превышала 1 мм (Cheptsov и др., 2018).
Для облучения образцы помещались в ранее описанную климатическую камеру (Cheptsov и др., 2018; Pavlov и др., 2019), позволяющую проводить облучение ускоренными электронами и поддерживать низкое давление и низкие температуры в ходе облучения. Образцы в полиэтиленовых пакетах помещались в предварительно охлажденную до –100°C камеру, затем пакеты прокалывались стерильной иглой, чтобы обеспечить в дальнейшем понижение давления. Далее камера герметично закрывалась и проводилась откачка воздуха до давления около 0.01 торр. Температура образцов контролировалась с помощью термопары и во время облучения составляла –130°С. Облучение проводилось с помощью ускорителя электронов РТЭ-1В (СССР) при энергии электронов 1 МэВ. Образцы были облучены дозами 10 и 100 кГр при интенсивности излучения 0.28 и 2.8 кГр/с соответственно. Также был проведен контроль воздействия температуры и давления без облучения, для чего образцы были выдержаны в течение 10 мин при тех же давлении и температуре, что и во время облучения (Cheptsov и др., 2018). Контролем служили образцы, не подвергавшиеся каким-либо из указанных воздействий и хранившиеся при +4°С. После облучения и до проведения анализа образцы транспортировались и хранились при отрицательных температурах. Длительность транспортировки и хранения образцов составляла не более 3 суток.
Оценку каталазной активности производили газометрическим методом (Tabatabai, 1994) по образованию газообразного кислорода в ходе следующей химической реакции:
Для этого навеску почвы массой 0.9 г вносили в толстостенную колбу емкостью 100 мл, добавляли 0.5 г CaCO3, почву смачивали 4 мл стерильной дистиллированной воды. Затем в колбу вносили стаканчик с 1.7 мл 10%-го раствора перекиси водорода. Колбу герметично закрывали пробкой, соединенной с V-образной бюреткой, заполненной водой для учета объема образующегося кислорода. Содержимое колбы интенсивно встряхивали в течение минуты, после чего регистрировали объем образовавшегося кислорода. Активность каталазы выражали в мл кислорода, выделившегося на 1 г почвы за минуту.
Для оценки суммарной активности дегидрогеназ почвы был использован тетразолиевый метод (Tabatabai, 1994), основанный на восстановлении дегидрогеназами бесцветного соединения 2,3,5-трифенилтетразолия хлористого (ТТХ) до красноокрашенного трифенилформазана (ТФФ). Навеску почвы массой 0.9 г помещали в стерильную пробирку, добавляли 100 мг CaCO3, 1 мл 0.1-молярный раствора глюкозы и 1 мл 1%-го раствора ТТХ и тщательно перемешивали. Пробирки помещали в анаэростат и после создания вакуума инкубировали при 30°С в течение 24 ч. По истечении срока инкубации образовавшийся в ходе активности дегидрогеназ ТФФ экстрагировали этанолом (25 мл) и отфильтровывали. Окрашенный раствор фотоколориметрировали при λ = 540 нм. Количество ТФФ, образовавшееся в ходе ферментативной реакции, рассчитывали по калибровочной кривой. Активность дегидрогеназ выражали в мг ТФФ, образующегося в 1 г почвы за сутки.
Аналогичным образом каталазная и дегидрогеназная активность была измерена в почве, предварительно стерилизованной сухим жаром при +180°C в течение 12 ч (отрицательный контроль) в связи с возможным вкладом минералов в разложение перекиси водорода и восстановление ТТХ.
Все анализы проводились в трехкратной повторности.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
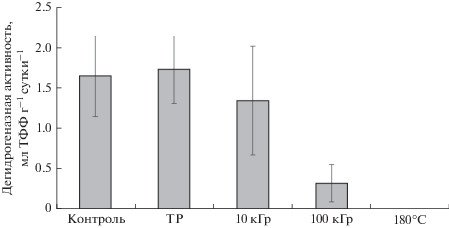
Каталазная и дегидрогеназная активность не изменилась после воздействия низкого давления и низкой температуры (рис. 1, 2). После облучения дозами 10 и 100 кГр активность каталазы также сохранилась на контрольном уровне (рис. 1). Активность дегидрогеназ снизилась на 18% после воздействия дозы 10 кГр, однако это снижение было статистически недостоверным. При облучении же дозой 100 кГр наблюдалось достоверное снижение дегидрогеназной активности на 80% относительно контроля (рис. 2). Каталаза и дегидрогеназы продемонстрировали высокую устойчивость к воздействию комплекса факторов внеземного пространства.
Рис. 1.
Влияние ионизирующей радиации на каталазную активность дерново-подзолистой почвы. ТР – экспонирование при низком давлении и низкой температуре без облучения, 180°C – стерилизованный образец (негативный контроль). Планки погрешности обозначают доверительный интервал при α = 0.95.
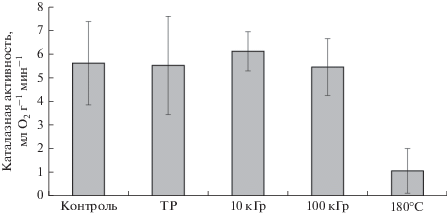
Рис. 2.
Влияние ионизирующей радиации на дегидрогеназную активность дерново-подзолистой почвы. ТР – экспонирование при низком давлении и низкой температуре без облучения, 180°C – стерилизованный образец (негативный контроль). Планки погрешности обозначают доверительный интервал при α = 0.95.
Изменение ферментативной активности при воздействии ионизирующей радиации описывается формулой:
(1)
${A \mathord{\left/ {\vphantom {A {{{A}_{0}}}}} \right. \kern-0em} {{{A}_{0}}}} = {{e}^{{( - kD}}}^{)},$По данным, полученным в нашем эксперименте, рассчитать коэффициент инактивации для каталазы нельзя, т.к. даже после воздействия максимальной дозы излучения активность фермента не изменилась. Однако ранее была показана 48% инактивация каталазы дозами около 4.4 кГр при облучении чистого фермента в виде монослоя (Smith, 1954) и снижение каталазной активности в почве на 20–30% после облучения дозами до 20 кГр (Denisova и др., 2007), что позволяет заключить, что в нашем эксперименте устойчивость каталазы была выше, чем в предыдущих исследованиях. Коэффициент инактивации дегидрогеназ в нашем эксперименте составил 0.016 кГр–1 (что также равно 0.16 Мрад–1). По литературным данным этот коэффициент для дегидрогеназ варьирует в пределах 0.005–0.018 кГр–1 (Brown, 1981; Denisova и др., 2007). То есть дегидрогеназы, в отличие от каталазы, при облучении в условиях низкого давления и низкой температуры не проявили повышенной устойчивости к облучению.
Выявленные различия между устойчивостью ферментов в нашем эксперименте и в ранее проведенных исследованиях могут быть связаны как с влиянием условий облучения, так и с какими-либо характеристиками объектов исследования, т.к. устойчивость одних и тех же ферментовв различных почвах может значительно отличаться (Shih, Souza, 1978; Burns и др., 1978; Pettit и др., 1976). Ранее существенное повышение устойчивости при аналогичных условиях облучения (температура, давление, дозы) наблюдалось для микроорганизмов (Cheptsov и др., 2018). Возможно, для ферментов эффект понижения температуры и давления при облучении может быть выявлен при воздействии бóльших доз излучения, что будет проверено в ходе дальнейших исследований.
С помощью формулы (1) рассчитано, что 90, 99 и 99.9% инактивация дегидрогеназ произойдет при облучении дозами 144, 288 и 432 кГр соответственно. Зная интенсивность ионизирующего излучения на Марсе (Hassler и др., 2014), можно оценить, в течение каких сроков ферменты могли бы сохранять активность в реголите на разных глубинах при накоплении радиационных повреждений. В частности, в поверхностном слое реголита снижение дегидрогеназной активности в 10, 100 и 1000 раз от исходного уровня могло бы произойти в течение 1.9, 3.8 и 5.7 млн лет соответственно. Более высокая устойчивость каталазы в сравнении с дегидрогеназой (рис. 1), а также сведения об устойчивости уреаз и фосфатаз к облучению в дозах 200–500 кГр (Pettit и др., 1976; Burns и др., 1978) позволяют предполагать, что длительность сохранения активности некоторых ферментов может быть еще выше. Полученные данные свидетельствуют о возможности сохранения сложных органических соединений во внеземных условиях в течение длительного времени и возможности обнаружения ферментативной активности в ходе космических миссий. Следует отметить, что поиск микробных клеток с помощью анализа ферментативной активности планируется проводить в ходе будущих миссий на Марсе. Так, в последние годы Японским агентством аэрокосмических исследований (JAXA) разрабатываются методики и оборудование для детектирования ферментов посадочными аппаратами (Yamagishi и др., 2010; 2018).
Подводя итог, мы показали, что ферменты могут выдерживать воздействие высоких доз ионизирующего излучения в условиях, моделирующих основные физические факторы внеземной среды. При этом устойчивость исследованных ферментов к облучению при низком давлении и низкой температуре была сопоставима с таковой при нормальных условиях. В продолжение работы планируется изучение воздействия более высоких доз излучения и активности более широкого спектра ферментов с целью выявления наиболее устойчивых из них в условиях реголита Марса.
Авторы благодарят О.А. Ершову за предоставленный для исследования образец почвы и В.Ю. Соловьева за помощь в проведении облучений.
Исследование выполнено при поддержке гранта РФФИ № 20-02-00470.
Список литературы
Blake R.E., Alt J.C., Martini A.M. Oxygen isotope ratios of PO4: an inorganic indicator of enzymatic activity and P metabolism and a new biomarker in the search for life // Proc. Natl. Acad. Sci. USA. 2001. V. 98. № 5. P. 2148–2153.
Blanco Y., de Diego-Castilla G., Viúdez-Moreiras D., Cavalcante-Silva E., Rodríguez-Manfredi J.A., Davila A.F., McKay C.P., Parro V. Effects of gamma and electron radiation on the structural integrity of organic molecules and macromolecular biomarkers measured by microarray immunoassays and their astrobiological implications // Astrobiology. 2018. V. 18. № 12. P. 1497–1516.
Bonner W.A., Hall H., Chow G., Liang Y., Lemmon R.M. The radiolysis and radioracemization of amino acids on clays // Orig. Life Evol. Biosp. 1985. V. 15. № 2. P. 103–114.
Brown K.A. Biochemical activities in peat sterilized by gamma-irradiation // Soil Biol. Biochem. 1981. V. 13. № 6. P. 469–474.
Burns R.G., Gregory L.J., Lethbridge G., Pettit N.M. The effect of γ-irradiation on soil enzyme stability // Experientia. 1978. V. 34. № 3. P. 301–302.
Cheptsov V., Vorobyova E., Belov A., Pavlov A., Tsurkov D., Lomasov V., Bulat S. Survivability of soil and permafrost microbial communities after irradiation with accelerated electrons under simulated Martian and open space conditions // Geosciences. 2018. V. 8. № 8. P. 298.
Cheptsov V., Belov A., Vorobyova E., Osipov G., Bulat S. Viability of the soddy–podzolic soil microbial community after 148–1250 kGy gamma irradiation // Planet. and Space Sci. 2019. V. 172. P. 8–13.
Cherubini C., Ursini O. Amino acids chemical stability submitted to solid state irradiation: the case study of leucine, isoleucine and valine // Springer Plus. 2015. V. 4. № 1. P. 541.
Cockell C.S., Schuerger A.C., Billi D., Friedmann E.I., Panitz C. Effects of a simulated martian UV flux on the cyanobacterium, Chroococcidiopsis sp. 029 // Astrobiology. 2005. V. 5. № 2. P. 127–140.
Dale W.M. Irradiation effects on enzymes (in vitro) // Strahlenbiologie (Radiation Biology). Handbuch der Medizinischen Radiologie (Encyclopedia of Medical Radiology). V. 2/1 / Ed. Zuppinger A. Berlin, Heidelberg: Springer, 1966. P. 214–235.
Dartnell L.R., Hunter S.J., Lovell K.V., Coates A.J., Ward J.M. Low-temperature ionizing radiation resistance of Deinococcus radiodurans and Antarctic Dry Valley bacteria // Astrobiology. 2010. V. 10. № 7. P. 717–732.
Dartnell L.R., Page K., Jorge-Villar S.E., Wright G., Munshi T., Scowen I.J., Ward J.M., Edwards H.G. Destruction of Raman biosignatures by ionising radiation and the implications for life detection on Mars // Anal. Bioanal. Chem. 2012. V. 403. № 1. P. 131–144.
Denisova T.V., Kazeev K.S., Kolesnikov S.I., Val’kov V.F. Changes in the biological properties of an ordinary chernozem exposed to gamma radiation // Eurasian Soil Sci. 2007. V. 40. № 9. P. 978–985.
Fornaro T., Boosman A., Brucato J.R., ten Kate I.L., Siljeström S., Poggiali G., Steele A., Hazen R.M. UV irradiation of biomarkers adsorbed on minerals under Martian-like conditions: Hints for life detection on Mars // Icarus. 2018. V. 313. P. 38–60.
Georgiou C.D., Deamer D.W. Lipids as universal biomarkers of extraterrestrial life // Astrobiology. 2014. V. 14. № 6. P. 541–549.
Hassler D.M., Zeitlin C., Wimmer-Schweingruber R.F., Ehresmann B., Rafkin S., Eigenbrode J.L., Brinza D.E., Weigle G., Böttcher S., Böhm E., Burmeister S., Guo J., Köhler J., Martin C., Reitz G., Cucinotta F.A., Kim M., Grinspoon D., Bullock M.A., Posner A., Gómez-Elvira J., Vasavada A., Grotzinger J.P., MSL Science Team. Mars’ surface radiation environment measured with the Mars Science Laboratory’s Curiosity rover // Science. 2014. V. 343. № 6169. P. 1244797.
Iglesias-Groth S., Cataldo F., Ursini O., Manchado A. Amino acids in comets and meteorites: stability under gamma radiation and preservation of the enantiomeric excess // Mon. Notic. Roy. Astron. Soc. 2011. V. 410. № 3. P. 1447–1453.
Jacobs G.P. A review of the effects of gamma radiation on pharmaceutical materials // J. Biomater. Appl. 1995. V. 10. № 1. P. 59–96.
Kminek G., Bada J.L. The effect of ionizing radiation on the preservation of amino acids on Mars // Earth and Planet. Sci. Lett. 2006. V. 245. № 1–2. P. 1–5.
Libický A., Pipota J., Fidlerová J. The effect of ionizing radiation on enzymes. VI. The effect of gamma irradiation on the proteolytic activity of pepsin derived from porcine gastric mucosa // Cesk. Farm. 1992. V. 41. № 1. P. 10.
Lensi R., Lescure C., Steinberg C., Savoie J.M., Faurie G. Dynamics of residual enzyme activities, denitrification potential, and physico-chemical properties in a γ-sterilized soil // Soil Biol. Biochem. 1991. V. 23. № 4. P. 367–373.
López-Islas A., Colín-García M., Negrón-Mendoza A. Stability of aqueous formaldehyde under γ irradiation: prebiotic relevance // Int. J. Astrobiol. 2019. V. 18. № 5. P. 420–425.
Mancinelli R.L., Klovstad M. Martian soil and UV radiation: microbial viability assessment on spacecraft surfaces // Planet. and Space Sci. 2000. V. 48. № 11. P. 1093–1097.
Marlow J.J., Martins Z., Sephton M.A. Mars on Earth: soil analogues for future Mars missions // Astron. and Geophys. 2008. V. 49. № 2. P. 2–20.
Materese C.K., Gerakines P.A., Hudson R.L. The radiation stability of thymine in solid H2O // Astrobiology. 2020. V. 20. № 8. P. 956–963.
McKay C.P., Stoker C.R., Glass B.J., Davé A.I., Davila A.F., Heldmann J.L., Marinova M.M., Fairen A.G., Quinn R.C., Zacny K.A., Paulsen G., Smith P.H., Parro V., Andersen D.T., Hecht M.H., Lacelle D., Pollard W.H. The icebreaker life mission to Mars: A search for biomolecular evidence for life // Astrobiology. 2013. V. 13. № 4. P. 334–353.
McLaren A.D. Radiation as a technique in soil biology and biochemistry // Soil Biol. Biochem. 1969. V. 1. № 1. P. 63–73.
Morimoto K., Kimura S., Inamori Y., Morisaka K. Stability of enzyme preparations on radiosterilization // Chem. Pharm. Bull. 1980. V. 28. № 4. P. 1304–1306.
Pavlov A.K., Blinov A.V., Konstantinov A.N. Sterilization of Martian surface by cosmic radiation // Planet. and Space Sci. 2002. V. 50. № 7–8. P. 669–673.
Pavlov A., Cheptsov V., Tsurkov D., Lomasov V., Frolov D., Vasiliev G. Survival of radioresistant bacteria on Europa’s surface after pulse ejection of subsurface ocean water // Geosciences. 2019. V. 9. № 1. P. 9.
Pavlov A.A., Vasilyev G., Ostryakov V.M., Pavlov A.K., Mahaffy P. Degradation of the organic molecules in the shallow subsurface of Mars due to irradiation by cosmic rays // Geophys. Res. Lett. 2012. V. 39. № 13. P. L13202.
Pettit N.M., Smith A.R.J., Freedman R.B., Burns R.G. Soil urease: activity, stability and kinetic properties // Soil Biol. Biochem. 1976. V. 8. № 6. P. 479–484.
Poch O., Kaci S., Stalport F., Szopa C., Coll P. Laboratory insights into the chemical and kinetic evolution of several organic molecules under simulated Mars surface UV radiation conditions // Icarus. 2014. V. 242. P. 50–63.
Preston L.J., Dartnell L.R. Planetary habitability: lessons learned from terrestrial analogues// Int. J. Astrobiol. 2014. V. 13. № 1. P. 81–98.
Röling W.F., Aerts J.W., Patty C.L., Ten Kate I.L., Ehrenfreund P., Direito S.O. The significance of microbe-mineral-biomarker interactions in the detection of life on Mars and beyond // Astrobiology. 2015. V. 15. № 6. P. 492–507.
Saha A., Mandal P.C., Bhattacharyya S.N. Radiation-induced inactivation of enzymes — a review // Radiat. Phys. Chem. 1995. V. 46. № 1. P. 123–145.
Schuerger A.C., Golden D.C., Ming D.W. Biotoxicity of Mars soils: 1. Dry deposition of analog soils on microbial colonies and survival under Martian conditions // Planet. and Space Sci. 2012. V. 72. № 1. P. 91–101.
Shih K.L., Souza K.A. Degradation of biochemical activity in soil sterilized by dry heat and gamma radiation // Orig. Life. 1978. V. 9. № 1. P. 51–63.
Smith C.L. The inactivation of monomolecular films of protein and its relation to the lifetime of active radicals formed in water by X-radiation // Arch. Biochem. Biophys. 1954. V. 50. № 2. P. 322–336.
Tabatabai M.A. Soil enzymes // Methods of Soil Analysis: Part 2. Microbiological and Biochemical Properties / Eds Weaver R.W., Angle S., Bottomley P., Bezdicek D., Smith S., Tabatabai A., Wollum A. Madiaon, USA: Soil Sci. Soc. of America, 1994. P. 775–833.
Thomas D.J., Schimel J.P. Mars after the Viking missions: Is life still possible? // Icarus. 1991. V. 91. № 2. P. 199–206.
Ueno T., Yoshizako F., Nishimura A., Kotaka T. Radiosterilization of enzyme preparations // Ann. Rep. Radiat. Center Osaka Prefect. 1976. V. 8. № 16. P. 62–65.
Voets J.P., Dedeken M., Bessems E. The behavior of some amino acids in gamma-irradiated soils // Natur wissenschaften.1965. V. 52. P. 476.
de Vera J.P. Biomolecules in space: The way to search for life on Mars // Astrobiology on the Int. Space Station. Springer, Cham., 2020. P. 1–39.
Wang Z., Walter E.D., Sassi M., Zhang X., Zhang H., Li S.X., Chen Y., Cui W., Tuladhar A., Chase Z., Winkelman A.D., Wang H., Pearce C.I., Clark S.B., RossoK.M. The role of surface hydroxyls on the radiolysis of gibbsite and boehmitenanoplatelets // J. Hazard. Mater. 2020. P. 122853.
Wilson D.E. The effect of ionizing radiation on the enzyme desoxyribonuclease in the dry state // Int. J. Radiat. Biol. Relat. Stud. Phys. Chem. Med. 1959.V. 1. № 4. P. 360–365.
Yamagishi A., Satoh T., Miyakawa A., Yoshimura Y., Sasaki S., Kobayashi K., Kebukawa Y., Yabuta H., Mita H., Imai E., Naganuma T., Fujita K., Usui T. LDM (life detection microscope): in situ imaging of living cells on surface of Mars // Trans. Jpn. Soc. Aeronaut. Space Sci. 2018. V. 16. № 3. P. 299–305.
Yamagishi A., Yokobori S.I., Yoshimura Y., Yamashita M., Hashimoto H., Kubota T., Yano H., Haruyama J., Tabata M., Kobayashi K., Honda H., Utsumi Y., Saiki T., Itoh T., Miyakawa A., Hamase K., Naganuma T., Mita H., Tonokura K., Sasaki S., Miyamoto H. Japan Astrobiology Mars Project (JAMP): Search for microbes on the Mars surface with special interest in methane-oxidizing bacteria // Biol. Sci. Space. 2010.V. 24. № 2. P. 67–82.
Zakharov Y.A., Nevostruev V.A.Radiolysis of solid inorganic salts with oxygen-containing anions // Russ. Chem. Rev. 1968. V. 37. № 1. P. 61.
Дополнительные материалы отсутствуют.
Инструменты
Астрономический вестник


