Биоорганическая химия, 2019, T. 45, № 1, стр. 3-16
Пептиды системы врожденного иммунитета растений. Часть I. Структура, биологическая активность и механизмы действия
Е. И. Финкина *, Д. Н. Мельникова *, И. В. Богданов *, Т. В. Овчинникова *
* Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук, Россия, 117997, Москва, ул. Миклухо-Маклая, 16/10
Поступила в редакцию 25.06.2018
После доработки 25.06.2018
Принята к публикации 25.06.2018
Аннотация
Иммунная система растений способна быстро реагировать на изменение условий окружающей среды, обеспечивая защиту от стрессов, патогенов и насекомых. В условиях инфицирования растения синтезируют множество соединений, ассоциированных с патогенезом, в том числе различные пептиды, которые не только обладают антимикробной активностью и усиливают действие друг друга, но и принимают участие в реализации целого комплекса защитных стратегий. Пептидные факторы системы врожденного иммунитета растений имеют разнообразную структурную организацию и обладают широким спектром биологической активности, включая антимикробную, противовирусную, противоопухолевую, инсектицидную, противовоспалительную, антипролиферативную, митогенную, анальгетическую. Некоторые из них участвуют в связывании и транспорте липидов, другие проявляют свойства блокаторов ионных каналов или ингибиторов протеаз и α-амилаз, но не оказывают токсического действия на собственные клетки и клетки млекопитающих. Часть растительных пептидов являются клинически значимыми пищевыми или пыльцевыми аллергенами. Все перечисленное делает их привлекательными объектами для детального изучения и возможного практического применения в различных сферах жизни человека. В обзоре представлены данные о разнообразии структур, биологической активности и механизмах антимикробного действия пептидов системы врожденного иммунитета растений.
ВВЕДЕНИЕ
Растения постоянно подвергаются воздействию различных стрессовых факторов. В связи с тем, что они ведут в основном неподвижный образ жизни, способность быстро адаптироваться к изменяющимся условиям окружающей среды становится ключевым фактором выживания. Основными стрессорами для растений являются засуха, атака насекомых, засоленность почвы, низкая температура и заражение фитопатогенными микроорганизмами. В арсенале у растений имеется целый ряд индуцируемых защитных механизмов, включающий утолщение клеточной стенки и изменение липидного состава клеточных мембран, повышение концентрации фитогормонов, накопление вторичных метаболитов – фитоалексинов и других низкомолекулярных веществ, образование активных форм кислорода и азота, активацию синтеза защитных белков и пептидов, развитие гиперчувствительного ответа и системной приобретенной резистентности (Systemic Acquired Resistance, SAR) [1].
Атака патогенных микроорганизмов приводит к активации иммунного ответа растений. Система врожденного иммунитета растений основана на способности распознавать сигналы об опасности – элиситоры, источником которых являются фитопатогенные микроорганизмы или сами растения. Неспецифичные экзогенные элиситоры, или патоген-ассоциированные молекулярные структуры (Pathogen Associated Molecular Patterns, PAMP), представляют собой вещества различной химической природы, которые образуются в результате разрушения клеток фитопатогенов при контакте с растением. Специфическими экзогенными элиситорами являются эффекторные белки фитопатогенов, действие которых изначально направлено на блокирование PAMP-активируемого иммунного ответа растения. Распознавание таких эффекторов клетками растения превращает их в факторы авирулентности фитопатогена и активирует “второй уровень” защиты растения.
Группу эндогенных элиситоров составляют молекулярные структуры, которые активно синтезируются растениями при их инфицировании или высвобождаются при повреждении клеток (Damage-Associated Molecular Patterns, DAMP) [2]. PAMP, DAMP и эффекторные белки распознаются специфичными рецепторами, расположенными в плазматической мембране или цитоплазме растительной клетки [3, 4]. В результате распознавания происходит запуск различных сигнальных путей посредством изменения внутриклеточного содержания ионов кальция, синтеза вторичных сигнальных молекул, таких как инозитолфосфат и активные формы кислорода (Reactive Oxygen Species, ROS), а также активации трехступенчатого каскада митоген-активируемых протеинкиназ (Mitogen-Activated Protein Kinases, MAPK) [5]. Передача сигнала приводит к изменению активности транскрипционных факторов, которые регулируют экспрессию различных генов, в том числе кодирующих широкий спектр белков и пептидов с антимикробной активностью [6].
КЛАССИФИКАЦИЯ ЗАЩИТНЫХ БЕЛКОВ И ПЕПТИДОВ РАСТЕНИЙ
В иммунном ответе растений принимает участие большое число разнообразных по свойствам белково-пептидных компонентов. Среди них особую группу составляют белки, связанные с патогенезом (Pathogenesis-Related Proteins, PR-белки), которые защищают растение в условиях стресса. Индукция их синтеза происходит при инфицировании растения и действии на него других неблагоприятных факторов окружающей среды. Семейство PR-белков включает в себя 17 классов пептидно-белковых факторов с различными молекулярными массами и структурно-функциональными свойствами. Сюда входят ферменты, гидролизующие клеточную стенку грибов (глюканазы (PR-2), хитиназы (PR-3,4,8,11), эндопротеазы (PR-7)); ингибиторы протеаз (PR-6); белки, связывающие и переносящие липидные молекулы (липид-транспортирующие белки (PR-14), гомологи Bet v 1 (PR-10)); белки и пептиды с выраженной антимикробной активностью (противогрибковые белки (PR-1), тауматин-подобные белки (PR-5), тионины (PR-13), дефенсины (PR-12)) и др.) [7].
Кроме того, существуют белки с антимикробной активностью, не принадлежащие к семейству PR-белков. К ним относятся запасные (2S-альбумины, лектины, напины, пуроиндолины), циклофилин-подобные и рибосом-инактивирующие белки, а также ферменты, расщепляющие нуклеиновые кислоты (рибонуклеазы, дезоксирибонуклеазы), LEA (Late Embryogenesis Abundant)-белки или доминирующие белки позднего эмбриогенеза и некоторые другие [8]. Защитными пептидами растений с антимикробной активностью, также не относящимися к семейству PR-белков, являются гевеин- и вицилин-подобные пептиды, α-гарпинины и другие четырехцистеиновые пептиды, снекины, ноттины, циклотиды, шеферины [9].
В обзоре будут рассмотрены все основные классы и группы защитных пептидов (с молекулярной массой до 10 кДа), играющих важную роль в реализации иммунного ответа растений. Многие из них внесены в базу данных PhytAMP (http://phytamp.hammamilab.org/main.php), в которой собраны сведения о растительных антимикробных пептидах (Antimicrobial Peptides, AMP).
СТРУКТУРНО-ФУНКЦИОНАЛЬНЫЕ СВОЙСТВА ЗАЩИТНЫХ ПЕПТИДОВ
Большинство защитных пептидов выделено из семян растений. В основной своей массе они являются катионными и имеют компактную, стабилизированную дисульфидными (S–S) связями структуру, которая обеспечивает их устойчивость к действию протеаз и изменению температуры или pH среды (рисунок). Представители различных классов защитных пептидов растений, в основном, ингибируют рост фитопатогенных грибов и характеризуются специфичностью антимикробного действия. Защитные пептиды также обладают инсектицидной, нематоцидной, противовирусной и антипролиферативной активностью в отношении опухолевых клеток, играют важную роль в развитии SAR растений (таблица). Кроме того, они, так же как и AMP животных, обладают иммуномодулирующими свойствами и участвуют в регуляции различных сигнальных путей с участием растительных гормонов, ROS и MAPK [10].
Таблица 1.
Сравнительная характеристика пептидов системы врожденного иммунитета растений
| Название | Мr, кДа | S–S-связи | Биологическая активность* | Вероятная мишень антимикробного действия** |
|---|---|---|---|---|
| Дефенсины (PR-12) | 5 |  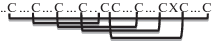 |
АБ, ПГ, ПВ, ИЦ, ИМ, М, ПО, ИББ, БИК, ИАФ | ЦПМ, ВКМ |
| Тионины (PR-13) | 5 | 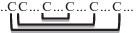 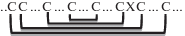 |
АБ, ПГ, ЦТ, ИЦ, ИМ | ЦПМ, ВКМ |
| LTP (PR-14) | 7 или 9–10 |
  |
АБ, ПГ, ПВ, ПО, А, связывают липидные молекулы, ИАФ |
ЦПМ |
| Линейные ноттины | 3–4 |  |
АБ, ПГ, ИЦ, ПО, ИАФ | н/о |
| Циклотиды | 2.7–4 |  |
АБ, ПГ, ПВ, ИЦ, подавляют рост улиток и гельминтов | ЦПМ |
| Гевеин-подобные пептиды | 3–5 | 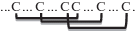   на примере Ee-CBP
на примере Ee-CBP
|
АБ, ПГ | КС, ВКМ |
| Вицилин-подобные пептиды | 4–11 | – | ПГ, ИАФ | КС |
| α-Гарпинины | 3–6 |  |
АБ, ПГ, ПВ, ИАФ | ВКМ |
| Пептиды Ib-AMP | 2–3 |  |
АБ, ПГ | ВКМ |
| Снекины | 6–7 |  |
АБ, ПГ | ЦПМ |
| Шеферины | 3–4 | – | АБ, ПГ | ВКМ |
| Ингибиторы протеаз (PR-6) | 6–9 |  на примере BBI бобовых
на примере BBI бобовых
|
ПГ, ПВ, М, ПО, ИАФ |
Ферменты |
* АБ – антибактериальная, ПГ – противогрибковая, ПВ – противовирусная, ИЦ – инсектицидная, ЦТ – цитотоксическая, ПО – противоопухолевая, М – митогенная, А – анальгезирующая, ИМ – иммуномодулирующая, ИББ – ингибирование биосинтеза белка, БИК – блокирование ионных каналов, ИАФ – ингибирование активности ферментов (протеаз и α-амилаз).
Дефенсины (PR-12). Дефенсины составляют консервативный класс AMP, представители которого обнаружены у позвоночных и беспозвоночных животных, растений, грибов и бактерий [11]. Растительные дефенсины относятся к семейству PR-белков и представляют собой осно́вные пептиды с массой около 5 кДа, структура которых стабилизирована четырьмя (C1-C8, C2-C5, C3-C6, C4-C7) или, гораздо реже, пятью S–S-связями [12, 13]. Одна из них (С1-С8) образована цистеинами, расположенными в N- и С-концевых участках структуры, что делает дефенсины растений псевдоциклическими соединениями и сближает их с циклическими пептидами циклотидами. Пространственная структура растительных дефенсинов в основном представлена одной α-спиралью и тремя скрученными антипараллельными β‑структурами (в β1αβ2β3-конфигурации) [14]. В ней присутствует цистеин-стабилизированный αβ-мотив (CSαβ, C2…C3XXXС4…С5…C6XC7, где X – остаток любой аминокислоты), характерный для токсинов насекомых, скорпионов и ядов пауков. Внутри этого мотива находится цистеин-стабилизированная α-спираль (CSH), которая встречается также в молекулах дефенсинов насекомых, нейротоксинов и блокаторов ионных каналов. В пыльце ряда растений (полыни Аrtemisia vulgaris, амброзии Ambrosia artemisiifolia, гваюлы Parthenium hysterophorus и подсолнечника Helianthus annuus) обнаружены дефенсины, в структуре которых присутствует необычный С-концевой домен, обогащенный гидроксилированными и О-гликозилированными остатками пролина [15].
Растительные дефенсины имеют широкий спектр биологической активности. Большинство из них обладают антимикробной активностью, которая характеризуется видоспецифичностью и наиболее выражена в отношении фитопатогенных грибов. Помимо этого, они ингибируют рост патогенных для человека микроорганизмов родов Candida, Aspergillus и Fusarium и при совместном применении с конвенциальными противогрибковыми средствами проявляют синергический эффект [16]. Как было отмечено выше, дефенсины имеют структурное сходство с нейротоксинами и обладают способностью блокировать натриевые, калиевые или кальциевые каналы [17]. Некоторые дефенсины ингибируют биосинтез белка [18]. Дефенсин-подобные пептиды из бобовых растений и некоторые другие дефенсины обладают митогенной активностью в отношении спленоцитов, ингибируют пролиферацию опухолевых клеток и активность обратной транскриптазы ВИЧ-1 [19, 20]. Дефенсин из перца Хабанеро Capsicum chinense, как и β-дефенсины млекопитающих, оказывает иммуномодулирующее действие на клетки млекопитающих [21]. Отдельные представители класса ингибируют активность протеаз и α-амилаз, оказывают инсектицидное действие [22].
Тионины (PR-13). Тионины, как и дефенсины, широко распространены в царстве растений; они обнаружены в листьях, корнях, стеблях и семенах различных видов, состоят из 45–47 а.о. и подразделяются на пять структурных типов [23]. Для тионинов I, II и IV типов характерно наличие четырех S–S-связей (C1-C8, C2-C7, C3-C6, C4-C5). III и V типы имеют по три S–S-связи с аналогичной аранжировкой, за исключением отсутствующей связи C2-C7. Тионины I типа являются осно́вными пептидами, к ним, в частности, принадлежит пуротионин из пшеницы Triticum aestivum. Тионины II типа характеризуются меньшей основностью и содержат один или два дополнительных аминокислотных остатка между четвертым и пятым цистеинами [24]. Пептиды III типа по основности подобны II типу и содержат шесть остатков цистеинов; к ним относятся виско- и форатоксины растений семейства Ремнецветные [25, 26]. Изоэлектрическая точка тионинов IV типа лежит в нейтральной области [27]. Пептиды V типа обнаружены в зародышах пшеницы и эгилопса Aegilops squarrosa, они нейтральны и сильно отличаются от остальных тионинов. Второй и восьмой цистеины в их составе отсутствуют, в связи с чем тионины данного типа имеют иную организацию S–S-связей [28].
Тионины всех типов имеют сходную организацию, содержат мотив β1-α1-α2-β2, формирующий жесткую Г-образную структуру, длинное плечо которой образовано двумя антипараллельными α-спиралями, а короткое – β-листом, состоящим из двух антипараллельных β-тяжей. Гидрофобные аминокислотные остатки расположены в основном на внешней поверхности длинного плеча, в то время как гидрофильные – находятся главным образом на внутренней поверхности короткого плеча и внешней поверхности угла между плечами [29].
Данные пептиды действуют против бактерий и грибов, в том числе дрожжей, вызывают вытекание внутриклеточного матрикса из клеток микроорганизмов, однако этот эффект, как и в случае дефенсинов, снижается в присутствии катионов. Тионины действуют в синергизме с растительными липид-транспортирующими белками, запасными 2S-альбуминами и ингибиторами протеаз [30, 31]. Пептиды этого класса оказывают токсическое действие на клетки млекопитающих и растительные протопласты, а также обладают инсектицидным действием [29]. Тионин Thi2.1 арабидопсиса Arabidopsis thaliana, так же как и дефенсин из перца Хабанеро [21], обладает иммуномодулирующей активностью, усиливает защитный ответ клеток млекопитающих в условиях инфицирования посредством активации выработки про- и противовоспалительных молекул [32].
Липид-транспортирующие белки (PR-14). Липид-транспортирующие белки (Lipid Transfer Proteins, LTP) составляют класс осно́вных пептидов с массой 7–10 кДа, способных обратимо связывать и переносить липидные молекулы. LTP широко представлены в царстве растений, но не обнаружены у водорослей. В связи с этим считается, что в арсенале системы врожденного иммунитета растений данные пептиды появились в момент выхода на сушу [33]. LTP разделяют на 10 подклассов (C, D, E, F, G, H, J, K, 1 и 2) на основании наличия/отсутствия гликозилфосфатидилинозитного якоря (GPI-якоря), расположения интронов в гене, гомологии аминокислотных последовательностей, организации S–S-связей и расположения межцистеиновых фрагментов.
Предполагается, что первыми в процессе эволюции появились представители подклассов D и G, гены которых найдены у печеночных мхов. Наиболее поздними являются LTP подкласса 1, обнаруженные у папоротников, а также подклассов 2 и C, гены которых найдены только у голо- и покрытосеменных [33]. Большинство растительных LTP содержат 8 остатков цистеина, вовлеченных в образование 4 S–S-связей. Благодаря компактной пространственной структуре LTP характеризуются высокой устойчивостью [34].
Наиболее изученными являются подклассы 1 и 2. LTP1 состоят из 90–95 а.о. и имеют следующий порядок образования S–S-связей: С1-С6, С2-С3, С4-С7, С5-С8. Их структура образована четырьмя α-спиралями, фрагментом 310-спирали и протяженным неструктурированным С-концевым участком [35]. LTP2 состоят из 65–70 а.о. и имеют иную организацию S–S-связей: С1-С5, С2-С3, С4-С7, С6-С8. Cтруктура LTP2 представлена тремя α-спиралями и областью, содержащей одиночные витки спирали [36]. Гидрофобные аминокислотные остатки LTP обращены внутрь молекулы и формируют там гидрофобную полость, форма и размеры которой сильно различаются у представителей данного класса [37]. Благодаря наличию этой полости LTP обладают способностью связывать различные липидные молекулы, так же как и гомологи основного пыльцевого аллергена березы Bet v 1 (PR-10) [38]. LTP образуют комплексы различной прочности с жирными кислотами с длиной цепи С10-С18, ацильными производными коэнзима А (CoA), фосфо- и галактолипидами, стеринами, жасмоновой кислотой. Помимо этого, они связывают простагландин В2, молекулы органических растворителей и некоторые лекарственные вещества. В опытах in vitro LTP осуществляют перенос между мембранами фосфолипидов и их производных, а также ацетил-CоА [37].
Многие LTP обладают антимикробной активностью в отношении фитопатогенных бактерий и грибов. LTP из перца Capsicum annuum и кофе Coffea canephora активны также в отношении грибов рода Candida [39, 40]. LTP нарцисса Narcissus tazetta и капусты полевой Brassica campestris обладают противовирусной активностью и способностью ингибировать пролиферацию опухолевых клеток человека in vitro [41, 42]. Некоторые представители класса, так же как и упомянутые выше дефенсины, ингибируют активность протеаз и α‑амилаз [43]. LTP кукурузы вызывает высвобождение цитохрома с из митохондрий, инициируя апоптотический каскад на митохондриальном уровне [44]. McLTP1 из нони Morinda citrifolia обладает анальгезирующей активностью, которая, по-видимому, связана с его действием на опиоидную систему [45].
Ноттины. Ноттины обнаружены в растениях, грибах, насекомых, моллюсках, пауках и являются одним из подтверждений параллельной эволюции. Существующая база данных KNOTTIN (http://www.dsimb.inserm.fr/KNOTTIN) содержит информацию о более чем 3000 пептидов [46].
Структура ноттинов, состоящих из 30–50 а.о., стабилизирована, как минимум, тремя S–S-связями (C1-C4, C2-C5, C3-C6). Характерным для них является наличие цистинового узла (сystine knot) или, как его еще называют, ноттинового мотива, в котором две S–S-связи (С1-С4, С2-С5) формируют кольцо, через которое проходит третья (С3-С6) [47]. Такая структурная организация обеспечивает исключительную стабильность ноттинов, которые сохраняют свою активность после кипячения и обладают резистентностью к действию различных протеаз [48]. К семейству ноттинов принадлежат некоторые ингибиторы α-амилаз и сериновых протеаз, антимикробные, инсектицидные и антигельминтные пептиды, токсины из ядов пауков и скорпионов. Мотивы цистинового узла присутствуют также в структурах растительных дефенсинов и гевеинов, различных факторов роста и гликопротеиновых гормонов человека [47]. Растительные ноттины представляют собой линейные или циклические пептиды, которые, на основании структурного сходства и спектра биологической активности, подразделяются на несколько групп.
Линейные ноттины. К линейным ноттинам относятся: ингибиторы α-амилаз и токсины, которые оказывают инсектицидное действие; ингибиторы сериновых протеаз; ингибиторы металлокарбоксипетидаз, проявляющие противогрибковую, противоопухолевую и антиангиогенную активность; ноттины с выраженной антимикробной активностью [47].
Линейные ноттины из семян растения Mirabilis jalapa (Mj-AMP1,2) [49] и лаконоса Phytolacca americana (PAFP-S) [50] состоят из 28–38 а.о., включая шесть остатков цистеина. Cтруктура PAFP-S характеризуется наличием трех скрученных β-тяжей, соединенных петлями различной длины. Расположенные в противоположных участках структуры осно́вные и гидрофобные аминокислотные остатки придают молекуле PAFP-S амфифильный характер [51]. Данные пептиды обладают противогрибковой активностью, подавляют рост грамположительных бактерий, но не оказывают токсического действия на грамотрицательные бактерии и эритроциты [49, 50]. Несмотря на высокую степень гомологии, Mj-AMP1 и Mj-AMP2 сильно различаются по степени выраженности антимикробной активности, которая сильно снижается в присутствии двухвалентных катионов [49].
Циклические ноттины (циклотиды). Первым открытым и охарактеризованным циклотидом является пептид калата B1 из африканского растения Oldenlandia affinis. К настоящему времени выделено и охарактеризовано около 300 циклотидов из различных видов растений, сведения о которых можно найти в базе данных Cybase (http://www.cybase.org.au/) [52].
Циклотиды состоят из 28–37 а.о. Они имеют циклическую структуру, образованную замыканием пептидной цепи по принципу голова к хвосту, и содержaт характерный для ноттинов цистиновый узел. Такая структура имеет компактные размеры и обеспечивает высокую стабильность пептидов. Кроме остатков цистеина, консервативными для циклотидов являются также остатки глицина (в положениях 2, 14 и 26) и глутаминовой кислоты (в положении 3), которые тоже играют важную роль в стабилизации их структуры [47, 53]. Особенностью последовательностей циклотидов является наличие в С-концевой области остатков аспарагина или аспарагиновой кислоты.
Циклотиды, основным структурным мотивом которых является β-шпилька, подразделяют на три подсемейства: циклотиды Мебиуса, браслетоподобные и ингибиторы трипсина [53]. Циклотиды подсемейств Мебиуса и браслетоподобных имеют одинаковую топологию цистиновых узлов, но у первых из них в структуре присутствует поворот на 180°, обусловленный наличием остатка Pro [54]. Браслетоподобные циклотиды характеризуются структурным разнообразием, широко распространены у растений и составляют примерно две трети циклотидов с известной первичной структурой [52]. Подсемейство циклотидов, ингибирующих активность трипсина, представлено небольшим числом пептидов, которые выделены из семян растения Momocordica cochinchinesis семейства Тыквенные и отличаются по структуре от представителей двух других подсемейств [55].
Циклотиды характеризуются широким спектром биологической активности, в микромолярных концентрациях подавляют рост бактерий, обладают средневыраженной противогрибковой активностью. Это показано, например, для калата B1 [56] и циклотидов из Clitoria ternatea семейства Бобовые [57]. Однако, антимикробная активность циклотидов проявляется только в буферах с низкой ионной силой, что ограничивает возможность их применения в медицине [58]. Отдельные представители подсемейств Мебиуса и браслетоподобных обладают инсектицидной активностью [59], подавляют рост улиток Pomacea canaliculata [60] и гельминтов [61]. Некоторые циклотиды этих подсемейств обладают противовирусной активностью в отношении ВИЧ [62]. Они не влияют на активность обратной транскриптазы ВИЧ. Предполагается, что циклотиды связывают фосфолипиды клеточной мембраны клетки-хозяина и/или оболочки вируса, препятствуя тем самым связыванию и/или слиянию вируса с клеточной мембраной [53].
Ряд циклотидов характеризуется избирательной цитотоксичностью в отношении опухолевых клеток. Механизм их противоопухолевой активности, по-видимому, связан со способностью индуцировать апоптоз и ингибировать пролиферацию и миграцию опухолевых клеток [63].
Гевеин-подобные пептиды – это небольшие катионные пептиды из 29–45 а.о., структура которых стабилизирована 3–5 S–S-связями, образующими, как и в случае ноттинов, цистиновый узел. Свое название данные пептиды получили благодаря структурному сходству с хитин-связывающим пептидом гевеином из латекса гевеи бразильской Hevea brasiliensis [64]. Хитин-связывающий (ChBD, Chitin-Binding Domain), или гевеин-подобный домен обеспечивает связывание полисахарида хитина, составляющего основу клеточной стенки грибов, и присутствует в структуре хитиназ и лектинов. Все хитин-связывающие белки и пептиды обладают противогрибковой активностью. ChBD гевеин-подобных пептидов богат ароматическими аминокислотными остатками и может быть представлен одной из следующих структур: SX(F/W/Y)X(F/W/Y)CGX4Y [65].
По количеству остатков цистеина этот класс подразделяют на 6C-, 8С- и 10С-гевеин-подобные пептиды. По расположению S–S-связей в цистиновом узле большинство гевеин-подобных пептидов подобны ноттинам. При этом четвертая и пятая S–S-связи (при их наличии в структуре пептидов) образуются между остатками цистеина, не входящими в цистиновый узел (таблица). 6C-гевеин-подобные пептиды обнаружены, например, в семенах амаранта хвостатого Amaranthus caudatus (Ac-AMP1,2) и амаранта запрокинутого A. retroflexus (Ar-AMP) [66], листьях звездчатки Stellaria media (SmAMP3) [67], различных частях кактуса Pereskia bleo (блеогены) [68]. 8C-гевеин-подобные пептиды присутствуют, например, в семенах гречихи посевной Fagopyrum esculentum (Fa-AMP1,2) [69], овса Avena sativa (авезин A) [70] и тысячеголова испанского Vaccaria hispanica (vH1, vH2) [65]. 10С-гевеин-подобные пептиды выделены, например, из пшеницы Triticum kiharae (WAMP-1a) [71] и бересклета Euonymus europaeus (Ee-CBP) [72]. Гевеин-подобные пептиды обнаружены у представителей голо- и покрытосеменных растений [73]. Считается, что ген пептида WAMP пшеницы мог возникнуть в результате сдвига рамки считывания древнего гена предшественника хитиназы в области, кодирующей каталитический центр фермента. Структура большинства гевеин-подобных пептидов характеризуется устойчивостью и может быть представлена следующим структурным мотивом: петля-β1-β2-петля-β3 [65].
Вицилин-подобные пептиды. Вицилины являются крупными белками, которые относятся к классу запасных 7S-глобулинов, присутствуют в семенах бобовых и других растений, обладают антимикробной активностью и являются пищевыми аллергенами [74]. В структуре вицилинов отсутствуют цистеины; они состоят из трех субъединиц с массами 40–80 кДа.
Из различных растений выделены вицилин-подобные пептиды, которые имеют структурное сходство с вицилинами и обладают антимикробной активностью. Данные пептиды мало изучены и не известно, являются ли они продуктами соответствующих генов или фрагментами вицилин-подобных 7S-глобулинов, которые образуются в результате ограниченного протеолиза или деградации этих белков. Возможно, образование коротких пептидов с выраженной антимикробной активностью из запасных белков, таких как 2S-альбумины и 7S-глобулины, является основой стратегии быстрой защиты растения от фитопатогенов во время прорастания семени, когда система иммунитета еще не полностью сформирована [75]. Из семян мальвы Malva parviflora выделены четыре пептида с антимикробной активностью и массой около 10 кДа. Два из них (CW-1,3) имеют черты сходства с вицилинами, а другие два (CW-2,4) – с 2S-альбуминами [75]. В семенах перца стручкового Capsicum baccatum в одной из пептидных фракций обнаружены два вицилин-подобных пептида с массами 4 и 8 кДа. Данная фракция обладала противогрибковой активностью, в том числе против грибов рода Candida, и способностью ингибировать активность α-амилаз млекопитающих и насекомых [76]. Пептидные фрагменты вицилина с молекулярной массой 9–11 кДа и противогрибковой активностью обнаружены в семенах хлопка Gossypium hirsutum [77].
α-Гарпинины и другие четырехцистеиновые пептиды. Из множества растений выделены четырехцистеиновые пептиды с антимикробной активностью, которые имеют различную структурную организацию. Четырехцистеиновые пептиды, имеющие общий структурный мотив CX3CXnCX3C и пространственную организацию в виде шпильки из двух α-спиралей (два мотива CX3C расположены на разных α-спиралях), которая стабилизирована двумя S–S-связями (C1-C4, C2-C3), выделяют в группу α-гарпининов [78]. К данному классу пептидов c установленной или предсказанной структурой в виде шпильки из двух α-спиралей относятся, например, Tk-AMP-X2 из семян пшеницы [79], EcAMP-1 из ежовники Echinochloa crus-galli [80], Sm-AMP-X из звездчатки [81], BWI-2c из гречихи посевной Fagopyrumes culentum [78], MBP-1 из кукурузы [82], люффин P1 из люффы цилиндрической Luffa cylindrica [83], VhTI из вероники плющелистной Veronica hederifolia [84], FtAMP из гречихи татарской F. tataricum [85]. Пептидами, содержащими в своей структуре мотивы CX3C и, возможно, относящимися к α-гарпининам, являются MiAMP из ореха макадамии Macadamia integrifolia [86]. Необходимо отметить, что подобную α-гарпининам пространственную структуру имеют некоторые токсины из ядов скорпионов и морских улиток [79].
Все α-гарпинины обладают противогрибковой активностью. Умеренно выраженную антибактериальную активность проявляют MBP-1 из кукурузы и MiAMP2с из макадамии. Антимикробная активность MiAMP2с, как в случае дефенсинов и тионинов, значительно снижается в присутствии ионов кальция. В проявлении противогрибковой активности Sm-AMP-X важную роль играют N- и C-концевые участки структуры пептида [81]. S–S-связи и остаток триптофана необходимы для антимикробного действия MBP-1 [82]. BWI-2c [78], VhTI [84] и FtAMP являются ингибиторами протеаз. Замена Arg21 в структуре FtAMP из гречихи татарской приводит к значительному снижению его способности ингибировать трипсин, но не влияет на противогрибковую активность [85]. Люффин P1 является рибосом-инактивирующим пептидом и обладает противовирусной активностью в отношении ВИЧ [83].
Примерами четырехцистеиновых пептидов с отличной от α-гарпининов структурой являются Ib-AMP1-4 из бальзамина Impatiens balsamina. Эти осно́вные пептиды длиной 20 а.о. имеют иной, чем у α-гарпининов, структурный мотив CCX8CX3C с двумя S–S-связями С1-С3 и С2-С4 [87]. Пространственная структура Ib-AMP1 содержит три β-поворота и характеризуется наличием полярных и гидрофобных фрагментов, расположенных в противоположных частях молекулы. Данные пептиды обладают противогрибковой активностью, в том числе в отношении представителей рода Candida, и антибиотической активностью против грамположительных бактерий, но не влияют на рост грамотрицательных бактерий и не оказывают цитотоксического действия на клетки млекопитающих [87, 88]. Отсутствие S–S-связей не снижает антимикробную активность Ib-AMP [89].
Ингибиторы протеаз (PR-6). Растительные ингибиторы протеаз составляют большой класс белков и пептидов с различной массой и структурной организацией. Структуры большинства ингибиторов протеаз стабилизированы S–S-связями, которые обеспечивают их функциональную активность и высокую устойчивость к денатурации и протеолизу, в том числе в желудочно-кишечном тракте человека [90].
Ингибитор трипсина и химотрипсина, выделенный из бобов Vicia faba, имеющий массу 7.5 кДа и принадлежащий к группе ингибиторов Баумана-Бирка (Bowman-Birk Inhibitor, BBI), обладает противогрибковой активностью, подавляет активность обратной транскриптазы ВИЧ-1 и активирует пролиферацию спленоцитов мышей [91]. Структура BBI двудольных стабилизирована семью (C1-C14, C2-C6, C3-C13, C4-C5, C7-C9, C8-C12, C10-C11) S–S-связями и представляет собой ядро из антипараллельных β-складчатых листов [92].
В семенах перца Capsicum annuum обнаружен ингибитор сериновых протеаз и α-амилазы PSI-1.2 с массой около 6 кДа и четырьмя S–S-связями, имеющий сходство с ингибиторами протеаз картофеля и обладающий противогрибковой активностью [93]. Структура ингибиторов этой группы характеризуется наличием тройного скрученного β‑листа и длинной петли, которая отвечает за взаимодействие с протеазами.
В листьях кассии Cassia fistula обнаружен ингибитор сериновых протеаз фистулин с массой около 4 кДа, который обладает активностью в отношении целого ряда патогенных для человека бактерий [94]. Из семян бобов мунг Phaseolus mungo выделен осно́вный ингибитор сериновых протеаз мангоин с массой около 10 кДа. Данный ингибитор обладает антибактериальной, противогрибковой и противоопухолевой активностью [95]. Из клубней картофеля Solanum tuberosum выделен ингибитор сериновых протеаз с массой 5.6 кДа, имеющий сходство с ингибиторами Кунитца и обладающий антибактериальной и противогрибковой активностью, в том числе против грибов рода Candida [96]. Ингибиторы Кунитца обычно имеют массу 20–22 кДа и характерную структуру в виде β-трилистника, стабилизированного двумя S–S-связями [97]. Также из клубней картофеля выделен другой ингибитор протеаз с массой 3.2 кДа и антимикробной активностью, который не проявляет гемолитические свойства [98].
Снекины. Снекины составляют класс осно́вных пептидов с массой 6–7 кДа, которые относятся к семейству Snakin/GASA (Gibberellin Acid-Stimulated from Arabidopsis). Гены Snakin/GASA широко представлены в царстве растений, однако биологические свойства кодируемых ими пептидов мало изучены. Данные гены кодируют предшественники, содержащие N-концевой сигнальный пептид, центральную вариабельную последовательность и С-концевой GASA-домен длиной приблизительно 60 а.о., включающий 12 остатков цистеина (XCX3CX3CX8CX3CX2CCX2CXCX11CXCX12CX) [99].
Из клубней картофеля выделены два пептида, снекин-1 (SN1 или StSN1) и снекин-2 (SN2 или StSN2), длиной 63 и 65 а.о., соответственно [100, 101]. Структура снекина-1 стабилизирована шестью S–S-связями (С1-С7, С2-С5, С3-С4, С6-С12, С8-С11, С9-С10) и содержит характерный для α‑гарпининов домен (α1-поворот-α2), короткую α-спираль, 310-спираль и две петли, которые предположительно имеют важное значение для проявления биологической функции пептида [102]. Получены и охарактеризованы также снекины SN2 томата [103] и MsSN1 люцерны [104].
Снекины в микромолярных концентрациях проявляют антимикробную активность в отношении широкого спектра фитопатогенных грибов и бактерий, способны действовать в синергизме с растительными дефенсинами [100–104]. В опытах in vitro они вызывают агрегацию бактериальных клеток и тем самым препятствуют распространению патогенов по растительным тканям [103]. Показано также, что MsSN1 из люцерны повышает устойчивость трансгенных растений к вирулентным штаммам фитопатогенов, но при этом не препятствует симбиотическим отношениям с азотфиксирующими микроорганизмами [104].
Шеферины. Два пептида с массой 3–4 кДа, богатых остатками глицина и гистидина и названные шеферинами, выделены из корней пастушьей сумки Capsella bursa-pastoris. Оба пептида содержат повторяющиеся Gly-Gly-His-мотивы, ингибируют рост грамотрицательных бактерий и различных видов грибов рода Candida [105]. Шеферин 1 (Shep 1) и его укороченные аналоги не обладают гемолитической активностью, их антимикробная активность сильно падает в растворах с высокой концентрацией соли [106].
МЕХАНИЗМЫ АНТИМИКРОБНОГО ДЕЙСТВИЯ
Механизмы антимикробного действия большинства пептидных факторов системы врожденного иммунитета растений недостаточно изучены. Однако показано, что данные пептиды оказывают свое антимикробное действие на уровне клеточной стенки и плазматической мембраны патогенных микроорганизмов, имеют внутриклеточные мишени и являются ингибиторами ферментов.
Клеточные стенки бактерий, грибов и растений имеют различное строение. У первых она состоит в основном из пептидогликана, у грибов обогащена полисахаридами – хитином и глюканом, а у растений – целлюлозой, гемицеллюлозой и пектином [107]. Хорошо известными PR-белками растений, мишенью антимикробного действия которых является клеточная стенка микроорганизмов, являются глюканазы и хитиназы, обладающие гидролитической активностью [8]. Многие, но не все хитиназы, в своей структуре содержат ChBD и каталитический домен. Действие хитиназ, содержащих ChBD, связано, в том числе, с их способностью взаимодействовать с хитином и нарушать формирование клеточной стенки гриба [108].
Как упоминалось выше, гевеин-подобные пептиды в своей структуре содержат ChBD и связывают хитин. Этим, как полагают, по аналогии с хитиназами может быть обусловлено их противогрибковое действие. Однако данные пептиды действуют также против грибов, например оомицетов, не содержащих хитин в составе клеточной стенки, и, следовательно, могут иметь иной механизм действия [71]. Предполагается, что механизм противогрибкового действия вицилина [74] и вицилин-подобных пептидов [76] тоже связан со способностью связывать хитин.
Бактериальные мембраны содержат большое количество анионных фосфолипидов (PL) – фосфатидилглицеринов, кардиолипина, лизофосфатидилглицеринов. Плазматические мембраны грибов в основном представлены нейтральными PL (фосфатидилэтаноламином, фосфатидилхолином). Наружные мембраны клеток млекопитающих в основном обогащены фосфатидилхолином. В отличие от высших эукариот, плазматическая мембрана которых содержит холестерин, основным стерином грибов является эргостерин, и на него направлено действие многих противогрибковых препаратов [109]. Также ключевыми компонентами плазматических мембран дрожжевых и филаментных грибов выступают сфинголипиды, которые участвуют в ряде клеточных процессов [110]. Цитоплазматическая мембрана является мишенью действия дефенсинов, тионинов, LTP, циклотидов и снекинов.
Считается, что тионины, LTP и снекины за счет электростатических взаимодействий неспецифически связываются с мембраной фитопатогенов. В опытах in vitro тионины и LTP вызывают нарушение проницаемости цитоплазматических мембран фитопатогенов и искусственных липосом, состоящих преимущественно из анионных PL [111, 112]. Однако действие LTP слабо выражено и наблюдается только в растворах с низкой ионной силой. Снекины, так же как и тионины, обладают бактерицидным и фунгицидным действием, вызывают гемолиз эритроцитов и разрушение протопластов растительных клеток. Их антимикробная активность снижается в солевых растворах. Предполагается, что тионины встраиваются в мембрану с образованием селективных ионных каналов или покрывают поверхность мембраны, вызывая изменение ее свойств, дестабилизацию и нарушение целостности бислоя [111]. Высказывается предположение, что снекины формируют поры в мембране фитопатогена и вызывают гибель его клеток [113]. LTP не образуют поры. Ослаблением электростатического взаимодействия с клеточной мембраной фитопатогена объясняется менее выраженная антимикробная активность изоформ LTP, содержащих меньшее число осно́вных аминокислотных остатков [41].
Как полагают, дефенсины и циклотиды имеют специфические липидные мишени, которые выполняют функцию своеобразных рецепторов. Дефенсины не нарушают проницаемость искусственных мембран. В роли специфических мишеней для них выступают фосфо- и гликосфинголипиды, а также фосфатидовые кислоты и фосфатидилинозиты клеточных мембран грибов [114].
Рис. 1.
Пространственные структуры представителей различных классов пептидов системы врожденного иммунитета растений.

Интересно отметить разнообразие мишеней и механизмов антимикробного действия дефенсинов. Даже для одного и того же пептида в отношении различных фитопатогенов механизмы действия могут быть разными, что обусловлено, вероятно, особенностями липидного состава цитоплазматических мембран грибов и конформационной гетерогенностью дефенсинов [115, 116]. Результатом взаимодействия дефенсина с мембраной фитопатогена является запуск различных каскадных реакций, которые приводят к изменению работы ионных каналов, нарушению целостности мембраны, накоплению ROS и, как следствие, апоптотической или некротической гибели клеток [114]. Показано, что циклотид калата B1 специфически связывает фосфатидилэтаноламин, нарушает целостность мембран, формирует поры и вызывает вытекание содержимого клеток [117, 118].
Антимикробное действие пептидов системы врожденного иммунитета растений кроме того связано с их проникновением внутрь клетки фитопатогена и взаимодействием с различными внутриклеточными мишенями. Как полагают, внутриклеточные мишени имеют дефенсины, тионины, гевеин-подобные пептиды, четырехцистеиновые пептиды, шеферины. Показано, что после взаимодействия с глюкозилцерамидами мембран клеток грибов дефенсин Psd1 из гороха Pisum sativum связывается с ядерным белком циклином F [119]. Еще один вариант внутриклеточного действия дефенсинов растений, предположительно, состоит в ингибировании биосинтеза белка [18]. Некоторые тионины, в частности вискотоксины, связываются с ДНК и РНК и, возможно, с другими внутриклеточными мишенями [120]. Например, пуротионины подавляют активность рибонуклеотидредуктазы и необратимо ингибируют β-глюкуронидазу [121]. Для гевеин-подобного пептида ипомеи Pn-AMP1 показано противогрибковое действие в отношении дрожжей Saccharomyces cerevisiae и Candida albicans, обусловленное воздействием на их цитоскелетный белок актин [122].
Показано, что α-гарпинин MBP-1 кукурузы не разрушает плазматические мембраны бактериальных клеток и имеет сродство к ДНК [82]. Еще один представитель этого класса пептидов, EcAMP1 из ежовника, связывается с поверхностью конидий гриба, проникает внутрь клетки, не нарушая целостности мембраны, и накапливается в цитоплазме [80]. Четырехцистеиновые пептиды Ib-AMP из бальзамина также не нарушают проницаемость клеточных мембран микроорганизмов и, предположительно, проникая внутрь клеток, взаимодействуют с внутриклеточными компонентами [88, 89]. Шеферин I из пастушьей сумки не нарушает проницаемость мембран грибов рода Candida, проникает в клетки, возможно посредством эндоцитоза, подобно другим гистидин-богатым пептидам, и имеет, скорее всего, внутриклеточные мишени [105].
Защитное действие растительных ингибиторов протеаз напрямую связано с функциями протеаз фитопатогенов, активность которых они подавляют. Протеиназы обеспечивают микроорганизмы необходимыми источниками пищи. Кроме того, они являются факторами вирулентности фитопатогенов, способствующими разрушению клеточной стенки растений и облегчению проникновения и распространения фитопатогенов по тканям, а также блокируют различные ступени иммунного ответа [123, 124]. У патогенных микроорганизмов протеазы выполняют функцию эффекторных белков, которые выделяются в межклеточное пространство или секретируются в растительные клетки и блокируют различные стадии сигнальных путей иммунного ответа, активируемого PAMP/DAMP или другими эффекторами. Они инактивируют и осуществляют деградацию рецепторов, которые распознают PAMP/DAMP и эффекторы, MAPK, транскрипционных факторов и др. [124]. Растительные ингибиторы протеаз, блокируя действие соответствующих ферментов, лишают патогенов необходимых источников питательных веществ, замедляют их распространение по тканям растения, препятствуют деградации протеазами микроорганизмов различных PR-белков других классов, секретируемых растением для своей защиты, например, хитиназ, глюканаз, дефенсинов, LTP и др., а также предупреждают блокирование сигнальных путей развития иммунного ответа [125, 126]. Вопрос о том, является ли антимикробная активность этих пептидов просто результатом ингибирования протеаз или же существует иной механизм их действия, остается открытым.
ЗАКЛЮЧЕНИЕ
Таким образом, в арсенале системы врожденного иммунитета растений находится множество разнообразных пептидных компонентов, участвующих в предотвращении развития инфекции. В условиях атаки фитопатогенных микроорганизмов или насекомых пептиды системы врожденного иммунитета растений синтезируются на рибосомах или образуются в результате ограниченного протеолиза и деградации белков. Пептиды системы врожденного иммунитета растений очень разнообразны и имеют преимущественно α-спиральную, β-структурную или смешанную организацию. Структура многих из них стабилизирована S–S-связями и характеризуется устойчивостью, которая, по-видимому, позволяет им сохранять функциональную активность в апопласте в условиях действия протеолитических ферментов, выделяемых патогенными микроорганизмами. Данные пептиды характеризуются широким спектром биологического действия, что обеспечивает их участие в защите растений от грибов, бактерий, вирусов и насекомых. Они имеют различные механизмы антимикробного действия, работают на уровне клеточной стенки и плазматической мембраны патогенных микроорганизмов, имеют внутриклеточные мишени и являются ингибиторами ферментов. Защитные пептиды также проявляют иммуномодулирующие свойства и участвуют в регуляции различных сигнальных путей растения. Кроме того, как было описано выше, пептиды системы врожденного иммунитета растений обладают антимикробной активностью в отношении патогенных для человека микроорганизмов, оказывают противоопухолевое действие и могут найти применение в медицинской практике.
Список литературы
Nürnberger T., Brunner F., Kemmerling B., Piater L. // Immunol. Rev. 2004. V. 198. P. 249–266.
Ranf S. // Curr. Opin. Plant Biol. 2017. V. 38. P. 68–77.
He Y., Zhou J., Shan L., Meng X. // J. Cell Sci. 2018. V. 131. pii: jcs209353. doi 10.1242/jcs.209353
Zhang X., Dodds P.N., Bernoux M. // Annu. Rev. Phytopathol. 2017. V. 55. P. 205–229.
Kachroo A., Vincelli P., Kachroo P. // Phytopathology. 2017. V. 107. P. 1452–1461.
Birkenbihl R.P., Liu S., Somssich I.E. // Curr. Opin. Plant Biol. 2017. V. 38. P. 1–9.
Golshani F., Fakheri B.A., Behshad E., Vashvaei R.M. // Biol. Forum Int. J. 2015. V. 7. P. 477–495.
Wong J.H., Ng T.B., Cheung R.C., Ye X.J., Wang H.X., Lam S.K., Lin P., Chan Y.S., Fang E.F., Ngai P.H., Xia L.X., Ye X.Y., Jiang Y., Liu F. // Appl. Microbiol. Biotechnol. 2010. V.87. P. 1221–1235.
Tam J.P., Wang S., Wong K.H., Tan W.L. // Pharmaceut. (Basel). 2015. V. 8. P.711–757.
Bolouri Moghaddam M.R., Vilcinskas A., Rahnamaeian M. // Mol. Plant Pathol. 2016. V. 17. P. 464–471.
Broekaert W., Terras F.R., Cammue B.P., Osborn R.W. // Plant Physiol. 1995. V. 108. P. 1353–1358.
Finkina E.I., Shramova E.I., Tagaev A.A., Ovchinnikova T.V. // Biochem. Biophys. Res. Communs. 2008. V. 371. P. 860–865.
Janssen B.J., Schirra H.J., Lay F.T., Anderson M.A., Craik D.J. // Biochemistry. 2003. V. 42. P. 8214–8222.
Shenkarev Z.O, Gizatullina A.K., Finkina E.I., Alekseeva E.A., Balandin S.V., Mineev K.S., Arseniev A.S., Ovchinnikova T.V. // Biochem. Biophys. Res. Communs. 2014. V. 451. P. 252–257.
Léonard R., Wopfner N., Pabst M., Stadlmann J., Petersen B.O., Duus J.Ø., Himly M., Radauer C., Gadermaier G., Razzazi-Fazeli E., et al. // J. Biol. Chem. 2010. V. 285. P. 27192–27200.
Vriens K., Cools T.L., Harvey P.J., Craik D.J., Braem A., Vleugels J., De Coninck B., Cammue B.P., Thevissen K. // Peptides. 2016. V. 75. P. 71–79.
Vriens K., Peigneur S., De Coninck B., Tytgat J., Cammue B.P., Thevissen K. // Sci. Rep. 2016. doi 10.1038/srep32121
Chen G.H., Hsu M.P., Tan C.H., Sung H.Y., Kuo C.G., Fan M.J., Chen H.M., Chen S., Chen C.S. // J. Agric. Food Chem. 2005. V. 53. P. 982–988.
Anaya-López J.L., López-Meza J.E., Baizabal-Aguirre V.M., Cano-Camacho H., Ochoa-Zarzosa A. // Biotechnol. Lett. 2006. V. 28. P. 1101–1108.
Wong J.H., Zhang X.Q., Wang H.X., Ng T.B. // Peptides. 2006. V. 27. P. 2075–2081.
Díaz-Murillo V., Medina-Estrada I., López-Meza J.E., Ochoa-Zarzosa A. // Peptides. 2016. V. 78. P. 109–118.
Sarkar P., Jana J., Chatterjee S., Sikdar S.R. // Springerplus. 2016. doi 10.1186/s40064–016–2144–2142
Stec B. // Cell Mol. Life Sci. 2006. V. 63. P. 1370–1385.
Bohlmann H., Apel K. // Mol. Gen. Genet. 1987. V. 207. P. 446–454.
Sauviat M.P. // Toxicon. 1990. V. 28. P. 83–89.
Stein G.M., Bussing A., Schaller G., Pfuller U., Schietzel M. // Ann. Oncol. 1998. V. 9. P. 87.
Schmidt A., Teeter M., Weckert E., Lamzin V.S. // Acta Crystallogr. Sect. F. Struct. Biol. Cryst. Commun. 2011. V. 67. P. 424–428.
Castagnaro A., Segura A., Garciaolmedo F. // Plant Physiol. 1995. V. 107. P. 1475–1476.
Florack D.E.A., Stiekema W.J. // Plant Mol. Biol. 1994. V. 26. P. 25–37.
Bohlmann H., Clausen S., Behnke S. // Embo J. 1988. V. 7. P. 1559–1565.
Broekaert W.F., Cammue B.P.A., De Bolle M.F.C., Thevissen K., De Samblanx G.W., Osborn R.W. // Crit. Rev. Plant Sci. 1997. V. 16. P. 297–323.
Báez-Magaña M., Díaz-Murillo V., López-Meza J.E., Ochoa-Zarzosa A. // Int. Immunopharmacol. 2018. V. 57. P. 47–54.
Edstam M.M., Viitanen L., Salminen T.A., Edqvist J. // Mol. Plant. 2011. V. 4. P. 947–964.
Palacin A., Varela J., Quirce S., del Pozo V., Tordesillas L., Barranco P., Fernandez-Nieto M., Sastre J., Diaz-Perales A., Salcedo G. // Clin. Exp. Allergy. 2009. V. 39. P. 1267–1276.
Bogdanov I.V., Shenkarev Z.O., Finkina E.I., Melnikova D.N., Rumynskiy E.I., Arseniev A.S., Ovchinnikova T.V. // BMC Plant Biol. 2016. V. 16. P. 107.
Samuel D., Liu Y.J., Cheng C.S., Lyu P.C. // J. Biol. Chem. 2002. V. 277. P. 35267–35273.
Finkina E.I., Melnikova D.N., Bogdanov I.V., Ovchinnikova T.V. // Acta Naturae. 2016. V. 8. P. 47–61.
Finkina E.I., Melnikova D.N., Bogdanov I.V., Ovchinnikova T.V. // Curr. Med. Chem. 2017. V. 24. P. 1772–1787.
Diz M.S., Carvalho A.O., Ribeiro S.F., Da Cunha M., Beltramini L., Rodrigues R., Nascimento V.V., Machado O.L., Gomes V.M. // Physiol. Plant. 2011. V. 142. P. 233–246.
Zottich U., Da Cunha M., Carvalho A.O., Dias G.B., Silva N.C., Santos I.S., do Nacimento V.V., Miguel E.C., Machado O.L., Gomes V.M. // Biochim. Biophys. Acta. 2011. V. 1810. P. 375–383.
Ooi L.S., Tian L., Su M., Ho W.S., Sun S.S., Chung H.Y., Wong H.N., Ooi V.E. // Peptides. 2008. V. 29. P. 2101–2109.
Lin P., Xia L., Wong J.H., Ng T.B., Ye X., Wang S., Shi X. // J. Pept. Sci. 2007. V. 13. P. 642–648.
Sawano Y., Hatano K., Miyakawa T., Komagata H., Miyauchi Y., Yamazaki H., Tanokura M. // Plant Physiol. 2008. V. 146. P. 1909–1919.
Crimi M., Astegno A., Zoccatelli G., Esposti M.D. // Arch. Biochem. Biophys. 2006. V. 445. P. 65–71.
Campos D.C., Costa A.S., Lima A.D., Silva F.D., Lobo M.D., Monteiro–Moreira A.C., Moreira R.A., Leal L.K., Miron D., Vasconcelos I.M., et al. // Int. J. Biol. Macromol. 2016. V. 86. P. 71–79.
Postic G., Gracy J., Perin Ch., Chiche L., Gelly J.-Ch. // Nucleic Acids Research. 2018. V. 46. P. D454–D458. doi 10.1093/nar/gkx1084
Molesini B., Treggiari D., Dalbeni A., Minuz P., Pandolfini T. // Br. J. Clin. Pharmacol. 2017. V. 83. P. 63–70.
Kolmar H. // Curr. Opin.Pharmacol. 2009. V. 9. P. 608–614.
Cammue B.P.A., De Bolle M.F., Terras F.R.G., Van Damme P.P.J., Rees S.B., Vanderleyden J., Broekaert W.F. // J. Biol. Chem. 1992. V. 267. P. 2228–2233.
Shao F., Hu Z., Xiong Y.M., Huang Q.Z., Wang C.G., Zhu R.H., Wang D.C. // Biochim. Biophys.Acta. 1999. V. 1430. P. 262–268.
Gao G.H., Liu W., Dai J.X., Wang J.F., Hu Z., Zhang Y., Wang D.C. // Biochemistry. 2001. V. 40. P. 10973–10978.
Kaas Q., Craik D.J. // Biopolymers. 2010. V. 94. P. 584–591.
Gould A., Camarero J.A. // Chembiochem. 2017. V. 18. P. 1350–1363.
Craik D.J., Daly N.L., Bond T., Waine C. // J. Mol. Biol. 1999. V. 294. P. 1327–1336.
Chiche L., Heitz A., Gelly J.C., Gracy J., Chau P.T., Ha P.T., Hernandez J.F., Le-Nguyen D. // Curr. Protein Pept. Sci. 2004. V. 5. P. 341–349.
Tam J.P., Lu Y.A., Yang J. L., Chiu K.W. // Proc. Natl. Acad. Sci. 1999. V. 96. P. 8913–8918.
Nguyen G.K., Zhang S., Nguyen N.T., Nguyen P.Q., Chiu M.S., Hardjojo A., Tam J.P. // J. Biol. Chem. 2011. V. 286. P. 24275 –24287.
Henriques S.T., Craik D.J. // Biochemistry. 2017. V. 56. P. 669–682.
Pinto M.F.S., Fensterseifer I.C.M., Migliolo L., Sousa D.A., de Capdville G., Arboleda-Valencia J.W., Colgrave M.L., Craik D.J., Magalhães B.S., Dias S.C., et al. // J. Biol. Chem. 2012. V. 287. P. 134–147.
Plan M.R.R., Saska I., Cagauan A.G., Craik D.J. // J. Agric. Food Chem. 2008. V. 56. P. 5237–5241.
Colgrave M.L., Kotze A.C., Kopp S., McCarthy J.S., Coleman G.T., Craik D.J. // Acta Trop. 2009. V. 109. P. 163–166.
Chen B., Colgrave M.L., Daly N.L., Rosengren K.J., Gustafson K.R., Craik D.J. // J. Biol. Chem. 2005. V. 280. P. 22395 –22405.
Hu E., Wang D., Chen J., Tao X. // Int. J. Clin. Exp. Med. 2015. V. 8. P. 4059 –4065.
Subroto T., de Vries H., Schuringa J.J., Soedjanaatmadja U.M.S., Hofsteenge J., Jekel P.A., Beintema J.J. // Plant Physiol. Biochem. 2001. V. 39. P. 1047–1055.
Wong K.H., Tan W.L., Kini S.G., Xiao T., Serra A., Sze S.K., Tam J.P. // Front Plant Sci. 2017. V. 8:1100. doi 10.3389/fpls.2017.01100
Broekaert W.F., Marien W., Terras F.R., De Bolle M.F., Proost P., Van Damme J., Dillen L., Claeys M., Rees S.B., Vanderleyden J., et al. // Biochemistry. 1992. V. 31. P. 4308–4314.
Rogozhin E.A., Slezina M.P., Slavokhotova A.A., Istomina E.A., Korostyleva T.V., Smirnov A.N., Grishin E.V., Egorov T.A., Odintsova T.I. // Biochimie. 2015. V. 116. P. 125–132.
Loo S., Kam A., Xiao T., Tam J.P. // Front Plant Sci. 2017. V. 8:2162. doi 10.3389/fpls.2017.02162
Fujimura M., Minami Y., Watanabe K., Tadera K. // Biosci. Biotechnol. Biochem. 2003. V. 67. P. 1636–1642.
Li S.S., Claeson P. // Phytochemistry. 2003. V. 63. P. 249–255.
Odintsova T.I., Vassilevski A.A., Slavokhotova A.A., Musolyamov A.K., Finkina E.I., Khadeeva N.V, Rogozhin E.A., Korostyleva T.V., Pukhalsky V.A., Grishin E.V., et al. // FEBS J. 2009. V. 276. P. 4266–4275.
Van den Bergh K.P.B., Rouge P., Proost P., Coosemans J., Krouglova T., Engelborghs Y., Peumans W.J., Van Damme E.J.M. // Planta. 2004. V. 219. P. 221–232.
Wong K.H., Tan W.L., Serra A., Xiao T., Sze S.K., Yang D., Tam J.P. // Front Plant Sci. 2016. V. 7:1639 doi 10.3389/fpls.2016.01639
Gomes V.M., Okorokov L.A., Rose T.L., Fernandes K.V., Xavier-Filho J. // Biochim. Biophys. Acta. 1998. V. 1379. P. 207–216.
Wang X., Bunkers G.J., Walters M.R., Thoma R.S. // Biochem. Biophys. Res. Communs. 2001. V. 282. P. 1224–1228.
Vieira Bard G.C., Nascimento V.V., Oliveira A.E., Rodrigues R., Da Cunha M., Dias G.B., Vasconcelos I.M., Carvalho A.O., Gomes V.M. // Biopolymers. 2014. V. 102. P. 335–343.
Chung R.P.-T., Neumann G.M., Polya G.M. // Plant Sci. 1997. V. 127. P. 1–16.
Oparin P.B., Mineev K.S., Dunaevsky Y.E., Arseniev A.S., Belozersky M.A., Grishin E.V., Egorov T.A., Vassilevski A.A. // Biochem. J. 2012. V. 446. P. 69–77.
Berkut A.A., Usmanova D.R., Peigneur S., Oparin P.B., Mineev K.S., Odintsova T.I., Tytgat J., Arseniev A.S., Grishin E.V., Vassilevski A.A. // J. Biol. Chem. 2014. V. 289. P. 14331–14340.
Nolde S.B., Vassilevski A.A., Rogozhin E.A., Barinov N.A., Balashova T.A., Samsonova O.V., Baranov Y.V., Feofanov A.V., Egorov T.A., Arseniev A.S., Grishin E.V. // J. Biol. Chem. 2011. V. 286. P. 25145–25153.
Slavokhotova A.A., Rogozhin E.A., Musolyamov A.K., Andreev Y.A., Oparin P.B., Berkut A.A., Vassilevski A.A., Egorov T.A., Grishin E.V., Odintsova T.I. // Plant Mol. Biol. 2014. V. 84. P. 189–202.
Sousa D.A., Porto W.F., Silva M.Z., da Silva T.R., Franco O.L. // Molecules. 2016. V. 21. pii: E1062. doi 10.3390/molecules21081062
Ng Y.M., Yang Y., Sze K.H., Zhang X., Zheng Y.T., Shaw P.C. // J. Struct. Biol. 2011. V. 174. P. 164–172.
Conners R., Konarev A.V., Forsyth J., Lovegrove A., Marsh J., Joseph-Horne T., Shewry P., Brady R.L. // J. Biol. Chem. 2007. V. 282. P. 27760–27768.
Cui X., Du J., Li J., Wang Z. // Acta Biochim. Biophys. Sin (Shanghai). 2018. doi 10.1093/abbs/gmy015
Marcus J.P., Green J.L., Goulter K.C., Manners J.M. // Plant J. 1999. V. 19. P. 699–710.
Tailor R.H., Acland D.P., Attenborough S., Cammue B.P., Evans I.J., Osborn R.W., Ray J.A., Rees S.B., Broekaert W.F. // J. Biol. Chem. 1997. V. 272. P. 24480–24487.
Lee D.G., Shin S.Y., Kim D.-H., Seo M.Y., Kang J.H., Lee Y., Kim K.L., Hahm K.-S. // Biotech. Letters. 1999. V. 21. P. 1047–1050.
Wang P., Bang J.K., Kim H.J., Kim J.K., Kim Y., Shin S.Y. // Peptides. 2009. V. 30. P. 2144–2149.
Qi R.F., Song Z.W., Chi C.W. // Acta Biochim. Biophys. Sin. (Shanghai). 2005. V. 37. P. 283–292.
Ye X.Y., Ng T.B., Rao P.F. // Biochem. Biophys. Res. Communs. 2001. V. 289. P. 91–96.
James A.M., Jayasena A.S., Zhang J., Berkowitz O., Secco D., Knott G.J., Whelan J., Bond C.S., Mylne J.S. // Plant Cell. 2017. V. 29. P. 461–473.
Vieira Bard G.C., Nascimento V.V., Ribeiro S.F., Rodrigues R., Perales J., Teixeira-Ferreira A., Carvalho A.O., Fernandes K.V., Gomes V.M. // Protein J. 2015. V. 34. P. 122–129.
Arulpandi I., Sangeetha R. // ISRN Pharm. 2012:584073. doi 10.5402/2012/584073
Wang S., Lin J., Ye M., Ng T.B., Rao P., Ye X. // Peptides. 2006. V. 27. P. 3129–3136.
Kim J.Y., Gopal R., Kim S.Y., Seo C.H., Lee H.B., Cheong H., Park Y. // Cell. Int. J. Mol. Sci. 2013. V. 14. P. 4349–4360.
Bendre A.D., Ramasamy S., Suresh C.G. // Int. J. Biol. Macromol. 2018. pii: S0141–8130(18)30322–2. doi 10.1016/j.ijbiomac.2018.02.148
Kim M.H., Park S.C., Kim J.Y., Lee S.Y., Lim H.T., Cheong H., Hahm K.S., Park Y. // Biochem. Biophys. Res. Communs. 2006. V. 346. P. 681–686.
Oliveira-Lima M., Benko-Iseppon A.M., Neto J.R.C.F, Rodriguez-Decuadro S., Kido E.A., Crovella S., Pandolfi V. // Curr. Protein Pept. Sci. 2017. V. 18. P. 368–374.
Segura A., Moreno M., Madueno F., Molina A., Garcia-Olmedo F. // Molec. Plant Microb. Inter. 1999. V. 12. P. 16–23.
Berrocal-Lobo M., Segura A., Moreno M., López G., García-Olmedo F., Molina A.// Plant Physiol. 2002. V. 128. P. 951–961.
Yeung H., Squire C.J., Yosaatmadja Y., Panjikar S., López G., Molina A., Baker E.N., Harris P.W., Brimble M.A. // Angew Chem. Int. Ed Engl. 2016. V. 55. P. 7930–7933.
Herbel V., Schäfer H., Wink M. // Molecules. 2015. V. 20. P. 14889–14901.
García A.N., Ayub N.D., Fox A.R., Gómez M.C., Diéguez M.J., Pagano E.M., Berini C.A., Muschietti J.P., Soto G. // BMC Plant Biol. 2014. V. 14:248. doi 10.1186/s12870–014–0248–9
Park C.J., Park C.B., Hong S.S., Lee H.S., Lee S.Y., Kim S.C. // Plant Mol. Biol. 2000. V. 44. P. 187–197.
Remuzgo C., Oewel T.S., Daffre S., Lopes T.R., Dyszy F.H., Schreier S., Machado–Santelli G.M., Teresa Machini M. // Amino Acids. 2014. V. 46. P. 2573–2586.
Brown L., Wolf J.M., Prados-Rosales R., Casadevall A. // Nat. Rev. Microbiol. 2015. V. 13. P. 620–630.
Theis T., Stahl U. // Cell. Mol. Life Sci. 2004. V. 61. P. 437–455.
Teixeira V., Feio M.J., Bastos M. // Prog. Lipid Res. 2012. V. 51. P. 149–177.
Fontaine T. // Biochimie. 2017. V. 141. P. 9–15.
Stec B., Markman O., Rao U., Heffron G., Henderson S., Vernon L. P., Brumfeld V., Teeter M.M. // J. Pept. Res. 2004. V. 64. P. 210–224.
Regente M.C., Giudici A.M., Villalaín J., de la Canal L. // Lett. Appl. Microbiol. 2005. V. 40. P. 183–189.
Herbel V., Wink M. // Peer J. 2016. V. 4:e1987. doi 10.7717/peerj.1987
Cools T.L., Struyfs C., Cammue B.P., Thevissen K. // Future Microbiol. 2017. V. 12. P. 441–454.
El-Mounadi K., Islam K.T., Hernandez-Ortiz P., Read N.D., Shah D.M. // Mol. Microbiol. 2016. V. 100. P. 542–559.
Финкина Е.И., Овчинникова Т.В. // Биоорганическая химия. 2018. Т. 44. С. 247–266. [Finkina E.I., Ovchinnikova T.V. // Russ. J. Bioorgan. Chem. 2018. V. 44. P. 261–278.]
Troeira Henriques S., Huang Y.H., Chaousis S., Wang C.K., Craik D.J. // Chembiochem. 2014. V. 15. P. 1956–1965.
Henriques S.T., Huang Y.H., Rosengren K.J., Franquelim H.G., Carvalho F.A., Johnson A., Sonza S., Tachedjian G., Castanho M.A., Daly N.L.,Craik D.J. // J. Biol. Chem. 2011. V. 286. P. 24231–24241.
Lobo D.S., Pereira I.B., Fragel-Madeira L., Medeiros L.N., Cabral L.M., Faria J., Bellio M., Campos R.C., Linden R., Kurtenbach E. // Biochemistry. 2007. V. 46. P. 987–996.
Li S.S., Gullbo J., Lindholm P., Larsson R., Thunberg E., Samuelsson G., Bohlin L., Claeson P. // Biochem. J. 2002. V. 366. P. 405–413.
Diaz I., Carmona M.J., Garcia-Olmedo F. // FEBS Lett. 1992. V. 296. P. 279–282.
Ja C.K., Lee B., Young M.E., Sung C.K., Cooper J.A., Baek D., Chae O.L., Sang Y.L., Yun D.J., Moo J.C. // Plant Cell Physiol. 2004. V. 45. P. 1669–1680.
Jashni M.K., Mehrabi R., Collemare J., Mesarich C.H., de Wit P.J. // Front Plant Sci. 2015. V. 6. P. 584.
Pogány M., Dankó T., Kámán-Tóth E., Schwarczinger I., Bozsó Z. // Int. J. Mol. Sci. 2015. V. 16. P. 23177–23194.
Jashni M.K., Dols I.H., Iida Y., Boeren S., Beenen H.G., Mehrabi R., Collemare J., de Wit P.J. // Mol. Plant Microbe Interact. 2015. V. 28. P. 996–1008.
Olivieri F., Eugenia Zanetti M., Oliva C.R., Covarrubias A.A., Casalongué C.A. // Eur. J. Plant Pathol. 2002. V. 108. P. 63–72.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


