Биоорганическая химия, 2019, T. 45, № 4, стр. 339-347
Структура хромофоров в GFP-подобных белках. Рентгеноструктурные данные
Н. В. Плетнева 1, Е. А. Горячева 1, И. В. Артемьев 1, С. Ф. Архипова 1, В. З. Плетнев 1, *
1 ФГБУН Институт биоорганической химии им. М.М. Шемякина и Ю. А. Овчинникова РАН
117997 Москва, ГСП-7, ул. Миклухо-Маклая, 16/10, Россия
* E-mail: vzpletnev@gmail.com
Поступила в редакцию 09.11.2018
После доработки 03.12.2018
Принята к публикации 05.12.2018
Аннотация
Открытие флуоресцентных белков (ФБ) в 1962 г. и последующее создание на их основе генетически кодируемых биомаркеров и биосенсоров революционизировало исследования живых систем. Сегодня исследователи имеют доступ к ФБ широкой цветовой гаммы, обладающих большим разнообразием специализированных свойств для визуализации биологических процессов in vivo с применением методов спектроскопии высокого разрешения. ФБ, подобные зеленому флуоресцентному белку (GFP), нашли широкое применение в клеточной биологии в качестве маркеров различных биологических мишеней в живой клетке. По мере развития исследований в области визуализации процессов в живых организмах, перед разработчиками биомаркеров появились задачи по получению новых ярких и фотостабильных биомаркеров разного цветового диапазона с улучшенными фотофизическими характеристиками. Рентгеноструктурные исследования играют важную роль в создании новых биомаркеров, поскольку позволяют установить для них структурно-функциональные взаимосвязи, которые служат руководством для целенаправленного изменения свойств ФБ в соответствии с требованиями предъявляемыми к биомаркерам современными методами исследований. В обзоре рассмотрены основные структуры хромофоров GFP-подобных ФБ, установленные методом рентгеноструктурного анализа.
ВВЕДЕНИЕ
Зеленые флуоресцентные белки (GFP) из морских организмов и их синие, желтые, оранжевые, красные и дальнe-красные генно-инженерные варианты проявляют способность флуоресцировать при облучении видимым светом. Благодаря этому свойству GFP-подобные флуоресцентные белки (ФБ) широко используются в клеточной биологии, биотехнологии и биомедицине в качестве биомаркеров для визуализации процессов в живых организмах, мониторинга экспрессии генов, локализации и миграции интересующих белков и клеток, определения жизненно важных внутриклеточных характеристик таких как pH, концентрация ионов и др. [1]. Они позволяют наблюдать органеллы клетки и их функциональное поведение, могут использоваться для визуализации различных аспектов развития раковой опухоли в животных in vivo, включая перемещение раковых клеток, инвазию, метастазирование, ангиогенез, а также для обеспечения быстрого скрининга потенциальных лекарственных средств. В различных странах активно проводятся исследования по созданию и структурно-функциональному изучению новых перспективных ФБ различной цветовой гаммы для практического использования в качестве биомаркеров.
Разнообразие фотофизических свойств ФБ определяется главным образом структурой хромофора и его ближайшего аминокислотного окружения. Хромофоры, образующиеся в результате посттрансляционной модификации белка, способны флуоресцировать при возбуждении видимым светом определенной длины волны.
Структура мономера GFP-подобных ФБ имеет форму β-бочонка (рис. 1а), сформированного из 11 антипараллельных β-тяжей, связанных Н-связями. Петли между β-тяжами располагаются на торцах бочонка, образуя “колпачки”, защищающие его внутреннюю область от воздействия внешней среды. Вдоль оси бочонка проходит спираль, в середине которой располагается ковалентно связанный хромофор. Олигомерная структура ФБ дикого типа обычно представлена димерами или тетрамерами. Димеры состоят из мономеров, расположенных антипараллельно друг другу (рис. 1б). Тетрамеры формируются двумя димерами, расположенными перпендикулярно друг другу.
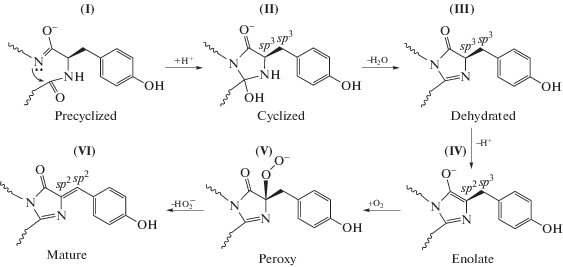
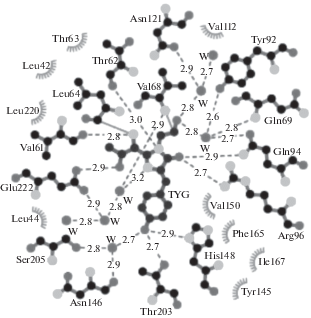
Хромофор формируется в результате автокаталитической посттрансляционной модификации трипептидного фрагмента белка -X-Tyr-Gly- без участия каких-либо кофакторов или субстратов, за исключением молекулярного кислорода. В белках дикого типа первый остаток хромофоробразующей триады вариабелен, а второй и третий – инвариантны. Один из общепринятых механизмов биосинтеза хромофора [2] нашел надежное подтверждение рентгеноструктурным методом с установлением структуры всех основных промежуточных состояний [3]. В соответствии с этим механизмом, синтез хромофора начинается с циклизации хромофоробразующей аминокислотной триады (-X-Tyr-Gly-), затем, в результате последующих реакций дегидратации и окисления, образуется “зрелый” хромофор (рис. 2). Гидроксильная группа остатка тирозина хромофора легко ионизируется, существенно повышая квантовый выход эмиссии и сдвигая максимум возбуждения в более длинноволновую область спектра. Хромофор связан с ближайшим аминокислотным окружением (рис. 3) через разветвленную сеть Н-связей. Мутации остатков в окружении хромофора, как правило, приводят к существенному изменению фотофизических свойств ФБ. Структура хромофора и стереохимические особенности его окружения определяют основные фотофизические свойства ФБ, включая скорость созревания, температурную и рН-зависимость, фотостабильность, спектральные характеристики. В качестве примера влияния окружения можно привести желтый флуоресцентный белок phiYFP (Phialidium; λэм 538 нм). Бициклическая структура его хромофора отвечает классической структуре, характерной для зеленых хромофоров. При этом, наблюдаемый батохромный сдвиг максимума эмиссии в желтую область спектра (λэм ~ 538 нм) вызван π-стэкинг-взаимодействием между антипараллельно расположенными ароматическими кольцами Tyr66 хромофора и Tyr203 из ближайшего окружения хромофора [5]. Реализация аналогичного взаимодействия в зеленом мутанте GFP_S65T путем замены Thr203Tyr привела к созданию желтого варианта с максимумом эмиссии 528 нм [6]. Предполагается, что π-стэкинг-взаимодействие увеличивает поляризуемость хромофора, стабилизируя его электронное состояние с предпочтительно бóльшим дипольным моментом, следствием чего является сдвиг флуоресценции в длинноволновую область спектра.
1. БИЦИКЛИЧЕСКИЕ ХРОМОФОРЫ
1.1. Природные Tyr-содержащие хромофоры
Остаток Tyr хромофор-образующей триады X-Tyr-Gly является строго консервативным во всех известных флуоресцентных белках дикого типа. Тирозин-содержащие бициклические хромофоры GFP-подобных ФБ представлены двумя основными типами: “зелеными” и “красными” хромофорами, характеризующимися длинами волн эмиссии (λэм) ~510 и ≥570 нм. Они характеризуются планарной структурой сопряженных двойных связей, состоящей из пятичленного имидазолинонового и фенольного (п-гидроксибензелиденового) циклов (рис. 4).
Рис. 4.
Зеленый (а) и красный (б) хромофоры X-Tyr-Gly (сопряженная система двойных связей выделена серым фоном).

У зеленых ФБ первому остатку хромофора с атомом Сα в sp3-гибридизации предшествует стандартная пептидная связь в транс-конфигурации, которая не лежит в плоскости хромофора (рис. 4а). Созревание хромофоров до “красной” формы в большинстве случаев проходит через промежуточную “зеленую”. В красных ФБ посттрансляционное образование бициклической системы хромофора включает дополнительную стадию окисления, в результате которой у первого остатка происходит образование двойной ацилиминной связи Cα=N с изменением гибридизации соответствующего Сα атома из sp3 в sp2 [7]. Предшествующая первому остатку пептидная связь принимает цис-конфигурацию и располагается в плоскости хромофора (рис. 4б). При этом происходит расширение сопряженной π-электронной системы хромофора, сопровождаемое сдвигом эмиссии в длинноволновую область спектра.
В подавляющем большинстве случаев боковая цепь остатка Tyr хромофора во флуоресцентных белках принимает цис-конформацию по отношению к связи Сα-N-имидазолинонового цикла и находится в анионной форме, отвечающей флуоресцентному состоянию [1]. Исключениями являются гомологичные красные ФБ дикого типа – eqFP578 и eqFP611 (Entacmae quadricolor) с хромофоробразующей триадой -Met-Tyr-Gly, у которых гидроксифенильная группа остатка Tyr хромофора находится в нетипичной транс-конформации, но, при этом, белки демонстрируют яркую флуоресценцию [8, 9]. Примечательно, что дизайн дальне-красного генно-инженерного варианта Katushka (λэм ~ 635 нм) из красного белка eqFP578 (λэм ~ 578 нм) сопровождался переходом остатка Tyr хромофора из высокоэнергетичной транс- в низкоэнергетичную цис-конформацию, с изменением системы локальных Н-связей вокруг хромофора и ~57-нм длинноволновым сдвигом эмиссии [9].
Помимо флуоресцентных белков существует группа природных GFP-подобных окрашенных хромобелков, которые не обладают флуоресценцией. В хромобелках остаток Tyr хромофора, как правило, находится в транс-протонированном состоянии, стабилизируемом H-связями с аминокислотными остатками из ближайшего окружения. При создании новых вариантов ФБ из хромобелков, появление флуоресценции сопровождается транс-цис-изомеризацией остатка тирозина хромофора. Путем точечных замен, из нефлуоресцентных хромобелков был получен ряд флуоресцентных белков с различными спектральными характеристиками. Внесение лишь одной замены в хромобелок asFP595 привело к появлению красной флуоресценции [10]. На основе хромобелка asCP из Anemonia sulcata был создан ряд разжигающихся флуоресцентных белков KFP (kindling fluorescent protein) [11]. В качестве одного из наиболее ярких примеров можно привести красный флуоресцентный фототоксичный фотосенсибилизатор KillerRed, полученный путем 18 аминокислотных замен из нефлуоресцентного нефототоксичного хромобелка anm2cp [12, 13].
Особо следует выделить красный белок laRFP из группы хордовых (подгруппа ланцетников Branchiostoma lanceolatum) с бициклическим хромофором на основе необычной хромофоробразующей триады -Gly-Tyr-Gly-. Здесь, в результате пост-трансляционной модификации белка Сβ-атом остатка Tyr хромофора образует ковалентную связь с соседним Tyr из ближайшего аминокислотного окружения (рис. 5) [14]. При этом, разрушение этой связи путем аминокислотных замен всегда приводит к зеленой форме хромофора. Наконец, единственным на сегодняшний день примером ФБ, где хромофоробразующая триада представлена последовательностью Gly-Tyr-Ala, является зеленый белок LanFP10-A (λэм ~ 504 нм) из подгруппы ланцетников (Branchiostoma floridae) [15]. Здесь третьим остатком хромофора вместо остатка Gly, ранее считавшегося строго консервативным, является Ala. Его замена на любой другой остаток приводила к исчезновению флуоресценции. Во флуоресцентной форме LanFP10-A посттрансляционная модификация хромофоробразующей триады завершилась формированием функциональной бициклической структуры хромофора, характерной для зеленых ФБ.
Рис. 5.
Структура хромофора Gly-Tyr-Gly красного флуоресцентного белка laRFP (показан черным цветом) с ближайшими остатками (показаны серым цветом) [14].

1.2. Генно-инженерные Phe/His/Trp-содержащие хромофоры
Поиск биомаркеров с новыми спектральными свойствами привел к созданию мутантных вариантов с заменами второго консервативного остатка хромофора – Tyr на другие ароматические остатки – Phe, His или Trp. Такие замены, как правило, сопровождаются сдвигами максимумов возбуждения и эмиссии в более коротковолновую область спектра. Так, на основе ключевой мутации Tyr66His в хромофоре зеленого GFP (Aequorea victoria; λem ~ 509 нм) был получен синий вариант BFP (λem ~ 448 нм) [16]. Единичная замена консервативного Tyr на Phe в хромофоре дальне-красного ФБ Rtms5 (λem ~ 630 нм) привела к зеленому варианту (λem ~ 508 нм) [17]. И наконец, введение остатка Trp привело к появлению таких белков, как ECFP и Cerulean, характеризующихся сдвигом эмиссии из зеленой (λem ~ 509 нм) в циановую область спектра (λem ~ 474 нм) [18, 19].
Бициклические хромофоры, содержащие остатки Phe и His вместо Tyr, характеризуются конформацией, аналогичной стандартным зеленым Tyr-содержащим хромофорам (рис. 6). В первом случае ориентация фенольного кольца в хромофоре инвариантна. В случае His-содержащего хромофора имидазольный цикл гистидина принимает по отношению к Cα-атому цис-ориентацию, описываемую углом Cα-Cβ-Сγ-Nδ1. Другие мутации остатка Tyr хромофора приводят к полной потере флуоресценции без значительных изменений положения пиков поглощения.
В структурах Trp-содержащих хромофоров обнаружены три возможные стерически разрешенные конформационные состояния триптофана, описываемые торсионными углами χ1 и χ2 вокруг соответствующих валентных связей Сα–Сβ и Сβ–Сγ – цис-цис (идеальные значения χ1 и χ2 ~ 0°), цис-транс (χ1 ~ 0° и χ2 ~ 180°) и транс-цис (χ1 ~ 180° и χ2 ~ 0°) (рис. 7). Конформация транс-транс (χ1 ~ 180° и χ2 ~ 180°) стерически запрещена. Рентгеноструктурные исследования цианового ФБ Cerulean и зеленого NowGFP при изменении pH позволили выявить цис-цис- и цис-транс-состояния Trp66 хромофора [18–20]. В структуре NowGFP изменение кислотности среды сопровождается синхронными изменениями конформационных состояний боковых цепей остатков из ближайшего окружения хромофора. При этом, сопутствующее изменение взаимодействующей с хромофором локальной сети водородных связей приводит к значительным изменениям спектральных свойств белка, связанных с обратимыми процессами ионизации-протонирования остатка триптофана хромофора. Третья возможная транс-цис-конформация остатка Trp хромофора была впервые обнаружена совсем недавно, при изучении пространственной структуры фототоксичного флуоресцентного белка KillerOrange [21]. В структуре белка эта конформация стабилизируется водородной связью между атомом азота индольного кольца остатка Trp хромофора и боковой цепью ближайшего остатка Gln159.
2. ТРИЦИКЛИЧЕСКИЕ ХРОМОФОРЫ
В трициклических хромофорах в процессе посттрансляционной модификации происходит образование третьего дополнительного гетероцикла с двойной связью, который, располагаясь в плоскости хромофора, расширяет его сопряженную π‑электронную систему, приводя к сдвигу максимума эмиссии в длинноволновую область спектра. В качестве примеров можно привести структуры трициклических хромофоров, реализующихся в желтом ФБ дикого типа zYFP538 (Zoanthus), оранжевом генно-инженерном варианте mOrange и в красной форме необратимо фотоконвертируемых флуоресцентных белков Kaede-группы. Механизмы биосинтеза этих хромофоров рассмотрены в работах [22–27].
Хромофор желтого флуоресцентного белка zYFP538 образуется из аминокислотной триады ‑Lys66-Tyr67-Gly68- и представляет собой планарную трициклическую систему сопряженных двойных связей (рис. 8а) [22, 28]. Уникальность структуры состоит в том, что помимо пятичленного имидазолинонового и фенольного (Tyr67) циклов, характерных для стандартной бициклической “зеленой” формы, хромофор zYFP538 содержит дополнительный шестичленный тетрагидропиридиновый цикл, который, согласно предложенной гипотезе [22], формируется автокаталитически в результате реакции трансиминирования атома Nζ боковой цепи остатка Lys66 с реакционноспособной ацилиминной связью Cα=N(66) переходного состояния. Реакция сопровождается разрывом основной цепи белка по связи Cα−N остатка Lys66 с образованием концевой карбоксамидной группы у предшествующего остатка Phe65. Образующаяся связь Cα=Nζ располагается в плоскости хромофора, что приводит к расширению его π-системы сопряженных двойных связей и, как следствие, к сдвигу спектральных характеристик в длинноволновую область.
Рис. 8.
Структура трициклических хромофоров -Lys-Tyr-Gly в желтом ФБ zYFP538 (в результате разрыва основной цепи белка по связи Cα−N остатка Lys хромофора образуется концевая карбоксамидная группа C(O)NH2 у предшествующего остатка Phe [22, 28]) (а) и Thr-Tyr-Gly в оранжевом ФБ mOrange (б) [23]. Сопряженная система двойных связей хромофоров выделена серым фоном.

Хромофор оранжевого генно-инженерного варианта mOrange (λem ~ 562 нм) образован из аминокислотной триады Thr-Tyr-Gly [23]. Его планарная трициклическая структура сопряженных двойных связей содержит дополнительный пятичленный 2-гидроксидигидрооксазоловый цикл, образованный в результате дополнительной реакции ОН-группы боковой цепи первого хромофоробразующего остатка Thr c основной полипептидной цепью (рис. 8б).
Фотопереключаемый флуоресцентный белок wtDendFP (Dendronephthya sp.) из Kaede-группы [24–26] характеризуется хромофоробразующей последовательностью His62-Tyr63-Gly64. При облучении УФ-светом (~380 нм) он демонстрирует необратимое превращение из зеленой формы (λem ~ 506 нм) в красную (λem ~ 575 нм). Фотоконверсия сопровождается разрывом основной цепи по связи Cα–N первого остатка хромофора с образованием концевой карбоксамидной группы у предшествующего остатка Leu61 (рис. 9) [29]. Образующаяся в процессе окисления двойная связь Cα=Cβ боковой цепи первого остатка His62 хромофоробразующей триады способствует включению его имидазольного цикла в плоскость хромофора, приводя к расширению общей π-электронной системы сопряженных двойных связей.
Рис. 9.
Структура хромофора His62-Tyr63-Gly64 флуоресцентного белка DendFP в зеленой и красной формах (сопряженная система двойных связей выделена серым фоном) [29].

ЗАКЛЮЧЕНИЕ
В последние годы усилия исследователей сосредоточены на созданиии флуоресцентных биомаркеров с новыми улучшенными фотофизическими характеристиками. В настоящее время широко используемые подходы при создании новых биомаркеров основаны на аминокислотных заменах вокруг хромофора методом направленной эволюции или/и структурно обоснованном мутагенезе с использованием данных рентгеноструктурного анализа. Значительно реже для этих целей практикуется дополнительная модификация самого хромофора по отдельным позициям хромофоробразующей триады. Причем, варьирование третьей позиции с заменой консервативного остатка Gly почти не изучено и может привести к неожиданным новым эффектам.
ФОНДОВАЯ ПОДДЕРЖКА
Исследование выполнено при финансовой поддержке фонда МКБ РАН (№ 01201456603).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Настоящая статья не содержит каких-либо исследований с участием людей в качестве объектов исследований и с использованием животных в качестве объектов.
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Chudakov D.M., Matz M.V., Lukyanov S., Lukyanov K.A. // Physiol. Rev. 2010. V. 90. P. 1103–1163.
Barondeau D.P., Tainer J.A., Getzoff E.D. // J. Am. Chem. Soc. 2006. V. 128. P. 3166–3168.
Pletneva N.V., Pletnev V.Z., Lukyanov K.A., Gurskaya N.G., Goryacheva E.A., Martynov V.I., Wlodawer A., Dauter Z., Pletnev S. // J. Biol. Chem. 2010. V. 285. P. 15978–15984.
Плетнева Н.В., Плетнев С.В., Богданов А.М., Горячева Е.А., Артемьев И.В, Суслова Е.А., Архипова С.Ф., Плетнев В.З. // Биоорган. химия. 2014. Т. 40. С. 414–420. [Pletneva N.V., Pletnev S.V., Bogdanov A.M., Goryacheva E.A., Artemyev I.V., Suslova E.A., Arkhipova S.F., Pletnev V.Z. // Russ. J. Bioorgan. Chem. 2014. V. 40. P. 383–389.]
Pletneva N.V., Pletnev V.Z., Souslova E., Chudakov D.M., Lukyanov S., Martynov V.I., Arhipova S., Artemyev I., Wlodawer A., Dauter Z., Pletnev S. // Acta Crystallogr. D Struct. Biol. 2013. V. 69. P. 1005–1012.
Wachter R.M., Elsliger M.A., Kallio K., Hanson G.T., Remington S.J. // Structure. 1998. V. 6. P. 1267–1277.
Tubbs J.L., Tainer J.A., Getzoff E.D. // Biochemistry. 2005. V. 44. P. 9833–9840.
Petersen J., Wilmann P.G., Beddoe T., Oakley A.J., Devenish R.J., Prescott M., Rossjohn J. // J. Biol. Chem. 2003. V. 278. P. 44626–44631.
Pletneva N.V., Pletnev V.Z., Shemiakina I.I., Chudakov D.M., Artemyev I., Wlodawer A., Dauter Z., Pletnev S. // Protein Sci. 2011. V. 20. P. 1265–1274.
Andresen M., Wahl M.C., Stiel A.C., Grater F., Schafer L.V., Trowitzsch S., Weber G., Eggeling C., Grubmuller H., Hell S.W., Jakobs S. // Proc. Natl. Acad. Sci. U.S.A. 2005. V. 102. P. 13070–13074.
Chudakov D.M., Feofanov A.V., Mudrik N.N., Lukyanov S., Lukyanov K.A. // J. Biol. Chem. 2003. V. 278. P. 7215–7219.
Bulina M.E., Chudakov D.M., Britanova O.V., Yanushevich Y.G., Staroverov D.B., Chepurnykh T.V., Merzlyak E.M., Shkrob M.A., Lukyanov S., Lukyanov K.A. // Nat. Biotechnol. 2006. V. 24. P. 95–99.
Pletnev S., Gurskaya N.G., Pletneva N.V., Lukyanov K.A., Chudakov D.M., Martynov V.I., Popov V.O., Kovalchuk M.V., Wlodawer A., Dauter Z., Pletnev V. // J. Biol. Chem. 2009. V. 284. P. 32028–32039.
Pletnev V.Z., Pletneva N.V., Lukyanov K.A., Souslova E.A., Fradkov A.F., Chudakov D.M., Chepurnykh T., Yampolsky I.V., Wlodawer A., Dauter Z., Pletnev S. // Acta Crystallogr. D Struct. Biol. 2013. V. 69. P. 1850–1860.
Roldan-Salgado A., Sanchez-Barreto C., Gaytan P. // Gene. 2016. V. 592. P. 281–290.
Wachter R.M., King B.A., Heim R., Kallio K., Tsien R.Y., Boxer S.G., Remington S.J. // Biochemistry. 1997. V. 36. P. 9759–9765.
Battad J.M., Traore D.A., Byres E., Rossjohn J., Devenish R.J., Olsen S., Wilce M.C., Prescott M. // PLoS One. 2012. V. 7. P. e47331.
Malo G.D., Pouwels L.J., Wang M., Weichsel A., Montfort W.R., Rizzo M.A., Piston D.W., Wachter R.M. // Biochemistry. 2007. V. 46. P. 9865–9873.
Lelimousin M., Noirclerc-Savoye M., Lazareno-Saez C., Paetzold B., Le V.S., Chazal R., Macheboeuf P., Field M.J., Bourgeois D., Royant A. // Biochemistry. 2009. V. 48. P. 10038–10046.
Pletnev V.Z., Pletneva N.V., Sarkisyan K.S., Mishin A.S., Lukyanov K.A., Goryacheva E.A., Ziganshin R.H., Dauter Z., Pletnev S. // Acta Crystallogr. D Struct. Biol. 2015. V. 71. P. 1699–1707.
Pletneva N.V., Pletnev V.Z., Sarkisyan K.S., Gorbachev D.A., Egorov E.S., Mishin A.S., Lukyanov K.A., Dauter Z., Pletnev S. // PLoS One. 2015. V. 10. P. e0145740.
Remington S.J., Wachter R.M., Yarbrough D.K., Branchaud B., Anderson D.C., Kallio K., Lukyanov K.A. // Biochemistry. 2005. V. 44. P. 202–212.
Shu X., Shaner N.C., Yarbrough C.A., Tsien R.Y., Remington S.J. // Biochemistry. 2006. V. 45. P. 9639–9647.
Nienhaus K., Nienhaus G.U., Wiedenmann J., Nar H. // Proc. Natl. Acad. Sci. U.S.A. 2005. V. 102. P. 9156–9159.
Hayashi I., Mizuno H., Tong K.I., Furuta T., Tanaka F., Yoshimura M., Miyawaki A., Ikura M. // J. Mol. Biol. 2007. V. 372. P. 918–926.
Tsutsui H., Shimizu H., Mizuno H., Nukina N., Furuta T., Miyawaki A. // Chem. Biol. 2009. V. 16. P. 1140–1147.
Pakhomov A.A., Martynov V.I. // Chem Biol. 2008. V. 15. P. 755–764.
Pletneva N.V., Pletnev S.V., Chudakov D.M., Tikhonova T.V., Popov V.O., Martynov V.I., Wlodawer A., Dauter Z., Pletnev V.Z. // Russ. J. Bioorgan. Chem. 2007. V. 33. P. 390–398.
Pletneva N.V., Pletnev S., Pakhomov A.A., Chertkova R.V., Martynov V.I., Muslinkina L., Dauter Z., Pletnev V.Z. // Acta Crystallogr. D Struct. Biol. 2016. V. 72. P. 922–932.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия