Биоорганическая химия, 2019, T. 45, № 4, стр. 441-445
Флуоресцентное маркирование олигонуклеотидных зондов для двухиндикаторного гибридизационного анализа на биочипе
В. Е. Шершов 1, Р. А. Мифтахов 1, В. Е. Кузнецова 1, Э. Н. Тимофеев 1, И. В. Гречишникова 1, М. А. Спицын 1, Т. О. Гусейнов 1, С. А. Лапа 1, А. С. Заседателев 1, А. В. Чудинов 1, *
1 ФГБУН Институт молекулярной биологии им. В.А. Энгельгардта РАН
119991 Москва, ул. Вавилова, 32, Россия
* E-mail: chud@eimb.ru
Поступила в редакцию 12.12.2018
После доработки 13.12.2018
Принята к публикации 15.12.2018
Аннотация
Осуществлен синтез молекулярной конструкции на основе полисульфированного индокарбоцианинового красителя и лизина для флуоресцентного маркирования олигонуклеотидных зондов, предназначенных для иммобилизации на подложку олигонуклеотидных биочипов.
Двухиндикаторный метод гибридизационного анализа НК служит способом, повышающим надежность молекулярно-генетических исследований. В этом методе анализируемая проба содержит маркер, флуоресцирующий в ближней ИК-области спектра, а олигонуклеотидный зонд, находящийся в ячейке, маркирован оптически-независимым красителем с максимумом флуоресценции на длине волны ~550 нм. Флуоресцентное маркирование олигонуклеотидных зондов позволит вычислять их концентрацию в ячейке биочипа и проводить корректировку сигналов в ячейках, в которых образовались совершенные и несовершенные дуплексы [1].
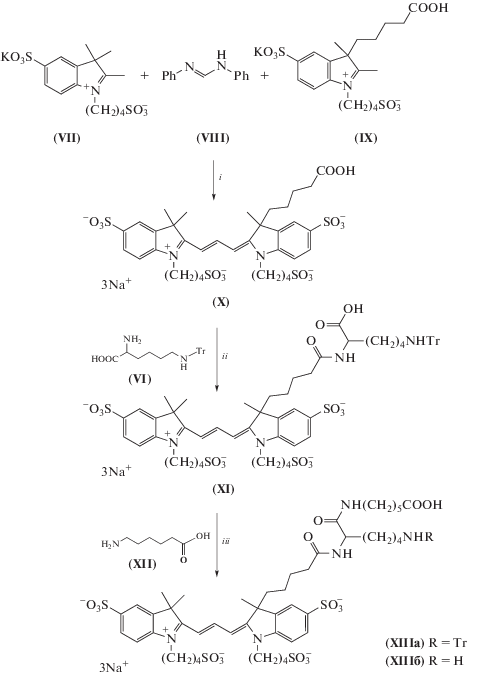
Нами предложена молекулярная конструкция (XIII) на основе индокарбоцианинового красителя (Cy3) и аминокислоты лизин, которая содержит активированную карбоксильную группу и защищенную алифатическую аминогруппу. Карбоксильная группа предложенной конструкции предназначена для связывания с олигонуклеотидным зондом, содержащим аминолинкер, а аминогруппа служит для иммобилизации флуоресцентно-меченного олигонуклеотидного зонда на полимерную подложку или в полисахаридную ячейку биочипа (рис. 1). Выбор полисульфированного индокарбоцианинового красителя (X) с реакционно-способной карбоксильной группой в положении 3 индоленинового фрагмента обусловлен его повышенной водорастворимостью, фотостабильностью и хемостойкостью, а также спектрально-люминесцентными характеристиками и требуемым оптическим диапазоном флуоресценции в области 550 нм. Кроме того, введение карбоксильного заместителя в положение 3 индоленинового фрагмента позволило синтезировать водорастворимый краситель с четырьмя симметрично-расположенными сульфогруппами, что привело к значительному увеличению квантового выхода флуоресценции по сравнению с коммерчески-доступным Су3, содержащим две сульфогруппы [2] (табл. 1).
Схема 1 . Схема синтеза N ε-тритиллизина. Условия: i – MeOH, AcCl, 20°C, 18 ч; ii – TrCl, Et3N, CHCl3, 20°C, 3 ч; iii – 5 М HCl, (CH3)2CO, tкип, 1 ч; iv – 1 М NaOH, tкип, 5 мин.
Нами осуществлен многостадийный синтез Nε-тритиллизина (VI) из лизин гидрохлорида (II) (схема 1 ). Использование тритильной группы в качестве защитной группировки для ε-аминогруппы лизина предполагает проведение предварительной этерификации карбоксильной группы путем ее превращения в сложный эфир (III). Именно использование метилового эфира лизина помогает провести реакцию тритилирования по обеим аминогруппам молекулы, затем снять эту защиту с карбоксильной группы, не затронув остальные защитные группы. Метиловый эфир лизина (III) синтезировали с количественным выходом действием смеси метилового спирта и ацетилхлорида нагреванием при 40°C в течение 4 ч [3]. Дитритилирование гидрохлорида (III) проводили по стандартной методике действием хлороформного раствора тритилхлорида в присутствии триэтиламина [4, 5]. Селективное детритилирование α-аминогруппы лизина (IV) проводили действием 5 М соляной кислоты в ацетоне [5]. Последующий щелочной гидролиз метилового эфира (V) проводили действием 1 М водного раствора гидроксида натрия [5].
Нами предложен и осуществлен синтез полисульфированного индокарбоцианинового красителя (X), основанный на двухстадийной конденсации солей индолениния (VII), (IX) и N,N '-дифенилформамидина (VIII) в смеси уксусный ангидрид–уксусная кислота при добавлении в качестве конденсирующего агента безводного ацетата калия (схема 2 ) [6–8]. Молекулярную конструкцию (XI) получали реакцией конденсации красителя (X) и Nε-тритиллизина (VI) с предварительной активацией карбоксильной группы красителя действием DSC в DMF. Использование конъюгата (XI) в виде его активированного эфира для флуоресцентного маркирования олигонуклеотидов не увенчалось успехом, скорее всего из-за возможного экранирования реакционного центра молекулы соседними с ним группами атомов. Для снижения пространственных затруднений в молекуле карбоксильную группу конъюгата (XI) дополнительно амидировали 6-аминокапроновой кислотой (XII).
Схема 2 . Схема синтеза молекулярной конструкции на основе полисульфированного индокарбоцианинового красителя и Nε-тритиллизина. Условия: i – Ac2O, AcOH, 118°C, 2 ч (1 стадия), Ac2O, AcOH, AcOK, 118°C, 4 ч (2 стадия); ii – DSC, DMF, 20°C, 4 ч; iii – DSC, DMF, 20°C, 4 ч.
Для всех индокарбоцианиновых красителей (X), (XI), (XIII) найден молярный коэффициент поглощения (ε) и относительный квантовый выход флуоресценции (Φ) в метаноле и водном фосфатно-солевом буферном растворе (PBS) (10 мМ калий фосфатный буфер, 0.9% NaCl, рН 7.4) (табл. 1).
Таблица 1.
Спектральные характеристики индокарбоцианиновых красителей
| Соединение | Растворитель | $\lambda _{{{\text{м а к с }}}}^{{{\text{abs}}}}$ | $\lambda _{{{\text{м а к с }}}}^{{{\text{em}}}}$ | Стоксов сдвиг | ε × 10–5, л моль–1 см–1 | Ф*, % |
|---|---|---|---|---|---|---|
| нм | ||||||
| (X) | PBS | 552 | 566 | 14 | 1.55 ± 0.03 | 28 |
| MeOH | 554 | 569 | 15 | 1.6 ± 0.02 | 39 | |
| (XI) | PBS | 553 | 567 | 14 | 1.38 ± 0.03 | 59 |
| MeOH | 558 | 572 | 14 | 1.5 ± 0.03 | 54 | |
| (XIIIа) | PBS | 554 | 568 | 14 | 1.31 ± 0.03 | 56 |
| MeOH | 558 | 572 | 14 | 1.43 ± 0.02 | 52 | |
| (XIIIб) | PBS | 552 | 567 | 15 | 1.49 ± 0.03 | 32 |
| MeOH | 558 | 573 | 15 | 1.52 ± 0.02 | 37 | |
* Квантовый выход измеряли относительно красителя Cy3 (GE Healthcare), Ф = 0.15 в PBS при 25°C [2].
Конъюгат краситель – лизин (XIII) переводили в активную форму в виде пара-нитрофенилового эфира и конденсировали в водно-органической среде с олигонуклеотидными зондами, содержащими аминолинкер с С6-спейсером (рис. 1). Детритилирование ε-аминогруппы лизинового фрагмента красителя проводили нагреванием при 90°C в течение 45 мин натрий-цитратного буферного раствора (15 мM, pH 5.5) флуоресцентно-меченного олигонуклеотида. Строение промежуточных и целевых соединений подтверждено данными УФ-, 1Н-ЯМР-спектроскопии и MALDI-TOF-масс-спектрометрии. Полученные таким образом модифицированные олигонуклеотидные зонды (I) будут использованы для проведения нормировки гибридизационных сигналов на биочипах [9].
ФОНДОВАЯ ПОДДЕРЖКА
Работа выполнена при финансовой поддержке гранта РФФИ 17-04-02062 А и стипендии Президента Российской Федерации для молодых ученых и аспирантов, осуществляющих перспективные научные исследования и разработки по приоритетным направлениям модернизации российской экономики на 2018–2020 гг. (регистрационный номер СП-274.2018.4).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Настоящая статья не содержит каких-либо исследований с участием людей в качестве объектов исследований и с использованием животных в качестве объектов.
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Pan’kov S.V., Chechetkin V.R., Somova O.G., Antonova O.V., Moiseeva O.V., Prokopenko D.V., Yurasov R.A., Gryadunov D.A., Chudinov A.V. // J. Biomol. Struct. Dyn. 2009. V. 27. P. 235–244.
Hughes L.D., Rawle R.J., Boxer S.G. // PLoS One. 2014. V. 9. e87649.
Hunt D.F., Yates J.R., Shabanowitz J., Winston S., Hauer Ch.R. // Proc. Natl. Acad. Sci. USA. 1986. V. 83. P. 6233–6237.
Bezas B., Zervas L. // J. Am. Chem. Soc. 1961. V. 83. P. 719–722.
French Body Corporate “Roussel Uclaf”. Lysine derivatives. Patent GB867788, 1958.
Кузнецова В.Е., Чудинов А.В. // Изв. АН, Cер. хим. 2008. № 3. С. 595–598.
Кузнецова В.Е., Лукьянова Т.А., Василисков В.А., Харитонова О.В., Чудинов А.В., Заседателев А.С. // Изв. АН, Cер. хим. 2007. № 12. С. 2355–2359.
Kuznetsova V.E., Vasiliskov V.A., Zasedatelev A.S., Chudinov A.V. // Mend. Communs. 2008. V. 18. № 3. P. 138–140.
Мифтаxов P.А., Лапа C.А., Шеpшов В.Е., Заcедателева О.А., Гуcейнов Т.О., Cпицын М.А., Кузнецова В.Е., Мамаев Д.Д., Лыcов Ю.П., Баpcкий В.Е., Тимофеев Э.Н., Заcедателев А.C., Чудинов А.В. // Биофизика. 2018. Т. 63. С. 661–668.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия