Биоорганическая химия, 2019, T. 45, № 4, стр. 392-402
Эффективность амплификации и субстратные свойства флуоресцентно-меченных трифосфатов дезоксиуридина в ПЦР с ДНК-полимеразами, не обладающими 3'-5'-экзонуклеазной активностью
С. А. Лапа 1, *, О. С. Волкова 1, М. А. Спицын 1, В. Е. Шершов 1, В. Е. Кузнецова 1, Т. О. Гусейнов 1, А. С. Заседателев 1, А. В. Чудинов 1
1 ФГБУН “Институт молекулярной биологии им. В. А. Энгельгардта РАН”
119991 Москва, ул. Вавилова, 32, Россия
* E-mail: lapa@biochip.ru
Поступила в редакцию 19.11.2018
После доработки 10.12.2018
Принята к публикации 29.01.2019
Аннотация
Исследована кинетика амплификации продукта в ПЦР при использовании в качестве субстрата флуоресцентно-меченных цвиттер-ионных трифосфатов дезоксиуридина с различной структурой флуорофора и различной длиной линкера, связывающего флуорофор с азотистым основанием; изучена зависимость выхода ПЦР-продукта от концентрации модифицированного субстрата в реакционной смеси; проведен гибридизационный анализ полученных продуктов амплификации. Для амплификации использованы ДНК-полимеразы Taq и Vent (exo-), не обладающие 3'-5'-экзонуклеазной активностью. Выявлено, что гидрофобность и пространственные размеры флуорофора являются важными факторами, влияющими на ингибирование ДНК-полимераз в ПЦР, в то время как длина линкера между флуорофором и азотистым основанием оказывает существенное влияние на субстратные свойства, т.е. эффективность встраивания меченых нуклеотидов дезоксиуридина в растущую цепь ДНК. Наиболее эффективными для применения в ПЦР с последующим флуоресцентным гибридизационным анализом на биочипах оказались электронейтральные производные трифосфата дезоксиуридина со средней длиной линкера. Исследованные соединения пригодны для введения метки в ПЦР-продукты с помощью Taq- и Vent (exo-)-ДНК-полимераз для гибридизационного анализа ДНК.
ВВЕДЕНИЕ
Флуоресцентное мечение ДНК широко используется в молекулярно-биологических исследованиях и медицинской диагностике. Возможность введения метки непосредственно в процессе ферментативной реакции амплификации (ПЦР, реакция удлинения праймера и др.) значительно упрощает процедуру получения образцов для проведения анализа. Для этого применяются флуоресцентно-меченные производные трифосфатов дезоксинуклеозидов (fluor-dNTP), в которых флуорофор введен по азотистому основанию [1, 2]. Важную роль при ферментативном получении флуоресцентно-меченных ДНК играет не только выбор физико-химических характеристик используемых флуорофоров (хемостойкость и фотостабильность, молярный коэффициент поглощения и квантовые выходы флуоресценции), но и способность соответствующих fluor-dNTP выступать в качестве субстратов для ДНК-полимераз [3, 4].
Одним из наиболее распространенных нуклеотидов для введения модификаций, в том числе флуоресцентных меток, является 2'-дезоксиуридин [5]. В качестве полимераз для ферментативного синтеза меченых ДНК часто используются коммерчески доступные термостабильные полимеразы Taq (семейство A) и Vent (exo-) (семейство B) (КФ 2.7.7.7), способные воспринимать в качестве субстрата производные 5'-трифосфатов 2'-дезоксиуридина [6, 7].
В ряду меток для флуоресцентного маркирования ДНК выделяются пентаметиновые индоцианиновые (индодикарбоцианиновые) красители ряда Сy5, которые обладают яркой флуоресценцией в ближнем ИК-диапазоне, достаточно химически стабильны и светостойки [8, 9]. Индоцианиновые красители широко используются во многих молекулярно-биологических приложениях [10, 11]. Широкое применение флуоресцентно-меченных трифосфатов нуклеозидов в составе молекулярно-биологических систем диагностики делает крайне важным изучение их совместимости с полимеразами и эффективности в гибридизационном анализе.
Ранее нами обнаружена зависимость эффективности встраивания трех производных 5'-трифосфатов 2'-дезоксиуридина, флуоресцентно-меченных индодикарбоцианиновыми красителями, от суммарного электрического заряда маркера в ходе ПЦР короткого олигонуклеотида. Показано, что эффективность уменьшается в ряду: нейтрально заряженный, положительно заряженный и отрицательно заряженный красители [12, 13]. Несколько позже для оценки эффективности флуоресцентно-меченных трифосфатов мы использовали мультиплексную ПЦР с последующим гибридизационным анализом нуклеиновых кислот [14]. Возможность применения различных производных ряда индодикарбоцианиновых красителей для использования в гибридизационном анализе генетических мишеней ДНК человека исследована нами в работе [15], кинетика образования меченых ПЦР-продуктов для анализа человеческого генома в ПЦР в реальном времени с TaqMan-зондом определена в работе [16] для четырех коммерчески доступных Taq-полимераз.
В настоящей работе проведено комплексное изучение субстратной эффективности цвиттер-ионных fluor-dUTP в реакциях амплификации ДНК-полимеразами, не обладающими корректирующей экзонуклеазной активностью, включающее: а) исследование кинетики амплификации с определением эффективности ПЦР (Е), б) определение выхода продуктов реакции для каждого модифицированного производного, в) тестирование на биологических микрочипах для определения чувствительности и специфичности гибридизационного анализа. По совокупности полученных нами ранее данных [13, 14] в качестве флуорофоров выбраны два индодикарбоцианиновых красителя с нейтральным распределенным зарядом (цвиттер-ионы), каждый из которых связывался по С5-положению пиримидинового цикла с помощью линкеров различной длины. В качестве бактериальной генетической мишени для изучения субстратной эффективности fluor-dUTP выбран фрагмент гена rpoB возбудителя туберкулеза человека Mycobacterium tuberculosis длиной около 200 п.о.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Флуоресцентно-меченные дезоксиуридинтрифосфаты (рис. 1), содержащие в своей структуре цвиттер-ионные индодикарбоцианиновые красители, различающиеся спектрально-люминесцентными характеристиками, гидрофильностью и пространственной структурой флуорофора, объединены в две группы по количеству сульфогрупп на флуорофоре. Производные fluor-dUTP, содержащие краситель с четвертичной N-алкиламмониевой группой (обозначены, как соединения группы (II)) и N-сульфоалкильным заместителем (обозначены как соединения группы (III)), дополнительно упорядочены в два ряда в зависимости от длины линкера, отдаляющего флуорофор от пиримидинового основания. Два образованных ряда включали в себя шесть fluor-dUTP с двумя типами флуорофоров (II) и (III), связанных линкерами различной длины (а, б, в).
Для изучения кинетики амплификации в присутствии модифицированных субстратов fluor-dUTP (II) или (III) проводили ПЦР в режиме реального времени с использованием Taq-ДНК-полимеразы (семейство А) и Vent (exo-)-ДНК-полимеразы (семейство B). В качестве контрольного образца сравнения использовали fluor-уридинтрифосфат (I), характеристики которого подробно представлены в работе [13]. Контрольный образец (I) содержит в своей структуре электронейтральный флуорофор с сульфогруппой в положении 5 индоленинового фрагмента; выбор электронейтрального контрольного образца продиктован удобством сравнения с электронейтральными исследуемыми образцами. Для выбора оптимальной концентрации fluor-dUTP проводили амплификацию (рис. 1), варьируя концентрацию от 0 до 48 мкМ. Рассчитывали эффективность амплификации (E) по углу наклона прямого участка S-образной кривой накопления сигнала [17, 18].
Степень ингибирования fluor-dUTP определяли на основании результатов ПЦР в режиме реального времени с использованием различных концентраций модифицированных нуклеозидтрифосфатов (II) и (III). Кривые накопления сигналов на примере соединения (IIIв) приведены на рис. 2. При концентрациях fluor-dUTP менее 4 мкМ ингибирующий эффект проявлялся как незначительный для всех исследованных образцов. При этом значения сигналов флуоресценции в последующем гибридизационном анализе полученных ПЦР-продуктов были выше фоновых сигналов в 2–4 раза, что недостаточно для проведения рутинного клинического анализа. При концентрациях fluor-dUTP, превышающих 16 мкМ, в случае Taq-полимеразы значительно возрастал ингибирующий эффект; при концентрации 48 мкМ наблюдалось полное ингибирование полимеразы. Vent (exo-)-ДНК-полимераза показала способность к эффективной амплификации в присутствии больших концентраций модифицированного субстрата (оптимум достигал 32 мкМ). Для корректного сравнения кинетики ПЦР для соединений двух исследуемых рядов fluor-dUTP в качестве рабочей концентрации выбрали 8 мкМ. Концентрация лимитировалась эффективностью амплификации с Taq-полимеразой. Проводили ПЦР в режиме реального времени при частичном замещении dTTP на каждый из fluor-dUTP (при их концентрации 8 мкМ) в трех повторах для каждого производного dUTP (II) и (III) (рис. 2). В каждом случае общая концентрация (dTTP + + mod-dUTP) составляла 200 мкМ. В качестве контрольного субстрата использовали немодифицированный (природный) dTTP в концентрации 200 мкМ.
Рис. 2.
ПЦР с Taq-полимеразой (а) и Vent (exo-)-полимеразой (б) в режиме реального времени и расчетные значения эффективности амплификации (Е) при концентрации fluor-dUTP, равной 8 мкМ.

Расчет эффективности амплификации E проводили по углу наклона прямого участка S-образной кривой накопления сигнала [17, 18]. Авторы работы [17] для определения эффективности ПЦР в режиме реального времени использовали два альтернативных метода: по последовательным разбавлениям образца с определением значения порогового цикла и по углу наклона прямого участка графика накопления, изображенного в логарифмическом масштабе. Данные, полученные методом последовательных разбавлений, который отличается большими требованиями к подготовке образцов и требует отдельных расчетов для каждого используемого разведения образца, хорошо коррелировали с данными метода расчета по углу наклона прямого участка S-образной кривой. Мы выбрали второй из протестированных методов, поскольку основным его преимуществом является непосредственное вычисление эффективности амплификации из отрезка прямой линии регрессии.
Выявлено влияние химической природы флуорофора в структуре fluor-dUTP на степень ингибирования ДНК-полимераз в ПЦР. В выбранных условиях оценки эффективности амплификации зависимость от длины линкера оказалась несущественной, в отличие от гибридизационного анализа (см. ниже), где этот фактор играл решающую роль для исследованных fluor-dUTP с электронейтральными индодикарбоцианиновыми красителями. Гораздо больший эффект в ПЦР определяла гидрофобность флуорофора. Так, ряд (IIa–в) показал воспроизводимо более высокую эффективность амплификации и более высокий выход целевого продукта по сравнению с рядом (IIIa–в) (табл. 1).
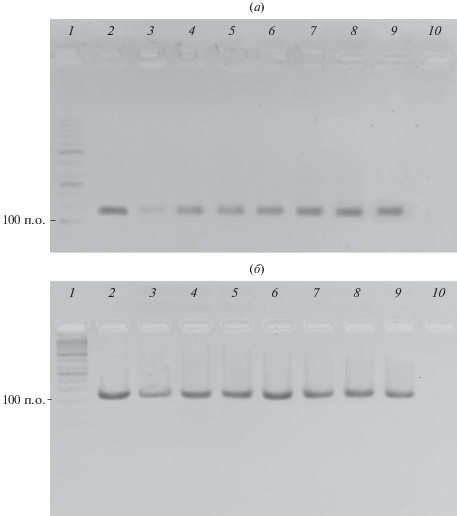
Для определения выхода продукта проводили три серии ПЦР для каждой из полимераз и для каждого fluor-dUTP без применения интеркалирующего красителя в процессе реакции. Количество циклов амплификации сокращали до 32 по сравнению с ПЦР в режиме реального времени, где применяли 40 циклов амплификации. Выход продукта оценивали по оптической плотности соответствующих полос в агарозном геле при окрашивании бромистым этидием (рис. 3) с помощью программного обеспечения ImageJ (NIH, США); данные приведены в табл. 1.
Рис. 3.
Ингибирующий эффект при разных концентрациях fluor-dUTP в ПЦР-смеси с Taq-полимеразой (а) и Vent (exo-)-полимеразой (б) на примере соединения (IIIв).

Показано, что эффективность ПЦР и выход целевого продукта воспроизводимо больше для всех fluor-dUTP (II) и (III) по сравнению с контрольным образцом (I). При сравнении с природным dTTP эффективность амплификации была ниже для каждого из fluor-dUTP, что говорит об ингибировании полимераз, причем и в этом случае для контрольного образца (I) ингибирующий эффект был максимальным (табл. 1). Выход продукта хорошо коррелировал с рассчитанными значениями эффективности ПЦР. Для всех исследованных fluor-dUTP в группах (II) и (III) эффективность амплификации и выход целевого полноразмерного продукта были несколько выше в случае Vent (exo-)-полимеразы по сравнению с Taq-полимеразой.
Рис. 4.
Электрофореграммы, полученные в цифровом формате RAW с сохранением данных попиксельной интенсивности сигнала для измерения выхода полноразмерного продукта ПЦР с Taq-полимеразой (а) и Vent (exo-)-полимеразой (б): 4% агарозный гель, окрашивание бромистым этидием, 1 – маркер длин двухцепочечных ДНК GeneRuler 50bp (Thermo Scientific, США); 2 – dTTP; 3 – (I); 4 – (IIа); 5 – (IIб); 6 – (IIв); 7 – (IIIа); 8 – (IIIб); 9 – (IIIв); 10 – отрицательный контрольный образец.
Гибридизационный анализ проводили на биологических микрочипах коммерческой тест-системы “ТБ-Биочип”, рассчитанной на одновременную мультиплексную гибридизацию ПЦР-продуктов фрагментов пяти генов. Поскольку в данном случае мы гибридизовали лишь один продукт асимметричной ПЦР (фрагмент гена rpo B), то сигналы вычисляли лишь с участка чипа, соответствующего этому гену. Принципиальная схема данного участка чипа, а также пример гибридизационной картины приведены на рис. 5. Концентрацию гибридизуемых продуктов выравнивали с учетом полученных данных выхода продукта для каждого модифицированного производного рядов (II) и (III). Гибридизацию целевых продуктов в равных концентрацях проводили с целью избежать эффектов влияния концентрации продукта на эффективность гибридизации (интенсивность сигнала, отношение совершенных и несовершенных дуплексов). Величину гибридизационных сигналов совершенных дуплексов использовали в качестве непрямого фактора оценки степени встраивания метки в ПЦР-продукт в ходе амплификации при равных концентрациях гибридизуемого ПЦР-продукта (рис. 6). Отношение сигналов совершенных и несовершенных дуплексов применяли в качестве критерия специфичности встраивания модифицированных нуклеотидов в растущую цепь ДНК и возможных неспецифических взаимодействий групп-флуорофоров с компонентами чипа, ухудшающих специфичность гибридизационного анализа. Гибридизацию проводили в трех повторах для каждого флуоресцентно-меченного производного (II) и (III). Величину отношения совершенных и несовершенных дуплексов (дискриминационное отношение) также вычисляли по каждой вариабельной позиции и затем находили среднее значение по чипу (табл. 1).
Рис. 5.
Принципиальная схема участка чипа, содержащего зонды, комплементарные анализируемому фрагменту гена rpo B M. tuberculosis (сверху) и гибридизационная картина (негатив) ПЦР-продукта, полученного с помощью соединения (IIб) в качестве субстрата и референс-штамма дикого типа M. tuberculosis H37rv, не содержащего мутаций в данном регионе, в качестве матрицы для амплификации. На схеме черным цветом обозначены ячейки, соответствующие дикому типу M. tuberculosis (отсутствует устойчивость к рифампицину), серым цветом – мутантные варианты. Схема поделена на зоны в соответствии с аминокислотными заменами по отдельным позициям кодируемого белка. Анализ осуществляется путем сравнения интенсивности сигнала в ячейке, соответствующей дикому типу, с сигналами ячеек, соответствующих мутантным вариантам, для каждой индивидуальной зоны. Д.Т. – дикий тип, Мут. – мутация. Схема анализа гибридизационных сигналов подробно описана в публикациях [19, 20].

Рис. 6.
Диаграммы интенсивности флуоресцентных сигналов совершенных дуплексов чипа (чувствительность гибридизационного анализа). Сигнал дуплекса, образованного ПЦР-продуктом, содержащим нуклеотид (I) для Taq-полимеразы, нормирован на единицу.

Таблица 1.
Эффективность амплификации, выход продукта и гибридизационные сигналы ПЦР-продуктов, полученные при помощи флуоресцентно-меченных дезоксиуридинтрифосфатов
| Fluor-dUTP | Эффективность амплификации* | Выход продукта (нормированный)** | Гибридизационный сигнал*** | Дискриминационное отношение |
||||
|---|---|---|---|---|---|---|---|---|
| Taq | Vent (exo-) | Taq | Vent (exo-) | Taq | Vent (exo-) | Taq | Vent (exo-) | |
| (I) | 1.56 | 1.68 | 1.00 | 1.12 | 1.00 | 1.19 | 3.8 | 2.5 |
| (IIа) | 1.72 | 1.82 | 2.59 | 3.64 | 0.65 | 0.93 | 1.6 | 1.3 |
| (IIб) | 1.69 | 1.78 | 2.33 | 3.28 | 2.12 | 2.69 | 4.1 | 2.7 |
| (IIв) | 1.73 | 1.80 | 2.78 | 3.64 | 2.87 | 3.10 | 3.5 | 2.5 |
| (IIIа) | 1.57 | 1.75 | 1.84 | 2.08 | 2.28 | 2.81 | 3.9 | 4.0 |
| (IIIб) | 1.61 | 1.85 | 1.87 | 2.04 | 2.45 | 2.96 | 5.2 | 4.9 |
| (IIIв) | 1.49 | 1.77 | 1.65 | 1.92 | 2.39 | 2.95 | 4.7 | 3.4 |
| dTTP | 1.76 | 1.85 | 3.23 | 3.57 | – | – | – | – |
* Эффективность амплификации (Е) определяли при концентрации флуоресцентно-меченного нуклеозидтрифосфата, равной 8 мкМ, и рассчитывали по формуле Е = 10tg α [17] (см. экспер. часть и рис. 2).
При гибридизационном анализе на биочипах в ряду fluor-dUTP (III) полученная усредненная интенсивность флуоресцентных сигналов высокая и варьирует в незначительных пределах. Наличие четвертичной аммониевой группы в структуре fluor-dUTP (IIа) ухудшило эффективность встраивания по сравнению с контрольным образцом (I). Однако увеличение длины линкера привело к постепенному росту эффективности встраивания в ряду трифосфатов (IIа–в). Такая тенденция роста эффективности встраивания в зависимости от длины линкера прослеживается только в случае трифосфатов (IIа–в), содержащих в своей структуре нейтрально заряженный краситель с четвертичной аммониевой группой. В случае ряда (IIIа–в) увеличение длины линкера выше среднего значения практически не повлияло на интенсивность гибридизационных сигналов, что хорошо соответствует полученным ранее данным для мультиплексной гибридизации [14].
Следует отметить, что средний уровень гибридизационных сигналов для фрагмента чипа, соответствующего гену rpo B, несколько ниже средних сигналов, получаемых в случае мультиплексной гибридизации [14]. Это может быть обусловлено высоким процентным содержанием G⋅C-пар в исследуемом фрагменте, а также обнаруженной внутренней структуре типа “шпилька”, что несколько уменьшает общую интенсивность гибридизационного сигнала в условиях эксперимента.
При анализе отношения сигналов ячеек с совершенными и несовершенными дуплексами (дискриминационная способность тест-системы) корреляция данных для различных fluor-dUTP обусловлена скорее интенсивностью целевых сигналов и приводит при их низких значениях к низкому разрешению (низкой дискриминации). Во всех случаях, кроме соединения (IIа) для Vent (exo-)-полимеразы, дискриминация достаточна для надежной интерпретации гибридизационной картины при диагностическом применении чипа. В упомянутом же случае низкий уровень дискриминации обусловлен низким целевым сигналом и, соответственно, высоким отношением фонового сигнала к целевому.
Оценка степени встраивания флуоресцентно-меченных dUTP с помощью гибридизационного анализа показала отсутствие прямой зависимости включения метки от эффективности fluor-dUTP в ПЦР и от выхода целевого продукта. Флуоресцентно-меченные уридинтрифосфаты (II) и (III) показали различную эффективность в ПЦР и различный выход целевого продукта в зависимости от химического строения флуорофора, но не от длины линкера, т.е. по группам (II) и (III), но не в рядах а-б-в. При этом длина линкера оказывает гораздо большее влияние на субстратную эффективность, определяя степень встраивания меток. Наиболее ярко этот эффект наблюдался при увеличении длины линкера с так называемого “короткого” до “среднего” для флуорофора с четвертичной аммониевой группой (табл. 1).
Краситель, связанный по 5-положению пиримидинового основания, ориентирован в широкую бороздку двунитевых ДНК и не должен влиять на образование двойной спирали комплементарных цепей ДНК. Однако краситель с двумя сульфогруппами и четвертичной аммониевой группой имеет значительные геометрические размеры, которые, как мы предполагаем, стерически затрудняют работу ДНК-полимеразы. Увеличение длины линкера, соединяющего пиримидиновое основание с красителем, уменьшает стерические препятствия. Молекула моносульфированного красителя более компактна, и увеличение длины линкера, по-видимому, не приводит к уменьшению стерических препятствий и увеличению встраивания модифицированного нуклеотида в растущую de novo цепь ДНК.
При этом увеличение длины линкера увеличивает гидрофобность (липофильность) красителя и модифицированного нуклеотида в целом, увеличивает неспецифическое взаимодействие с ДНК и ДНК-полимеразой и уменьшает эффективность встраивания модифицированных нуклеотидов в растущую цепь ДНК. Поэтому, с ростом длины линкера наблюдается первоначальный рост эффективности встраивания модифицированных нуклеотидов, а затем эффективность начинает снижаться.
В условиях проведения эксперимента Vent (exo-)-полимераза показала несколько большие эффективность амплификации и выход продукта по сравнению с Taq-полимеразой для всех исследованных образцов флуоресцентно-меченных производных dUTP в широком диапазоне концентраций (0–48 мкМ). По эффективности амплификации при высоких концентрациях fluor-dUTP полимераза Vent (exo-) существенно превосходила Taq-полимеразу. По совокупности показателей чувствительности и специфичности при проведении гибридизации на биочипах (уровень сигнала и дискриминирующая способность) наиболее эффективными оказались электронейтральные производные со средней длиной линкера (IIб) и (IIIб).Таким образом, исследованные fluor-dUTP пригодны для введения метки в ПЦР-продукты с помощью Taq- и Vent (exo-)-ДНК-полимераз для последующего гибридизационного анализа.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе применяли следующие реагенты: немодифицированные трифосфаты дезоксинуклеозидов (dNTPs) (Thermo Scientific, США); полимеразы Taq (Thermo Scientific, США) и Vent (exo-) (New England Biolabs, США); флуоресцентный краситель для ПЦР EvaGreen (Biotium, США); бромид этидия (Хеликон, Россия) – для окрашивания агарозных электрофорезных гелей. В качестве маркера длин продуктов применяли GeneRuler 50 bp DNA Ladder (Thermo Scientific, США). Воду для приготовления растворов получали на установке Milli-Q (EMD Millipore, США). Для хроматографической очистки олигонуклеотидов применяли колонку BDS Hypersil C18 (Thermo Scientific, США). Остальные реактивы и растворители приобретены в компаниях “Sigma-Aldrich” (США), “Acros Organics” (Бельгия) и “Fluka” (США) и имели качество “reagent grade” или “biochemical grade”. В работе использованы полуавтоматические пипетки (Gilson, Франция), амплификатор PTC-220 (Bio-Rad, США), амплификатор для ПЦР в режиме реального времени IQ5 (BioRad, США), центрифуга-вортекс “Микроспин” FV-2400 (Biosan, Латвия), высокоскоростная центрифуга для микропробирок Frontier 5515 (Ohaus, США), система для горизонтального электрофореза (ООО “Хеликон”, Россия), транс-иллюминатор TCP-20.МС 254/312 нм (Vilber Lourmat, Франция), цифровой фотоаппарат EOS 500D (Canon, Япония) с оптическим фильтром SYBR photographic filter S7569 (Molecular Probes, США). Олигонуклеотиды синтезировали с помощью автоматического синтезатора ABI 394 DNA/RNA (Applied Biosystems, США). Измерение концентрации олигонуклеотидов и ДНК проводили с помощью спектрофотометра для микрообъемов NanoDrop 1000 (Thermo Scientific, США).
Свойства и синтез использованных в настоящей работе флуоресцентно-меченных трифосфатов дезоксиуридина описаны ранее [14].
ДНК-матрицы для исследований кинетики амплификации и субстратной эффективности флуоресцентно-меченных трифосфатов дезоксиуридина. Для определения эффективности амплификации использовали матрицу, полученную в результате проведения ПЦР фрагмента гена rpo B из деконтаминированной геномной ДНК Mycobacterium tuberculosis, штамм H37rv, и праймеры: прямой 105f (5'-CGTGGAGGCGATCACACCGCAGACGTTG-3') и обратный 293r (5'-AGTGAGACGGGTGCACGTCGCGGACCT-3'), впервые описанные в работе [19]. Полученный ПЦР-продукт очищали на спин-колонках (Bio-Rad, США), растворяли в деионизованной воде качества MQ и доводили концентрацию до 104 копий/мкл. Ту же матрицу применяли в симметричной гнездовой ПЦР для определения выхода продуктов амплификации и в асимметричной гнездовой ПЦР для получения преимущественно одноцепочечных продуктов для гибридизационного анализа.
Эффективность амплификации с помощью ПЦР в режиме реального времени. Для определения кинетики амплификации по накоплению флуоресцентного сигнала EvaGreen для каждого флуоресцентно-меченного трифосфата дезоксиуридина проводили ПЦР в режиме реального времени на приборе BioRad IQ5. Использовали праймеры: прямой 1272f (5'-CGCCGCGATCAAGGAGTTCT-3') и обратный 1398r (5'-TCACGTGACAGACCGCCGGG-3') [19]. Использовали Taq- и Vent (exo-)-ДНК-полимеразы, количество которых в реакционную смесь брали согласно рекомендациям производителя. Реакционная смесь содержала природные дезоксинуклеозидтрифосфаты dATP, dCTP, dGTP в концентрации 200 мкM каждый, а также флуоресцентно-меченный дезоксиуридинтрифосфат (I)–(III), в концентрации от 0 до 48 мкМ для изучения ингибирующего эффекта и 8 мкМ для определения кинетики и выхода продукта ПЦР. Суммарную концентрацию каждого нуклеозидтрифосфата (I)–(III) и природного dTTP доводили до 200 мкM с помощью 2 мМ раствора природного dTTP.
Температурно-временной профиль ПЦР состоял из предварительной денатурации при 95°С в течение 3 мин, за которой следовали 40 циклов: 95°С (денатурация ДНК) в течение 30 с, 64°С (отжиг праймеров) в течение 30 с, 72°С (достройка праймеров) в течение 30 с и далее завершающая инкубация при 72°С в течение 5 мин.
Эффективность реакции определяли по углу наклона прямого участка S-образной кривой накопления ДНК, представленной в логарифмическом масштабе. Использовали следующую формулу для расчета эффективности: Е = 10tg α, где E – эффективность амплификации (динамический показатель накопления флуоресцентного сигнала), tg α – тангенс угла наклона линейного участка кривой накопления флуоресцентного сигнала.
Выход продуктов амплификации. Для определения количества наработанного ПЦР-продукта проводили ПЦР по симметричному типу для получения двухцепочечной ДНК. Температурно-временной режим аналогичен примененному для ПЦР в реальном времени, за исключением количества циклов амплификации, которое составляло 32 цикла. Полученные ПЦР-продукты разделяли в 4% агарозном геле, количество продукта оценивали по оптической плотности соответствующих полос в дорожках геля с использованием программы ImageJ (NIH, США).
ПЦР с флуоресцентно-меченными трифосфатами дезоксиуридина (I)–(III) для последующего проведения гибридизации на биочипах. Для подготовки образцов для гибридизации проводили асимметричную гнездовую ПЦР (с внутренними праймерами 1272f и 1398r) [19, 20] в соотношении 10/1. Использованное соотношение праймеров позволяет получать преимущественно одноцепочечный продукт для последующей гибридизации с иммобилизованными зондами биочипа. В качестве матрицы использовали более длинный фрагмент, полученный с помощью праймеров 105f и 293r. Получение матрицы для асимметричной ПЦР представлено выше. Соотношение компонентов реакции (кроме соотношения праймеров) и концентрация нуклеозидтрифосфата (I)–(III) (8 мкМ) – как в случае определения кинетики ПЦР, но без интеркалирующего красителя EvaGreen. Температурно-временной режим аналогичен примененному для ПЦР в реальном времени, за исключением количества циклов амплификации, которое составляло 32 цикла. Полученный ПЦР-продукт при необходимости разбавляли деионизованной водой качества MQ для выравнивания концентраций ПЦР-продуктов с учетом данных определения выхода продуктов по электрофорезу – для последующего проведения гибридизационного анализа.
Гибридизация на биологических микрочипах. Гибридизацию продуктов ПЦР осуществляли на чипах, входящих в состав коммерческой тест-системы “ТБ-Биочип”. Гибридизационная смесь состояла из гибридизационного буфера (20 мкл, 1.5 М гуанидинтиоцианат, 75 мМ буфер HEPES рН 7.5, 7.5 мМ EDТА) и реакционной смеси (10 мкл) после проведения асимметричной ПЦР и определения выхода целевого продукта. Полученную смесь перемешивали на встряхивателе типа “вортекс” и центрифугировали в течение 10 с при 1000 g. Полученную гибридизационную смесь (30 мкл) вносили в одно из отверстий реакционной камеры биочипа. Гибридизацию проводили при 37°C в течение 10–12 ч. По окончании гибридизации биочип трижды промывали дистиллированной водой при 37°C, снимали гибридизационную камеру и высушивали биочип в потоке воздуха.
Регистрация результатов гибридизации. Регистрацию флуоресцентного изображения микрочипа выполняли на универсальном аппаратно-программном комплексе (УАПК) (ООО “БИОЧИП-ИМБ”, Россия) для анализа биологических микрочипов с использованием специализированного программного обеспечения ImageWare® (ООО “БИОЧИП-ИМБ”, Россия).
Список литературы
Ren X., El-Sagheer A.H., Brown T. // Nucl. Acids Res. 2016. V. 44. e79.
Wu J., Tang X. // Bioorg. Med. Chem. 2013. V. 21. P. 6205–6211.
Dziuba D., Pohl R., Hocek M. // Bioconjug. Chem. 2014. V. 19. P. 1984–1995.
Wynne S.A., Pinheiro V.B., Holliger P., Leslie A.G. // PLoS One. 2013. V. 8. e70892.
Rohloff J.C., Gelinas A.D., Jarvis T. C., Ochsner U.A., Schneider D.J., Gold L., Janjic N. // Mol. Ther. Nucl. Acids. 2014. V. 3. e201.
Giller G., Tasara T., Angerer B., Mühlegger K., Amacker M., Winter H. // Nucl. Acids Res. 2003. V. 31. P. 2630–2635.
Kuwahara M., Nagashima J., Hasegawa M., Tamura T., Kitagata R., HanaWa K., Hasoshima S., Kasamatsu T., Ozaki H., Sawai H. // Nucl. Acids Res. 2006. V. 34. P. 5383–5394.
Mujumdar R.B., Ernst L.A., Mujumdar S.R., Lewis C.J., Waggoner A.S.// Bioconjug. Chem. 1993. V. 4. P. 105–111.
Lee W., von Hippel P.H., Marcus A.H. // Nucl. Acids Res. 2014. V. 42. P. 5967–5977.
Le Guennic B., Jacquemin D. // Acc. Chem. Res. 2015. V. 48. P. 530–537.
Lee J.S., Song J.J., Deaton R., Kim J.W. // Biomed. Res Int. 2013. 2013:310461.
Шеpшов В.Е., Кузнецова В.Е., Лыcов Ю.П., Гуcейнов Т.О., Баpcкий В.Е., Cпицын М.А., Заcедателева О.А., Ваcилиcков В.А., Cуpжиков C.А., Заcедателев А.C., Чудинов А.В. // Биофизика. 2015. Т. 60. С. 1216–1218.
Zasedateleva O.A., Vasiliskov V.A., Surzhikov S.A., Kuznetsova V.E., Shershov V.E., Guseinov T.O., Smirnov I.P., Yurasov R.A., Spitsyn M.A., Chudinov A.V. // Nucl. Acids Res. 2018. V. 46. e73.
Shershov V.E., Lapa S.A., Kuznetsova V.E., Spitsyn M.A., Guseinov T.O., Polyakov S.A., Stomahin A.A., Zasedatelev A.S., Chudinov A.V. // J. Fluoresc. 2017. V. 27. P. 2001–2016.
Фесенко Д.О., Гусейнов Т.О., Лапа С.А., Кузнецова В.Е., Шершов В.Е., Спицын М.А., Наседкина Т.В., Заседателев А.С., Чудинов А.В. // Мол. биология. 2018. Т. 52. С. 533–542.
Лисица Т.С., Шершов В.Е., Спицын М.А., Гусейнов Т.О., Иконникова А.Ю., Фесенко Д.О., Лапа С.А., Заседателев А.С., Чудинов А.В., Наседкина Т.В. // Биофизика. 2017. Т. 62. С. 464–471.
Ramakers C., Ruijter J.M., Lekanne Deprez R.H., Moorman A.F.M. // Neuroscience Letters. 2003. V. 339. P. 62–66.
Peirson S.N., Butler J.N., Foster R.G. // Nucl. Acids Res. 2003. V. 31:e73.
Mikhailovich V., Lapa S., Gryadunov D., Sobolev A., Strizhkov B., Chernyh N., Skotnikova O., Irtuganova O., Moroz A., Litvinov V., Vladimirskii M., Perelman M., Chernousova L., Erokhin V., Zasedatelev A., Mirzabekov A. // J. Clin. Microbiol. 2001. V. 39. P. 2531–2540.
Gryadunov D., Mikhailovich V., Lapa S., Roudinskii N., Donnikov M., Pan’kov S., Markova O., Zasedatelev A., Mirzabekov A., Kuz’min A., Chernousova L., Skotnikova O., Moroz A. // Clin. Microbiol. Infect. 2005. V. 11. P. 531–539.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия



