Биоорганическая химия, 2020, T. 46, № 3, стр. 270-272
Эффект проскальзывания в реакции элонгации праймера при использовании модифицированных 2'‑дезоксиуридинтрифосфатов
В. А. Василисков 2, В. Е. Шершов 2, Р. А. Мифтахов 2, В. Е. Кузнецова 2, С. П. Радько 1, 3, А. В. Лисица 3, С. А. Лапа 2, С. А. Суржиков 2, Э. Н. Тимофеев 2, А. С. Заседателев 2, А. В. Чудинов 1, 2
1 ООО “ИБМХ-ЭкоБиоФарм”
119121 Москва, ул. Погодинская, 10, стр. 8, Россия
2 ФГБУН Институт молекулярной биологии им. В.А. Энгельгардта РАН
119991 Москва, ул. Вавилова, 32, Россия
3 Научно-исследовательский институт биомедицинской химии им. В.Н. Ореховича Российской академии медицинских наук
119121 Москва, ул. Погодинская, 10, стр. 8, Россия
Поступила в редакцию 01.11.2019
После доработки 29.11.2019
Принята к публикации 10.12.2019
Аннотация
Выявлен эффект проскальзывания праймерной цепи в реакции элонгации праймера на гомополимерной матрице при использовании модифицированных аналогов dUTP. Эффект наблюдается при использовании Vent(exo-) ДНК полимеразы и в заметной степени подавляется добавлением к реакционной смеси природных нуклеотидов dATP (2'-дезоксиаденозинтрифосфат), dCTP (2'-дезоксицитидинтрифосфат ) и dGTP (2'-дезоксигуанозинтрифосфат).
ВВЕДЕНИЕ
Модифицированные 2'-дезоксинуклеозид трифосфаты нашли широкое применение при отборе высокоаффинных ДНК аптамеров методом SELEX [1]. В качестве модифицированных нуклеотидов чаще всего используют аналоги 2'-дезоксиуридинтрифосфата (dUTP), содержащие модификацию в положении 5 урацила. Эффективность аналога в качестве субстрата ДНК полимераз оценивается, как правило, в реакции элонгации праймера.
Одной из основных характеристик модифицированного субстрата является его способность к многократному встраиванию с образованием полностью модифицированного участка. Для оценки этого параметра в реакции элонгации праймера используют ДНК-матрицу, содержащую гомополимерный участок типа (dA)n. Однако, как показано в настоящей работе, при использовании гомополимерной матрицы интерпретация результатов может осложняться из-за эффекта проскальзывания цепи (slippage). При исследовании субстратных характеристик новых модифицированных нуклеотидов на основе амидов аминоаллил-dUTP мы обнаружили выраженный эффект проскальзывания праймерной цепи.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
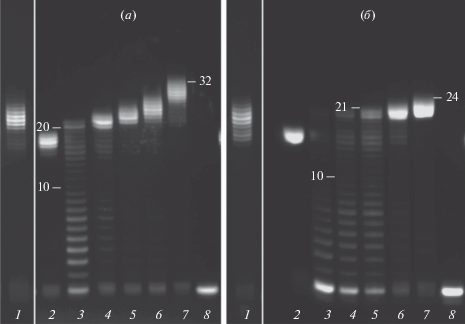
В настоящей работе мы использовали олигонуклеотидную модель, содержащую в матричной цепи фрагмент dA20 (рис. 1, а). Объектами настоящего исследования были неприродные аналоги dUTP (рис. 1, б), синтезированные нами ранее [2]. При проведении реакции удлинения праймера Vent(exo-) ДНК полимеразой с аналогами dUTP обнаружен эффект проскальзывания модифицированной цепи (рис. 2). Для dUTP (Ia) максимальная длина модифицированной цепи превышала длину матрицы на 15–16 нуклеотидов. Столь выраженный эффект наблюдался лишь при условии добавления к реакционной смеси только неприродного нуклеотида. Введение в реакцию дополнительно смеси dATP, dCTP и dGTP ограничивает число избыточных нуклеотидов до 6–7 (рис. 2б). Несколько менее выраженный эффект проскальзывания наблюдался для двух других нуклеотидов (Iб, Iв). Природный dTTP достраивает праймер до размера матрицы с небольшой примесью N + 1 продукта в присутствии Taq ДНК полимеразы. Однако, при использовании Vent(exo-) полимеразы для природного нуклеотида также наблюдается заметный эффект проскальзывания.
Рис. 1.
Строение модифицированных 2'-дезоксиуридин-5'-трифосфатов (I): (а) R = C2H5; (б) R = н-C3H7; (в) R = н-C4H9, использованных в реакции элонгации праймера.

Рис. 2.
Электрофоретическое разделение продуктов реакции элонгации праймера c dUTP (Ia) с Vent(exo-) ДНК-полимеразой при добавлении только модифицированного нуклеотида (а) или смеси модифицированного нуклеотида с dATP, dCTP и dGTP (б). Анализ выполнен в денатурирующем полиакриламидном геле (20%) при 50°С. Дорожки 1 и 2 – контроли с dTTP и Vent (exo-) (3 ч) и Taq (1 ч) ДНК полимеразой соответственно. Дорожки (3–7) соответствуют времени проведения реакции 10 с, 1 мин, 5 мин, 30 мин и 3 ч. Дорожка 8 – праймер. Цифрами отмечена разница длин выбранного фрагмента и праймера. Модифицированные цепи отличаются меньшей подвижностью при электрофорезе по сравнению с природной ДНК.
Проскальзывание цепей при репликации часто наблюдается на микросателлитных участках ДНК, содержащих короткие повторы (1–6 п.о.). Это явление лежит в основе механизма возникновения коротких indel мутаций (insertions/deletions). Исследования показывают, что увеличение длины повторяемого фрагмента или уменьшение количества повторов снижают вероятность проявления эффекта [3]. Важным фактором, способствующим проявлению проскальзывания, является стабилизация выпетленных конфигураций ДНК, способных к дальнейшей элонгации. Стабилизация может осуществляться за счет образования выпетливаний с классическими парами оснований, мисматчами или с неканонической структурой [4–6]. Эффект проскальзывания цепи для неприродных аналогов не обнаружен нами в литературе. Структура модифицированных нуклеотидов I (а–в) допускает участие амидных фрагментов в стабилизации выпетливаний на неприродном участке цепи. Обнаруженный эффект проявляется в условиях, заметно отличающихся от условий отбора аптамеров. В силу этого предполагается, что он не оказывает заметного влияния на результаты селекции с использованием неприродных трифосфатов. Однако проскальзывание может заметно искажать результаты оценки субстратной эффективности неприродных нуклеотидов, особенно в случае малоэффективных субстратов, когда наблюдаемая максимальная длина неприродной цепи не превышает размера матрицы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реакцию достраивания праймера проводили с использованием матрицы М и праймера А (приведены последовательности 5'-3'): (М): (A)20-TTG-TCA-CTC-AGA-CCA-ACT-CCC-T; (Р): Су3-A-ACA-GTG-AGT-CTG-GTT-GAG-GGA. Реакцию элонгации праймера проводили в реакционной смеси (25 мкл), содержащей 4 мкM праймера, 4 мкM матрицы, модифицированный dUTP (IIIа–г) в концентрации 200 мкМ и Vent(exo-) ДНК-полимеразу (NEB, США) в количестве 5 ед. акт. в буфере Thermopol™ при температуре 72°С. Время элонгации варьировали от 10 с до 3 ч. Продукт реакции разделяли электрофорезом в денатурирующих условиях. Детекцию проводили в диапазоне флуоресценции красителя Cy3 с возбуждением при 535 нм и регистрацией при 580 нм.
Список литературы
Lapa S.A., Chudinov A.V., Timofeev E.N. // Mol. Biotechnology. 2016. V. 58. P. 79–92.
Василисков В.А., Лапа С.А., Кузнецова В.Е., Суржиков С.А., Шершов В.Е., Спицын М.А., Гусейнов Т.О., Мифтахов Р.А., Заседателева О.А., Лисица А.В., Радько С.П., Заседателев А.С., Тимофеев Э.Н., Чудинов А.В. // Биоорг. хим. 2019. Т. 45. С. 446–448. [Vasiliskov V.A., Lapa S.A., Kuznetsova V.E., Surzhikov S.A., Shershov V.E., Spitsyn M.A., Guseinov T.O., Miftahov R.A., Zasedateleva O.A., Lisitsa A.V., Radko S.P., Zasedatelev A.S., Timofeev E.N., Chudinov A.V. // Rus. J. Bioorg. Chem. 2019. V. 45. p. 221–223.]
Liljegren M.M., de Muinck E.J., Trosvik P. // PLoS One. 2016. V. 11. P. e0159232.
Lo Y.-S., Tseng W.-H., Chuang C.-Y., Hou M.-H. // Nucl. Acids Res. 2013. V. 41. P. 4284–4294.
Hou M.-H., Robinson H., Gao Y.-G., Wang A.H.J. // Nucl. Acids Res. 2002. V. 30. P. 4910–4917.
Edwards S.F., Sirito M., Krahe R., Sinden R.R. // Proc. Natl. Acad. Sci. USA. 2009. V. 106. P. 3270–3275.
Huang T.Y., Chang C.K., Kao Y.F., Chin C.H., Ni C.W., Hsu H.Y., Hu N.J., Hsieh L.C., Chou S.H., Lee I.R., Hou M.H. // Proc. Natl. Acad. Sci. USA. 2017. V. 114. P. 9535–9540.
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия


