Биоорганическая химия, 2022, T. 48, № 3, стр. 375-378
Влияние положения сопряженного заместителя на оптические свойства производных хромофора белка Kaede
И. Н. Мяснянко 1, 2, Н. С. Балеева 1, 2, *, М. С. Баранов 1, 2
1 ФГБУН “Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова” РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
2 Российский национальный исследовательский медицинский университет имени Н.И. Пирогова
117997 Москва, ул. Островитянова, 1, Россия
* E-mail: nsbaleeva@gmail.com
Поступила в редакцию 13.09.2021
После доработки 20.09.2021
Принята к публикации 29.09.2021
- EDN: XCMAYG
- DOI: 10.31857/S0132342322030149
Аннотация
Синтезированы новые производные хромофора белка Kaede – (Z)-2-(4-метоксибензилиден)-6/8-фенилимидазо[1,2-a]пиридин-3(2H)-оны. Установлено, что положение фенильного заместителя в имидазопиридиноновом фрагменте не влияет на оптические свойства подобных соединений.
ВВЕДЕНИЕ
Синтетические аналоги хромофоров флуоресцентных белков – бензилиденимидазолоны – высокоперспективны в качестве основы для новых флуоресцентных меток. Благодаря большому количеству существующих синтетических методов модификаций этих соединений можно легко получить вещества разного строения и с разными заместителями, что потенциально позволяет значительно варьировать их оптические свойства [1, 2]. В частности, для флуоресцентных красителей важна способность поглощать и испускать свет длинноволнового диапазона – менее токсичный для биологических тканей. Эффективный подход к батохромному смещению максимумов абсорбции и эмиссии красителей – увеличение системы сопряженных π-связей. Например, флуоресцентные белки Kaede и DsRed, хромофоры которых содержат во 2-м положении имидазолона заместители с кратными связями, имеют максимум флуоресценции 580–585 нм [3], в то время как флуоресцентный белок GFP (Green Fluorescent Protein), хромофор которого имеет алкильную группу в этом положении, характеризуется флуоресценцией с максимумом 510 нм [3]. Аналогично показано, что синтетические аналоги хромофора GFP, имеющие во 2-м положении иные стирольные заместители, испускают свет в области ~600 нм [4–8]. Схожими свойствами обладают конденсированные производные [9, 10], у которых данный фрагмент циклически замкнут на атом азота имидазолонового цикла. Ранее на примере пары синтетических аналогов хромофора Kaede нами была изучена зависимость оптических свойств от подвижности кратной связи во 2-м положении имидазолона (рис. 1) [11]. Было установлено, что фиксация двойной связи для конденсированного производного (I) приводит к батохромному сдвигу максимумов абсорбции на 79 нм и эмиссии на 19 нм (рис. 1).
Цель настоящей работы – изучение влияния положения фенильного заместителя в имидазопиридиноновом фрагменте на оптические свойства производных хромофора белка Kaede.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На первом этапе работы нами из бромопиридин-2-аминов были получены пиридиновые производные глицина (II) и (III). Затем с помощью конденсации с анисовым альдегидом были синтезированы соответствующие имидазопиридиноны (IV). На заключительной стадии синтеза с помощью реакции арилирования бромпроизводных (IV) были получены целевые соединения (V).
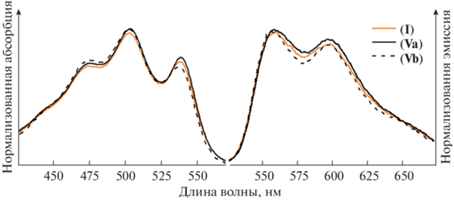
Установлено, что оптические свойства полученных соединений (V) (схема 1 ) не отличаются от свойств ранее описанного аналога (I) (рис. 1). Все производные характеризуются абсорбцией с максимумом 500–505 нм и эмиссией с максимумом 555–560 нм в ацетонитриле (рис. 2). Вероятно, что отсутствие влияния положения фенильного заместителя связано с неполным сопряжением с π‑системой молекулы из-за его подвижности. В связи с этим перспективное направление для дальнейших исследований – создание производных с жестко фиксированными ароматическими заместителями.
Схема 1 . Схема синтеза целевых соединений (V).
Также мы установили, что новые производные (V) обладают слабой флуоресценцией с квантовым выходом 1.5–2.0% (в ацетонитриле). Многие производные хромофоров флуоресцентных белков с подобными свойствами могут быть использованы в качестве флуорогенных красителей [10, 12]. Поэтому можно предположить, что производные (V) и родственные им соединения также перспективны для применения во флуоресцентной микроскопии в данной роли.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование. Спектры ЯМР (δ, м.д.; J, Гц) регистрировали на спектрометре Fourier 300 (300 МГц; Bruker, США) при 303 K в DMSO-d6 (внутренний стандарт – Me4Si), спектры поглощения – на спектрофотометре Cary 100 Bio (Varian, США), спектры флуоресценции – на спектрофлуориметре Cary Eclipse (Varian, США). Температуры плавления определяли на приборе SMP 30 (Stuart Scientific, Великобритания) и не исправляли. Масс-спектры высокого разрешения регистрировали на приборе micrOTOF II (Bruker, Германия), ионизация электрораспылением.
Синтез этил(бромопиридин-2-ил)глицината (II). Бромопиридин-2-амин (10 г, 58 ммоль) растворяли в смеси HClO4 (50%, 24.0 мл) и EtOH (50 мл), добавляли водный раствор глиоксаля (40%, 8.00 мл, 64 ммоль). Полученную смесь кипятили в течение 40 ч. Затем реакционную смесь охлаждали до 0°С, разбавляли насыщенным раствором NaHCO3 до рН 7, экстрагировали CHCl3 (4 × 160 мл), сушили над безводным Na2SO4 и упаривали. Продукт очищали методом флеш-хроматографии (элюент – этилацетат и гексан, 1 : 1).
Синтез гидрохлорида (бромопиридин-2-ил)глицина (III). Этил-2-((бромопиридин-2-ил)амино)ацетат (32 ммоль) растворяли в HCl (5 М, 32 мл) и кипятили 6 ч. Затем смесь упаривали, остаток промывали Et2O (2 × 50 мл) и сушили в вакууме.
Синтез (Z)-бромо-2-(4-метоксибензилиден)ими-дазо[1,2-a]пиридин-3(2H)-она (IV). 2-((3-Бромопиридин-2-ил)амино)уксусной кислоты гидрохлорид (800 мг, 3.0 ммоль) помещали в колбу Шленка, вакуумировали, заполняли аргоном и добавляли 4.5 мл PCl3 (51 ммоль). Полученную смесь кипятили в течение 5 ч и упаривали. К остатку в токе аргона добавляли анисовый альдегид (0.330 мл, 2.7 ммоль), пиридин (3.0 мл) и триэтиламин (0.50 мл). Реакционную смесь выдерживали при 70°С в течение 12 ч, а затем упаривали. Полученный остаток растворяли в EtOAc (50 мл), промывали насыщенным раствором NaHCO3 (10 мл) и насыщенным раствором NaCl (3 × 15 мл), сушили над безводным Na2SO4 и упаривали. Полученный продукт очищали методом флеш-хроматографии (элюент – этилацетат и гексан, 1 : 3).
Синтез (Z)-2-(4-метоксибензилиден)-фенилимидазо[1,2-a]пиридин-3(2H)-она (V). В колбу Шленка помещали (Z)-бромо-2-(4-метоксибензилиден)имидазо[1,2-a]пиридин-3(2H)-он (33 мг, 0.1 ммоль), фенилбороновой кислоты пинаколовый эфир (54 мг, 0.26 ммоль) и CsCO3 (163 мг, 0.5 ммоль). Колбу вакуумировали, заполнили аргоном и добавляли PhMe (2 мл) и Pd(Ph3P)4 (12 мг, 0.01 ммоль). Смесь выдерживали 4 ч при 75°С, затем добавляли CH2Cl2 (50 мл) и промывали водой (2 × 80 мл). Органическую фазу сушили над безводным Na2SO4 и упаривали. Продукт очищали флеш-хроматографией (элюент – хлороформ).
Выходы реакций, температуры плавления и спектральные характеристики синтезированных соединений (II–V) приведены в дополнительных материалах.
ЗАКЛЮЧЕНИЕ
Синтезированы новые производные хромофора белка Kaede – (Z)-2-(4-метоксибензилиден)-6/8-фенилимидазо[1,2-a]пиридин-3(2H)-оны. Установлено, что оптические свойства этих соединений не зависят от положения фенильного заместителя в имидазопиридиноновом фрагменте, что, вероятно, объясняется неполным сопряжением с π-системой молекулы.
Новые соединения могут быть использованы в качестве флуорогенных красителей, поскольку они, как и многие производные хромофоров флуоресцентных белков, обладают слабой флуоресценцией.
Список литературы
Баранов М.С., Лукьянов К.А., Ямпольский И.В. // Биоорг. химия. 2013. Т. 39. С. 255–276. [Baranov M.S., Lukyanov K.A., Yampolsky I.V. // Russ. J. Bioorg. Chem. 2013. V. 39. P. 223–244.] https://doi.org/10.1134/S1068162013030047
Baleeva N.S., Baranov M.S. // Chem. Heterocycl. Compd. 2016. V. 52. P. 444–446. https://doi.org/10.1007/s10593-016-1909-4
Chudakov D.M., Matz M.V., Lukyanov S., Lukyanov K.A. // Physiological Rev. 2010. V. 90. P. 1103–1163. https://doi.org/10.1152/physrev.00038.2009
Chuang W.-T., Chen B.-S., Chen K.-Y., Hsieh C.-C., Chou P.-T. // Chem. Commun. 2009. V. 45. P. 6982–6984. https://doi.org/10.1039/b908542d
Feng G., Luo C., Yi H., Yuan L., Lin B., Luo X., Hu X., Wang H., Lei C., Nie Z., Yao S. // Nucl. Acids Res. 2017. V. 45 P. 10380–10392. https://doi.org/10.1093/nar/gkx803
Singh A., Rajbongshi B.K., Ramanathan G. // J. Chem. Sci. 2015. V. 127. P. 941–948. https://doi.org/10.1007/s12039-015-0855-5
Muselli M., Baudequin C., Perrio C., Hoarau C., Bischoff L. // Chem. Eur. J. 2016. V. 22. P. 5520–5524. https://doi.org/10.1002/chem.201600602
Shen B., Qian Y. // Dyes Pigm. 2019. V. 166. P. 350–356. https://doi.org/10.1016/j.dyepig.2019.03.034
Baleeva N.S., Myannik K.A., Yampolsky I.V., Baranov M.S. // Eur. J. Org. Chem. 2015. V. 26. P. 5716–5721. https://doi.org/10.1002/ejoc.201500721
Bozhanova N.G., Baranov M.S., Baleeva N.S., Gavrikov A.S., Mishin A.S. // Int. J. Mol. Sci. 2018. V. 19. P. 3778. https://doi.org/10.3390/ijms19123778
Зайцева С.О., Зайцева Э.Р., Смирнов А.Ю., Балеева Н.С., Баранов М.С. // Биоорг. химия. 2020. Т. 46. С. 106–109. [Zaitseva S.O., Zaitseva E.R., Smirnov A.Yu., Baleeva N.S., Baranov M.S. // Russ. J. Bioorg. Chem. 2020. V. 46. P. 120–123.] https://doi.org/10.1134/S1068162020010136
Myasnyanko I.N., Gavrikov A.S., Zaitseva S.O., Smirnov A.Yu., Zaitseva E.R., Sokolov A.I., Malyshevskaya K.K., Baleeva N.S., Mishin A.S., Baranov M.S. // Chem. Eur. J. 2020. V. 27. P. 3986–3990. https://doi.org/10.1002/chem.202004760
Дополнительные материалы
- скачать ESM.docx
- Приложение 1
Инструменты
Биоорганическая химия