Биоорганическая химия, 2023, T. 49, № 2, стр. 113-133
Как меняются общепринятые подходы к применению полимерсодержащих композитов в молекулярной диагностике
Д. В. Капустин *
ФГБУН “Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова” РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
* E-mail: kapustin@ibch.ru
Поступила в редакцию 28.07.2022
После доработки 10.08.2022
Принята к публикации 12.08.2022
- EDN: PDBAWW
- DOI: 10.31857/S0132342323020112
Аннотация
Известные подходы к выделению биополимеров, в частности нуклеиновых кислот (НК), из биологических проб основаны на связывании молекул с сорбентом (“позитивная селекция”) с их последующей элюцией с использованием подходящего элюента. В обзорной статье обсуждаются физико-химические процессы, положенные в основу разработки способов выделения НК из биологических образцов. Показано, что методы, включающие твердофазную селективную экстракцию (т.е. обратимую сорбцию), обеспечивают возможность миниатюризации и автоматизации соответствующих процессов. В обзоре обсуждаются преимущества альтернативного подхода к выделению НК, основанного на использовании специальных сорбентов, связывающих белки и другие компоненты биологических проб, в то время как эти сорбенты проявляют сорбционную инертность по отношению к НК (“негативная селекция”). Рассмотрены подходы к созданию таких композитных полимерсодержащих сорбентов, используемых в пробоподготовке при проведении молекулярной диагностики, и способы их эффективного применения. Продемонстрировано, что благодаря междисциплинарному подходу с использованием комплекса синтетических и аналитических методов удается объединить в качестве единого объекта исследования такие весьма разные по структуре и свойствам материалы, как наноструктурированные композиты (на основе пористых кремнеземов, синтетических мембран, стеклянных мультикапилляров), содержащие фторполимеры и полианилины. Обсуждаются результаты использования таких композитов при селективном выделении НК и/или белков из биологических образцов. Рассмотрены альтернативные области применения таких композитов в молекулярной диагностике, в частности в масс-спектрометрии. Обрисованы направления расширения области применения полимерсодержаих композитов благодаря одновременному использованию сорбционных качеств поверхности получаемых композитов и свойств молекул сорбата. Показано, что для технологичного получения таких композитов пригодны как полимерные, так и низкомолекулярные модификаторы одинаковой химической природы.
СОДЕРЖАНИЕ
ВВЕДЕНИЕ.......................................................114
СОРБЦИОННЫЕ СВОЙСТВА ФТОРПОЛИМЕР- И ПОЛИАНИЛИНСОДЕРЖАЩИХ КОМПОЗИЦИОННЫХ СОРБЕНТОВ В ОТНОШЕНИИ НУКЛЕИНОВЫХ КИСЛОТ И БЕЛКОВ...............................................114
ТЕХНОЛОГИЧНЫЕ СПОСОБЫ СИНТЕЗА ПОЛИМЕРСОДЕРЖАЩИХ КОМПОЗИТОВ ДЛЯ ВЫДЕЛЕНИЯ БИОПОЛИМЕРОВ............122
ПРИМЕНЕНИЕ FP- И PANI-СОДЕРЖАЩИХ КОМПОЗИТОВ В СОСТАВЕ БИОСЕПАРИРУЮЩИХ ЭЛЕМЕНТОВ.........126
Применение в пробоподготовке при проведении молекулярной диагностики..................................126
Другие области применения FP- и PANI- содержащих композитов.....................................127
ПРОЯВЛЯЮТ ЛИ ПОЛИМЕРНЫЕ И НИЗКОМОЛЕКУЛЯРНЫЕ МОДИФИКАТОРЫ ОДИНАКОВОЙ ПРИРОДЫ СХОДНЫЕ СОРБЦИОННЫЕ СВОЙСТВА?......................129
ЗАКЛЮЧЕНИЕ.................................................131
СПИСОК ЛИТЕРАТУРЫ.................................131
ВВЕДЕНИЕ
Большинство известных способов выделения биополимеров, в частности нуклеиновых кислот (НК), из биологических проб основано на связывании молекул с поверхностью специального сорбента (“позитивная селекция”) с их последующей элюцией с использованием подходящего элюента. В силу многостадийности соответствующих протоколов не всегда обеспечивается требуемая чистота выделяемого компонента биологической смеси, а сам процесс нередко сопровождается потерями выделяемого биополимера на каждой стадии. Тем не менее методы, основанные на твердофазной селективной экстракции (т.е. на обратимой сорбции), продолжают развиваться и совершенствоваться, поскольку обеспечивают возможность миниатюризации и автоматизации протоколов выделения.
Альтернативный подход к выделению НК, основанный на использовании специальных композитных полимерсодержащих сорбентов, связывающих белки и другие компоненты биологических проб, в то время как эти композиты проявляют сорбционную инертность по отношению к НК (“негативная селекция”), демонстрирует определенные преимущества. Прежде всего, удается выделять НК из пробы в одну стадию, за счет чего значительно сокращается продолжительность пробоподготовки. Подобранные оптимальные условия выделения обеспечивают минимизацию потерь и получение высокочистых препаратов биополимеров, непосредственно пригодных к использованию без дополнительной очистки и концентрирования.
Предлагаемая вниманию читателей обзорная статья преследует несколько взаимосвязанных целей. Прежде всего, представляется важным продемонстрировать, что благодаря междисциплинарному подходу с применением комплекса современных синтетических и аналитических методов удается объединить в качестве объекта исследования такие разные по структуре и свойствам материалы, как фторсодержащие полимеры и полианилины. В частности, речь пойдет об использовании указанных полимеров в качестве модификаторов поверхности твердых носителей при получении сорбентов, позволяющих селективно выделять НК и/или белки из биологических образцов. Во-вторых, следует показать, что благодаря использованию междисциплинарного подхода удается расширять области применения получаемых композитов за счет одновременного использования выявляемых свойств носителей, их модификаторов и молекул сорбата. И наконец, не менее интересно рассмотреть результаты недавних работ, подтверждающих, что для технологичного получения таких сорбентов пригодны как полимерные, так и низкомолекулярные модификаторы одинаковой природы.
СОРБЦИОННЫЕ СВОЙСТВА ФТОРПОЛИМЕР- И ПОЛИАНИЛИНСОДЕРЖАЩИХ КОМПОЗИЦИОННЫХ СОРБЕНТОВ В ОТНОШЕНИИ НУКЛЕИНОВЫХ КИСЛОТ И БЕЛКОВ
Методы выделения и очистки НК и белков весьма разнообразны, поскольку реализуются с применением различных сорбентов, водных, органических и смешанных сред, хаотропных агентов, ферментов, поверхностно-активных веществ и т.д. Некоторые методы отличаются простотой и выполняются вручную, реализация других требует применения сложного оборудования. Такие методы основаны на известных физико-химических процессах, включающих экстракцию выделяемого компонента [1–3] или его осаждение (физическое осаждение или хемосорбцию) [1, 4, 5]. Отдельную группу представляют способы выделения биополимеров из смеси водных полимерных растворов, т.е. в двухфазной системе [6]. При разделении смесей белков и/или НК также нередко используют хроматографические методы, основанные на различиях в скоростях перемещения молекул в системе несмешивающихся и движущихся относительно друг друга фаз [7, 8]. Эти методы реализуются благодаря различной растворимости НК, белков и полисахаридов, а также их различному сродству с поверхностью используемого сорбента.
Как правило, методы выделения НК с использованием сорбентов многостадийны и, как следствие, трудоемки и времязатратны. Дело в том, что эти методы основаны на концепции “улавливания” и удерживания выделяемой НК сорбентом из смеси на первом этапе выделения. Вслед за этим необходимо удалить примеси, а затем элюировать выделяемый компонент с поверхности или из объема частиц сорбента. Таким образом, подобные системы выделения основаны на реализации эффекта “позитивной селекции” в отношении выделяемой НК, что определяет многостадийность процесса выделения и неизбежные потери выделяемой НК на каждой стадии. При выделении НК из биологических образцов чаще всего используют твердые носители, селективно и обратимо удерживающие НК, такие как нативные или химически модифицированные кремнеземы, стекла, полимерные монолиты, а также композитные мембраны.
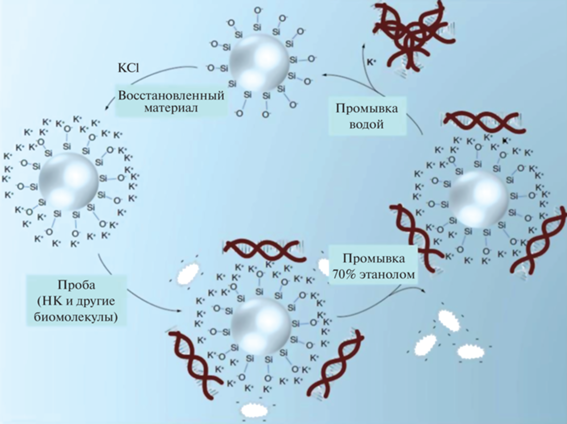
Принцип “позитивной селекции”, положенный в основу классического способа выделения НК из биологических образцов, базируется на специфическом взаимодействии молекул НК с поверхностью частиц кремнезема в присутствии хаотропной соли при щелочных значениях рН [1, 9]. В этих условиях происходит денатурация большинства биомолекул за исключением молекул ДНК, которые устойчивы к денатурации и эффективно связываются с положительно заряженной поверхностью кремнезема. Образовавшийся комплекс “ДНК–кремнезем” отмывают от несвязавшихся примесей, а очищенную ДНК элюируют с сорбента буферным раствором с низким содержанием солей или водой [10] (рис. 1). Такой многостадийный механизм выделения НК обеспечивает всего 40–50%-ный выход ДНК [11].
Не вдаваясь в детали проблем, связанных с получением и применением перечисленных носителей и сорбентов, следует отметить, что существует необходимость в разработке альтернативных технологий, позволяющих получать композитные материалы, демонстрирующие эффект “негативной селекции” в отношении НК. Использование таких материалов должно обеспечивать реализацию принципиально более простой одностадийной схемы выделения целевого компонента смеси (НК), в результате чего выделяемый (и одновременно очищаемый) биополимер после контакта биологического образца с сорбентом, не удерживаясь, выходит в исключенном объеме (“негативная селекция”), а прочие компоненты (примеси) удерживаются сорбентом (“позитивная селекция”). Понятия “негативная селекция” и “позитивная селекция” в данном контексте впервые были введены в работе Yagudaeva et al. [12].
Принципиальное различие в принципах выделения НК на основе “позитивной” и “негативной селекции” наглядно выявляется уже при сравнении соответствующих схем, представленных в литературе [13, 14] (рис. 2).
В известных работах проблемы получения композитов для выделения НК решены с использованием междисциплинарного подхода с комплексным применением химико-технологических, физико-химических и молекулярно-биологических методов. Разработан ряд технологий, обеспечивающих формирование нанотолщинных покрытий фтор- и анилинсодержащих полимеров на поверхности твердых носителей различной природы. Также разработаны специальные биосепарирующие элементы, включающие полученные сорбенты, и соответствующие протоколы пробоподготовки, обеспечивающие достижение заданных параметров выделения НК из биологических источников. Наиболее интересные свойства таких материалов и особенности методик, в которых они используются, рассмотрены ниже.
Еще в 1978–1980 гг. Hjerten показал, что перфторполимеры обладают уникальной способностью обратимо сорбировать белковые молекулы, но при этом не удерживать (или слабо удерживать) НК [15, 16]. Позже был разработан ряд кремнеземных сорбентов, модифицированных нанопокрытиями политетрафторэтилена (PTFE), демонстрирующих обнаруженный эффект, и применяемых, например, в качестве эффективных гемосорбентов [17, 18]. Эти материалы получали методом радиационной постполимеризации тетрафторэтилена в присутствии частиц объемно-пористого кремнезема [19]. Повсеместное применение таких материалов ограничено сложностью технологии их получения (ввиду необходимости использования источника γ-излучения, вакуумной и криогенной техники, а также поддержания строго определенных условий синтеза).
Также было известно, что в результате полимеризации анилина в присутствии твердых подложек на их поверхности формируются устойчивые полианилиновые (PANI) покрытия, селективные в отношении сорбции различных заряженных ионов и молекул. Однако первые работы по применению PANI-модифицированных материалов для разделения компонентов смесей биополимеров стали появляться только с начала 2000-х гг. [20].
Эффект “негативной селекции” в отношении НК неоднократно проиллюстрирован результатами использования ВЭЖХ-колонок с PTFE- и PANI-содержащими кремнеземными сорбентами при разделении смеси плазмиды pBR322 из Escherichia coli, РНК и сопутствующих белков [21, 22]. Молекулы ДНК с PTFE-колонки выходили в первой фракции в исключенном объеме, молекулы РНК слабо удерживались, но также элюировались в составе второй фракции в изократическом режиме. Аналогичный результат достигался при использовании PANI-модифицированного кремнезема. Различия в сорбционном поведении PTFE- и PANI-содержащих сорбентов были выявлены при десорбции удерживаемых сорбентами белков. Удерживаемые молекулы белков полностью десорбировались с PTFE-колонки в обращенно-фазовом режиме по мере увеличения концентрации органического растворителя. Скорость элюирования белков зависела от их гидрофобности. Напротив, удерживаемые PANI-покрытием молекулы белков выходили с колонки в условиях понижающегося градиента рН в зависимости от значения их изоэлектрической точки (pI), но не от молекулярной массы или гидрофобности.
Недавно Капустин и Зубов с соавт. [12, 23, 24] провели сравнительное исследование сорбционных свойств ряда полиарамидов и PANI (нанесенных на поверхность объемно-пористых кремнеземов или стеклянных пластин) в отношении НК и белков, полагая, что эффект “негативной селекции” в отношении НК может проявляться при использовании не только перфторированных, но также частично фторированных и не содержащих фтор полимеров, например, PANI, а возможно, и других синтетических полимеров.
Поскольку на сорбционные свойства сорбента могут влиять как химическая структура макромолекул поверхностного слоя, так и особенности его поверхностной морфологии, эти факторы оценивали по отдельности. Статическую сорбцию биополимеров (НК и белков) изучали с использованием компактных спин-картриджей, содержащих исследуемые модельные сорбенты, что обеспечивало низкий расход сорбента (60–150 мг на картридж) и быструю (3–5 мин) биосепарацию (в отличие от методов традиционной колоночной хроматографии), осуществляемую при центрифугировании картриджей (0.24 g × 1000, 1 мин). Изучая механизмы сорбции биополимеров на полученных материалах и отвечая на вопрос, присущи ли сорбционные свойства перфторполимеров другим классам полимеров, исследовали свойства кремнеземов, модифицированных полиарамидами, содержащими набор таких “ключевых” элементов, как ароматический азот, фтор, а также донорные и акцепторные фрагменты. При исследовании динамической сорбции биополимеров в режиме реального времени аналогичные полимерные покрытия наносили методом spin-coating на плоские стеклянные подложки. Свойства полученных покрытий сравнивали со свойствами PTFE-, фторопласт- (FP-) и PANI-содержащих сорбентов. Полиарамиды наносили на поверхность стеклянных пластин из их растворов в тетрагидрофуране, фторопласт-42Л (FP) – из его раствора в ацетоне. PANI-покрытия получали методом окислительной осадительной полимеризации анилина на поверхности стеклянных пластин.
Морфологию поверхности покрытий, нанесенных на стеклянные пластины, исследовали методом сканирующей зондовой микроскопии. Оказалось, что покрытия неравномерны по толщине, а некоторые имеют сквозные или несквозные поры. По сравнению с полиарамидными покрытиями, FP- и PANI-покрытия имели относительно ровную поверхность без сквозных пор. Поверхность покрытий, получаемых химическими методами, оказалась значительно более гладкой по сравнению с покрытиями, полученными методом “кастинга”.
Для подтверждения соответствия реальной химической структуры поверхностных слоев получаемых полимерных нанопокрытий их ожидаемому химическому составу покрытия исследовали методом рентгеновской фотоэлектронной спектроскопии. Установлено, что для всех образцов теоретически рассчитанные и экспериментально определенные атомные доли C, N, S и F совпадают, различаясь в пределах ошибки метода. Эти данные подтвердили, что химические структуры поверхностных слоев соответствуют брутто-формулам использованных модификаторов, а полученные полимерные покрытия пригодны для сравнительного исследования сорбционных свойств в зависимости от химической структуры полимерного модификатора.
В результате определения ξ-потенциалов поверхности частиц полученных сорбентов оказалось, что все исследованные полиарамидсодержащие материалы имели слабый положительный заряд (1.5–5 мВ), несколько более сильный у FP-материала (10 мВ) и у PANI-содержащих сорбентов (30 ± 2 мВ), что предполагало наличие у последних слабо выраженных ионообменных свойств.
Очевидно, что сорбция растворенного вещества на поверхности может происходить в статических или динамических условиях. В результате статической сорбции растворенные в неподвижной жидкой фазе молекулы удерживаются неподвижным слоем частиц сорбента. Статическая сорбционная активность сорбента характеризуется количеством удерживаемого вещества на единицу массы сорбента к моменту достижения равновесия при постоянной температуре. При динамической сорбции молекулы удерживаются при пропускании жидкой фазы (раствора биополимера) над исследуемой полимерной поверхностью. Динамическую сорбционную активность покрытия в первом приближении характеризуют временем насыщения формируемого адсорбционного слоя, скорость формирования и толщина которого зависят от свойств поверхности и от природы сорбата.
В цитируемых работах [12, 23, 24] cтатическую сорбцию биополимеров на полимерсодержащих кремнеземах исследовали, нанося на картридж с модельным сорбентом аликвоту раствора биополимера или бактериального лизата (использовали клетки E. coli и Agrobacterium tumefaciens C58). Характеристики исследуемых биополимеров представлены в табл. 1. Отобранные элюаты анализировали спектрофотометрически, электрофоретически и методом ПЦР. Эффект “негативной селекции” в отношении двухнитевой ДНК (днДНК) отмечен для всех материалов, хотя между ними наблюдали определенные различия. Так, в группе полиарамидсодержащих сорбентов выход днДНК в элюатах различался между отдельными образцами (до 15%), а максимальное значение (75% от количества в исходном растворе) отмечено для материалов, одновременно включающих трифторметильные и электроноакцепторные группы.
Таблица 1.
Некоторые характеристики использованных биополимеров
| Биополимер | Молекулярная масса, кДа | pI |
|---|---|---|
| BSA | ∼66.5 | 4.8 |
| Пепсин | ∼34.6 | 2.2 |
| Лизоцим | ∼14.4 | 11.3 |
| Цитохром С | ∼12 | 10.6 |
| тРНК из пекарских дрожжей, тип X | ∼25 | – |
| ДНК-линейка: смесь фрагментов 75–20 000 п.н. | 52–13 800* | – |
| днДНК из E. coli | ∼2760 (4000 п.н.)* | – |
| днДНК из Agrobacterium tumefaciens C58 | ∼13 800 (20 000 п.н.)* | – |
Высокий выход днДНК (80%) наблюдали при использовании FP-PANI-сорбента. Увеличить выход днДНК до 99.9% удавалось, нанося НК-содержащий раствор на предварительно смоченный водой слой сорбента. Напротив, выход днДНК с FP-материала оказался на 6–18% ниже, чем со всех остальных образцов. Таким образом, выход днДНК достаточно высок при использовании некоторых полиарамидов, но ниже, чем при использовании PANI-содержащих сорбентов, что, тем не менее, подтверждает наличие эффекта “негативной селекции” в отношении днДНК. РНК, имеющая в своей структуре как двухнитевые, так и однонитевые последовательности, удерживалась всеми исследованными сорбентами значительно сильнее, чем днДНК (70–93% – полиарамидсодержащими материалами, >95% – PANI- и FP-PANI-сорбентами, 98% – PTFE-содержащим материалом). Важно, что при использовании PANI- и FP-PANI-сорбентов удавалось элюировать до 90% удержанной РНК водой или нейтральным буферным раствором.
В работах [12, 23, 24] также показано, что выход удерживаемой ДНК зависит как от химической структуры полимерного модификатора, так и от третичной структуры сорбата, но не от его молекулярной массы (пропорциональной длине цепи макромолекулы, а следовательно, числу возможных точечных контактов с поверхностью сорбента), что служит доказательством отсутствия значимого сорбционного взаимодействия ДНК-молекул с исследуемыми полимерными поверхностями. Наиболее высокую степень очистки ДНК от РНК обеспечивали перфторполимер- и PANI-модифицированные сорбенты (содержание ДНК в элюате более чем в 15 раз превышало содержание РНК, а в случае PTFE-материала – более чем в 30 раз).
Все исследованные сорбенты удерживали белки (65–85% от нанесенного количества). Было установлено, что сорбционная емкость полиарамидсодержащих материалов (за исключением материала, содержащего трифторметильные группы) слабо зависит как от молекулярной массы, так и от pI белка, однако при использовании PANI-содержащих материалов сорбционная емкость заметно росла с увеличением основности (pI) белка. Наиболее близкие сорбционные свойства по отношению к биополимерам проявляли полиарамиды с электроноакцепторными (сульфонильными) группами и PANI-содержащие материалы. Таким образом, введение в структуру полимерного модификатора функциональных групп, незначительно, на первый взгляд, изменяющих суммарный химический состав, оказывает заметное влияние на сорбционные свойства получаемых полимерных покрытий.
Степень очистки ДНК, выделенной из бактериальных лизатов с помощью PANI-содержащих сорбентов, обеспечивала возможность ее непосредственного использования в ПЦР.
Динамическую сорбцию НК и белков на исследуемых покрытиях в реальном времени изучали методом спектрально-корреляционной интерферометрии (СКИ) [25, 26]. Над поверхностью тонкой стеклянной пластины с нанесенным покрытием исследуемого полимера пропускали растворы биополимеров, измеряя интерференцию между опорным лучом, отраженным от нижней поверхности пластины, и лучом, отраженным от поверхности раздела “адсорбционный слой – вода”. Изменение толщины адсорбированного слоя фиксировали в пикометровом диапазоне.
Исследовали сорбцию днДНК и белков, различающихся значениями pI (BSA, лизоцима и пепсина) в натрий-фосфатном буфере, рН 7.2. Растворы (или смеси) пропускали до “насыщения” сигнала, затем систему промывали чистым буферным раствором. При пропускании раствора ДНК над поверхностью PANI-модифицированной пластины адсорбционный слой не образовывался, что совпадало с результатами исследований удерживания ДНК в режиме статической сорбции. Поскольку сорбционная емкость PANI-покрытия зависит от pH среды, авторы ожидали, что в нейтральных средах белки с более высокими значениями pI будут сильнее удерживаться на PANI-поверхности, что и подтвердилось экспериментально. Макромолекулы пепсина (pI 2.2) в среде с рН 7.2 не образовывали адсорбционного слоя. В случае BSA и лизоцима на PANI-поверхности формировался устойчивый адсорбционный слой, сохранявшийся после прекращения подачи раствора белка и разрушавшийся только в результате заметного понижения рН среды. Устойчивый слой молекул белка, который удерживался на поверхности полимера при промывке буферным раствором с нейтральным pH, формировался только на PANI-покрытии. Сравнение данных по статической и динамической сорбции белков показало, что кислый белок пепсин удерживается объемно-пористыми сорбентами, в то время как при использовании метода СКИ адсорбционный слой пепсина на всех тестируемых поверхностях не образуется. Авторы предположили, что пепсин удерживается в порах, наличие которых подтверждено для всех исследованных образцов, что в целом усиливает способность разработанных композитов удерживать суммарную белковую фракцию при очистке ДНК от белков.
Полученные в работах [12, 23, 24] данные для наглядности сведены в табл. 2. Проанализировав эти данные, авторы заключили, что сорбционные свойства исследованных материалов определяются суммарным вкладом различных механизмов сорбции, происходящей в результате гидрофобных, диполь-дипольных взаимодействий и обратимого образования водородных связей. Тот факт, что все материалы практически не удерживают отрицательно заряженную гидрофильную днДНК и одновременно более эффективно сорбируют РНК, содержащую гидрофобные участки, указывает на роль гидрофобных взаимодействий между поверхностью сорбента и молекулами сорбата. Присутствие в структуре полиарамидов и PANI полярных групп и слабый положительный заряд поверхности соответствующих полимерных покрытий указывают на то, что соответствующие материалы должны обладать анионообменными свойствами. Вместе с тем эти сорбенты (как и фторполимерсодержащие материалы) крайне слабо удерживают молекулы днДНК. По-видимому, ионообменные свойства этих сорбентов выражены слабо не только за счет стерических затруднений, но также за счет делокализации положительных зарядов по макромолекуле или даже между несколькими макромолекулами в составе покрытия [27] и препятствует образованию устойчивой ионной связи, требующей локализации и достаточного сближения противоположных зарядов на соответствующих атомах сорбента и сорбата. Поэтому молекулы днДНК, дополнительно стабилизированные многочисленными водородными связями внутри двухнитевой структуры, на таких поверхностях не удерживаются, а макромолекулы белков, имеющие локализованные заряды на экспонированных в водной среде боковых группах, удерживаются в различной степени в зависимости от значения их pI.
Таблица 2.
Характеристики покрытий и сорбционные свойства исследованных сорбентов
| Модификатор | PA1 | PA7 | PA8 | PA11 | PTFE | FP | PANI | FP-PANI |
|---|---|---|---|---|---|---|---|---|
| Характеристики полимерного покрытия | ||||||||
| ξ-Потенциал, мВ | 2.1 ± 0.6 | 2.3 ± 0.5 | 1.6 ± 0.3 | 5.3 ± 0.9 | Н/о | 10.2 ± 0.6 | 32.0 ± 5.0 | 30.4 ± 1.0 |
| Максимальная толщина покрытия, нм | 1321.4 | 316.8 | 341.2 | 55.2 | Н/о | 405.3 | 319.4 | 1016.7 |
| Наличие сквозных пор в покрытии* | +/–
 |
+/– |
+ |
–
 |
Н/о | –
 |
–
 |
– |
| Удерживание биополимеров | ||||||||
| Выход ДНК, % | 74.0 ± 0.5 | 75.0 ± 0.5 | 60.0 ± 0.5 | 63.0 ± 0.5 | 67.0 ± 0.5 | 65.0 ± 0.4 | 71.0 ± 0.5 | 80.0 ± 0.8 |
| Выход РНК, % | 30.0 ± 0.3 | 30.0 ± 0.3 | 7.0 ± 0.2 | 15.0 ± 0.2 | 2.0 ± 0.1 | 7.0 ± 0.2 | 4.0 ± 0.1 | 5.0 ± 0.15 |
| Емкость по белку, мг/г сорбента | ||||||||
| BSA | 8.0 ± 0.2 | 8.0 ± 0.1 | 7.0 ± 0.1 | 7.0 ± 0.1 | 8.0 ± 0.2 | 7.0 ± 0.1 | 7.0 ± 0.1 | 7.0 ± 0.16 |
| Пепсин | 7.0 ± 0.1 | 6.5 ± 0.1 | 7.0 ± 0.1 | 7.0 ± 0.1 | 7.5 ± 0.1 | 7.0 ± 0.1 | 6.0 ± 0.1 | 6.0 ± 0.13 |
| Цитохром С | 8.0 ± 0.2 | 8.5 ± 0.1 | 7.5 ± 0.2 | 7.5 ± 0.1 | 8.0 ± 0.1 | 8.0 ± 0.2 | 9.0 ± 0.2 | 9.0 ± 0.21 |
| Лизоцим | 8.0 ± 0.2 | 8.4 ± 0.1 | 7.3 ± 0.2 | 7.5 ± 0.1 | 8.0 ± 0.2 | 8.0 ± 0.1 | 8.5 ± 0.2 | 9.0 ± 0.20 |
| Отношение выходов ДНК/РНК | 2.5 | 2.5 | 8.6 | 4.2 | 33.5 | 9.3 | 17.8 | 16.0 |
| А260/А280 (смесь ДНК + BSA)** |
1.5 | 1.7 | 1.2 | 1.2 | 1.5 | 1.1 | 1.4 | 1.9 |
| Характеристики динамической сорбции биополимеров | ||||||||
| Продолжительность насыщения адсорбционного слоя, мин | ||||||||
| BSA | 2.0 ± 0.2 | 3.0 ± 0.2 | 2.0 ± 0.2 | 3.0 ± 0.2 | Н/о | Н/о | 0.8 ± 0.1 | Н/о |
| Лизоцим | 7.0 ± 0.3 | 2.0 ± 0.2 | 4.0 ± 0.2 | 3.0 ± 0.2 | Н/о | Н/о | 0.8 ± 0.1 | Н/о |
| Пепсин | – | – | – | – | Н/о | Н/о | – | Н/о |
| днДНК | – | – | – | – | Н/о | Н/о | – | Н/о |
| Толщина адсорбционного слоя, нм | ||||||||
| BSA | 1.0 ± 0.1 | 1.5 ± 0.2 | 1.4 ± 0.2 | 2.1 ± 0.2 | Н/о | Н/о | 1.7 ± 0.2 | Н/о |
| Лизоцим | 0.2 ± 0.1 | 0.2 ± 0.1 | 1.3 ± 0.2 | 2.5 ± 0.2 | Н/о | Н/о | 2.1 ± 0.2 | Н/о |
| Пепсин | – | – | – | – | Н/о | Н/о | – | Н/о |
| днДНК | – | – | – | – | Н/о | Н/о | – | Н/о |
Наиболее вероятный вклад в сорбционные свойства фторполимерсодержащих сорбентов обусловлен преимущественно гидрофобными взаимодействиями. Белковая фракция сорбируется из водной среды на неполярной поверхности фторполимера, характеризующейся низкой поверхностной энергией, в то время как отрицательно заряженные в широком диапазоне рН молекулы днДНК не удерживаются. РНК удерживается слабо и затем может быть элюирована в изократическом режиме.
Существенный вклад в механизм обратимой сорбции белков на PANI-поверхности, по-видимому, также вносит способность молекулы PANI к образованию водородных связей между атомом водорода вторичной аминогруппы и акцепторами водородной связи в молекуле белка.
Таким образом, одновременное проявление эффектов “негативной селекции” в отношении НК и “позитивной селекции” в отношении белков свойственно широкому кругу полимеров, имеющих в своей структуре атомы фтора и/или азота. Полиарамиды оказались удачной моделью для изучения сорбционных свойств фторсодержащих полимеров и PANI, но их применение в качестве эффективных сорбентов для выделения НК нецелесообразно. По сравнению с ними FP- и PANI-сорбенты обеспечивают максимальный выход днДНК за счет “негативной селекции”, эффективнее связывают РНК и белки, что делает такие композиты перспективными материалами для одностадийного выделения очищенных препаратов НК из биологических смесей.
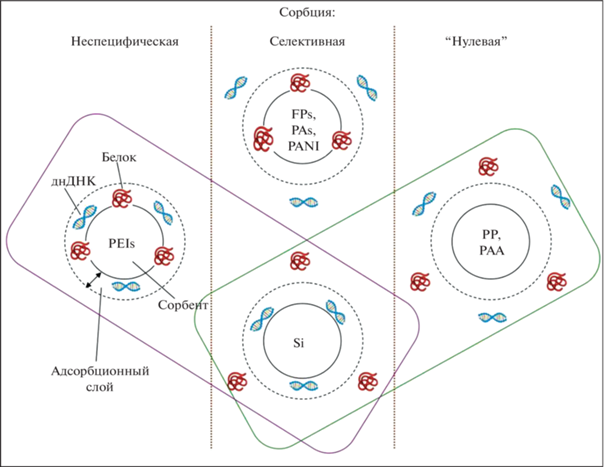
В отличие от сорбционных материалов, в определенных условиях удерживающих НК (таких как, например, полиэтиленимин или кремнеземы) и не связывающих белки (например, кремнеземы, полипропилен или полиакриламид), композиты, модифицированные FPs, PANI и некоторыми полиарамидами, ведут себя противоположным образом (рис. 3). Подбирая соответствующий полимерный модификатор, можно решать конкретные задачи по селективному выделению биополимеров из сложных смесей, используя “нулевую” сорбционную способность к удерживанию ДНК и способность к обратимой сорбции белков в зависимости от значения их pI. Количественные параметры сорбции при этом зависят как от химической структуры полимерного покрытия в составе сорбента, так и от природы молекул сорбата и в значительно меньшей степени – от морфологии поверхности сорбента.
Рис. 3.
Возможные типы сорбции НК и белков на различных материалах: PEIs – полиэтиленимины, FPs – фторполимеры, PAs – полиарамиды, PANI – полианилины, PP – полипропилен, PAA – полиакриламид, Si – кремнезем [14].
ТЕХНОЛОГИЧНЫЕ СПОСОБЫ СИНТЕЗА ПОЛИМЕРСОДЕРЖАЩИХ КОМПОЗИТОВ ДЛЯ ВЫДЕЛЕНИЯ БИОПОЛИМЕРОВ
Ни PTFE, ни PANI не обладают удовлетворительными механическими и технологическими свойствами, позволяющими изготовить из них качественные пористые сорбенты. Решение этой проблемы заключается в создании композиционных сорбентов – материалов на основе твердых носителей, модифицированных нанослоями соответствующих полимеров (рис. 4). Полимерное покрытие должно быть тонким и равномерно распределенным по поверхности носителя, обеспечивая снижение неспецифической сорбции и повышение химической стабильности композиционного сорбента. При этом значения внутреннего диаметра и объема пор носителя не должны значительно уменьшаться.
Рис. 4.
Морфология композиционных полимерсодержащих сорбентов [21]: (а) – неактивированный носитель, (б) – носитель с активированной поверхностью.

Предложенный подход состоит в формировании сплошных равномерно распределенных полимерных нанослоев (толщиной 2–10 нм) требуемой химической структуры на поверхность твердых матриц с получением нанокомпозитного материала, поверхность которого, контактирующая с биологическими молекулами или частицами, будет вести себя как соответствующий полимер, а жесткость и морфология (пористость и удельный объем носителя) определяются свойствами исходной матрицы. В качестве носителей могут использоваться объемно-пористые частицы, синтетические мембраны, капилляры и др. (в зависимости от назначения получаемого композита). Прямой синтез таких нанокомпозитов предполагает, что реакции синтеза макромолекул будут сопровождаться образованием однородных полимерных нанопокрытий, прочно связанных с поверхностью носителя, в том числе с внутренней поверхностью пор [22].
Чтобы синтезировать такой композит, желательно предварительно тем или иным способом активировать поверхность носителя. Структура получаемого материала по сравнению с морфологически менее совершенным композитом того же брутто-состава схематически представлена на рис. 4 на примере объемно-пористой дисперсной частицы. В результате использования неактивированного носителя (рис. 4а) нередко получают неоднородное и неравномерно распределенное по поверхности носителя покрытие (с полимерными “пробками” в просветах пор и с непокрытыми участками), что снижает селективность сорбции, химическую стойкость материала подложки и усиливает нежелательную неспецифическую сорбцию. Напротив, можно ожидать, что использование носителя с активированной поверхностью (рис. 4б) позволит получать химически стойкие высокоселективные композиты с низким уровнем неспецифической сорбции, высокой удельной площадью поверхности и однородным распределением поверхностных функциональных групп, что обеспечит интенсификацию поверхностных сорбционных и/или химических процессов.
Таким образом, наряду с решением “обычных” химических задач, сопровождающих синтез макромолекул, при получении композитов следует обеспечить выполнение дополнительных условий: 1) локализовать реакцию на поверхности носителя (по возможности избегая протекания реакции в объеме реакционной смеси); 2) контролировать толщину (на нанометровом уровне) и морфологию (обеспечивая получение бездефектного слоя) полимерного покрытия; 3) стремиться к разработке “универсального” воспроизводимого метода синтеза, пригодного для химически различных систем. В рамках соответствующих исследований также предполагалось показать, что из одной “базовой” матрицы возможно получать широкий набор композитов с различным гидрофильно-липофильным балансом, с различными ионогенными группами, а также материалов, содержащих иммобилизованные биолиганды [22, 28].
В работах [28–33] подробно рассмотрены разработанные подходы к получению серии FP- и PANI-содержащих композитов, демонстрирующих эффект “негативной селекции” в отношении НК. Не останавливаясь на деталях, представленных в этих работах, следует отметить, что разработанные подходы к получению композитов со стойкими нанотолщинными полимерными покрытиями удобно формально подразделить на две группы. К первой группе относятся способы, в которых композит с полимерным нанопокрытием получали в результате полимеризации мономера в присутствии неактивированного носителя. К этой группе также следует отнести способы, в которых слой готового прекурсора (олигомера или полимера) предварительно наносили на поверхность носителя методом “кастинга”, а затем прекурсор иммобилизовали на поверхности носителя за счет химического отверждения (в том числе в результате полимераналогичных превращений).
В качестве соответствующих примеров следует привести способы получения PANI-содержащих композитов путем химического осаждения полимерного нанопокрытия [20]. Процесс отличается наличием индукционного периода, автокаталитическим характером и нередко сопровождается завершением реакции до полного исчерпания мономера. При этом важно получить первый слой PANI, а образование последующих слоев будет катализироваться предыдущими слоями. В присутствии кремнеземной поверхности полимеризация параллельно протекает на поверхности и в объеме реакционной смеси, и до 60% мономера расходуется на образование взвеси полимерных частиц в объеме реакционной смеси. Эти частицы оседают на поверхность PANI-модифицированного носителя, слабо удерживаясь на ней и загрязняя сорбент (особенно поверхность пор), что весьма существенно усложняет процедуру отмывки материала. Напротив, при использовании поверхностей, представляющих собой поликислоты, мономер расходуется преимущественно на образование PANI-покрытия, а не взвеси полимерных частиц в объеме реакционной среды. Таким образом, существует по крайней мере один путь для локализации процесса формирования PANI-покрытия на поверхности носителя – использование носителей с кислотными поверхностными группами.
В качестве другого примера можно привести способы получения композиционных полимерсодержащих сорбентов методом “кастинга” с ультразвуковой обработкой для улучшения равномерности распределения покрытий на объемно-пористых носителях. Так, в работе Капустина с соавт. [30] описано получение полифторбутадиенсодержащего сорбента методом “кастинга” с последующим фторированием. На первом этапе получали прекурсор – кремнеземный материал с олигобутадиеновым покрытием, который затем обрабатывали in situ парами XeF2 в атмосфере аргона в режиме псевдоожижения. Фторирование сопровождалось химическим структурированием полимера за счет рекомбинации макрорадикалов и взаимодействия радикалов с кратными связями с образованием поперечно-сшитого фторированного полимерного покрытия. Благодаря замещению атомов водорода атомами фтора модифицировались поверхностные свойства полимерного покрытия (без изменения его объемных свойств). Использование XeF2 в качестве фторирующего агента значительно упростило технологию фторирования по сравнению с обработкой смесью фтора с азотом.
Вторая группа методов включает способы синтеза композитов, основанные на локализации процесса полимеризации на активированной поверхности носителя, т.е. когда полимеризация инициируется определенными поверхностными функциональными группами в составе носителя и протекает на его поверхности. В качестве примера такого подхода можно привести способ получения PANI-содержащих сорбентов на основе кремнеземов, модифицированных сульфированным сополимером стирола с дивинилбензолом. При окислительной полимеризации анилина на первой стадии образуется катион-радикал анилиния. Yagudaeva et al. [32] предполагали, что эффективными матрицами, одновременно обеспечивающими протонирование анилина и локализацию процесса полимеризации на поверхности носителя, могут служить твердые нерастворимые поликислоты (кислые катионообменники). Для получения такой матрицы поверхность кремнезема сначала модифицировали политетрафторэтиленом методом пострадиационной прививочной полимеризации. На полученное покрытие методом пострадиационной блоксополимеризации прививали сополимер стирола с дивинилбензолом (PSt-DVB). Затем полученный PSt-DVB-кремнезем сульфировали разбавленной серной кислотой, варьируя продолжительность обработки. В результате получали материалы с различным содержанием поверхностных сульфогрупп. При полимеризации анилина на поверхности таких носителей практически отсутствовал индукционный период полимеризации. Образование частиц PANI в объеме реакционной системы не наблюдали, конверсия мономера повышалась пропорционально увеличению содержания поверхностных сульфогрупп.
Локализовать процесс формирования PANI-покрытия на поверхности носителя также удалось в результате проведения матричной полимеризации, протекающей с образованием полимерных комплексов, состоящих из растворенных макромолекул “матрицы” и синтезируемого на них PANI. В отличие от осадительной полимеризации анилина в присутствии низкомолекулярной кислоты, в процессе матричной полимеризации система остается фазово-гомогенной. Поликомплексы проявляют свойства, отличные от свойств образующих их полимеров. Этот принцип был положен в основу получения новых композитов, в которых предварительно силаминированный 3‑аминопропилтриэтоксисиланом кремнезем модифицировали продуктами матричной окислительной полимеризации анилина на ароматических полисульфокислотах (PSAs), в частности с использованием поли(п,п'-(2,2'-дисульфокислоты)дифениленизофталамида (изо-PSA). Проводили модификацию силаминированного стекла готовыми комплексами изо-PSA–PANI либо полимеризовали анилин в присутствии силаминированного стекла, предварительно покрытого изо-PSA. PSA полностью сорбируется на силаминированном кремнеземе. При соотношении изо‑PSA : анилин, равном 1 : 1 (исходя из числа звеньев в цепи PSA), наблюдали максимально достижимую конверсию анилина [33].
Использование интерполимерных комплексов изо-PSA–PANI в качестве модификаторов облегчает масштабирование технологии благодаря стойкости модификатора при хранении (в виде раствора или порошка). Полученные в форме порошка комплексы не растворяются в органических растворителях (кроме TGF и DMFA), однако хорошо растворимы в воде. Такие комплексы можно использовать по мере необходимости для приготовления водных растворов требуемой концентрации (в зависимости от пористости используемого носителя и от желаемой толщины полимерного покрытия), применяемых в качестве полимерного реагента для модифицирования поверхности силаминированных кремнеземов.
Еще один способ синтеза композитов основан на проведении озон-индуцированной полимеризации на поверхности твердых носителей. Kapustin et al. [34] подтвердили, что поверхность кремнеземного носителя может быть активирована в результате обработки озоном с образованием активных центров различной природы. Кремнезем (диоксид кремния) не реагирует с озоном, однако кремнеземы, как правило, содержат примеси оксидов железа или алюминия (0.5–3.5 мас. %), которые под действием озона образуют ион-радикальные и/или пероксидные группы, способные инициировать полимеризацию различных мономеров. Присутствие таких групп подтверждается спектрами ПМР [35]. Активированный озоном кремнезем можно использовать в качестве гетерогенного инициатора полимеризации мономеров, полимеризующихся по различным механизмам (фтормономеры, анилин, стирол и др.). Обработку носителя озоново-воздушной смесью (вместо чистого кислорода) в течение 1–4 ч и последующую (со)полимеризацию мономеров на активированной поверхности носителя проводили на специальной установке с озонатором. Получены сорбенты, модифицированные PTFE (с использованием образующихся поверхностных радикалов без добавления инициатора) и PANI (с использованием поверхностных пероксидов без добавления окислителя). В систему дополнительно вводили гексафторпропилен (HFP) во избежание образования концевых заряженных кислородсодержащих групп с целью уменьшения неспецифической сорбции биополимеров либо аллиламин (ААm) или аллиловый спирт (АAl) с целью введения дополнительных функциональных групп для повышения гидрофильности поверхности и селективности получаемых материалов в процессах разделения смесей одно- и двухнитевых НК. Сомономеры вводили одновременно с тетрафторэтиленом (TFE) в режиме постполимеризации либо после исчерпания TFE на первом этапе, обеспечивая повышенное содержание поверхностных амино- или гидроксигрупп соответственно. Озонированный кремнезем также оказался эффективен в качестве гетерогенного инициатора окислительной полимеризации анилина в отсутствие низкомолекулярного окислителя. В этом случае PANI-покрытие образуется на поверхности частиц носителя, а взвесь полимерных частиц в реакционном объеме отсутствует.
С помощью такого подхода удалось разработать относительно безопасный и воспроизводимый способ получения PANI- и FP-содержащих композитов с дополнительными функциональными группами на поверхности.
Следует также рассмотреть способы получения PANI-содержащих сорбентов на основе гидрофобизованного носителя. Поскольку на стадии индукционного периода при полимеризации анилина образуются гидрофобные феназинсодержащие олигомерные продукты, разумно предположить, что синтез PANI можно локализовать на поверхности гидрофобизованной матрицы, например, покрытого фторполимером кремнезема. В работе Kapustin et al. [36] кремнезем обрабатывали раствором фторопласта-42Л (FP), после удаления растворителя на поверхности носителя получали нанотолщинное гидрофобное FP-покрытие. При полимеризации анилина в присутствии полученного носителя, низкомолекулярной кислоты и окислителя образующиеся гидрофобные олигомеры прочно сорбировались на гидрофобизованной поверхности, служащей в данном случае “матрицей”, удерживающей растущие макромолекулы PANI. Полученный технологический эффект определялся тем, что локализация полимеризации анилина на поверхности носителя достигалась в отсутствие сомодификаторов PANI и без предварительной химической активации поверхности носителя. Кроме того, отпала необходимость в обработке полученного материала водным аммиаком для предотвращения образования взвеси полимерных частиц в реакционном объеме, что необходимо при синтезе PANI-содержащих композитов в присутствии неактивированных носителей. Морфологические характеристики всех полученных материалов получали с использованием ртутной порометрии, сравнивая их стойкость в условиях щелочного гидролиза с немодифицированными носителями.
В литературе также описаны способы получения PANI-содержащих композитов на основе некремнеземных носителей. При формировании PANI-покрытий на неорганических или органических носителях (свойства которых определяют механические и морфологические характеристики получаемых материалов) важно учитывать особенности конструкции биосепарирующего элемента, в состав которого будет включен получаемый композит.
Так, использование мультикапиллярных (МК) систем в качестве носителей при получении PANI-модифицированных сорбентов обеспечило возможность контролировать точный объем анализируемой пробы (что особенно важно при количественном выделении). Модифицировать поверхность МК-систем анилинсодержащими покрытиями можно двумя путями. Во-первых, заполняя объем МК реакционной смесью и проводя полимеризацию анилина, протекающую как на внутренней поверхности стенок капилляров, так и в их объеме. Частицы полимера, слабо связанные с покрытием, легко удаляются промывкой. Во-вторых, в качестве полимерного модификатора можно использовать растворы сополимеров анилина с замещенными анилинами подходящего состава. Для выделения биополимеров из биологических образцов оптимальны МК-структуры шириной 4 мм и длиной 60 мм, с капиллярами диаметром 40 мкм, которые могут быть впаяны в стандартные пластиковые наконечники для ручных или автоматических дозаторов. Для работы с наконечниками не требуется дополнительное оборудование (центрифуги, насосы и др.). Эти наконечники также можно присоединять к шприцам, обеспечивая работу с большими объемами образца. Разработанная технология запатентована [37].
При получении PANI-содержащих сорбентов в качестве носителей также пригодны синтетические мембраны. Полимерные мембраны имеют жесткий каркас, развитую поверхность, они стойки к воздействию агрессивных сред, не набухают. Их структурные характеристики (удельную поверхность, структуру и размер пор) можно изменять в широких пределах. В качестве подложек при получении PANI-модифицированных сорбентов использовали отечественные синтетические мембраны МФФК (фторопластовая гидрофобная), МФФК-Г (фторопластовая гидрофилизованная), ММК (микрофильтрационная полиамидная), МКМ (капроновая), ММПА+ (нейлоновая с положительным поверхностным зарядом), ПА-66 (полигексаметиленадипинамидная) и МПС (полиэфирсульфоновая). Разработаны технологичные способы получения мембранных PANI-сорбентов. Важно подчеркнуть, что модифицированную PANI-покрытием мембрану в составе биосепарирующего элемента (картриджа) использовали не в качестве фильтра, а как селективный сорбент (в скрученном особым образом виде), благодаря чему не происходила фильтрация образца через мембрану, но обеспечивался максимальный контакт образца с поверхностью мембраны. Способ получения такого мембранного сорбента описан, например, в патенте Капустина с соавт. [38].
Таким образом, разработанные технологические приемы обеспечили получение полимерсодержащих композитов с сохранением пористости исходных носителей различной природы и с равномерно распределенным по поверхности носителей полимерным покрытием.
ПРИМЕНЕНИЕ FP- И PANI-СОДЕРЖАЩИХ КОМПОЗИТОВ В СОСТАВЕ БИОСЕПАРИРУЮЩИХ ЭЛЕМЕНТОВ
Ниже рассмотрены примеры применения FP- и PANI-содержащих композитов, демонстрирующих эффект “негативной селекции” в отношении НК, в молекулярной диагностике. Разработанная в этой области методология позволила получать нанотолщинные полимерные покрытия на разнообразных твердых матрицах (дисперсные носители, синтетические мембраны, мультикапилляры и др.), оптимальных для решения конкретных задач.
На рис. 5 [14] представлена линейка устройств, из которых легко выбрать наиболее подходящий вариант для эффективного выделения биополимеров из конкретного биологического объекта.
Рис. 5.
Примеры разработанных биосепарирующих элементов: 1 – спин-картриджи с PANI-сорбентом; 2 – двухслойная концентрирующая спин-колонка (верхний очищающий слой – FP-сорбент, нижний концентрирующий слой – гранулы сшитого полиакриламида); 3 – стеклянные мультикапилляры, покрытые нанослоем PANI, впаянные в наконечник для механического дозатора; 4 – PANI-модифицированная мембрана ММК-2, размещенная в картридже; 5 – кремниевые пластины с 3-ABA-PANI-покрытием для масс-спектрометрии [14].

Применение в пробоподготовке при проведении молекулярной диагностики
В литературе достаточно широко представлены примеры использования FP- и PANI-содержащих сорбентов в пробоподготовке при проведении ПЦР-анализа. Так, за счет высокой сорбционной емкости и селективности FP- и PANI-содержащих сорбентов удается в одну стадию разделять смеси НК и белков, не изменяя состав элюента (и даже в отсутствие такового). Это позволило провести одностадийное выделение ДНК из биологических образцов, содержащих вирусы [36], из лизатов культур грамположительных и грамотрицательных бактерий [28, 34], лизатов растительной ткани [14, 31, 33], крови человека и животных [28, 30, 31], пищевых продуктов [14] и др. Аналогичная пробоподготовка с применением коммерческих наборов включает, как правило, ~20 манипуляций (и занимает от одного до нескольких часов), в то время как процедура с применением FP-PANI-сорбентов – всего восемь манипуляций (с учетом времени, затрачиваемого на проведение лизиса, на проведение процедуры требуется ~30 мин).
Пробоподготовка с использованием PANI-сорбентов оказалась весьма эффективной в клинической ПЦР-диагностике, например, при одновременном определении в мазках пациентов двух групп микроорганизмов, включающих Gardnerella vaginalis и Candida albicans, а также Chlamydia trachomatis, Ureaplasma urealyticum, Mycoplasma hominis и Mycoplasma genitalium [34].
Высокая эффективность применения FP-PANI-сорбентов в диагностике патогенов человека подтверждена результатами выделения ДНК из Mycobacterium tuberculosis complex. В работе Kapustin et al. [39] сравнивали количество ДНК, выделенной из образцов мокроты больных туберкулезом на сорбентах и с помощью роботизированной станции для выделения и амплификации Tecan Freedom EVO® PCR (Tecan Trading AG, Швейцария). Количество копий ДНК при выделении с помощью FP-PANI-сорбента значительно превышало количество копий при автоматическом выделении (максимально в 33 раза), притом что для автоматического выделения брали в 10 раз больше материала. После разведения образца эффективность автоматической амплификации была сопоставима по сравнению с образцами, прошедшими очистку на картриджах, однако даже в этом случае количество копий ДНК при автоматическом выделении составило всего 70% по сравнению с выделением на FP-PANI-сорбенте. Таким образом, протокол ручного выделения с использованием FP-PANI-сорбента предотвращает потери ДНК и обеспечивает эффективную очистку от ингибиторов полимеразы.
FP-PANI-сорбент эффективен при выделении ДНК палочковидной агробактерии A. tumefaciens C58, инфицирующей клетки растений (а в ряде случаев опасной для ВИЧ-инфицированных пациентов). Показано, что одностадийная процедура выделения с использованием FP-PANI-сорбента по сравнению с коммерческими наборами обеспечивает значительно более высокий выход ДНК с одновременным отсутствием РНК в получаемых элюатах [35].
FP-PANI-сорбент также эффективен при одновременном выделении ДНК из тканей растений и грибов, что доказано результатами одностадийного выделения ДНК фитопатогенного гриба (Fusarium graminearum) как из зараженных семян пшеницы, так и непосредственно из мицелия гриба [35].
В работе Zybin et al. [40] описан двухкомпонентный биосепарирующий элемент (БЭ), содержащий FP-PANI-сорбент и полиальгинатные частицы. Это устройство продемонстрировало высокую эффективность при удерживании гуминовых веществ (мощный ингибитор полимеразы) из почвенных экстрактов. Гидрофобная фракция гуминовых веществ была полностью удержана сорбентом, а эффективность сорбции гидрофильной фракции составила ~95%. Выход суммарной почвенной ДНК, выделяемой за счет эффекта “негативной селекции”, составил не менее 94%.
В литературе представлены примеры эффективного применения FP-PANI-содержащего сорбента в пробоподготовке клинических образцов сыворотки крови человека, содержащих вирусную ДНК, для ПЦР-диагностики. Так, в работе Kapustin et al. [36] показано, что при помощи указанного сорбента ДНК вируса гепатита В (HBV) в крови четырех групп пациентов (с хроническим гепатитом, у доноров с высокой и низкой концентрацией ДНК HBV, а также у возвратных доноров) определяется одинаково эффективно (в результате выделения в течение 3−5 мин), в отличие от вариантов с использованием коммерческих наборов, основанных на эффекте “позитивной селекции” (анализ занимает 20–30 мин). ДНК HBV представлена в основном двухнитевой макромолекулой. Для подтверждения эффективности использования разработанного материала для выделения однонитевой ДНК из реальных клинических образцов была проведена успешная ПЦР-детекция вируса TTV (transfusion transmitted virus или torque teno virus), содержащего однонитевую кольцевую молекулу ДНК [36].
В недавних работах [41–43] показано, что порошки полисопряженных полимеров в определенных условиях связывают вирусы (безоболочечные и оболочечные), а также бактериальные клетки. В работе [14] оценивали степень удерживания ряда РНК-содержащих оболочечных вирусов (вирус лихорадки Синдбис 1383 клон 3, вирус западного энцефаломиелита лошадей, вирус гриппа B/Colorado/06/2017, подобный вирусу B/Victoria/2/87) на картриджах с мембранными сорбентами, модифицированными PANI. Мембрану в картриджи вставляли особым образом (когда скрученная мембрана используется не как фильтр, а в качестве сорбента). Показано, что использование таких мембранных сорбентов позволяет быстро, как правило, на порядки (от 2 до более чем в 3000 раз), снижать вирусную нагрузку в вируссодержащих жидкостях.
Таким образом, PANI-содержащие композиты полезны не только при селективном разделении смесей биомакромолекул (НК и белков), но также эффективно взаимодействуют с надмолекулярными структурами (вирусные частицы). Такие материалы могут найти применение при деконтаминации вируссодержащих сред (например, для обеззараживания воды и воздуха), а также в качестве материала лицевых повязок с целью защиты медицинского персонала и пациентов от распространения вирусных инфекций, передающихся воздушно-капельным путем.
Другие области применения FP- и PANI-содержащих композитов
Как следует из приведенных выше примеров, сорбционные свойства FP- и PANI-содержащих сорбентов в отношении биополимеров могут проявляться в различной степени в зависимости от химического состава полимерных модификаторов, использованных при получении сорбентов. Поэтому, например, можно ожидать, что степень удерживания НК, различающихся вторичной структурой (от “нулевой” сорбции до полного удерживания), будет зависеть от присутствия на поверхности полимерных покрытий дополнительно вводимых функциональных групп, что может быть использовано при разработке эффективных протоколов разделения смесей таких НК (либо для дополнительной очистки отдельных фракций НК). В работе Kapustin et al. [28] приведены результаты удерживания днДНК, РНК и олигонуклеотидов (онДНК) сорбентами, полученными на основе обработанного озоном кремнезема и модифицированными сополимерами TFE с HFP, AAm и AAl. Действительно, выход НК изменялся в зависимости от полярности поверхности сорбента. Удерживание онДНК и РНК возрастало в ряду PTFE-HFP – PTFE-AAl – PTFE-AAm. В то же время выход днДНК повышался при использовании сорбента, содержащего гидроксильные группы, по сравнению с материалом, модифицированным сополимером, содержащим звенья AAm.
FP-PANI-сорбент оказался эффективен при очистке ПЦР-фрагментов (ампликонов) от примесей, присутствующих в реакционной смеси после проведения ПЦР, таких как Taq-полимераза (сорбентом удерживается >95%), dNTP (до 84%), олигонуклеотиды (до 100%) и флуорофоры (до 100%). Для оценки эффективности очистки применяли спектрофотометрию, электрофорез и методы с использованием радиоактивной метки. Очищенные ампликоны можно использовать для клонирования генов, секвенирования НК и т.д. [14].
В работе Kapustin et al. [28] показано, что использование частично фторированных полимеров с активными функциональными группами в качестве модификаторов поверхности позволяет проводить иммобилизацию биолигандов. Разработан носитель для твердофазного синтеза олигонуклеотидов на основе пористого кремнезема, предварительно покрытого нанотолщинным слоем сополимера этилена с метил-3-(1-(дифтор-((трифторэтенил)-окси)-метил)-1,2,2,2-тетрафторэтокси)-2,2,3,3-тетрафторпропанатом (EVE). Этот сополимер содержит активные эфирные группы, что позволяет использовать их в качестве “якоря” для иммобилизации биолигандов. Наличие фторированных групп снижает неспецифическую сорбцию синтезируемых олигонуклеотидов на поверхности носителя (благодаря эффекту “негативной селекции”). На поверхности EVE-модифицированного кремнезема иммобилизовали остатки нуклеозида DMT-dT-SNPE за счет взаимодействия с якорными группами. Поверхностная концентрация нуклеозидных остатков составила ~40 мкмоль/г сорбента. На полученном носителе синтезировали олигонуклеотид dT20 с выходом ~30 ОЕ/мл (~6 пмоль/мкл). Материал сохранял свои свойства при длительном хранении при комнатной температуре. В течение 9 месяцев содержание доступных нуклеозидных остатков снизилось всего на 0.86%.
Интересное применение FP-сорбентов описано в работах [14, 44]. Авторы полагали, что кремнеземные носители, поверхностно модифицированные FP, проявляют себя как мягкие обращенно-фазовые сорбенты (как с олео-, так и с гидрофобными свойствами в зависимости от состава используемого элюента). Таким образом, их можно использовать для выделения не только биополимеров, но и низкомолекулярных биологически активных веществ (БАВ), различающихся гидрофильно-липофильным балансом. Эффективность применения картриджей с FP-сорбентом для выделения БАВ продемонстрирована при совместном выделении водо- и жирорастворимых витаминов из крови человека. Разработан воспроизводимый метод одновременного выделения производных пяти водорастворимых (С, В1, В5, В6, В12) и четырех жирорастворимых (А, D3, E, K) производных витаминов (витамеров) из одной пробы крови (5–10 мл). Из образца крови получали и концентрировали сыворотку, затем проводили жидкофазную экстракцию неполярным растворителем. Органическую фазу упаривали, а сухой остаток растворяли в метаноле. Полученный раствор, как и предварительно сконцентрированную водную фазу, независимо пропускали через картриджи с FP-сорбентом, получая элюаты, содержащие, соответственно, смесь жиро- и смесь водорастворимых витамеров. Элюаты анализировали с помощью ВЭЖХ. Соотнесение пиков на хроматограмме с конкретными компонентами пробы проводили, одновременно регистрируя времена удерживания компонентов и спектры поглощения каждого пика, сравнивая результаты со значениями, полученными в тех же условиях для стандартов определяемых витаминов. Разработанный способ обеспечивал высокую чувствительность (пределы обнаружения различных компонентов варьировались в диапазоне 0.001–0.1 мкг/мл), а также воспроизводимость ВЭЖХ-анализа производных витаминов, выделенных из крови с помощью FP-сорбента.
Весьма интересными оказались результаты применения разработанных PANI-модифицированных композитов в масс-спектрометрии. Введение дополнительных функциональных групп в PANI-покрытия открыло новые возможности для использования таких композитов в биоаналитике. В работе Vaczine-Shlosser et al. [45] показано, что разделение смесей белков (пептидов) с различными pI можно проводить непосредственно на кремниевой пластине (чипе), покрытой нанослоем сополимера анилина с 3-аминобензойной кислотой (3-ABA-PANI). Предварительно получали конъюгаты белков, различающихся значениями рI, с люминесцентными (с эмиссией при 546, 581 и 610 нм) полупроводниковыми нанокристаллами (CdSe)ZnS. Смесь конъюгатов наносили на поверхность модифицированного чипа, систему промывали раствором с определенным рН, удерживание белков на пластине визуализировали в УФ-свете. На пластине удерживались белки с pI > pH отмывочного раствора.
Параллельно было обнаружено, что анилинсодержащее покрытие абсорбирует энергию лазерного источника, что позволяет использовать чипы с таким покрытием в масс-спектрометрии в формате SELDI-TOF-MS (времяпролетная масс-спектрометрия с использованием поверхностно-усиленной лазерной десорбции/ионизации) без добавления к пробе “веществ-матриц” (например, ароматических кислот), поглощающих энергию и способствующих переводу аналита в газовую фазу. Присутствие “вещества-матрицы” приводит к появлению значительного фонового сигнала в низкомолекулярной части масс-спектра. Напротив, при использовании чипов, покрытых сополимером 3-ABA-PANI, для анализа пептидов (брадикинина и др.) фоновые пики в масс-спектре не наблюдали. Добавление “матрицы” (α-циано-4-гидроксикоричной или горчичной кислот) приводило к появлению интенсивного фона, маскирующего пики низкомолекулярных аналитов, что продемонстрировано на рис. 6 на примере определения брадикинина.
Рис. 6.
Определение брадикинина методом SELDI-TOF-MS на кремниевых чипах, модифицированных сополимером 3-ABA-PANI (адаптированный рисунок из патента Vaczine-Shlosser et al. [45]).

Из рис. 6 следует, что разработанное покрытие обладает высокой “матричной” активностью и обеспечивает образование протонированных молекулярных ионов ([M + H]+) [45]. Таким образом, разработана эффективная аналитическая система для масс-спектрометрии, обеспечивающая удаление примесей из пробы и одновременно повышающая информативность анализа за счет существенного упрощения структуры масс-спектра.
ПРОЯВЛЯЮТ ЛИ ПОЛИМЕРНЫЕ И НИЗКОМОЛЕКУЛЯРНЫЕ МОДИФИКАТОРЫ ОДИНАКОВОЙ ПРИРОДЫ СХОДНЫЕ СОРБЦИОННЫЕ СВОЙСТВА?
Как известно, многочисленная группа хроматографических материалов, применяемых при разделении смесей биополимеров, представлена кремнеземами, поверхностно модифицированными низкомолекулярными соединениями (силанами, металлсодержащими фрагментами молекул, остатками нуклеозидов, антител и т.д.) [7, 8]. Напротив, в цитируемых выше работах обсуждались примеры применения в молекулярной диагностике композитов, полученных в результате модифицирования поверхностей твердых носителей полимерными нанопокрытиями. С целью получения таких материалов был разработан ряд технологичных способов синтеза. Также было показано, что введение дополнительной функциональности как во фтор-, так и в анилинсодержащие полимерные модификаторы, используемые при синтезе композиционных сорбентов, позволяет расширить область их практического применения.
Однако остается открытым вопрос, возможно ли при использовании низкомолекулярных модификаторов, сходных по химическому составу с соответствующими макромолекулами, разрабатывать технологичные способы получения композиционных сорбентов, демонстрирующих аналогичные сорбционные свойства. Из представленных выше данных следует, что PANI-покрытия, как правило, получают в результате проведения окислительной осадительной полимеризации анилина в присутствии твердого носителя, т.е. в результате прямого синтеза сорбента [29, 31], поскольку PANI нерастворим в обычных растворителях (за исключением высококипящего N-метил-2-пирролидона и смеси концентрированных кислот). Сложность механизма полимеризации анилина и разнообразие факторов, влияющих на эту реакцию, часто приводят к образованию полимерных продуктов, различающихся по химической структуре и морфологии, что может сказаться на сорбционных свойствах поверхности PANI.
В этом отношении интересно исследование Yagudaeva et al. [46], в котором в качестве аналога и альтернативы PANI предложено использовать олигомерные молекулы тетраанилина (TANI). Этому способствовал ряд причин. Во-первых, олигомеры анилина, как и макромолекулы PANI, представляют собой полисопряженные системы, структурно близкие PANI [47]. Эти молекулы могут существовать в трех различных окисленных состояниях: в полностью восстановленной форме “лейкоэмеральдина”, в полностью окисленной форме “пернигранилина” и в форме “эмеральдина” с соотношением окисленных и восстановленных фрагментов 1 : 1 [48]. Олигомеры имеют определенную молекулярную структуру, и они (что особенно важно) растворимы в органических растворителях, таких как толуол, тетрагидрофуран, диметилсульфоксид, диоксан, ацетон, ацетонитрил, N-метил-2-пирролидон. Поскольку приготовление покрытий на основе олигомеров анилина осуществляется из их растворов, предполагалось, что это позволит лучше контролировать надмолекулярную организацию получаемого покрытия по сравнению с покрытиями PANI и получать бездефектные пленки с улучшенной структурой, которые определяют сорбционные свойства таких покрытий.
Известно большое количество структур олигомеров анилина [49–53]. Для приготовления нанопокрытий был выбран TANI с концевыми фенильными группами, поскольку он выступает наиболее стабильным соединением среди олигомеров PANI, а также самым коротким олигомером, имеющим три степени окисления.
TANI в форме лейкоэмеральдинового основания (LEB) и в форме эмеральдинового основания (EB) (TANI-LEB и TANI-EB соответственно) синтезировали в соответствии с методикой Wang et al. [54]. Полученные соединения были охарактеризованы методами рентгеновской фотоэлектронной спектроскопии, ИК-, 1H-ЯМР- и 13C-ЯМР-спектроскопии, результаты которых подтвердили соответствие их реального химического состава брутто-формулам.
Авторы предположили, что оценка сорбционных свойств покрытий TANI по отношению к биополимерам методом СКИ позволит адекватно ответить на вопрос о пригодности TANI в качестве альтернативы модификатору поверхности PANI при приготовлении сорбентов, демонстрирующих эффект “негативной селекции” по отношению к НК. С этой целью методом Ленгмюра формировали пленки, нанося растворы TANI-EB в смеси DMSO с толуолом, взятых в равных объемах, на водную субфазу. Качество получаемых покрытий дополнительно контролировали методом сканирующей зондовой микроскопии, нанося пленки на стеклянные пластины методом Ленгмюра–Шеффера. Оптимальную морфологию имели покрытия, полученные после последовательного нанесения двух пленок.
В качестве объектов для изучения сорбции биополимеров на поверхности получаемых покрытий использовали днДНК из E. coli, тРНК дрожжей и белки, различающиеся значениями pI и молекулярными массами (лизоцим, BSA, овальбумин, гемоглобин и пепсин). Сравнение сорбционных свойств TANI- и PANI-покрытий методом СКИ подтвердило, что механизм сорбции белков поверхностью TANI-EB определяется их структурой и значением pI, по аналогии с механизмом удерживания биополимеров на поверхности PANI. НК не удерживались обеими поверхностями.
Обнаруженные свойства полученных покрытий TANI-EB позволяют рассматривать их как перспективную альтернативу PANI-содержащим материалам для создания хроматографических субстратов с контролируемыми сорбционными свойствами по отношению к биомакромолекулам, а именно к НК и белкам.
ЗАКЛЮЧЕНИЕ
На первый взгляд, объединение таких различных материалов, как FP- и PANI-содержащие композиты, в качестве единого объекта исследования может показаться неожиданным. Тем не менее в определенных условиях даже столь различные материалы можно эффективно применять в процессах разделения компонентов смесей биополимеров, поскольку входящие в состав этих композитов полимерные модификаторы демонстрируют весьма близкие сорбционные свойства в отношении биомакромолекул, таких как белки, пептиды и нуклеиновые кислоты.
Использование нетрадиционных полимерных модификаторов с комплексом особых свойств позволило изменить сам принцип выделения биополимеров из биологических смесей сложного состава. Иными словами, произошел переход от использования материалов, демонстрирующих эффект “позитивной селекции” в отношении НК, к применению материалов и методов, основанных на использовании эффекта “негативной селекции”. В результате стало возможным проводить выделение биополимеров (в частности, НК) из биологических смесей в одну стадию (в отличие от традиционных многостадийных методов).
Использование FP- и PANI-содержащих сорбентов не только обеспечивает одностадийное выделение НК из разнообразных биологических объектов в процессе пробоподготовки в молекулярной диагностике, но с их помощью также удается решать особые задачи, такие как иммобилизация биолигандов, выделение низкомолекулярных биологически активных соединений, разделение смесей НК, различающихся третичной структурой, очистка ПЦР-фрагментов. Наконец, композиты с нанопокрытиями на основе сополимеров анилина с замещенными анилинами эффективны в качестве “рабочих тел” в масс-спектрометрии.
Таким образом, полимерсодержащие композиты – полезный и эффективный инструмент молекулярной биотехнологии, область их применения постоянно расширяется. Новым перспективным шагом в этом направлении может стать использование низкомолекулярных (олигомерных) модификаторов, демонстрирующих близкие сорбционные свойства по сравнению со свойствами макромолекул PANI.
Следует признать, что поступательное развитие молекулярной диагностики было бы невозможным без комплексных исследований свойств носителей, их модификаторов и биомакромолекул, проводимых на стыке материаловедения и бионанотехнологии.
Список литературы
Sambrook J., Russel D.W. // Molecular cloning: a laboratory manual. 3rd edition / Ed. Russel D.W. Cold Spring Harbor, NY: Cold Spring Harbor Laboratory Press, 2001. 2100 p.
Marko M.A., Chipperfield R., Birnboim H.C. // Anal. Biochem. 1982. V. 121. P. 382–387. https://doi.org/10.1016/0003-2697(82)90497-3
Chomczynski P., Sacchi N. // Nat. Protoc. 2006. V. 1. P. 581–585. https://doi.org/10.1038/nprot.2006.83
Carr S.M., Griffith O.M. // Biochem. Genet. 1987. V. 25. P. 385–390. https://doi.org/10.1007/BF00554547
Janson J.-Ch. // Protein purification: principles, high resolution methods, and applications. 3rd edition / Ed. Janson J.-Ch. Hoboken. NJ: John Wiley & Sons, Inc., 2011. 548 p.
Albertson P.-A. // Partition of cell and macromoleculs. separation and purification of biomolecules, cell organelles, membranes and cell in aqueous polymer two-phase systems and their use in biochemical analysis and biotechnology. 3rd edition / Ed. Albertson P.-A. NY: John Wiley & Sons, Inc., 1986. 346 p.
Остерман Л.А. // Хроматография белков и нуклеиновых кислот / Отв. ред. Георгиев Г.П. М.: Наука, 1985. 536 с.
Snyder L.R., Kirkland J.J. // Introduction to modern liquid chromatography. 2nd edition / NY, Chichester, Brisbane, Toronto: John Wiley & Sons, Inc., 1979. 863 p.
Rother D., Sen T., East D., Bruce I.J. // Nanomedicine (Lond). 2011. V. 6. P. 281–300. https://doi.org/10.2217/nnm.10.159
Melzak K.A., Sherwood C.S., Turner R.F.B., Haynes C.A. // J. Colloid Interface Sci. 1996. V. 181. P. 635–644. https://doi.org/10.1006/JCIS.1996.0421
Beld M., Sol C., Goudsmit J., Boom R // Nucl. Acids Res. 1996. V. 24. P. 2618–2619. https://doi.org/10.1093/nar/24.13.2618
Yagudaeva E.Yu., Zybin D.I., Vikhrov A.A., Prostyakova A.I., Ischenko A.A., Zubov V.P., Kapustin D.V. // Colloids Surf. B Biointerfaces. 2018. V. 163. P. 83–90. https://doi.org/10.1016/j.colsurfb.2017.12.025
QIAamp DNA Mini Kit and QIAamp DNA Blood Mini Kit Handbook // Qiagen, 2003. https://depts.washington.edu/kellylab/wordpress/wp-content/uploads/2019/03/QIAGEN_protocol.pdf
Капустин Д.В. // Фторполимер- и полианилинсодержащие композиты как эффективный инструмент молекулярной биотехнологии. Дис. докт. хим. наук, ИБХ им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН, Москва, 2020.
Hjerten S. // J. Chromatogr. A. 1978. V. 159. P. 47–55. https://doi.org/10.1016/S0021-9673(00)98545-5
Hjerten S., Hellman U. // J. Chromatogr. A. 1980. V. 202. P. 391–395. https://doi.org/10.1016/S0021-9673(00)91823-5
Муйдинов М.Р. // Российский химический журнал (Журнал Российского химического общества им. Д.И. Менделеева). 2008. Т. LII. № 3. С. 81–89.
Муйдинов М.Р. // Патент RU 2104695 C1, 1998.
Сабуров В.В., Муйдинов М.Р., Гурьянов С.А., Катаев А.Д., Туркин С.И., Зубов В.П. // Журнал физической химии. 1991. Т. 65. № 10. С. 2692–2698.
Капустин Д.В., Ягудаева Е.Ю., Завада Л.Л., Жигис Л.С., Зубов В.П., Ярошевская Е.М., Плобнер Л., Лайзер Р.-М., Брем Г. // Биоорг. химия. 2003. Т. 29. С. 310–315. [Kapustin D.V., Yagudaeva E.Yu., Zavada L.L., Zhigis L.S., Zubov V.P. Yaroshevskaya E.M., Plobner L., Leiser R.-M. // Russ. J. Bioorg. Chem. 2003. V. 29. P. 281–285.] https://doi.org/10.1023/a:1023992701568
Ivanov A.E., Saburov V.V., Zubov V.V. // Advances in Polymer Science. 1992. V. 104. P. 134–175. https://doi.org/10.1007/3-540-55109-3_4
Zubov V.P., Kapustin D.V., Generalova A.N., Yagudaeva E.Yu., Vikhrov A.A., Sizova S.V., Muydinov M.R. // Polymer Science Series A. 2007. V. 49. P. 1247–1264. https://doi.org/10.1134/S0965545X07120036
Liaw D.-J., Yagudaeva E.Yu., Prostyakova A.I., Lazov M.A., Zybin D.I., Ischenko A.A., Zubov V.P., Chang C.-H., Huang Y.-C., Kapustin D.V. // Colloids Surf. B. 2016. V. 145. P. 912–921. https://doi.org/10.1016/j.colsurfb.2016.05.068
Льяо Д.-Дж., Зыбин Д.И., Простякова А.И., Ягудаева Е.Ю., Вихров А.А., Ищенко А.А., Зубов В.П., Капустин Д.В. // Известия ВУЗов. Химия и химическая технология. 2018. Т. 61. С. 4–22. https://doi.org/10.6060/tcct.2018610
Nikitin P.I., Gorshkov B.G., Nikitin E.P., Ksenevich T.I. // Sensors Actuators B. 2005. V. 111. P. 500–504. https://doi.org/10.1016/J.SNB.2005.03.043
Orlov A.V., Pushkarev A.V., Znoyko S.L., Novichikhin D.O., Bragina V.A., Gorshkov B.G., Nikitin P.I. // Biosensors and Bioelectronics. 2020. V. 159. P. 112187. https://doi.org/10.1016/j.bios.2020.112187
Walter W., Focke G.E., Wnek Y.W. // J. Phys. Chem. 1987. V. 91. P. 5813–5818. https://doi.org/10.1021/J100306A059
Kapustin D., Prostyakova A., Bryk Ya., Yagudaeva E., Zubov V. // In: Nanocomposites and polymers with analytical methods / Ed. Cuppoletti J. Croatia: Intech, 2011. P. 83–106. https://doi.org/10.5772/18081
Капустин Д.В., Зубов В.В. // Вестник МИТХТ. 2011. Т. 6. № 5. С. 21–46.
Капустин Д.В., Сабуров В.В., Завада Л.Л., Евстратов А.В., Барсамян Г.Б., Зубов В.П. // Биоорг. химия. 1998. Т. 24. С. 868–876. [Kapustin D.V., Saburov V.V., Zavada L.L., Evstratov A.V. Barsamyan G.B., Zubov V.P. // Russ. J. Bioorg. Chem. 1998. V. 24. P. 770–777.]
Kapustin D.V., Yagudaeva E.Y., Zubov V.P., Muydinov M.R., Yaroshevskaja E.M., Plobner L., Leiser R.-M., Brem G. // In: Frontiers in DNA Research / Ed. Woods C.R. NY: Nova Science Publishers, 2006. P. 113–136.
Yagudaeva E.Yu., Muydinov M.R., Kapustin D.V., Zubov V.P. // Russ. Chem. Bull. Int. Ed. 2007. V. 56. P. 1166–1173. https://doi.org/10.1007/S11172-007-0177-Y
Yagudaeva E.Yu., Bukina Ya.A., Prostyakova A.I., Zubov V.P., Tverskoy V.A., Kapustin D.V. // Polymer Sci. Ser. A. 2009. V. 51. P. 675–682. https://doi.org/10.1134/S0965545X09060121
Kapustin D.V., Prostyakova A.I., Ryazantcev D.Yu., Zubov V.P. // Nanomedicine (Lond). 2011. V. 6. P. 241–255. https://doi.org/10.2217/nnm.11.6
Простякова А.И. // Синтез полимерсодержащих сорбентов и их использование для одностадийного выделения ДНК. Дис. канд. хим. наук, ИБХ им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН, Москва, 2013.
Kapustin D.V., Prostyakova A.I., Zubov V.P. // Bioanalysis. 2014. V. 6. P. 957–966. https://doi.org/10.4155/bio.13.332
Скибина Ю.С., Белоглазов В.И., Тучин В.В., Капустин Д.В., Простякова А.И. // Патент RU 2547597 C1, 2015.
Капустин Д.В., Тарасов А.В., Простякова А.И., Лепешин С.А. // Патент RU 2631934 C1, 2017.
Kapustin D.V., Prostyakova A.I., Alexeev Ya.I., Varlamov D.A., Zubov V.P., Zavriev S.K. // Acta Naturae. 2014. V. 6. C. 6–10. https://doi.org/10.32607/20758251-2014-6-2-48-52
Zybin D.I., Prostyakova A.I., Kapustin D.V. // Microchem. J. 2021. V. 166. P. 106225. https://doi.org/10.1016/J.MICROC.2021.106225
Иванова В.Т., Иванов В.Ф., Грибкова О.Л., Курочкина Я.Е., Матюшина Р.О., Ванников А.В. // Патент RU 2372951 C2, 2009.
Морозова Е.О. // Сорбционное взаимодействие микропатогенов с полимерными материалами на основе полипиррола. Дис. канд. биол. наук, ФГБУ “НИЦЭМ им. Н.Ф. Гамалеи”, Москва, 2018.
Ivanova V.T., Garina E.O., Burtseva E.I., Kirillova E.S., Ivanova M.V., Stejskal J., Sapurina I.Yu. // Chem. Papers. 2017. V. 71. P. 495–503.
Зайцева И.П., Серебрянский Е.П., Скальная М.Г., Капустин Д.В. // Вестник восстановительной медицины. 2014. №. 2 (60). С. 62–65.
Vaczine-Shlosser G., Ribbing C., Bachman P.K., Zubov V.P., Kapustin D.V. // Int. Application WO 2011004308 A1, 2011.
Yagudaeva E., Vikhrov A., Malakhova Yu., Iskandyarova Yu., Firsova M., Prostyakova A., Korovin A., Malakhov S., Nichugovskiy A., Zubov V., Kapustin D. // Synthetic Metals. 2021. V. 274. P. 116712. https://doi.org/10.1016/j.synthmet.2021.116712
Wang Y., Tran H.D., Liao L., Duan X., Kaner R. // J. Am. Chem. Soc. 2010. V. 132. P. 10365–10373. https://doi.org/10.1021/ja1014184
MacDiarmid A.G., Zhou Y., Feng J. // Synthetic Metals. 1999. V. 100. P. 131–140. https://doi.org/10.1016/S0379-6779(98)00164-7
Yepez G., Poyil A.N., Bugarin A. // Synthesis. 2019. V. 51. P. 3611–3616. https://doi.org/10.1055/S-0037-1611889
Chu J.W.-F., Hsu Sh.-Ch., Lu Y., Yu Y., Santiago K.S., Yeh J. // Polymer. 2017. V. 128. P. 218–228. https://doi.org/10.1016/J.POLYMER.2017.09.034
Liu Y., Li J., Zhu J., Lyu W., Xu H., Feng J., Yan W. // Colloid Polym. Sci. 2018. V. 296. P. 1777–1786. https://doi.org/10.1007/s00396-018-4401-0
Ding Y., Liang J., Liu G., Ni W., Shen L. // Coatings. 2019. V. 9. P. 399–411. https://doi.org/10.3390/COATINGS9060399
Wei Z., Faul C. // Macromol. Rapid Commun. 2008. V. 29. P. 280–292. https://doi.org/10.1002/MARC.200700741
Wang W., MacDiarmid A.G. // Synthetic Metals. 2002. V. 129. P. 199–205. https://doi.org/10.1016/S0379-6779(02)00053-X
Дополнительные материалы отсутствуют.
Инструменты
Биоорганическая химия