Биологические мембраны: Журнал мембранной и клеточной биологии, 2019, T. 36, № 1, стр. 32-43
Анализ связи показателей световой стадии фотосинтеза с фотохимическим индексом отражения (PRI) в условиях кратковременного освещения листа гороха
В. С. Сухов a, *, Е. Н. Громова a, Е. М. Сухова a, Л. М. Сурова a, В. Н. Неруш a, В. А. Воденеев a
a Нижегородский государственный университет им. Н.И. Лобачевского
603950 Нижний Новгород, просп. Гагарина, 23, Россия
* E-mail: vssuh@mail.ru
Поступила в редакцию 27.02.2018
После доработки 05.04.2018
Принята к публикации 28.03.2018
Аннотация
Фотохимический индекс отражения (photochemical reflectance index, PRI) связан с превращением виолоксантина в зеаксантин в ксантофилловом цикле и отражает функционирование электронно-транспортной цепи хлоропластов. Регистрация PRI осуществляется относительно простым и неинвазивным методом и поэтому представляет собой перспективный подход для дистанционного мониторинга фотосинтетических процессов и выявления развития фотосинтетического стресса. Однако коэффициент корреляции между PRI и фотосинтетическими параметрами существенно варьирует в различных работах; одной из возможных причин такой вариабельности в естественных условиях могут быть изменения освещения и развитие переходных процессов в фотосинтетическом аппарате. В настоящей работе проведен анализ влияния длительности освещения (минутный интервал) на связь показателей световой стадии фотосинтеза с PRI. Фотосинтетические показатели и PRI определяли у листьев гороха. Выявлена высокая отрицательная корреляция между изменениями PRI, индуцированными освещением, и изменениями квантовых выходов фотохимических реакций фотосистем I и II; изменения PRI не коррелировали с изменениями нефотохимического тушения. Между усредненными по всему временнóму диапазону величинами квантовых выходов фотохимических реакций и PRI наблюдалась положительная корреляция, а в случае нефотохимического тушения и PRI – отрицательная корреляция. Абсолютная величина коэффициента корреляции PRI с показателями световой стадии фотосинтеза возрастала при увеличении длительности освещения. Таким образом, связь PRI с показателями световой стадии фотосинтеза в листе гороха может зависеть от длительности освещения, по крайней мере, в минутном интервале.
ВВЕДЕНИЕ
Фотосинтез является ключевым процессом в жизни растений. Действие большинства стрессоров приводит к изменению в протекании фотосинтетических процессов в тилакоидных мембранах. Избыточное закисление люмена хлоропластов и связанное с ним превращение виолоксантина в зеаксантин в ходе ксантофиллового цикла является одним из типичных ответов фотосинтетического аппарата на действие неблагоприятных факторов [1, 2], вызывающим увеличение нефотохимического тушения флуоресценции (NPQ) и влияющим на другие фотосинтетические показатели. Развивающаяся при стрессе деэпоксидация виолоксантина сопровождается снижением отражения света на длине волны 531 нм; такое снижение потенциально может быть использовано для дистанционной оценки развития фотосинтетического стресса у растений [3]. На основании этого Gamon и др. [3] предложили новый спектральный индекс – фотохимический индекс отражения (photochemical reflectance index, PRI), который традиционно рассчитывается с использованием уравнения (1) [3–5]:
где R531 и R570 – интенсивности отраженного света на длинах волн 531 и 570 нм соответственно.В настоящее время существует значительное количество работ, показывающих связь между величиной PRI и фотосинтетическими показателями, прежде всего квантовым выходом фотохимических реакций фотосистемы II (ФPSII) и NPQ (см., например, обзор [5]). При этом в большинстве случаев между PRI и ФPSII наблюдается высокая положительная корреляция, а между PRI и NPQ – высокая отрицательная корреляция [6–8], что хорошо согласуется со снижением отражения при длине волны 531 нм при развитии фотосинтетического стресса [3]. Однако коэффициент корреляции между фотосинтетическими показателями и PRI может сильно варьировать [5]. Например, в работе [9] сообщается о высокой отрицательной корреляции между PRI и квантовым выходом фотохимических реакций фотосистемы II и о высокой положительной корреляции между PRI и NPQ. Существование таких “парадоксальных” зависимостей может значительно осложнять использование PRI для оценки фотосинтетического стресса и требует выяснения возможных причин их появления.
Существует большое число факторов, влияющих на эффективность использования индексов отражения [5, 7, 10], например атмосфера и почва, особенности положения листа, временнóй масштаб измерений, уровень измерений (лист, поверхность растительного покрова) и т.д. Одной из потенциальных причин вариабельности связи между фотосинтетическими показателями и PRI могут быть быстрые колебания интенсивности освещения (в минутном и секундном диапазоне), часто возникающие в естественных условиях [11, 12]. В частности, при сдвигах интенсивности освещения скорость изменения потоков электронов и ФPSII будет выше, чем скорость изменения NPQ [11, 12] и, вероятно, связанного с ним PRI; это значит, что связь между PRI и другими фотосинтетическими показателями будет меняться. Более того, сложная природа NPQ, включающего в себя как обусловленные, так и не обусловленные ксантофилловым циклом компоненты с различными временами формирования [1, 2], также может модифицировать связь PRI с фотосинтетическими показателями. В частности, после изменения интенсивности освещения (и в зависимости от величины такого изменения) может происходить изменение вкладов различных компонент NPQ.
Целью настоящей работы является экспериментальный анализ возможного влияния длительности освещения (в минутном диапазоне) на связь показателей световой стадии фотосинтеза с фотохимическим индексом отражения в листе высшего растения.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы. В качестве объекта исследования использовали двух–трехнедельные проростки гороха (Pisum sativum L., сорт “Альбумен”), которые были выращены на гидропонике в климатической камере (KBW-240, Binder, Германия). Выращивание осуществляли при температуре 24°С и 16-часовом световом периоде.
Исследование фотохимического индекса отражения. На рис. 1 показана общая схема освещения, использованная при регистрации фотосинтетических параметров и PRI (рис. 1а), и схема расположения листа при этом (рис. 1б). Для измерения PRI использовали спектрометр S-100 (Солар ЛС, Беларусь), позволяющий регистрировать спектр отраженного света в диапазоне от 190 до 1050 нм со спектральным разрешением около 1 нм. Для передачи светового потока от листа к спектрометру использовали световод, расположенный на расстоянии 1.5 см от поверхности листа. В качестве источника освещения для регистрации R531 и R570, а также в качестве источника актиничного света для фотосинтеза использовали галогенную лампу; общая плотность светового потока падающего на лист составила около 630 мкмоль м–2 с–1.
Рис. 1.
Временнáя последовательность режимов освещения и регистрации параметров в эксперименте (а), схема одновременной регистрации показателей световой стадии фотосинтеза и фотохимического индекса отражения (photochemical reflectance index, PRI) (б), записи динамики изменений поглощения света фотосистемой I и флуоресценции фотосистемы II во время вспышки насыщающего света (в) и пример динамики изменений относительной величины $F_{{\text{m}}}^{{\text{'}}}$ у листа гороха в условиях действия актиничного света и последующей темновой релаксации (n = 6) (г). Dual-E и Dual-DB – эмиттерный и детекторный блоки РАМ-флуориметра Dual-PAM-100. AL – актиничный белый свет с интенсивностью около 630 мкмоль м–2 с–1 (галогенная лампа), SPs – повторяющиеся каждые 30 с насыщающие вспышки (SP), с длительностью 300 мс и интенсивностью 10 000 мкмоль м–2 с–1 (светодиодные матрицы Dual-E и Dual-DB с максимумами на 630 нм), ML – измерительный свет с интенсивностью 24 мкмоль м–2 с–1 (светодиодная матрица Dual-DB с максимумом на 460 нм), RL – отраженный листом свет. “on” и “off” – моменты включения и выключения соответствующего типа освещения. F0 и Fm – начальный и максимальный уровни флуоресценции фотосистемы II после темновой адаптации, F и $F_{{\text{m}}}^{{\text{'}}}$ – текущий и максимальный уровни флуоресценции в условиях действия актиничного света и после его выключения. Pm – максимальное поглощение света фотосистемой I после темновой адаптации, P и $P_{{\text{m}}}^{{\text{'}}}$ – текущий и максимальный уровни поглощения света в условиях действия актиничного света и после его выключения. R531 и R570 – интенсивности отраженного света на длинах волн 531 и 570 нм. Поглощение света фотосистемой I определяли как разность между поглощением на длинах волн 875 и 830 нм [19].
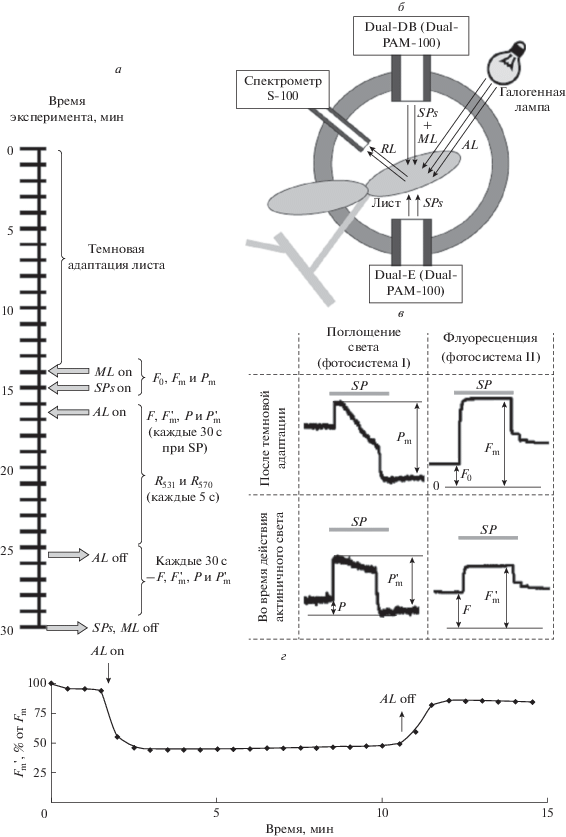
При определении R531 и R570 значение отраженного света на каждой спектральной полосе получали путем усреднения значений в диапазонах 526–536 и 565–575 нм соответственно. Накопление сигнала осуществлялось в течение каждых 5 с; таким образом, мы использовали пятисекундный “временнóй шаг” для определения R531 и R570. Регистрация PRI начиналась с момента включения освещения и продолжалась в течение всего девятиминутного периода действия света; значения PRI, которые были получены одновременно с действием насыщающих световых вспышек (см. ниже), исключались из анализа.
Исследования параметров световой стадии фотосинтеза. Для регистрации показателей световой стадии фотосинтеза листа гороха использовали PAM-флуориметр Dual-PAM-100 (Heinz Walz GmbH, Германия), как описано в наших работах [13–17]; временнáя последовательность режимов освещения и регистрации показана на рис. 1а. Предварительная темновая адаптация листьев составляла 15 мин, при этом первые 14 мин лист находился в условиях полного затемнения, а в течение последней минуты адаптации на него действовал слабый измерительный свет (24 мкмоль м–2 с–1, 460 нм). После этого осуществлялась первая вспышка насыщающего света (10 000 мкмоль м–2 с–1, 630 нм) длительностью 300 мс, которая позволяла определить максимальный уровень флуоресценции после темновой адаптации (Fm); минимальный уровень флуоресценции после темновой адаптации (F0) определялся по величине флуоресценции перед первой вспышкой насыщающего света (рис. 1в).
Известно, что окисленные реакционные центры фотосистемы I (${\text{P}}_{{700}}^{ + }$) имеют максимум поглощения в области 810–840 нм [18], поэтому согласно стандартному протоколу Dual-PAM-100 для оценки их количества использовали величину поглощения света на длине волны 830 нм, из которой вычитали поглощение света на длине волны 875 нм (референтная длина волны), что позволяло повысить стабильность измерения поглощения света во времени. Регистрация такого показателя позволяла прежде всего оценить максимальное поглощение света фотосистемой I (Pm), которое пропорционально общему количеству таких фотосистем в исследуемой зоне [18]. В соответствии со стандартной для Dual-PAM-100 процедурой определения Pm лист в течение 10 с подсвечивался дальним красным светом (730 нм), после чего давалась вспышка насыщающего света и определялась разность между максимальным и минимальным значениями поглощением света фотосистемой (рис. 1в). Определение Pm осуществлялось через 30 с после определения F0 и Fm, во время второй вспышки насыщающего света.
В дальнейшем насыщающие вспышки также следовали каждые 30 с; через 15 с после четвертой с момента начала измерения вспышки осуществлялось девятиминутное включение актиничного света (галогенная лампа, общая плотность светового потока около 630 мкмоль м–2 с–1). Последние 4 мин измерения актиничный свет выключали, и на лист действовал только измерительный свет и периодические насыщающие вспышки. Во время каждой насыщающей вспышки определяли текущий и максимальный уровни флуоресценции (F и $F_{{\text{m}}}^{{\text{'}}}$) и аналогичные уровни поглощения света фотосистемой I (P и $P_{{\text{m}}}^{{\text{'}}}$) (рис. 1в). Важно отметить, что при использованном в эксперименте режиме действия актиничного света большая часть светового снижения $F_{{\text{m}}}^{{\text{'}}}$ релаксировала в пределах 1–1.5 мин после прекращения освещения (рис. 1г), т.е. основной вклад в нефотохимическое тушение флуоресценции в этих условиях вносила быстро релаксирующая энергозависимая компонента тушения, которая тесно связана с ксантофилловым циклом [1, 2] и, вероятно, с PRI.
Определение всех показателей флуоресценции и поглощения света осуществлялось автоматизированно с использованием программного обеспечения Dual-PAM-100. Далее на основании измеренных показателей рассчитывался квантовый выход фотохимических реакций фотосистемы I $\left( {{{{\text{Ф }}}_{{{\text{PSI}}}}} = \frac{{P_{{\text{m}}}^{{\text{'}}} - P}}{{{{P}_{{\text{m}}}}}}} \right)$ [18], квантовый выход фотохимических реакций фотосистемы II $\left( {{{{\text{Ф }}}_{{{\text{PSII}}}}} = \frac{{F_{{\text{m}}}^{{\text{'}}} - F}}{{F_{{\text{m}}}^{{\text{'}}}}}} \right)$ [19] и нефотохимическое тушение флуоресценции хлорофилла $\left( {{\text{NPQ}} = \frac{{{{F}_{{\text{m}}}} - F_{{\text{m}}}^{{\text{'}}}}}{{F_{{\text{m}}}^{{\text{'}}}}}} \right)$ [1].
Статистическая обработка результатов. Полученные в ходе анализа значения показателей у каждого растения (PRI, ФPSI, ФPSII, NPQ) усредняли в каждом из минутных интервалов (от 1-й до 9-й мин освещения), что позволяло сопоставить динамику фотосинтетических показателей и фотохимического индекса отражения и снизить погрешность результатов. Полученные результаты использовали для расчета средних значений и стандартных отклонений среднего, а также для построения диаграмм рассеяния, корреляционного и регрессионного анализа.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
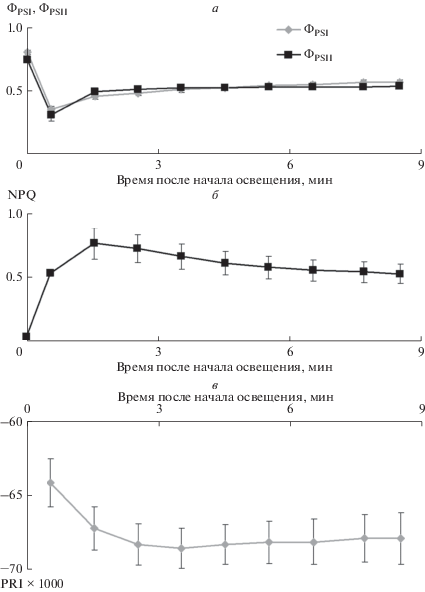
Анализ динамики изменений показателей световой стадии фотосинтеза на включение света показал, что квантовые выходы фотохимических реакций фотосистем I и II значительно снижаются по сравнению с темновым уровнем в 1-ю мин освещения; однако уже на 2-й мин освещения происходит частичное восстановление величин ФPSI и ФPSII (рис. 2а). В случае нефотохимического тушения наблюдается противоположенная картина (рис. 2б): возрастание тушения в течение первых 2 мин освещения сменяется его снижением. Важно отметить, что возрастание NPQ развивается медленнее, нежели происходит снижение квантовых выходов фотохимических реакций. Динамика изменения величины PRI в условиях освещения развивается еще более медленно (рис. 2в); при этом максимальное уменьшение величины этого показателя происходит на 3–4-й мин освещения, после чего наблюдается его слабое возрастание.
Рис. 2.
Зависимость квантовых выходов фотохимических реакций фотосистем I и II (ФPSI и ФPSII), нефотохимического тушения флуоресценции (NPQ) и фотохимического индекса отражения (PRI) от длительности освещения листа гороха (n = 6). Предварительное затемнение листа составило 15 мин, за точку ноль принят момент начала освещения.
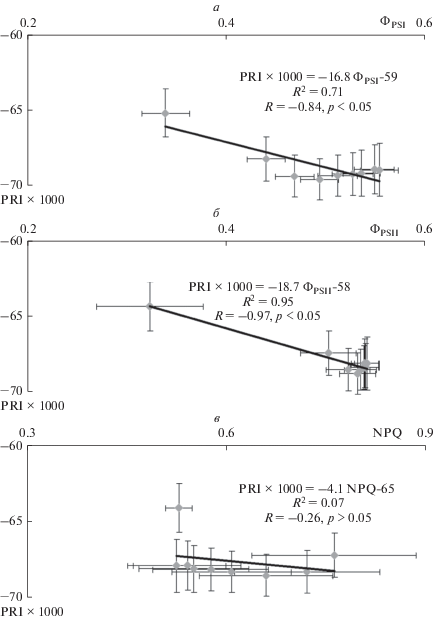
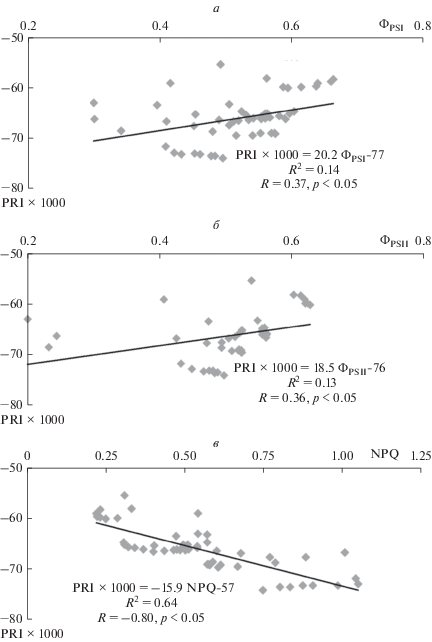
Сопоставление динамик изменения различных показателей на рис. 2 показывает, что, несмотря на качественное сходство таких изменений, их временны́е характеристики могут существенно различаться. Для более строгой оценки связи исследованных фотосинтетических показателей с PRI во время развития индуцированных освещением изменений были построены диаграммы рассеяния для этих показателей и PRI, а также проведен корреляционный анализ (рис. 3). Было показано, что между квантовыми выходами и PRI наблюдается высокая отрицательная корреляция (рис. 3а, б). Это означает, что в условиях развития вызванных освещением изменений фотосинтетических процессов ФPSI и ФPSII меняются в противоположенном направлении по сравнению с изменениями PRI. Такой результат противоречит значительному массиву данных о положительной связи квантовых выходов фотохимических реакций и фотохимического индекса отражения [6–8, 20, 21] и соответствует отдельным работам [9], в которых показаны парадоксальные зависимости PRI от фотосинтетических показателей. В определенном противоречии с литературными данными [21, 22] находится также слабая отрицательная корреляция между NPQ и PRI, которая наблюдалась при сопоставлении динамик этих показателей после начала освещения (рис. 3в); однако сила связи между нефотохимическим тушением флуоресценции и фотохимическим индексом отражения может существенно варьировать [5].
Рис. 3.
Диаграммы рассеяния, описывающие связь PRI с ФPSI (а), ФPSII (б) и NPQ (в). Диаграммы рассеяния построены на основании результатов, представленных на рис. 2; каждая точка соответствует различному времени освещения листа. R2 – коэффициент детерминации, R – коэффициент корреляции Пирсона (n = 9).
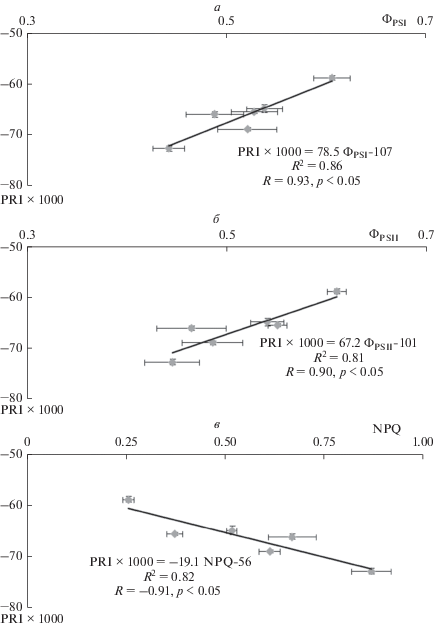
Полученные результаты можно объяснить особенностями связи между PRI и фотосинтетическими показателями в условиях развития индуцированных освещением изменений фотосинтетических процессов. Кроме того, они могут отражать стабильные во времени связи между исследованными показателями, которые характерны для данного растительного объекта и данной интенсивности освещения. Для проверки второго предположения мы оценили корреляцию средней величины фотосинтетических показателей со средними величинами PRI, рассчитанными для каждого растения по всему временнóму диапазону (9 мин освещения). Использованная процедура позволила минимизировать влияние индукционных переходов фотосинтетических процессов на связь фотосинтетических показателей и PRI. Рисунок 4 показывает, что в этом случае PRI был положительно связан с ФPSI и ФPSII и отрицательно – с NPQ; при этом абсолютные величины коэффициентов корреляции были достаточно высоки и достигали 0.90 и более. Такой результат хорошо согласуется с большинством опубликованных работ [6–8, 20, 21] и показывает, что именно развитие индукционных переходов может приводить к появлению парадоксальных зависимостей PRI от фотосинтетических показателей и, в частности, к возникновению отрицательной корреляции между PRI и квантовыми выходами фотохимических реакций.
Рис. 4.
Диаграммы рассеяния, описывающие связь PRI с ФPSI (а), ФPSII (б) и NPQ (в). Диаграммы рассеяния построены на основании результатов, усредненных по всей длительности освещения (9 мин); каждая точка соответствует конкретному исследуемому растению. R2 – коэффициент детерминации, R – коэффициент корреляции Пирсона (n = 6).
Возможные механизмы разнонаправленных изменений квантовых выходов фотохимических реакций и PRI требуют дальнейших исследований. Однако можно предположить, что снижение рН люмена и увеличение рН стромы, которые развиваются при освещении [23], может способствовать появлению отрицательной связи между PRI и ФPSI и ФPSII. Возрастание рН стромы может приводить к изменению локализации ферредоксин-NADP-редуктазы и, как следствие, к активации потока электронов на NADP [24, 25], что должно приводить к росту ФPSI и ФPSII. С другой стороны, снижение рН люмена приводит к активации деэпоксидазы в ксантофилловом цикле и превращению виолоксантина в зеаксантин [2, 23, 26], что вызывает снижение отражения на длине волны 531 нм и уменьшение PRI [3, 27]. Возможной причиной слабой связи между величинами PRI и NPQ в таких условиях является сложная природа нефотохимического тушения, энергозависимая компонента которого может быть связана как с переходами в ксантофилловом цикле, так и непосредственно с изменениями рН [2, 23].
При измерениях в полевых условиях растения могут находиться в разных условиях освещения и, возможно, на различных стадиях развития индукционного ответа фотосинтетических процессов. Чтобы определить, какие величины коэффициентов корреляции будут наблюдаться в таких неоднородных условиях, мы рассчитали корреляцию между показателями световой стадии фотосинтеза и PRI на основании всего массива экспериментальных значений, т.е. проанализировали все временны́е точки для всех исследованных растений (рис. 5). В этом случае между PRI и квантовыми выходами фотохимических реакций фотосистем I и II наблюдалась достаточно слабая положительная корреляция (рис. 5а, б), которая, тем не менее, имела достоверный характер. В то же время между PRI и NPQ наблюдалась высокая отрицательная корреляция (рис. 5в). Такой результат позволяет предположить, что при анализе группы растений с неоднородными условиями освещения значения PRI будут достаточно точно отражать изменения NPQ, однако применение PRI для оценки ФPSI и ФPSII будет менее эффективным.
Рис. 5.
Диаграммы рассеяния, описывающие связь PRI с ФPSI (а), ФPSI (б) и NPQ (в) на основании всех исследованных растений и всех временны́х интервалов после начала освещения (n = 54). R2 – коэффициент детерминации, R – коэффициент корреляции Пирсона.
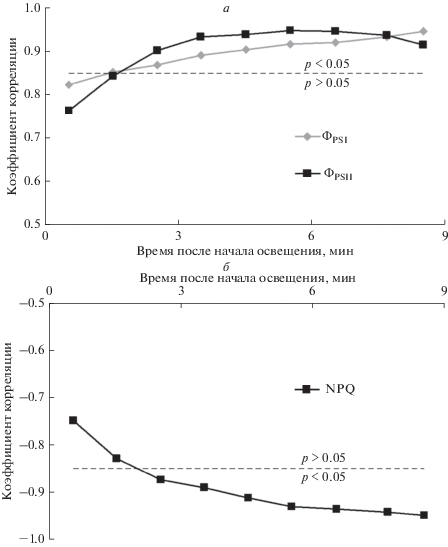
Далее была проведена оценка связи величин фотосинтетических показателей и фотохимического индекса отражения при разной длительности освещения (рис. 6). Такой анализ показал, что абсолютная величина корреляции всех исследованных фотосинтетических показателей с PRI возрастала при увеличении длительности освещения; при этом знак коэффициентов корреляции соответствовал типичным зависимостям PRI от конкретных фотосинтетических показателей. Отдельно следует отметить, что корреляция между значениями PRI и фотосинтетическими показателями через 1–2 мин освещения не была статистически значимой.
Рис. 6.
Зависимость коэффициента корреляции Пирсона между значениями PRI и величинами ФPSI, ФPSII (а) и NPQ (б) от времени освещения (n = 6). Пунктирными линиями обозначена граница между статистически значимой (p < 0.05) и статистически незначимой (p > 0.05) корреляциями.
Согласно данным литературы, именно в первые минуты освещения происходят наибольшие по величине изменения рН [28], что обусловлено низкой активностью ферментов цикла Кальвина [26] и Н+-ATP-синтазы тилакоидной мембраны [29] после затемнения. Наши результаты также свидетельствуют в пользу этого, так как наиболее быстрое и значительное по величине изменение NPQ (возрастание) наблюдалось в первые 2 мин эксперимента (рис. 2б); зависящая от рН люмена энергозависимая компонента тушения вносила основной вклад в NPQ в данных экспериментальных условиях (рис. 1г). На основании этого можно предположить, что именно в первые 2–3 мин освещения происходит максимальное закисление люмена, которое потом несколько снижается. Как было отмечено выше, возрастание градиента рН может существенно влиять на потоки электронов [24, 25] и нефотохимическое тушение [1, 2], причем пути реализации такого влияния могут быть не связаны с превращением виолоксантина в зеаксантин. В частности, известно [2], что значительное закисление люмена может вызывать возрастание NPQ без вовлечения ксантофиллового цикла, в то время как превращение виолоксантина в зеаксантин снижает порог активации нефотохимического тушения протонами люмена. С другой стороны, ранее было показано, что деэпоксидация виолоксантина происходит в минутном диапазоне [30, 31], что согласуется с относительно медленным достижением минимума PRI в наших экспериментах (3–4 мин после начала освещения, рис. 2в). Таким образом, сопоставление литературных данных и результатов эксперимента позволяет предположить, что в течение первых нескольких минут освещения изменения фотосинтетических показателей в меньшей степени связаны с превращениями в ксантофилловом цикле. Такой механизм может лежать в основе относительно слабой связи фотосинтетических показателей и PRI в первые минуты освещения.
В целом, полученные результаты показывают, что при регистрации фотохимического индекса отражения в условиях значительного возрастания интенсивности освещения может наблюдаться существенно ослабление и даже инвертирование корреляции этого показателя с параметрами световой стадии фотосинтеза, что может вносить ошибку при использовании PRI для диагностики фотосинтетических процессов. При этом использование PRI для оценки NPQ является в таких условиях более эффективным, нежели его использование для оценки ФPSI и ФPSII.
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 17-76-20 032).
Список литературы
Muller P., Li X.-P., Niyogi K.K. 2001. Non-photochemical quenching. A response to excess light energy. Plant. Physiol. 125, 1558–1566.
Ruban A.V. 2015. Evolution under the sun: Optimizing light harvesting in photosynthesis. J. Exp. Bot. 66, 7–23.
Gamon J.A., Peñuelas J., Field C.B. 1992. A narrow-waveband spectral index that tracks diurnal changes in photosynthetic efficiency. Remote Sens. Environ. 41, 35–44.
Garbulsky M.F., Peñuelas J., Gamon J., Inoue Y., Filella I. 2011. The photochemical reflectance index (PRI) and the remote sensing of leaf, canopy and ecosystem radiation use efficiencies. A review and meta-analysis. Remote Sens. Environ. 115, 281–297.
Zhang C., Filella I., Garbulsky M.F., Peñuelas J. 2016. Affecting factors and recent improvements of the photochemical reflectance index (PRI) for remotely sensing foliar, canopy and ecosystemic radiation-use efficiencies. Remote Sens. 8, 677.
Evain S., Flexas J., Moya I. 2004. A new instrument for passive remote sensing: 2. Measurement of leaf and canopy reflectance changes at 531 nm and their relationship with photosynthesis and chlorophyll fluorescence. Remote Sens. Environ. 91, 175–185.
Porcar-Castell A., Garcia-Plazaola J.I., Nichol C.J., Kolari P., Olascoaga B., Kuusinen N., Fernández-Marín B., Pulkkinen M., Juurola E., Nikinmaa E. 2012. Physiology of the seasonal relationship between the photochemical reflectance index and photosynthetic light use efficiency. Oecologia. 170, 313–323.
Liu L., Zhang Y., Jiao Q., Peng D. 2013. Assessing photosynthetic light-use efficiency using a solar-induced chlorophyll fluorescence and photochemical reflectance index. Int. J. Remote Sens. 34, 4264–4280.
Sarlikioti V., Driever S.M., Marcelis L.F.M. 2010. Photochemical reflectance index as a mean of monitoring early water stress. Ann. Appl. Biol. 157, 81–89.
Moran M.S., Inoue Y., Barnes E.M. 1997. Opportunities and limitations for image-based remote sensing in precision crop management. Remote Sens. Environ. 61, 319–346.
Armbruster U., Carrillo L.R., Venema K., Pavlovic L., Schmidtmann E., Kornfeld A., Jahns P., Berry J.A., Kramer D.M., Jonikas M.C. 2014. Ion antiport accelerates photosynthetic acclimation in fluctuating light environments. Nat. Commun. 5, 5439.
Davis G.A., Rutherford A.W., Kramer D.M. 2017. Hacking the thylakoid proton motive force for improved photosynthesis: modulating ion flux rates that control proton motive force partitioning into Δψ and ΔpH. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 372, 20160381.
Sukhov V., Surova L., Sherstneva O., Vodeneev V. 2014. Influence of variation potential on resistance of the photosynthetic machinery to heating in pea. Physiol. Plant. 152, 773–783.
Шерстнева О.Н., Сурова Л.М., Воденеев В.А., Плотникова Ю.И., Бушуева А.В., Сухов В.С. 2015. Роль внутри и внеклеточных протонов в индукции фотосинтетического ответа вариабельным потенциалом в проростках гороха. Биол. мембраны. 32, 446–454.
Sukhov V., Surova L., Sherstneva O., Katicheva L., Vodeneev V. 2015. Variation potential influence on photosynthetic cyclic electron flow in pea. Front. Plant. Sci. 5, 766.
Sukhov V., Surova L., Sherstneva O., Bushueva A., Vodeneev V. 2015. Variation potential induces decreased PSI damage and increased PSII damage under high external temperatures in pea. Funct. Plant. Biol. 42, 727–736.
Sukhov V., Gaspirovich V., Mysyagin S., Vodeneev V. 2017. High-temperature tolerance of photosynthesis can be linked to local electrical responses in leaves of pea. Front. Physiol. 8, 763.
Klughammer C., Schreiber U. 2008. Saturation pulse method for assessment of energy conversion in PS I. PAM Application Notes, 1, 11–14.
Maxwell K., Johnson G.N. 2000. Chlorophyll fluorescence – a practical guide. J. Exp. Bot. 51, 659–668.
Osório J., Osório M.L., Romano A. 2012. Reflectance indices as nondestructive indicators of the physiological status of Ceratonia siliqua seedlings under varying moisture and temperature regimes. Funct. Plant. Biol. 39, 588–597.
Zinnert J.C., Nelson J.D., Hoffman A.M. 2012. Effects of salinity on physiological responses and the photochemical reflectance index in two co-occurring coastal shrubs. Plant Soil. 354, 45–55.
Shrestha S., Brueck H., Asch F. 2012. Chlorophyll index, photochemical reflectance index and chlorophyll fluorescence measurements of rice leaves supplied with different N levels. J. Photochem. Photobiol. B. 113, 7–13.
Kramer D.M., Cruz J.A., Kanazawa A. 2003. Balancing the central roles of the thylakoid proton gradient. Trends Plant Sci. 8, 27–32.
Alte F., Stengel A., Benz J.P., Petersen E., Soll J., Groll M., Bӧlter B. 2010. Ferredoxin: NADPH oxidoreductase is recruited to thylakoids by binding to a polyproline type II helix in a pH dependent manner. Proc. Natl. Acad. Sci. USA. 107, 19 260–19 265.
Benz J.P., Stengel A., Lintala M., Lee Y.H., Weber A., Philippar K., Gügel I.L., Kaieda S., Ikegami T., Mulo P., Soll J., Bӧlter B. 2010. Arabidopsis Tic62 and ferredoxin-NADP(H) oxidoreductase form light-regulated complexes that are integrated into the chloroplast redox poise. Plant Cell. 21, 3965–3983.
Бухов Н.Г. 2004. Динамическая световая регуляция фотосинтеза. Физиология растений. 51, 825–837.
Filella I., Porcar-Castell A., Munné-Bosch S., Bäck J., Garbulsky M.F., Peñuelas J. 2009. PRI assessment of long-term changes in carotenoids/chlorophyll ratio and short-term changes in de-epoxidation state of the xanthophyll cycle. Int. J. Remote Sens. 30, 4443–4455.
Zaks J., Amarnath K., Kramer D.M., Niyogi K.K., Fleming G.R. 2012. A kinetic model of rapidly reversible nonphotochemical quenching. Proc. Natl. Acad. Sci. USA. 109, 15757–15762.
Hisabori T., Konno H., Ichimura H., Strotmann H., Bald D. 2002. Molecular devices of chloroplast F1-ATP synthase for the regulation. Biochim. Biophys. Acta. 1555, 140–146.
Jahns P., Wehner A., Paulsen H., Hobe S. 2001. De-epoxidation of violaxanthin after reconstitution into different carotenoid binding sites of light-harvesting complex II. J. Biol. Chem. 276, 22 154–22 159.
Jahns P., Latowski D., Strzalka K. 2009. Mechanism and regulation of the violaxanthin cycle: the role of antenna proteins and membrane lipids. Biochim. Biophys. Acta. 1787, 3–14.
Дополнительные материалы отсутствуют.
Инструменты
Биологические мембраны: Журнал мембранной и клеточной биологии


